BAB 2
TINJAUAN PUSTAKA
2.1. Baterai
Ada dua jenis baterai, yaitu baterai primer dan sekunder atau disebut juga non-isi ulang dan isi ulang. Produksi baterai primer hanya dapat digunakan untuk sekali pemakaian, habis selama penggunaan dan kemudian dibuang. Sel yang dapat diisi ulang atau sel sekunder paling sering diproduksi dalam keadaan bermuatan, dan kemudian diisi sebelum penggunaan. Sementara sel primer yang digunakan hanya selama siklus pertama (primer), sel-sel sekunder yang digunakan dalam siklus sekunder dibebankan di antara keduanya. Produk hasil reaksi dalam sel primer memiliki energi stabil untuk membalikkan proses, tidak membalikkan reaksi asli, reaksi yang tidak diinginkan lainnya akan berlangsung sehingga sel-sel primer tidak dapat diisi ulang (Armand, 2008)
Produksi untuk baterai berbeda, tergantung pada aplikasi. Sementara susunan sel hibrida baterai membutuhkan daya yang tinggi untuk memanfaatkan energi, mobil listrik membutuhkan kepadatan energi yang tinggi untuk mendapatkan jarak tempuh yang lebih besar. Terdapat kriteria yang berbeda pada baterai tergantung pada aplikasi dan telah memberikan peluang untuk menemukan satu "solusi emas" yang terbaik untuk setiap situasi. Sebaliknya, untuk masa mendatang mungkin akan banyak baterai kimia yang berbeda dan disesuaikan dengan aplikasi bidang tertentu (Nordh, 2013).
Ketersediaan bahan adalah masalah besar bagi baterai isi ulang. Bahan aktif dapat bereaksi pada situasi yang tidak diinginkan secara perlahan-lahan, dari waktu ke waktu, menyebabkan kapasitas baterai menurun, sehingga membuat efisiensi baterai menurun. Penurunan efisiensi pada baterai ini tergantung pada jumlah siklus baterai. Hal ini bisa menjadi solusi tepat dalam aplikasi kendaraan listrik hibrida, karena baterai ini memiliki siklus yang panjang. Untuk mendapatkan kinerja yang baik dari baterai, maka siklus hidup dari baterai harus diperpanjang (Nordh, 2013).
2.1.1 Bagaimana Baterai Beroperasi
Banyak reaksi kimia yang melibatkan transfer elektron sehingga material aktif yang terlibat mengalami perubahan dalam keadaan oksidasi yang disebut reaksi redoks. Dalam reaksi redoks, salah satu material aktif teroksidasi dengan memberikan elektron sehingga bilangan oksidasi naik dan material aktif lain berkurang dengan menerima elektron dan dengan demikian mengurangi bilangan oksidasinya. Secara fisik, reaksi oksidasi terpisah dari reaksi reduksi dan membawa elektron melalui sirkuit eksternal sehingga elemen galvanik (atau sel baterai) terbentuk. Selama elektron bergerak melalui sirkuit eksternal maka akan ada arus yang dapat digunakan, sebagai contohnya kekuatan bola lampu di senter. Tujuan dari semua baterai adalah untuk mengkonversi energi kimia yang tersimpan menjadi energi listrik (Nordh, 2013).
Setiap reaksi redoks memiliki tegangan tertentu. Ada nilai mutlak praktis untuk potensial ini, sehingga sistem pengukuran relatif digunakan sebagai gantinya. Dalam referensi ini, potensial keseimbangan reaksi antara proton dan gas hidrogen diatur ke nol.
2H + + 2 e- → H2 (g) (2.1) Untuk mengukur potensi reaksi lain, percobaan diatur di mana persamaan (2.1) didefinisikan sebagai anoda dan reaksi lain sebagai katoda, dan diukur potensial antara dua reaksi ekuilibrium. Potensi reaksi tersebut tergantung pada suhu, tekanan dan aktivitas reaktan, sehingga tidak praktis untuk tabulasi semua nilai saat adanya faktor-faktor tersebut. Potensi standar diukur terhadap persamaan (2.1) di bawah satu variabel tetap seperti suhu, tekanan, dan nilai yang terukur. Kondisi ini menjelaskan bahwa potensial suhu dan tekanan normal (NTP) pada reduksi standar. Karena pada persamaan (2.1) didefinisikan sebagai anoda, berarti keseimbangan yang diukur dilambangkan sebagai katoda dan potensial elektroda diberi tanda yang sesuai (+/-) (Nordh, 2013).
Dalam sel baterai, site reduksi disebut katoda dan site oksidasi disebut anoda. Elektroda yang bertindak sebagai anoda dan yang bertindak sebagai katoda ditentukan oleh bagaimana potensial reduksi standar berhubungan satu sama lain, dan dengan demikian yang lainnya lebih mudah teroksidasi. Elektroda dengan
potensial standar yang lebih tinggi akan bertindak sebagai katoda, dan potensial rendah sebagai anoda (Nordh, 2013).
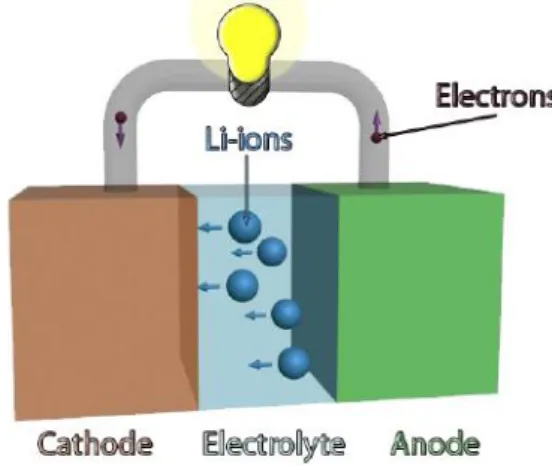
Skema dasar baterai (menggunakan elektrolit Li-ion) ditunjukkan pada Gambar 2.1. Kedua elektroda dipisahkan oleh isolasi elektronik dan ionik yang terdapat pada elektrolit, ketika sedang terhubung dengan sebuah sirkuit eksternal maka elektron akan mengalir. Elektrolit biasanya berupa larutan garam. Jika elektrolit tidak mengalami isolasi elektronik, maka elektron akan diangkut melalui elektrolit bukan melalui sirkuit eksternal, dan baterai akan mengalami hubungan pendek, sehingga terjadi kerugian kapasitas. Namun demikian, banyak elektrolit yang memiliki beberapa konduktivitas elektronik yang rendah. Sementara penghantar ini tidak cukup untuk baterai pada sirkuit pendek dan discharge dengan cepat, kondisi ini akan menyebabkan discharge pada baterai itu sendiri lambat dari waktu ke waktu, sehingga waktu penyimpanan pada baterai terbatas. (Nordh, 2013)
Gambar 2.1. Skema sederhana dari baterai Lithium ion
Gambar 2.1 menampilkan skema baterai yang sangat sederhana dengan komponen utama: anoda, katoda dan elektrolit. Perjalanan ion melalui elektrolit dari anoda ke katoda dan elektron melalui sirkuit eksternal. Namun, ada beberapa lagi komponen yang diperlukan untuk sebagian besar baterai praktis. Skema kerja baterai yang lebih lengkap dapat dilihat pada Gambar 2.2. Elektroda membutuhkan separator mekanis, jika tidak ada separator maka baterai akan mengalami arus pendek dan bisa hancur. Elektrolit cair lebih disukai karena konduktivitas ionik yang tinggi, tetapi elektrolit cair kurang stabil untuk
mencegah kontak antara elektroda. Sehingga separator menjadi solusi untuk hal ini, polimer atau serat gelas berpori sering direndam dengan cairan elektrolit untuk menggabungkan pemisahan fisik dan konduktivitas ionik. Elektroda bahan aktif itu sendiri merupakan konduktor elektronik yang buruk, sehingga elektroda menjadi bahan komposit dengan aditif yang meningkatkan konduktivitas. Kolektor memberikan kontak yang baik antara elektroda dan sirkuit eksternal. (Winter, 2004)
Gambar 2.2. Skema lengkap dari baterai Lithium ion
Dari Gambar 2.2. dapat dilihat dalam sebuah wadah, anoda dan katoda dipisahkan oleh separator dan direndam dalam elektrolit. Kolektor yang dihubungkan dengan kontak akan menyediakan sambungan ke sirkuit eksternal.
Berikut dua formula dari NTP potensial reduksi standar:
O2(g) + 4H+ + 4e- 2H2O E = + 1,229 V (2.2) 2H2O + 2e- H2 (g) + 2OH
-(aq) E = -0.83 V (2.3)
ditunjukkan bahwa setiap baterai berisi air hanya memiliki jendela potensial stabil antara -0,83 V dan 1,229 V tanpa menghasilkan hidrogen atau oksigen gas. Kebanyakan baterai ion lithium komersial memiliki anoda dengan potensial kerja di bawah -0,83 V, oleh karena itu penting untuk menghindari terjadinya hubungan dengan gas beracun dalam air ketika perangkat baterai ion lithium bekerja.
Ada beberapa cara untuk menaikan spesifikasi dari baterai. Energi dapat dinyatakan dalam energi spesifik yang diukur dalam Wh/kg atau kepadatan energi diukur dalam Wh/L, juga disebut energi gravimetri dan volumetric density. Listrik dinyatakan dalam daya spesifik (W/kg) dan kerapatan daya (W/L). Kekuatan khusus/densitas daya dan energi spesifik/kepadatan energi dari baterai dapat diubah oleh desain sel. Lapisan tebal bahan elektroda memberikan energi yang tinggi karena peningkatan jumlah bahan aktif, tapi ini juga meningatkan panjang difusi untuk ion dalam materi yang pada gilirannya dapat menurunkan daya. Begitu juga sebaliknya, lapisan tipis elektroda memberikan jalur difusi pendek dan lebih berpengaruh, tetapi mereka mengandung bahan yang kurang aktif dan akibatnya kandungan energi menurun. Dengan demikian, peningkatan satu sifat bahan sering datang dari bahan lainnya (Nordh, 2013).
2.1.2 Desain baterai
Meskipun ada banyak konfigurasi sel, pemakaian baterai yang paling umum adalah dalam bentuk sel koin, sel gulung, sel prismatik, dan sel datar (Winter, 2004 ; Dell, 2000 ; Tarascon, 2001). Desain sel koin adalah desain lurus ke depan di mana elektroda sejajar satu sama lain. Elektroda ini dipisahkan biasanya dengan lembar polietilen (separator) yang berisi elektrolit cair. Bahan-bahan ini ditempatkan dalam kaleng logam silinder tipis yang disegel oleh tutup logam. Untuk mencegah hubungan listrik arus pendek, gasket polimer digunakan untuk tutup kaleng. Dengan demikian, biasanya tiang satu untuk elektroda sementara tutupnya adalah tiang elektroda lain dari sel. Nama desain ini berasal dari casingnya yang menyerupai koin. Desain yang paling umum kedua adalah desain sel gulung. Desain ini menggunakan strip panjang elektroda dan separator dalam gulungan dan dapat ditempatkan dalam silinder panjang. Sebuah sistem yang sama yang digunakan untuk menutup desain sel koin juga digunakan dalam sel ini. Sel prismatik mirip dengan sel silinder dalam sel gulung yang datar. Desain sel datar mengandung bolak piring elektroda dan separator. Setiap lempeng elektroda memiliki tab yang masing-masing dilas ke semua tab lain elektroda.
Gambar 2.3 (1-4 (a-d)) menyajikan empat desain sel umum dari referensi (Tarascon, 2001).
Gambar 2.3 Empat desain sel umum baterai: a. silinder, b. koin, c. prismatik, dan d. datar (Tarascon, 2001)
2.2. Baterai Ion Lithium
Baterai lithium pertama kali diusulkan pada tahun 1976 dan telah banyak digunakan dalam aplikasi portable sejak awal 1990-an. Dalam beberapa tahun terakhir, tingginya harga minyak telah memberikan inisiatif bagi para peneliti untuk melihat ke dalam teknologi baterai baru yang dapat digunakan dalam aplikasi kendaraan listrik. Di Kalangan baterai lithium, ada tiga kategori pembagian, yaitu: logam lithium, lithium polymer dan ion lithium. (Whittingham, 1976)
Lithium ion tidak memiliki definisi kimia yang unik seperti asam timbal, nikel metal hidrida atau Baterai Nickel Cadmium. Sebuah sel lithium ion memiliki tiga utama komponen: elektroda positif (katoda), elektroda negatif (anoda) dan separator. Di setiap sel memiliki kelebihan dan kekurangan. Di satu sisi, berbagai
bahan katoda dan anoda memberikan fleksibilitas untuk merancang baterai untuk kebutuhan aplikasi yang spesifik, namun di sisi lain dalam jumlah yang besar, kemungkinan menimbulkan kebingungan pada reaksi kimia tertentu yang dikembangkan dan berhasil diuji di lapangan. (Whittingham, 1976)
Berbagai pilihan yang tersedia untuk masing-masing komponen (manfaat dan kerugian) dijelaskan secara rinci di bawah ini. Karakteristik listrik dan kinerja baterai seperti tegangan, kapasitas, kepadatan energi, tingkat kemampuan, siklus hidup, dan lama hidup akan berubah sebagai salah satu konsekuensi dalam memilih bahan yang berbeda untuk anoda, katoda, elektrolit dan separator. Seperti yang akan ditampilkan nanti, tidak ada satu kombinasi tertentu komponen sel tersebut yang dapat memenuhi setiap kebutuhan di semua aplikasi. Harus memilih salah satu dan memodifikasi komponen sel untuk memenuhi kebutuhan aplikasi. Selain itu, kita juga dapat merubah komposisi bahan katoda dan anoda, ukuran partikel dan morfologi untuk mencapai kinerja baterai tertentu. (Whittingham, 1976)
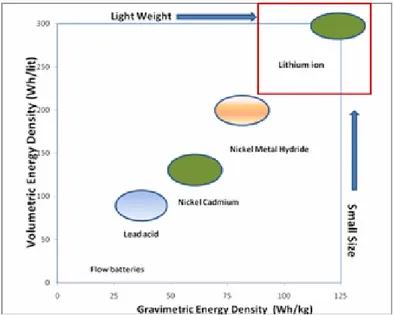
Gambar 2.4. Perbandingan keunggulan dari masing-masing jenis baterai (Whittingham, 1976)
Gambar 2.4 menunjukkan berbagai perbandingan teknologi baterai yang berbeda dalam hal kepadatan energi volumetrik (Wh/L) dan kepadatan energi gravimetri (Wh/kg). Seperti dapat diamati pada Gambar 2.4, baterai lithium jauh lebih kecil dan lebih ringan dibandingkan dengan semua teknologi lainnya. Kotak
merah menunjukkan berbagai teknologi baterai lithium baru dengan kinerja baterai yang unik. Seperti yang dilihat bahwa baterai lithium merupakan baterai yang memiliki aliran paling besar di antara semua teknologi penyimpanan energi. (Whittingham, 1976)
2.2.1 Spesifikasi Kimia Baterai Ion Lithium
Sejak komersialisasi baterai Lithium-ion yang dapat diisi ulang di awal tahun 1990-an, lithium berbasis kimia memiliki pangsa yang semakin meningkat dari pasar baterai global. Ini karena lithium memiliki beberapa sifat kimia dan fisik yang jauh lebih baik dari yang diinginkan. Pertama, lithium adalah unsur yang paling elektronegatif dalam pengurangan potensi standar seri NPT dengan potensial elektroda negatif -3,05 V. Hal ini memungkinkan untuk memproduksi baterai dengan tegangan hingga 6 V, meskipun 3-3,5 V adalah rentang tegangan yang paling umum untuk baterai lithium. Hasil tegangan tinggi dalam baterai mampu melakukan lebih banyak pekerjaan dengan jumlah pembawa muatan yang sama, baterai memiliki energi spesifik yang lebih tinggi dari sel yang setara dengan tegangan yang lebih rendah. Kedua, lithium adalah salah satu unsur yang paling ringan dan terkecil dalam tabel periodik. Hal ini lebih mempermudah untuk membuat desain baterai yang lebih ringan dan lebih kecil, dan akibatnya lithium memiliki kepadatan energi gravimetri dan volumetrik yang lebih tinggi dari sel yang setara dengan elemen yang lebih berat. Jari-jari ionik yang kecil juga membuat baterai lithium relatif lebih mudah untuk menemukan bahan interkalasi yang baik (Nordh, 2013).
Logam lithium murni akan menghasilkan energi volumetrik dan gravimetri tertinggi untuk baterai lithium. Logam lithium sendiri adalah elektronik konduktif yang memiliki sifat mekanik yang baik, sehingga tidak ada tambahan yang diperlukan. Dengan adanya elektrolit dalam baterai, lithium memiliki energi spesifik yang lebih tinggi. Namun, dengan menggunakan logam lithium menimbulkan masalah besar dalam sel sekunder. Setelah pengisian, ketika ion lithium kembali pindah ke lithium logam foil, pembentukan dendrit dapat diamati. Setelah berulang dendrit ini dapat tumbuh ke sisi positif dari baterai dan dengan
demikian terjadi arus pendek pada baterai, dalam skenario kasus terburuk mungkin terjadi ledakan. Masalah keamanan ini terlalu besar untuk diabaikan, dan karena itu alternatif sumber lithium perlu digunakan. Ketika memecahkan masalah dengan dendrit yang berhubungan dengan lithium logam, banyak jalan alternatif yang dieksplorasi, dan hasil yang paling menjanjikan berasal dari senyawa interkalasi. Suatu senyawa interkalasi bekerja sebagai matriks tempat di mana ion lithium disimpan. Struktur host materi secara keseluruhan tidak berubah ketika dimasukkan lithium dalam senyawa interkalasi; lithium sebaliknya menemukan lubang dalam struktur di mana ia dapat disimpan (Nordh, 2013).
Salah satu elektroda negatif yang paling umum digunakan dalam baterai saat ini adalah grafit. Atom-atom karbon dalam grafit tersusun dalam lapisan halus dengan ikatan van der waals. Atom lithium kemudian dapat bergerak antara lapisan tersebut dan disimpan (lihat Gambar 2.5). Di tengah lapisan terdapat cincin karbon yang memungkinkan satu atom lithium dapat disimpan dalam enam karbon dan membentuk LiC6. Masalah keamanan dapat diatasi karena bahan interkalasi yang umumnya tidak mengalami pembentukan dendrit, namun berpengaruh pada energi dan daya spesifik (Nordh, 2013).
Gambar 2.5. Skema dari bahan elektroda dalam baterai Li-ion (Nordh, 2013)
Dari Gambar 2.5 dapat dilihat bahan elektroda menggunakan logam lithium oksida katoda dan anoda grafit. Lithium diselingi antara lapisan grafit saat baterai terisi dan dalam struktur host oksida ketika habis (Nordh, 2013).
Baterai yang paling umum, lithium-ion memiliki grafit sebagai anoda, bekerja pada -2.5 V vs elektroda hidrogen standar, dan bahan interkalasi lain, umumnya oksida logam transisi, sebagai katoda bekerja sekitar 1,0 V. Memiliki satu elektroda yang bekerja pada -2.5 V dan yang lainnya di 1,0 V, sehingga total potensial di mana baterai beroperasi adalah 3,5 V. Potensial ni memang cukup besar untuk membuat elektrolit tetap stabil secara kimiawi dari kedua reaksi, oksidasi dan reduksi. Bahkan, sebagian besar elektrolit tidak stabil dalam potensial yang ada dalam baterai lithium (Xu, 2004). Yang paling sering terjadi adalah anoda akan bertindak sebagai katalis dan garam organik dalam elektrolit bereaksi membentuk zat baru pada permukaan anoda. Layer baru ini bersifat pasif pada permukaan elektroda, sehingga mencegah reaksi lebih lanjut dalam elektrolit. Lapisan ini disebut Solid Electrolyte Interface (atau SEI) (Nordh, 2013).
Gambar 2.6. Kemungkinan komposisi lapisan SEI pada anoda grafit dalam baterai Li-ion (Nordh, 2013).
Pada Gambar 2.6 dapat dilihat kemungkinan kombinasi bahan di lapisan SEI pada grafit, dengan ketebalan yang khas. SEI bermanfaat bagi baterai, dalam arti bahwa SEI merupakan elektroda pasif yang bereaksi dengan elektrolit, tetapi juga memiliki beberapa kelemahan. Difusi ion dapat diturunkan dengan lapisan SEI, sehingga mengurangi daya maksimum yang dapat diekstraksi dari baterai. Pembentukan lapisan SEI juga mengkonsumsi bahan aktif, sehingga mengurangi kapasitas baterai. Selain itu, selama interkalasi dan deinterkalasi, bahan dasar sering mengalami perubahan volume. Perubahan volume ini akan membentuk retakan di SEI dan SEI baru akan terbentuk pada saat terjadi retakan. Setelah ini
terjadi berulang-ulang, maka perlahan-lahan akan mengurangi kapasitas dari baterai (Winter, 2004 ; Palacin, 2009).
2.2.2 Bahan Dalam Baterai Ion Lithium
Untuk penggunaan akhir, mungkin kadang-kadang tampak seperti hanya ada satu jenis baterai ion lithium, tetapi kenyataannya ada beberapa sel kimia yang berbeda dari sel ion lithium. Anoda standar di sebagian besar sel komersial saat ini adalah grafit. Namun, bahan katoda dan elektrolit bervariasi secara substansial dalam sel, bersama-sama dengan formulasi komposit elektroda, ukuran partikel bahan aktif, dan lain-lain (Nordh, 2013).
Elektrolit dalam sel komersial memiliki sejumlah aditif untuk meningkatkan kinerja baterai dan keselamatan, resep khusus untuk sebagian besar elektrolit komersial menjadi rahasia yang dijaga ketat. Secara umum, kebanyakan elektrolit komersial mengandung karbonat organik dan garam lithium, di mana LiPF6 adalah garam yang paling umum digunakan (Nordh, 2013).
Grafit umumnya digunakan untuk kinerja yang cukup baik, dengan biaya rendah, tetapi untuk memenuhi kebutuhan baterai kedepannya, semakin banyak penelitian yang sedang dilakukan pada bahan anoda alternatif untuk meningkatkan kinerja keseluruhan baterai Li-ion. Salah satu anoda yang mungkin adalah Li4Ti5O12: Lithium-Titanat Oxide, LTO. Bahan LTO telah dikenal untuk waktu yang lama, namun telah mengalami peningkatan jumlah dalam beberapa tahun terakhir. LTO dipelajari dalam penelitian superkonduktor di tahun 1980-an (Ronci, 2002), dan kemudian ditemukan bahwa LTO dapat berinterkalasi dalam proses reversibel. Kemudian studi menemukan bahwa LTO adalah bahan zero-regangan (Ronci, 2002 ; Colbow, 1989), yang dalam teori harus memungkinkan pemakaian arus yang sangat tinggi/charge. Jika tidak terjadi perubahan volume, proses charge/discharge tidak dibatasi oleh gerakan dalam materi, dan dengan demikian tidak harus memblokir jalan difusi ionik, yang pada gilirannya akan mencapai kapasitas tinggi pada arus yang tinggi. LTO menampilkan stabilitas pengiriman daya yang sangat baik, yang akan membuat komponen ideal dalam baterai kendaraan listrik hibrida (Nordh, 2013).
2.3. Baterai Lithium Titanium Oksida (Li4Ti5O12)
Baterai dengan anoda lithium titanat telah dikenal sejak 1980-an. Li-titanate menggantikan grafit di anoda baterai lithium-ion yang khas dan bentuk-bentuk materi dalam struktur spinel.
2.3.1. Spinel Lithium Titanium Oksida 2.3.1.1. Gambaran struktural
Spinel Lithium Titanium Oksida (Li4Ti5O12) digunakan sebagai anoda pada baterai ion lithium pada satu fase dalam sistem terner Li-Ti-O. Ini terdapat pada satu titik akhir yang berhubungan dengan fase spinel LiTi2O4. Dalam spinel Li4Ti5O12, 1/6 dari ion Ti disubstitusi oleh ion Li+. Dengan demikian, dalam notasi spinel, rumus empiris Li[Li1/3Ti5/3]O4 dimana kation dalam kurung merupakan kation pada situs oktahedral (Harrison, 1985).
2.3.1.2. Pembuatan Li4Ti5O12 (LTO)
Banyak kelompok yang telah melaporkan produksi bahan ini. Pada intinya, dua rute telah dieksplorasi. Rute pertama adalah reaksi solid-state antara TiO2 dan garam Li. Reaksi solid-state menggunakan campuran prekursor menyeluruh yang dipanaskan sampai sekitar 800oC di udara selama 24 jam. Bahan yang dihasilkan adalah bubuk putih yang berstruktur spinel. Rute ini adalah yang paling mudah untuk produksi bahan ini dan ukuran partikel rata-rata produk tersebut dalam kisaran 5 sampai 10 mikron (Peramunage, 1998 ; Wang, 1999 ; Zaghib, 1999). Rute kedua adalah metode sol-gel yang dilaporkan oleh Bach et al. (Bach, 1998-1999). Metode ini menggunakan Ti-isopropoxide dicampur dengan lithium asetat. Produk hasil hidrolisis Ti-isopropoxide berupa zat putih susu. Campuran ini dikeringkan dan dipanaskan sampai 500oC di udara untuk membentuk bubuk spinel (Simon, 2007).
2.3.1.3. Karakteristik elektrokimia
Li4Ti5O12 biasanya digunakan sebagai elektroda anoda dan memiliki kapasitas teoritis 175 mAh/g. Dengan menggunakan rumus empiris Li4Ti5O12, spinel ini dapat menerima hingga 3 mol atom Li untuk membentuk Li7Ti5O12 pada charge. Penurunan ini reversibel setelah pengisian dan bahan teroksidasi kembali ke Li4Ti5O12. Persamaan (2.4) menggambarkan reaksi reduksi dan oksidasi (Simon, 2007).
Li4Ti5O12 + 3Li+ + 3e- ↔ Li7Ti5O12 (2.4)
Kinerja elektrokimia bahan ini agak unik, jika dibandingkan dengan bahan interkalasi lainnya. Salah satu fitur uniknya adalah potensi datar (sekitar 1.55 V vs logam Li) lebih dari 90% untuk kapasitas saat interkalasi dan deinterkelasi ion Li+. Polarisasi juga kurang penting jika dibandingkan dengan elektroda oksida logam lainnya pada rapat arus yang sama. Hal ini diyakini bahwa rata-rata potensi region substansial terdiri dari dua tahap, yaitu Li4Ti5O12 dan Li7Ti5O12, yang selalu hadir pada charge dan discharge (Colbow, 1989 ; Ohzuku, 1995).
Fitur unik yang lain adalah perubahan volume sangat kecil ketika material ion Li+ ini mengalami interkalasi dan deinterkalasi sebagai sel discharge dan charge. (Ohzuku, 1995)
2.3.2. Keuntungan dan Kerugian anoda Li4Ti5O12 (LTO)
LTO menawarkan keuntungan dalam hal kekuasaan dan stabilitas kimia, tetapi baterai berbasis LTO memiliki tegangan rendah: 2.5 V vs LiCoO2 dan 1.9 V vs LFP. Namun demikian, tegangan operasi yang lebih rendah membawa keuntungan yang signifikan dalam hal keselamatan. Selanjutnya, baterai ini dapat diisi ulang dengan cepat. Data menunjukkan bahwa baterai ini dapat dengan aman dikenakan tarif lebih tinggi dari 10 C. Ini berarti baterai dapat diisi dalam waktu kurang dari 10 menit. Baterai berbasis LTO juga memiliki luas rentang suhu operasi dan efisiensi mengisi ulang melebihi 98%. Meskipun kepadatan energi dari baterai berbasis LTO rendah dibandingkan dengan baterai ion lithium lain, masih lebih tinggi dari asam timbal dan baterai NiCad. Ada banyak aplikasi di mana baterai asam timbal dan baterai NiCad digunakan dalam hubungannya
dengan generator. Perubahan volumetrik selama pengisian dan pengosongan sangat kecil dibandingkan dengan karbon dan memberikan siklus hidup lebih lama. Baterai berbasis LTO memberikan kinerja yang jauh lebih baik pada suhu rendah dibandingkan dengan baterai berbasis karbon. Kehidupan siklus besar dan kemampuan tingkat tinggi baterai berbasis LTO juga membawa keuntungan unik dalam aplikasi di mana keandalan kisi rendah. Ketika jaringan listrik tersedia, baterai dapat diisi dengan cepat dan dikosongkan dengan lambat. Ini akan menghemat sejumlah besar biaya dalam hal diesel dan sering penggantian baterai VRLA. Untuk kendaraan listrik, kemampuan mengisi ulang cepat membuat perbedaan besar dalam waktu mengisi ulang dibandingkan dengan bahan kimia lainnya. 10 menit untuk baterai berbasis LTO dibandingkan dengan 8 jam untuk bahan kimia tertentu. (Whittingham, 1976)
2.4. Bahan Baku
Bahan baku yang digunakan dalam pembuatan lembaran anoda adalah sebagai berikut:
2.4.1. Serbuk Li4Ti5O12 (LTO)
Sifat fisik dan kimia dari serbuk LTO adalah: berbentuk padat (serbuk), berwarna putih, tidak berbau, titik lelehnya > 1,000 °C (> 1,832 °F).
Efek terhadap kesehatan jika terjadi kontak terhadap bahan ini adalah jika terkena kulit dapat menyebabkan iritasi kulit, kerusakan mata serius / iritasi mata, mungkin berbahaya bila terhirup yang dapat menyebabkan iritasi saluran pernafasan dan berbahaya jika tertelan. Gejala paling penting dari efek kesehatan tersebut adalah pusing, iritasi, batuk dan sesak nafas.
Tindakan pertolongan pertama jika terjadi kontak yaitu, jika tidak bernapas berikan napas buatan. Jika kontak dengan kulit maka cuci menggunakan sabun dengan air yang banyak. Cari bantuan medis jika iritasi berkembang. Jika terjadi kontak dengan mata maka segera basuh mata dengan air selama minimal 15 menit. Jika tertelan maka jangan pernah memberikan apapun melalui mulut kepada orang yang tidak sadar. Bilas mulut dengan air. (MSDS LTO)
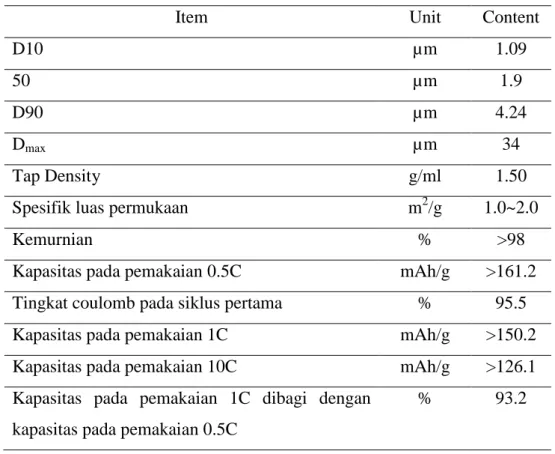
Tabel 2.1 Spesifikasi serbuk LTO
Item Unit Content
D10 µm 1.09
50 µm 1.9
D90 µm 4.24
Dmax µm 34
Tap Density g/ml 1.50
Spesifik luas permukaan m2/g 1.0~2.0
Kemurnian % >98
Kapasitas pada pemakaian 0.5C mAh/g >161.2 Tingkat coulomb pada siklus pertama % 95.5 Kapasitas pada pemakaian 1C mAh/g >150.2 Kapasitas pada pemakaian 10C mAh/g >126.1 Kapasitas pada pemakaian 1C dibagi dengan
kapasitas pada pemakaian 0.5C
% 93.2
2.4.2. PVDF
Polyvinylidene fluoride atau Polyvinylidene difluorida (PVDF) adalah bahan polimerisasi yang berbahaya dengan rumus kimia C2H2F2. PVDF memiliki karakteristik kimia dan fisika sebagai berikut: berbentuk pellet, berwarna putih dan tidak berbau, berat jenis 1,76 - 1,80, kelarutan dalam air dapat diabaikan, Hidrogen Fluorida (HF) memiliki NAB 3 ppm, titik lelehnya 165 °C (329 °F), tekanan uap 20 hPa (15 mmHg) pada 32°C (90°F) , densitasnya 1,78 g/mL pada 25°C (77°F).
Bahan ini stabil secara kimiawi di bawah kondisi penyimpanan dan penanganan yang normal serta dapat diantisipasi. Meskipun tidak begitu berbahaya dalam kondisi penanganan normal, tetapi jika bahan ini dipanaskan lebih dari 600oF (315oC) maka akan diproduksi suatu produk penguraian yang berbahaya dan evolusi HF menjadi cepat pada suhu 700oF (370oC). Produk penguraian yang berbahaya tersebut berupa hidrogen fluorida dan oksida karbon dengan konsentrasi suhu dan lama pemanasan yang bervariasi.
Hasil dekomposisi dari Hidrogen Fluorida (HF) tersebut sangat korosif dan dapat menyebabkan luka bakar parah yang mungkin tidak segera terlihat atau menyakitkan. Paparan HF dapat berakibat fatal jika diserap melalui kulit, terhirup atau tertelan. Dalam semua kasus paparan hidrogen fluorida utama (termasuk luka bakar pada kulit pada telapak tangan) mengakibatkan hipokalsemia. Pasien dengan luka bakar pada leher atau wajah, atau dengan tanda-tanda iritasi pernafasan, harus dipantau untuk edema paru, dan edema saluran napas pada pernafasan obstruksi. Perawatan pernapasan harus diawasi secara teliti dan lebih lanjut diberikan sebesar 2,5% kalsium glukonat oleh nebulization. Jika rasa sakit terus berlanjut lebih dari 30 menit, pertimbangkan untuk menyuntikkan kalsium glukonat (5%) ke dalam jaringan kulit di sekitar daerah yang terkena. Pada saat proses pemakaian produk, diharuskan pada ruangan yang memiliki ventilasi memadai. Simpan pada wadah tertutup rapat. Hindari dari menghirup asap atau uap pengolahan. (MSDS PVDF)
2.4.3. Super-P
Super P adalah campuran superplasticizing yang dapat mengurangi jumlah air yang dibutuhkan tanpa mempengaruhi konsistensi campuran. Aplikasi utama yang dibuat yaitu di pabrik perkerasan, beton dan lembaran. Manfaat dari penggunaan bahan Super-P adalah meningkatkan campuran plastisitas untuk penanganan lebih mudah dan cepat, meningkatkan daya tahan dan kekuatan, mengurangi penyusutan, membuatnya lebih mudah untuk mendapatkan permukaan halus dan mengurangi permeabilitas. Pemakaian bahan Super-P harus pada saat yang sama dengan agregat kering. Campur selama satu menit untuk memastikan dispersi lengkap. Super-P harus ditambahkan secara terpisah dari admixtures lainnya.
Sifat fisik dan kimia dari bahan Super-P adalah bahan ini berupa serbuk berwarna hitam, baunya tidak menyengat, densitas: 0.6 g/mL, pH: 7-10, Viskositas: 22,5 cst pada suhu 40oC, bersifat stabil, tidak cocok bila disatukan dengan asam dan zat pengoksidasi kuat, bersifat korosif, kelarutan dalam air: sebagian larut.
Efek terhadap kesehatan dapat menyebabkan iritasi mata atau iritasi kulit, berpotensi pada efek kesehatan choronic: studi pada hewan menunjukkan bahwa dietilen glikol monobutil eter memiliki efek reversibel pada organ manusia seperti hati, ginjal, sistem darah.
Pertolongan pertama jika terjadi kontak mata yaitu basuh segera dengan air selama minimal 15 menit, jika kontak dengan kulit: cuci dengan sabun dan bilas dengan air, segera hubungi dokter jika iritasi berkembang. Jika terjadi inhalasi pindahkan ke udara segar, jika napas terhenti, berikan napas buatan. (MSDS Super-P)
2.4.4. N,N-DMAC (N,N-Dimethylacetamide)
N,N-DMAC merupakan bahan kimia yang umumnya digunakan dalam penyusunan formula kimia untuk aplikasi industri, pembuatan zat kimia lain (digunakan sebagai perantara), dan sebagai pelarut dalam proses industri.
Sifat fisik dan kimia dari N,N DMAC adalah bahan ini berupa cairan tak berwarna hingga kuning dan memiliki bau amonia lemah, memiliki titik beku -20°C dan titik didih 165-166°C, non-eksplosif namun dianggap sebagai cairan yang tidak mudah terbakar. Nilai pH 4 (200g/l , 20°C), titik lebur -20°C, flash point 64.0°C. Batas ledakan bawah 5-15°C dibawah titik nyala. Batas ledakan atas nyala pada suhu 345°C. Tekanan uap 2,0 mbar (20°C), densitas 0.94 g/cm3 (20°C), kepadatan relatif 0.94. Koefisien Partisi noctanol/air (log Pow) -0.77 (25°C) , dekomposisi termal 420°C, > 120 kJ/kg. Viskositas dinamis 0,92 mPa.s (25°C). Kelarutan dalam air > 1.000 g/l (20°C), massa molar 87.12 g/mol.
Efek terhadap kesehatan yaitu: Berbahaya bila terhidup yang mengakibatkan toksisitas akut, berbahaya jika kena kulit, mungkin berbahaya jika tertelan, tidak menyebabkan iritasi pada kulit, dapat menimbulkan iritasi pada mata jika terkena, tidak dianggap sensitif, tidak dianggap mutagenik, tidak dianggap karsinogenik, dapat menyebabkan keracunan setelah paparan berulang.
2.4.5. Cu Foil
Sifat fisik dan kimia dari Cu foil yaitu: berbentuk padat dalam lembaran, berwarna keemasan, tidak berbau dan memiliki densitas 8.9 g/cm3. Adhesive acrylic bersifat konduktif, ketebalan berkisar 1,4 mil (0,04mm) dan tebal total (ASTM D1000) 3,5 mils (0,088mm). Pertambahan panjang 5%. Kekuatan adhesi (ASTM D3330) 35 oz (3.8 N / 10 mm). Rentang suhu -40ºC sampai +130ºC.
Efek kesehatan yang dapat merugikan manusia yaitu: debu pada proses inhalasi dapat menyebabkan iritasi. Jika terjadi kontak dengan debu dari bahan maka dapat menyebabkan iritasi pada mata.
Perlindungan tangan dapat dilakukan dengan menggunakan sarung tangan untuk melindungi tangan dari tepi lembaran tembaga yang tajam selama penanganan material. Perlindungan Pernapasan: Jika ada debu atau asap, menggunakan respirator sesuai dengan standar NIOSH/MSHA. Perlindungan mata: dapat mengunakan kacamata pengaman. Perlindungan kulit dan tubuh dengan memakai pakaian bersih atau sarung tangan pelindung. Simpan jauh dari kelembaban dan tetap di bawah suhu 25oC & 60% RH untuk mencegah dari oksidasi.
2.5. Karakterisasi
Karakterisasi yang dilakukan dalam penelitian ini meliputi:
2.5.1. Karakterisasi morfologi komposit lembaran anoda dengan SEM-EDS
Scanning Electron Microscopy (SEM) dilakukan sebagai analisis pendahuluan untuk mendapatkan visualisasi sampel. SEM bekerja dengan membombardir sampel dengan elektron berenergi tinggi yang menyebabkan elektron keluar dari dalam sampel dan elektron yang keluar tersebut akan dideteksi oleh detektor, yang disebut elektron sekunder. Elektron sekunder memiliki energi rendah dan mudah berhenti, dan oleh karena itu metode analisis sangat sensitif terhadap topografi. Dengan menghitung data yang diterima dengan metode ini, representasi visual, yaitu, mikrograf sebuah sampel dapat dihasilkan.
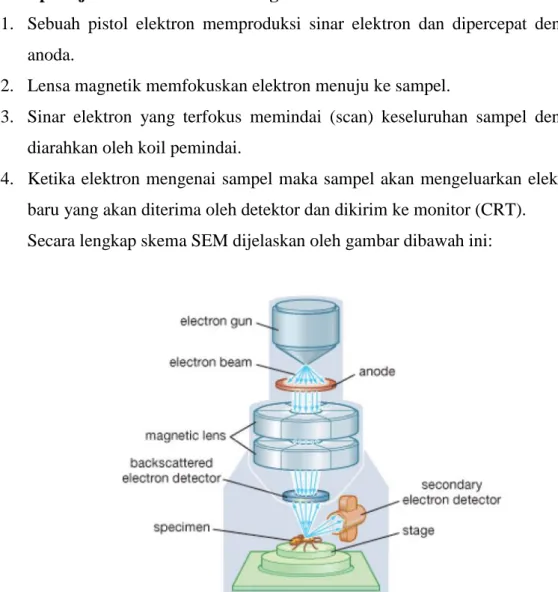
Prinsip kerja dari SEM adalah sebagai berikut:
1. Sebuah pistol elektron memproduksi sinar elektron dan dipercepat dengan anoda.
2. Lensa magnetik memfokuskan elektron menuju ke sampel.
3. Sinar elektron yang terfokus memindai (scan) keseluruhan sampel dengan diarahkan oleh koil pemindai.
4. Ketika elektron mengenai sampel maka sampel akan mengeluarkan elektron baru yang akan diterima oleh detektor dan dikirim ke monitor (CRT).
Secara lengkap skema SEM dijelaskan oleh gambar dibawah ini:
Gambar 2.7. Prinsip kerja SEM (Sumber: Encyclopedia Britannica, Inc, 2008)
Ada beberapa sinyal yang penting yang dihasilkan oleh SEM. Dari pantulan inelastis didapatkan sinyal elektron sekunder dan karakteristik sinar X sedangkan dari pantulan elastis didapatkan sinyal backscattered electron.
Ada SEM yang dilengkapi dengan fasilitas EDS yang dihasilkan dari karakteristik Sinar X, yaitu dengan menembakkan sinar X pada posisi yang ingin kita ketahui komposisinya. Maka setelah ditembakkan pada posisi yang diinginkan maka akan muncul puncak – puncak tertentu yang mewakili suatu unsur yang terkandung. Dengan EDS juga bisa membuat elemental mapping (pemetaan elemen) dengan memberikan warna berbeda – beda dari masing – masing elemen di permukaan bahan. EDS bisa digunakan untuk menganalisa
secara kunatitatif dari persentase masing – masing elemen. (materialcerdas.wordpress.com)
2.5.2. Karakterisasi gugus fungsional dengan FTIR (Fourier Transform Infrared)
Spektrofotometri infra-merah merupakan alat rutin dalam penemuan gugus fungsional, pengenalan senyawa, dan analisa campuran. Kebanyakan gugus, seperti C-H, O-H, C=N, dan C=N, menyebabkan pita absorpsi infra-merah, yang berbeda sedikit dari satu molekul ke yang lain tergantung pada substituen yang lain (Day dan Underwood,1990).
Pancaran infra-merah pada umumnya mengacu pada bagian spektrum elektromagnet yang terletak di antara daerah tampak dan daerah gelombang mikro. Bagi kimiawan organik, sebagian besar kegunaannya terbatas di antara 4000 cm-1 dan 666 cm-1 (2,5 – 15,0 μm). Akhir-akhir ini muncul perhatian pada daerah infra-merah dekat, 14.290 – 4000 cm-1 (0,7 – 2,5 μm) dan daerah infra-merah jauh, 700 – 200 cm-1 (14,3 – 50 μm) (Silverstein, dkk., 1986).
Spektrofotometri infra-merah juga digunakan untuk penentuan struktur, khususnya senyawa organik dan juga untuk analisis kuantitatif, seperti analisa kuantitatif pencemaran udara, misalnya karbon monoksida dalam udara dengan teknik non-dispersive (Khopkar, 2003).
Pada dasarnya Spektrofotometri FT-IR (Fourier Trasform Infra Red) adalah sama dengan spektrofotometri IR dispersi, yang membedakannya adalah pengembangan pada sistim optiknya sebelum berkas sinar infra-merah melewati
sampel.
Cara Kerja Alat Spektrofotometer FTIR
Sistem optik Spektrofotometer FT-IR seperti pada gambar dibawah ini dilengkapi dengan cermin yang bergerak tegak lurus dan cermin yang diam. Dengan demikian radiasi infra-merah akan menimbulkan perbedaan jarak yang ditempuh menuju cermin yang bergerak (M) dan jarak cermin yang diam (F). Perbedaan jarak tempuh radiasi tersebut adalah 2 yang selanjutnya disebut sebagai retardasi ( δ ). Hubungan antara intensitas radiasi IR yang diterima detektor
terhadap retardasi disebut sebagai interferogram. Sedangkan sistem optik dari Spektrofotometer IR yang didasarkan atas bekerjanya interferometer disebut sebagai sistem optik Fourier Transform Infra Red.
Gambar 2.8. Skema sistem kerja dari FTIR (Sumber:http://persembahanku.wordpress.com)
Pada sistem optik FT-IR digunakan radiasi LASER (Light Amplification by Stimulated Emmission of Radiation) yang berfungsi sebagai radiasi yang diinterferensikan dengan radiasi infra merah agar sinyal radiasi infra-merah yang diterima oleh detektor secara utuh dan lebih baik.
Detektor yang digunakan dalam Spektrofotometer FT-IR adalah TGS (Tetra Glycerine Sulphate) atau MCT (Mercury Cadmium Telluride). Detektor MCT lebih banyak digunakan karena memiliki beberapa kelebihan dibandingkan detektor TGS, yaitu memberikan respon yang lebih baik pada frekwensi modulasi tinggi, lebih sensitif, lebih cepat, tidak dipengaruhi oleh temperatur, sangat selektif terhadap energi vibrasi yang diterima dari radiasi infra-merah
(http://id.wikipedia.org/wiki/Spektrofotometer_FTIR).
2.5.3. Karakterisasi Cyclic Voltamettry
Dalam teknik voltametri siklik, pemindaian potensial dilakukan dalam arah bolak-balik mengikuti pola reaksi oksidasi dan reduksi. Voltamogram siklik reaksi redoks reversible diperlihatkan pada Gambar 2.9.
Pada voltamogram siklik tersebut, pemindaian kearah potensial negatif menghasilkan reaksi reduksi dengan arus puncak katodik pada potensial , sedangkan pemindaian kea rah sebaliknya menghasilkan arus puncak anodik pada potensial puncak .
Gambar 2.9. Profil voltamogram siklik suatu reaksi redoks.
Untuk reaksi redoks yang berlangsung secara reversibel, karakteristik voltametri siklik yang dapat diamati adalah:
1. Pemisahan potensial antara dua arus puncak (∆E) adalah mV.
2. Posisi potensial puncak tidak dipengaruhi oleh laju pemindaian potensial.
3. Rasio arus puncak, , sama dengan satu.
4. Arus puncak berbanding lurus dengan akar laju pindai. dan ∞ √
5. Seperti yang terjadi pada LSV, variasi laju pindai berpengaruh pada variasi tinggi arus puncak, tetapi tidak menggeser potensial puncak. (Bard, 2001)
2.5.4. Karakterisasi kapasitas baterai (Charge/Discharge)
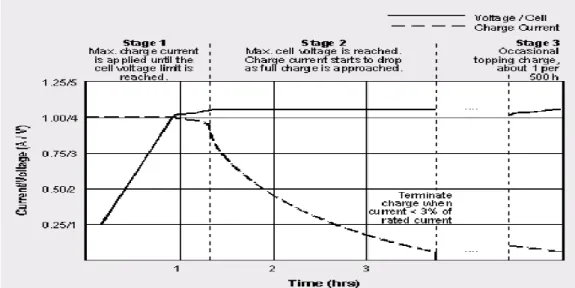
Untuk mendapatkan performasi sebuah baterai maka diperlukan pengujian charge/discharge sehingga akan didapatkan besar kapasitas sel baterai. Baterai lithium sekunder memiliki pola pengisian yang agak berbeda dengan baterai lainnya. Dipergulungn charger dengan profil I-V yang memenuhi karakteristik sebagai sumber arus dan sekaligus diakhir tahap pengisian berkarakteristik
sebagai sebuah sumber tegangan. Gambar 2.10 menunjukkan profil I-V pengisian baterai lithium ion rechargeable.
Gambar 2.10 Profil tegangan yang harus dipenuhi selama mengisi ulang sebuah baterai lithium.
Terdiri dari 3 tahapan. Stage 1 baterai diisi dengan sumber arus tetap, stage 2-3 dengan sumber tegangan tetap. (Achmad, 2011)