TEKNIK POLIMERISASI
(POL)
Disusun oleh: Hilman Prasetya Edi Dr. IGBN Makertihartha Dr. Melia Laniwati Gunawan
Dr. Ardiyan Harimawan
PROGRAM STUDI TEKNIK KIMIA FAKULTAS TEKNOLOGI INDUSTRI
INSTITUT TEKNOLOGI BANDUNG 2014
POL 1
DAFTAR ISI
DAFTAR ISI ... 1 DAFTAR GAMBAR ... 3 DAFTAR TABEL ... 4 BAB I PENDAHULUAN ... 5BAB II TUJUAN DAN SASARAN ... 6
II.1. Tujuan... 6
II.2. Sasaran ... 6
BAB III RANCANGAN PERCOBAAN ... 7
III.1. Perangkat dan Alat Ukur ... 7
III.2. Bahan ... 7
III.3. Skema Alat Percobaan ... 8
BAB IV PROSEDUR KERJA ... 9
IV.1. Prosedur Percobaan ... 10
IV.2. Tes I – Analisa Kadar Formaldehid Bebas... 11
IV.3. Tes II – pH Larutan ... 12
IV.4. Tes III – Penentuan Viskositas Sampel ... 12
IV.5. Tes IV – Penentuan Kadar Resin ... 13
IV.6. Tes V – Penentuan Densitas Sampel ... 13
DAFTAR PUSTAKA ... 14
LAMPIRAN A TABEL DATA MENTAH ... 15
A.1. Penentuan Kinetika Reaksi... 15
A.2. Penentuan pH Larutan Sampel ... 16
A.3. Penentuan Viskositas Larutan Sampel ... 16
A.4. Penentuan Densitas Larutan Sampel ... 16
A.5. Penentuan Kadar Resin ... 17
LAMPIRAN B PROSEDUR PERHITUNGAN ... 18
B.1. Penentuan Jumlah Formadehid ... 18
B.2. Penentuan Jumlah Urea ... 18
B.3. Penentuan Jumlah Katalis dan Buffer ... 18
B.4. Penentuan Kadar Formaldehid Bebas ... 19
POL 2
B.6. Penentuan Kadar Resin ... 24
B.7. Penentuan Konsentrasi Resin (Cr) ... 24
B.8. Penentuan Viskositas Resin ... 24
B.9. Penentuan Densitas Resin ... 25
B.10. Penentuan Massa Molekul Rata-Rata (MR) ... 25
LAMPIRAN C DATA SPESIFIKASI DAN LITERATUR ... 26
C.1. Densitas Air pada Berbagai Temperatur ... 26
C.2. Viskositas Air pada Berbagai Temperatur ... 26
C.3. Massa Molekul Relatif ... 26
POL 3
DAFTAR GAMBAR
Gambar 3.1. Skema Alat Percobaan ... 8
Gambar 4.1. Diagram Alir Prosedur Percobaan ... 10
Gambar 4.2. Diagram Alir Prosedur Tes I ... 11
Gambar 4.3. Diagram Alir Prosedur Tes II... 12
Gambar 4.4. Diagram Alir Prosedur Tes IV ... 13
Gambar B.1. Kurva Orde Reaksi 1 ... 22
Gambar B.2. Kurva Orde Reaksi 2 ... 22
Gambar B.3. Kurva Orde Reaksi 0 ... 23
POL 4
DAFTAR TABEL
Tabel A.1. Data Penentuan Kineika Reaksi ... 15
Tabel A.2. Data pH Larutan Sampel ... 16
Tabel A.3. Data Viskositas Sampel ... 16
Tabel A.4. Data Densitas Sampel ... 17
Tabel A.5. Data Kadar Resin ... 17
Tabel B.1. Contoh Data Percobaan ... 21
Tabel C.1. Densitas Air ... 26
Tabel C.2. Viskositas Air ... 26
Tabel C.3. Massa Molekul Relatif Bahan ... 26
POL 5
BAB I
PENDAHULUAN
Polimer sudah menjadi material yang memenuhi kebutuhan hidup sehari-hari manusia. Polimer dapat menjadi bahan bermacam-macam alat kebutuhan manusis seperti botol, tali, plastik, teflon, dan lainnya. Penggunaannya semakin digemari karena sifatnya yang ringan, tahan korosi, beberapa bahan relatif tahan asam, beberapa bahan relative tahan sampai temperatur tinggi, dan kuat. Polimer adalah senyawa yang bermassa molekul relatif besar dan terdiri atas monomer-monomer.
Urea-formaldehid resin adalah hasil kondensasi urea dengan formaldehid. Resin jenis ini termasuk dalam kelas resin thermosetting yang mempunyai sifat tahan terhadap asam, basa, tidak dapat melarut dan tidak dapat meleleh. Polimer termoset dibuat dengan menggabungkan komponen-komponen yang bersifat saling menguatkan sehingga dihasilkan polimer dengan derajat cross link yang sangat tinggi. Karena sifat-sifat di atas, aplikasi resin urea-formaldehid yang sangat luas sehingga industri urea-formaldehid berkembang pesat. Contoh industri yang menggunakan industri formaldehid adalah addhesive untuk plywood, tekstil resin finishing, laminating, coating, molding, casting, laquers, dan sebagainya.
Pembuatan resin urea-formaldehid secara garis besar dibagi menjadi tiga. Reaksi pertama adalah reaksi metiolasi, yaitu penggabungan urea dan formaldehid membentuk monomer-monomer yang berupa monometilol dan dimetil urea. Reaksi kedua adalah penggabungan monomer yang terbentuk menjadi polimer yang lurus dan menghasilkan uap air. Tahap ini disebut tahap kondensasi. Proses ketiga adalah proses curing, dimana polimer membentuk jaringan tiga dimensi dengan bantuan pemanasan dalam oven.
Pada praktikum ini akan dipelajari pengaruh beban rasio urea-formaldehid pada pembentukan resin. Untuk itu digunakan variasi perbandingaan formaldehid dan urea (F/U). Untuk mempelajari kinetika reaksi, sebelum proses curing larutan resin urea formaldehid dideteksi konsentrasi jumlah formaldehid yang bebas.
POL 6
BAB II
TUJUAN DAN SASARAN
II.1. Tujuan
Tujuan pelaksanaan praktikum modul teknik polimerisasi adalah:
1. Praktikan mempelajari salah satu teknik polimerisasi, khususnya polimerisasi kondensasi Urea-Formaldehid.
2. Praktikan mempelajari reaksi polimerisasi tersebut.
3. Praktikan mempelajari pengaruh-pengaruh kondisi operasi terhadap hasil reaksi polimerisasi.
II.2. Sasaran
Sesuai tujuan di atas, hasil percobaan polimerisasi urea-formaldehid ini diharapkan berupa:
1. Mekanisme reaksi polimerisasi kondensasi dan persamaan reaksinya. 2. Parameter-parameter persamaan reaksi polimerisasi.
POL 7
BAB III
RANCANGAN PERCOBAAN
III.1. Perangkat dan Alat Ukur
Perangkat dan alat ukur yang akan digunakan untuk percobaan teknik polimerisasi adalah:
1. Set perangkat modul teknik polimerisasi yang terdiri atas labu berdasar bundar dimana reaksi dilangsungkan, yang dilengkapi dengan pengaduk yang digerakkan oleh motor listrik, thermometer untuk mengamati suhu reaksi, refluks kondensor, dan alat pengambil sampel.
2. Viscometer 3. Waterbath 4. Erlenmeyer 5. Piknometer 6. Labu volumetrik 7. Perangkat titrasi 8. Timbangan/ neraca 9. Oven 10.Cawan perselen III.2. Bahan
Bahan-bahan yang akan digunakan untuk percobaan teknik polimerisasi adalah: 1. Urea
2. Formaldehid (dalam bentuk larutan formalin) 3. Na-sulfit
4. Na-karbobat 5. Alkohol
6. Indikator Corellin 7. Asam sulfat
POL 8
III.3. Skema Alat Percobaan
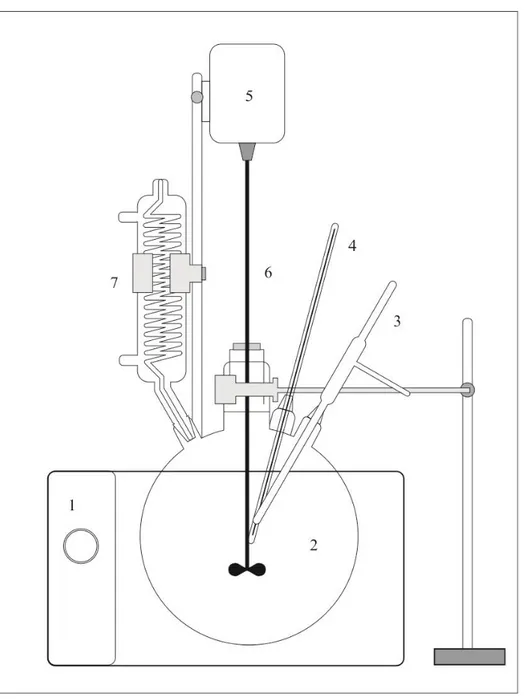
Gambar 3.1. Skema Alat Percobaan Keterangan:
1. Waterbath. 2. Reaktor.
3. Tempat pengambil sampel. 4. Termometer.
5. Motor pengaduk. 6. Impeller.
POL 9
BAB IV
PROSEDUR KERJA
Pada bab ini akan dijelaskan cara pengerjaan percobaan teknik polimerisasi. Cara kerja percobaan secara umum dijelaskan di bawah ini:
1. Menyusun peralatan sesuai dengan sketsa gambar dan mengecek kondisi peralatan 2. Mempersiapkan peralatan analisa
3. Menghitung dan mempersiapkan zat-zat kimia yang diperlukan dalam reaksi, sesuai dengan kondisi variasi percobaan
4. Melakukan percobaan reaksi kondensasi. Extent of reaction diamati dengan mengambil sampel pada waktu tertentu dan dianalisa kadar formaldehid bebas dengan cara Test I. Reaksi dihentikan jika dari hasil tersebut di atas kadar formaldehid yang konstan.
5. Analisa hasil reaksi dilakukan sebagai berikut:
Analisis pH dengan kertas pH
Analisis kadar formaldehid bebas dengan Test I
Analisis kadar resin dengan Test V
Analisis viskositas, dan stroke cure dengan Test III dan IV A., B., C.
Analisis densitas dengan est VI. Jika diperlukan data viskositas tiap sampel perlu dilakukan Test IV.A
POL 10
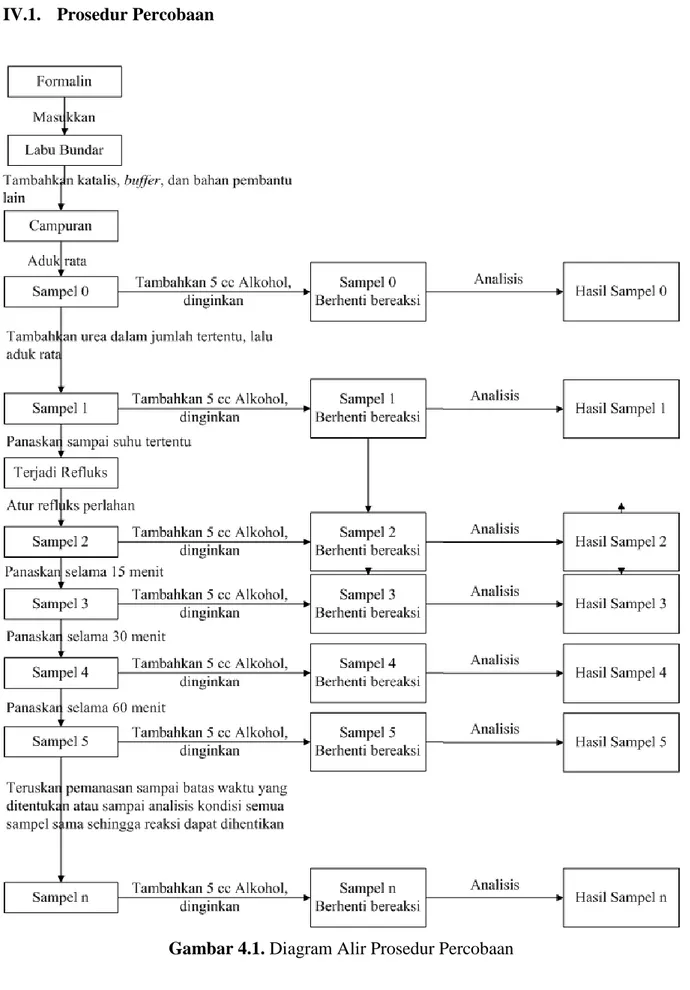
IV.1. Prosedur Percobaan
POL 11
IV.2. Tes I – Analisa Kadar Formaldehid Bebas
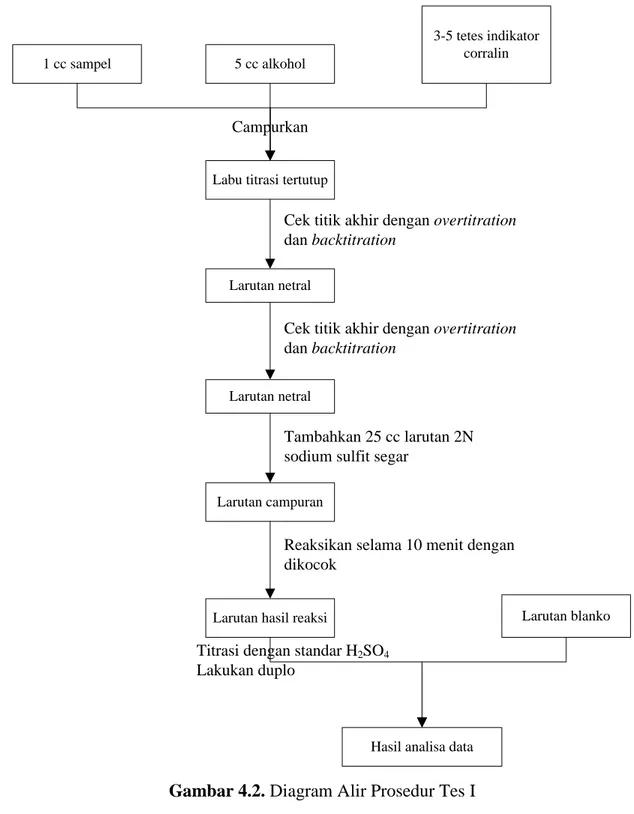
Tes I dilakukan untuk menganalisa kadar formaldehid bebas dengan menggunakan sodium sulfit. Diagram alir prosedur ditunjukkan pada Gambar 4.2.
Dasar reaksi: NaOH yang terbentuk, ekivalen dengan kadar formaldehid bebas dalam larutan. H2O + CH2O + Na2SO4 → HO − CH2− SO3Na + NaOH
1 cc sampel 5 cc alkohol
3-5 tetes indikator corralin
Labu titrasi tertutup
Larutan netral
Larutan netral
Larutan campuran
Larutan hasil reaksi Larutan blanko
Hasil analisa data Campurkan
Cek titik akhir dengan overtitration
dan backtitration
Cek titik akhir dengan overtitration
dan backtitration
Tambahkan 25 cc larutan 2N sodium sulfit segar
Reaksikan selama 10 menit dengan dikocok
Titrasi dengan standar H2SO4
Lakukan duplo
POL 12
IV.3. Tes II – pH Larutan
Tes II dilakukan untuk menganalisa pH larutan dengan menggunakan kertas pH. Diagram alir prosedur ditunjukkan pada Gambar 4.3.
Gambar 4.3. Diagram Alir Prosedur Tes II
IV.4. Tes III – Penentuan Viskositas Sampel
Tes III dilakukan untuk menentukan viskositas cairan dengan menggunakan viskometer Ostwald pada temperatur konstan. Viskometer dikalibrasi dengan menggunakan air pada suhu tertentu untuk mendapatkan nilai K.
POL 13
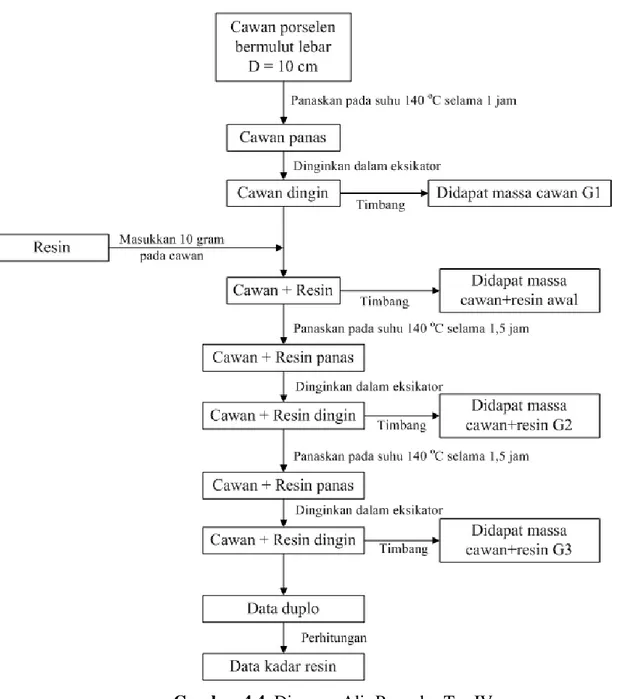
IV.5. Tes IV – Penentuan Kadar Resin
Tes IV dilakukan untuk menentukan waktu curing. Diagram alir prosedur ditunjukkan pada Gambar 4.4.
Gambar 4.4. Diagram Alir Prosedur Tes IV
IV.6. Tes V – Penentuan Densitas Sampel
Tes V dilakukan untuk menentukan densitas cairan dengan menggunakan piknometer. Piknometer dikalibrasi dengan menggunakan air pada suhu tertentu.
POL 14
DAFTAR PUSTAKA
1. Billmeyer Jr., F.W., Textbook of Polymer Science, John Wiley and Sons, 1994, pp. 186-219
2. D’Alelio, G.F., Experimental Plastics and Synthetic Reisns, John Wiley and Sons, 1952, pp. 163-166
3. Kirk-Orthmer, Encyclopedia of Chemical Technology, 2nd Edition., Vol. 2, pp. 225-258
POL 15
LAMPIRAN A
TABEL DATA MENTAH
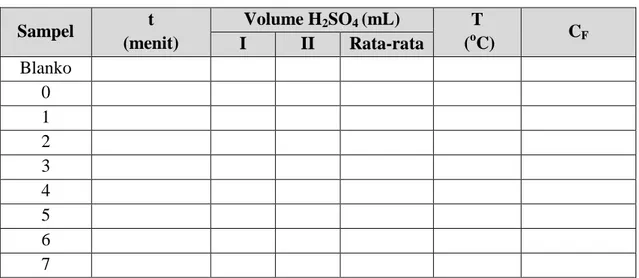
A.1. Penentuan Kinetika Reaksi
F/U = Volume Formalin = mL Massa Urea = g Massa Amonia = g Massa buffer = g Konsentrasi H2SO4 = M Volume sampel = mL Temperatur = oC
Tabel A.1. Data Penentuan Kineika Reaksi
Sampel t (menit) Volume H2SO4 (mL) T (oC) CF I II Rata-rata Blanko 0 1 2 3 4 5 6 7 \
POL 16
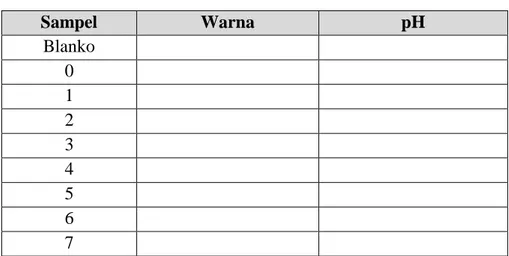
A.2. Penentuan pH Larutan Sampel
Tabel A.2. Data pH Larutan Sampel
Sampel Warna pH Blanko 0 1 2 3 4 5 6 7
A.3. Penentuan Viskositas Larutan Sampel
Waktu untuk aqua dm = detik
Specific gravity aqua dm =
Viskositas aqua dm (Tpercobaan) = cP
Tabel A.3. Data Viskositas Sampel
No Cr (g/100mL) t (detik) 1 2 3 4 5
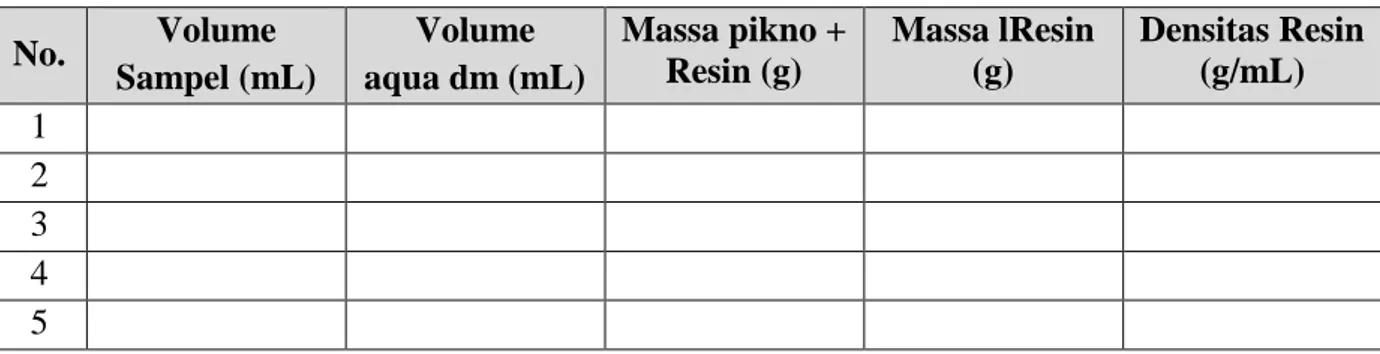
A.4. Penentuan Densitas Larutan Sampel
Massa piknometer kosong = g
Massa piknometer + aqua dm = g Densitas aqua dm (Tpercobaan) = g/mL
Volume piknometer = mL
POL 17
Tabel A.4. Data Densitas Sampel
No. Volume Sampel (mL) Volume aqua dm (mL) Massa pikno + Resin (g) Massa lResin (g) Densitas Resin (g/mL) 1 2 3 4 5
A.5. Penentuan Kadar Resin
Tabel A.5. Data Kadar Resin No. Massa cawan
kosong G1 (g) Massa cawan + Resin basah Massa Cawan + Resin G2 (g) Massa Cawan + Resin G3 (g) Massa Resin (g) 1 2 3 4 5 6 7
POL 18
LAMPIRAN B
PROSEDUR PERHITUNGAN
B.1. Penentuan Jumlah Formadehid
Massa larutan formalin = ρ*V
dimana: ρ larutan formalin = 1.079 g/mL Misalkan V(volume percobaan) = 500 mL
Maka → massa larutan formalin = 500 mL*1,079 g/mL massa larutan formalin = 539,5 g
Jika larutan formalin mengandung 36% formaldehid,
massa formaldehid = 0,36*539,5 = 194,22 g
Mol Formaldehid = Massa Formaldehid MR
Mol Formaldehid = 194,22
30 = 6,47 mol B.2. Penentuan Jumlah Urea
Misalkan untuk F/U = 1,65
Maka → mol urea = F/1,65 = 6,474/1,65 = 3,924 mol Massa urea = mol urea* MR urea = 3,924 mol*66 g/mol
Massa urea = 235,418 g
B.3. Penentuan Jumlah Katalis dan Buffer
Misal: massa total campuran = X g massa katalis 5% massa total = 0,05 X massa buffer 5% massa katalis = 0,05*0,05*X X = massa (formalin + urea + katalis + buffer) X = 539,5 + 235,418 + 0,05X + 0,05*0,05*X 0,9475 X = 774,918
POL 19
Massa NH4OH yang ditambahkan = 40,89 g NH4OH yang digunakan 21%-W/W = 194,73 g
Volume NH4OH yang ditambahkan (larutan 21%-W/W) adalah: (densitasmassa ) larutan =194,730,934 = 208,49 mL
Massa Na2CO3 yang ditambahkan = 2,5.10-3.X = 2,045 g B.4. Penentuan Kadar Formaldehid Bebas
Misalkan Cc,blanko = 0,2
Cc,titran H2SO4 = 0,7
Pada kondisi tersebut Csampel = 1,5 Maka → konsentrasi formaldehid bebas adalah:
CF= massa CH2O (g) 100 mL = 3 ∗ (Cc,titran− Cc,blanko) ∗ NH2SO4 Cc,sampel CF = (3 ∗ (0,7 − 0,2) ∗ 1 1,5 ) = 1,05 g/100 mL
B.5. Penentuan Orde dan Konstanta Laju Reaksi
Persamaan umum laju reaksi:
−dCF
dt = k ∗ CFn
Untuk menentukan orde dan konstanta laju reaksi secaea sederhana digunakan metoda integral.
1. Jika diasumsikan reaksi mengikuti orde 1 terhadap konsentrasi, persamaan kinetika laju reaksinya adalah:
−dCF
dt = k ∗ CF1 Integrasi persamaan tersebut adalah sebagai berikut:
∫ dCF CF CF C0 = − ∫ k ∗ dt t 0 lnCF C0 = −k ∗ t
POL 20
ln CF = ln C0− kt
Dengan demikian, bila dialurkan ln Cf terhadap t (waktu) akan diperoleh hubungan linier dengan gradien garis –k menunjukkan konstanta laju reaksi.
2. Jika diasumsikan reaksi mengikuti orde 2 terhadap konsentrasi, persamaan kinetika laju reaksinya adalah:
−dCF
dt = k ∗ CF2 Integrasi persamaan tersebut adalah sebagai berikut:
∫ dCF CF2 CF C0 = − ∫ k ∗ dtt 0 1 C0− 1 CF = −kt 1 CF = 1 C0+ kt
Dengan demikian, bila dialurkan 1/Cf terhadap t (waktu) akan diperoleh hubungan linier dengan gradien garis k menunjukkan konstanta laju reaksi.
3. Jika diasumsikan reaksi mengikuti orde 0 terhadap konsentrasi, persamaan kinetika laju reaksinya adalah:
−dCF dt = k
Integrasi persamaan tersebut adalah sebagai berikut:
∫ dCF CF C0 = − ∫ k ∗ dt t 0 CF− C0 = −kt CF = C0− kt
Dengan demikian, bila dialurkan Cf terhadap t (waktu) akan diperoleh hubungan linier dengan gradien garis –k menunjukkan konstanta laju reaksi.
POL 21
4. Jika diasumsikan reaksi mengikuti orde 1,5 terhadap konsentrasi, persamaan kinetika laju reaksinya adalah:
−dCF
dt = k ∗ CF1,5 Integrasi persamaan tersebut adalah sebagai berikut:
∫ dCF CF1,5 CF C0 = − ∫ k ∗ dt t 0 2 ∗ (CF−0,5− C0−0,5) = −kt CF−0,5 = − 1 2kt + C0 −0,5
Dengan demikian, bila dialurkan Cf terhadap t (waktu) akan diperoleh hubungan linier dengan gradien garis –0,5.k. Konstanta laju reaksi adalah 2 kali gradien.
Berikut contoh data percobaan:
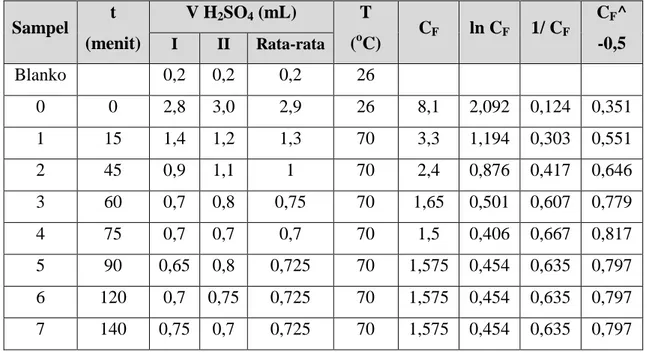
Tabel B.1. Contoh Data Percobaan
Sampel t (menit) V H2SO4 (mL) T (oC) CF ln CF 1/ CF CF^ -0,5 I II Rata-rata Blanko 0,2 0,2 0,2 26 0 0 2,8 3,0 2,9 26 8,1 2,092 0,124 0,351 1 15 1,4 1,2 1,3 70 3,3 1,194 0,303 0,551 2 45 0,9 1,1 1 70 2,4 0,876 0,417 0,646 3 60 0,7 0,8 0,75 70 1,65 0,501 0,607 0,779 4 75 0,7 0,7 0,7 70 1,5 0,406 0,667 0,817 5 90 0,65 0,8 0,725 70 1,575 0,454 0,635 0,797 6 120 0,7 0,75 0,725 70 1,575 0,454 0,635 0,797 7 140 0,75 0,7 0,725 70 1,575 0,454 0,635 0,797
POL 22
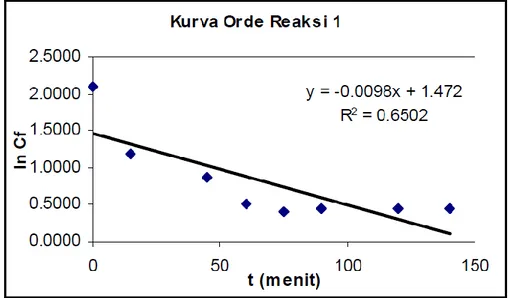
Jika persamaan kinetika laju reaksi tersebut diasumsikan mengikuti orde 1:
Gambar B.1. Kurva Orde Reaksi 1
Jika persamaan kinetika laju reaksi tersebut diasumsikan mengikuti orde 2:
POL 23
Jika persamaan kinetika laju reaksi tersebut diasumsikan mengikuti orde 0:
Gambar B.3. Kurva Orde Reaksi 0
Jika persamaan kinetika laju reaksi tersebut diasumsikan mengikuti orde 1,5:
POL 24
Dari kempat pendekatan/tebakan orde reaksi tersebut, yang paling mendekati kurva linear adalah jika persamaan kinetika reaksi tersebut dimodelkan sebagai persamaan aju reaksi orde 2 (R2 paling mendekati 1 yaitu 0,727).
Dan konstanta laju reaksi persamaan kinetika tersebut adalah 0,035. Maka secara umum persamaan kinetika reaksi polimerisasi urea formaldehid sesuai rangkaian data tersebut adalah:
−dCF
dt = 0,0035CF2 B.6. Penentuan Kadar Resin
Persamaan yang digunakan adalah:
%Kadar Resin = G3 − G1
Massa sampel resin× 100% B.7. Penentuan Konsentrasi Resin (Cr)
Persamaan yang digunakan adalah:
CR= ρResin× Kadar Resin × V Sampel
B.8. Penentuan Viskositas Resin Persamaan yang digunakan adalah:
μdinamik = μaqua dm t aqua dm× Qsampel SGaqua dm× tsampel μspesifik = μdinamik t aqua dm (T)− 1 μspesifik CR = μintrinsik+ k(μintrinsik)2× CR
POL 25
SG adalah specific gravity. Dengan mengalurkan grafik μspesifik/CR terhadap CR, akan diperoleh garis yang menunjukkan fungsi linear dengan slope μintrinsik.
B.9. Penentuan Densitas Resin
Persamaan yang digunakan adalah:
%Resin = G3 − G1
Berat Resin Sampel× 100% B.10. Penentuan Massa Molekul Rata-Rata (MR)
Persamaan yang digunakan adalah:
μ
intrinsik= k × (MR)
aNilai k didapat dari penyelesaian grafik μspesifik/CR terhadap CR. Gradien garis tersebut adalah k. μintrinsik2. Jika μintrinsik dan k diketahui, maka MR polimer dapat dihitung.
POL 26
LAMPIRAN C
DATA SPESIFIKASI DAN LITERATUR
C.1. Densitas Air pada Berbagai Temperatur
Tabel C.1. Densitas Air Temperatur (oC ρ (g/mL)
25 26 27 28
C.2. Viskositas Air pada Berbagai Temperatur
Tabel C.2. Viskositas Air Temperatur (oC µ (cP)
25 26 27 28
C.3. Massa Molekul Relatif
Tabel C.3. Massa Molekul Relatif Bahan
Zat Rumus Molekul MR
Urea CO(NH2)2 60
Formaldehid CH2O 30
Amoniak NH4OH 35
Natrium Karbonat Na2CO3 106
POL 27
C.4. Densitas Zat pada Temperatur Percobaan
Tabel C.4. Densitas Bahan
Zat Rumus Molekul ρ (g/mL)
Urea CO(NH2)2
Formaldehid CH2O
Amoniak NH4OH
Natrium Karbonat Na2CO3 Natrium Sulfit Na2SO3