POLIMERISASI UREA-FORMALDEHID
Retno Sulistyo Dhamar Lestrari, S.T.,M.Eng, Ulil Anshori, Intan Juniari Nuru
Jurusan Teknik Kimia, Fakultas Teknik,
Universitas Sultan Ageng Tirtayasa.Jalan Jenderal Sudirman Km.3 Cilegon 42435, Banten, Indonesia
ABSTRAK
Polimer merupakan senyawa makromolekul yang terbentuk dari susunan ulang molekul kecil. Reaksi penggabungan dari monomer menjadi polimer disebut reaksi polimerisasi. Urea-formaldehid dibuat dengan reaksi polimerisasi kondensasi. Tujuan dari percobaan polimer adalah agar dapat memahami salah satu teknik polimerisasi, khususnya polimerisasi kondensasi Urea-formaldehid, dan mengerti reaksinya serta mengetahui pengaruh-pengaruh kondisi operasi terhadap hassil reaksi polimerisasi. Aplikasi industry dari urea-formaldehid adalah sebagai coating, mikro enkapsulasi dan perekat. Percobaan dilakukan dengan reaksi kondensasi, kelangsungan reaksi diamati dengan mengambil cuplikan setiap 10 menit selama satu jam, kemudian menentukan kadar, densitas, viskositas dan pH formaldehid. Hasil percobaan menunjukkan orde reaksi pada percobaan polimerisasi adalah orde 2, hasil terbaik terjadi pada saat F/U = 1.75
Keyword : Reaksi kondensasi, polimerisasi, formaldehid, orde reaksi
1. Pendahulun
1.1 Latar Belakang
Kebutuhan manusia akan polimer dari tahun-ketahun menga lami peningkatan yang signifikan. Hal ini ditandai dengan seemakin banyaknya peralatan dirumah-rumah yang memakai bahan polimer, polimer sangat bermanfaat bagi kehidupan manusia di dunia, mulai dari sebagai wadah makanan, minuman, cashing alat elektronik, serta dalam bidang medis digunakan untuk membuat sintesis organ manusia.
Polimerisasi merupakan proses bereaksinya molekul monomer bersama dalam reaksi kimia untuk membentuk tiga dimensi jaringan atau rantai polimer. Polimerisasi digolongkan kedalam beberapa system seperti : system adisi-kondensasi dan system pertumbuhan rantai bertahap. Salah satu contoh polimerisasi kondensasi yaitu proses pembuatan Urea-formaldehid. Urea-formaldehid resin adalah hasil kondensasi urea dengan formaldehid. Resin ini termasuk dalam kelas resin thermosetting yang mempunyai sifat tahan asam, basa, tidak dapat melarut dan meleleh.
Aplikasi industry yang menggunakan polimer formaldehid, yaitu adhesive untuk plywood, tekstil resin finishing, laminating coating, molding dan sebagainya.
2. Tinjauan Pustaka
2.1 Polimer
Polimer berasal dari Bahasa yunani yaitu
poly, yang berarti banyak, dan mer yang berarti bagian atau satuan. Ciri utama polimer yakni mempunyai rantai yang sangat panjang dan memiliki massa molekul yang besar.[1]
Polimer merupakan rangkaian molekul panjang yang tersusun dari pengulangan kesatuan molekul yang kecil dan sederhana. Molekul kecil dan sederhana penyusun polimer disebut dengan monomer.[2]
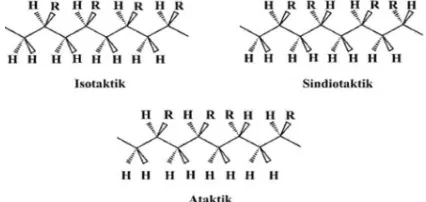
[image:1.595.344.557.611.712.2]Berdasarkan keteraturan rantainya, polimer dapat dibedakan menjadi polimer kristalin, semi kristalin dan amorf. Polimer kristalin adalah polimer dengan susunan rantai yang teratur satu terhadap yang lainnya. Polimer amorf memiliki susunan rantai acak.[3]
2.2 Proses Polimerisasi
Proses pembentukan rantai molekuk raksasa polimer dari unit-unit molekul terkecil melibatkan reaksi yang kompleks. Proses polimerisasi secara umum dapat dikelompokkan menjadi dua jenis reaksi, yaitu polimerisasi adisi dan polimerisasi.[8]
2.2.1 Polimerisasi Adisi
Polimerisasi adisi umumnya terjadi pada monomer berkaitan rangkap dan melibatkan molekul tidak stabil sebagai inisiator. Adapun tahapan reaksi polimerisasi adisi adalah sebagai berikut.
a. Inisiasi
Pembentukan pusat aktif hasil peruraian suatu inisiator. Peruraian suatu inisiator dapat dilakukan menggunakan panas, sinar uv, dan sinar gamma (radiasi).
b. Propagasi (perambatan)
Tahapan dimana pusat aktif bereaksi dengan monomer secara adisi kontinyu (berlanjut).
c. Terminasi (pengakhiran)
Tahapan dimana pusat aktif dinonaktifkan pada tahap akhir. Penonaktifan ini dapat dilakukan dengan menggandengkan radikal dan disporposionasi yang melibatkan transfer suatu atom dari satu ujung rantai ke ujung rantai lainnya.
[9]
2.2.2 Polimerisasi Kondensasi
Polimerisasi kondensasi adalah reaksi antara dua pusat aktif membentuk senyawa baru yang lebih besar dan hasil samping. Ciri-ciri polimerisasi kondensasi, yaitu :
a. Berlangsung sevara bertahap melalui reaksi antara pasangan gugus fungsi ujung.
b. Berat molekul polimer bertambah secara bertahap.
c. Kereaktifan suatu gugus fungsi dalam bentuk polimernya sama dengan dalam bentuk monomer.
d. Dapat membentuk struktur cincin, bergantung pada keluwesan gugus yang terlibat dan ukuran cincin yang terbentuk.
e. Dapat membentuk polimer bercabang atau sambung hilang apabila gugus fungsi kedua monomer lebih dari dua.
f. Dalam tahap tertentu terbentuk struktur jaringan, maka terjadi perubahan sifat polimer yang mendadak, misalnya campuran reaksi berubah dari cairan menjadi gel.
g. Derajat polimerisasi dikendalikan dengan variasi waktu dan suhu. Derajat polimerisasi (DP) suatu polimer adalah rasio atau perbadingan berat molekul polimer dengan berat molekul monomernya. DP menggambarkan ukuran molekul dari suatu polimer berdasarkan jumlah dari monomer penyusunnya.[10] h. Penghentian polimerisasi kondensasi dapat
dilakukan dengan penambahan penghentian ujung seperti asam etanoat, penambahan salah satu monomer berlebih dan penambahan pada suhu tertentu.
2.3 Reaksi Urea-formaldehid
Urea-formaldehid adalah hasil kondensasi urea dengan formaldehid. Resin jenis ini termasuk dalam kelas resin thermoset yang mempunyai sifat tahan terhadap asam, basa, tidak dapat melarut dan tidak dapat meleh.
Gambar 2. Struktur Molekul Urea-formaldehid
Mekanisme reaksi urea-formaldehid terdiri dari tiga tahap, yaitu tahap reaksi metilolasi, tahap reaksi kondensasi dan tahap reaksi curing.
2.4 Variabel Reaksi Urea-formaldehid
Variabel yang menentukan proses polimerisasi urea-formaldehid, adalah :
a. Perbandingan mol formaldehid dengan urea.
Reaksi metilolasi berlangsung baik pada suasana basa dengan pH antara 8.5 – 9, sedangkan kondisi berlangsung baik pada keadaan asam. Untuk mengatur pH digunakan katalis asam atau basa.
c. Temperature
Temperatur reaksi boleh melebihi titik lelehnya, karena dimetilol urea yang terjadi akan kehilangan air dan formaldehid. d. Katalis
Untuk proses ini digunakan katalis ammonia yang menururnkan energy aktivasi dengan menyerap panas pada saat curing, fungsinya adalah untuk mengatur penguapan agar tidak gosong.
e. Waktu reaksi
Semakin lama reaksi berjalan, maka resin urea-formaldehid yang dihasilkan akan semakin banyak.
3 Metodelogi Penelitian
3.1 Diagram Alir
Berikut ini diagram alir percobaan polimerisasi urea formaldehid.
a. Proses pembentukan urea-formaldehid Formalin
Na2CO3
Katalis
b. Analisa viskositas
c. Analisa kadar formaldehid
1 cc sampel 5 cc alkohol 3 tetes pp
Labu leher tiga
Sampel 0
Sampel 0
Memanaskan T=800C
Sampel 1
Sampel 2
Sampel 6 Memanaskan t=10 menit
Memanaskan t=10 menit, sampai sampel 6
Hasil Sampel 0
Hasil Sampel 0
Hasil Sampel 1
Hasil Sampel 2
Hasil
Viscometer
Menghitung waktu sampel mengalir kebatas bawah
Mencatat waktu dan menghitung viscositas
Erlemeyer
Menitrasi dengan larutan H2SO4
Mencatat volume titran
Menambahkan 25 ml Na2SO4
Mencatat volume titran
Menitrasi dengan larutan H2SO4
Melakukan duplo Analisa
Analisa
Analisa Analisa
Analisa Analisa
Analisa
Analisa
[image:3.595.45.274.427.799.2]
d. Analisa densitas
3.2 Alat dan Bahan
3.2.1 Alat
Alat yang digunakan pada percobaan polimerisasi urea-formaldehid, yaitu :
a. Alat titrasi b. Labu leher 3 c. Piknometer d. Pengduk stirrer e. Viskometer ostwold f. Water bath
3.2.2 Bahan
Bahan yang dibutuhkan pada percobaan polimerisasi urea-formaldehid, yaitu :
a. Alcohol b. Asam sulfat
c. Formalin d. Indikator pp e. Na2SO4
f. Urea
3.3 Prosedur Percobaan
Pada percobaan polimerisasi urea-formaldehid terdapat empat prosedur yaitu :
3.3.1 Proses Pembentukan Urea-formaldehid
Menyiapkan alat dan bahan untuk praktikum teknik polimerisasi, masukkan larutan formalin kedalam labu leher tiga, menambahkan larutan Na2CO3 sebagai buffering agent sebanyak 5% dari
jumlah katalis dan memasukkan ammonia sebagai katalis sebanyak 5% dari jumlah total campuran, menganalisa larutan tersebut sehingga mendapatkan hasil sampel ke 0, menambahkan urea dengan jumlah tertentu ke dalam sampel 0, dapat dikatakan sampel 0 menjadi 1. Menganalisa sampel 1 sehingga mendapatkan hasil, memanaskan sampel 1 secara perlahan hingga temperature tertentu sehingga dapat dikatakan sampel 1 menjadi sampel 2. Menganalisa sampel 2 sehingga mendapatkan hasil, melanjutkan pemanasan dan mengambil sampel setiap 10 menit sampai satu jam.
3.3.2 Analisa Kadar Formaldehid
Mencapurkan 1 cc sampel, 5 cc alcohol dan 3-5 tetep indicator corselin didalam labu titrasi, mengecek titik akhir over titration dan back-titration, bias dikatakan larutan netral. Menambahkan 25 cc larutan sodium sulfite kedalam larutan netral sehingga menjadi larutan campuran, kemudian mentitrasi larutan campuran dengan larutan H2SO4, lalu melakukan perhitungan.
3.3.3 Analisa pH
Mencelupkan kertas pH kedalam sampel. Warna kertas pH akan berubah sesuai dengan warna-warna berdasarkan ukuran pHnya.
3.3.4 Analisa Viskositas
Memasukkan sampel kedalam viscometer ostwold yang sudah dikalibrasi, kemudian melakukan pengukuran viscositas.
3.3.5 Analisa Densitas
Piknometer
Menghitung massa piknometer kosong
Memasukkan sampel kedalam piknometer
Menghitung massa piknometer kosong + sampel
Mencatat hasil
[image:4.595.64.216.168.478.2]Gambar 5. Diagram Alir Analisa Kadar Formaldehid
Memasukkan sampel kedalam piknometer yang sudah dikalibrasi, kemudian menghitung dari selisih berat piknometer kosong dengan piknometer berisi sampel.
3.4 Variabel Percobaan
Variabel percobaan polimerisasi urea-formaldehid, terdapat dua variabel, yaitu : variabel bebas dan variabel tetap. Variabel bebas terdiri dari jumlah katalis yang digunakan dan jumlah buffer yang digunakan, sedangkan variabel tetap terdiri dari massa urea, volume formalin, suhu operasi, konsentrasi H2SO4, volume sampel saat uji kadar
formaldehid bebas yaitu 1 ml, volume etanol, volume Na2SO4 dan volume indicator pp.
[image:5.595.325.576.73.246.2]4 Hasil dan Pembahasan
Gambar 7. Urea-formaldehid Hasil Percobaan
Gambar 8. Urea-formaldehid Pembanding
Terlihat pada gambar 7, hasil polimerisasi urea-formaldehid tidak terbentuk endapan seperti pada gambar 8. Hal ini menandakan bahwa pada gambar 7 hanya terbentuk rantai-rantai pendek urea-formaldehid, sedangkan pada gambar 8 produk hasil polimerisasinya sudah berbentuk rantai panjang urea formaldehid yang ditandai dengan adanya endapan berwana merah jambu ke putihan. Factor yang sangat mempengaruhi produk urea formaldehid yaitu kondisi pH, apabila pada saat bereaksi kondisinya asam, maka akan terbentuk senyawa Goldsmith, sehingga molekul polimer yang dihasilkan akan rendah dan memiliki rantai pendek.
Pada percobaan polimerisasi urea-formaldehid, terdapat beberapa variasi
perbandingan mol formalin dengan mol urea, yaitu : F/U = 1.5; F/U=1.75; dan F/U=2.
Gambar 9. Grafik Orde Reaksi 2 pada Variasi F/U
[image:5.595.99.228.414.487.2]Pada gambar 9, diperoleh grafik linierisasi dari tiga variasi. Variasi F/U dengan orde reaksi 2 memiliki hasil linierisasi mendekati 1. Hal ini dapat diketahui bahwa pada percobaan polimerisasi urea formaldehid ini memiliki orde reaksi 2, sebagai orde yang tepat untuk reaksi ini. Pada variasi F/U = 1.75 terlihat pada menit ke 60, konsentrasi Cf hampir mendekati 0.45(gr/100ml), sedangkan pada variasi F/U = 1.5 dan F/U = 2, konsentrasi Cf pada menit ke 60, kurang dari 0.4(gr/100ml). Hal ini menunjukkan bahwa F/U = 1.75 dengan orde reaksi 2 merupakan kondisi yang optimal.
Gambar 10. Grafik Pengaruh Densitas terhadap Waktu pada Variasi F/U
[image:5.595.325.576.458.607.2]
[image:6.595.41.291.200.347.2]
ini, menyebabkan berat molekul pada sampel semakin berat, dengan semakin beratnya suatu molekul, maka densitasnya juga akan mengalami kenaikan. Dari ke tiga variasi F/U diperoleh densitas tertinggi disetiap waktunya pada variasi F/U = 1.75. Hal ini terjadi karena F/U = 1.75 merupakan perbandingan yang optimal untuk reaksi pembentukan urea-formaldehid.
Gambar 11. Grafik Pengaruh Viskositas terhadap Waktu pada Variasi F/U
Dari analisa viskositas pada ke tiga variasi, diperoleh nilai viskositas tertinggi pada setiap perubahan waktu yaitu pada variasi F/U = 1.5. Hal ini sesuai dengan grafik densitas pada gambar 10. Densitas berbanding terbalik dengan viscositas, apabila densitas suatu zat tinggi, maka viscositas zat tersebut bernilai rendah.
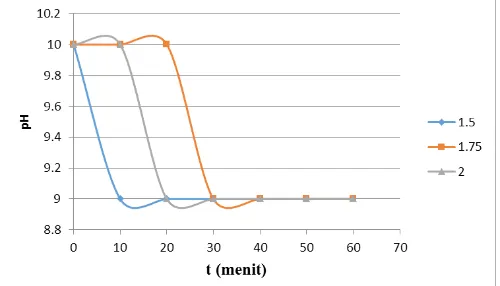
Gambar 12. Grafik Perubahan pH pada Setiap Waktu
Pada gambar 12 menujukkan perubahan pH pada setiap waktu dengan variasi F/U. Pada grafik ini diperoleh hasil pada F/U = 1.75, nilai pH pada menit ke 0 hinggan menit ke 20 pH konstan pada pH 10. Hal ini menandakan bahwa proses
polimerisasi urea formaldehid berlangsung optimal dibandingkan dengan variassi F/U lainnya. Polimerisasi urea-formaldehid akan optimal jika kondisi pada saat reaksi memiliki pH yang basa, akan tetapi seiring berjalannya waktu, proses polimerisasi urea-formaldehid berjalan kea rah asam, untuk mempertahankan keadaan basa, maka digunakan senyawa buffer untuk mempertahankan kondisi pH. Polimerisasi urea formaldehd berlangsung optimal pada pH dengan rentang 9-10.
5. Kesimpulan dan Saran 5.1 Kesimpulan
Berdasarkan percobaan polimerisasi kondensasi urea formaldehid dengan variasi F/U, sebagai berikut :
a. Dari ketiga variasi F/U, didapatkan F/U yang optimal untuk reaksi polimerisasi urea formaldehid adalah F/U = 1.75
b. Orde reaksi pada polimerisasi urea formaldehid yaitu orde 2.
c. Laju reaksi pada percobaan polimerisasi
urea formaldehid yaitu
−dCf
dt =0.0055. cf
2
5.2 Saran
Saran yang dapat diberikan pada percobaan polimerisasi urea formaldehid, yaitu :
a. Menggunakan indicator PP yang baru, agar hasil titrasi sesuai
b. Menggunakan pH meter pada saat pengukuran pH, agar dapat diketahui secara akurat.
Daftar Pustaka
[1] Stevens, M,P 2007. Kimia Polimer. Cetakan 2. Terjemahan L. Sopyan. Pradnya pranita. Jakarta : xxi + 669 hlm.
[2] Efan, Ahmad. Polimer. Jurusan Teknik Mesin, FT. UMJ. Jember.
[image:6.595.41.291.494.637.2]
[4] Othmer, K. 1984. Encyclopedia of Chemical Technology. 3rd Edition. Intersciens Publication.
John Willey and Sons. New York.
[5] Flory,PJ. 1984. Principle of Chemical Chemistry. Edition 7. Cornell, University Press. London.
[6] Billmeyer. 1984. Textbook of Polimer Sciens New York. John Willey and Sons.
[7] Suppriyadi. 1985. Polimerisasi Urea-formaldehid. ITB. Bandung
[8] De’Aldio, CF. 1952. Fundamental Principles of Polymerization. John Willey and Jons. New York Inc.
[9] Rochmadi. 2010. Technologi Polimer.