TINJAUAN PUSTAKA
Anestesi
Istilah anestesi dimunculkan pertama kali oleh dokter Oliver Wendell Holmes (1809-1894) berkebangsaan Amerika, diturunkan dari dua kata Yunani : An berarti tidak, dan Aesthesis berarti rasa atau sensasi nyeri. Secara harfiah berarti ketiadaan rasa atau sensasi nyeri. Dalam arti yang lebih luas, anestesi berarti suatu keadaan hilangnya rasa terhadap suatu rangsangan. Pemberian anestetikum dilakukan untuk mengurangi dan menghilangkan rasa nyeri baik disertai atau tanpa disertai hilangnya kesadaran. Seringkali anestesi dibutuhkan pada tindakan yang berkaitan dengan pembedahan. Anestetikum yang diberikan pada hewan akan membuat hewan tidak peka terhadap rasa nyeri sehingga hewan menjadi tenang, dengan demikian tindakan diagnostik, terapeutik, atau pembedahan dapat dilaksanakan lebih aman dan lancar (Tranquilli et al. 2007; Miller 2010).
Perjalanan waktu sepanjang sejarah menunjukkan bahwa anestesi pada hewan digunakan untuk menghilangkan rasa dan sensasi terhadap suatu rangsangan yang merugikan (nyeri), menginduksi relaksasi otot, dan terutama untuk membantu melakukan diagnosis atau proses pembedahan yang aman. Alasan lain penggunaan anestesi pada hewan adalah untuk melakukan pengendalian hewan (restraint), keperluan penelitian biomedis, pengamanan pemindahan (transportasi) hewan liar, pemotongan hewan yang humanis, dan untuk melakukan ruda paksa (euthanasia). Secara umum tujuan pemberian anestetikum pada hewan adalah mengurangi atau menghilangkan rasa nyeri dengan meminimalkan kerusakan organ tubuh dan membuat hewan tidak terlalu banyak bergerak. Semua tujuan anestesi dapat dicapai dengan pemberian obat anestetikum secara tunggal maupun dalam bentuk balanced
anesthesia, yaitu mengkombinasikan beberapa agen anestetikum maupun dengan
Preanestesi
Preanestesi adalah pemberian zat kimia sebelum tindakan anestesi umum dengan tujuan utama menenangkan pasien, menghasilkan induksi anestesi yang halus, mengurangi dosis anestetikum, mengurangi atau menghilangkan efek samping anestetikum, dan mengurangi nyeri selama operasi maupun pasca operasi (Debuf 1991; McKelvey dan Hollingshead 2003). Pemilihan preanestetikum dipertimbangkan sesuai dengan spesies, status fisik pasien, derajat pengendalian, jenis operasi, dan kesulitan dalam pemberian anestetikum (Booth dan Branson 1995).
Preanestetikum yang paling umum digunakan pada hewan adalah atropine, acepromazin, xylazine, diazepam, midazolam, dan opioid atau narkotik. Atropine digunakan untuk mengurangi salivasi, peristaltik dan mengurangi bradikardia akibat anestesi. Acepromazin digunakan sebagai penenang atau tranquilizer. Xylazine, medetomidin, diazepam, dan midazolam digunakan sebagai agen sedatif dan merelaksasi otot. Opioid atau narkotik digunakan untuk mengurangi rasa sakit, seperti disajikan pada Gambar 1.
Gambar 1. Klasifikasi agen preanestesi yang digunakan pada anestesi umum
(Sumber: Warren 1983; McKelvey dan Hollingshead 2003).
Klasifikasi Anestesi
Keadaan teranestesi dapat dihasilkan secara kimia dengan obat-obatan dan secara fisik melalui penekanan sensori pada syaraf. Obat-obatan anestetika umumnya diklasifikasikan berdasarkan rute penggunaannya, yaitu: 1). Topikal misalnya melalui
Tranquilizer : Promazin, Acepromazin, Chlorpromazin, Xylazine, Diazepam, Midazolam, Lorazepam, Madetomidin. Pelemas otot (Muscle paralyzer): Xylazine, Diazepam, Midazolam, Medetomidin, Lorazepam, Curare. Antikolinergik : Atropine, Scopolamine, Aminopentamid, Glikopirolat. Narkotik : Morpin, Apomorpin, Meperidin, Oksimorpin, Etorpin, Nalorpin. Agen Dissosiatif : Penciklidine, Ketamine, Tiletamine. Preanestesi
kutaneus atau membrana mukosa; 2). Injeksi seperti intravena, subkutan, intramuskular, dan intraperitoneal; 3). Gastrointestinal secara oral atau rektal; dan 4). Respirasi atau inhalasi melalui saluran nafas (Tranquilli et al. 2007).
Anestetetikum juga dapat diklasifikasikan berdasarkan daerah atau luasan pada tubuh yang dipengaruhinya, yaitu : 1). Anestesi lokal, terbatas pada tempat penggunaan dengan pemberian secara topikal, spray, salep atau tetes, dan infiltrasi. 2). Anestesi regional, mempengaruhi pada daerah atau regio tertentu dengan pemberian secara perineural, epidural, dan intratekal atau subaraknoid. 3). Anestesi umum, mempengaruhi seluruh sistem tubuh secara umum dengan pemberian secara injeksi, inhalasi, atau gabungan (balanced anaesthesia) (Adams 2001; McKelvey dan Hollingshead 2003).
Anestesi Lokal
Anestetikum lokal adalah suatu bahan kimia yang mampu menghambat konduksi syaraf perifer tanpa menimbulkan kerusakan permanen pada syaraf tersebut. Mekanisme kerja anestetikum lokal dengan cara menghambat (blok) saluran ion sodium (Na) pada syaraf perifer, konduksi atau aksi potensial pada syaraf terhambat sehingga respon nyeri secara lokal hilang. Anestetikum lokal mencegah proses depolarisasi membran syaraf secara lokal melalui penghambatan saluran ion Na, sehingga membran akson tidak dapat bereaksi dengan neurotransmitter acetilkolin dan membran akan tetap dalam keadaan semipermiabel serta tidak terjadi perubahan potensial. Keadaan tersebut menyebabkan aliran inpuls yang melewati syaraf berhenti, sehingga semua rangsangan tidak sampai ke SSP. Sifat hambatan syaraf umumnya bersifat lokal, selektif, dan tergantung pada dosis atau jumlah obat yang diberikan (Tranquilli et al. 2007; Miller 2010).
Sifat sifat yang harus dimiliki oleh obat anestetikum lokal adalah poten, artinya efektif dalam dosis rendah, daya penetrasinya baik, mula kerjanya cepat, masa kerjanya lama, toksisitas sistemik rendah, tidak mengiritasi jaringan, pengaruhnya reversibel, dan mudah dikeluarkan dari tubuh (Adams 2001; Tranquilli et al. 2007).
Penggunaan anestetikum lokal bisa dilakukan dengan meneteskan pada permukaan daerah yang akan dianestesi (surface aflication), dengan melakukan injeksi secara sub-kutan pada daerah yang akan dianestesi (subdermal, intradermal), serta dengan melakukan pemblokiran pada daerah tertentu (field block anestesi). Anestetikum yang sering digunakan sebagai anestetikum lokal adalah procaine HCI 2% - 4%, Lidocaine 0,5 - 2%, Lidocaine 4%, Tetracaine, bupivacaine 0,25% atau 0,5%, Dibucain, Pehacaine, Lidonest, dan Chlor buthanol dengan dosis pemberian secukupnya (Quantum statis, QS). Lidocaine dan bupivacaine dapat diencerkan dengan larutan salin (bukan air) untuk menurunkan konsentrasinya. Bupivacaine mempunyai onset lebih lambat (20 menit) dan durasi lebih panjang (6 jam) dibandingkan lidocaine (onset lebih cepat dan durasi 1-2 jam) (Adams 2001; Sudisma 2006; Tranquilli et al. 2007).
Anestesi Regional
Anestesi regional adalah tindakan menghilangnya nyeri yang dilakukan dengan cara menyuntikkan anestetikum lokal pada lokasi syaraf yang menginervasi regio atau daerah tertentu sehingga menyebabkan hambatan konduksi inpuls yang reversibel. Anestetikum regional dapat menghilangkan rasa nyeri pada suatu daerah atau regio tertentu secera reversibel tanpa disertai hilangnya kesadaran. Mekanisme kerja dan jenis anestetikum yang digunakan sama dengan anestetikum lokal, tetapi daerah atau luasan pada tubuh yang dipengaruhi adalah daerah atau regio tertentu. Anestesi regional dibedakan berdasarkan rute pemberiannya, yaitu secara epidural, spinal atau intrathekal atau subaraknoid, dan blok pleksus brakhialis (Adams 2001; McKelvey dan Hollingshead 2003).
Anestesi epidural dihasilkan dengan cara menginjeksikan anestetikum lokal diantara duramater dan periosteum dari canalis spinalis (epidural space). Anestetikum tidak langsung mengenai medula spinalis, sehingga efek anestesi terjadi setelah 15-20 menit pemberian. Anestesi epidural menghambat sensasi dan kontrol motorik daerah abdominal, pelvis, ekor, dan kaki belakang. Anestesi ini biasanya digunakan untuk laparotomi, amputasi ekor, urethrostomi, pembedahan cesar,
pembedahan daerah pelvis, dan amputasi daeran kaki belakang. Pada hewan kecil dilakukan antara tulang lumbar terakhir dan tulang sakral 1. Sedangkan pada hewan besar dilakukan antara tulang coccigia 1 dan 2. Anestetikum yang digunakan sama dengan anestetikum lokal, seperti lidocaine 2%, bupivacain 0,5%, ropivacain 0,75% atau mepivacaine 2% dengan dosis pemberian 1ml/5kg BB. Lidocain menghasilkan durasi sekitar 1-2 jam dan bupivacain sekitar 6 jam (McKelvey dan Hollingshead 2003).
Spinal atau intrathekal atau subaraknoid anestesi sama dengan anestesi epidural tetapi dilakukan melalui duramater dan subaraknoid dimana jarum menembus duramater dan subaraknoid sehingga anestetikum masuk ke dalam dan langsung mengenai syaraf spinal, menghasilkan anestesi yang segera dan lebih cepat. Anestesi ini mengakibatkan resiko berontak dan rasa sakit yang memerlukan kesembuhan lebih lama. Anestetikum yang digunakan sama dengan anestetikum lokal. Sedangkan blok pleksus brakhialis adalah anestesi regional dengan cara menyuntikkan anestetikum lokal di daerah perjalanan fleksus brakhialis yang menginervasi daerah kaki depan (Adams 2001; McKelvey dan Hollingshead 2003; Sudisma 2006; Tranquilli et al. 2007).
Anestesi Umum
Anestesi umum adalah keadaan hilangnya nyeri di seluruh tubuh dan hilangnya kesadaran yang bersifat sementara yang dihasilkan melalui penekanan sistem syaraf pusat karena adanya induksi secara farmakologi atau penekanan sensori pada syaraf. Agen anestesi umum bekerja dengan cara menekan sistem syaraf pusat (SSP) secara reversibel (Adams 2001). Anestesi umum merupakan kondisi yang dikendalikan dengan ketidaksadaran reversibel dan diperoleh melalui penggunaan obat-obatan secara injeksi dan atau inhalasi yang ditandai dengan hilangnya respon rasa nyeri (analgesia), hilangnya ingatan (amnesia), hilangnya respon terhadap rangsangan atau refleks dan hilangnya gerak spontan (immobility), serta hilangnya kesadaran (unconsciousness) (McKelvey dan Hollingshead 2003).
Mekanisme kerja anestesi umum pada tingkat seluler belum diketahui secara pasti, tetapi dapat dihipotetiskan mempengaruhi sistem otak karena hilangnya kesadaran, mempengaruhi batang otak karena hilangnya kemampuan bergerak, dan mempengaruhi kortek serebral karena terjadi perubahan listrik pada otak. Anestesi umum akan melewati beberapa tahapan dan tahapan tersebut tergantung pada dosis yang digunakan. Tahapan teranestesi umum secara ideal dimulai dari keadaan terjaga atau sadar kemudian terjadi kelemahan dan mengantuk (sedasi), hilangnya respon nyeri (analgesia), tidak bergerak dan relaksasi (immobility), tidak sadar (unconsciousness), koma, dan kematian atau dosis berlebih (Tranquilli et al. 2007; Miller 2010).
Anestesi umum yang baik dan ideal harus memenuhi kriteria : tiga komponen anestesi atau trias anestesi (sedasi, analgesi, dan relaksasi), penekanan refleks, ketidaksadaran, aman untuk sistem vital (sirkulasi dan respirasi), mudah diaplikasikan dan ekonomis. Dengan demikian, tujuan utama dilakukan anestesi umum adalah upaya untuk menciptakan kondisi sedasi, analgesi, relaksasi, dan penekanan refleks yang optimal dan adekuat untuk dilakukan tindakan dan prosedur diagnostik atau pembedahan tanpa menimbulkan gangguan hemodinamik, respiratorik, dan metabolik yang dapat mengancam (Wolfensohn dan Lloyd 2000; Adams 2001; Tranquilli et al. 2007; Miller 2010).
Agen anestesi umum dapat digunakan melalui injeksi, inhalasi, atau melalui gabungan secara injeksi dan inhalasi. Anestetikum dapat digabungkan atau dikombinasikan antara beberapa anestetikum atau dengan zat lain sebagai preanestetikum dalam sebuah teknik yang disebut balanced anesthesia untuk mendapatkan efek anestesi yang diinginkan dengan efek samping minimal. Anestetika umum inhalasi yang sering digunakan pada hewan adalah halotan, isofluran, sevofluran, desfluran, dietil eter, nitrous oksida dan xenon. Anestetika umum yang diberikan secara injeksi meliputi barbiturat (tiopental, metoheksital, dan pentobarbital), cyclohexamin (ketamine, tiletamin), etomidat, dan propofol (McKelvey dan Hollingshead 2003; Garcia et al. 2010).
Anestesi umum inhalasi merupakan salah satu metode anestesi umum yang dilakukan dengan cara memberikan agen anestesi yang berupa gas dan atau cairan yang mudah menguap melalui alat anestesi langsung ke udara inspirasi. Mekanisme kerja anestesi umum inhalasi sangat rumit dan sampai saat ini masih merupakan misteri, karena pemberian anestetikum inhalasi melalui pernapasan menuju organ sasaran yang jauh adalah suatu hal yang unik. Hiperventilasi akan menaikkan ambilan anestetikum dalam alveolus dan hipoventilasi akan menurunkan ambilan alveolus. Kelarutan zat inhalasi dalam darah adalah faktor utama yang penting dalam menentukan induksi dan pemulihan anestesi inhalasi. Induksi dan pemulihan akan berlangsung cepat pada zat yang tidak larut dan lambat pada zat yang larut. Kadar alveolus minimal atau minimum alveolar cencentration (MAC) adalah kadar minimal zat anestesi dalam alveolus pada tekanan satu atmosfir yang diperlukan untuk mencegah gerakan pada 50% pasien yang dilakukan rangsangan insisi standar. Immobilisasi tercapai pada 95% pasien apabila kadar anestetikum dinaikkan di atas 30% nilai MAC. Dalam keadaan seimbang, tekanan parsial anestetikum dalam alveoli sama dengan tekanan zat dalam darah dan otak tempat kerja anestetikum (Latief et al. 2007; McKelvey dan Hollingshead 2003).
Anestetika umum inhalasi yang pertama kali dikenal dan digunakan untuk membantu pembedahan adalah N2O. Kemudian menyusul, eter, kloroform, etil
klorida, halotan, metoksifluran, enfluran, isofluran, desfluran, sevofluran, dan xenon. Anestetika umum inhalasi yang umum digunakan saat ini adalah N2
Nitrous oxide (N
O, halotan, enfluran, isofluran, desfluran, sevofluran, dan xenon. Obat obat anestesi yang lain ditinggalkan, karena efek sampingnya yang tidak dikehendaki. Misalnya, eter mudah terbakar dan meledak, menyebabkan sekresi bronkus berlebihan, mual dan muntah, kerusakan hati, dan baunya yang sangat merangsang. Kloroform menyebabkan aritmia dan kerusakan hati. Metoksifluran menyebabkan kerusakan hati, toksik terhadap ginjal, dan mudah terbakar (Latief et al. 2007; McKelvey dan Hollingshead 2003; Tranquilli et al. 2007).
2O) atau dinitrogen monoksida adalah anestesi inhalasi yang
ini bersifat anestetikum lemah, tetapi analgesianya kuat, sehingga jarang digunakan secara tunggal. Anestetikum yang sering dikombinasikan dengan N2O adalah
halotan. Pada akhir anestesi setelah N2O dihentikan, akan cepat keluar mengisi
alveoli, sehingga terjadi pengenceran oksigen dan terjadi hipoksia difusi. Mengatasi hipoksia difusi, biasanya diberikan 100% oksigen selama 5 – 10 menit. Potensi N2O
digunakan pada hewan tidak baik, karena mempunyai MAC yang tinggi. MAC N2
Halotan sering digunakan sebagai induksi anestesi dikombinasikan dengan N
O pada manusia mendekati 100%, tetapi pada anjing hampir 200% dan kucing mendekati 250% (Latief et al. 2007; McKelvey dan Hollingshead 2003).
2
Desfluran adalah halogenasi eter yang rumus bangun dan efek klinisnya mirip dengan isofluran. Desfluran sangat mudah menguap dibandingkan anestetikum lainnya, sehingga perlu menggunakan vaporizer khusus. Potensi desfluran sangat rendah (MAC 6,0%), bersifat simpatomimetik, menyebabkan takikardia dan
O, karena halotan adalah analgesik lemah tetapi sifat anestesinya kuat sehingga kombinasi keduanya sangat ideal. Pemeliharaan anestesi dengan halotan biasanya digunakan dosis 1-2% pada napas spontan atau dosis 0,5-1% pada napas terkendali, dan dapat disesuaikan dengan respon klinis pasien. Nilai MAC halotan adalah moderat, potensinya berada diantara metoksifluran dan isofluran, yaitu 0,3 – 0,75%. Halotan mempunyai tekanan uap yang tinggi, sehingga memerlukan ketelitian penggunaan vaporizer yang lebih tinggi. Penggunaan vaporizer yang memiliki tingkat ketelitian kurang, dapat menyebabkan konsentrasi halotan mencapai 30%, padahal konsentrasi normal halotan yang diperlukan untuk anestesi adalah 1-2%, sehingga penggunaan halotan memerlukan vaporizer khusus. Halotan menyebabkan vasodilatasi cerebral, meningkatkan aliran darah pada otak yang sulit dikendalikan. Kelebihan dosis halotan menyebabkan depresi napas, menurunkan tonus simpatik, terjadi hipotensi, bradikardi, vasodilatasi perifer, depresi vasomotor, dan depresi miokardium. Halotan dimetabolisme 20% di hati secara oksidatif menjadi komponen bromin, klorin, dan asam trikloro asetat. Halotan menyebabkan gangguan hati dan pasca pemberian sering menyebabkan pasien meninggal (Latief et al. 2007; McKelvey dan Hollingshead 2003).
hipertensi. Pengaruh depresi nafasnya sama dengan isofluran dan merangsang jalan napas atas sehingga tidak dapat digunakan sebagai induksi anestesi.
Isofluran merupakan halogenasi eter dan secara kimia sangat mirip dengan metoksifluran dan sevofluran. Rentang keamanan isofluran lebih lebar dibandingkan halotan dan metoksifluran, sehingga sangat umum digunakan pada hewan terutama anjing dan kuda walaupun dengan harga yang lebih mahal. Penggunaaan isofluran pada dosis anestesi atau subanestesi menurunkan metabolisme otak terhadap oksigen, tetapi akan meningkatkan aliran darah di otak dan tekanan intrakranial, sehingga menjadi pilihan pada pembedahan otak. Pengaruh terhadap jantung dan curah jantung (cardiac output) sangat minimal, sehingga dapat digunakan pada pasien dengan kelainan jantung. Potensi isofluran lebih kecil dibandingkan halotan karena mempunyai nilai MAC lebih tinggi dibandingkan halotan. Pemeliharaan anestesi dengan isofluran biasanya digunakan konsentrasi 1,5 – 2,5 % isofluran dalam oksigen (Latief et al. 2007; McKelvey dan Hollingshead 2003).
Anestesi umum injeksi merupakan metode anestesi umum yang dilakukan dengan cara menyuntikkan agen anestesi langsung melalui muskulus atau pembuluh darah vena. Anestesi injeksi biasanya digunakan untuk induksi pada hewan kecil maupun pada hewan besar dan dapat juga digunakan untuk pemeliharaan anestesi. Anestetika injeksi yang baik memiliki sifat-sifat tidak mengiritasi jaringan, tidak menimbulkan rasa nyeri pada saat diinjeksikan, cepat diabsorsi, waktu induksi, durasi, dan masa pulih dari anestesi berjalan mulus, tidak ada tremor otot, memiliki indeks terapeutik tinggi, tidak bersifat toksik, mempunyai pengaruh minimal terhadap organ tubuh terutama saluran pernapasan dan kardiovaskular, cepat dimetabolisme, tidak bersifat akumulatif, dapat dikombinasikan dengan obat lain seperti relaksan otot, analgesik, dan sudah diketahui antidotanya. Beberapa anestetika injeksi yang sering digunakan pada hewan adalah golongan barbiturat seperti thiopental sodium, methoheksital, dan pentobarbital. Golongan lainnya yang juga sering digunakan pada hewan adalah golongan cycloheksamin (ketamine dan tiletamin), etomidat, dan propofol. (Brander et all. 1991; McKelvey dan Hollingshead 2003).
Semua golongan barbiturat untuk keperluan anestesi berada dalam bentuk garam sodium dan dilarutkan dalam air menjadi larutan 2,5 atau 5%. Tiga klas golongan barbiturat yang digunakan pada hewan adalah ultrashort-acting
barbiturates (metoheksital), short-acting barbiturates (tiopental), dan
intermediate-acting barbiturates (pentobarbital). Sedangkan long-acting barbiturates
(penobarbital) biasanya digunakan untuk sedatip dan antikonvulsi, bukan untuk anestesi. Barbiturat menimbulkan sedasi, hipnosis, dan depresi pernafasan tergantung dosis dan kecepatan pemberian serta pengaruh analgesia yang ditimbulkan sedikit. Efek utama golongan barbiturat adalah depresi pusat pernafasan, depresi pusat vasomotor, dan miokardium sehingga menurunkan curah jantung dan tekanan darah.
Etomidat berbentuk kristal putih, dapat larut dalam air, etanol, dan propilin glikol. Etomidat adalah sedatif hipnotik imidazol yang biasanya digunakan sebagai induksi anestesi pada anjing dan kucing. Kombinasi anestetikum dengan etomidat menghasilkan relaksasi otot yang baik tetapi tidak menghasilkan analgesia dan durasinya sangat singkat seperti propofol, karena metabolisme etomidat sangat cepat. Etomidat mempunyai pengaruh yang minimal terhadap fungsi kardiovaskuler seperti denyut jantung, curah jantung, dan tekanan darah. Etomidat dapat diberikan secara infusi dengan kecepatan dosis 50 -150 µ/kg/menit.
Ketamine adalah anestetikum umum injeksi golongan nonbarbiturat, termasuk golongan phenilsycloheksamin. Ketamine mempunyai efek analgesia yang sangat kuat akan tetapi efek sedasi dan hipnotiknya kurang (tidur ringan). Ketamine meningkatkan tekanan darah sistol maupun diastol kira kira 20- 25%, karena adanya aktivitas syaraf simpatik meningkat dan depresi baroreseptor. Pemberian anestetikum ketamine secara tunggal dosis 10-15 mg/kg berat badan secara intra muskular pada anjing menimbulkan kekejangan otot dan hipersalivasi serta durasi kerja anestesi yang sangat pendek. Mengatasi kerugian penggunaan anestetikum ketamine secara tunggal, ketamine sering dikombinasikan dengan obat lain sebagai preanestesi.
Propofol adalah anestesi umum injeksi turunan alkil penol (2,6-diisopropylphenol), mempunyai pH netral, dan dapat diberikan dalam bentuk emulsi minyak dalam air. Walaupun propofol memperlihatkan warna putih seperti susu,
sangat aman diberikan secara intravena dan dapat diberikan secara berulang-ulang atau sebagai alternatif dapat diberikan secara infusi terus-menerus. Propofol mempunyai efek analgesia yang sangat ringan akan tetapi efek sedasi dan hipnotiknya sangat kuat. Efek samping penggunaaan propofol adalah hipotensi, apnea, dan rasa sakit pada tempat suntikan. Efek samping utama yang sangat dihindari dari propofol adalah penekanan sistem respirasi. Efek samping tersebut sangat berkaitan dengan dosis dan kecepatan penyuntikannya, keuntungan penggunaan propofol akan diperoleh dengan cara mengkombinasikan dengan agen anestetikum lain untuk menurunkan dosis dan meminimalkan pengaruh buruk yang ditimbulkan (Stawicki 2007).
Tahapan Anestesi Umum
Tahapan anestesi sangat penting untuk diketahui terutama dalam menentukan tahapan terbaik untuk melakukan pembedahan, memelihara tahapan tersebut sampai batas waktu tertentu, dan mencegah terjadinya kelebihan dosis anestetikum. Tahapan anestesi dapat dibagi dalam beberapa langkah, yaitu: preanestesi, induksi, pemeliharaan, dan pemulihan (McKelvey dan Hollingshead 2003).
Tahap preanestesi merupakan tahapan yang dilakukan segera sebelum dilakukan anestesi, dimana data tentang pasien dikumpulkan, pasien dipuasakan, serta dilakukan pemberian preanestetikum. Induksi adalah proses dimana hewan akan melewati tahap sadar yang normal atau conscious menuju tahap tidak sadar atau
unconscious. Agen induksi dapat diberikan secara injeksi atau inhalasi. Apabila agen
induksi diberikan secara injeksi maka akan diikuti dengan intubasi endotracheal tube untuk pemberian anestetikum inhalasi atau gas menggunakan mesin anestesi. Waktu minimum periode induksi biasanya 10 menit apabila diberikan secara intramuskular (IM) dan sekitar 20 menit apabila diberikan secara subkutan (SC). Tahap induksi ditandai dengan gerakan tidak terkoordinasi, gelisah dan diikuti dengan relaksasi yang cepat serta kehilangan kesadaran. Idealnya, keadaan gelisah dan tidak tenang dihindarkan pada tahap induksi, karena menyebabkan terjadinya aritmia jantung.
Preanestesi dan induksi anestesi dapat diberikan secara bersamaan, seperti pemberian acepromazin, atropine, dan ketamine dicampur dalam satu alat suntik dan diberikan secara intravena (IV) pada anjing. (Adams 2001; McKelvey dan Hollingshead 2003; Tranquilli et al. 2007).
Selanjutnya hewan akan memasuki tahap pemeliharaan status teranestesi. Pada tahap pemeliharaan ini, status teranestesi akan terjaga selama masa tertentu dan pada tahap inilah pembedahan atau prosedur medis dapat dilakukan. Tahap pemeliharaan dapat dilihat dari tanda-tanda hilangnya rasa sakit atau analgesia, relaksasi otot rangka, berhenti bergerak, dilanjutkan dengan hilangnya refleks palpebral, spingter ani longgar, serta respirasi dan kardiovaskuler tertekan secara ringan. Begitu mulai memasuki tahap pemeliharaan, respirasi kembali teratur dan gerakan tanpa sengaja anggota tubuh berhenti. Bola mata akan bergerak menuju ventral, pupil mengalami konstriksi, dan respon pupil sangat ringan. Refleks menelan sangat tertekan sehingga endotracheal tube sangat mudah dimasukkan, refleks palpebral mulai hilang, dan kesadaran mulai hilang. Anestesi semakin dalam sehingga sangat nyata menekan sirkulasi dan respirasi. Pada anjing dan kucing, kecepatan respirasi kurang dari 12 kali per menit dan respirasi semakin dangkal. Denyut jantung sangan rendah dan pulsus sangat menurun karena terjadi penurunan seluruh tekanan darah. Nilai CRT akan meningkat menjadi 2 atau 3 detik. Semua refleks tertekan secara total dan terjadi relaksasi otot secara sempurna serta refleks rahang bawah sangat kendor. Apabila anestesi dilanjutkan lebih dalam, pasien akan menunjukkan respirasi dan kardiovaskuler lebih tertekan dan pada keadaan dosis anestetikum berlebih akan menyebabkan respirasi dan jantung berhenti. Dengan demikian, pada tahap pemeliharaan sangat diperlukan pemantauan dan pengawasan status teranestesi terhadap sistim kardiovaskuler dan respirasi (McKelvey dan Hollingshead 2003; Tranquilli et al. 2007 ).
Ketika tahap pemeliharaan berakhir, hewan memasuki tahap pemulihan yang menunjukkan konsentrasi anestetikum di dalam otak mulai menurun. Metode atau mekanisme bagaimana anestetikum dikeluarkan dari otak dan sistem sirkulasi adalah bervariasi tergantung pada anestetikum yang digunakan. Sebagian besar anestetikum
injeksi dikeluarkan dari darah melalui hati dan dimetabolisme oleh enzim di hati dan metabolitnya dikeluarkan melalui sistem urinari. Pada hewan kucing, ketamine tidak mengalami metabolisme dan dikeluarkan langsung tanpa perubahan melalui ginjal. Kadar anestetikum golongan tiobarbiturat di dalam otak dapat dengan cepat menurun karena dengan cepat disebarkan ke jaringan terutama otot dan lemak, sehingga hewan akan sadar dan terbangun dengan cepat mendahului ekskresi anestetikum dari dalam tubuh hewan. Anestetikum golongan inhalasi akan dikeluarkan dari tubuh pasien melalui sistem respirasi, molekul anestetikum akan keluar dari otak memasuki peredaran darah, alveoli paru-paru, dan akhirnya dikeluarkan melalui nafas. Tanda tanda adanya aktivitas refleks, ketegangan otot, sensitivitas terhadap nyeri pada periode pemulihan dinyatakan sebagai kesadaran kembali (McKelvey dan Hollingshead 2003).
Durasi atau lama waktu kerja anestetikum dan kualitas anestesi dapat dilihat dari pengamatan perubahan fisiologis selama stadium teranestesi. Dikenal dua waktu induksi pada durasi anestesi. Waktu induksi 1 adalah waktu antara anestetikum diinjeksikan sampai keadaan hewan tidak dapat berdiri. Waktu induksi 2 adalah waktu antara anestetikum diinjeksikan sampai keadaan hewan tidak ada refleks pedal atau hewan sudah tidak merasakan sakit (stadium operasi). Durasi adalah waktu ketika hewan memasuki stadium operasi sampai hewan sadar kembali dan merasakan sakit jika daerah disekitar bantalan jari ditekan. Waktu siuman atau recovery adalah waktu antara ketika hewan memiliki kemampuan merasakan nyeri bila syaraf disekitar jari kaki ditekan atau mengeluarkan suara sampai hewan memiliki kemampuan untuk duduk sternal, berdiri atau jalan (Moens dan Fargetton 1990; Verstegen dan Petcho 1993; McKelvey dan Hollingshead 2003).
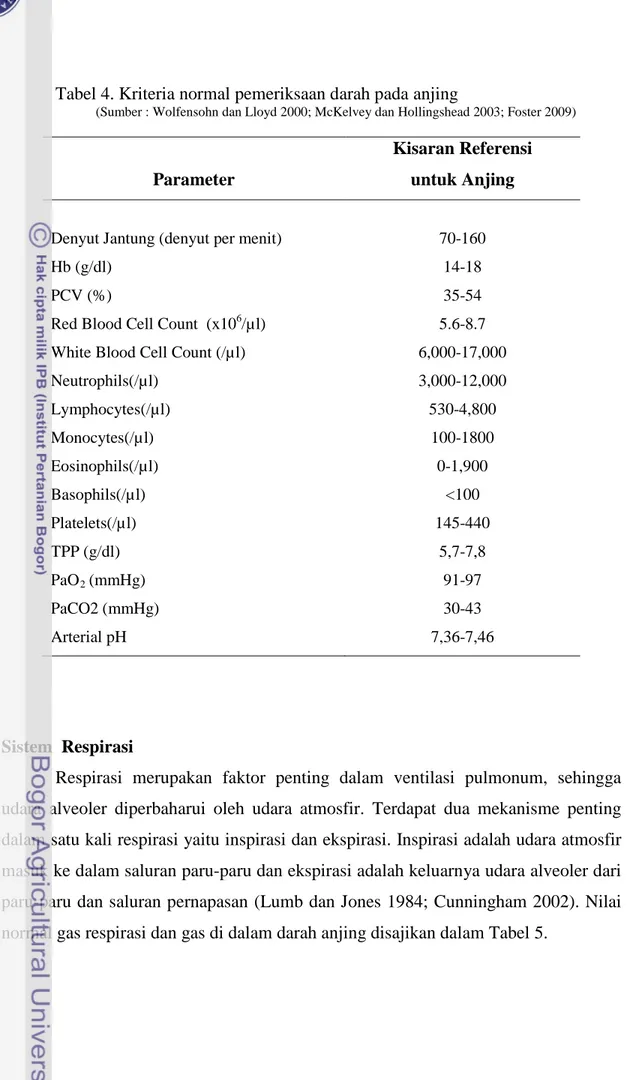
McKelvey dan Hollingshead (2003) dan Tranquilli et al. (2007) menyatakan bahwa untuk memonitor anestesi dilakukan pengamatan tahap-tahap anestesi umum. Kualitas status teranestesi dapat dilihat dari perubahan fisiologis sebagai tanda kedalaman anestesi, seperti disajikan pada Tabel 1.
Tabel 1 Tahapan dan indikasi status teranestesi oleh anestetikum umum Fase/Tahapan Indikator I II III Plane 1 III Plane 2 III Plane 3 III Plane 4 IV Tingkah laku Tidak terkontrol Eksitasi: kuat, bersuara, anggora gerak, mengunyah ternganga.
Teranestesi Teranestesi Teranestesi Teranestesi Hampir mati Respirasi Normal, cepat 20-30x/mnt Tidak teratur, tertahan atau hiper-ventilasi Teratur: 12-20x/mnt Teratur, dangkal: 12-16x/mnt Dangkal: <12x/mnt Putus-putus (ada berhenti) Apnea (berhenti) Fungsi Kardio-vaskuler Tetap denyut jantung meningkat Pulse kuat, denyut jantung >90x/mnt denyut jantung >90x/mnt Denyut jantung 60-90/mnt, CRT meningkat, Pulse lemah Denyut jantung <60x/mnt, CRT lama, membran pucat. Kollap Respon bedah/ insisi
Kuat Kuat Ada respon dengan gerakan Denyut jantung dan respirasi meningkat
Tidak ada Tidak ada Tidak ada
Kedalaman anestesi Tidak teranestesi Tidak teranestesi
Dangkal Sedang Dalam Over dosis Mati
Posisi Bola mata Tengah Tengah, tidak tetap Tengah, rotasi, tidak tetap Sering rotasi di ventral Ditengah, rotasi di ventral Tengah Tengah Ukuran Pupil Normal Mungkin berdilatasi Normal Dilatasi ringan Dilatasi sedang Dilatasi lebar Dilatasi lebar Respon Pupil (+) (+) (+) Lambat Sangat lambat, (-). (-) (-) Kejangan Otot
Baik Baik Baik Relaksasi Sangat
menurun
Lembek Lembek
Refleks Ada Ada,
mungkin berlebih Ringan, hilang Ada (patella, telinga, palpebral, kornea), yang lain hilang Semua minimal, hilang
Tidak ada Tidak ada
Stadiun 1 atau stadium analgesi adalah stadium awal anestesi yang terjadi segera setelah dilakukan anestesi secara inhalasi atau injeksi. Hewan pada stadium ini masih sadar tetapi kehilangan orientasi dan menurunnya sensitifitas terhadap rasa
nyeri. Respirasi dan denyut jantung masih normal atau meningkat, dan semua refleks masih ada; Stadium 2 atau stadium delirium atau eksitasi adalah stadium yang dimulai dari hilangnya kesadaran. Semua refleks masih ada dan bisa muncul berlebihan. Hewan masih dapat mengunyah, menelan, dan mulut umumnya menganga. Kondisi pupil yang dilatasi tetapi akan berkontriksi apabila ada rangsangan sinar. Stadium ini berjalan cepat dan bahkan akan terlewati apabila diberikan preanestesi yang baik. Stadium 2 akan berakhir apabila hewan menunjukkan tanda relaksasi otot, respirasi menurun, dan terjadi penurunan refleks; Stadium 3 atau stadium pembedahan adalah stadium melakukan tindakan bedah dan dibagi menjadi empat plane, yaitu plane 1 atau anestesi ringan, plane 2 atau anestesi pembedahan, plane 3 atau anestesi dalam, dan plane 4 atau paralisa; dan Stadium 4 atau stadium terminal (stadium kelebihan dosis).
Sejarah dan Mekanisme Kerja Anestesi Umum
Anestetikum pertama kali ditemukan adalah eter oleh William Thomas Green Morton pada tahun 1846. Morton memperagakan penggunaan dietil eter untuk menghilangkan kesadaran dan rasa nyeri pada pasien yang sedang ditangani untuk pembedahan tumor rahang di Massachusetts General Hospital Boston pada tanggal 16 Oktober 1846 dan berhasil tanpa memperlihatkan gejala kesakitan. Dengan ditemukannya eter sebagai anestetikum tahun 1846, pembedahan dapat dilakukan tanpa siksaan dan bebas rasa nyeri sehingga mendorong berkembangnya ilmu bedah dengan pesat. Kemudian muncul teori mekanisme kerja anestesi oleh Vonbibra dan Harles tahun 1847 yang menjelaskan bahwa anestetikum bekerja karena larut pada lipid di otak. Dikemudian hari dipertanyakan kembali oleh karena tidak semua bahan yang larut pada lemak dapat digunakan sebagai anestetikum. Selanjutnya oleh Hans Meyer pada tahun 1899 dan Charles Overton tahun 1901 memperkenalkan teori “Meyer-Overton”. Teori ini menyatakan bahwa potensi anestesi berhubungan dengan kelarutan bahan anestetikum pada lemak. Anestetikum akan larut pada lipid dan merusak struktur lipid membran syaraf . Dengan demikian, makin mudah suatu bahan anestetikum larut dalam lemak, makin kuat daya anestesinya. Namun hal ini hanya
berlaku untuk anestetikum inhalasi cair atau volatil sedangkan pada anestetikum parenteral seperti pentotal pernyataan di atas tidak berlaku. Hipotesis Vonbibra dan Harles tahun 1847 dan Meyer-Overton tahun 1901 dimentahkan dengan munculnya hipotesis protein membran yang mempengaruhi ion, bahwa membran sel syaraf mengandung protein dan anestetikum akan terikat pada protein, selanjutnya akan mempengaruhi saluran ion. (Mashour 2006; Pretto 2002; Miller 2010).
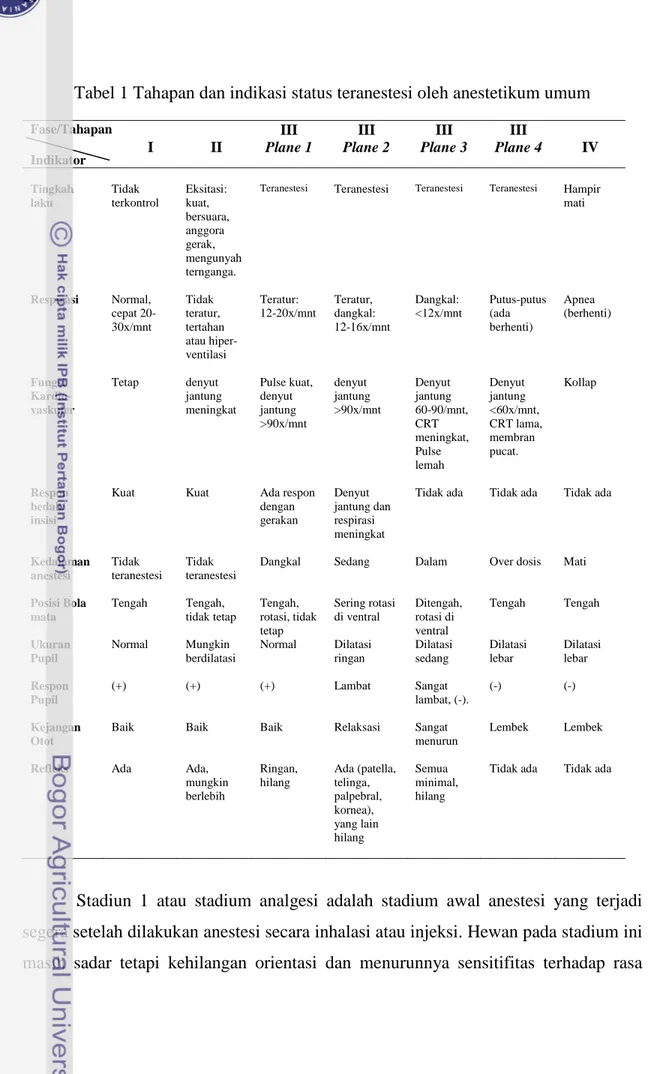
Dalam perkembangan selanjutnya, pemahaman teori saluran ion yang dipengaruhi oleh neurostransmiter dan reseptor kini diterima sebagai teori mekanisme kerja anestesi umum. Anestetikum akan bekerja mempengaruhi dua jenis reseptor yaitu : 1. Reseptor γ amino butiric acid (GABA) terutama reseptor GABAA
Gamma-amino butiric acid merupakan neurotransmiter inhibitori utama di
otak, disintesis dari glutamat dengan bantuan enzim glutamic acid decarboxylase (GAD), didegradasi oleh GABA-transaminase. Sekali dilepaskan, GABA berdifusi menyeberangi celah sinap untuk berinteraksi dengan reseptornya sehingga menimbulkan aksi penghambatan fungsi SSP. Neurotransmiter GABA lepas dari ujung syaraf gabanergik, berikatan dengan reseptornya, membuka saluran ion Cl, ion Cl masuk ke dalam sel, terjadi hiperpolarisasi sel syaraf , terjadi efek penghambatan transmisi syaraf , dan depresi SSP. Reseptor GABA sebagi tempat terikatnya GABA terdiri dari dua jenis, yaitu ionotropik (GABA
yang merupakan reseptor inhibitori, dan 2. Reseptor Glutamat yang merupakan reseptor eksitatori kususnya pada sub tipe N-methyl D-aspartat (NMDA) (Rudolph dan Antkowiak 2004; Cameron 2006; Garcia et al. 2010 ) .
A) dan metabotropik
(GABAB). Reseptor GABAA terletak di postsinaptik dan cukup penting karena
merupakan tempat aksi obat-obat benzodiazepin dan golongan barbiturat. Reseptor GABAA terdiri dari lima subtipe (pentamer) 2α, 2ß, dan 1γ, masing masing subtipe
mempunyai N-terminal binding site, terdiri dari 450 asam amino, dan mempunyai 4-transmembran (TM) saluran ion. Sampai saat ini telah diketahui ada 19 reseptor subunit GABAA, yaitu lebih dari 85% konsentrasinya dalam bentuk kombinasi
α1ß2γ2, α2ß3γ2, dan α3ß1 -3γ2. Reseptor GABAA adalah reseptor komfleks yang
dan neurosteroid (Gambar 2) (Rudolph dan Antkowiak 2004; Cameron 2006; Garcia
et al. 2010; Miller 2010) .
Gambar 2. Reseptor GABAA terdiri dari lima subtipe (pentamer) 2α, 2ß, dan 1γ, m asing
masing subtipe mempunyai N-terminal binding site, terdiri dari 450 asam amino, 4-transmembran (TM) sebagai saluran ion dan tempat terikatnya anestetika (Sumber: Cameron J Weir 2006; Miller 2010) .
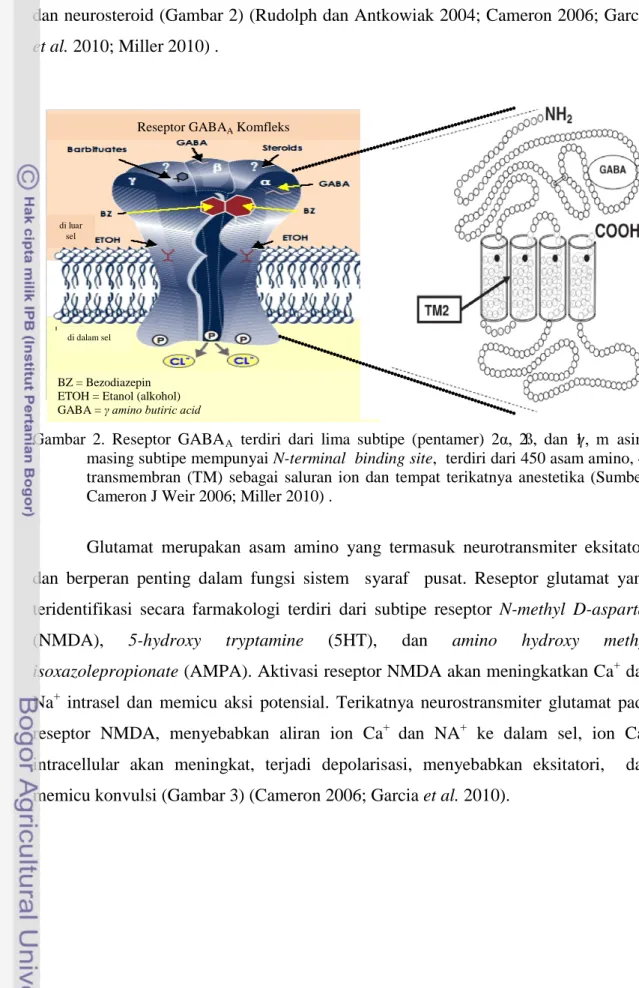
Glutamat merupakan asam amino yang termasuk neurotransmiter eksitatori dan berperan penting dalam fungsi sistem syaraf pusat. Reseptor glutamat yang teridentifikasi secara farmakologi terdiri dari subtipe reseptor N-methyl D-aspartat (NMDA), 5-hydroxy tryptamine (5HT), dan amino hydroxy methyl
isoxazolepropionate (AMPA). Aktivasi reseptor NMDA akan meningkatkan Ca+ dan
Na+ intrasel dan memicu aksi potensial. Terikatnya neurostransmiter glutamat pada reseptor NMDA, menyebabkan aliran ion Ca+ dan NA+ ke dalam sel, ion Ca+ intracellular akan meningkat, terjadi depolarisasi, menyebabkan eksitatori, dan memicu konvulsi (Gambar 3) (Cameron 2006; Garcia et al. 2010).
Reseptor GABAA Komfleks
BZ = Bezodiazepin ETOH = Etanol (alkohol) GABA = γ amino butiric acid
di luar sel
Gambar 3. Skema reseptor N-methyl D-aspartat (NMDA) komfleks
(Sumber: Uwe Rudolph dan Bernd Antkowiak 2004; Miller 2010) .
Reseptor GABA dan Glutamat adalah reseptor yang sebagaian besar terletak pada otak khususnya di hipotalamus yang merupakan target kerja anestetikum, yaitu di daerah tuberomammilary nucleous (TMN). Anestetikum umum akan terkonsentrasi untuk meningkatkan aktivitas reseptor GABAA (Cameron 2006;
Mashour 2006; Pretto 2002; Miller 2010). Konsentrasi rendah isofluran, enfluran, halotan, dan propofol mempengaruhi GABA dan induksi Cl-, pada dosis tinggi akan secara langsung mempengaruhi reseptor GABAA
Secara seluler, anestetika bekerja pada sel neuron melalui interaksi dengan kanal ion. Membran protein akan diaktivasi oleh rangsangan kimia atau karena adanya perubahan sebagai sinyal pada membran sel. Dengan adanya sinyal, terjadi aktivasi membran protein, kanal ion akan mempengaruhi elektrik neuron, terjadi perpindahan ion pada permukaan membran sel sehingga terjadi perubahan kondisi di dalam sel yang sangat negatif atau sangat positif. Kondisi di dalam sel yang sangat negatif menyebabkan hiperpolarisasi sel sehingga terjadi inhibitori, sedangkan kondisi yang sangat positif menyebabkan depolarisasi sel sehingga terjadi kondisi
menjadi terbuka (Henschel et al. 2008).
Skema subtipe reseptor N-methyl D-aspartat (NMDA)
ekstraseluler
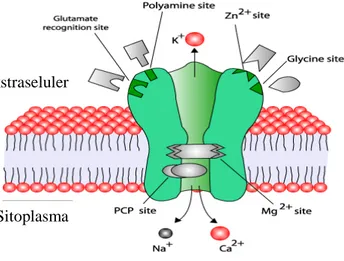
eksitatori. Pada umumnya, anestesi umum bekerja dengan cara memperkuat (+) sinyal inhibitori atau menghambat (-) sinyal eksitatori. Secara klinis, anestetikum mempengaruhi fungsi kanal ion lebih dari satu pada sistem syaraf dan hal ini berdampak pada aktivitas neuron dengan drajat berbeda dan daerah berbeda, seperti disajikan pada Gambar 4 (Cameron 2006; Garcia et al. 2010).
Gambar 4 Anestesi umum bekerja dengan cara mempengaruhi aktivitas transmitter-gate ion channel dengan cara meningkatkan (+) sinyal inhibitori dan/atau menghambat (-) sinyal eksitatori neurotransmiter. GABA= γ amino butiric acid, NMDA= N-methyl D-aspartat, 5HT3 = 5-hydroxy tryptamine, AMPA = amino hydroxy methyl isoxazolepropionate. (sumber: Cameron J Weir 2006).
Anestetika umum yang sering digunakan saat ini sebagai induksi dan pemeliharaan anestesi ada lima jenis anestetika inhalasi dan lima jenis anestetika injeksi intravena. Anestetika inhalasi yaitu N2O, isofluran, sevofluran, desfluran, dan
xenon. Anestetika intravena yaitu propofol, etomidat, ketamine, metoheksital, dan tiopental. Ketamine, N2O, dan xenon bekerja dengan cara menghambat reseptor
glutamat dengan pengaruh yang sangat kuat menghambat reseptor subtipe NMDA dan berpengaruh sangat lemah pada reseptor lain seperti reseptor GABAA. Anestetika
sisanya bekerja pada reseptor GABAA dengan pengaruh utama meningkatkan fungsi
reseptor GABAA dan berpengaruh juga pada kanal ion lainnya seperti reseptor glisin,
Anestesi Umum
reseptor nikotin, reseptor 5HT3, reseptor glutamat, dan pompa ion kalium. Reseptor GABAA adalah reseptor inhibitori neurotransmiter yang sebagian besar terletak di
SSP (Garcia et al. 2010). Dengan demikian anestetikum secara umum bertindak sebagai sinyal yang akan merangsang reseptor GABAA
Anestetika umum injeksi, selain ketamine, bekerja meningkatkan pengaruh reseptor GABA
, menyebabkan hiperpolarisasi (inhibitori), mengganggu proses fisiologi dan menimbulkan perubahan klinis seperti hipnosis, depresi refleks spinal, dan amnesia (Cameron 2006; Garcia et al. 2010).
A pada otak khususnya subtipe ß3 menyebabkan kehilangan
kesadaran dan subtipe ß2 (50% pada SSP) menyebabkan sedasi. Sedangkan anestetikum ketamine, anestetika gas, N2O, Xenon dan sejenisnya bekerja sedikit
atau lemah pada reseptor GABAA atau Glisin, tetapi sangat kuat menghambat pada
reseptor glutamat subtipe NMDA sehingga akan menutup aliran Ca2+
Reseptor GABA
dan membuka saluran ion K yang menyebabkan terjadinya analgesik kuat (Miller 2010).
A adalah reseptor yang ditemukan di SSP dan reseptor inilah
merupakan target anestesi. Anestetika umum meningkatkan kerja GABA dan menginduksi saluran ion Cl. Pada dosis tinggi, anestetika dapat langsung mengaktivasi reseptor GABAA, tanpa GABA. Sedangkan anestetika apolar seperti
xenon atau cyclopropan mempunyai pengaruh yang sedikit atau tidak berpengaruh pada reseptor GABAA. Pengaruh fungsional anestetika pada reseptor GABAA
Franks (2008) dan Miller (2010) menerangkan bahwa anestetikum volatil bekerja pada reseptor GABA
sangat tergantung pada komposisi reseptor subunitnya, yaitu subunit α, β, atau subunit γ (Franks 2008; Miller 2010).
A subunit α pada transmembran (TM)2 dan TM3
bagian protein Ser270 (αS270). Propofol sebagai anestetikum intravena bekerja pada reseptor GABAA subunit ß TM2 dan TM3 bagian N265 (ßN265). Sedangkan
anestetika isofluran dan halotan mempunyai ikatan anestetik pada TM1, TM2, TM3, dan TM4 bagian M159 yang sangat mempengaruhi tranduksi sinyal. Sedangkan isofluran dan xenon lebih banyak menghambat reseptor melalui kompetisi dengan glisin ( Gambar 5).
Mascia et al. (2000) menyebutkan bahwa alkohol dan anestetika mempengaruhi reseptor glisin dan reseptor GABAA melalui asam amino pada TM2
dan TM3 dari α subunit, yaitu pada reseptor glisin pada S267, A288, dan Ser270 sedangkan pada reseptor GABAA subunit β pada S270, A291, Asn 265, dan Met286.
Propofol mirip dengan propanethiol bekerja pada reseptor Glisin TM2 α1 (S267C), pada reseptor GABAA TM2 α2 (S270C) ß1, pada TM3 α1 (A288C), pada TM3 α2
(A291C)ß1, pada TM2 β2 (Tyr445). Asam amino pada TM2 adalah tempat terikatnya anestetika dan alkohol (Gambar 5) (Mascia et al. 2000; Franks 2008; Miller 2010).
Gambar 5. Anestetika volatil (isofluran) bekerja pada reseptor GABAA
dan anestetika intravena (propofol) bekerja pada reseptor GABA subunit α
A
(Sumber : Miller 2010).
subunit β.
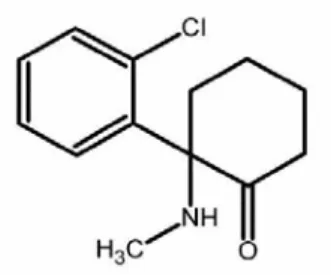
Tinjauan Anestetikum Umum Ketamine HCl
Ketamine HCl adalah anestetikum golongan phencyclidine (PCP) dengan rumus 2-(0-chlorophenyl)-2-(methylamino)-cyclohexanone hydrochloride, golongan nonbarbiturat, dan termasuk dissosiatif anestesi, yaitu pada dosis rendah sebagai preanestesi dan pada dosis lebih tinggi sebagai anestesi umum. Ketamine HCl merupakan larutan tidak berwarna, stabil pada suhu kamar dan mempunyai tingkat keamanan lebar (Gambar 6) (Sulistia 1987; Adams 2001).
Gambar 6 Struktur kimia ketamine HCl
Ketamine HCl mempunyai sifat menghilangkan rasa sakit yang kuat serta reaksi anestesinya tidak menyebabkan ngantuk (Pathak et al.1982; Kul et al. 2001). Ketamine menghasilkan pengaruh anestesi melalui mekanisme yang bekerja pada reseptor N methyl D aspartate (NMDA). Ketamine diklasifikasikan sebagai antagonis reseptor NMDA, pada daerah tempat kerja PCP. Afinitas ketamine sangat tinggi pada reseptor NMDA, sehingga menghasilkan pengaruh analgesik yang sangat kuat (Stawicki 2007). Sebagai antagonis NMDA, ketamine menghambat refleks nosiseptik spinal, yaitu menghambat konduksi rasa nyeri ke talamus dan daerah kortek. Penghambatan reseptor NMDA dengan dosis ketamine yang rendah akan menghasilkan pengaruh analgesik yang baik (Intelisano et al. 2008). Ketamine juga menyebabkan gangguan fungsi pada beberapa tempat di otak seperti pada talamus dan kortek serebral menjadi tertekan. Ketamine juga memperpanjang kerja GABA (gamma amino butyric acid), suatu neurotransmiter penghambat di otak dengan cara menghambat pengikatannya di ujung syaraf (Cullen 1997). Reseptor GABA dapat merubah permiabilitas ion Cl
-Adams (2001) menyebutkan bahwa aktivitas ketamine dapat secara langsung menstimulasi pusat adrenergik dan secara tidak langsung menghambat pengambilan (uptake) catecholamine terutama norepineprin. Ketamine dapat mengubah aktivitas dan dapat menyebabkan pelepasan norepineprin pada syaraf simpatik (Adams 2001; Rudolph dan Antkoeiak 2004). Pengaruh klinis yang ditimbulkan ketamine sangat bervariasi seperti : analgesia, anestesi, halusinasi, neurotoksisitas, hipertensi arterial, dan bronkodilatasi. Ketamine juga menimbulkan agitasi (kehilangan orientasi, gelisah, dan menangis) yang sering disebut penomena
listrik jantung dengan memperpanjang interval PR dan QT, tetapi tidak mempengaruhi bentuk gelombang EKG. Ketamine juga dapat menghambat efferen vagal (vagolitik) melalui aktivitas pada syaraf pusat. Terhadap sistem kardiovaskuler, ketamine menyebabkan peningkatan tekanan darah, peningkatan denyut jantung, peningkatan cardiac output, peningkatan tekanan vena (Cullen 1997), peningkatan tekanan arteri, temperatur tubuh, dan peningkatan tekanan intraokuler (Haskin 1989).
Pemberian anestetikum ketamine secara tunggal dosis 10-15 mg/kg berat badan secara intra muskular pada anjing menimbulkan kekejangan otot dan hipersalivasi serta durasi kerja anestesi yang sangat pendek. Mengatasi kerugian penggunaan anestetikum ketamine secara tunggal, ketamine sering dikombinasikan dengan obat lain sebagai preanestesi, misalnya sedatif tranquuilizer golongan penotiazin seperti acepromazin atau clorpromazin, sedatif hipnotik golongan α2-adrenoceptor seperti xylazine, dan golongan benzodiazepin seperti diazepam atau midazolam yang diberikan secara IM atau IV (Bishop 1996). Penggunaan kombinasi xylazine 2 mg/kgBB lima menit kemudian diikuti dengan ketamine 20 mg/kgBB, menyebabkan menurunnya denyut jantung, tekanan darah arteri dan respirasi (Kul et al. 2001). Waktu anestesi yang dihasilkan oleh kombinasi anestesi xylazine (2 mg/kgBB) dan ketamine (15 mg/kgBB) dalam satu spuit secara intamuskular pada anjing lokal sekitar 45 menit (Sudisma et al. 2001). Pemberian xylazine secara tunggal pada anjing akan menyebabkan muntah dan penurunan denyut jantung beberapa menit setelah pemberian xylazine (Bishop 1996).
Propofol
Propofol dapat digunakan secara tunggal pada prosedur anestesi yang singkat atau untuk induksi sebelum intubasi dan anestesi inhalasi. Propofol mempunyai pH netral dan dapat diberikan dalam bentuk emulsi minyak dalam air dengan konsentrasi 10 mg/ml. Walaupun propofol memperlihatkan warna putih seperti susu, sangat aman diberikan secara intravena. Propofol adalah turunan alkil penol (2,6-diisopropylphenol), seperti pada Gambar 7 (McKelvey dan Hollingshead 2003).
2,6-diisopropylphenol (C12H18O)
Gambar 7 Struktur kimia propofol
Propofol termasuk agen anestetikum intravena short acting hypnotic. Propofol menghasilkan pengaruh anestesi melalui mekanisme yang bekerja pada reseptor GABAA (Intelisano et al. 2008). Propofol memperbesar pengaruh GABA yang
mempunyai fungsi menghambat aksi (inhibitory) sistem syaraf pusat, meningkatkan konduksi Cl-
Propofol mempunyai molekul mirip alkohol, molekulnya akan bekerja dan berikatan pada reseptor GABA
yang menyebabkan hiperpolarisasi sehingga tingkat rangsangan sel (excitability) menurunkan, menyebabkan sedasi dan relaksasi (Mihic dan Harris 1997; Intelisano et al. 2008).
A pada membran sel syaraf pada otak khususnya
reseptor GABAA subtipe ß3 pada transmembran (TM)2 dan TM3 bagian N265
(ßN265) sehingga menyebabkan kehilangan kesadaran dan pada reseptor GABAA
subtipe ß2 (50% pada SSP) akan menyebabkan sedasi. Subtipe ß3 yang terdapat pada reseptor GABAA merespon propofol dan etomidat sehingga terjadi depresi
respiratoris (Henschel et al. 2008). Propofol menghasilkan pengaruh menghilangkan kesadaran dan pelemas otot yang baik, menyebabkan hipotensi arterial, bardikardi, depresi respirasi terutama apabila diberikan secara cepat dengan dosis yang tinggi (Franks 2008; Miler 2010; Stawicki 2007). Propofol menyebabkan vasodilatasi pada vena dan arteri serta berakibat langsung penurunan tekanan darah dan menyebabkan relaksasi pembuluh darah (Karsli et al. 1999). Penelitian pada manusia, propofol menyebabkan rendahnya tekanan darah sistol (SAP) dan tekanan darah rata-rata (MAP) tanpa menimbulkan pengaruh pada denyut jantung (Belo et al. 1994 dalam Mohamadnia et al. 2008).
Efek samping propofol berhubungan dengan dosis penggunaan dan keuntungan penggunaan propofol akan diperoleh dengan cara mengkombinasikan dengan agen anestetikum lain untuk menurunkan dosis dan meminimalkan pengaruh buruk yang ditimbulkan (Dzikiti et al. 2007). Efek samping penggunaaan propofol adalah hipotensi, apnea, dan rasa sakit pada tempat suntikan (Stawicki 2007).
Propofol dapat dilarutkan dalam larutan salin (garam) atau dektrosa 5% dalam air untuk digunakan pada anjing. Larutan tersebut lebih akurat dan dapat melindungi efek samping terhadap respirasi dan kardiovaskular. Propofol tidak dianjurkan untuk dilarutkan dalam konsentrasi yang kurang dari 0,2% (2mg/ml), karena tidak dapat bercampur dengan pelarut atau agen lain. Tidak seperti cycloheksamin dan barbiturat, propofol dapat diberikan secara berulang-ulang dan injeksi dapat diulang setiap 3-5 menit atau sesuai dengan kebutuhan yang disesuaikan dengan status pasien atau sebagai alternatif dapat diberikan secara infus terus-menerus. Periode pemulihan anestesi dengan propofol sangat cepat dan berjalan dengan lembut, walaupun diberikan secara berulang-ulang. Pemulihan anestesi dengan propofol pada anjing sekitar 20 menit (McKelvey dan Hollingshead 2003).
Dosis propofol yang dibutuhkan pasien dan durasi anestesinya tergantung dari preanestetikum yang digunakan. Apabila digunakan dosis 6 mg/kg IV, onset anestesinya kurang dari 60 detik dan durasinya sekitar 5-10 menit. Dosis propofol yang kecil (0,2-0,4 mg/kg/menit) dapat diberikan pada pasien secara infusi terus-menerus dengan pompa injeksi atau tetes IV. Propofol dapat digunakan pada anjing dengan dosis pemberian 4mg/kg secara intravena (Bishop 1996). Penggunaan propofol pada hewan kecil sebagai induksi digunakan dosis 3-8mg/kg secara intravena, sedangkan sebagai pemeliharaan anestesi digunakan dosis 0,5-1mg/kg diulang setiap 3-5 menit atau dapat diberikan secara infusi intravena 0,3-0,5mg/kg/menit. Metode total intraveous anesthesia (TIVA) menggunakan propofol digunakan secara luas pada pasien manusia yang ditangani diluar ruang operasi. Propofol yang digunakan pada manusia mempunyai waktu pemulihan yang singkat, kadang lebih cepat dari isofluran dan menyebabkan muntah dan mabuk pasca operasi.
Penggunaan propofol dengan metode TIVA juga dipercaya sebagai anestesi alternatif untuk hewan kesayangan terutama anjing (Tsai et al. 2007).
Induksi anestesi pada anjing dengan propofol (4mg/kg) dan ketamine (2mg/kg) secara intravena dalam satu spuit dilanjutkan dengan infusi intravena dengan propofol (0,5mg/kg/menit) dan ketamine (0,2mg/kg/menit), menghasilkan anestesi dengan hemodinamik yang stabil (Intelisano et al. 2008). Anestesi pada anjing dengan kombinasi propofol (4mg/kg) dan ketamine (4mg/kg) secara intravena menghasilkan anestesi yang aman dan dapat digunakan sebagai alternatif anestesi untuk prosedur pembedahan yang panjang (Muhammad et al. 2009). Kombinasi propofol dengan preanestetikum mempunyai rentang keamanan yang lebar pada anjing. Eksitasi dan tremor otot jarang terjadi, oleh karena itu diperlukan preanestetikum seperti acepromazin(0,1mg/kg IV), pentobarbital (2mg/kg), atau diazepam (0,3-0,5mg/kg IV). Propofol sangat aman diberikan pada hewan dengan gangguan hati dan ginjal, karena metabolisme propofol sangat cepat. Satu kekurangan propofol adalah kelemahan untuk disimpan, karena mengandung minyak kedelai, lesithin, dan gliserol sehingga akan mendukung pertumbuhan bakteri. Ampul dan botol harus disimpan dengan aseptik dan tidak dianjurkan untuk digunakan setelah dibuka selama 12 jam (McKelvey dan Hollingshead 2003; Tsai et al. 2007; BBraun 2009).
Xylazine
Xylazine adalah salah satu golongan alpha2-adrenoceptor stimulant atau alpha-2 adrenergic receptor agonist. Alpha-alpha-2 agonist seperti xylazine dan medetomidin
adalah preanestetikum yang sering digunakan pada anjing dan kucing untuk menghasilkan sedasi, analgesi, dan pelemas otot. Golongan alpha-2 agonist yang lain seperti romifidin sering digunakan pada kuda, tetapi tidak direkomendasikan untuk anjing dan kucing (Lemke 2004). Xylazine HCl mempunyai rumus kimia
2(2,6-dimethylphenylamino)-4H-5,6-dihydro 1,3-thiazine hydrochloride, seperti disajikan
N-(2,6-dimethylphenyl)-5,6-dihydro-4H-1,3-thiazin-2-amine (C12H16N2S)
Gambar 8 Struktur kimia xylazine HCl
Xylazine bekerja melalui mekanisme yang menghambat tonus simpatik karena xylazine mengaktivasi reseptor postsinap α2-adrenoseptor sehingga
menyebabkan medriasis, relaksasi otot, penurunan denyut jantung, penurunan peristaltik, relaksasi saluran cerna, dan sedasi. Aktivitas xylazine pada susunan syaraf pusat adalah melalui aktivasi atau stimulasi reseptor α2-adrenoseptor, menyebabkan
penurunan pelepasan simpatis, mengurangi pengeluaran norepineprin dan dopamin. Reseptor α2
Xylazine menghasilkan sedasi dan hipnotis yang dalam dan lama, dengan dosis yang ditingkatkan mengakibatkan sedasi yang lebih dalam dan lama serta durasi panjang (Hall and Clarke 1983). Xylazine diinjeksikan secara intramuskular menyebabkan iritasi kecil pada daerah suntikan, tetapi tidak menyakitkan dan akan hilang dalam waktu 24 –48 jam (Hall and Clarke 1983; Brander et al. 1991).
-adrenoseptor adalah reseptor yang mengatur penyimpanan dan atau pelepasan dopamin dan norepineprin. Xylazine menyebabkan relaksasi otot melalui penghambatan transmisi impuls intraneural pada susunan syaraf pusat dan dapat menyebabkan muntah. Xylazine juga dapat menekan termoregulator (Adams 2001).
Xylazine menyebabkan tertekannya sistem syaraf pusat, bermula dari sedasi, kemudian dengan dosis yang lebih tinggi menyebabkan hypnosis, tidak sadar dan akhirnya keadaan teranestesi (Hall dan Clarke 1983). Pada sistem pernafasan, xylazine menekan pusat pernafasan. Xylazine juga menyebabkan relaksasi otot yang bagus melalui imbibisi transmisi intraneural impuls pada SSP. Penggunaan xylazine pada anjing menghasilkan efek samping merangsang muntah tetapi dapat mengosongkan lambung pada anjing diberi makan sebelum dianestesi.
Xylazine biasa digunakan pada kucing, anjing dan kuda sebagai agen sedatif untuk keperluan pembedahan minor dan untuk menguasai hewan atau handling. Penggunaaan xylazine dengan dosis yang lebih tinggi bukan saja untuk sedasi dan analgesi, tetapi juga menghasilkan immobilisasi. Xylazine bisa digunakan sendiri atau dikombinasikan dengan obat lain seperti benzodiazepin atau opioid untuk menghasilkan sedasi. Xylazine juga dapat dikombinasikan dengan anestesi injeksi seperti ketamine, tiopental, dan propofol atau anestesi inhalasi seperti halotan dan isofluran untuk menghasilkan anestesi yang lebih baik (Lemke 2004). Xylazine biasanya digunakan sebagai preanestesi, tetapi pada anjing akan menyebabkan muntah sehingga bersifat kontra-indikasi untuk hewan yang menderita obstruksi gastro-intestinal. Waktu induksi dari suatu agen anestesi bisa dikurangi sampai 50-75% dengan pemberian preanestesi xylazine untuk menghindari overdosis (Bishop 1996).
Sebagai preanestesi pada kuda, xylazine dapat diikuti dengan tiopenton, metoheksiton atau ketamine. Dengan anestetikum ketamine, penggunaan xylazine adalah dosis 1,1 mg/kg berat badan secara intra muskular dan diikuti dengan ketamine 2,2 mg/kg berat badan. Pada anjing, xylazine bisa digunakan secara sub-kutan atau intra muskular dengan dosis 1-3 mg/kg berat badan (Bishop 1996). Xylazine dapat digunakan sebagai preanestetikum pada anjing dengan dosis 0,25-2mg/kg secara intramuskular dan dosis 0,2-0,5mg/kg secara intravena (McKelvey dan Hollingshead 2003).
Midazolam
Midazolam adalah golongan short-acting benzodiazepin (Gambar 9) umumnya digunakan pada manusia tetapi dapat digunakan pada anjing, kucing, babi, burung, dan kuda. Midazolam stabil dalam larutan, sehingga dapat dikombinasikan dengan ketamine atau ketamine-larutan salin untuk pemberian secara infus, diabsorbsi dengan baik dan tidak mengiritasi jaringan bila diaplikasikan secara intramuskular (Lumb dan Jones 1996).
Gambar 9 Struktur kimia midazolam
Midazolam merupakan golongan Imidazobenzodiazepin yang larut dalam air, menghasilkan efek hipnotik, relaksasi otot dan lebih potensial daripada golongan benzodiazepine lain seperti diazepam (Plumb 1991; Luna et al. 1992). Golongan benzodiazepin memperkuat kerja GABA yang merupakan neurotransmiter inhibitori utama pada otak, mampu menekan reflekss-refleks polisinaps dan berpengaruh terhadap medulla spinalis (Brander et al. 1991). Midazolam bekerja pada reseptor benzodiazepin dengan cara meningkatkan pengikatan GABA pada reseptor GABAA
Midazolam dimetabolisme di hati. Produk metabolit utama midazolam adalah hidroksimidazolam yang diekresikan melalui hati sebanyak 40-50%,
, sehingga menimbulkan penghambatan SSP (Stawicki 2007).
α
-hydroxymidazolam yang terbentuk akan segera terikat dengan asam glukoronat (tidak aktif) dan 50-70% dosis midazolam yang diberikan kemudian dieliminasi melalui ginjal. Waktu paruh eliminasi midazolam pada manusia 1,5-3 jam (Anonim 2002). Midazolam mempunyai waktu paruh singkat dan aktivitas farmakologi yang rendah. Waktu paruh midazolam dalam serum dan durasi midazolam pada manusia lebih pendek dibandingkan penggunaan diazepam. Waktu paruh eliminasi midazolam pada manusia lebih kurang 2 jam sedangkan diazepam mencapai 30 jam (Plumb 1991).Midazolam diabsorbsi cepat dengan kesempurnaan absorbsi 91% pasca injeksi intramuskular dan rentang bioavailabilitas 31-72% pada pemberian per-oral. Onset pasca injeksi midazolam secara intravena sangat cepat karena midazolam termasuk zat lipofilik tinggi. Reflekss akan berkurang pada 30-97 detik post pemberian midazolam pada manusia. Obat ini memiliki ikatan kuat dengan protein (94-97%) dan secara cepat menembus blood brain barrier (Plumb 1991). Menurut
Anonim (2002), ketersediaan hayati midazolam post injeksi intramuskular lebih dari 90% dan konsentrasi plasma maksimum pada manusia dicapai dalam 30 menit. Ikatan protein plasma midazolam adalah 96-98%. Selain menembus blood brain barrier, midazolam juga mampu menembus plasenta dan memasuki sirkulasi janin.
Midazolam dapat digunakan secara sendiri sebagai tranquilizer atau dikombinasikan dengan anestetikum umum untuk mencegah hipertonus otot dan meningkatkan sedasi. Pada anjing, midazolam diinjeksikan intramuskular atau intravena, walau pemberian intravena lebih sering digunakan untuk induksi anestesi (Lumb dan Jones 1996). Midazolam digunakan sebagai preanestesi untuk mengurangi kegelisahan sebelum prosedur pembedahan, sebagai sedatif, hipnotik, dan menimbulkan amnesia (Stawicki 2007). Midazolam dapat mencegah hipertonus otot, meningkatkan efek sedasi, menghasilkan efek hipnotik, dan lebih potensial dibandingkan diazepam (Lumb dan Jones 1996; Muir et al. 2000).
Midazolam diindikasikan untuk sedasi preoperasi, amnesia, penanganan seizures atau status epilepsi, sedasi dan amnesia untuk endoskopi, dan dikombinasikan dengan agen anestesi lain sebagai anestesi umum (Stawicki 2007). Efek samping penggunaan midazolam adalah hipotensi, bradikardi, depresi respirasi, kerusakan fungsi motor, dan koma. Overdosis midazolam dapat ditangani dengan pemberian flumazenil (Stawicki 2007).
Midazolam lebih baik dibandingkan dengan diazepam. Midazolam bersifat stabil di dalam larutan sehingga dapat dikombinasikan dengan ketamine atau ketamine-larutan saline untuk pemberian secara infus (Plumb 1991; Jacobson dan Hartsfield 1993). Midazolam diabsorbsi dengan baik dan tidak mengiritasi jaringan bila diaplikasikan intramuskular dan pengaruhnya akan muncul setelah tiga menit penyuntikan (Lumb dan Jones 1996). Dosis midazolam yang dianjurkan pada anjing 100-200 microgram/kgBB intravena, intramuskular atau subkutan (Lumb dan Jones 1996; Bishop 1996). Midazolam digunakan sebagai preanestesi pada anjing dengan dosis 0,1-0,2mg/kg (maksimal 10mg) secara intramuskular maupun intravena (McKelvey dan Hollingshead 2003). Midazolam juga sering digunakan pada kucing dan dikombinasikan dengan ketamine (0,2mg/kg midazolam dan 10mg/kg ketamine
IM). Penggunaan midazolam untuk preoperasi berkisar 0,066-0,22 mg/kgBB intramuskular atau intravena (Plumb 1991; McKelvey dan Hollingshead 2003).
Atropine
Atropine adalah prototipe agen menghambat muskarinik atau antimuskarinik dan merupakan ekstrak alkaloid dari tumbuhan belladona yang termasuk famili potato (Adams 2001). Atropine dan derivat alamiahnya adalah ester alkaloid ammonium tersier asam tropat (Katzung 1992). Secara kimia, molekul atropine terdiri dari dua komponen yang berikatan melalui ikatan ester. Komponen pertama adalah tropine yang merupakan sebuah basa organik dan komponen kedua adalah asam tropat (Gambar 10).
Gambar 10 Struktur kimia atropine
Atropine merupakan antimuskarinik, digunakan untuk mengurangi salivasi dan sekresi bronkial dan melindungi serta mencegah kejadian aritmia disebabkan prosedur atau sifat obat-obat anestesi. Sebagai preanestesi, atropine diindikasikan pada anjing untuk mencegah sejumlah saliva yang dapat menghalangi jalan nafas. Atropine dan hyoscin tidak direkombinasikan untuk preanestesi pada kuda karena dapat menyebabkan eksitasi dan medriasis. Atropine mencegah efek samping muskarinik dari antikolinesterase, yang digunakan untuk mengembalikan pengaruh non-depolarisasi obat-obat neuromuskular blok. Atropine adalah obat yang paling umum untuk digunakan sebagai antimuskarinik untuk pengobatan bradikardia. Penggunaan atropine pada anjing adalah 30–100 mikrograms/Kg BB (Bishop 1996). Dosis atropine sulfas sebagai preanestetikum 0,02-0,04 mg/kgBB intramuskular atau subkutan (Plumb 1991). Atropine biasa digunakan sebagai preanestetik pada anjing dengan dosis 0,02-0,04mg/kg secara subkutan, intramuskular, maupun secara
intravena (McKelvey dan Hollingshead 2003). Pemakaian atropine sulfas dosis tinggi berakibat peningkatan frekuensi jantung dan tonus vagal perifer dan sentral. Kejadian disarithmia jantung dan takhikardi pada pemberian atropine sulfas pernah dilaporkan pada anjing (Lumb dan Jones 1996).
Perubahan Aspek Fisiologi dalam Anestesi
Pengamatan aspek fisiologi untuk pengawasan suatu anestesi dapat dikatakan sempurna apabila seluruh perubahan aspek fisiologi dapat diamati, tetapi perubahan aspek fisiologi pada sistem kardiovaskuler, respirasi dan suhu tubuh merupakan parameter yang terpenting diamati selama periode anestesi (Adams 2001, Flecknell, 1987). Kunci efektifitas anestesi dan tingkat keamanan selama periode anestesi adalah dilakukannya pengawasan dan pemantauan (monitoring) anestesi yang baik. Pemeriksaan cepat dan seksama selama periode anestesi dilakukan terhadap kedalaman anestesi, kardiovaskuler dan respirasi, oksigenasi, dan variabel yang lain, seperti disajikan pada Tabel 2.
Tabel 2. Perubahan fisiologi yang diperiksa selama periode anestesi • Respirasi : kecepatan, kedalaman, dan sifat (gerak kantong reservoir dan gerakan dada). • Warna membrana mukosa dan capillary refill time (CRT).
• Denyut jantung
• Pulsus : kecepatan dan kekuatan
• Ketegangan rahang, posisi bola mata, dan aktivitas refleks palpebral. • Oksigenasi (kecepatan aliran dan tekanan)
• Temperatur tubuh pasien
Sumber: McKelvey dan Hollingshead 2003
Tanda-tanda vital dan refleks harus diperiksa selama hewan teranestesi. Tanda vital menunjukkan variabel yang mengindikasikan mekanisme respon keseimbangan (homeostasis) hewan terhadap anestesi, seperti denyut jantung, kecepatan respirasi,
capillary refill time (CRT), dan temperatur. Tanda vital bagi pasien menandakan
kemampuan pasien untuk mempertahankan fungsi respirasi dan sirkulasi selama teranestesi. Tanda vital dapat diamati dengan indera (sentuhan, pendengaran, atau
penglihatan) atau menggunakan alat seperti mesin EKG atau oximeter. Tanda vital yang harus diperiksa selama teranestesi adalah denyut dan ritme jantung, pulsus, CRT, warna membrana mukosa, kehilangan darah, kecepatan dan kedalaman respirasi, dan temperatur. Tanda vital lain yang juga diperiksa adalah oksigenasi, CO2, EKG, dan tekanan darah. Sedangkan refleks adalah reaksi tidak sengaja dari
hewan terhadap rangsangan seperti ditusuk atau dipukul. Refleks memberikan informasi terhadap kedalaman anestesi tetapi tidak berhubungan dengan keamanan anestesi atau mekanisme homeostasis pasien (McKelvey dan Hollingshead 2003).
Sistem Kardiovaskeler
Sistem kardiovaskuler adalah suatu sistem dalam tubuh yang terdiri dari jantung, pembuluh darah dan darah. Fungsi utama sistem kardiovaskuler adalah sebagai sistem sirkulasi atau alat transport. Sirkulasi darah akan mengangkut substansi penting untuk kesehatan dan kehidupan, seperti oksigen (O2) dan nutrisi
yang diperlukan oleh setiap sel dalam tubuh. Darah juga membawa karbondioksida (CO2
Denyut jantung adalah hitungan berapa kali jantung berdenyut dalam satu menit. Pengamatan frekuensi denyut jantung dapat menggambarkan kualitas fungsi kardiovaskuler yang bertugas mengangkut O
) dan hasil sisa metabolisme tubuh dari tiap-tiap sel dan mengirimnya ke paru-paru, hati, atau ginjal sebagai tempat untuk pengeluaran (Cunningham 2002). Jantung berfungsi sebagai pompa yang melakukan tekanan terhadap darah untuk menimbulkan tekanan yang diperlukan agar darah dapat mengalir ke jaringan. Pembuluh darah berfungsi sebagai saluran untuk mengarahkan dan mendistribusikan darah dari jantung ke semua bagian tubuh dan mengembalikan ke jantung (Sherwood 2001, Cunningham 2002).
2 dan nutrien ke seluruh jaringan tubuh,
membawa limbah metabolisme dan mempertahankan homeostasis seluler. Pengamatan frekuensi denyut jantung dapat dihitung secara auskultasi dengan mempergunakan stetoskop yang diletakkan tepat di atas apeks jantung di rongga dada sebelah kiri, atau dapat pula dengan merasakan pulsus hewan pada pembuluh darah arteri femoralis atau brachialis. Selain itu, pengukuran frekuensi denyut jantung
dapat juga dilakukan dengan elektrokardiogram (EKG) (Cunningham 2002, Nelson 2003).
Denyut jantung minimal yang masih aman pada anjing teranestesi adalah 60 kali/menit. Denyut jantung yang lebih rendah menandakan kedalaman anestesi yang berlebihan atau ada gangguan. Denyut jantung yang umum pada hewan yang teranestesi adalah 60-120 kali per menit (anjing sehat 60-180x/menit). Penurunan denyut jantung pada kondisi teranestesi adalah normal, akibat adanya pengaruh sebagian besar anestetikum yang dapat menekan denyut jantung dan fungsi miokardiak. Hanya beberapa atestetika yang dapat meningkatkan denyut jantung seperti atropine, ketamine, dan tiletamin (McKelvey dan Hollingshead 2003).
Selama dalam keadaan teranestesi, jantung dapat diamati dengan elektrokardiograf untuk melihat gambaran elektrokardiogram. Elektrokardiogram (EKG) adalah suatu rekaman keadaan yang menggambarkan konduksi listrik jantung. Rekaman konduksi listrik jantung sangat umum digunakan secara klinis untuk mendiagnosa disfungsi listrik jantung. Depolarisasi atrial, depolarisasi ventrikel, dan repolarisasi ventrikel akan menyebabkan depleksi voltase yang khas dalam bentuk gelombang pada elektrokardiogram. Alat elektrokardiograf dapat digunakan untuk melihat gambaran elektrokardiogram dan denyut jantung (Cunningham 2002).
Jantung dibentuk oleh tiga jenis sel yang menyebabkan terjadinya eksitasi, yaitu sel pacemaker sebagai sumber bioelektrik jantung dan secara dominan berada di nodus SA (Sino-Atrial node), sel konduksi sebagai kawat penghubung arus bioelektrik seperti nodus AV (Atrio-Ventricular node), berkas his atau serabut purkinje, dan sel otot jantung (miokardium) yang berfungsi untuk kontraksi (Cunningham 2002).
Jantung berdepolarisasi apabila terdapat dua buah kesatuan yang secara fungsional terisolasi, yaitu atrium kanan dan kiri serta ventrikel kanan dan kiri yang dijembatani oleh nodus AV. Jalur gelombang depolarisasi dimulai dari nodus SA pada atrium kanan, kemudian menyeberangi atrium dari nodus SA ke atrium kiri. Dinding atrium relatif tipis sehingga depolarisasi berjalan terus melalui endokardium dan epikardium. Kecepatan depolarisasi ini dipengaruhi oleh rangsangan otonom,
suhu dan ukuran serabut miokardium. Gelombang depolarisasi menyebabkan atrium berkontraksi dan darah akan mengalir ke ventrikel. Kemudian gelombang depolarisasi mengalir melalui berkas his dan serabut purkinje yang menyebabkan dinding ventrikel berkontraksi dan darah dapat dialirkan keluar ventrikel (Sherwood 2001, Karim dan Kebo 2002).
Gelombang EKG ditandai dengan satu seri defleksi atau gelombang, dengan perjanjian bahwa suatu potensial positif menghasilkan defleksi ke atas dan suatu potensial negatif menghasilkan defleksi ke bawah. Gelomgang P, menunjukkan depolarisasi atrium atau kontraksi atrium. Gelombang untuk repolarisasi atrium tidak terlihat pada EKG, karena tertutup oleh gelombang Q, R, dan S. Gelombang Q, R, dan gelombang S, bersama-sama merupakan komplek QRS. Komplek QRS menunjukkan depolarisasi ventrikel atau kontraksi ventrikel. Ketetapan pada komplek QRS adalah setiap awal defleksi negatif ditunjukkan oleh Q, setiap defleksi positif (dengan atau tanpa didahului oleh Q) ditunjukkan oleh R, dan setiap defleksi negatif yang mengikuti R, ditunjukkan oleh S. Gelombang T menunjukkan repolarisasi ventrikel. Walaupun depolarisasi dan repolarisasi adalah proses yang bertolak belakang, gelombang T dan gelombang R biasanya menunjuk kearah yang sama, yang menunjukkan bahwa penyebab aktivasi dan penurunan mengambil jalur yang berbeda melalui miokardium. Interval PR atau PQ adalah waktu yang berlalu antara permulaan eksitasi atrium dan permulaan eksitasi ventrikel atau penjumlahan dari waktu depolarisasi atrium dan waktu perlambatan simpul AV. Interval QT bervariasi dengan denyut jantung, segmen ini menunjukkan waktu yang diperlukan untuk depolarisasi dan repolarisasi ventrikel atau jarak antara permulaan gelombang Q sampai akhir gelombang T, sedangkan durasi QRS adalah waktu yang diperlukan untuk depolarisasi atau kontraksi ventrikel, seperti disajikan pada Gambar 11 (Sherwood 2001; Karim dan Kebo 2002; Gay dan Rothenburger 2000).
Gambar 11 Diagram gambaran gelombang elektrokardiogram (EKG).
Selain EKG, tekanan darah juga dapat mempengaruhi terjadinya gangguan pada sistem kardiovaskuler. Tekanan darah arteri sangat dipengaruhi oleh cardiac
output dan tahanan total perifer, denyut jantung, serta stroke volume. Peningkatan stroke volume atau cardiac output akan meningkatkan tekanan darah. Peningkatan
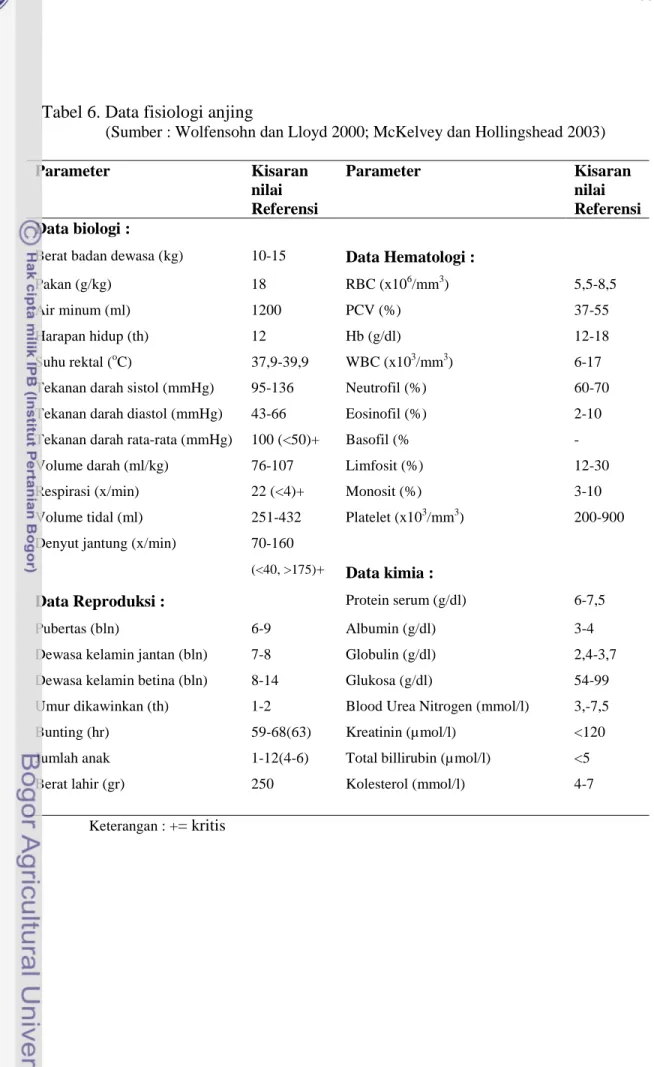
tahanan perifer juga akan mempengaruhi peningkatan tekanan darah. Jadi penurunan denyut jantung, stroke volume atau tahanan perifer secara sendiri-sendiri atau dikombinasikan akan menurunkan tekanan darah arteri (Muir et al. 2000; Cunningham 2002 ). Nilai normal denyut jantung, elektrokardiogram, dan tekanan darah arteri pada anjing disajikan pada Tabel 3.
Tabel 3. Kriteria elektrokardiogram (EKG) dan tekanan darah normal pada anjing
Parameter Kisaran Normal pada Anjing
Denyut Jantung (denyut per menit) 70 – 160 Gelombang P (maximum)(detik dan mv) 0,04 dan 0,4
Interval PQ(detik) 0,06 – 0,13 Interval QRS(detik) 0,04 – 0,05 Gelombang R(mv) 3 Segmen ST(mv) 0,2 Gelombang T (maximum) 1/3 R Interval QT(detik) 0,15 – 0,25
Tekanan sistol/diastol (rata-rata)( mmHg) 100/65(90)-160/100(100)
Sumber : Nelson 2003
Denyut jantung, gambaran elektrokardiogram dan tekanan darah arteri adalah parameter penting pada sistem kardiovaskuler yang harus diperhatikan sebelum dan
1= Durasi P 2= Interval PR 3= Durasi QRS 4= Interval QT