3 METODOLOGI
3.1 Waktu dan Tempat
Penelitian ini dilakukan pada bulan Maret sampai Juni 2012. Proses pelarutan kitosan, uji antibakteri, uji efektivitas antibakteri, uji pH, kadar air, mineral, nitrogen, dan protein bertempat di Laboratorium Mikrobiologi Hasil Perikanan dan Laboratorium Biokimia Hasil Perairan, Departemen Teknologi Hasil Perairan. Pengujian FTIR MB-3000 (Fourier Transform InfraRed) dilakukan di Laboratorium Analisis FTIR dan PCR, Departemen Fisika. Pengujian fisik hand sanitizer yang meliputi viskositas, daya sebar dan stabilitas dilakukan di Laboratorium Rekayasa Pengolahan Pangan, Departemen Ilmu dan Teknologi Pangan, Institut Pertanian Bogor.
Pelaksanaan penelitian terdiri dari dua tahap yaitu penelitian tahap pertama dan penelitian tahap kedua yang dilengkapi dengan analisis data. Penelitian tahap pertama berupa analisis mutu kitosan, penentuan formula gel antiseptik, penentuan karakteristik gel antiseptik terhadap kombinasi kitosan dan CMC (Karboksil Metil Selulosa) serta pengujian kitosan sebagai bahan antibakteri. Sedangkan penelitian tahap kedua berupa uji efektivitas kemampuan antibakteri dari hand sanitizer yang dihasilkan dan membandingkannya dengan hand sanitizer komersil.
3.2 Bahan dan Alat
Bahan-bahan yang digunakan dalam penelitian ini adalah kitosan serbuk yang diperoleh dari Laboratorium Bioteknologi Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor, bahan kimia: asam asetat 1%, CMC (Karboksil Metil Selulosa), serbuk kitosan, esens apel, alkohol 70% (antiseptik), media NA (Nutrient Agar), media NB (Nutrient Broth), media MHA (Mueller Hinton Agar), biakan Escherichia coli, biakan Staphylococcus aureus, bromcherosol green-methyl red dan aquades. Peralatan yang digunakan meliputi, timbangan digital, magnetic stirer, viskometer brookfield tipe DV–E, FTIR MB-3000 (Fourier Transform Infra Red), vortex, autoklaf, pipet mikro, inkubator, labu erlenmeyer, oven, bunsen, ruang laminar,
tabung reaksi, beaker glass, sudip, penangas air, plastik wrap, cawan petri, batang pengaduk, pH meter dan jarum ose.
3.3 Prosedur Kerja
Prosedur penelitian dilakukan dalam dua tahap, yaitu penelitian tahap pertama dan penelitian tahap kedua.
3.3.1 Penelitian Tahap Pertama
Penelitian tahap pertama bertujuan untuk mengetahui mutu kitosan yang akan digunakan pada penelitian utama. Mutu kitosan yang diamati meliputi pengujian kadar air, kadar mineral, kadar nitrogen, kadar protein dan derajat deasetilasi. Selain itu dilakukan juga pengujian kemampuan kitosan sebagai antibakteri, penentuan formula gel antiseptik yang bertujuan untuk menentukan formula terbaik pembuatan gel antiseptik dan mengetahui karakteristik gel antiseptik terhadap kombinasi kitosan dan CMC (Karboksil Metil Selulosa). Pengujian kitosan sebagai antibakteri bertujuan untuk melihat kemampuan kitosan dalam menghambat pertumbuhan bakteri. Uji antibakteri menggunakan metode paper disk.
Tahap pertama yang dilakukan adalah peremajaan bakteri. Jenis bakteri yang digunakan yaitu, S. aureus dan E. coli. Biakan bakteri dipindahkan ke dalam media NA lalu diikubasi selama 24 jam pada suhu 37 oC di dalam inkubator. Tahap kedua, biakan yang telah diikubasi lalu dipindahkan dari media NA ke media NB dan kembali diikubasi selama 24 jam pada suhu 37 oC didalam water bath inkubator. Tahap ketiga yaitu pemindahan biakan bakteri ke dalam media MHA. Tahap selanjutnya adalah media MHA di masukkan ke dalam autoklaf selama 1,5 jam pada suhu 121 oC. Kemudian siapkan paper disk lalu masing-masing paper disk ditetesi sampel sebanyak 20 µL dengan menggunakan pipet mikro. Tahap terakhir yaitu paper disk diletakkan di atas cawan petri lalu diikubasi selama 24 jam pada suhu 37 oC di dalam inkubator. Setiap jenis bakteri dilakukan sebanyak 3 kali ulangan. Setelah diikubasi dilakukan pengukuran zona bening yang terdapat disekitar paper disk. Semakin besar zona bening yang dihasilkan menunjukkan semakain baik kemampuan kitosan dalam menghambat pertumbuhan bakteri (Islam et al. 2011).
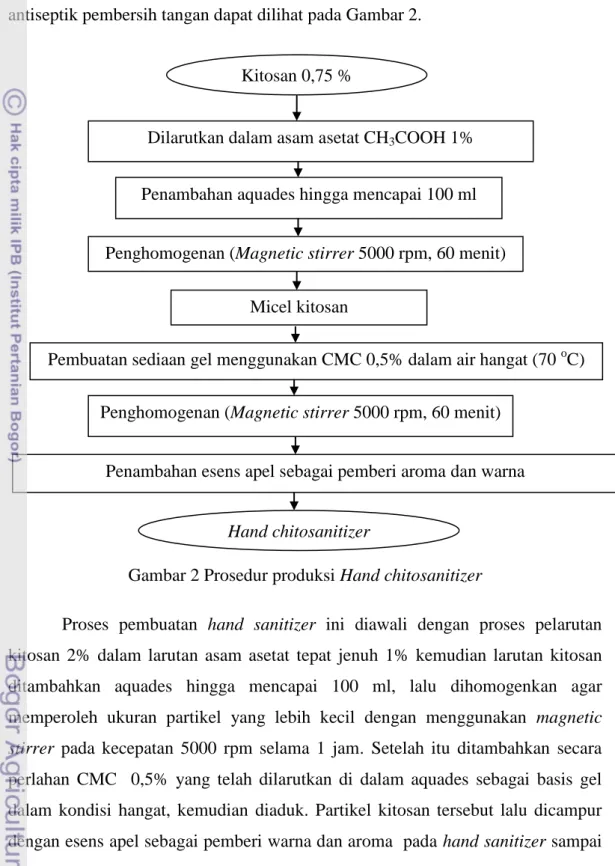
Selanjutnya dilakukan penentuan formula gel antiseptik yang bertujuan untuk menentukan komposisi bahan-bahan gel antiseptik yang dapat menghasilkan karakteristik gel antiseptik yang terbaik. Prosedur pembuatan gel antiseptik pembersih tangan dapat dilihat pada Gambar 2.
Gambar 2 Prosedur produksi Hand chitosanitizer
Proses pembuatan hand sanitizer ini diawali dengan proses pelarutan kitosan 2% dalam larutan asam asetat tepat jenuh 1% kemudian larutan kitosan ditambahkan aquades hingga mencapai 100 ml, lalu dihomogenkan agar memperoleh ukuran partikel yang lebih kecil dengan menggunakan magnetic
stirrer pada kecepatan 5000 rpm selama 1 jam. Setelah itu ditambahkan secara
perlahan CMC 0,5% yang telah dilarutkan di dalam aquades sebagai basis gel dalam kondisi hangat, kemudian diaduk. Partikel kitosan tersebut lalu dicampur dengan esens apel sebagai pemberi warna dan aroma pada hand sanitizer sampai tercampur rata.
Kitosan 0,75 %
Dilarutkan dalam asam asetat CH3COOH 1%
Penghomogenan (Magnetic stirrer 5000 rpm, 60 menit) Micel kitosan
Pembuatan sediaan gel menggunakan CMC 0,5% dalam air hangat (70 oC)
Penambahan esens apel sebagai pemberi aroma dan warna Penambahan aquades hingga mencapai 100 ml
Hand chitosanitizer
Selanjutnya dilakukan pengujian untuk mengetahui pengaruh kombinasi kitosan dan CMC. Perlakuan formulasi gel antiseptik dilakukan terhadap kitosan. Kitosan dibuat dalam empat taraf perbedaan konsentrasi yaitu, 0,25%, 0,50%, 0,75%, dan 1%, sedangkan CMC dibuat dalam satu perlakuan konsentrasi yaitu 0,5% sehingga didapatkan empat perlakuan. Penentuan konsentarsi CMC sebesar 0,5% didasarkan pada hasil dari penelitian tahap pertama, yakni CMC dengan konsentrasi 0,5% untuk menghasilkan basis gel terbaik lalu dicampurkan kedalam kitosan. Selain itu, pemilihan konsentrasi CMC sebesar 0,5% juga didasarkan pada penelitian yang dilakukan oleh Sugita et al. (2007) yang telah melakukan sintesis dan optimalisasi gel kitosan-karboksimetil selulosa (CMC) pada ragam konsentrasi CMC 0,00% sampai 1% (b/v).
Selanjutnya masing-masing perlakuan diuji karakteristiknya menggunakan pengujian fisik yang meliputi stabilitas, daya sebar, viskositas dan uji kimia (pH). Formulasi pada penelitian tahap pertama dapat dilihat pada Tabel 3.
Tabel 3 Formula yang digunakan pada penelitian tahap pertama
Bahan Perlakuan K11 K12 K13 K14 Kitosan (%) 0,25% 0,50% 0,75% 1% Aquades (ml) 50 ml 50 ml 50 ml 50 ml CMC (%) 0,5% 0,5% 0,5% 0,5% Esens apel (ml) 0,1 ml 0,1 ml 0,1 ml 0,1 ml
3.3.2 Penelitian Tahap Kedua
Pada penelitian tahap kedua, formulasi sediaan gel kitosan yang telah dilakukan dari penelitian tahap pertama dibandingkan daya antiseptiknya dengan daya antiseptik kontrol positif (sedian gel antiseptik tangan dengan bahan aktif etanol dan triklosan). Pengujian daya antiseptik dilakukan dengan metode Replika (Retnosari dan Isadiartuti 2006) sebagai berikut: Telapak tangan dicuci dengan air kran, kemudian dikeringkan. Selanjutnya pada telapak tangan diteteskan 0,5 ml gel kemudian diratakan dan didiamkan. Selanjutnya sidik ibu jari ditempelkan pada media padat nutrient agar dalam cawan petri dan dilakukan secara duplo. Media diinkubasi pada suhu 37 ºC selama 24 jam. Setelah diinkubasi, jumlah koloni bakteri dihitung. Replikasi dilakukan sebanyak 3 kali. Telapak tangan dicuci dengan air, kemudian dikeringkan. Selanjutnya pada telapak tangan
diteteskan 0,5 ml gel kemudian diratakan dan didiamkan selama satu menit. Selanjutnya dilakukan kontak sidik ibu jari pada media dalam cawan petri. Media diinkubasi pada suhu 37 ºC selama 24 jam.
Setelah diinkubasi jumlah koloni bakteri dihitung. Replikasi dilakukan sebanyak 3 kali. Selain itu untuk melihat efektivitas kemampuan kitosan dalam menghambat pertumbuhan bakteri dilakukan kontak sidik ibu jari pada media nutrient agar yang terdapat dalam cawan petri dengan selang waktu jam ke-0, jam ke-0,5, dan jam ke-1. Penentuan selang waktu pengambilan sampel didasarkan pada interval waktu yang dibutuhkan bakteri untuk membelah diri. Setiap jenis bakteri memiliki interval waktu yang berbeda antara satu dengan yang lainnya. Misalnya: E. coli membelah diri setiap 15-29 menit dan S. aureus membelah diri setiap 27-30 menit (Entjang 2003). Data hasil perhitungan jumlah koloni bakteri masing-masing formula tersebut dianalisis dengan menggunakan rancangan acak kelompok dan bila terdapat perbedaan dilanjutkan dengan uji Duncan.
3.4 Analisis Penelitian
Prosedur analisis meliputi analisis viskositas, analisis pengukuran derajat deasetilasi, uji kimia, analisis kadar air, analisis kadar mineral, dan analisi kadar protein.
3.4.1 Analisis viskositas (AOAC.1995)
Larutan kitosan dengan konsentrasi 0,25%, 0,5%, 0,75%, dan 1% dipanaskan dalam bak air mendidih sambil diaduk secara teratur sampai suhu mencapai 75 ºC. Viskositas diukur dengan menggunakan Viscosimeter Brookfield.
Spindel terlebih dahulu dipanaskan pada suhu 75 ºC kemudian dipasangkan ke alat ukur Viscosimeter Brookfield tipe DV–E. Posisi spindel
dalam larutan panas diatur sampai tepat, viscometer dihidupkan dan suhu larutan diukur. Ketika suhu larutan mencapai 75 ºC, thermometer dikeluarkan dan nilai viskositas diketahui dengan pembacaan viskosimeter pada skala 1 sampai 100. Pembacaan dilakukan setelah satu menit putaran penuh. Hasil bacaan digandakan 5 kali untuk spindel no.1 dengan kecepatan 12 rpm, dan digandakan 2 untuk spindel yang sama dengan kecepatan 60 rpm. Hal ini berfungsi untuk menyatakan viskositas mutlak dalam satuan centipoises (cP).
3.4.2 Analisis pengukuran derajat deasetilasi (Domsay 1985)
Kitosan sebanyak 0,2 gram digerus menggunakan KBr dalam mortar agate sampai homogen, kemudian dimasukkan dalam cetakan pelet, dicetak dengan dipadatkan dan divakum sampai optimum, selanjutnya pelet ditempatkan dalam sel dan dimasukkan ke dalam tempat sel pada spektrofotometer inframerah IR-408 yang sudah dinyalakan dan stabil. Kemudian tekan tombol pendeteksian, akan muncul histogram FTIR pada rekorder yang memunculkan puncak-puncak dari gugus fungsi yang terdapat pada sampel kitosan. Histogram yang diperoleh dapat digunakan untuk analisis kualitatif dan kuantitatif misalnya analisis kuantitatif derajat deasetilasi dari kitosan.
Pengukuran derajat deasetilasi berdasarkan kurva yang tergambar oleh spektrofotometer. Puncak tertinggi (P0) dan puncak terendah (P) dicatat dan diukur dengan garis dasar yang dipilih. Nisbah absorbansi dihitung dengan rumus:
Keterangan: P0 = Jarak antara garis dasar dengan garis singgung antara dua
puncak tertinggi dengan panjang gelombang 1.655cm-1 P = Jarak antara garis dasar dengan lembah terendah dengan
panjang gelombang 1.655cm-1 atau 3.450 cm-1.
Perbandingan absorbansi pada 1.655cm-1 dengan absorbansi 3.450 cm-1 digandakan satu per standar N-deasetilasi kitosan (1,33). Dengan mengukur absorbansi pada puncak yang berhubungan, nilai persen N-deasetilasi dapat dihitung dengan rumus:
Keterangan: A1.655 = Absorbansi pada panjang gelombang 1.655 cm-1.
A3.450 = Absorbansi pada panjang gelombang 3.450 cm-1.
1,33 = konstanta untuk derajat deasetilasi yang sempurna. A = log Po
3.4.3 Uji kimia (pH)
Sebelum dilakukan pengukuran, pH meter terlebih dahulu dikalibrasi dengan menggunakan buffer pH. Setelah itu, elektroda dibersihkan dengan air suling dan dikeringkan. Kemudian elektroda dimasukkan ke dalam sampel sabun cair yang akan diperiksa, pada suhu 25 oC. Selanjutnya pH meter dibiarkan selama beberapa menit sampai nilai pada monitor pH meter stabil. Setelah stabil, nilai yang ditunjukkan dicatat sebagai pH sampel.
3.4.4 Analisis kadar air (SNI 2006)
Analisis kadar air dilakukan mengacu pada SNI 01-2356-2006. Cawan porselen dikeringkan dalam oven selama 30 menit, lalu didinginkan dalam desikator selama 15 menit. Selanjutnya sampel ditimbang sebanyak 5 g dalam cawan dan dikeringkan dalam oven pada suhu 100 oC dalam tekanan tidak lebih dari 10 mmHg selama 5 jam atau sampai beratnya konstan. Cawan beserta isinya kemudian didinginkan dalam desikator dan ditimbang. Perhitungan kadar air dapat dilihat sebagai berikut :
Keterangan :
A = berat cawan kosong (g)
B = berat cawan + sampel awal (g) C = berat cawan + sampel kering (g) 3.4.5 Analisis kadar mineral (AOAC 2005)
Cawan pengmineralan dikeringkan di dalam oven selama 1 jam pada suhu 105 oC, kemudian didinginkan selama 15 menit di dalam desikator dan ditimbang hingga didapatkan berat yang konstan. Sampel sebanyak 5 g dimasukkan ke dalam cawan pengmineralan dan dipijarkan di atas nyala api bunsen hingga tidak berasap lagi. Setelah itu dimasukkan ke dalam tanur pengmineralan dengan suhu 600 oC selama 1 jam, kemudian ditimbang hingga didapatkan berat yang konstan. Kadar mineral ditentukan dengan rumus:
Keterangan : A = Berat cawan porselen kosong (g) B = Berat cawan dengan sampel (g)
C = Berat cawan dengan sampel setelah dikeringkan (g) 3.4.6 Analisis kadar protein (AOAC 1980)
Tahap-tahap yang dilakukan dalam analisis protein terdiri dari tiga tahap yaitu destruksi, destilasi, dan titrasi. Pengukuran kadar protein dilakukan dengan metode mikro Kjeldahl. Sampel ditimbang sebanyak 0,25 g, kemudian dimasukkan ke dalam labu Kjeldahl 100 ml, lalu ditambahkan 0,25 g selenium dan 3 ml H2SO4 pekat. Contoh didestruksi pada suhu 410 oC selama kurang lebih 1 jam sampai larutan jernih lalu didinginkan. Setelah dingin, ke dalam labu Kjeldahl ditambahkan 50 ml akuades dan 20 ml NaOH 40%, kemudian dilakukan proses destilasi dengan suhu destilator 100 oC.
Hasil destilasi ditampung dalam labu Erlenmeyer 125 ml yang berisi campuran 10 ml asam borat (H3BO3) 2% dan 2 tetes indikator bromcherosol green-methyl red yang berwarna merah muda. Setelah volume destilat mencapai 40 ml dan berwarna hijau kebiruan, maka proses destilasi dihentikan. Lalu destilat dititrasi dengan HCl 0,1 N sampai terjadi perubahan warna merah muda. Volume titran dibaca dan dicatat. Larutan blanko dianalisis seperti contoh. Dengan metode ini diperoleh kadar nitrogen total yang dihitung. Kadar protein dihitung dengan rumus sebagai berikut:
Keterangan : Faktor konversi alat = 2,5
Faktor konversi = 6,25
3.5 Rancangan Percobaan
Pada penelitian tahap pertama rancangan percobaan yang digunakan adalah Rancangan Acak Lengkap (RAL). Rancangan percobaan ini dilakukan untuk mengetahui pengaruh perlakuan konsentrasi kitosan terhadap sifat fisik gel
yamg meliputi, daya sebar, viskositas dan perubahan viskositas. Perlakuan yang diberikan terdiri dari 4 taraf yaitu, konsentrasi kitosan 0,25%, 0.50%, 0,75%, dan 1% dengan ulangan masing-masing sebanyak 3 kali. Data dianalisis dengan menggunakan analisis ragam ANOVA. Apabila hasil analisis ragam memberikan pengaruh yang berbeda nyata (tolak Ho), maka dilanjutkan dengan uji lanjut Duncan. Model matematis yang digunakan adalah sebagai berikut:
Keterangan :
Yij : Pengamatan perlakuan ke-i dan ulagan ke-j µ : Rataan Umum
Pi : Pengaruh perlakukan ke-i dan Єij : Galat perlakuan ke-I dan ulangan ke-j
Pada penelitian tahap kedua, rancangan percobaan yang digunakan adalah Rancangan Acak Kelompok (RAK). Rancangan percobaan ini dilakukan untuk mengetahui pengaruh perlakuan konsentrasi kitosan terhadap jumlah koloni bakteri yang dihasilkan pada 3 kelompok waktu yang berbeda. Perlakuan yang diberikan terdiri dari 6 taraf, yaitu konsentrasi kitosan 0% (kontrol negatif), 0,25%, 0,50%, 0,75%, 1%, dan kontrol positif (hand sanitizer komersil) dengan dilakukan pada 3 kelompok rentan waktu yang berbeda, yakni jam 0, jam ke-0,5, dan jam ke-1. Data dianalisis dengan menggunakan analisis ragam ANOVA. Apabila hasil analisis ragam memberikan pengaruh yang berbeda nyata (tolak Ho), maka dilanjutkan dengan uji lanjut Duncan. Model matematis yang digunakan adalah sebagai berikut:
Keterangan :
Yij : Pengamatan Kelompok ke-i dan Perlakuan ke-j µ : Rataan Umum
Ki : Pengaruh Kelompok ke-i Pj : Pengaruh Perlakuan ke-j dan
Єij : Galat Kelompok ke-i dan Perlakuan ke-j Yij = µ + Pi + Єij