APLIKASI ENZIM BAKTERI SELULOLITIK DAN
XILANOLITIK DALAM DEKOMPOSISI SUBSTRAT
LIMBAH TANAMAN PADI
Hasrul Satria Nur
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
2007
HASRUL SATRIA NUR. P055050011. Pemanfaatan Bakteri Selulolitik dan Xilanolitik Yang Potensial Untuk Dekomposisi Jerami Padi. Dibimbing oleh ANJA MERYANDINI dan HAMIM
Bakteri selulolitik dan xilanolitik merupakan organisme yang penting dalam mendekomposisi bahan organik sisa-sisa tanaman yang mengandung lignoselulosa tinggi termasuk jerami padi. Penelitian ini bertujuan untuk mengisolasi bakteri selulolitik asal tanah pertanian di Jawa Barat dan Jawa Tengah serta mengkaji kemampuan bakteri selulolitik dan xilanolitik hasil seleksi (45I-3 dan 234P-16) dalam dekomposisi jerami padi. Metode penelitian ini meliputi isolasi dan seleksi bakteri yang memiliki kemampuan aktivitas selulolitik yang tinggi dengan melihat kemampuannya dalam mendegradasi substrat selulosa dan kemampuan tumbuh pada suhu tinggi (50 oC). Bakteri hasil seleksi kemudian diuji kemampuan dekomposisinya pada jerami padi selama 6 minggu. Empat kombinasi bakteri yang meliputi: C4-4 + Xilanolitik (A), C5-1 + Xilanolitik (B), C11-1 + Xilanolitik (C), 45I-3 + 234P-16 (D) serta kontrol (E, tanpa bakteri) digunakan sebagai kombinasi inokulan dalam dekomposisi jerami padi. Variabel pengamatan meliputi perubahan pH-H2O, suhu, C-organik, N-total, N-NH4+, rasio C/N, laju dekomposisi, bobot sisa substrat, kandungan hara makro-mikro serta kondisi fisik substrat.
Hasil isolasi dan seleksi diperoleh 3 isolat bakteri selulolitik yaitu C4-4, C5-1 dan C11-1 dari 31 isolat. Nilai pH-H2O perlakuan C4-4 + Xilanolitik (A) dan C5-1 + Xilanolitik (B) menunjukkan profil pH yang relatif stabil dari perlakuan lainnya. Rasio C/N semua perlakuan mengalami penurunan pada minggu ke-3 dekomposisi dengan nilai rasio C/N perlakuan A, B, C, D, dan E secara berturut-turut yaitu 22.484, 23.425, 27.494, 26.823, dan 29.525. Laju dekomposisi semua kombinasi perlakuan A, B, C, D menunjukkan hasil yang lebih cepat dibandingkan kontrol. Kandungan hara makro-mikro perlakuan A, B, C, D mengalami peningkatan pada akhir dekomposisi sedangkan pada kontrol tidak. Kondisi fisik substrat yang meliputi perubahan bentuk dan warna substrat memperlihatkan hasil yang lebih baik pada perlakuan A dan B dibandingkan yang lainnya. Dari hasil penelitian ini dapat disimpulkan bahwa kombinasi isolat bakteri C4-4 + Xilanolitik (A) dan C5-1 + Xilanolitik (B) merupakan kombinasi terbaik dalam dekomposisi jerami padi.
ABSTRACT
HASRUL SATRIA NUR. P055050011. Utilization of Potential Cellulolytic and Xilanolytic Bacteria for Decomposition of Rice Straw. Under the direction of ANJA MERYANDINI and HAMIM
The cellulolytic and xilanolytic bacteria are among organisms that is important to decompose organic matters from agriculture with higher lingo-cellulose compound such as rice straw. This research aims to isolate cellulolytic bacteria from agricultural soil in West and Central Java, and to study the cellulolytic and xilanolytic capacity of selected bacteria (45I-3 and 234P-16) to decompose rice straw. Method of this research comprised isolation and selection of cellulolytic bacteria which have a higher cellulolytic activity and was able to grow under higher temperature (50 oC). The selected bacteria than were analysed their ability to decompose rice straw for 6 weeks. Four combinations of bacteria including C4-4 + Xilanolytic (A), C5-1 + Xilanolytic (B), C11-1 + Xilanolytic (C), 45I-3 + 234P-16 (D), and control (without bacteria) were applied as inoculant of rice straw decomposition. The parameters analysed including the changes of pH-H2O, temperature, C-organic, total N and N-NH4+, decomposition rate, remaining weight, macro-micro nutrient content as well as physical properties of the substrate.
There were 3 prospective isolates of cellulolytic bacteria resulted from the total of 31 isolates we found, i.e. C4-4, C5-1, and C11-1. The pH-H2O value of C4-4 + Xilanolytic (A) and C5-1 + Xilanolytic (B) was relatively more stable. C/N ratio of all treatments decreased after 3 weeks incubation. The C/N ratio value of A, B, C, D and E treatments were 22.484, 23.425, 27.494, 26.823, and 29.525 respectively. Decompositon rate all of combination A, B, C, D treatments were quicker than the control. The content of macro-micro nutrient of A, B, C, D treatments increased in the end of measuremant, while the control didn’t. The physical characteristic of substrate including the shape and colour was better in A and B treatments that others. The result indicated that the combination of C4-4 + Xilanolytic (A) and C5-1 + Xilanolytic (B) bacteria was the best combination of cellulolytic and xilanolytic bacteria for decomposition of rice straw.
Limbah Pertanian
Nama
: Hasrul Satria Nur
NRP :
P055050011
Disetujui
Komisi Pembimbing
Dr. Anja Meryandini, MS
Ketua
Dr. Ir. Hamim, M.Si.
Anggota
Diketahui
Ketua Program Studi
Bioteknologi
Dr. Muhammad Jusuf, DEA
Dekan Sekolah Pascasarjana IPB
PEMANFAATAN BAKTERI SELULOLITIK DAN
XILANOLITIK YANG POTENSIAL UNTUK
DEKOMPOSISI JERAMI PADI
Hasrul Satria Nur
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Bioteknologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
2008
Judul Tesis : Pemanfaatan Bakteri Selulolitik dan Xilanolitik Yang Potensial Untuk Dekomposisi Jerami Padi
Nama : Hasrul Satria Nur
NRP : P055050011
Disetujui Komisi Pembimbing
Dr. Anja Meryandini, MS Ketua
Dr. Ir. Hamim, M.Si. Anggota
Diketahui
Ketua Program Studi Bioteknologi
Dr. Muhammad Jusuf, DEA
Dekan Sekolah Pasca Sarjana
Prof. Dr. Ir. Khairil A. Notodiputro, MS
© Hak cipta milik IPB, tahun 2008
Hak cipta dilindungi UU
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumber
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah
b. Pengutipan tidak merugikan kepentingan yang wajar IPB
2. Dilarang mengumumkan dan memperbanyak sebagian atau seluruh karya tulis dalam bentuk apapun tanpa izin IPB
Penulis dilahirkan di Krui Lampung Barat, putra ketiga dari enam bersaudara pasangan Chairullah AY dan Hasnawati. Pendidikan sekolah menengah atas penulis diselesaikan di SMA Negeri 3 Bandar Lampung. Tahun 1996 penulis melanjutkan studi S-1 pada Jurusan Biologi FMIPA Universitas Lampung (Unila) dan diselesaikan pada Juni 2001.
Penulis pada tahun 2001, pernah bekerja sebagai Ka Sie Quality Control
Pineapple Juice Concentrate pada PT Kencana Acidindo Perkasa Lampung. Dan
terhitung dari bulan Desember 2002-sekarang, penulis adalah staf pengajar pada Program Studi Biologi FMIPA Universitas Lambung Mangkurat (Unlam) Banjarbaru Kalimantan Selatan.
Tahun 2005 penulis melanjutkan studi S-2 pada Program Studi Bioteknologi Institut Pertanian Bogor (IPB) dengan Beasiswa BPPS dari Dirjen DIKTI DepDiknas Republik Indonesia.
PRAKATA
Syukur Alhamdulillah penulis panjatkan kehadirat Allah SWT yang telah memberikan rahmat dan karunia-Nya sehingga penulis dapat menyelesaikan penelitian dan penulisan Tesis yang berjudul ” Pemanfaatan Bakteri Selulolitik dan Xilanolitik Yang Potensial Untuk Dekomposisi Jerami Padi”.
Dalam pelaksanaan penelitian penulis mendapat banyak bantuan moral maupun materiil dan ucapan terima kasih penulis sampaikan kepada: Dr Anja Meryandini, MS., selaku ketua komisi pembimbing atas arahan dan bimbingan selama penelitian dan penulisan tesis. Dr.Ir. Hamim, M.Si., selaku anggota komisi pembimbing atas arahan dan koreksi dalam penulisan tesis. Dr.Ir. Titi Candra Sunarti, M.Si., selaku penguji luar komisi pada ujian tesis atas saran dan koreksi dalam penulisan.
Ungkapan terima kasih juga disampaikan kepada Ayahanda dan Ibunda tercinta yang senantiasa memberikan dukungan, kepercayaan, dan do’a yang tiada henti-hentinya demi kemajuan penulis. Kedua kakak yang kuhormati Nurul Zahrotun, S.Sos, Desven Forida, S.Sos., dan ketiga adikku yang kubanggakan Hendri Dunan, Husni Thamrin, SH serta Hadi Wijaya. Pamanda Mukri Rahmat, SH., Syahril dan Darwis R yang telah memberikan perhatian dan nasehatnya selama penulis berada di Bogor. Dan juga kepada teman-teman penelitian Bu It, Mbak Niken, Tri, Wahyu, Besti serta teman-teman Bioteknologi angkatan 2005. Staf teknisi Lab Mikrobiologi Mbak Heni, Pak Jaka, Pak Endang dan Bu Dewi di Lab Bioteknologi Hewan dan Biomedis PPSHB. Akhirnya penulis berharap laporan tesis ini dapat memberikan kontribusi dalam pengembangan IPTEKS, khususnya teknologi pengomposan.
Bogor, Februari 2008
DAFTAR TABEL··· VIII DAFTAR GAMBAR ··· IX DAFTAR LAMPIRAN... X I PENDAHULUAN ... 1 1.1 Latar Belakang ... 1 1.2 Tujuan Penelitian... 2 1.3 Hipotesa ... 2 II TINJAUAN PUSTAKA ... 3
2.1 Selulosa, Enzim Selulase, dan Mikroba Selulolitik ... 3
2.2 Xilan dan Xilanase... 6
2.3 Pengomposan ... 7
2.4 Rasio C/N (Karbon/Nitrogen)... 9
III BAHAN DAN METODE ... 11
3.1 Waktu dan Tempat ... 11
3.2 Alat dan Bahan ... 11
3.3 Metode Penelitian... 11
3.3.1 Isolasi dan seleksi bakteri selulolitik ... 11
3.3.2 Produksi selulase... 12
3.3.3 Pengujian aktivitas enzim ... 12
3.3.4 Produksi Streptomyces sebagai inokulan... 13
3.3.5 Dekomposisi substrat ... 13
3.3.7 Parameter dekomposisi ... 14
IV HASIL DAN PEMBAHASAN ... 16
4.1 Hasil... 16
4.1.1 Isolasi bakteri dan aktivitas selulase... 16
4.1.2 Perubahan pH-H2O dan kadar amonium substrat ... 17
4.1.3 Kandungan C-organik dan N-total ... 19
4.1.4 Rasio C/N dan suhu dekomposisi... 20
4.1.5 Laju dekomposisi dan bobot sisa substrat... 21
4.1.6 Kandungan Hara Makro-Mikro dan Kondisi Fisik Substrat ... 23
4.2 Pembahasan ... 24
V SIMPULAN DAN SARAN... 34
DAFTAR PUSTAKA ... 35
1 Nisbah selulolitik isolat bakteri C4-4, C5-1, dan C11-1 ... 16 2 Aktivitas selulase isolat bakteri C4-4, C5-1, dan C11-1 pada suhu 50 oC dan
pH 6.5 ... 17 3 Kandungan hara makro-mikro substrat selama dekomposisi... 24
DAFTAR GAMBAR
Halaman
1 Unit dasar dan struktur supramolekuler dari selulosa ... 3
2 Tahapan dalam proses pengomposan ... 8
3 Aktivitas selulolitik isolat bakteri C4-4, C5-1, dan C11-1 pada media carboxymethyl cellulose setelah inkubasi 48 jam pada suhu ruang ... 16
4 Profil derajat keasaman (pH) substrat selama dekomposisi ... 18
5 Profil kadar amonium (N-NH4+) substrat selama dekomposisi ... 18
6 Profil C-organik substrat selama dekomposisi ... 19
7 Profil N-total substrat selama dekomposisi ... 20
8 Profil nisbah C/N substrat selama dekomposisi ... 21
9 Profil suhu (oC) substrat selama dekomposisi ... 21
10 Laju dekomposisi substrat jerami padi pada akhir dekomposisi... 22
11 Konstanta dekomposisi substrat jerami padi pada akhir dekomposisi... 22
12 Bobot sisa substrat jerami padi pada akhir dekomposisi... 23
1 Sumber asal isolat-isolat bakteri selulolitik ... 42
2 Nisbah selulolitik isolat bakteri pada media agar-agar CMC setelah inkubasi 48 jam pada suhu ruang... 43
3 Hasil seleksi pertumbuhan isolat bakteri selulolitik pada suhu 50 oC selama 48 jam ... 43
4 Hasil pengukuran pH-H2O substrat selama dekomposisi... 44
5 Hasil pengukuran kadar amonium/NH4+ (ppm) substrat selama dekomposisi 45 6 Hasil pengukuran kandungan C-organik (%) substrat selama dekomposisi .. 46
7 Hasil pengukuran kandungan N-total (%) substrat selama dekomposisi ... 47
8 Hasil penentuan rasio C/N substrat selama dekomposisi ... 48
9 Hasil pengukuran suhu (oC) substrat selama dekomposisi ... 49
10 Hasil penentuan laju dekomposisi (R) substrat selama dekomposisi... 49
11 Hasil penentuan konstanta dekomposisi (k) substrat selama dekomposisi ... 50
I. PENDAHULUAN
1.1 Latar Belakang
Padi (Oryza sativa L.) adalah sumber karbohidrat utama bagi sebagian besar masyarakat Indonesia. Tanaman ini di satu sisi merupakan penopang dalam ketahanan pangan nasional, tetapi pada sisi lain produk samping dari tanaman padi belum termanfaatkan secara optimal, terlebih di kalangan petani itu sendiri. Hal ini dapat dilihat dari pola perilaku petani setelah pemanenan hasil, melakukan penanganan limbah pertanian dengan cara pembakaran. Proses secara in-situ dalam pembersihan lahan pasca panen seperti ini memberikan dampak negatif. Cara-cara penanganan tersebut masih sering dijumpai pada kalangan petani, disebabkan oleh metode yang cepat dan murah. Akan tetapi, praktek seperti ini memberikan efek hilangnya nutrien, nilai penting bahan organik, dan mengakibatkan polusi lingkungan (Mishra et al. 2001).
Kondisi ini membuat pemanfaatan limbah pertanian secara optimal menjadi penting, seperti halnya pemanfaatan jerami padi untuk mengembalikan kesuburan lahan. Jerami padi merupakan sumber pupuk organik yang penting bagi petani. Pemanfaatan limbah ini sejalan dengan upaya pemerintah terhadap pengembangan pertanian organik (Go Organic 2010) yang merupakan salah satu program untuk mempercepat terwujudnya pembangunan agribisnis berwawasan lingkungan dengan tujuan meningkatkan kesejahteraan masyarakat khususnya petani (Damardjati 2005). Disamping itu produk akhir dari dekomposisi yang berupa kompos, dapat memacu keberadaan plant growth promoting-rhizobacteria (PGPR) dengan tersedianya sumber karbon sebagai sumber energi. Keberadaan PGPR secara langsung meningkatkan pertumbuhan tanaman melalui beberapa mekanisme: fiksasi nitrogen atmosfer, produksi siderofor, pelarutan mineral-mineral, seperti fosfor dan sintesis fitohormon (Glick 1995). Oleh karenanya dekomposisi limbah merupakan topik yang menarik dikaji guna memahami rangkaian proses dalam mendapatkan produk pengomposan yang baik. Laju dekomposisi sangat tergantung pada kualitas substrat organik, kondisi lingkungan, sifat kimia substrat, dan aktivitas mikroorganisme (Xu dan Hirata 2005; Haraguchi et al. 2002).
Substrat organik sebagai material dasar dalam dekomposisi sangat tergantung pada struktur kimia penyusun. Dalam penelitian digunakan substrat dari
limbah padi yaitu jerami. Dalam 1 mm3 jerami padi terkandung C-organik 46.13%, N-total 0.52%, selulosa 32%, dan lignin13.3% (Nandi et al. 2000). Sementara itu, Mishara et al. (2001) menggunakan sampel jerami padi untuk studi dekomposisi dan mineralisasi C, N, P dan K pada tanah lahan perkebunan gandum. Pada jerami padi tersebut terkandung 42% C, 5.1% lignin, 40% selulosa , 22% hemiselulosa, 0.55% polifenol, 0.6% N, 0.1% P dan 1.3% K. Tingginya kandungan selulosa dan hemiselulosa pada substrat memberikan peluang untuk pemanfaatan bakteri selulolitik dan xilanolitik dalam upaya percepatan laju dekomposisi.
Penelitian diawali dengan isolasi dan seleksi bakteri selulolitik dari 28 sampel tanah pertanian di Jawa Barat dan Jawa Tengah. Berikutnya dalam penelitian diaplikasikan kemampuan interaksi enzim bakteri selulolitik dan xilanolitik dari isolat 45I-3 dan 234P-16 yang merupakan isolat terkarakterisasi (Meryandini 2005) dalam dekomposisi jerami padi.
1.2 Tujuan Penelitian
Penelitian ini bertujuan untuk mengisolasi bakteri selulolitik asal tanah pertanian di Jawa Barat dan Jawa Tengah serta mengkaji kemampuan bakteri selulolitik dan xilanolitik hasil seleksi (45I-3 dan 234P-16) dalam dekomposisi jerami padi.
1.3 Hipotesa
Hipotesa yang diajukan dalam penelitian adalah sebagai berikut:
Aplikasi semua bakteri selulolitik dan xilanolitik memberikan profil berbeda terhadap beberapa parameter dalam dekomposisi jerami padi.
II. TINJAUAN PUSTAKA
2.1 Selulosa, Enzim Selulase, dan Mikroba Selulolitik
Selulosa merupakan polimer glukosa linear yang seragam dengan ikatan β-1-4 glikosidik. Beberapa rantai molekul selulosa yang paralel dapat saling berikatan melalui ikatan hidrogen intermolekuler membentuk suatu mikrofibril. Beberapa mikrofibril kemudian membentuk fibril dan akhirnya menjadi serat selulosa yang bersifat tidak larut (Gambar 1).
(a) (b) (c) Gambar 1 Unit dasar dan struktur supramolekuler dari selulosa: (a) unit dasar
dengan ikatan β-(1-4)-glikosidik, (b) ikatan intramolekuler hidrogen dalam selulosa kristalin alami antara O-3-H dan O-5’, dan antara O-2-H dan O-6’, (c) Model fibril tepi dari struktur supramolekul selulosa (Klemm et al. 1998).
Setiap molekul selulosa tersusun atas unit-unit glukosa. diperkirakan mencapai lebih dari 10.000 unit. Pada kayu. fibril-fibril selulosa tersebut membentuk struktur kristal, terbungkus oleh lignin yang berfungsi sebagai pelindung selulosa. Sifat fisik dan kimia dari selulosa yang demikian menyebabkan selulosa berfungsi sebagai komponen struktural utama dinding sel tumbuhan (Knabner 2002).
Selulosa juga merupakan bagian terbesar dari komponen lignoselulosa tumbuhan. Kandungan selulosa tumbuhan tingkat tinggi tidak tetap, tetapi bervariasi menurut umur dan jenis tumbuhan. Konsentrasinya berkisar antara 15-45% dari bobot kering tumbuhan dan pada rerumputan yang masih muda kandungan selulosa relatif sedikit, berkisar 15% dari bobot kering tumbuhan (Hardjo et al. 1989).
Enzim selulase merupakan kelompok enzim yang mampu memutus ikatan β-1-4 glikosidik dalam molekul selulosa, selodekstrin, selobiosa, dan turunan selulosa.
Pada umumnya enzim ini diklasifikasikan menjadi tiga kelompok tergantung spesifisitas dalam menghidrolisa selulosa, yaitu endoglukanase (EC 3.2.1.4), eksoglukanase (EC 3.2.1.91), dan β-glukosidase (EC 3.2.1.21). Ketiga kelompok enzim ini bekerjasama menghidrolisa selulosa yang tidak dapat larut menjadi glukosa, sehingga aktivitas gabungan ketiga enzim ini dapat diukur dengan memantau jumlah glukosa yang dihasilkan.
Endoglukanase merupakan komponen selulase yang selalu ditemukan pada mikroorganisme selulolitik baik cendawan maupun bakteri. Enzim ini memiliki afinitas yang tinggi terhadap turunan selulosa tersebut dengan aksi endo dan bereaksi secara acak pada serat selulosa yang memiliki kristalinitas rendah. Enzim ini lebih dikenal dengan nama CMC-ase dikarenakan aktivitas yang tinggi pada substrat CMC. CMC-ase merupakan salah satu enzim dalam komplek selulase, menghasilkan selodekstrin, selobiosa, dan glukosa. Aktivitas enzim ini menyebabkan penurunan viskositas substrat yang dapat larut, karena itu pengukuran penurunan viskositas larutan CMC merupakan metode yang sering digunakan untuk menentukan aktivitas endoglukanase (Ilmen et al. 1997; Darwis et
al. 1997).
Eksoglukanase merupakan kelompok enzim yang lebih dikenal dengan selobiohidrolase. Enzim ini menghasilkan produk hidrolisa utamanya adalah selobiosa. Enzim ini bereaksi sebagai eksoenzim dan melepaskan selobiosa sebagai produk utama dari selulosa kristal. Enzim ini menghidrolisa selooligomer (selotetraosa dan seloheksosa) menjadi selobiosa tetapi tidak dapat menghidrolisa selobiosa. Umumnya bakteri hanya memiliki selobiohidrolase (eksoglukanase) yang mampu memecah selooligomer, pNPC atau phosphoric swoolen cellulose (Takasima et al. 1996).
β-glukosidase merupakan enzim hidrolitik bereaksi terhadap berbagai senyawa dengan ikatan β-D-glikosidik. Enzim ini tidak menghidrolisis CMC atau selulosa tetapi menghidrolisa selooligosakarida, pNPG, dan selobiosa menjadi glukosa yang merupakan sumber karbon yang dapat digunakan dengan mudah untuk pertumbuhan cendawan. Berdasarkan substrat yang dihidrolisa enzim ini dikelompokkan menjadi tiga jenis yaitu: selobiose, ekso-β-1.4 glukan-glukohidrolase, dan aril-β-glukosidase. Selobiase merupakan enzim yang dapat menghidrolisa
5
selobiosa menjadi glukosa, ekso-β-1.4-glukan–glukosidase adalah enzim yang dapat menghidrolisis p-nitrofenil-β-D-glukosida (Irawadi 1991).
Enzim selulase berperan penting dalam proses biodegradasi tumbuhan berlignoselulosa. Enzim ini dapat dihasilkan oleh cendawan dan bakteri selulolitik. Di bidang industri, enzim selulase telah ditemukan aplikasi terbarunya dalam produksi dan proses kimia makanan dan industri bahan seperti pabrik kertas rayon dan selopan. Selain itu enzim selulase telah dimanfaatkan secara intensif untuk ekstraksi komponen penting dari sel-sel tumbuhan, perbaikan nilai nutrisi pakan ternak, dan preparasi protoplas tumbuhan dalam bidang penelitian genetika (Kader
et al. 1999). Substrat selulosa di alam berada dalam bentuk kristalin dan amorf.
Mikroorganisme memproduksi banyak enzim untuk mendegradasi substrat, seperti untuk degradasi bahan-bahan sel tumbuhan. Sistem ini dikenal sebagai sistem enzim (Lynd et al. 2002). Berbeda hal nya substrat selulosa sintetik yang hanya dihidrolisis oleh satu tipe enzim selulase berikut ini: carboxymethyl cellulose dan
trinitrophenyl Cm-cellulose dihidrolisis oleh endoglukanase, methylumbelliferyl-β-D-cellobiose (MUC) dan p-nitrophenyl-β-D-cellobioside (pNPC) dihidrolisis oleh
eksoglukanase serta methylumbelliferyl-β-D-glycopyranaside (MUG) dan
p-nitrophenyl-β-D-glycopyranisede (pNPG) dihirolisis oleh β-glikosidase (Coral et al.
2002). Di samping itu beberapa kelompok bakteri selulolitik telah ditemukan berperan penting dalam degradasi limbah padat kota yaitu dari familia Bacillaceae dan beberapa genera Cellulomonas, Clostridium, Microbacterium, Eubacterium, dan
Lactobacillus (Pourcher et al. 2001).
Mikroba selulolitik seperti halnya bakteri dan cendawan menghasilkan seperangkat enzim yang menghidrolisa selulosa kristal secara sinergis menjadi oligosakarida yang lebih kecil dan akhirnya menjadi glukosa yang berfungsi sebagai sumber karbon dan unsur hara bagi pertumbuhan mikroba tersebut. Enzim yang berperan dalam proses hidrolisis tersebut adalah selulase yang dihasilkan mikroorganisme sebagai respon terhadap adanya selulosa pada lingkungan hidupnya dan proses tersebut berlangsung jika terjadi kontak antara enzim selulase dan permukaan selulosa. Selain berperan penting dalam perombakan karbon, mikroorganisme selulolitik juga ada yang mampu menyerang patogen tumbuhan atau cendawan antagonis (Ilmen et al. 1997).
Aktivitas mikroba selulolitik secara umum dipengaruhi oleh ketersediaan nitrogen, suhu, aerasi, kelembaban, pH, keberadaan karbohidrat, dan proporsi relatif lignin dalam residu. Pada pH rendah cendawan lebih berperan aktif dalam merombak selulosa dan prosesnya relatif lebih cepat pada kisaran pH 5.0.
Beberapa bakteri penghasil selulase termasuk dalam genus sebagai berikut:
Acetobacter, Bacillus, Cellulomonas, Cythopaga, Pseudomonas, Sarcina, dan Vibrio.
Beberapa hasil penelitian menunjukkan beberapa bakteri yang dapat digunakan untuk menghasilkan enzim selulase antara lain: Pseudomonas flurescent var
cellulose, Cellulomonas fimi, Bacillus subtilis, Clostridium thermocellum, Acetobacter xylinum (Heck et al. 2002).
2.2 Xilan dan Xilanase
Xilan merupakan komplek heteropolisakarida yang terdiri atas tulang punggung residu xilosa dihubungkan oleh ikatan β-1.4 glikosidik. Xilan terikat secara kovalen pada lignin dan melalui ikatan hidrogen pada selulosa. Xilan dapat dibedakan menjadi homoxilan linier, arabinoxilan, glukoronoxilan. Selain xilosa, xilan juga dapat mengandung arabinosa, asam glukoronat, asam asetat, asam ferulat, dan asam ρ-koumarat sebagai rantai samping (Beg et al. 2001; Saha 2003).
Xilan adalah komponen utama penyusun polisakarida hemiselulosa, pada tumbuhan kandungannya mencapai sekitar 30-35% berat kering total. Xilan dari rumput-rumputan, sereal, kayu keras, dan lunak berbeda dalam komposisi.
Birchwood xylan tersusun oleh 89.3% xilosa, 1% arabinosa, 1.4% glukosa, dan 8.3%
asam anhidrouronik. Rice bran xylan mengandung 46% xilosa, 44.9% arabinosa, 6.1% galaktosa, 1.9% glukosa, dan 1.1% asam anhidrounik. Wheat arabino xylan tersusun oleh 65.8% xilosa, 33.5% arabinosa, 0.1% manosa, 0.1% galaktosa, dan 0.3% glukosa. Corn fiber xylan adalah salah satu komplek heteroxilan yang terdiri atas ikatan (1.4) residu xilosa dengan komposisi 48-58% xilosa, 33-35% arabinosa, 5-11% galaktosa, dan 3-6% asam glukoronat (Saha 2003).
Hidrolisis xilan diperlukan beberapa enzim berbeda yaitu endo-1.4-β-xilanase yang menghidrolisis struktur dasar xilan secara acak menjadi xilooligosakarida, 1.4-β-D- xilosidase yang memutus xilooligosakarida menjadi xilosa. Gugus penyusun samping xilan akan dibebaskan oleh α-L-arabinofuranosidase, α-D-glukorodase, dan
7
asetil xilan esterase menjadi arabinosa, glukuronat, dan asetat (Subraminayan dan Prema 2002).
Enzim endo-β-xilanase (EC.3.2.1.8) sebagian besar dihasilkan oleh mikroba seperti bakteri, cendawan, dan beberapa diantaranya berasal dari hewan. Endoxilanase mampu memutus ikatan β-1-4 pada bagian dalam rantai xilan secara teratur. Enzim β-xilosidase (EC.3.2.1.37) menghidrolisis 1.4-β-xilooligosakarida dari ujung non–pereduksi dan melepaskan xilosa. Xilosa selain merupakan hasil hidrolisis juga merupakan inhibitor bagi enzim β-xilosidase. Sebagian besar enzim β-xilosidase yang berhasil dimurnikan masih menunjukkan adanya aktivitas transferase yang menyebabkan enzim ini kurang dapat digunakan dalam industri penghasil xilosa (Richana 2002). Enzim α-L-arabinofuranosidase (EC.3.2.1.55) menghidrolisis ujung non-pereduksi antara ikatan α-L-arabinofuranosida dengan berbagai polisakarida yang mengandung arabinofuranosa (Debeche et al. 2002). Enzim ini merupakan bagian dari glikosida hidrolase yang berperan dalam proses degradasi hemiselulosa seperti arabinoxilan, arabinogalaktan, dan L-arabinan. Adanya substituen L-arabinofuranosida dalam struktur xilan dapat secara kuat menghambat aktivitas endo-xilanase dan β-xilosidase yang berakibat menghalangi degradasi total dari polimer xilan (Shallom et al. 2002).
Beberapa hasil penelitian melaporkan bahwa xilanase juga bermanfaat untuk biokonversi limbah pertanian terutama untuk hidrolisis xilan menjadi xilooligosakarida dan hidrolisis xilooligosakarida menjadi xilosa (Vasquez et al. 2000).
2.3 Pengomposan
Pengomposan adalah dekomposisi oksidatif-biologi dari penyusun bahan– bahan organik dalam limbah di bawah keadaan yang terkendali (Sharma et al. 1997). Sebagai sebuah proses biologi, pengomposan memerlukan keadaan yang khusus seperti suhu, kelembaban, aerasi, pH, dan rasio C/N. Produk utama dari pengomposan secara aerobik adalah CO2, air, ion mineral, dan bahan organik stabil yang sering disebut humus. Proses pengomposan sendiri meliputi tiga proses berbeda yaitu proses awal dimana komponen-komponen yang mudah terdegradasi didekomposisi, kemudian fase termofilik yaitu fase dimana bahan-bahan seperti selulosa didegradasi melalui aktivitas oksidasi mikroorganisme, dan terakhir adalah
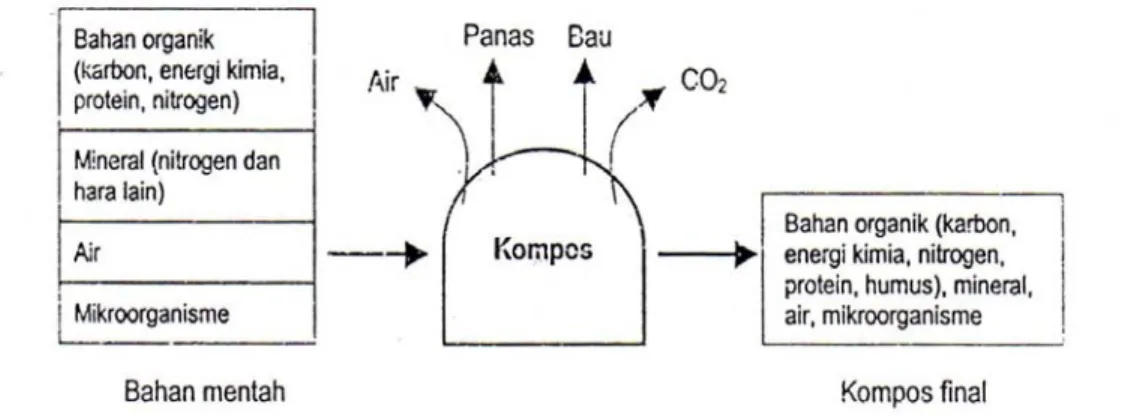
fase maturasi dan stabilisasi. Pengomposan merupakan proses komplek, melibatkan bahan-bahan organik, organisme (mikroba), faktor fisik (lingkungan) sehingga terjadi proses transformasi kimia, biologi, dan fisik di bawah keadaan lingkungan yang berubah dengan hasil akhir kompos (Gambar 2).
mbar 1. Tahapan dalam proses pengomposan (Rynks et al 1992).
Gambar 2 Tahapan dalam proses pengomposan (Rynks et al. 1992).
Limbah organik pertanian dalam jumlah besar merupakan bahan pokok pengomposan sekaligus sebagai sumber pupuk organik potensial (Pramono et al. 2003).
Salah satu indikator pengomposan adalah munculnya suhu termofil pada bahan organik yang sedang dikomposkan. Dengan suhu antara 65-70 oC sudah dianggap cukup untuk mensterilisasi bahan yang dikomposkan. Berbagai bibit penyakit dapat dimatikan selama proses berlangsung sehingga hasil akhir yang diperoleh adalah kompos higienis, jika diaplikasikan di lapangan tidak akan memberikan dampak merugikan bagi lingkungan. Oleh karena itu sangat penting mengetahui perbedaan kompos muda (belum matang) dan kompos matang. Untuk kompos muda sebagian kompos masih bersifat fitotoksik. Humifikasi bahan organik yang tidak lengkap menghasilkan molekul-molekul intermediat yang masih bersifat racun bagi tumbuhan dan menyebabkan terjadinya kekurangan nitrogen.
Fungsi kompos sebagai amandemen tanah adalah mirip pupuk kimia yaitu memperkaya tanah akan N, P, K namun pengaruh prinsipnya adalah untuk merangsang stabilisasi fisik, biologi, kimia tanah, dan keseimbangan elemen-elemen mineral. Humus adalah produk akhir humifikasi di mana senyawa-senyawa yang berasal dari lignin, polisakarida, senyawa-senyawa nitrogen diubah menjadi bahan-bahan stabil (Tuomela et al. 2000).
9
Faktor-faktor yang mempengaruhi laju pengomposan adalah sebagai berikut: 1) Ukuran bahan yang dikomposkan, semakin kecil partikel maka semakin banyak jumlahnya dan semakin luas pula jumlah permukaan yang dicerna oleh mikroorganisme. 2) Suhu dan tinggi tumpukan, metabolisme mikroorganisme dalam tumpukan menimbulkan energi dalam bentuk panas. Panas yang terperangkap di dalam tumpukan akan meningkatkan suhu tumpukan. 3) Ketersediaan oksigen dan pembalikan, kadar oksigen ideal adalah 10%-18%, kekurangan oksigen mengakibatkan mikroorganisme aerobik mati dan akan tergantikan oleh mikroorgaisme anaerobik. Aerasi sangat diperlukan untuk mengurangi kadar air yang tinggi pada bahan organik yang akan dikomposkan dan untuk menjaga agar pada proses pengomposan selalu ada udara segar dan kondisi anaerob dapat dihindari. 4) Rasio karbon-nitrogen (C/N), digunakan untuk mendapatkan degradasi biologis dari bahan-bahan organik yaitu apakah limbah tersebut baik atau tidak untuk dijadikan kompos serta untuk menunjukkan umur dan kematangan kompos. 5) Kadar air dan udara pada tumpukan kompos, kadar air atau kelembaban ideal adalah antara 40%-60% dengan kadar terbaik adalah 50%. Kisaran tersebut harus dipertahankan untuk memperoleh jumlah populasi mikroorganisme terbesar karena semakin besar populasinya maka makin cepat proses dekomposisi. 6) Derajat keasaman, pada awal proses pengomposan derajat keasaman akan selalu turun karena sejumlah mikroba akan mengubah sampah organik menjadi asam organik. pH ideal dalam proses pengomposan adalah antara 6-8 dengan tingkat masih diterima adalah pH 5.0 (Rochaeni et al. 2003).
2.4 Rasio C/N (Karbon/Nitrogen)
Rasio karbon-nitrogen bahan organik merupakan faktor yang sangat penting dalam percepatan pengomposan. Transformasi bahan organik untuk pupuk yang melibatkan aktivitas mikroorganisme sangat tergantung pada kadar karbon dan nitrogen yang terdapat di dalam bahan. Rasio karbon nitrogen optimal untuk proses pengomposan yaitu berkisar antara 30-40, tetapi proses pengomposan dapat berlangsung lebih baik jika rasio karbon nitrogen antara 25-35. Rasio C/N optimum untuk pengomposan adalah 30-35, mikroorganisme menggunakan 30 bagian karbon untuk setiap bagian nitrogen. Rasio C/N setelah menjadi kompos adalah 10-20 (Rochaeni et al. 2003).
Bahan organik dengan rasio C/N tinggi akan menurunkan aktivitas biologi mikroba yang terlibat. Beberapa siklus aktivitas mikroba dapat terjadi untuk mendegradasi bahan yang mengandung karbon. Nitrogen yang telah dimobilisasi akan didaur ulang yaitu dengan matinya beberapa mikroba untuk mereduksi kandungan karbon pada residu-residu organik. Oleh karena itu, proses dekomposisi yang sempurna akan berlangsung dalam waktu lama. Secara umum semakin tinggi rasio C/N dari bahan organik maka semakin lambat proses dekomposisi. Sebaliknya dalam kondisi nisbah C/N rendah walaupun proses dekomposisi berlangsung, beberapa nitrogen yang tidak dapat diasimilasi akan hilang akibat proses volatilisasi sebagai amoniak atau denitrifikasi. Pada kondisi nilai C/N rendah dan kondisi yang sesuai, amoniak akan dioksidasi lebih lanjut menjadi nitrit dan nitrat. Selama pengomposan akan terjadi penurunan nilai nisbah C/N akibat terbentuknya CO2, sementara nilai N cenderung konstan (Dalzel et al. 1987).
III. BAHAN DAN METODE
3.1 Waktu dan Tempat
Penelitian ini berlangsung dari bulan September 2006 hingga bulan September 2007. Pelaksanaan penelitian ini bertempat di Laboratorium Mikrobiologi, Laboratorium Biologi Tanah Faperta, Laboratorium Bioteknologi Hewan dan Biomedis PPSHB, dan Rumah pengomposan Cikabayan, Departemen Biologi FMIPA IPB, Bogor.
3.2 Alat dan Bahan
Peralatan yang dipergunakan dalam penelitian ini meliputi peralatan dalam isolasi bakteri selulolitik, produksi enzim selulase, xilanase, pengomposan, analisa kandungan karbon organik, nitrogen (N-total dan N-NH4), unsur hara makro dan mikro, suhu, pH-H2O serta oven untuk penentuan bobot sisa, laju dekomposisi (R).
Bahan yang digunakan dalam penelitian ini adalah sampel tanah, jerami padi, media CMC, avicel, kertas saring Whatman No.1, NaCl 2.0 M, merah kongo 0.1%, media xilan 0.75%, asam dinitro salisilat (DNS), glukosa, bufer fosfat pH 6.5, dan bahan dalam analisa C organik, N-total, N-NH4+, pH-H2O, hara makro-mikro serta penentuan laju dekomposisi.
3.3. Metode Penelitian
3.3.1 Isolasi dan seleksi bakteri selulolitik
Bakteri selulolitik diisolasi dari lahan pertanian di daerah Jawa Barat dan Jawa Tengah (Lampiran 1). Metode pengambilan sampel tanah dilakukan dengan cara mengambil sampel tanah pada ke dalaman 10-20 cm. Sampel tanah yang diambil merupakan sampel komposit, kemudian dimasukan dalam wadah plastik gelap berlabel. Isolasi bakteri selulolitik dilakukan dengan cara membuat serangkaian pengenceran dari sampel tanah. Dari pengenceran berseri tersebut dilakukan metode cawan sebar pada media agar-agar CMC. Koloni-koloni yang ditumbuhkan selama 24-48 jam pada suhu 30 oC dimurnikan.
Terhadap biakan murni yang diperoleh dilakukan uji kualitatif aktivitas selulolitik dengan cara melihat kemampuan pembentukan zona jernih. Dari
masing-masing isolat yang membentuk zona jernih juga diukur nisbah selulolitik dengan rumus perhitungan:
R = diameter zona – diameter koloni diameter koloni
Hasil isolat bakteri selulotik yang menunjukkan nilai nisbah terbesar dilanjutkan dengan uji aktivitas kemampuan produksi enzim selulase pada tiga substrat selulosa berbeda untuk melihat kompleksitas isolat bakteri dalam degradasi substrat selulosa. Isolat-isolat yang memiliki kemampuan degradasi baik dilakukan peremajaan pada media agar miring untuk aplikasi lebih lanjut (Cappucino dan Sherman 2001).
3.3.2 Produksi selulase
Isolat bakteri selulase potensial ditumbuhkan pada media agar-agar CMC dengan komposisi per liter: CMC 10 g, CaCl2 0.04 g, FeSO4.7H2O 0.02 g, glukosa 0.1%, KNO3 0.11 g, K2HPO4 0.02 g, ekstrak khamir 2.0 g, agar-agar 1.5%. Pengkulturan isolat dilakukan selama 48 jam pada suhu 30 oC. Sebanyak 1-2 loop bakteri diinokulasi dalam 100 ml media CMC cair selama 5 sampai 7 hari pada suhu ruang. Hasil kultur disentrifugasi pada kecepatan 12298 x g selama 15 menit untuk memperoleh ekstrak kasar untuk analisa aktivitas enzim selulase (Heck et al. 2002).
3.3.3 Pengujian aktivitas enzim
Aktivitas selulase dilakukan pada ketiga jenis enzim yaitu aktivitas CMC-ase, avicelase, FP-ase. Aktivitas CMC-ase diukur dengan cara menambahkan larutan enzim sebanyak 1 ml dalam 1 ml substrat CMC 1.0% dalam bufer fosfat 0.2 M pH 6.5. Penentuan aktivitas avicelase dilakukan dengan cara menambahkan larutan enzim sebanyak 2 ml dalam 2 ml substrat avicel dalam bufer fosfat 0,2 M pH 6.5. FP-ase ditentukan dengan menambahkan sebanyak 1 ml larutan enzim ke dalam 0.5 g kertas saring Whatman No.1 (1 x 6 cm2) dalam bufer fosfat pH 6.5. Inkubasi dilakukan pada suhu 50 oC selama 60 menit (Silva et al. 2005; Alam et al. 2004).
Jumlah gula yang diproduksi dalam supernatan ditentukan dengan metode asam dinitro salisilat (DNS) dengan glukosa sebagai standar (Miller 1959). Aktivitas selulase dinyatakan sebagai jumlah glukosa yang dilepas dalam µg ml-1 dari enzim kasar/menit (U ml-1). Pengukuran aktivitas masing-masing larutan diukur
13
menggunakan spektrofotometer pada λ = 540 nm. Perhitungan aktivitas selulase dihitung berdasarkan rumus:
Aktivitas selulase (U/ml) = (CX sampel – CX kontrol) x Fp x 1000 berat molekul glukosa x waktu
Keterangan : CX = kadar selulosa dan FP = faktor pengenceran
3.3.4 Produksi Streptomyces sebagai inokulan
Isolat Streptomyces sp 234P-16 dan 45I-3 diremajakan dalam media agar xilan (ekstrak khamir 1.0%, sukrosa 10.3%, dan 0.5% birchwood xylan, agar-agar 1.5%), inkubasi dilakukan selama 7-14 hari pada suhu 30 oC sampai terbentuk spora. Sebanyak 2 loop (berdiameter 1 cm) kultur Streptomyces sp 234P-16 dan 45I-3 diinokulasikan ke dalam 100 ml media cair xilan dalam Erlenmenyer 500 ml. Inkubasi dilakukan pada inkubator bergoyang dengan agitasi 150 rpm pada suhu 30 oC selama 5 hari (Fahrurrozi 2007; Prihandono 2007).
3.3.5 Dekomposisi substrat
Substrat yang digunakan adalah jerami padi. Preparasi substrat dilakukan dengan mencacah bagian batang dan daun yang segar dengan ukuran 2-5 cm (Mishra et al. 2001; Devevre dan Horwath 2000). Kemudian substrat dimasukkan dalam kantong plastik dan disterilisasi menggunakan otoklaf pada suhu 121 oC selama 30 menit. Banyaknya substrat yang digunakan adalah 3.0 kg/sampel. Empat kombinasi isolat bakteri yang meliputi: C4-4 + xilanolitik (A), C5-1 + xilanolitik (B), C11-1 + xilanolitik (C), 45I-3 + 234P-16 (D) serta kontrol (E, tanpa bakteri) digunakan sebagai kombinasi inokulan dalam dekomposisi jerami padi. Dekomposisi substrat dilakukan selama 6 minggu. Pengukuran parameter dekomposisi dilakukan dalam selang waktu (0, 1, 2, 3, 4, 5, dan 6 minggu).
3.3.6 Pengukuran C-organik dan N-total substrat
Kandungan C organik substrat diukur menggunakan metode Walkey dan Black dengan cara sebagai berikut: sebanyak 1.0 g substrat kering udara dimasukkan dalam labu ukur 100 ml dan ditambahkan 10 ml K2Cr2O7 1.0 N serta H2SO4 pekat. Pengocokan larutan dilakukan diatas kain flanel yang sedikit basah dan lunak selama 10 menit, jika warna larutan masih hijau ditambahkan lagi larutan
K2Cr2O7 dan H2SO4 pekat serta dicatat banyaknya penambahan. Pendinginan dilakukan sebelum ditepatkan dengan akuades dan dikocok kembali serta didiamkan selama 24 jam.
Cairan yang jernih dipipet sebanyak 10 ml dan dimasukkan ke dalam Erlenmenyer 50 ml, ditambahkan 1 ml H3PO4 pekat dan 2-3 tetes indikator difenilamin. Titrasi larutan menggunakan FeSO4.7H2O sebagai standar demikian pula halnya terhadap blanko (Teklay dan Malmer 2004; Nelson dan Sommers 1982). Kandungan C-organik substrat dihitung menggunakan rumus perhitungan sebagai berikut:
% C-organik = ( vol sampel – vol blanko) x 100 x 12 x 100 x 100 % berat substrat (g) 10 4 77
Penetapan N-total substrat menggunakan metode Mikro Kjeldahl dengan cara memasukan sebanyak 1.0 g substrat ke dalam labu Kjeldahl. Ke dalam labu tersebut ditambahkan 0.5–1.0 g katalis campuran selenium dan 3-5 ml H2SO4 pekat. Larutan dipanaskan sampai seluruhnya terdenaturasi (± 2 jam), kemudian didinginkan serta ditambahkan akuades hingga volume menjadi 100 ml.
Larutan dipipet sebanyak 10 ml dan dimasukkan ke dalam labu distilasi serta ditambahkan NaOH 40%. Larutan penampung yang terdiri atas 15 ml larutan H3BO3 2.0% dan 3-5 tetes indikator campuran dalam labu Erlenmenyer 100 ml, diusahakan supaya tidak ada gas yang keluar. Distilasi dihentikan apabila larutan penampung sudah menunjukkan warna hijau (sekitar 15 menit). Larutan dititrasi dengan H2SO4 standar dan dicatat volume titernya, demikian halnya terhadap perlakuan blanko (Tores et al. 2005; AOAC 1984). Kandungan N-total substrat dihitung menggunakan rumus perhitungan sebagai berikut:
% N = 100/10 x (ml sampel – ml blanko) x 0,014 x 100 % berat substrat (g)
3.3.7 Parameter Dekomposisi
Beberapa parameter yang diamati dalam menilai dekomposisi substrat yang berasal dari jerami padi yaitu nisbah C/N, berat sisa substrat, dan laju dekomposisi. Berat sisa substrat di estimasi dengan persamaan sebagai berikut :
Berat sisa (%) = (Wi – Wd)/Wi x 100
15
Perhitungan terhadap laju dekomposisi (R) dan konstanta (k) di hitung berdasarkan rumus (Sangha et al. 2006; Fioretto et al. 2005; Uchida et al. 2005):
R = Xo – Xt Xt x t
Ln (Xt/X0 = -k t
Keterangan: Xo = massa awal substrat (g) Xt = massa tersisa substrat (g)
t = waktu (bulan) k = laju dekomposisi (Fioretto et al. 2005; Uchida et al. 2005).
Peubah-peubah yang diamati dalam dekomposisi substrat jerami padi dengan menggunakan bakteri selulolitik dan xilanolitik sebagai berikut: pengamatan harian meliputi perubahan suhu yang diukur pada siang hari dengan termometer. Pada minggu ke-0, 1, 2, 3, 4, 5, dan 6 dilakukan analisa terhadap kadar C-organik dengan metode Walkey dan Black, N-total dan N-NH4 dengan metode Mikro Kjeldahl, dan pH-H2O dengan pH meter.
Analisa akhir dilakukan untuk menilai kematangan substrat yang meliputi pengukuran unsur hara makro dan mikro (N, P, K, Ca, Mg, Fe, Cu, Zn, dan Mn). Terhadap unsur Ca, Mg, Fe, Cu dan Mn ditentukan dengan AAS (Atomic Absorption Spectroscopy), K menggunakan flame fotometer dan P dengan metode spektrofotometer. Penentuan berat sisa, laju dekomposisi serta kondisi fisik substrat yang terjadi ditentukan pada akhir dekomposisi.
4.1 HASIL
4.1.1 Isolasi Bakteri dan Aktivitas Selulase
Seleksi bakteri selulolitik dari lahan pertanian di Jawa Barat dan Jawa Tengah menghasilkan tiga isolat terpilih dari 31 isolat yang diperoleh dengan melihat rasio selulolitik yaitu C4-4, C5-1 dan C11-1 (Lampiran 2). Disamping itu juga isolat ini telah diuji pertumbuhannya pada suhu 50 oC dengan hasil pertumbuhan positif (Lampiran 3). Ketiga isolat terpilih diuji aktivitas selulolitiknya pada media
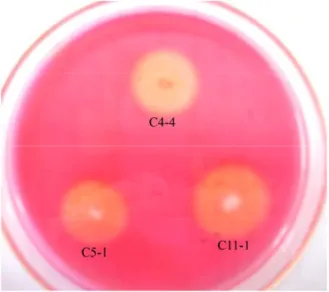
carboxymethyl cellulose pada inkubasi 48 jam. Aktivitas selulolitik ketiga isolat
disajikan pada (Gambar 3 dan Tabe 1).
Gambar 3 Aktivitas selulolitik isolat bakteri C4-4, C5-1, dan C11-1 pada media
carboxymethyl cellulose setelah inkubasi 48 jam pada suhu ruang.
Tabel 1 Nisbah selulolitik isolat bakteri C4-4, C5-1, dan C11-1 Isolat Diameter koloni (cm) Diameter zona bening (cm) Indek selulolitik C4-4 0.3 1.2 3.0 C5-1 0.2 1.3 5.5 C11-1 0.5 1.6 2.2
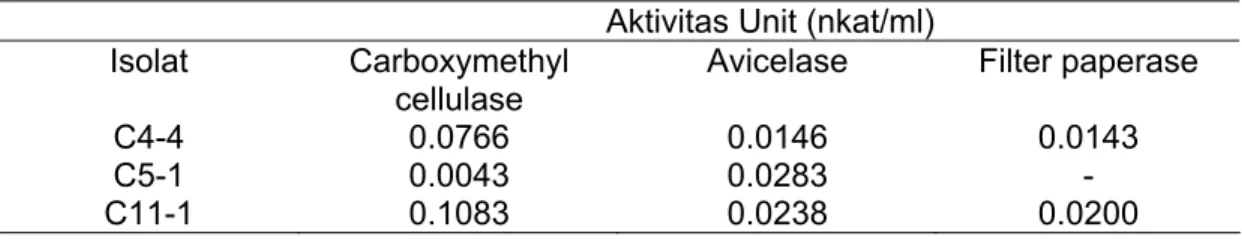
17
Isolat bakteri C4-4, C5-1 dan C11-1 diuji aktivitas selulasenya pada substrat selulosa berbeda yaitu carboxymethyl cellulose, avicelase dan filter paperase. Hasil pengukuran aktivitas enzim selulase disajikan pada (Tabel 2). Satu unit aktivitas selulase didefinisikan sebagai jumlah enzim yang menghasilkan 1 µmol glukosa dalam satu menit. Aktivitas enzim dalam tabel dinyatakan dalam satuan nkat/ml. Dybaker (2001) menyatakan bahwa 1 U = 1 µmol/min ≈ 16,67 nkat.
Tabel 2. Aktivitas selulase isolat bakteri C4-4, C5-1, dan C11-1 pada suhu 50 oC dan pH 6,5
Aktivitas Unit (nkat/ml) Isolat Carboxymethyl
cellulase
Avicelase Filter paperase C4-4 0.0766 0.0146 0.0143 C5-1 0.0043 0.0283 - C11-1 0.1083 0.0238 0.0200
4.1.2 Perubahan pH-H2O dan Kadar Amonium Substrat (NH4+)
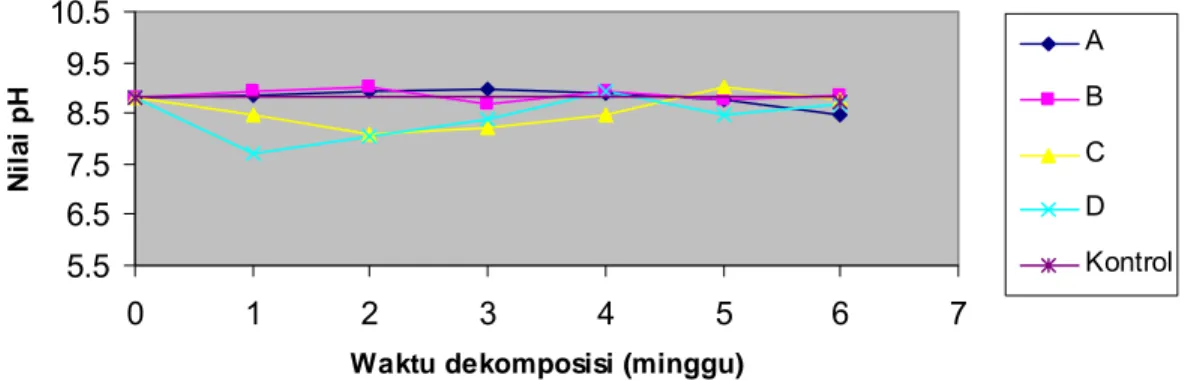
Nilai derajat keasaman (pH) substrat selama dekomposisi berlangsung menunjukkan profil berbeda. Profil pH perlakuan A mencapai puncak pada minggu ke-3 (8.89), B tercapai minggu ke-2 (9.01), C terjadi minggu ke-5 (9.00), dan D dengan nilai pH 8.94 minggu ke-4 (Gambar 4 dan Lampiran 4).
Perubahan pH cenderung menurun di akhir dekomposisi minggu ke-6, dengan penurunan derajat keasaman dari perlakuan A (8.45), B (8.85), C (8.74), D (8.66), dan 8.74 untuk pH kontrol. Dari hasil ini terlihat bahwa masing-masing perlakuan yang dalam penyebutan berikutnya menggunakan sebutan sebagai berikut: C4-4 + xilanolitik (A), C5-1 + xilanolitik, dan C11-1 + xilanolitik memperlihatkan karakteristik pH berbeda. Perlakuan A dan B pada minggu pertama dekomposisi langsung menunjukkan peningkatan nilai derajat keasaman dan terhadap waktu dekomposisi berikutnya penurunan relatif konstan. Akan tetapi, perlakuan C pada awal dekomposisi juga menunjukkan peningkatan dan selanjutnya menurun, sedangkan perlakuan D di awal dekomposisi mengalami penurunan dan berikutnya nilai pH naik secara perlahan. Hasil ini menunjukkan bahwa semua perlakuan inokulan bakteri selulolitik dan xilanolitik dalam dekomposisi mempunyai kisaran pH dalam suasana alkalin. Hal ini terlihat di akhir dekomposisi semua perlakuan memiliki nilai kisaran pH dari 8.45 – 8.74.
5.5 6.5 7.5 8.5 9.5 10.5 0 1 2 3 4 5 6 7
Waktu dekomposisi (minggu)
Ni la i p H A B C D Kontrol
Gambar 4 Profil derajat keasaman (pH) substrat selama dekomposisi. Perlakuan A adalah kombinasi isolat bakteri selulolitik C4-4 + xilanolitik; B = C5-1 + xilanolitik; C = C11-1 + xilanolitik dan D = xilanolitik.
Hasil pengukuran kadar amonium (N-NH4+) selama enam minggu dekomposisi substrat jerami padi memperlihatkan pola perubahan amonium dari setiap kombinasi perlakuan. Nilai N-NH4+ perlakuan A mencapai maksimum minggu ke-3 sebesar 393.53 ppm, B minggu ke-1 535.63 ppm, C 338.10 ppm dan D 509.25 ppm di minggu ke-3 dekomposisi (Gambar 5 dan Lampiran 5). Penurunan amonium masing-masing perlakuan berlangsung di minggu ke-3 dan ke-4 dekomposisi. Hal ini ditunjukkan besarnya penurunan N-NH4+ setiap perlakuan. Pada perlakuan A, C, dan D berlangsung pada minggu ke-4 yaitu 338.10 ppm, 264.60 ppm, dan 294.00 ppm, sedangkan perlakuan B kadar amonium mengalami penurunan 338.10 ppm.
50 150 250 350 450 550 650 0 1 2 3 4 5 6 7
Waktu dekomposisi (minggu)
N-NH 4 + (ppm ) A B C D Kontrol
Gambar 5 Profil kadar amonium (N-NH4+) substrat selama dekomposi. Perlakuan A adalah kombinasi isolat bakteri selulolitik C4-4 + xilanolitik; B = C5-1 + xilanolitik; C = C11-1 + xilanolitik dan D = xilanolitik.
19
4.1.3 Kandungan C-organik dan N-total
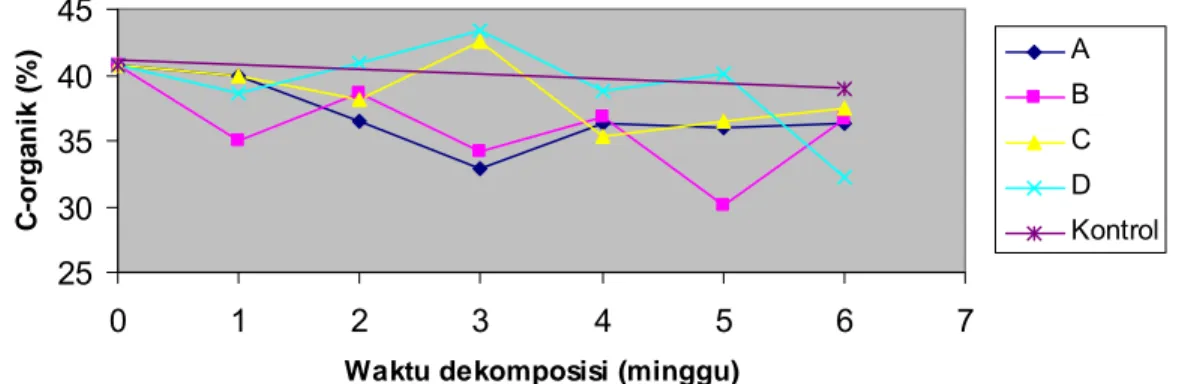
C-organik substrat mengalami penurunan selama dekomposisi berlangsung. Nilai C-organik pada substrat jerami padi yang mendapat perlakuan kombinasi isolat C4-4 + xilanolitik (A) yaitu sebesar 39.91% minggu ke-1, mengalami penurunan minggu ke-3 dekomposisi dan untuk tahap selanjutnya nilai C-organik pada perlakuan A relatif stabil hingga akhir proses. Perlakuan C5-1 + xilanolitik (B) kandungan C-organik meningkat minggu ke-2 (38.58%) dan mengalami penurunan sebesar 30.13% minggu ke-5. Demikian halnya terhadap perlakuan C11-1 + xilanolitik (C), dan 45I3+234P-16 (D) juga mengalami peningkatan C-organik minggu ke-3 sebesar 42.53% dan 43.38%, selanjutnya mengalami penurunan (Gambar 6 dan Lampiran 6). 25 30 35 40 45 0 1 2 3 4 5 6 7
Waktu dekomposisi (minggu)
C -org a ni k ( % ) A B C D Kontrol
Gambar 6 Profil C-organik substrat selama dekomposisi. Perlakuan A adalah kombinasi isolat bakteri selulolitik C4-4 + xilanolitik; B = C5-1 + xilanolitik; C = C11-1 + xilanolitik dan D = xilanolitik.
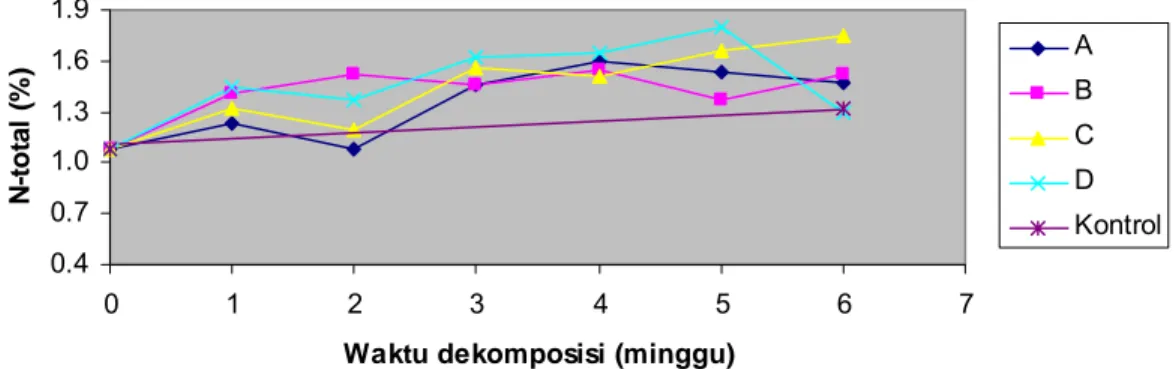
Nilai N-total masing-masing kombinasi inokulan selama dekomposisi cenderung bervariasi. Hal ini digambarkan dari perlakuan C4-4 + xilanolitik (A) dan C5-1 + xilanolitik (B) dengan penurunan N-total setelah minggu ke-4 sebesar 1.53% dan 1.37%. Pada perlakuan C11-1 + xilanolitik (C) kandungan N-total meningkat hingga akhir dekomposisi 1.75%, tetapi pada 45I3+234P-16 (D) kandungan N-total mengalami penurunan pada akhir dekomposisi dengan konsentrasi N-total 1.29 % (Gambar 7 dan Lampiran 7).
0.4 0.7 1.0 1.3 1.6 1.9 0 1 2 3 4 5 6 7
Waktu dekomposisi (minggu)
N -to ta l (% ) A B C D Kontrol
Gambar 7 Profil N-total substrat selama dekomposisi. Perlakuan A adalah kombinasi isolat bakteri selulolitik C4-4 + xilanolitik; B = C5-1 + xilanolitik; C = C11-1 + xilanolitik dan D = xilanolitik.
4.1.4 Rasio C/N dan Suhu Dekomposisi
Nisbah C/N substrat selama 6 minggu aplikasi menunjukkan pola penurunan setelah minggu kedua. Nilai rasio C/N dari perlakuan C4-4 + xilanolitik (A) mencapai puncak minggu ke-2 sebesar 35.584, C5-1 + xilanolitik (B) minggu ke-1 26,516, C11-1 + xilanolitik (C) 3C11-1.995 minggu ke-2 dan 45I3+234P-C11-16 (D) 29.900 di minggu ke-2. Penurunan nilai rasio C/N semua perlakuan terjadi pada minggu ke-3 dekomposisi. Hal ini terlihat dari penurunan nisbah C/N dari perlakuan A, B, C, D menjadi berturut-turut 22.484, 23.425, 27.494 dan 26.823 (Gambar 8 dan Lampiran 8).
Akhir dekomposisi substrat jerami padi, nisbah C/N pada perlakuan A, B, C, D dibandingkan dengan kontrol mempunyai nisbah C/N lebih rendah. Hal ini ditunjukkan dengan rasio C/N untuk kontrol (29.525), perlakuan A (24.856), B (24.200), C (21.685) dan D (25.905). Adanya penurunan ini menjadikan indikasi berlangsungnya dekomposisi. 10 15 20 25 30 35 40 45 0 1 2 3 4 5 6 7
Waktu dekomposisi (minggu)
R asi o C /N A B C D Kontrol
21
Gambar 8 Profil nisbah C/N substrat selama dekomposisi. Perlakuan A adalah kombinasi isolat bakteri selulolitik C4-4 + xilanolitik; B = C5-1 + xilanolitik; C = C11-1 + xilanolitik dan D = xilanolitik.
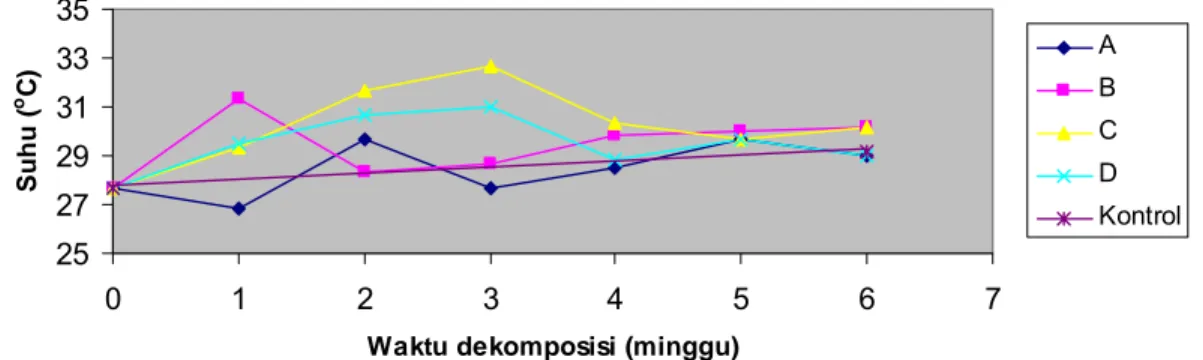
Hasil pengukuran suhu selama 6 minggu dekomposisi menunjukkan suhu yang berbeda diantara perlakuan. Peningkatan suhu dekomposisi terjadi pada minggu ke-3 sebesar 32.67 0C (C) dan 31.00 0C (D). Terhadap perlakuan A peningkatan suhu pada minggu ke-2 dekomposisi (29.67 0C) serta perlakuan B (31.33 0C) minggu ke-1 dekomposisi. Dari hasil pengukuran suhu terlihat bahwa semua perlakuan berada dalam fase mesofilik (Gambar 9 dan Lampiran 9).
25 27 29 31 33 35 0 1 2 3 4 5 6 7
Waktu dekomposisi (minggu)
Su h u ( o C) A B C D Kontrol
Gambar 9 Profil suhu substrat selama dekomposisi. Perlakuan A adalah kombinasi isolat bakteri selulolitik C4-4 + xilanolitik; B = C5-1 + xilanolitik; C = C11-1 + xilanolitik dan D = xilanolitik.
4.1.5 Laju Dekomposisi dan Bobot Sisa Substrat
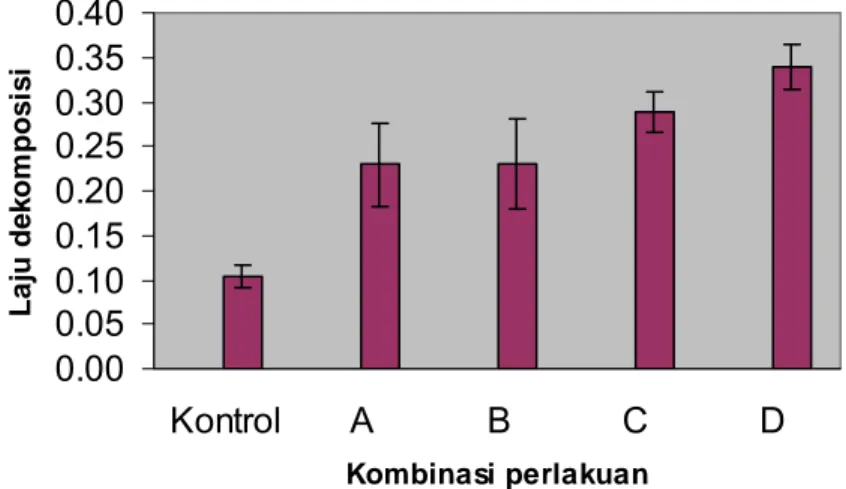
Laju dekomposisi menggambarkan aktivitas mikroba dalam pemanfaatan substrat yang digunakan. Dekomposisi substrat pada akhir perlakuan menunjukkan hasil yang berbeda diantara kombinasi inokulan. Hasil dekomposisi yang dinyatakan dalam laju dekomposisi (R) dari masing-masing perlakuan pada minggu ke-6 memperlihatkan nilai yang berbeda dibandingkan kontrol. Kombinasi perlakuan C4-4 + xilanolitik (A) ,C5-1 + xilanolitik (B) dengan laju dekomposisi sebesar 0.229. Terhadap perlakuan C11-1 + xilanolitik (C) 0.288 dan 45I3+234P-16 (D) 0.340 serta kontrol dengan laju dekomposisi sebesar 0.103 (Gambar 10 dan Lampiran 10). Laju dekomposisi berbanding lurus dengan konstanta dekomposisi (k). Konstanta dekomposisi juga memperlihatkan nilai yang berbeda diantara masing-masing kombinasi inokulan dengan kontrol. Kombinasi C4-4 + xilanolitik, C5-1 + xilanolitik
sebesar 0.053, C11-1 + xilanolitik (0.070), 45I3+234P-16 (0.089) serta terhadap kontrol dengan nilai k 0.020 (Gambar 11 dan Lampiran 11).
0.00 0.05 0.10 0.15 0.20 0.25 0.30 0.35 0.40 Kontrol A B C D Kombinasi perlakuan La ju de k o m pos is i
Gambar 10 Laju dekomposisi substrat jerami padi pada akhir dekomposisi. Perlakuan A adalah kombinasi isolat bakteri selulolitik C4-4 + xilanolitik; B = C5-1 + xilanolitik; C = C11-1 + xilanolitik dan D = xilanolitik. 0.00 0.02 0.04 0.06 0.08 0.10 0.12 Kontrol A B C D Kombinasi perlakuan K ons ta nt a de k o m pos is i
Gambar 11 Konstanta dekomposisi substrat jerami padi pada akhir dekomposisi. Perlakuan A adalah kombinasi isolat bakteri selulolitik C4-4 + xilanolitik; B = C5-1 + xilanolitik; C = C11-1 + xilanolitik dan D = xilanolitik.
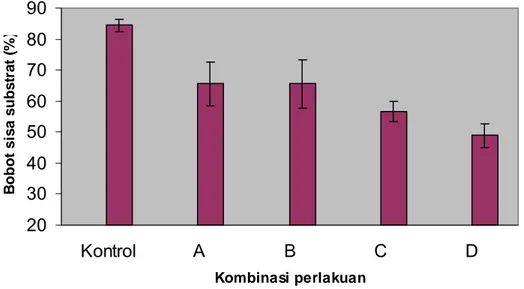
Bobot sisa substrat pada akhir dekomposisi memperlihatkan prosentase berbeda diantara kombinasi inokulan dengan kontrol. Bobot sisa bahan kontrol menunjukkan prosentase sebesar 84.445%, C4-4 + xilanolitik, C5-1 + xilanolitik
23
dengan prosentase yang sama 65.556%, C11-1 + xilanolitik 56.667%, dan 45I3+234P-16 48.889% (Gambar 12 dan Lampiran 12).
20 30 40 50 60 70 80 90 Kontrol A B C D Kombinasi perlakuan B obot s is a s u bs tr a t ( % )
Gambar 12 Bobot sisa substrat jerami padi pada akhir dekomposisi. Perlakuan A adalah kombinasi isolat bakteri selulolitik C4-4 + xilanolitik; B = C5-1 + xilanolitik; C = C11-1 + xilanolitik dan D = xilanolitik.
Berdasarkan gambar diatas terlihat bahwa kombinasi inokulan mempunyai aktivitas yang tinggi dibandingkan kontrol. Hal ini terlihat dari besarnya nilai bahan tersisa selama dekomposisi.
4.1.6 Kandungan Hara Makro-Mikro dan Kondisi Fisik Substrat
Kandungan makro-mikro nutrien substrat selama akhir dekomposisi menunjukkan adanya perubahan terhadap kontrol perlakuan (Tabel 3). Hasil pengukuran terhadap kandungan makro-mikro nutrien substrat diakhir pengomposan menunjukkan adanya peningkatan dari masing perlakuan C4-4 + xilanolitik (A), C5-1 + xilanolitik (B), C11-1 + xilanolitik (C) dan 45I-3+234P-16 (D) dibandingkan kontrol. Dari setiap perlakuan memperlihatkan peningkatan kandungan hara, baik terhadap kandungan hara makro (N, P, K, Ca, Mg, Fe) maupun hara mikro (Fe, Cu, Zn, Mn). Peningkatan kandungan hara yang tinggi terjadi pada perlakuan B, sehingga kombinasi ini baik digunakan untuk pengomposan.
Tabel 3 Kandungan hara makro-mikro substrat selama dekomposisi
Kandungan hara substrat pada akhir dekomposisi
Perlakuan N P K Ca Mg Fe Cu Zn Mn (%) (ppm) Kontrol 1.32 0.09 0.33 0.20 0.09 359.2 5.4 7.1 186.8 A 1.46 0.12 0.57 0.28 0.12 470.0 6.8 11.1 213.9 B 1.52 0.16 0.92 0.32 0.14 1760.0 20.3 58.6 306.6 C 1.75 0.13 0.59 0.27 0.13 1368.3 12.6 65.0 608.3 D 1.29 0.12 0.76 0.27 0.12 2228.0 17.8 44.8 680.0
Kondisi fisik substrat selama dekomposisi menunjukkan perubahan. Hal ini dapat dilihat adanya perubahan bentuk dan warna substrat (Gambar 13). Dari pengamatan terhadap kondisik fisik yang dilakukan dengan pengamatan secara visual terlihat bahwa struktur substrat semua perlakuan A, B, C, D menunjukkan struktur yang hancur dibandingkan dengan kontrol. Demikian halnya terhadap penampakan warna substrat terlihat bahwa substrat yang mendapat perlakuan inokulasi bakteri selulolitik dan xilanolitik menampakan warna coklat kehitaman, sedangkan pada kontrol substrat masih berwarna kuning kecoklatan.
Kontrol A B C D
Gambar 13 Performansi substrat jerami padi pada akhir dekomposisi. Perlakuan A adalah kombinasi isolat bakteri selulolitik C4-4 + xilanolitik; B = C5-1 + xilanolitik; C = C11-1 + xilanolitik dan D = xilanolitik.
4.2 Pembahasan
Isolat bakteri C4-4, C5-1 dan C11-1 yang ditumbuhkan pada media
carboxymethyl cellulose mempunyai aktivitas selulolitik. Hal ini ditandai adanya
kemampuan pembentukan zona jernih dari ketiga isolat tersebut. Keberadaan zona jernih menandakan bahwa isolat-isolat uji yang digunakan memiliki kemampuan dalam menghidrolisis substrat.
25
Teather dan Wood (1982) melaporkan bahwa dalam karakterisasi dan penghitungan bakteri selulolitik dapat digunakan dua metode yaitu 1) dengan menggunakan substrat tidak larut yang telah dilabel dengan pewarna dan 2) substrat terlarut carboxymethyl cellulose yang pengendapannya dengan detergen untuk visualisasi zona hidrolisis pada media cawan agar. Pewarna yang digunakan dalam visualisasi adalah merah kongo 0,1% dengan spesifikasi interaksi terhadap polisakarida yang mengandung unit-unit β-(1→4) glukopiranosil dan β-(1→3) D-glukan.
Aktivitas selulase isolat C4-4, C5-1 dan C11-1 mempunyai aktivitas berbeda dalam menghidrolisis substrat. Isolat C4-4 dan C11-1 memiliki aktivitas dalam memanfaatkan ketiga substrat selulase yaitu carboxymethyl cellulose, avicel, dan
filter paper, tetapi isolat C5-1 hanya memiliki aktivitas dalam hidrolisis substrat CMC
dan avicel.
Perbedaan dalam hidrolisa substrat menunjukkan bahwa ketiga isolat memiliki karakter berbeda dalam aktivitas enzimnya. Lemos et al. (2003) menyatakan bahwa mikroba selulolitik adalah mikroba yang mempunyai enzim untuk menghidrolisis selulosa dan kristalin selulosa. Ada tiga enzim selulase yang berperan dalam hidrolisa yaitu 1) endo-1,4-β-D-glukanase (EG; EC 3.2.1.4) yang bekerja secara acak sepanjang rantai selulosa menghasilkan situs baru untuk selobiohidrolase, 2) ekso-1,4-β-D-glukan (CBH; EC 3.2.1.91) yang bekerja sebagai eksoglukanase melepas selobiosa sebagai produk utama dan 3) 1,4-β-D-glukosidase (EC 3.2.1.21) yang menghidrolisis selobiosa menjadi glukosa (Jorgensen et al. 2003). Untuk penentuan aktivitas enzim dari ketiga macam enzim selulase digunakan uji spesifik. Uji spesifik untuk menggukur aktivitas endoglukanase menggunakan substrat carboxymethyl cellulose, eksoglukanase (substrat avicel) dan aktivitas glukosidase dengan
p-nitrophenyl-β-D-glycopyranoside (pNPG). Dari hasil ini terlihat bahwa isolat C4-4 dan C11-1 memiliki
aktivitas ketiga kelompok enzim selulase yakni endoglukanase, eksoglukanase dan glukosidase. Akan tetapi, isolat C5-1 hanya memiliki aktivitas enzim selulase dari kelompok enzim endo dan eksoglukanase saja.
Kondisi pH alkalin mempunyai dampak yang baik dalam dekomposisi, hal ini terlihat dari penelitian Heerden et al. (2002) yang menggunakan kalsium hidroksida (CaOH)2 dalam pengomposan limbah jeruk untuk menyesuaikan tingkat pH substrat.
Perlakuan ini bertujuan untuk meningkatkan suasana pH substrat yang bersifat asidik menjadi alkalin, sehingga dengan demikian kondisi ikatan lignin-selulosa menjadi lebih mudah untuk dipecah oleh enzim yang diproduksi mikroba selulolitik.
Penelitian Sari (2007) yang menyatakan bahwa isolat bakteri C4-4 memiliki aktivitas spesifik selulase pada kisaran pH 4.5-8.0, isolat C5-1 memiliki aktivitas spesifik selulase pada kisaran pH 3.0-8.0 dan isolat C11-1 mempunyai aktivitas spesifik selulase pada pH 3.0-9.0. Terhadap isolat-isolat xilanolitik juga menunjukkan kisaran pH yang luas, terlihat dari aktivitas spesifik xilanase 45I-3 yang memiliki pH 3.0-9.0 dengan aktivitas optimum xilanase pada pH 5.0. Demikian halnya untuk isolat 234P-16 juga mempunyai aktivitas spesifik xilanase pada kisaran pH 3.0-9.0 dengan aktivitas optimum xilanase pH 5.0 (Meryandini 2005).
Hasil penelitian Lei et al. (2000) dan Rajbanshi et al. (1998) juga melaporkan bahwa selama dekomposisi terjadi peningkatan derajat keasaman substrat. Dalam laporannya menyatakan bahwa pada awal dekomposisi (pengomposan), nilai pH menunjukkan penurunan yang nyata selama dua atau tiga hari pertama dari pengomposan aerobik. Hal ini disebabkan oleh pembentukan beberapa asam organik. Selanjutnya setelah 2-4 hari pH cenderung meningkat hingga akhir proses sebesar 8.0-9.0. Venglovsky et al. (2005) juga melaporkan bahwa selama pengomposan terjadi peningkatan pH sebesar 8.25 dengan penambahan zeolit 1% dan 8.30 dengan penambahan zeolit 2% pada hari ke-5 dan selanjutnya mengalami penurunan secara gradual hingga hari ke-40 hingga mencapai 6.20 dan 6,23, tetapi setelah periode ini derajat keasaman mengalami peningkatan kembali untuk perlakuan zeolit 1% 6.8 dan 6.9 terhadap 2%.
Bertoldi et al. (1983) menyarankan bahwa pH optimum dalam pengomposan
berkisar antara 5.5 dan 8.0, dikarenakan tingkat pH merupakan salah satu karakteristik penting dari proses pengomposan. Selama proses terjadi mineralisasi nitrogen organik menjadi nitrogen amonia yang menyebabkan nilai pH meningkat, sedangkan penurunan pH disebabkan oleh produksi asam-asam organik yang meningkat atau proses nitrifikasi. Perubahan tingkat pH juga dipengaruhi oleh pertukaran amonium.
Pola perubahan amonium cenderung menurun selama dekomposisi berlangsung. Kombinasi inokulan dari masing-masing perlakuan memperlihatkan penurunan kandungan amonium setelah minggu ke-3 hingga akhir dekomposisi
27
pada minggu ke-6. Pola yang sama dilaporkan oleh Venglovsky et al. (2005) selama pengomposan fraksi padat kotoran babi yang diperkaya dengan zeolit alam memperlihatkan penurunan drastis N-NH4+. Dalam penelitian ini dilaporkan bahwa penurunan terjadi pada pengamatan hari ke-5, 7, dan 21 yaitu (406, 490, dan 546 mg l -1) terhadap penambahan zeolit 1% dan pada pengamatan hari 7, 21, dan 28 sebesar (294, 392 dan 329 mg l -1) untuk perlakuan zeolit 2%.
Perubahan amonium berhubungan dengan nilai pH, pada derajat keasaman yang rendah ion amonium bersaing dengan ion hidrogen diantara situs pertukaran. Akan tetapi, pada pH yang tinggi ion amonium ditransformasi menjadi gas amonia. Untuk itu dalam aplikasinya disarankan nilai pH berada pada interval 4-8 selama fase awal pengomposan. Kithome et al. (1998) membuktikan bahwa dengan percobaan variasi pH antara 4 dan 7, sebagian besar amonium di adsorbsi pada pH 7. Lebih lanjut Tiquia et al. (1997) menyatakan bahwa kehilangan atau penurunan dalam N-NH4+ merupakan indikator kematangan dan baiknya proses pengomposan. Penurunan konsentrasi amonium dihasilkan melalui volatilisasi amonia, rendahnya intensitas degradasi material organik, dan penggunaan sumber nitrogen yang sedikit. Akan tetapi, adanya peningkatan konsentrasi amonium pada minggu awal pengomposan menandakan intensitas degradasi material organik dan amonium dihasilkan melalui mineralisasi N-organik tersebut. Disamping itu peningkatan jumlah amonium juga dapat menghambat aktivitas mikroba (Sanche-Monedero et al. 2001). Keberadaan amonium diperlukan oleh mikroba untuk pertumbuhan. Dan jumlah N-NH4+ yang diperlukan relatif berada pada konsentrasi rendah yaitu < 1 µg N g -1 tanah (Shi dan Norton 2000).
Menurut Bernal et al. (1996) bahwa sebagian besar dari proses immobilisasi nitrogen yang terjadi adalah merupakan bagian dari pemanfaatan amonium oleh mikroba untuk menyusun protein sel nya. Pada fase pertumbuhan mikroorganisme yang pesat, jumlah amonium yang dibutuhkan juga tinggi, sehingga akibatnya jumlah nitrogen dalam bentuk amonium berkurang.
Adanya penurunan kandungan C-organik merupakan indikator yang menandakan bahwa dekomposisi berlangsung. Goyal et al. (2005) melaporkan bahwa selama pengomposan bahan organik yang berbeda-beda terjadi perubahan total kandungan C-organik. Dari hasil penelitiannya terlihat bahwa pada pengomposan limbah tumbuhan tebu + kotoran ternak (4:1) terjadi perubahan
C-organik dari 47.5% (hari ke-0) menjadi 43.0% (hari ke-60) serta pada pengomposan limbah eceng gondok juga terjadi perubahan C-organik dari 41.8% (hari ke-0) menjadi 30.2% (hari ke-60). Perbedaan dalam perubahan kandungan C-organik berhubungan dengan komposisi kimia penyusun dinding sel tumbuhan. Hal ini terlihat dari keberadaan senyawa karbon yang sukar dipecah seperti halnya lignin pada limbah tebu tersebut.
Atkinson et al. (1996) melaporkan bahwa perubahan C-organik disebabkan
oleh hilangnya karbon sebagai karbon dioksida. Hal ini terlihat dari hasil pengomposan sampah serbuk gergaji dengan kotoran ternak, 29% karbon yang hilang sebagai CO2 dan substrat yang mengandung jumlah karbon besar dalam bentuk lignin sudah dipastikan dekomposi berlangsung lambat. Diketahui bahwa karbon menyusun 40-50% dari bobot kering jaringan tumbuhan, sehingga bila dikomposkan keperluan karbon dan nutrisi dari mikroba yang berperan dalam pengomposan diperoleh melalui perombakan senyawa karbon yang menyusun jaringan. Dekomposisi senyawa karbon pada pengomposan bergantung pada aktivitas mikroba yang berperan. CO2 yang dibebaskan melalui oksidasi dalam pengomposan menggambarkan tingkat aktivitas mikrobanya (Barrigton et al. 2002).
Perubahan C-organik juga berlangsung pada pengomposan bersama antara limbah gandum + abu terbang (0-60%). Hal ini terlihat dari penurunan C-organik pada penambahan abu terbang 0% sebesar 37.2% hingga 28.4% untuk konsentrasi penambahan 60%. Dan penurunan drastis terjadi dengan inokulasi Bacillus
polymyxa dimana kandungan C-organik menurun dari 30.2% pada tingkat 0%
hingga 21.2% pada tingkat 60% abu terbang (Gaind dan Gaur 2002).
Variasi kadar N-total selama dekomposi juga terjadi pada pengomposan limbah tumbuhan tebu + kotoran ternak (1:1) dengan pola N-total yang terus meningkat seiring dengan waktu pengomposan, seperti hal nya pada perlakuan C. Nilai N-total pada perlakuan ini adalah 1.50%, 1.53%, 1.71% pada pengomposan hari ke-0, 30 dan 60. Pada perlakuan pengomposan limbah eceng gondok terjadi penurunan N-total sebagai berikut 2.31%, 1.58%, 1.70% terhadap perlakuan pada hari ke-0, 30 dan 60. Penurunan kandungan N-total pada tahap awal pengomposan disebabkan oleh bentuk N yang hilang dalam bentuk amonia, tipe bahan yang dikomposkan, dan rasio C/N substrat (Goyal et al. 2005).
29
Sanchez-Monedero et al. (2001) menyatakan bahwa pengomposan dengan substrat yang memiliki rasio C/N rendah menghasilkan nilai N yang mudah dilepas dibandingkan limbah dengan nisbah C/N tinggi. N yang hilang akibat volatilisasi tidak hanya dipengaruhi oleh kelembaban atau cara aerasi, tapi juga oleh kehilangan C selama pengomposan. Selain itu penurunan konsentrasi N dapat juga disebabkan oleh immobilisasi N selama pengomposan. Martin et al. (1993) menemukan bahwa pada substrat dekomposisi dengan kandungan ligno-selulosa tinggi menyebabkan kemampuan degradasi mikroba yang rendah dan menimbulkan banyak kehilangan N.
Rasio C/N merupakan salah satu karakteristik utama yang digunakan dalam proses pengomposan. Walaupun demikian rasio ini pada fase padat tidak dapat digunakan sebagai indikator mutlak dikarenakan adanya variasi yang mempengaruhi dalam pengomposan tersebut, seperti komposisi substrat yang dikomposkan (Abdelhamid et al. 2004).
Dalam penelitian ini terlihat bahwa hingga akhir dekomposisi semua perlakuan kombinasi inokulan memperlihatkan nisbah C/N ≥20, hal ini menandakan bahwa kombinasi inokulan yang diaplikasikan berpeluang untuk digunakan sebagai bioaktivator. Kendatipun demikian dalam aplikasi ini masih perlu adanya perbaikan metode, penambahan nutrisi dan perbanyakan jumlah substrat yang digunakan untuk mencapai standarisasi SNI 19-7030-2004 dalam pengomposan, dimana nilai C/N rasio berkisar 10-20.
Sutanto (2002) menyatakan bahwa nisbah C/N sangat penting untuk memasok hara yang diperlukan mikroba selama pengomposan berlangsung. Bahan dasar kompos yang mempunyai nisbah C/N 20 sampai 35 sangat menguntungkan dalam pengomposan, selain itu nilai C/N yang terlalu besar (>40) atau terlalu kecil (<20) akan mengganggu kegiatan biologis proses dekomposisi. Apabila ketersediaan karbon terbatas (nisbah C/N terlalu rendah) tidak cukup senyawa sebagai sumber energi yang dapat dimanfaatkan mikroorganisme untuk mengikat seluruh nitrogen bebas. Dan jika ketersediaan karbon berlebihan (C/N >40) jumlah nitrogen sangat terbatas sehingga menjadikan faktor pembatas pertumbuhan mikroorganisme. Nisbah C/N yang cukup besar juga menunjukkan substrat yang sukar terdekomposisi, sedangkan nisbah C/N rendah relatif menunjukkan substrat mudah untuk didekomposisi.
Dalam proses pengomposan aerobik terdapat dua fase suhu yaitu mesofilik (23-45 oC) dan termofilik (45-65 oC). Kisaran suhu ideal untuk pengomposan adalah 55 oC-65 oC. Lebih lanjut Liang C et al. (2003) menyatakan bahwa pada suhu pengomposan 60 oC memperlihatkan berkurangnya aktivitas komunitas mikroorganisme, tetapi pada suhu ini aktivitas mikroorganisme termofilik bersifat optimum. Pada suhu pengomposan di bawah 20 oC mengakibatkan aktivitas dekomposisi mikroba yang rendah, bahkan proses dekomposisi terhenti. Hasil pengukuran yang sama juga dilaporkan Ruskandi (2006) bahwa dalam pengomposan limbah kelapa (sabut + daun) dicatat rerata suhu (oC) selama pengomposan yaitu 28.6; 27.3; 27.7; dan 27.4; pada (minggu ke-1, 2, 3, 4), limbah sulit terdekomposisi (jerami padi + jagung) 40.4; 38.3; 34.4; 34.2; (minggu ke-1, 2, 3, 4) dan limbah mudah terdekomposisi (kacang tanah + rumput) 44.0; 36.0; 36.6; 33.5; pada (minggu ke-1, 2, 3, 4).
Tidak tercapainya peningkatan suhu hingga batas ideal disebabkan oleh beberapa hal seperti kurangnya jumlah tumpukan bahan yang dikomposkan dan cara pengendalian suhu selama pengomposan. Akan tetapi, aktivitas mikroba yang diaplikasikan dalam penelitian ini terus berlangsung. Hal ini diperkuat oleh hasil penelitan karakterisasi Sari (2007) dan Meryandini (2005) yang menyatakan bahwa isolat-isolat yang digunakan dalam aplikasi ini memiliki aktivitas enzim pada kisaran suhu yang luas. Semua isolat C4-4, C5-1 dan C11-1 memiliki aktivitas spesifik selulase pada kisaran suhu 30-90 oC dengan aktivitas optimum pada suhu 70 oC (C4-4), suhu 90 oC (C5-1) dan suhu 70 oC (C11-1). Untuk aktivitas isolat 45I-3 dan 234P-16 juga memiliki aktivitas spesifik xilanase pada kisaran suhu 30-90 oC, dengan aktivitas optimum pada suhu 50 oC terhadap isolat 45I-3 dan suhu 90 oC untuk isolat 234P-16.
Perez-Harguindeguy et al. (2000) menyatakan bahwa perbedaan dalam laju dekomposisi berhubungan dengan variasi sifat bahan yang dikomposkan, seperti kekerasan daun, konsentrasi nitrogen, lignin, dan polifenol serta rasio C/N. Disamping itu proses dekomposisi tergantung pada tipe dari bahan untuk dekomposisi dan faktor-faktor lain seperti iklim dan ketersediaan air. Berikutnya kualitas dari bahan mempengaruhi proses mikroba dalam hal immobilisasi dan penyimpanan nutrien di dalam sistem (Bardget et al. 1999).