BAB II
TINJAUAN PUSTAKA
2.1 Nanopartikel
2.1.1 Pengenalan umum nanopartikel
Perhatian dalam nanoteknologi meningkat secara pesat dalam bidang ilmiah termasuk penghantaran obat, nanoimaging, dan aplikasi yang berhubungan dengan medis lainnya. Nanopartikel dapat dibuat dalam banyak bentuk dan ukuran yang berbeda-beda dengan menggunakan material organik dan inorganik. Akan tetapi, secara defenisi, partikel ini harus berada dalam kisaran ukuran 1-1000 nm. Karena penggunaan nanopartikel dalam penghantaran obat dan nanomedicine selalu dibutuhkan untuk pemberian secara parenteral, yang telah ada dan terus menjadi kebutuhan utama pada penggunaan pembawa polimer baik bersifat biokompatibel dan biodegradabel. Ulasan ini akan fokus pada aplikasi dari nanoteknologi untuk menghantarkan agen terapetik dan diagnostik menggunakan nanopartikel polimer biodegradabel untuk penghantaran sistemik, lokal dan bertarget (Chakravarthi dan Dennis, 2008).
Keuntungan menggunakan nanopartikel sebagai sistem penghantaran obat adalah sebagai berikut (Mohanraj dan Chen, 2006):
1. Ukuran partikel dan sifat permukaan dari nanopartikel dapat dimanipulasi dengan mudah untuk mencapai target obat baik secara aktif maupun pasif setelah pemberian secara parenteral.
2. Nanopartikel penghantar obat dapat mengontrol dan memperpanjang pelepasan obat pada saat tranportasi dan pada sisi lokalisasi, mengubah
distribusi organ dari obat, dan berikutnya mempengaruhi klirens dari obat sehingga dapat mencapai peningkatan efikasi terapetik obat dan mengurangi efek samping.
3. Pelepasan secara terkontrol dan sifat degradasi partikel dapat diatur sesuai dengan pemilihan jenis matriks. Drug loading secara relatif tinggi dan obat dapat dimasukkan ke dalam sistem tanpa reaksi kimia, ini merupakan faktor penting untuk memelihara aktivitas obat.
4. Mengarahkan obat ke organ target dapat dicapai dengan melekatkan ligan target pada permukaan partikel atau menggunakan tuntunan magnet.
5. Sistem dapat diberikan dalam berbagai rute seperti oral, nasal, parenteral, intraokular dan lain-lain.
Disamping keuntungan tersebut, nanopartikel memiliki keterbatasan. Sebagai contoh, ukurannya yang kecil dan area permukaan yang luas dapat menyebabkan agregasi, menyebabkan penanganan fisik nanopartikel sangat sulit dalam bentuk cair dan padat. Sebagai tambahan ukuran partikel yang kecil dan area permukaan yang luas menghasilkan keterbatasan drug loading dan pelepasan yang cepat. Masalah ini harus ditanggulangi sebelum nanopartikel digunakan secara klinis atau dibuat secara komersial (Mohanraj dan Chen, 2006).
2.1.2 Pembuatan nanopartikel
Nanopartikel dapat dibuat dari beberapa material seperti protein, polisakarida, dan polimer sintetik. Pemilihan material matriks bergantung pada banyak faktor seperti (Mohanraj dan Chen, 2006):
1. Ukuran nanopartikel yang dibutuhkan
3. Karakteristik permukaan seperti muatan dan permeabilitas 4. Tingkat biodegradasi, biokompatibilitas, dan toksisitas 5. Profil pelepasan obat yang diinginkan
6. Antigenitas pada produk akhir
Pembuatan nanopartikel secara luas dapat diklasifikasikan secara luas menjadi dua kategori yaitu:
1. Proses top-down
Proses top-down terdiri atas pengurangan ukuran partikel dari partikel obat yang besar menjadi partikel yang lebih kecil dengan menggunakan teknik penggilingan yang bervariasi seperti penggilingan media, mikrofluidisasi dan homogenisasi tekanan tinggi. Tidak ada pelarut keras yang digunakan dalam teknik ini. Walaupun demikian, semua proses penggilingan media membutuhkan energi yang tinggi dan tidak efisien. Pertimbangan terhadap banyaknya panas yang dihasilkan dalam metode ini membuat pengolahan material yang termolabil menjadi sulit (Parrol, 1990).
2. Proses bottom-up
Pembuatan bottom-up berupa pembentukan nanostruktur atom demi atom atau molekul demi molekul. Pada pendekatan bottom-up, obat dilarutkan dalam pelarut organik dan kemudian diendapkan pada penambahan antisolvent dalam adanya stabilizer (Date dan Patravale, 2004).
Nanopartikel paling banyak dibuat dengan 3 metode ini yaitu: 1. Dispersi dari polimer
2. Polimerisasi dari monomer
Tetapi, terdapat metode lain seperti teknologi supercritical fluid (Reverchon dan Adami, 2006) dan juga dideskripsikan dalam literatur pada produksi nanopartikel. Yang terakhir ini diklaim memiliki kontrol mutlak terhadap ukuran partikel, bentuk dan komposisi, yang dapat dijadikan contoh untuk produksi nanopartikel secara masal dalam industri (Mohanraj dan Chen, 2006).
2.1.2.1 Dispersi dari polimer
Dispersi dari polimer merupakan teknik umum yang digunakan untuk membuat nanopartikel polimer biodegradabel dari poly lactic acid (PLA); Poly (D,L glycolide) (PLG); Poly (D, L-lactide-co-glycolide) (PLGA) dan Poly (Cyanoacrylate) (PCA) (Ravi, et al., 2004; Li, et al., 2001; Kwon, et al., 2001). Teknik ini dapat digunakan dengan beberapa cara sebagai berikut:
1. Metode evaporasi pelarut: dalam metode ini, polimer dilarutkan dalam larutan organik seperti diklorometana, kloroform dan etil asetat, yang juga digunakan sebagai pelarut untuk melarutkan obat hidrofobik. Campuran dari polimer dan larutan obat kemudian diemulsifikasikan dalam larutan air yang mengandung surfaktan agen pengemulsi untuk membentuk emulsi minyak dalam air (o/w). setelah terbentuk emulsi yang stabil, pelarut organik dievaporasi dengan menurunkan tekanan atau dengan pengadukan secara berkala. Ukuran partikel yang terbentuk dipengaruhi oleh tipe dan konsentrasi dari stabilizer, kecepatan homogenizer dan konsentrasi polimer. Untuk memproduksi ukuran partikel yang kecil, diperlukan homogenasi atau ultrasonikasi (Zambaux, et al., 1998). 2. Metode emulsifikasi spontan atau difusi pelarut: metode ini merupakan versi
modifikasi dari metode evaporasi pelarut (Niwa, et al., 1993). Dalam metode ini, pelarut yang bercampur air bersama-sama dengan sejumlah kecil perlarut
organik yang tidak bercampur air digunakan sebagai fase minyak. Karena adanya difusi spontan dari pelarut, turbulensi antarmuka yang terbentuk antara 2 fase yang mengarah pada pembentukan partikel kecil. Seiring meningkatnya pelarut yang bercampur air, maka penurunan ukuran partikel dapat dicapai. 2.2.1.2 Metode polimerisasi
Pada metode ini, monomer dipolimerisasi menjadi bentuk nanopartikel dalam larutan air. Obat dicampur dalam medium polimerisasi atau diadsorpsi dalam nanopartikel setelah polimerisasi terbentuk. Suspensi nanopartikel kemudian dimurnikan untuk menghilangkan stabilizer dan surfaktan yang digunakan untuk polimerisasi melalui sentrifugasi dan re-suspending partikel dalam medium isotonik bebas surfaktan. Teknik ini biasanya digunakan untuk membuat nanopartikel polybutylcyanoacrylate atau poly (alkylcyanoacrylate) (Zhang, et al., 2001; Boudad, et al., 2001). Pembentukan nanokapsul dan ukuran partikel bergantung pada konsentrasi surfaktan dan stabilizer yang digunakan (Puglisi, et al., 1995).
2.1.2.3 Metode koaservasi dan gelasi ionik
Banyak peneliti fokus pada penyiapan nanopartikel menggunakan polimer hidrofilik biodegradabel seperti kitosan, gelatin dan natrium alginat. Calvo dan pekerjanya mengembangkan metode untuk menyiapkan nanopartikel kitosan hidrofilik dengan gelasi ionik (Calvo, et al., 1997). Metode ini meliputi campuran dari 2 fase air, yang satu berupa polimer kitosan, di-block co-polymer ethylene oxide atau polypropylene oxide dan yang lain berupa polianion natrium trypolyphosphate. Dalam metode ini, gugus asam amino yang bermuatan positif dari kitosan berinteraksi dengan trypolyphosphate yang bermuatan negatif, untuk
membentuk koaservat yang berukuran nanometer. Koaservat terbentuk dari hasil interaksi elektrostatik antara 2 fase air, sedangkan gelasi ionik meliputi material yang mengalami transisi dari cairan menjadi gel karena kondisi interaksi ionik pada suhu ruang (Mohanraj dan Chen, 2006).
2.1.3 Efek sifat nanopartikel pada penghantaran obat 2.1.3.1 Ukuran partikel
Ukuran partikel dan distribusi ukuran merupakan sifat yang paling penting pada sistem nanopartikel. Mereka menentukan distribusi in vivo, nasib biologi, toksisitas dan kemampuan bertarget pada sistem nanopartikel. Sebagai tambahan, mereka juga mempengaruhi drug loading, pelepasan obat dan stabilitas pada nanopartikel (Mohanraj dan Chen, 2006).
Banyak studi telah mendemostrasikan bahwa ukuran submikron nanopartikel memiliki sejumlah keuntungan pada sistem penghantaran obat (Panyam dan V, 2003). Secara umum nanopartikel memiliki uptake intraselular yang relatif lebih tinggi dibanding dengan mikropartikel dan tersedia jarak yang lebar pada target biologis dan mobilitas relatif. Desai, et al., (1996), menemukan bahwa nanopartikel 100 nm memiliki uptake yang lebih besar dibandingkan dengan mikropartikel 1 mikrometer dalam sel Caco-2. Dalam studi yang selanjutnya, nanopartikel berpenetrasi melalui lapisan submukosa dalam model usus in situ pada tikus, ketika mikropartikel lebih banyak terlokalisasi dalam lapisan epitel. Hal ini juga dilaporkan bahwa nanopartikel dapat melewati sawar darah otak diikuti dengan pembukaan ikatan ketat oleh manitol hiperosmotik, yang menyediakan penghantaran yang diperpanjang dari agen terapetik untuk pengobatan penyakit yang sulit seperti tumor otak (Kroll, et al., 1998). Tween 80
yang melapisi nanopartikel ditunjukkan dapat melewati sawar darah otak (Kreuter, et al., 2003). Dalam lapisan sel, hanya nanopartikel submikron dapat diambil secara efisien tapi bukan mikropartikel ukuran yang lebih besar (Zauner, et al., 2001).
Pelepasan obat dipengaruhi oleh ukuran partikel. Partikel yang lebih kecil memiliki luas permukaan yang besar, oleh karena itu, kebanyakan obat dihubungkan dengan dekat dengan permukaan partikel, menyebabkan pelepasan obat yang cepat. Dimana, partikel yang lebih besar mempunyai inti yang besar yang menyebabkan obat lebih terenkapsulasi dan lambat difusi keluar (Redhead, et al., 2001). Partikel yang lebih kecil juga memiliki resiko yang lebih besar untuk mengalami agregasi selama penyimpanan dan transportasi dispersi nanopartikel. Nanopartikel menjadi tantangan untuk formulasi dengan ukuran yang sekecil mungkin tetapi memiliki stabilitas yang maksimum (Mohanraj dan Chen, 2006).
Degradasi polimer juga mempengaruhi dipengaruhi oleh ukuran partikel. Sebagai contoh, kecepatan degradasi polimer PLGA meningkat dengan bertambahnya ukuran partikel in vitro (Dunne, et al., 2000). Hal itu dianggap bahwa dalam partikel yang lebih kecil, produk degradasi dari PLGA yang terbentuk, lebih mudah difusi keluar dari partikel, dan ketika berada dalam partikel besar, produk degradasi yang lebih cenderung tetap dalam matriks polimer dalam periode yang lama untuk menyebabkan degradasi autokatalitik dari material polimer. Oleh karena itu, dapat dihipotesis bahwa partikel yang lebih besar menyebabkan degradasi polimer yang lebih besar sebanding dengan pelepasan obatnya. Tetapi menurut Panyam, et al., 2003, partikel PLGA dengan
kisaran ukuran yang berbeda dan ditemukan laju degradasi in vitro tidak terlalu berbeda untuk partikel dengan ukuran yang berbeda.
Sekarang ini, metode yang paling cepat dan paling banyak digunakan untuk menentukan ukuran partikel adalah dengan photon correlation spectroscopy atau dynamic light scattering. Photon correlation spectroscopy menyediakan pengukuran viskositas medium dan menentukan diameter pada partikel melalui gerakan Brownian dan sifat penghamburan cahaya (Swarbrick and Boylan, 2002). Hasil yang didapat dari photon correlation spectroscopy selalu dibuktikan oleh scanning atau transmission electron microscopy.
2.1.3.2 Sifat permukaan nanopartikel
Ketika nanopartikel diberikan secara intravena, mereka sangat mudah dikenali oleh sistem imun tubuh dan kemudian dibersihkan oleh fagosit yang terdapat dalam sirkulasi (Mueller, et al., 1993). Terlepas dari ukuran dari nanopartikel, hidrofobisitas permukaannya menentukan jumlah yang teradsorbsi komponen darah, terutama protein (opsonin). Hal ini pada gilirannya mempengaruhi nasib in vivo dari nanopartikel (Mueller, et al., 1993; Brigger, et al., 2002). Perlekatan opsonin pada permukaan nanopartikel dikenal dengan aksi opsonisasi sebagai jembatan antara nanopartikel dengan fagositosis. Penggabungan obat dengan dengan pembawa konvensional menyebabkan modifikasi pada profil biodistribusi obat, sebagai penghantaran utama pada mononuclear phagocytes system (MPS) seperti hati, limpa, paru-paru dan sum-sum tulang. Walaupun, ketika di dalam aliran darah, permukaan nanopartikel yang tidak termodifikasi (nanopartikel konvensional) akan teropsonisasi dengan
cepat dan dibersihkan besar-besaran oleh makrofag dari organ yang kaya MPS (Grislain, et al., 1983).
Oleh karena itu, untuk meningkatkan kemungkinan target obat oleh nanopartikel, hal ini diperlukan untuk memperkecil opsonisasi dan memperpanjang sirkulasi nanopartikel in vivo. Hal ini dapat dicapai dengan (Mohanraj dan Chen, 2006):
a. Penyalutan permukaan nanopartikel dengan menggunakan polimer hidrofilik atau surfaktan.
b. Formulasi nanopartikel dengan kopolimer biodegradabel dengan segmen hidrofilik seperti polyethylene glycol (PEG), polietilen oksida, polyoxamer, tween 80.
Potensial zeta dari nanopartikel secara umum digunakan untuk mengkaraktersiasi muatan permukaan dari nanopartikel (Couvreur, et al., 2002). Hal ini menunjukkan potensial elektrik dari partikel dan dipengaruhi oleh komposisi partikel dan medium pendispersi. Nanopartikel dengan potensial zeta di atas (+/-) 30 mV menunjukkan suspensi yang stabil, sebagai muatan permukaan yang mencegah terjadinya agregasi dari partikel. Potensial zeta dapat juga digunakan untuk menentukan material aktif permukaan yang dienkapsulasi berada pada pusat nanokapsul atau diadsorbsi pada permukaan.
2.1.3.3 Drug loading
Secara ideal, sistem nanopartikulat yang sukses harus mempunyai kapasitas muatan obat yang tinggi sehingga mengurangi kuantitas material matriks untuk pemberian. Drug loading dapat dilakukan dengan 2 metode yaitu: 1. Digabung pada saat produksi nanopartikel (metode penggabungan)
2. Absorpsi obat setelah pembentukan nanopartikel dengan inkubasi pembawa dengan larutan obat jenuh (teknik adsorpsi dan absorpsi).
Drug loading dan efisiensi penjerapan sangat dipengaruhi oleh tingkat-padat kelarutan obat dalam material matriks atau polimer (disolusi padat atau dispersi), yang dihubungkan pada komposisi polimer, berat molekul, interaksi obat-polimer dan adanya gugus fungsional (ester dan karboksil) (Govender, et al., 1999; Govender, et al., 2000; Panyam, et al., 2004). PEG tidak mempuyai atau sedikit efek pada drug loading (Peracchia, et al., 1997). Makromolekul atau protein menunjukkan efisiensi muatan yang tinggi ketika dia dimuat dan dekat dengan titik isoelektrik dimana ia mempunyai kelarutan yang rendah dan adsorpsi maksimum, untuk molekul kecil, studi menunjukkan bahwa penggunaan interaksi ionik antara obat dengan material matriks dapat menjadi cara yang lebih efektif untuk meningkatkan drug loading (Chen, et al., 1994; Chen, et al., 2003).
2.1.3.4 Pelepasan obat
Untuk mengembangkan sistem nanopartikulat, baik pelepasan obat dan biodegradasi polimer merupakan faktor pertimbangan yang penting. Secara umum, laju pelepasan obat dipengaruhi oleh:
1. Kelarutan obat
2. Desorpsi pada permukaan/ obat teradsorpsi 3. Difusi obat melalui nanopartikel matriks 4. Erosi/degradasi matriks nanopartikel 5. Kombinasi dari proses erosi/ difusi
Jadi, kelarutan, difusi, dan biodegradasi dari material matriks mempengaruhi proses pelepasan (Mohanraj dan Chen, 2006).
Dalam kasus nanosferis, dimana obat terdistribusi secara merata, pelepasan terjadi oleh difusi atau erosi matriks di bawah kondisi sink. Jika difusi obat lebih cepat dari erosi matriks, mekanisme pelepasan lebih banyak dikontrol oleh proses difusi. Pelepasan yang cepat paling utama disebabkan oleh lemahnya ikatan atau obat diadsorbsi pada permukaan besar nanopartikel (Magenheim, et al., 1993). Ini terbukti bahwa metode penggabungan memiliki efek pada profil pelepasan. Jika obat yang dimuat dengan metode penggabungan, sistem memiliki efek pelepasan yang kecil dan memiliki sifat sustained release (Fresta, et al., 1995). Jika nanopartikel dilapisi dengan polimer, pelepasan dikontrol dengan difusi obat dari inti melewati membran polimer. Lapisan membran bertindak sebagai penghalang untuk pelepasan, oleh karena itu, kelarutan dan difusivitas obat dalam polimer membran menjadi faktor penentu dalam pelepasan obat. Lebih lanjut, kecepatan pelepasan juga dapat dipengaruhi oleh interaksi ionik antara obat dan penambahan bahan pembantu. Ketika obat dilibatkan dalam interaksi dengan bahan pembantu untuk membentuk kompleks yang sedikit larut dalam air, kemudian pelepasan obat dapat menjadi lebih lambat dengan hampir tidak terjadi efek pelepasan (Chen, et al., 1994); sedangkan jika penambahan bahan pembantu seperti penambahan ethylene oxide-propylene oxide block copolymer (PEO-PPO) sampai kitosan, mengurangi interaksi dari model obat bovine serum albumin (BSA) dengan material matriks (kitosan) karena interaksi kompetitif elektrostatik dari PEO-PPO dengan kitosan, kemudian meningkatkan pelepasan obat (Calvo, et al., 1997).
Variasi metode yang dapat digunakan untuk studi pelepasan in vitro obat, yaitu:
1. Sel difusi berdampingan dengan membran biologis maupun buatan 2. Teknik dialysis bag diffusion
3. Teknik reverse dialysis bag
4. Agitasi diikuti dengan ultrasentrifugasi/sentrifugasi 5. Teknik ultrafiltrasi atau ultrafiltrasi sentrifugasi.
Biasanya studi pelepasan dilakukan oleh agitasi terkontrol diikuti dengan sentrifugasi. Karena memakan waktu dan kesulitan teknis yang dihadapi dalam pemisahan nanopartikel dari media pelepasan, teknik dialisis secara umum lebih disukai (Mohanraj dan Chen, 2006).
2.2 Teknik Dialisis
Dari semua metode yang digunakan untuk memeriksa jumlah obat yang terlepas dari bentuk sediaan yang berukuran nano, metode dialisis yang paling sering digunakan dan popular. Dalam metode ini, pemisahan fisika dari bentuk sediaan dapat dicapai dengan menggunakan membran dialisis yang memudahkan sampling pada interval waktu tertentu. Dari berbagai jenis teknik dialisis yang digunakan, teknik yang paling sering digunakan adalah dialysis bag (dialisis biasa), dan adaptasi lain seperti reverse dialysis, dan side by side dialysis (Chidambaram dan Burgess, 1999; Yan, et al., 2010; Calvo, et al., 1996). Pada teknik dialisis biasa, nanopartikel dimasukkan ke dalam ke dalam dialysis bag yang berupa media pelepasan (kompartemen/ media dalam), yang kemudian ditutup dan ditempatkan dalam wadah besar yang berisi medium pelepasan (kompartemen/ media luar), diagitasi untuk meminimalkan efek lapisan air yang
tidak teraduk (Kumar, et al., 2011; Muthu dan Singh., 2009). Secara umum, volume yang dimasukkan ke dalam dialysis bag (media dalam) lebih kecil dibandingkan dengan media luar. Sebagai contoh, volume media dalam yang dilaporkan dalam literatur berkisar 1-10 ml, sedangkan volume media luar lebih besar, yaitu sekitar 40-100 ml (Kumar, et al., 2011; Yan, et al., 2010; Muthu dan Singh., 2009). Oleh karena itu, ukuran wadah dipengaruhi oleh volume total dari medium pelepasan yang dibutuhkan untuk studi pelepasan secara in vitro. Dalam teknik dialisis biasa, jumlah obat yang terlepas dari nanopartikel berdifusi melalui membran dialisis menuju kompartemen luar dimana sampel diambil untuk dianalisis (Gambar 2.1).
Gambar 2.1 Gambar teknik dialisis biasa (D’Souza dan De Luca, 2006)
Kemudahan untuk mendesain dan sampling dengan metode dialisis membuatnya menjadi teknik yang paling simpel dan mudah untuk studi pelepasan obat dari berbagai jenis bentuk sediaan nano seperti nanosferis, liposom, emulsi, nanosuspensi dan lain-lain (Yan, et al., 2010; Calvo, et al., 1996; Muthu dan Singh., 2009). Akan tetapi, terdapat persoalan yang dilaporkan mengenai teknik dialisis biasa. Jika ditutup dengan tidak benar, maka akan terjadi kebocoran media
dan bentuk sediaan dialysis bag. Data pelepasan obat akan tidak sempurna jika adanya kondisi nonsink dan waktu equilibrium yang tinggi (Heng, et al., 2008). 2.3 Nanopartikel Alginat
Nanopartikel alginat telah digunakan untuk memformulasi berbagai obat. Karena mereka disiapkan dalam lingkungan berair di bawah kondisi sejuk, nanopartikel alginat terutama cocok untuk formulasi protein, peptida dan oligonukleotida (Lambert, et al., 2001). Selanjutnya, selain bersifat biodegradabel, alginat juga nonimunnogenik. Untuk mengurangi tingkat pertukaran dari kation seperti Ca2+ dengan ion monovalen dalam medium disolusi, alginat anionik sering digabung dengan molekul kationik seperti kitosan, poly-l-lysine, atau tripolyphosphate. Beberapa contoh dari berbagai aplikasi dari nanopartikel berbasis alginat telah dijelaskan. Nanopartikel alginat disiapkan dengan tripolyphosphate digunakan untuk penghantaran oral (Bodmeier, et al., 1989). Studi dari sifat fisik menunjukkan bahwa nanopartikel alginat-kitosan cocok untuk penghantaran DNA (Douglas dan Tabrizian, 2005). Nanopartikel alginat yang dilapisi dengan kitosan meningkatkan stabilitas dan menurunkan pelepasan cepat dari ovalbumin (Borges, et al., 2005). Studi melaporkan bahwa nanopartikel alginat yang distabilkan dengan kitosan dapat meningkatkan bioavailabilitas dan pelepasan diperpanjang dari obat antijamur dibandingkan dengan nanopartikel PLGA (Pandey, et al., 2005). Walaupun sebagian besar digunakan untuk pemberian oral, nanopartikel alginat inhalasi meningkatkan bioavailabilitas dari obat antituberkulosis (Zahoor, et al., 2005). In vivo, nanopartikel alginat terakumulasi dalam sel Kupffer, sel parenkim dalam hati dan fagosit dalam limpa dan hati (Yi, et al., 1999; Ahmad, et al., 2006). Nanopartikel alginat juga
dilaporkan untuk diabsorbsi pada Peyer’s patches, memberi kesan bahwa ini akan meningkatkan kemampuan target pada mukosa usus (Borges, et al., 2006). Di dalam tubuh, alginat terdegradasi oleh hidrolisis asam pada segmen guluronic dan mannuronic (Holtan, et al., 2006).
2.4 Nanopartikel Kitosan
Selain untuk obat yang memiliki berat molekul rendah dan nutrasetikal, nanopartikel kitosan, banyak digunakan untuk penghantaran makromolekul seperti DNA dan small interfering Ribonucleic acid (siRNA) (Chen dan Subirade, 2005). Selain pelepasan yang diperpanjang dari makromolekul, nanopartikel kitosan melindungi mereka dari nuklease. Nanopartikel kitosan placebo memiliki aktivitas antibakteri untuk beberapa mikroba seperti Escherichia coli (Qi, et al., 2004). Permukaan nanopartikel kitosan dimodifikasi secara hidrofobik dengan asam linoleat untuk penghantaran tripsin (Liu, et al., 2005). Aplikasi lain dari kitosan seperti penghantaran paru-paru (Grenha, et al., 2005) dan mata (Enriquez, et al., 2006). Gugus amina primer pada posisi kedua dapat dimodifikasi untuk menyesuaikan kitosan untuk aplikasi yang spesifik. Sebagai contoh, konjugasi kimia dari gugus amina menjadi gugus metoksi-PEG meningkatkan kelarutan air (Saito, et al., 2003). Thiolasi dari kitosan meningkatkan permeasi dari nanopartikel (Bernkop-Schnurch, 2000). Modifikasi secara hidrofobik glikol kitosan menjadi nanopartikel telah digunakan untuk menghantarkan doksorubisin (Hyung Park, et al., 2006). Target nanopartikel kitosan pada reseptor folat pada permukaan sel meningkatkan efisiensi transfeksi DNA (Mansouri, et al., 2006). Tidak terdapat efek yang ditemukan pada nanopartikel kitosan. Pada pemberian intravena, nanopartikel kitosan terakumulasi pada hati (Yan, et al., 2006).
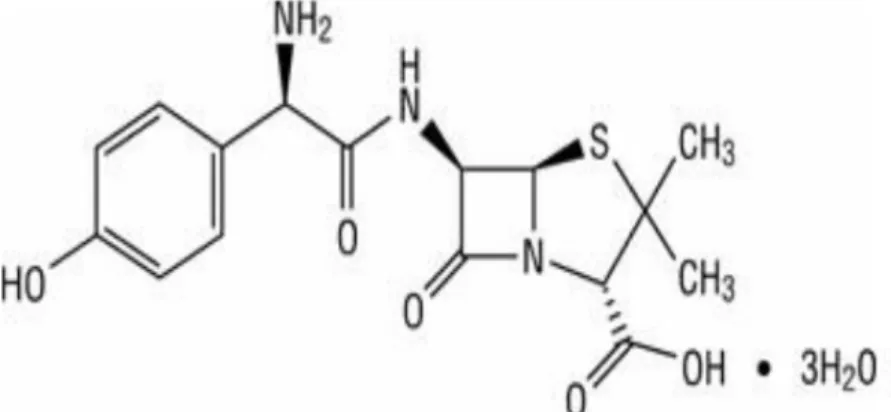
2.5 Amoksisilin 2.5.1 Uraian bahan a. Rumus bangun:
Gambar 2.2 Rumus bangun amoksisilin (Ditjen POM, 1995) b. Rumus molekul: C16H19N3O5S.
c. Berat molekul: 419,45.
d. Nama kimia: Asam (2S, 5R, 6R)-6-[(R)-(-)-2-amino-2- (hidroksifenil)asetamido]-3,3-dimetil-7-okso-4 tia-1-azabisiklo[3,2,0]- heptana-2-karboksilat trihidrat.
e. Pemerian: Serbuk hablur, putih, praktis tidak berbau.
f. Kelarutan: Sukar larut dalam air dan metanol; tidak larut dalam benzena, dalam karbontetraklorida dan dalam kloroform.
2.5.2 Efek farmakologi amoksisilin
Amoksisilin termasuk dalam antibiotik golongan Beta laktam. Mekanisme kerja beta laktam dapat diringkas dengan urutan sebagai berikut (Istiantoro dan Gan, 2007):
1. Obat bergabung dengan penicillin-binding protein (PBPs) pada kuman.
2. Terjadi hambatan sintesis dinding sel kuman karena proses transpeptidasi antar rantai peptidoglikan terganggu.
3. Kemudian terjadi aktivasi enzim proteolitik pada sel dinding. 2.6 Bovine Serum Albumin
Uraian bahan adalah sebagai berikut: a. Sinonim: Bovine Plasma Albumin
b. Struktur: berat molekul dari BSA kebanyakan disebutkan 66.120 (Frank, 1975) atau 66.267 (Reed, 1980), tapi direvisi pada tahun 1990 menjadi 66.430 (Hirayama, 1990). Ketiga nilai didasarkan pada rangkaian asam amino yang terdapat pada saat publikasi. BSA merupakan rantai polipeptida yang mengandung sekitar 583 gugus asam amino dan tidak mengandung karbohidrat. Pada pH 5-7, mengandung 17 rantai disulfida dan 1 gugus sulfidril (Frank, 1975; Reed, 1980).
c. Kelarutan/stabilitas larutan: albumin bersifat larut dalam air dan hanya dapat diendapkan oleh konsentrasi tinggi pada garam netral seperti ammonium sulfat. Stabilitas larutan BSA sangat tinggi (terutama jika larutan disimpan sebagai aliquot dingin). Secara nyata, albumin sering digunakan sebagai stabilizer atau protein pengsolubilisasi lain. Tetapi, albumin mudah terkoagulasi dengan adanya panas (Lewis, 1993). Dengan pemanasan pada 50oC atau diatasnya, albumin mudah membentuk agregat hidrofobik yang tidak akan kembali menjadi monomer ketika didinginkan. Pada suhu rendah agregasi juga mungkin terjadi, tetapi dengan kecepatan yang lebih lama.
Adanya gugus amino dan karboksil bebas pada ujung-ujung rantai molekul protein, menyebabkan protein mempunyai banyak muatan (polielektrolit) dan bersifat amfoter (dapat bereaksi dengan asam maupun basa) daya reaksi berbagai jenis protein terhadap asam dan basa tidak sama, tergantung dari jumlah dan letak
gugus amino dan karboksil dalam molekul. Dalam larutan asam (pH rendah) gugus amino akan bereaksi dengan H+, sehingga protein bermuatan positif. Bila pada kondisi ini dilakukan elektrolisis, molekul protein akan bergerak ke arah katoda. Sebaliknya, dalam larutan basa (pH tinggi) molekul protein akan bereaksi sebagai asam atau bermuatan negatif, sehingga molekul protein akan bergerak ke anoda. Pada pH tertentu yang disebut sebagai titik isoelektrik (pI), muatan gugus amino dan karboksil bebas akan saling menetralkan sehingga molekul bermuatan nol. Tiap jenis protein mempunyai titik isoelektrik yang berlainan. Pengendapan paling cepat terjadi pada titik isoelektrik ini. Lapisan molekul protein pada bagian dalam yang bersifat hidrofobik berbalik keluar, sedangkan bagian luar yang bersifat hidrofil terlipat ke dalam. Pelipatan atau pembalikan terjadi khususnya bila larutan protein telah mendekati pH isoelektrik dan akhirnya protein mulai menggumpal dan mengendap (Winarno, 1982).
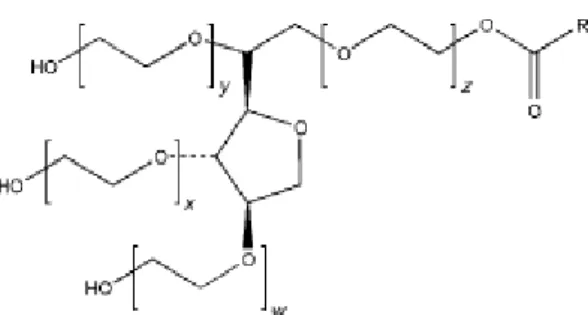
2.7 Tween 80
Tween 80 adalah ester asam lemak polioksietilen sorbitan, dengan nama kimia polioksietilen 20 sorbitan monooleat. Rumus molekulnya adalah C64H124O26 dan rumus strukturnya adalah sebagai berikut:
Pada suhu 25ºC, Tween 80 berwujud cair, berwarna kekuningan dan berminyak, memiliki aroma yang khas, dan berasa pahit. Larut dalam air dan etanol, tidak larut dalam minyak mineral. Tween 80 secara luas digunakan dalam produk kosmetik dan makanan. Kegunaan Tween 80 antara lain sebagai: zat pendispersi, emulgator, dan peningkat kelarutan, pensuspensi dan pembasah (Rowe, et al., 2009). Selain itu, Tween 80 dapat mencegah aglomerasi dan meningkatkan stabilitas fisik (Shafie dan Hadeel, 2013).