B
IOTEKNOLOGI
&
IOSAINS
B
NO: 01 VOLUME: 02 JUNI 2015
KARAKTERISASI ISOLAT BAKTERI FIBRINOLITIK WU 021055*
ASAL PERAIRAN PANTAI PAPUMA, JEMBER
Ajeng Maharani Sri Pananjung, Evi Umayah Ulfa, Kartika Senjarini,
dan Sattya Arimurti
AKTIVITAS LIGNINOLISIS DARI BASIDIOMYCETES YANG DAPAT
DIPAKAI UNTUK BIODEGRADASI DIOKSIN
Nuki Bambang Nugroho
PENICILLIN PRODUCTION BY MUTANT OF
Penicillium chrysogenum
Dudi Hardianto, Suyanto, Erwahyuni E. Prabandari, Lira Windriawati,
Edy Marwanta and Tarwadi
PENENTUAN KOMBINASI MEDIUM TERBAIK GALAKTOSA DAN
SUMBER NITROGEN PADA PROSES PRODUKSI ETANOL
Rofiq Sunaryanto dan Berti Hariasih Handayani
THE COMBINATION OF GROWTH HORMONES INCREASED THE IN VITRO
SHOOTS MULTIPLICATION ON SAGO PALM (
Metroxylon sagu
Rottb.)
Teuku Tajuddin, Karyanti, Tati Sukarnih and Nadirman Haska
PRELIMINARY CYTOTOXIC EVALUATION OF
Andrographis paniculata
IN BREAST CANCER CELL LINES
Tarwadi, Churiyah, Olivia Bunga Pongtuluran, Fifit Juniarti,
and Fery Azis Wijaya
BALAI PENGKAJIAN BIOTEKNOLOGI
CENTER FOR BIOTECHNOLOGY ASSESMENT
KOMPETENSI
Balai Pengkajian Bioteknologi – BPPT
Center for Biotechnology Assessment - BPPT
Membangun keunggulan
bioteknologi industri, kesehatan, dan
pertanian untuk meningkatkan
daya saing industri dan
pertumbuhan ekonomi Nasional
Pelayanan Teknis Pengujian Teknologi Mikropropagasi Tanaman Teknologi Agromikrobiologi Balai Pengkajian Bioteknologi Center for Biotechnology Assessment
Kawasan PUSPIPTEK Gedung 630, Setu - Tangerang Selatan BANTEN – Indonesia Telp. +62 21 7563120, Fax +62 21 7560208 Teknologi Ex-vitro Tanaman Rekayasa Industri Berbasis Bioteknologi Aplikasi Bioteknologi Pakan Ternak Laboratorium Rekayasa Genetika
Laboratorium Mikrobiologi
Laboratorium Mikrobiologi Vitamin dan Enzim
Laboratorium Teknologi Fermentasi
Laboratorium Rekoveri dan Ekstraksi Senyawa Obat
Laboratorium Analitik dan Kontrol Kualitas
Laboratorium Kultur Jaringan Tanaman
Laboratorium Bioteknologi Pakan Ternak
Laboratorium Agromikrobiologi
Pilot plant fermentasi (bioreaktor : 75l L (3 buah), 500 L, dan 2.500 L)
Pilot plant penapisan (recovery)
Filtrasi membran mikro, ultra nano dan Reverse Osmosis
Destilasi dan stripping
Kristalisasi dan Pengeringan vakum
Sentrifugasi dan Ekstraksi (padat/cair dan cair/cair)
Pilot plant teknologi mikropropagasi tanaman (In Vitro)
Pilot plant teknologi Ex Vitro
Unit pengolah limbah Cair aerob/anaerob
Fasilitas Pilot Plant
Fasilitas Laboratorium
CENTRE FOR BIOTECHNOLOGY ASSESSMENT
Teknologi Fermentasi &Proses Hilir
Rekayasa Genetika Terapan
JURNAL
BIOTEKNOLOGI & BIOSAINS INDONESIA
Homepage Jurnal: www.jbbindonesia.weebly.comDiterbitkan oleh : Balai Pengkajian Bioteknologi BPPT
Gd.630 Kawasan PUSPIPTEK Serpong Tangerang Selatan Banten Indonesia 15314
Penanggung Jawab : Kepala Balai Pengkajian Bioteknologi
Ketua Editor : Dr. Rofiq Sunaryanto
Dewan Editor :
Drs. Tarwadi, M.Si Dr. Anis H Mahsunah, M.Sc Dr. Ir. Teuku Tajuddin, M.Sc Juwartina Ida Royani, M.Si
Mitra Bestari
Dr. Pudjono (Fakultas Farmasi Universitas Gajah Mada) Dr. Elok Zubaidah (Fakultas Pertanian Universitas Brawijaya)
Editor Pelaksana
Endah Dwi Hartuti, S.Si, Apt Diana Dewi, M.Si
Design Grafis & internet publisher
Dr. rer.nat. Catur Sriherwanto
Sekretariat & Distribusi
Siti Zulaeha, S.Si Imron Rosidi, M.Si
VOLUME 02 NOMOR 01 JUNI 2015
JURNAL
BIOTEKNOLOGI & BIOSAINS INDONESIA
Homepage Jurnal: www.jbbi.weebly.comDAFTAR ISI
Halaman:
KARAKTERISASI ISOLAT BAKTERI FIBRINOLITIK WU 021055*
ASAL PERAIRAN PANTAI PAPUMA, JEMBER
Ajeng Maharani Sri Pananjung, Evi Umayah Ulfa, Kartika Senjarini, dan Sattya
Arimurti
47 – 54
AKTIVITAS LIGNINOLISIS DARI BASIDIOMYCETES YANG DAPAT
DIPAKAI UNTUK BIODEGRADASI DIOKSIN
Nuki Bambang Nugroho
55 – 60
PENICILLIN PRODUCTION BY MUTANT OF
Penicillium chrysogenum
Dudi Hardianto, Suyanto, Erwahyuni E. Prabandari, Lira Windriawati,
Edy Marwanta and Tarwadi
61 – 65
PENENTUAN KOMBINASI MEDIUM TERBAIK GALAKTOSA DAN
SUMBER NITROGEN PADA PROSES PRODUKSI ETANOL
Rofiq Sunaryanto dan Berti Hariasih Handayani
66 – 72
THE COMBINATION OF GROWTH HORMONES INCREASED THE IN VITRO
SHOOTS MULTIPLICATION ON SAGO PALM (
Metroxylon sagu
Rottb.)
Teuku Tajuddin, Karyanti, Tati Sukarnih and Nadirman Haska
73 – 79
PRELIMINARY CYTOTOXIC EVALUATION OF
Andrographis paniculata
IN BREAST CANCER CELL LINES
Tarwadi, Churiyah, Olivia Bunga Pongtuluran, Fifit Juniarti, and Fery Azis Wijaya
80 – 85
ISSN: 2442 - 2606
47
JURNAL
BIOTEKNOLOGI & BIOSAINS INDONESIA
Homepage Jurnal: www.jbbindonesia.weebly.comKARAKTERISASI ISOLAT BAKTERI FIBRINOLITIK WU 021055* ASAL
PERAIRAN PANTAI PAPUMA, JEMBER
Characterization of Fibrinolytic Bacteria WU 021055* from Papuma Coast, Jember
Ajeng Maharani Sri Pananjung1, Evi Umayah Ulfa1, Kartika Senjarini2, Sattya Arimurti2
1
Fakultas Farmasi, Universitas Jember
2
Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Jember, Jln. Kalimantan 37, Jember 68121 e-mail: [email protected]
ABSTRACT
A blood clot (thrombus) in a blood stream is formed due to a circulatory system imbalance in the hemostasis which resulted in plug of blood vessels. The supplies of nutrients and ox-ygen to the tissues is inhibited (ischemia) by the accumulation of thrombus and embolus in the blood vessel. This prosses is the main cause for further atherotrombotic disease’s such as myocardial infraction and cerebral infraction. This disease, could be overcome by thrombolytic therapy by using fibrinolytic protease enzyme. Fibrinolytic activity of protease enzymes have been studied from various species of bacteria. Bacterial isolate of WU 021055* obtained from Papuma coastal waters has demonstrated fibrinolytic activity. This research aimed to identify the morphological characterization (colony and cell morphology), characterization of physiological (indole test, fermented carbohydrates test (glucose, lac-tose, sucrose and fructose), catalase test, starch hydrolysis test, and the pH effect test), and Molecular identification using 16S rRNA. Based on those characterization, the bacteri-al isolates of WU 021 055 * shows a high similarity to Bacillus Aerius.
Keywords: Atherotrombosis, fibrinolytic, characterization of bacteria
ABSTRAK
Bekuan darah (trombus) dalam peredaran darah terbentuk akibat ketidakseimbangan sistem sirkulasi dalam hemostasis yang menyebabkan penyumbatan pembuluh darah. Akumulasi trombus dan embolus pada pembuluh darah mengakibatkan suplai nutrisi dan oksigen ke jaringan terhambat (iskemia) dan bahkan kematian jaringan (infark). Pembentukan ini merupakan etiologi dari penyakit aterotrombosis seperti infark miokard dan infark serebral. Penyakit akibat trombosis ini dapat diatasi dengan terapi trombolitik dengan enzim protease fibrinolitik. Aktivitas enzim protease fibrinolitik telah diteliti dari berbagai spesies bakteri. Isolat bakteri WU 021055* asal perairan pantai papuma tampak memiliki aktivitas fibrinolitik. Pada penelitian ini dilakukan identifikasi isolat bakteri melalui karakterisasi morfologi (morfologi koloni dan sel), karakterisasi fisiologis (uji indol, uji fermentasi karbohidrat (glukosa, laktosa, sukrosa dan fruktosa), uji katalase, uji hidrolisis pati, dan uji pengaruh pH), dan identifikasi secara molekuler menggunakan 16S rRNA. Berdasarkan karakterisasi morfologi, fisiologi, dan marker 16S rRNA, isolat bakteri WU 021055* menunjukkan kemiripan yang tinggi dengan Bacillus aerius.
Karakterisasi Isolat Bakteri Fibrinolitik... Ajeng Maharani Sri Pananjung et al.
48
PENDAHULUAN
Penyakit atherotrombosis seperti infark miokard dan infark serebral merupakan penyakit yang terjadi akibat sumbatan bekuan darah (trombus) pada pembuluh darah (arteri). Pada tahun 2004, penyakit tersebut merupakan penyebab kematian utama di dunia. Terhitung sebanyak 7.200.000 (12,2%) kematian terjadi akibat penyakit ini di seluruh dunia (World Health Organization, 2008). Salah satu penyebab dari infark miokard dan infark serebral adalah trombosis yang diakibatkan oleh ruptur dari plak aterosklerosis pada dinding pembuluh darah sehingga menghasilkan bekuan darah. Bekuan darah terbentuk disebabkan karena sistem sirkulasi yang tidak seimbang dalam hemostasis sehingga terjadi penyumbatan pembuluh darah. Derajat sumbatan bekuan darah dan ukuran infark ditentukan oleh derajat dan lokasi proses pembentukan bekuan darah (Prasad et al., 2007).
Trombus yang menyumbat pembuluh darah tersebut dapat dihancurkan dengan mekanisme trombolisis (fibrinolisis). Fibrinolisis bekerja dengan mengaktifkan plasminogen menjadi enzim proteolitik plasmin. Plasmin akan mengubah bentuk trombus dan membatasi perkembangan trombosis dengan mencerna proteolitik fibrin (Kumada et al., 1994). Mekanisme kerja enzim fibrinolitik adalah dengan menghidrolisis fibrin yang menyebabkan bekuan darah menjadi produk terlarut yang dapat dibuang dari peredaran darah sehingga membebaskan pembuluh darah dari bekuan darah dan memulai proses penyembuhan dinding pembuluh darah (Escobar et al., 2002). Agen fibrinolitik dapat diperoleh dari tanaman, hewan, atau mikroba. Penggunaan mikroba khususnya bakteri telah banyak diteliti sebagai penghasil agen fibrinolitik.
Indonesia merupakan negara yang memiliki wilayah perairan laut yang sangat luas, sekitar dua pertiga wilayah negara ini berupa lautan. Review riset mengenai diversitas biota laut dari perairan Indonesia mengindikasikan bahwa potensi biota laut Indonesia sebagai penghasil senyawa bioaktif dalam pengembangan obat sangat besar (Chasanah, 2009). Hasil penelitian Setiawan (2013), menunjukkan bahwa bakteri asal perairan pantai Papuma yaitu
isolat dengan kode WU 021055* memiliki aktifitas fibrinolitik. Isolat telah diuji aktivitas fibrinolitiknya menggunakan metode fibrin
plate assay dengan indeks aktivitas enzim fibrinolitik sebesar 11. Karena potensi yang dimiliki isolat bakteri tersebut sebagai penghasil enzim fibrinolitik maka karakterisasi terhadap bakteri tersebut sangatlah penting. Salah satu karakterisasi yang dapat dilakukan yaitu identifikasi isolat bakteri. Identifikasi isolat bakteri dapat dilakukan dengan metode konvensional dan metode molekuler. Metode konvensional didasarkan pada identifikasi fenotip diantaranya pemeriksaan morfologi, fisika, kimia, biokimia. Identifikasi
mikroorganisme secara molekuler
menggunakan penanda molekul tertentu, seperti 16S rRNA atau gen pengkodenya. Metode molekuler ini didasarkan pada teknik
polymerase chain reaction (PCR) yang merupakan teknik penggandaan in vitro. Sekuen 16S rRNA juga digunakan sebagai penanda molekuler karena molekulnya bersifat ubiquitous (terdapat di semua makhluk hidup) dengan fungsi yang identik pada seluruh organisme. Penggunaan molekul 16S rRNA menjadi pilihan yang banyak digunakan untuk melacak filogeni bakteri. Selain itu informasi genetik dari sekuen 16S rRNA cukup lengkap pada data base Gene Bank sehingga lebih mudah untuk melihat kekerabatan bakteri.
BAHAN DAN METODE
Bahan yang digunakan adalah satu isolat bakteri dari Perairan Pantai Papuma Jember koleksi Laboratorium Mikrobiologi Jurusan Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Jember yang memiliki aktivitas fibrinolitik yaitu WU 0210155*. Alat yang digunakan adalah mikroskop electron Olympus BX53F dan mesin polymerase chain reaction (PCR)
Techne TC-312.
1. Peremajaan Isolat Bakteri
Isolat bakteri dalam stok gliserol (-80°C) diremajakan dengan cara bakteri ditumbuhkan pada media NB (Nutrient Broth) cair dan digoyangkan pada suhu ruang selama 18 jam. Hasil peremajaan dimurnikan koloninya untuk mendapatkan koloni tunggal (single colony) dengan cara streak pada media NB padat dan diinkubasi pada inkubator dengan suhu ruang
49 selama 48 jam. Koloni tunggal hasil
peremajaan dibiakkan kembali dalam media NB cair selama 18 jam.
2. Pewarnaan Gram Isolat Bakteri
Pewarnaan Gram dilakukan dengan membuat usapan tipis suspensi dari isolat bakteri berumur 24 jam pada gelas objek yang bersih, kemudian dikeringanginkan. Setelah kering, difiksasi dengan cara melewatkan bagian bawah gelas objek di atas api bunsen. Selanjutnya hapusan bakteri ditetesi dengan larutan Kristal violet selama 1 menit. Dibilas dengan air kran mengalir. Kemudian ditetesi dengan larutan iodine dan dibiarkan selama 1 menit. Dibilas dengan air kran mengalir. Dibilas dengan alkohol 96% selama 20 detik. Dibilas kembali dengan air kran mengalir. Ditetesi dengan safranin selama 45 detik. Terakhir dibilas dengan air kran mengalir, dan diletakkan di atas kertas serap. Hasil pewarnaan Gram isolat bakteri diamati di bawah mikroskop dengan pembesaran 1000x. Untuk memperjelas morfologi sel, cover glass di atas suspensi bakteri ditetesi dengan minyak imersi dan perhitungan koloni bakteri dengan menggunakan koloni counter. Sel bakteri Gram positif akan berwarna ungu hingga biru, sedangkan bakteri Gram negatif akan berwarna merah.
3. Karakterisasi Biokimia
Karakterisasi isolat bakteri WU 021055* yang dilakukan meliputi uji indol, uji fermentasi karbohidrat (glukosa, laktosa, sucrosa dan fruktosa), uji katalase, uji hidrolisis pati, dan uji pengaruh pH. Uji indol dilakukan dengan inokulasi isolat bakteri ke dalam medium NB padat pada tabung reaksi secara aseptik, di inkubasi pada suhu 37ºC selama 24 jam, kemudian ditetesi dengan reagen Kovac’s. Uji fermentasi karbohidrat (glukosa, laktosa, sucrosa dan fruktosa) dilakukan dengan menambahkan medium NB cair dengan brom tymol blue
(BTB) sebagai indikator dimasukkan ke dalam tabung reaksi, ditambahkan gula yang di fermentasikan 1-2%. Isolat diinokulasi dan diinkubasi pada suhu 37ºC selama 24 jam (Cappuccino dan Sherman, 1987).
Uji katalase dilakukan dengan cara isolat diberi 2 tetes reagen hidrogen peroksida (H2O2) 3%.Pada uji hidrolisis pati,
isolat bakteri digoreskan pada media pati dan diinkubasi selama 24 jam. Permukaan koloni ditetesi dengan iodin. Uji pengaruh pH dilakukan dengan menumbuhkan satu ose isolat bakteri dari suspensi biakan dalam larutan media NB cair dibuat dalam suasana pH yang berbeda yaitu pH 3, 5, 7 dan diinkubasi selama 24 jam.
4. Isolasi DNA Kromosom Isolat Bakteri
Kultur bakteri sebanyak 1000 µl disentrifugasi 13.000 x g selama 5 menit pada suhu 4°C sehingga didapatkan pelet dan diulang sebanyak tiga kali. Isolasi DNA dilakukan mengikuti prosedur Wizard® Genomic DNA Purification Kit.
5. PCR DNA pengkode 16S rRNA
Isolat bakteri yang terlihat pita DNA
genomnya diamplifikasi dengan
menggunakan primer DNA pengkode 16S rRNA yaitu 27F (5’ AGA GTT TGA TCM TGG CTC AG 3’), 533F (5’ GTG CCA GCM GCC GCG GTA A 3’) dan 907R (5’ CCG TCA ATT CMT TTG AGT TT 3’), 1492R (5’ GGT TAC CTT GTT ACG ACT T 3’) (Lane,1991). PCR dilakukan dengan mereaksikan 15 µl aquabidest steril, 25 µl 2x PCR Master mix (Qiagen Kit), 1,25µl forward primer (10 pmol/µl, konsentrasi akhir 0,25 pmol/µl), 1,25 µl reverse primer (10 pmol/µl, konsentrasi akhir 0,25 pmol/µl) dan 2 µl ekstrak DNA. Suhu denaturasi 98°C dalam 5 menit dan 95°C dalam 35 detik; annealing dengan suhu 55°C selama 35 detik dan elongasi pada suhu 72°C dalam 90 detik. Total siklus 35 kali.
6. Purifikasi DNA Hasil PCR
Purifikasi hasil PCR dilakukan melalui pemotongan gel agarosa yang mengandung pita DNA hasil PCR. Produk PCR dimurnikan pada 1% gel agarosa mengikuti prosedur PCR clean-up Gel Extraction Nucleospin® Extract II. Produk purifikasi DNA hasil PCR diukur dengan menggunakan NanoDrop spektrofotometer.
7. Analisis data sekuen DNA pengkode 16S rRNA BLAST NCBI
Penentuan urutan DNA murni
(sequencing) dilakukan dengan mengirimkan DNA hasil purifikasi dari produk PCR ke 1st BASE Singapura. Bioedit software (Tom Hall, Ibis Theraupetics) digunakan untuk analisis data kasar hasil sequencing. Setelah
Karakterisasi Isolat Bakteri Fibrinolitik... Ajeng Maharani Sri Pananjung et al.
50
Tabel 1. Hasil Pengamatan Morfologi Isolat Bakteri WU 021055*
Karakteristik Hasil
Bentuk Koloni Bulat
Bentuk Tepian Koloni Bergerigi
Warna koloni Putih
Bentuk Sel Basil
Warna Sel Ungu
Gram (+/-) +
diketahui alignment sekuen DNA pengkode 16S rRNA dari masing-masing isolat maka sekuen dibandingkan dengan database gen pengkode 16S rRNA menggunakan BLAST online software (www.ncbi.nlm.nih.gov.) untuk menentukan spesies dari isolat dan hubungan kekerabatan dengan spesies bakteri lainnya
HASIL DAN PEMBAHASAN
Identifikasi secara fenotip dilakukan sebagai tahap awal sebelum identifikasi lebih lanjut. Identifikasi fenotip meliputi morfologi isolat bakteri yaitu, bentuk koloni, bentuk tepian koloni, warna koloni dan juga morfologi sel isolat bakteri pada (Tabel 1). Koloni isolat bakteri merupakan sekumpulan dari masa sel yang dapat dilihat secara langsung dengan mata. Semua sel dalam koloni itu sama dan dianggap semua sel tersebut merupakan keturunan (progeny) dari satu mikroorganisme dan mewakili sebagai biakan murni. Penampakan koloni isolat bakteri WU 021055* berbentuk bulat, tepi bergerigi dan berwarna putih. Semua koloni dalam media tumbuh menunjukkan warna dan bentuk koloni yang homogen sehingga dapat disimpulkan bahwa isolat bakteri WU 021055* pada (Gambar 1) dalam media tumbuh tersebut murni.
Pengamatan pewarnaan Gram
menunjukkan isolat bakteri WU 021055* bersifat Gram positif dengan bentuk sel basil yang dibandingkan dengan kontrol negatif E. coli dan kontrol positif B. subtilis.
Menurut Jawetz et al (2008) bakteri dibagi dalam golongan Gram positif dan Gram negatif berdasarkan reaksinya terhadap pewarnaan Gram. Bakteri dikatakan Gram negatif apabila sel bakteri berwarna merah dan termasuk Gram positif apabila sel bakteri berwarna ungu. Hasil pewarnaan
isolat bakteri WU 021055* pada Gambar 2 menunjukkan Gram positif dan berbentuk basil. Disimpulkan bahwa isolat bakteri WU 021055* termasuk dalam Genus Bacillus.
Karakterisasi fisiologis isolat bakteri
WU 021055* diamati berdasarkan
pengamatan uji biokimia. Hasil uji biokimia isolat bakteri WU 021055* menunjukkan hasil positif pada pengujian hidrolisis pati yang ditandai dengan perubahan warna pada media uji. Uji katalase positif ditandai dengan adanya gelembung pada media uji. Isolat bakteri WU 021055* dapat tumbuh optimal pada pH 7. Hal ini ditandai dengan keruhnya media uji pada kondisi pH 7. Pada pengujian fermentasi karbohidrat menunjukkan hasil negatif ditandai dengan tidak terbentuknya gelembung pada tabung durham. Uji pembentukan indol memberikan hasil negatif ditandai dengan tidak terbentuknya cincin merah pada media uji.
Teori dari identifikasi bakteri dengan teknik konvensional adalah membandingkan bakteri yang sedang diidentifikasi dengan bakteri yang telah teridentifikasi sebelumnya. Bila tidak terdapat bakteri yang ciri-cirinya 100% serupa, maka dilakukan pendekatan terhadap bakteri yang memiliki ciri-ciri yang paling menyerupai. Oleh karena itu teknik identifikasi dengan metode konvensional akan selalu menghasilkan suatu bakteri tertentu yang sudah teridentifikasi
sebelumnya dan tidak akan dapat
menemukan spesies baru (Cowan, 1974). Menurut Claus & Barkeley (1986) genus
Bacillus mempunyai sifat fisiologis yang menarik karena tiap-tiap jenis mempunyai kemampuan yang berbeda-beda. Genus
Bacillus ditemui di berbagai lingkungan termasuk udara, tanah, perairan, dan makanan fermentasi. Sravankumar et al
(2010) juga mengemukakan bahwa bakteri
Gambar 1. (a) Morfologi koloni isolat bakteri WU 021055* pada cawan petri dan (b) Morfologi satu koloni isolat bakteri WU 021055* pada pembesaran 1000X.
a
51
B. aerius memiliki bentuk basil, gram positif, dan hasil uji biokimia (Tabel 2). Hasil karakterisasi fisiologis menunjukkan kesamaan isolat bakteri WU 021055* dengan B. aerius yang diteliti sebelumnya.
Pada penelitian Setiawan (2013) isolat bakteri WU 021055* menunjukkan aktivitas fibrinolitik ditandai dengan terbentuknya zona bening di sekitar koloni bakteri yang diuji pada media fibrin agar. Enzim fibrinolitik merupakan kelompok enzim protease yang mampu mendegradasi fibrin atau fibrinogen. Enzim fibrinolitik dapat diaplikasikan pada penderita trombosis karena enzim ini dapat menghancurkan fibrin dalam bekuan darah menjadi produk degradasinya yang lebih larut dalam darah (Sajuthi et al., 2010). Dilaporkan dalam penelitian Zhang et al (2012), bahwa B. aerius memiliki protein dengan aktivitas trombolitik, antikoagulan, dan hemolisis. Hal ini menunjukkan bahwa isolat bakteri WU 021055* memiliki kesamaan aktivitas fibrinolitik dengan B. aerius.
Karakterisasi secara molekuler menggunakan sekuen 16S rRNA sebagai kunci identifikasi. Analisis 16S rRNA
Gambar 2. Hasil pewarnaan Gram (a) Isolat Bakteri WU 021055*(+); (b) Kontrol (-) E.coli; (c) Kontrol (+) B. Subtilis. Pewarnaan Gram dengan umur kultur 24-48 jam pada pembesaran 1000 X.
Tabel 2.Hasil Uji Biokimia Isolat Bakteri WU 021055* Pengujian Karakteristik B. aerius (Sravankumar, 2010) Hasil (+/-) pengamatan Hidrolisis pati + + Katalase + + Fermentasi karbohidrat:: a. sukrosa - - b. fruktosa - - c. glukosa - - d. laktosa - - Pengaruh pH: a. pH 3 - b. pH 5 - c. pH 7 + d. pH 9 + Pembentukan indol - - Keterangan:
1. Hidrolisis pati (+) terdapat perubahan warna 2. Katalase (+) terdapat
gelembung
3. Fermentasi karbohidrat: a. sukrosa (-) tidak ada
gelembung b. fruktosa (-) tidak ada
gelembung c. glukosa (-) tidak ada
gelembung d. laktosa (-) tidak ada
gelembung 4. Pengaruh pH a. pH 3 (-) tidak terjadi perubahan warna b. pH 5 (-) tidak terjadi perubahan warna c. pH 7 (+) larutan terjadi kekeruhan d. pH 9 (+) larutan terjadi kekeruhan 5. Pembentukan Indol (-)
tidak terdapat cincin merah
menggunakan prinsip PCR yaitu melibatkan beberapa siklus yang masing-masing terdiri dari tiga tahap berurutan, yaitu pemisahan (denaturasi) rantai cetakan DNA, penempelan (annealing) pasangan primer pada DNA target dan pemanjangan (elongasi) primer atau reaksi polimerisasi yang dikatalisis oleh DNA polimerase. Dalam proses PCR diperlukan DNA kromosom sebagai template yaitu sebagai cetakan untuk pembentukan molekul DNA baru melalui isolasi DNA kromosom.
Hasil isolasi DNA kromosom pada Gambar 3 menunjukkan adanya satu pita di atas 10.000 bp jika dibandingkan dengan marker 1 kb. Pada umumnya ukuran DNA kromosom bakteri berukuran lebih dari 10.000 bp. Ukuran DNA kromosom yang tidak dapat ditentukan, namun ukuran tersebut dapat diindikasikan bahwa pita DNA tersebut merupakan DNA kromosom bakteri dan bukan merupakan plasmid atau DNA organel. DNA organel misalnya DNA
a
a
b
b
c
c
Karakterisasi Isolat Bakteri Fibrinolitik... Ajeng Maharani Sri Pananjung et al.
52
mitokondria atau DNA kloroplas tidak terdapat dalam sel bakteri karena sel bakteri tidak memiliki organel tersebut sehingga dapat dipastikan DNA tersebut adalah DNA kromosom.
Amplifikasi dengan PCR 16S rRNA dilakukan menggunakan primer universal yang dapat mengamplifikasi keseluruhan gen pada bakteri berdasarkan daerah konservatif dari gen pengkode 16S rRNA. Hasil amplifikasi DNA pengkode 16S rRNA menunjukkan bahwa pita DNA hasil PCR dengan pasangan primer yang pertama 27F dan 907R tampak sejajar dengan pita DNA marker yang berukuran 900 bp. Hal ini relevan dengan hasil yang diharapkan yaitu fragmen DNA berukuran 873 bp yang berkisar di pita DNA marker tersebut. Pita DNA hasil PCR dengan pasangan primer yang kedua
yaitu 533F dan 1492R berada pada kisaran fragmen marker yang berukuran 1000 bp. Hasil ini sesuai dengan ekspektasi ukuran hasil PCR menggunakan primer tersebut yaitu 959 bp.
Selanjutnya, untuk mendapatkan
produk PCR yang murni dan tidak
terkontaminasi oleh sisa-sisa PCR perlu
dilakukan pemurnian produk PCR.
Pemurnian ini penting dilakukan agar proses
sequencing DNA berlangsung dengan baik dan mendapatkan kualitas yang baik pula. DNA sampel yang memiliki kualitas kemurnian yang baik yaitu memiliki nilai 1,7-2,0 dari perbandingan A260/A280 (Oswald, 2007). Nilai pengukuran kemurnian hasil purifikasi produk PCR termasuk dalam rentang murni yaitu antara 1,7-2,0. Konsentrasi sampel DNA dapat dihitung dengan membandingkan intensitas pita DNA Tabel 3. Beberapa organisme yang memiliki kemiripan terdekat dengan isolat bakteri WU 021055* berdasarkan
urutan nuklotida DNA pengkode 16S rRNAnya.
Description Max score Total score Query cover E value Ident. Bacillus aerius strain 24K 16S ribosomal RNA gene, partial sequence 1482 1482 100% 0.0 99% Bacillus stratosphericus strain 41KF2a 16S ribosomal RNA gene, partial sequence 1482 1482 100% 0.0 99% Bacillus altitudinis strain 41KF2b 16S ribosomal RNA gene, partial sequence 1482 1482 100% 0.0 99% Bacillus stratosphericus strain 41KF2a 16S ribosomal RNA gene, partial sequence 1478 1478 99% 0.0 99% Bacillus safensis strain NBRC 100820 16S ribosomal RNA gene, partial sequence 1459 1459 100% 0.0 98% Bacillus pumilus strain NBRC 12092 16S ribosomal RNA gene, partial sequence 1459 1459 100% 0.0 98%
Gambar 3. Elektroforegram hasil isolasi DNA
kromosom isolat bakteri asal perairan pantai Papuma, Jember.
Gambar 4. Elektroforegram hasil pemurnian produk PCR DNA pengkode 16S rRNA isolat WU 021055* melalui elektroforesis gel agarosa.
53 sampel dengan konsentrasi masing-masing
pita DNA marker (Oswald, 2007). Hasil PCR Amplifikasi DNA pengkode 16S rRNA yang telah dimurnikan dan diukur konsentrasinya melalui NanoDrop Spektro-fotometri dapat dilihat pada Gambar 4.
Hasil amplifikasi PCR gen 16S rRNA yaitu 873 bp pada pasangan primer yang pertama 27F dan 907R serta pasangan primer yang kedua 533F dan 1492R yaitu 959 bp kemudian dilakukan sequencing. Proses sekuensing dilakukan dengan menggunakan jasa 1st BASE. Hasil pembacaan fragmen DNA berupa untai tunggal. Pada penelitian ini data
sequencing yang diperoleh berupa sekuen utuh DNA pengkode 16S rRNA isolat WU 021055* yang telah diolah secara manual menggunakan software BioEdit menjadi input program BLAST. Hasil sekuen utuh 16S rRNA pada penelitian didapatkan 835 bp, panjang urutan basa nukleotida tersebut cukup mampu mengidentifikasi isolat hingga tingkat genus dan pembacaan tingkat spesies dalam gen pengkode 16S rRNA untuk mengidentifikasi isolat bakteri.
Hasil analisis sekuen DNA pengkode 16S rRNA menunjukkan blast sekuen WU 021055* dengan data 16S rRNA di Gene Bank. Beberapa organisme yang memiliki homologi tertinggi (99%) dengan isolat bakteri WU 021055* dapat dilihat pada (Tabel 3).
Menurut Drancourt (2000)
berdasarkan data urutan gen pengkode 16S rRNA, homologi dengan nilai ≥99%
menunjukkan bahwa spesies yang
dibandingkan merupakan spesies yang sama, sedangkan homologi dengan nilai ≥97% dinyatakan bahwa isolat yang dibandingkan berada pada genus yang
sama dan homologi antara 89-93%
menunjukkan famili yang berbeda. Tetapi hal ini perlu ditelusuri melalui analisis filogenetik dengan melihat percabangan yang dibentuk oleh isolat melalui pengamatan posisi yang ditempati diantara spesies yang lain atau spesies pembandingnya. Pohon filogeni pada Gambar 5 menunjukkan bahwa isolat WU 021055* terletak sejajar dengan B. aerius yang berarti bahwa isolat WU
021055* merupakan B. Aerius.
Gambar 5. Pohon filogeni yang menunjukkan hubungan kedekatan isolat WU 021055* dengan bakteri yang terdapat
Karakterisasi Isolat Bakteri Fibrinolitik... Ajeng Maharani Sri Pananjung et al.
54
KESIMPULAN
Berdasarkan hasil analisis dan
pembahasan, maka dapat diambil
kesimpulan bahwa hasil pemeriksaan morfologi bakteri dan uji biokimia menujukkan bahwa isolat bakteri WU 021055* memiliki ciri yang sama dengan
Bacillus aerius. Berdasarkan hasil analisis sekuen dengan menggunakan program BLAST pada sekuen utuh hasil editing produk sequencing DNA pengkode 16S rRNA, isolat bakteri WU 021055*
merupakan Bacillus aerius dengan
presentase kemiripan 99%.
UCAPAN TERIMAKASIH
Terimakasih diucapkan kepada DIPA Universitas Jember yang telah membiayai penelitian ini melalui program Fundamental Nasional 2014 DIKTI.
DAFTAR PUSTAKA
Cappucino JG dan N Sherman (1987) Microbiology, A Laboratory Manual. California. Menko Park The Benjamin/ Cummins Publishing Company, Menlo Park, Calofornia.
Chasanah E (2009) Marine biodiscovery research In Indonesia: challenges and rewards. J Coastal Dev 12(1):1-12. Claus D dan CW Berkeley (1984)
Endospore-Forming Rods and Cocci. Dalam: NR Krieg dan JG Jolt (ed.), Bergeys Manual of Determinative Bacteriology. Williams and Wilkins, Baltimore: 529–551.
Cowan ST (1974) Manual for the Identification of Medical Bacteria. Cambridge University Press, London.
Drancourt M, C Bollet, A Carlioz, R Martelin, JP Gayral, D Raoult. (2000) 16S ribosomal DNA sequence analysis of a large collection of environmental and clinical unidentifiable bacterial isolates. J Clin Microbiol 38(10):3623-3630.
Escobar CE, DM Harmaening, VL Simmons, Smith, KM Moore, J Wyrick-Glatzel (2002) Introduction to Hemostasis. Dalam: DM Harmening (ed.), Clinical Hematology and Fundamentals of Hemostasis. (Edisi
Keempat) FA Davis, Philadelphia.
Jawetz M & Adelberg (2008) Mikrobiologi Kedokteran. Alih Bahasa oleh Huriwati Hartanto. Penerbit Buku Kedokteran ECG, Jakarta.
Lane DJ, B Pace, GJ Olsen, DA Stahl, ML Sogin, NR Pace (1985) Rapid determination of 16S ribosomal RNA sequences for phylogenetic analyses. Proc Natl Acad Sci USA.82(20):6955–6959.
Sravankumar G, YVK Durgaprasad, T Ramana, Hasasreeramulu dan CSLV Devi (2010) Isolation and identification of bacteria from marine biofilm on the artificial plat forms (iron panels) from Visakhapatham coast, India. Indian J Mar Sci 43(6): 955-959. Kumada K, T Onga, H Hoshino (1994) The effect
of natto possessing a high fibrinolytic activity in human plasma. Igaku to Seibutsugaku 128(3):117-119.
Oswald N (2007) Quick reference: Determining DNA Concentration and Purity. [online]
http://bitesizebio.com/13501/dna-concentration-purity/ diakses 17 Desem-ber 2015.
Prasad S, RS Kashyap, JY Deopujari, HJ Purohit, GM Taori, HF Daginawala (2007) Effect of Fagonia Arabica (Dhamasa) on in vitro Thrombolysis. BMC Complementary and Alternative Medicine 7(1):36.
Setiawan A (2013) Skrining Agen Fibrinolitik Isolat Bakteri dari Perairan pantai papuma kabupaten jember. Skripsi fakultas kesehatan masyarakat Universitas Jember. Sajuthi, Suparto, Yanti, dan Praira (2010)
Purifikasi dan Pencirian Enzim Protease Fibrinolitik dari Ekstrak Jamur Merang. Makara, Sains, 14(2):145-150.
World Health Organization (2008) The World Health Report 2008: Primary Health Care Now More Than Ever. Geneva: WHO Library Cataloguing-in-Publication.
Zhang X, Yuan Hongshui, Xin Xin dan Zhu
Baocheng (2012) Enzymological
Properties and Thrombolysis Effect in Vitro of Fibrinolytic Enzyme S-7FE-1.J Chin Ins Food Sci Tech 10:013. Jurnal online
http://en.cnki.com.cn/Article_en/CJFDTOT AL-ZGSP201210013.htm diakses 12 Juli 2015.
55
VOLUME 02 NOMOR 01 JUNI 2015
JURNAL
BIOTEKNOLOGI & BIOSAINS INDONESIA
Homepage Jurnal: www.jbbindonesia.weebly.comAKTIVITAS LIGNINOLISIS DARI BASIDIOMYCETES YANG DAPAT
DIPAKAI UNTUK BIODEGRADASI DIOKSIN
Ligninolytic Activity of Basidiomycetes Applicable for Dioxin Biodegradation
Nuki Bambang Nugroho
Balai Pengkajian Bioteknologi, BPPT
Gedung 630 Kawasan PUSPIPTEK, Setu, Tangerang Selatan, 15314 Telp : (021) 7563120, Fax : (021) 7560208
E-mail: [email protected]
ABSTRACT
Chemical compounds that belong to dioxin group known as highly toxic environmental
pollutant. Polychlorinated dibenzo-p-dioxin and polychlorinated dibenzofuran produced during organic materials burning process. Pentachlorophenol, a compound similar to dioxin, widely used as wood preservative, fungicide, bacteriocide, herbicide, algicide and insecticide. Some white-rot fungi have potential to produce lignin degrading enzyme and degrade dioxin compounds. Diversity of white-rot fungi in Indonesia, which is a potential source for environmental pollutant-degrading microorganisms. In this study, basidiomycetes were isolated from fruiting body and rotted wood samples. Samples were collected from seven provinces in Indonesia. Three hundred seventy isolated basidiomycetes were screened for dioxin degrading activity. Dye-decolorization method was used for this screening. The result indicated that sixty isolated basidiomycetes have dioxin degrading activity, three of these basidiomycetes indicated significant activity.
Keywords: ligninolytic, basidiomycetes, biodegradation, dioxin ABSTRAK
Senyawa-senyawa kimia dalam kelompok dioksin telah diketahui sebagai polutan lingkungan yang sangat beracun. Dibenzo-p-dioksin terpoliklorinasi dan dibenzofuran terpoliklorinasi dihasilkan selama proses pembakaran bahan-bahan organik. Pentaklorofenol, suatu senyawa mirip dioksin, banyak digunakan sebagai pengawet kayu, fungisida, bakterisida, herbisida, algisida dan insektisida. Beberapa jamur pelapuk putih memiliki potensi untuk menghasilkan enzim pengurai lignin dan mendegradasi senyawa-senyawa dioksin. Keanekaragaman jamur pelapuk putih di Indonesia yang tinggi merupakan sumber potensial mikroorganisme pengurai polutan lingkungan. Pada kajian ini,
basidiomisetes diisolasi dari sampel-sampel tubuh buah dan kayu lapuk yang diambil dari tujuh provinsi di Indonesia. Tiga ratus tujuh puluh isolat basidiomisetes telah diseleksi aktivitasnya sebagai pendegradasi dioksin. Metode dye-decolorization digunakan pada seleksi ini. Hasil seleksi menunjukkan bahwa enam puluh isolat basidiomisetes memiliki aktivitas sebagai pendegradasi dioksin, tiga isolat di antaranya menunjukkan aktivitas tertinggi.
Kata kunci: ligninolisis, basidiomycetes, biodegradasi, dioksin
Aktivitas Ligninolisis dari Basidiomycetes… Nuki Bambang Nugroho
56
PENDAHULUAN
Jaringan kayu terdiri atas tiga biopolimer utama; selulosa, hemiselulosa dan lignin. Lignin merupakan polimer aromatik sangat tidak beraturan yang disintesis pada tanaman oleh reaksi polimerisasi p -hidroksisinamil alkohol tersubstitusi. Reaksi polimerisasi ini dikatalisis oleh enzim peroksidase. Beberapa mikroorganisme, khususnya jamur pelapuk putih, dapat mendegradasi polimer lignin yang kompleks.
Phanerochaete chrysosporium merupakan jamur pelapuk putih yang sering dipakai pada penelitian biodegradasi lignin (ligninolisis). Ligninolisis hanya terjadi jika ada substrat lain yang dapat didegradasi (Field et al. 1993). Setelah pertumbuhan awal P. chrysosporium
berhenti karena keterbatasan karbon, nitrogen atau belerang, ligninolisis mulai terjadi.
Ligninolisis merupakan proses tidak spesifik. Senyawa yang memiliki struktur aromatik (seperti senyawa xenobiotic) sangat mudah didegradasi oleh enzim ligninolisis. Senyawa-senyawa kimia dalam kelompok dioksin telah diketahui sebagai polutan lingkungan yang sangat beracun. Dibenzo-p -dioksin terpoliklorinasi (polychlorinated dibenzo-p-dioxin / PCDD) dan dibenzofuran terpoliklorinasi (polychlorinated dibenzofuran / PCDF) dihasilkan pada proses pembakaran bahan-bahan organik (Valli et al. 1992;Wittich 1998). Pentaklorofenol (pentachloro-phenol / PCP), suatu senyawa mirip dioksin, banyak digunakan sebagai pengawet kayu, fungisida, bakterisida, herbisida, algisida dan insektisida. Banyak senyawa xenobiotic, seperti PCDD, PCDF, polycyclicaromatichydrocarbon (PAH), fenol terklorinasi, polychlorinated biphenyl
(PCB), pestisida dan senyawa-senyawa pewarna, dapat dioksidasi pada kultur jamur pelapuk putih (Kamei dan Kondo 2005; Mori dan Kondo 2002a, 2002b, 2002c, Field dan Sierra-Alvarez 2008). Jamur dapat mendegradasi PCDD/PCDF pada kondisi aerob. Jamur menggunakan enzim (lignin peroksidase atau mangan peroksidase) untuk mengoksidasi molekul dari senyawa PCDD / PCDF (Urbaniak 2013). Selain jamur, bakteri yang diisolasi dari tanah terkontaminasi dioksin dapat mendegradasi fenol, dan hal ini
menunjukkan juga kemampuan
mendegradasi PCDD/PCDF (
Bui et al
. 2012). Beberapa enzim terlibat padaligninolisis terutama lignin peroksidase (LiP) dan mangaan peroksidase (MnP). Beberapa jamur pelapuk putih (white-rot fungi) diketahui menghasilkan enzim LiP, salah satu enzim pengurai lignin (Buckley et al. 1998). Enzim LiP yang dimurnikan dapat mengoksidasi beberapa senyawa PAH menjadi PAH kinon, PCP menjadi tetrakloro-p-benzokinon, dan
memecah diklorodibenzo-p-dioksin
(dichlorodibenzo-p-dioxin / DCDD). Proses penguraian dioksin tidak hanya dilakukan oleh LiP, tetapi juga dibantu oleh MnP dan
laccase (Lac). Beberapa jamur pelapuk putih, tetapi bukan P. Chrysosporium, juga menghasilkan enzim Lac. Enzim ini merupakan enzim yang bekerja pada o-kinol,
p-kinol dan amino fenol. Lac berperan pada polimerisasi fenol dan oksidasi senyawa aromatik bukan fenol. Enzim dehalogenase dapat mendegradasi PCDD yang memiliki lebih dari empat subtituen klorin (Sakaki dan Munetsuna 2010).
Metode seleksi enzim oksidase, khususnya Lac dan peroksidase, biasanya berdasarkan reaksi pembentukan atau
penghilangan warna sehingga
pendeteksiannya mudah dilakukan.
Penghilangan warna pada senyawa pewarna merupakan indikator terjadinya oksidasi awal senyawa-senyawa xenobiotic dan lignin (Pasti dan Crawford 1991). Jamur pelapuk putih dapat mendegradasi senyawa-senyawa dioksin karena struktur kimia dioksin mirip dengan sebagian struktur lignin. Enzim peroksidase dihasilkan oleh jamur pelapuk putih mengkatalisis oksidasi lignin dan senyawa aromatik menyerupai lignin. Senyawa pewarna seperti Remazol Brilliant Blue R, Poly B-411, Poly R-478, Poly R-481, Poly S-119, Poly T-128 dan Poly Y-606 dapat mengalami penghilangan warna oleh jamur pendegradasi lignin (Glenn dan Gold 1983, Platt et al. 1985, Pasti dan Crawford 1991, Ollikka et al. 1993).
BAHAN DAN METODE
1. Sampel
Sampel kayu lapuk dan tubuh buah basidiomisetes diambil dari 7 provinsi di Indonesia, yaitu Sumatera Barat, Jawa Barat, Kalimantan Timur, Sulawesi Selatan, Sulawesi Utara, Bali dan Lombok. Sampel untuk isolasi basidiomisetes adalah kayu lapuk dan tubuh buah basidiomisetes.
57 Seleksi Basidiomisetes sebagai pengurai
dioksin dilakukan dengan metode dye decolorization. Basidiomisetes yang menunjukkan aktivitas pengurai dioksin selanjutnya diisolasi dengan metode single
mycelium transfer.
2. Metode seleksi
Metode seleksi awal (primary screening method) mengadopsi metode dye decolorization sebagaimana diuraikan oleh Sato et al. (2002). Senyawa pewarna Remazol brilliant blue R (RBBR) mengalami pengurangan / penghilangan warna oleh jamur pendegradasi lignin, sehingga penghilangan warna ini merupakan indikator yang baik untuk mengetahui oksidasi awal senyawa xenobiotic dan lignin (Pasti dan Crawford 1991). Seleksi awal dilakukan dengan menginokulasikan sampel langsung ke permukaan media pewarna yang terdiri atas dua lapis. Lapis atas: 0,5% malt extract (Difco Laboratories, detroit, MI, USA), 1% agar dan 1% RBBR. Lapis bawah: Czapek Dox agar (Difco Laboratories, detroit, MI, USA). Benomyl 20 mg/l (Aldrich Chemical Co. Inc., Milwaukee, WI, USA) ditambahkan ke lapis atas media untuk menghambat pertumbuhan jamur-jamur yang tidak diinginkan.
Isolat yang terseleksi dengan dye decolorization diseleksi lanjut mengikuti
secondary screening method (Gambar 1) (Sato et al. 2002). Setiap isolat yang terseleksi dengan dye decolorization
ditransfer ke dalam empat labu Erlenmeyer 50 mL bertutup gelas berisi 5 mL medium rendah nitrogen (Tien dan Kirk 1988), dan dipreinkubasi pada 25oC selama 10 hari. Setelah preinkubasi, 20 µl 2,7-DCDD (AccuStandard Inc., New Haven, CT, USA. dilarutkan dalam N,N-dimethylformamide / DMF) ditambahkan ke dalam dua labu sampai konsentrasi akhir 2,7-DCDD 10 µM (kultur inkubasi 15 hari: A). Tutup labu Erlenmeyer dilapis rekat dengan pita Teflon setelah penambahan 2,7-DCDD. Selama 15 hari inkubasi pada 25oC, 250 µl larutan glukosa 20% (konsentrasi akhir 1%) ditambahkan dua kali dan oksigen ditambahkan empat kali ke dalam kultur (Gambar 1). Dua puluh mikroliter DMF (tanpa 2,7-DCDD) ditambahkan ke dalam dua labu lainnya (kultur kontrol: B), kemudian diperlakukan (inkubasi, penambahan glukosa
dan penambahan oksigen) seperti kultur A. Satu hari sebelum akhir masa inkubasi, 2,7-DCDD ditambahkan ke dalam kultur B, DMF ditambahkan ke dalam kultur A. Setelah inkubasi selesai, dilakukan perbandingan jumlah 2,7-DCDD tersisa dalam kultur A dan B.
Untuk mengambil 2,7-DCDD yang tersisa dalam kultur, dilakukan mengikuti Sato
et al. (2002). Asam sulfat pekat sebanyak 5 mL ditambahkan sebelum ekstraksi dengan n -heksana (tiga bagian masing-masing 10 mL) (Takada et al. 1996). Fraksi n-heksana dikumpulkan dan dicuci dengan aquades. Fraksi dikeringkan dalam desikator dengan penyerap air natrium sulfat kemudian dipekatkan sampai 0,1 mL. Konsentrasi 2,7-DCDD ditentukan dengan GC-MS mengikuti kondisi yang dijelaskan oleh Sato et al. (2002). Antrasena digunakan sebagai internal standar.
HASIL DAN PEMBAHASAN
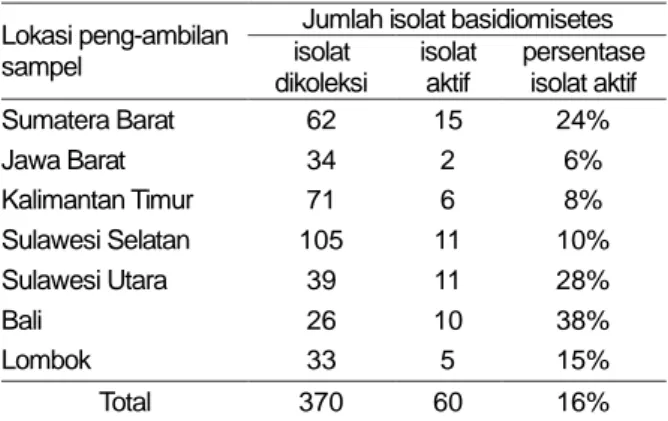
Dari isolasi ini diperoleh 370 isolat basidiomisetes, 60 di antaranya menunjukkan aktivitas penghilangan warna senyawa RBBR (Tabel 1). Perbandingan jumlah isolat aktif penghilang warna RBBR terhadap total isolat pada setiap lokasi sampel berkisar dari 6% sampai 38%. Isolat-isolat aktif penghilang warna RBBR diseleksi lebih lanjut menggunakan secondary screening method.
Persentase 2,7-DCDD yang tersisa dalam kultur A dan B ditunjukkan pada Tabel 2 dan Gambar 2. Dari 60 isolat yang diseleksi menggunakan secondary screening method diperoleh 12 isolat dengan kemampuan degradasi dioksin. Sebagian besar isolat ini menunjukkan laju recovery
2,7-DCDD yang mirip untuk kedua perlakuan
Tabel 1. Aktivitas penghilangan warna RBBR oleh isolat basidiomisetes
Lokasi peng-ambilan sampel
Jumlah isolat basidiomisetes isolat dikoleksi isolat aktif persentase isolat aktif Sumatera Barat 62 15 24% Jawa Barat 34 2 6% Kalimantan Timur 71 6 8% Sulawesi Selatan 105 11 10% Sulawesi Utara 39 11 28% Bali 26 10 38% Lombok 33 5 15% Total 370 60 16%
Aktivitas Ligninolisis dari Basidiomycetes… Nuki Bambang Nugroho
58
(A dan B). Hal ini menunjukkan bahwa sebagian besar isolat hanya memiliki kemampuan kecil dalam mendegradasi dioksin, kecuali isolat KT-BS, KT-BB dan SS-MN. Isolat KT-BS dan KT-BB diisolasi dari sampel asal Bukit Suharto dan Bukit Bangkirai Kalimantan Timur, sedangkan isolat SS-MN berasal dari sampel Malino Sulawesi Selatan. Perbedaan recovery 2,7-DCDD ditunjukkan isolat BS (23%), KT-BB (27%) dan SS-MN (18%). Perbedaan
recovery 2,7-DCDD oleh ketiga isolat ini
menunjukkan kemampuan degradasi
dioksin yang nyata. Kemampuan ketiga isolat pendegradasi dioksin ini lebih besar dibandingkan galur pendegradasi dioksin,
Phanerochaete sordida YK-624 (5%) (Sato
et al. 2002).
Tabel 2. Recovery 2,7-DCDD dari kultur inkubasi 15 hari dan 1 hari (kontrol) Isolat Recovery 2,7-DCDD inkubasi 15 hari (A) inkubasi 1 hari = kontrol (B) perbedaan (B-A) SB-7 100% 98% -2% SB-13 88% 92% 3% JB-17 78% 79% 2% KT-BS 76% 99% 23% KT-BB2 64% 91% 27% SS-MN 82% 100% 18% SU-12 75% 76% 1% SU25 67% 73% 6% BL-11 71% 69% -2% BL-18 56% 66% 10% LB-18 39% 39% 0% LB-24 38% 30% -8% YK-624* 5%
*data dari Sato et al. (2002)
59
Gambar 2.Recovery 2,7-DCDD dari kultur inkubasi 15 hari dan 1 hari (kontrol)
KESIMPULAN
Metode dye-decolorization dapat digunakan pada seleksi basidiomisetes pendegradasi dioksin. Seleksi dengan metode dye-decolorization menunjukkan 60 isolat basidiomisetes yang menunjukkan aktivitas sebagai pendegradasi dioksin.
Seleksi lanjutan dengan metode
perbandingan degradasi dioksin pada kultur lima belas hari dengan kontrol menunjukkan ada 3 isolat yang menunjukkan aktivitas degradasi dioksin yang nyata.
DAFTAR PUSTAKA
Buckley KF, Dobson DW (1998) Extracellular ligninolytic enzyme production and polymeric dye decolorization in immobilized cultures of Chrysosporium lignorum CL1. Biotechnol Lett 20(3):301-306.
Bui HB, Nguyen LT, Dang LD (2012) Biodegradation of Phenol by Native Bacteria Isolated From Dioxin Contaminated Soils. J Bioremed Biodeg 3(11):1-6. doi:10.4172/2155-6199.1000168.
Field JA, de Jong E, Feijoo-Costa G, de Bont JAM (1993) Screening for ligninolytic fungi applicable to the biodegradation of xenobiotics. Trends Biotechnol 11(2):44-49.
Field JA, Sierra-Alvarez R (2008) Microbial transformation and degradation of polychlorinated biphenyls. Environ Pollut 155(1):1-12.
Glenn JK, Gold MH (1983) Decolorization of
several polymeric dyes by the
lignin-degrading basidiomycete
Phanerochaete chrysosporium. Appl Environ Microbiol 45(6):1741-1747. Ollikka P, Alhonmäki K, Leppänen V, Glumoff
T, Raijola T, Suominen I (1993) Decolorization of azo, triphenyl methane, heterocyclic, and polymeric dyes by lignin peroxidase isoenzymes from Phanerochaete chrysosporium. Appl Environ Microbiol 59(12):4010-4016.
Kamei I, kondo R (2005) Biotransformation of dichloro-, trichloro-, and tetrachlorodibenzo-p-dioxin by the white-rot fungus Phlebia lindtneri. Appl Microbiol Biotechnol 68(4):560-566. Mori T, kondo R (2002a) Degradation of
2,7-dichlorodibenzo-p-dioxin by wood-rotting fungi, screened by dioxin degrading ability. FEMS Microbiol Lett 213(1):127-131.
Mori T, kondo R (2002b) Oxidation of chlorinated dibenzo-p-dioxin and dibenzofuran by white-rot fungus,
Phlebia lindtneri. FEMS Microbiol Lett 216(2):223-227.
Mori T, Kondo R (2002c) Oxidation of dibenzo- p-dioxin, dibenzofuran, biphenyl, and diphenyl ether by the white-rot fungus Phlebia lindtneri. Appl Microbiol Biotechnol 60(1-2):200-205. Pasti MB, Crawford DL (1991) Relationships
between the abilities of streptomycetes to decolorize three anthron-type dyes and to degrade lignocellulose. Can J Microbiol 37(12):902-907.
Platt MW, Hadar Y, Chet I (1985) The decolorization of the polymeric dye Poly-Blue (polyvinalamine sulfonate-anthroquinone) by lignin degrading fungi. Appl Microbiol Biotechnol 21(6):394-396.
Sakaki T, Munetsuna E (2010) Enzyme systems for biodegradation of polychlorinated dibenzo-p-dioxins. Appl Microbiol Biotechnol 88(1):23-30. Sato A, Watanabe T, Watanabe Y, Harazono
K, Fukatsu T (2002) Screening for basidiomycetous fungi capable of degrading 2,7-dichlorodibenzo-p-dioxin. FEMS Microbiol Lett 213(2):213-217. Takada S, Nakamura M, Matsueda T, Kondo
R, Sakai K (1996) Degradation of polychlorinated dibenzo-p-dioxins and
Aktivitas Ligninolisis dari Basidiomycetes… Nuki Bambang Nugroho
60
polychlorinated dibenzofurans by the white rot fungus Phanerochaete sordida YK-624. Appl Environ Microbiol 62(12):4323-4328.
Tien M, Kirk TK (1988) Lignin peroxidase of
Phanerochaete chrysosporium YK-624. Methods Enzymol 161:238-249.
Urbaniak M (2013) Biodegradation of PCDDs/PCDFs and PCBs. Di dalam: R Chamy and F Rosenkranz (Ed.) (2013) Biodegradation-Engineering
and Technology, Intech Publisher. Valli K, Wariishi H, Gold MH (1992)
Degradation of 2,7-dichlorodibenzo-p-dioxin by the lignin-degrading
basidiomycete Phanerochaete
chrysosporium. J Bacteriol 174(7):2131-2137.
Wittich RM (1998) Degradation of dioxin-like compounds by microorganisms. App Microbiol Biotechnol 49(5):489-499.
61
VOLUME 02 NOMOR 01 JUNI 2015
JURNAL
BIOTEKNOLOGI & BIOSAINS
INDONESIA
Homepage Jurnal: www.jbbindonesia.weebly.com
PENICILLIN PRODUCTION BY MUTANT OF
Penicillium chrysogenum
Produksi Penisilin oleh Mutan
Penicillium chrysogenum
Dudi Hardianto, Suyanto, Erwahyuni E. Prabandari, Lira Windriawati, Edy Marwanta and Tarwadi
Biotech Center, Agency for the Assessment and Application of Technology, Puspiptek Area Serpong 15314, Indonesia
E-mail: [email protected]
ABSTRAK
Penisilin adalah antibiotika yang pertama kali ditemukan dan digunakan untuk pengobatan infeksi bakteri. Sejak ditemukan penisilin sebagai antibioti ka oleh Alexander Fleming pada tahun 1928, banyak usaha dilakukan untuk meningkatkan produktivitas Penicillium chrysogenum.Pemuliaan galur untuk meningkatkan produksi penisilin dapat menggunakan mutasi acak secara fisika dan kimia. Pada penelitian ini, rad iasi sinar ultraviolet digunakan untuk mendapatkan mutan Penicillium chrysogenum. Produksi penisilin ditentukan dengan HPLC dan produktivitas mutan dibandingkan dengan induk Penicillium chrysogenum. Hasil produksi penisilin dari mutan M12 menghasilkan peni silin 1,23 kali lebih banyak dibandingkan dengan induk Penicillium chrysogenum. Kata kunci: Penisilin, Penicillium chrysogenum, ultraviolet, mutant.
ABSTRACT
Penicillin is the first antibiotic discovered and used for treatment of bacterial infections. Since the discovery of penicillin as antibiotic by Alexander Fleming in 1928, much effort has been invested to improve productivity of Penicillium chrysogenum. Strain improvement to increase the penicillin production can use random mutation with physical and chemical. In this research, Ultraviolet irradiation was used to obtain Penicillium chrysogenum mutant. Penicillin production was determined by HPLC and productivity of Penicillium chrysogenum
mutants were compared to wild type. The penicillin yield of m utant M12 produced1.23 fold compared to wild type.
Keywords: Penicillin, Penicillium chrysogenum, ultraviolet, mutant.
Penicillin Production by Mutant… Dudi Harianto et al.
62
INTRODUCTION
Penicillin is the first antibiotic discovered and used for treatment of bacterial infections. The structure of β-lactam penicillin consists of a bicyclic nucleus formed by a β-lactam ring and a thiazolidine ring containing a sulfur atom and an acyl side chain bound to the amino group present at C-6 (Liras and Martin 2006). Although some bacteria are resistant to penicillin, this antibiotic is still widely used today. Penicillin is used in treatment many gram-positive bacterial infections, such as Staphylococcus
pyogenes (strep throat) and
Streptococcus pneumoniae (respiratory tract infection, otitis media) (Christensen
et al. 2000, Rayamajhi et al. 2000). Bacterial cell wall synthesis is inhibited by penicillin. Penicillin binds to the enzyme transpeptidase that link the peptidoglycan molecules in bacterial cell wall.
Penicillin industrially is produced by the filamentous fungus Penicillium chrysogenum and commercial production of penicillin began in 1941 (Newbert et al. 1997). The production of penicillin by the submerged fed-batch fermentation in stainless tank reactors of 30,000-100,000 galon capacity is important for several decades (Elander 2003) and optimization of penicillin production is very important for the penicillin companies (Thykaer dan Nielsen 2003). Since the discovery of the production of antibiotics by Alexander Fleming in 1929, much effort has been invested in selection and synthesis of strains with improved productivity (Harris
et al. 2009). Classical strain improvement with random mutation and screening has been used to obtain overproducing strains. The UV irradiation is the one of techniques for strain improvement and its technique is very effective for mutation because the bases DNA absorb the UV irradiation. The effect of the absorbed UV irradiation is the formation of thymine dimers and cross links in the same strand (Parekh et al. 2000). Mutants are unstable, mutagenic events are random and do not necessarily affect only the genes involved in antibiotic synthesis. Re-isolation of mutants, since prolonged
storage of high producing strains is needed to know stability of mutants.
The increase in penicillin
fermentation productivity and high recovery yield (>90%) has led to significant cost reduction fispite increasing labor, energy, and raw materials costs. In 1953, the bulk cost for penicillin production was ~$300/kg. In 1980, the bulk price for penicillin was ~$35/kg. In the late 1990s, bulk penicillin cost ranged from $10 to 20/kg and bulk marketed costs for 6-APA have been estimated to range from $ 35 to 40/kg (Elander 2000).
The aim of this research was obtained Penicillium chrysogenum mutant that produces higher amount of penicillin than wild type.
MATERIALS AND METHODS
1. Microorganism
Strain of Penicillium chrysogenum in this study was obtained from Biotech Center Culture Collection, Agency for the Assessment and Application of Technology.
2. Mutation by UV Irradiation
Czapek Dox Agar was used to select
Penicillium chrysogenum mutants. A conidial from 10 days old culture of
Penicillium chrysogenum was suspended in striled water and ajusted to about 103 conidia/ml. Conidial suspension was irradiated by short wave UV irradiation of 254 nm and the time of irradiated variated from 5-30 minutes with interval 5 minutes. 50 µL conidial suspension of the growth of
Penicillium chrysogenum mutants were inoculated, spreaded into Czapek Dox Agar plates, and the inoculated plates were incubated for 10 days at 28oC.
3. Isolation and Selection Mutants
After 10 days, mutant colonies were separated by inoculation each mutant colony on Czapek Dox Agar plates. The inoculated plates were incubated for 10 days at 28oC.
4. Production of Penicillin
One of mutants colony was inoculated in seed medium (6.1% corn steep liquor, 2.0 % sucrose, 0.5% CaCO3) and incubated in
63 suspension of inoculum was inoculated in
fermentation medium (4.2% corn step liquor, 13% lactose, 0.40% KH2PO4, (NH4)SO4.7H2O
0.45%, 0.15% Na2SO4, 0.1% CaCO3 pH 5.9)
and incubated in shaker for 10 days at 28oC.
4. Analysis of Penicillin
Broth of fermentation was centrifugated at 15000 g, and supernatant was filtered through filter 0.45 µm. 10 µL sample was injected to HPLC mechine from Waters with C18 column (Symmetry), mobile phase: 5 mM KH2PO4 and 6 mM H3PO4 : Acetonitrile (60 :
40), flow rate 1.0 mL/min, and ultraviolet detector λmax: 210 nm.
RESULTS AND DISCUSSION
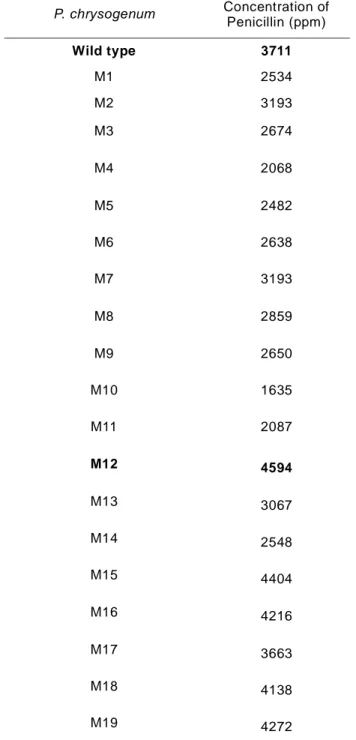
The survivals of P. chrysogenum
mutants were selected and tested for penicillin production. Penicillin yield of Mutants varied from 1635 to 4594 ppm. Mutant M12 produced 1.23 fold (4594 ppm) compared to wild type (3305 ppm) (Table 1.). The hyperproduction of mutant may be caused mutation of one or more biosynthesis of penicillin gene or the disrupsion of the lys2 gene (gene for lysine biosynthesis). The mutation of biosynthesis of penicillin gene may increase enzymes activity for penicillin production or disruption of the lys2
gene increase aminoadipic acid (precursor for penicillin biosynthesis).
Figure 1. Effect of UV exposure time on P.chrysogenum and mutants from 50% and above survivals were selected and used for production of penicillin.
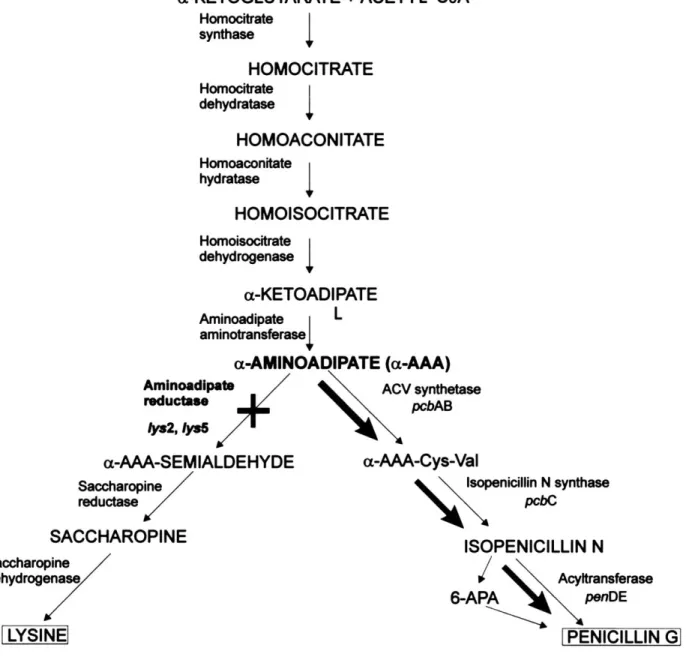
In Penicillium chrysogenum the biosynthesis of penicillin and lysine have several steps in common (Figure 2.). It should be possible to increase penicillin production by the disrupsion of lys2 gene (Casqueiro et al. 1999). The poor result of penicillin of mutants may be caused by mutation in penicillin biosynthesis genes. The mutation of biosynthesis of penicillin gene may cause decrease enzymes activity for penicillin production.
Table 1. Penicillin production of mutants
P. chrysogenum Concentration of Penicillin (ppm) Wild type 3711 M1 2534 M2 3193 M3 2674 M4 2068 M5 2482 M6 2638 M7 3193 M8 2859 M9 2650 M10 1635 M11 2087 M12 4594 M13 3067 M14 2548 M15 4404 M16 4216 M17 3663 M18 4138 M19 4272 0 20 40 60 80 100 120 0 5 10 15 20 25 30 35 Su rv iv al s (%)
Exposure time (min) Survivals
Penicillin Production by Mutant… Dudi Harianto et al.
64
Figure 2. Biosynthesis pathway of penicillin and lysine in P. chrysogenum (Casqueiro et al. 1999)
CONCLUSION
The penicillin yield of mutants var-ied from 1635 to 4594 ppm and mutant M12 from 30 minutes-irradiated produced 1.23 fold compared to wild type.
REFERENCES
Casqueiro J, S Guteirrez, O Banuelos, MJ Hijarrubia, and J.F. Martin (1999) Gene targeting in Penicillium chrysogenum: disruption of the lys2
gene leads to penicillin Overproduc-tion. J Bacteriol 181(4): 1181-1188. Christensen B, J Thykaer, and J Nielsen
(2000) Metabolic characterization of high- and low-yielding strains of
Penicillium chrysogenum. Appl Microbiol Biotechnol 54(2): 212-217. Elander RP (2003) Industrial production of
β-lactam antibiotics. Appl Microbiol Biotechnol 61(5-6): 385-392.
Harris DM, ZA van der Krogt, P Klaassen, LM Raamsdonk, S Hage, MA van den Berg, RAL Bovenberg, JT Pronk, and J
65 Daran (2009) Exploring and dissecting
genome-wide gene expression re-sponses of Penicillium chrysogenum to phenylacetic acid consumption and penicillinG production. BMC Genom: 10(1):75.
Irum W and T Anjum (2012) Production en-hancement of cyclosporin ‘A’ by
Aspergillus terreus throug mutation. Afr J Biotechnol 11(7): 1736-1743.
Liras P and JF Martin (2006) Gene Cluster for β-lactam Antibiotics and Control of Their Expression: Why Have Clusters Evolved, and from Where did They originate? Int Microbiol 9(1): 9-19. Newbert RW, B Barton, P Greaves, J
Har-per, and G Turner (1997) Analysis of a commercially improved Penicillium chrysogenum strain series:
involve-ment of recombinogenic regions in amplification and deletion of the peni-cillin biosynthesis gene cluster. J Ind Microbiol Biotechnol 19(1): 18-27. Parekh S, VA Vinci, and RJ Strobel (2000)
Improvement of Microbial Strain and
Fermentation Processes. Appl
Microbiol Biotechnol 54(3): 287-301. Ravalat J, T Douki, and J Cadet (2001)
Di-rect and IndiDi-rect Effect of UV Radiation on DNA and its Components. J Photochemist Photobiol: 63(1-3):88-102.
Rayamajhi N, SB Cha, and HS Yoo (2000) Antibiotics resistances: past, present and future. J Biomed Res 11(2): 65-80. Thykaer and J Nielsen (2003) Metabolic
en-gineering of β-lactam production.
Penentuan Kombinasi Medium… Rofiq Sunaryanto et al.
66
VOLUME 02 NOMOR 01 JUNI 2015
JURNAL
BIOTEKNOLOGI & BIOSAINS INDONESIA
Homepage Jurnal: www.jbbindonesia.weebly.comPENENTUAN KOMBINASI MEDIUM TERBAIK GALAKTOSA DAN
SUMBER NITROGEN PADA PROSES PRODUKSI ETANOL
Determination of The Best Medium of Galactose and Nitrogen Sources on Ethanol Production
Rofiq Sunaryanto1 dan Berti Hariasih Handayani2
1
Balai Pengkajian Bioteknologi, Kawasan PUSPIPTEK Serpong Tangerang Selatan Banten 15314. Telp/Fax.(021)7560208
2
Jurusan Biologi Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Padjajaran. E-mail: [email protected]
ABSTRACT
Ethanol is an important product for the industry based on biotechnology. Ethanol can be produced from various raw materials and some types of microbes. Determination of the best combination of galactose with nitrogen sources on ethanol production using Saccharomyces cerevisiae has been done. Combination of Galactose concentration 3 g/L and 20 g/L with the nitrogen source 10 g/L (casein, peptone, and urea) is used to obtained the best composition of medium. Fermentation was carried out for 60 hours at 30° C, agitation 250 rpm, working volume 50 mL in a 250 mL erlenmeyer. The results showed the galactose concentration 20 g/L was able to improve the productivity of ethanol. Galactose 20 g/L with 10 g/L casein produce highest ethanol 6% (v/v). Galactose 20 g/L with 10 g/L peptone produce 2.5% (v/v) ethanol, and galactose 20 g/L with 10 g/L urea produce 0.58% (v/v) ethanol. The use of galactose concentration 3 g/L with some combination of nitrogen sources produce ethanol below 0,7%(v/v).
Keywords: ethanol, galactose, peptone, urea, casein, Saccharomyces cerevisiae ABSTRAK
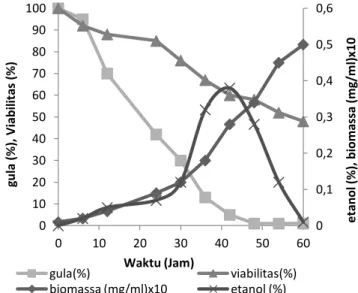
Etanol merupakan salah satu produk penting bagi industri yang berbasis bioteknologi. Etanol dapat dihasilkan dari berbagai macam bahan baku dan beberapa jenis mikroba. Penentuan kombinasi terbaik antara galaktosa dengan sumber nitrogen pada produksi etanol menggunakan Saccharomyces cerevisiae telah dilakukan. Konsentrasi galaktosa 3 g/L dan galaktosa 20 g/L dikombinasikan dengan sumber nitrogen dengan konsentrasi 10 g/L dalam hal ini digunakan kasein, pepton, dan urea digunakan sebagai perlakuan untuk mendapatkan kombinasi medium sumber karbon dan sumber nitrogen terbaik. Fermentasi untuk menghasilkan etanol dilakukan selama 60 jam pada suhu 30°C, agitasi 250 Rpm dengan volume kerja 50 mL dalam erlenmeyer 250 mL. Hasil penelitian menunjukkan penambahan galaktosa dengan konsentrasi sampai dengan 20 g/L mampu memperbaiki produktivitas etanol dan pertumbuhan sel Saccharomyces cerevisiae. Konsentrasi 20 g/L galaktosa dengan 10 g/L kasein menghasilkan produktivitas etanol paling tinggi yaitu 6%(v/v), konsentrasi galaktosa 20 g/L dengan 10 g/L pepton menghasilkan 2,5% (v/v) etanol dan konsentrasi galaktosa 20 g/L dengan 10 g/L urea menghasilkan 0,58%(v/v) etanol. Penggunaan konsentrasi galaktosa 3 g/L yang dikombinasikan dengan beberapa jenis sumber nitrogen menghasilkan etanol dibawah 0,7%(v/v).
Kata Kunci: etanol, galaktosa, pepton, urea, kasein, Saccharomyces cerevisiae