BAB VII
IDENTIFIKASI HIBRIDA SOMATIK HASIL FUSI ANTARA JERUK SIAM SIMADU DENGAN MANDARIN SATSUMA
Ringkasan
Fusi protoplas adalah salah satu alat yang dapat digunakan dalam program perbaikan tanaman pada tanaman jeruk. Hibrida somatik pada tanaman yang berasal dari hasil fusi protoplas dari dua tetua yang berbeda dapat diidentifikasi secara molekuler, sitologi, dan morfologi. Untuk mendapatkan hibrida somatik hasil fusi protoplas antara jeruk siam Simadu dengan Mandarin Satsuma pada penelitian ini dilakukan melalui pertumbuhan in vitro pada media selektif terhadap regeneran yang diperoleh, marka molekuler ISSR, jumlah kromosom, morfologi dan warna daun serta kandungan total klorofil daun. Dari hasil penelitian keragaan pertumbuhan in vitro pada media tumbuh MW+EM 500 mg/l diperoleh 5 kandidat hibrida somatik dari 19 regeneran yang dihasilkan. Berdasarkan evaluasi molekur dengan penanda ISSR8 diperoleh 4 hibrida somatik dari 5 kandidat yang diuji. Jumlah kromosom dari hibrida somatik yang diperoleh merupakan penjumlahan dari jumlah kromosom kedua tetuanya (36 pasang) kecuali R10 dengan jumlah kromosom 35 pasang. Warna dan tulang daun dari hibrida somatik merupakan intermediet dari kedua tetuanya.
Kata kunci: Jeruk siam Simadu, mandarin Satsuma, identifikasi, in vitro, sitologi, ISSR, morfologi, hibrida somatik.
IDENTIFICATION OF FUSAN SOMATIC HYBRIDS BETWEEN SIAM SIMADU WITH MANDARIN SATSUMA
Abstrak
Protoplasts fusion is one tool that can be used for citrus breeding program. Somatic hybrid from two different parents can be identified by molecular, cytological, and morphology. To obtain somatic fusion hybrid between Mandarin Satsuma and siam Simadu in this study, the growth in vitro on selective media for regenerant obtained, ISSR molecular markers, chromosome number, morphology and leaf color and leaf chlorophyll content. Results of research on the performance of growth in vitro growth medium MW + EM 500 mg / l obtained 19 regenerants, five of whom are candidates for somatic hybrids. Based on the evaluation of ISSR molecular marker was obtained four somatic hybrids of the five candidates tested. Somatic hybrids chromosome number obtained was the sum of the number of chromosomes for both parents (36 pairs), except for R10 with the number 35 pairs of chromosomes. Leaf and bones color from somatic hybrid is an intermediately of both their parents.
Keywords: Citrus siam Simadu,Mandarin Satsuma, identification, in vitro culture, cytology, ISSR, morphology, and somatic hybrids.
Pendahuluan
Populasi dari tanaman yang diregenerasikan dari fusi protoplas mengandung variabilitas genetik yang lebih tinggi dibandingkan variabilitas dari populasi tanaman yang dihasilkan dari hibrida seksual karena terdapat rekombinasi gen yang ada pada sitoplasma selain rekombinasi dari inti (Wenzel 1980; Grosser et al. 1990 dan Spiegel-Roy dan Goldschmidt 1996). Variabilitas teramati pada bagian yang berbeda dari karakter fenotipik seperti tinggi tanaman, bentuk daun, ukuran daun, ukuran petiol, panjang daun, warna bunga, bentuk buah, dan viabilitas serbuk sari (Kobayashi and Ohgawara 1988; Sihachakr et al. 1989; Grosser et al. 1990; Yamamoto and Kobayasi 1996; Fu et al. 2003). Variabilitas dari hibrida somatik dapat terjadi akibat subkultur kalus yang terus-menerus, ketidak stabilan dari kombinasi inti sel yang menyebabkan hilangnya ekspresi gen atau hilangnya bagian dari informasi genetik dan adanya segregasi sitoplasma atau inti setelah fusi sehingga menghasilkan kombinasi yang unik (Ammirato et al. 1983).
Tanaman hibrida somatik yang dihasilkan harus dapat diidentifikasi dari tanaman yang tidak berfusi, tanaman hasil fusi sesama tetua (homo fusi) dan multi fusi. Hibrida somatik tersebut harus merupakan kombinasi dari kedua tetua yang difusikan (gabungan dari jeruk mandarin satsuma dengan siam simadu). Jumlah kromosom hibrida somatik seharusnya merupakan penjumlahan dari jumlah kromosom sel yang berfusi. Untuk mengidentifikasi hibrida somatik pada tahap awal dilakukan dengan menentukan tingkat ploidi secara cepat dengan Flow Cytometry sehingga dapat dibedakan regeneran hasil fusi dengan non fusi. Kemudian dilakukan dengan cara melihat jumlah dan ukuran stomata, jumlah sel kloroplas dan jumlah kromosom (Jaskani 1998; Xu et al. 2006; Cai et al. 2007).
Untuk mempercepat perolehan informasi genetik dari tanaman hasil fusi protoplas yang diinginkan sebelum dilakukan penanaman di lapang untuk evalusi fenotifik dapat dilakukan dengan marka genetik. Marka genetik yang sering digunakan untuk identifikasi hibrida somatik antara lain adalah marka morfologi dibandingkan dengan tetuanya, penanda isozim dan penanda DNA. Pada saat ini
sudah banyak digunakan marka molekuler sebagai alat bantu seleksi, baik yang berbasis DNA maupun protein. Marka berbasis DNA merupakan marka yang paling banyak jenisnya dan mempunyai variabilitas yang besar. Marka molekuler mempunyai keunggulan karena seleksi dapat dilakukan pada tahap benih, bahkan dapat dilakukan pada tahap in vitro sehingga dapat mempercepat kepastian sifat dari regeneran yang dihasilkan dari proses fusi protoplas. Beberapa marka molekuler yang dapat digunakan dan telah berhasil mengidentifikasi hasil fusi protoplas antara lain adalah RAPD, ISSR, RFLP dan SSR (Cai et al. 2007).
Penerapan teknologi fusi protoplas pada tanaman jeruk di negara-negara maju telah lama digunakan untuk mengintrogresikan sifat genetik yang secara alami tidak dapat dilakukan (incompatible) maupun yang kompatibel untuk mendapatkan tanaman jeruk yang unggul. Ohgawara et al. (1985) adalah orang pertama berhasil mendapatkan hibrida baru hasil fusi protoplas pada tanaman jeruk yang berasal dari genus C. Sinensis dengan Poncirus trifoliata. Selanjutnya, Grosser et al. 1989 juga berhasil mendapatkan hibrida antar spesies C. aurantifolia dengan Valencia sweet orange, C. reticulata dengan Citropsis gilletiana (Grosser et al. 1990), C. sinensis dengan Severinia buxifolia (Grosser et al. 1992), C. sinensis dengan Fortunella javonica (Takami et al. 2004) dan C. sinensis dengan hibrida Carrizo citrange (L.) (Louzada et al. 1992), C. unshiu dengan C. sinensis (Yamamoto dan Kobayasi 1996). Sampai dengan tahun 1996 telah diperoleh 15 hibrida baru hasil fusi protoplas, baik yang berasal dari tetua yang kompatibel maupun yang tidak kompatibel (Spiegel-Roy dan Goldschmidt 1996). Berdasarkan laporan Nicotra (2000) telah diperoleh 60 hibrida somatik di CREC, Florida seperti hibrida Palazelli, Primosole, Simeto, Desiderio, Bellezza, dan Sirio yang berasal dari Italy, Kara, wilking, Kinnow, Sunburst, dan Fortune yang berasal dari USA, Yafit, Norit, dan Adit dari Israel, Nankou, Hakaya, Tsunokaori, Benimadoca, Ariake, Amakusa, Hareyaka, Mihocore, Yoku dan Shiranuhi dari Jepang.
Sampai saat ini, teknolofi fusi protoplas sudah banyak digunakan untuk merakit kultivar unggul baru atau hibrida baru tanaman jeruk seperti; fusi protoplas antara C. sinensis dengan C. lansium (Fu et al. 2003), C. unshiu Marc.) dengan C.
grandis dan C. sinensis (Cai et al. 2007) dan transfer sitoplasma C. unshiu untuk mendapatkan alloplasmic melalui fusi protoplas asimetris (Xu et al. 2006). De Carvalho Costa et al. (2003) juga telah berhasil mendapatkan tanaman jeruk batang bawah yang toleran terhadap citrus blight, tristeza virus dan Phytophthora. Selain itu, pemetaan genetik secara molekuler juga sudah ada yang melakukan, terutama pemetaan genetik untuk ketahanan terhadap penyakit dan sifat seedless.
Pada pernelitian ini, hibrida somatik di identifikasi dengan cara evalusi pertumbuhan in vitro pada media selektif, marka molekuler denga penanda ISSR, jumlah kromosom, morfologi daun dan kandungan klorofil.
Bahan dan Metode
Penelitian keragaan in vitro regeneran hasil fusi protoplas dan penetapan kandungan klorofil dilakukan di Laboratorium Biologi Sel dan Jaringan. Evalusi genetik secara molekuler dilakukan di Laboratorium Biologi Molekuler Balitbang Biogen Bogor. Penetapan jumlah kromosom dilakukan di Laboratorium taksonomi LIPI. Penyambungan dengan batang bawah dan pengamatan morfologi dilakukan di rumah kaca dan kebun percobaan Balai Penelitian Jeruk dan Buah Subtropika (Balitjestro) Malang.
Keragaan in vitro regeneran hasil fusi protoplas
Bahan tanaman yang digunakan dalam penelitian ini adalah 19 regeneran hasil fusi protoplas jeruk mandarin satsuma (C. unshiu) dengan siam Simadu (C. nobilis). Setiap individu dari 19 regeneran hasil fusi protoplas yang diperoleh diperbanyak secara klonal melalui kultur in vitro dalam media kultur menggunakan media dasar MW + EM 500 mg/l (hasil penelitian 1) . Media ini dapat digunakan untuk seleksi awal hibrida somatik karena media tersebut sangat cocok untuk pertumbuhan jeruk Siam secara in vitro dan tidak cocok untuk pertumbuhan jeruk siam Satsuma. Hal ini dilakukan untuk mendapatkan duplikat setiap individu regeneran dalam koleksi in vitro jika tunasnya disambung dengan batang bawah di
rumah kaca. Peubah yang diamati pada tahap ini adalah tinggi tunas dan banyaknya jumlah daun setiap regeneran yang dikulturkan.
Evaluasi molekuler kandidat hibrida somatik dengan penanda ISSR
Isolasi DNA. Lima kandidat hibrida somatik yang terpilih berdasarkan keragaan in vitro terhadap semua regeneran hasil fusi protoplas dievaluasi lebih lanjut secara molekuler berdasarkan marka ISSR. Sampel daun yang digunakan adalah daun yang masih muda. Daun diambil dan dibersihkan dengan alkohol 70% lalu ditimbang tanpa tulang daunnya sebanyak 0,5 gram. Penggunaan DNA volume kecil menggunakan metode Doyle dan Doyle (1990). Panaskan 1 ml Buffer ekstraksi (60 ml CTAB 3%, 47,6 ml NaCl 1,4 M, 8 ml EDTA 20 mM dan 20 ml Tris-HCl 100 mM) dan 5 µl mercaptoethanol dalam waterbath 65oC selama 15 menit. Gerus 0,5 gr daun, pvp dan nitrogen cair dalam mortar hingga menjadi serbuk. Masukkan dalam tabung eppendorf yang telah berisi buffer ekstraksi dan dikocok. Lalu divortex dan inkubasi dalam waterbath pada suhu 65oC selama 30 menit. Setiap 5 menit, tabung eppendorf digoyang atau dibolak–balik. Tambahkan 700 µl Chloroform:Isoamylalcohol (CHISAM) (24:1) lalu divortex. Sentrifuge 6000 rpm selama 10 menit. Ambil supernatan (bagian atas) dan masukkan dalam eppendorf baru. Tambahkan 1 ml CHISAM dan sentrifuge 6000 rpm selama 10 menit. Ambil fase atasnya dan tambahkan 1 ml Isopropanol dingin lalu aduk secara perlahan (gently). Inkubasi dalam Freezer selama 30 menit dan sentrifuge 6000 rm selama 10 menit. Buang supernatan lalu bersihkan 2 kali dengan 200 µl buffer pencuci. Setelah itu, keringanginkan endapan DNA (pellet) dalam Laminar Air Flow (LAF). Tambahkan 500 µl buffer TE dan 1 µl RNAse. Inkubasi dalam waterbath pada suhu 37oC selama 30 menit. Dinginkan sebentar lalu tambahkan 1 ml ethanol absolut 96% dingin dan inkubasi dalam freezer selama 30 menit. Sentrifuge 6000 rpm selama 10 menit. Buang supernatan (bagian atasnya) lalu keringanginkan pellet DNA dalam LAF. Pellet DNA disuspensi dengan 50 µl buffer TE. Simpan pada suhu 20oC sampai digunakan.
[DNA] (µg/ml) = Nilai ABS260 X 50 µg/ml X Faktor Pengenceran
Pengukuran Kualitas dan Kuantitas DNA. Setelah diperoleh sampel DNA, selanjutnya untuk mengetahui kualitas DNA dilakukan elektroforesis dengan menggunakan 0,8% agarose yang dilarutkan dalam TBE 0,5X
• Larutan 0,8% agarose dipanaskan dengan microwave selama 40 detik kemudian didiamkan sampai hangat–hangat kuku dan ditambah 4 µl EtBr per cetakan lalu dituang dalam plate sampai keras.
• Gel direndam dalam elektroforesis chamber. Sampel yang digunakan sebanyak 5 µl dan 2 µl loading dye dimasukkan ke dalam wells (sumur).
• Elektroforesis pada tegangan 110 volt selama 1 jam
• Visualisasi hasil elektroforesis diatas UV transluminator dan didokumentasikan dengan kamera.
Untuk mengetahui nilai konsentrasi DNA diukur dengan menggunakan spektrofotometer. Sampel diukur pada absorbansi 260 nm dan 280 nm. Adapun konsentrasi DNA dihitung dengan rumus:
50 µg/ml merupakan faktor konversi dari nilai absorbansi 260 = 1 sehingga konsentrasi DNA berarti 50 µg/ml. Untuk kemurnian DNA dihitung berdasarkan hasil bagi nilai ABS260 dengan ABS280 (OD260/OD280
Optimasi Program Reaksi PCR dan Amplifikasi DNA dengan PCR. Sebelum dilakukan amplifikasi DNA dengan PCR, terlebih dahulu dilakukan optimasi program reaksi PCR untuk memperoleh kondisi optimum PCR yang dapat digunakan untuk amplifikasi DNA dengan primer mikrosatelit yang telah ditentukan. Optimasi reaksi PCR adalah 1 siklus denaturasi awal pada suhu 94°C selama 5 menit, diikuti dengan 32 siklus denaturasi suhu 94°C selama 1 menit, annealing suhu 55°C selama 30 detik dan ekstensi suhu 72°C selama 1 menit. Siklus PCR diakhiri dengan 1 siklus ekstensi ). Hasil pembagian ditunjukkan dengan nilai rasio, dimana nilai rasio 1,8 menunjukkan tingkat kemurnian DNA yang sangat baik. Apabila terkontaminasi dengan protein, nilai rasio yang diberikan lebih kecil dari nilai rasio konsentrasi DNA murni dan apabila terkontaminasi oleh RNA, nilai rasio yang diberikan lebih besar dari 2 (Sambrook (1989).
akhir suhu 72°C selama 4 menit (Oliveira et al. 2002). Primer yang digunakan dalam optimasi program adalah 20 pasang primer SSR (forward and reverse) yang telah dikembangkan olehKijas et al. (1997).
Reaksi amplifikasi PCR dilakukan menggunakan 25 µl dengan 1/10 volume buffer 10X (100mM Tris-HCl pH 8,3; 500 mM KCl; 25mM MgCl2
Visualisasi Hasil PCR. Elektroforesis dilakukan untuk mengetahui hasil amplifikasi DNA dengan menggunakan PCR, adapun elektroforesis dilakukan melalui elektroforesis horizontal dengan 1,8 %–4 % agarose yang dilarutkan dalam 100 ml buffer TAE 1X, kemudian dielektroforesis dengan tegangan 57 mA selama 3 jam, sebanyak 10 µl produk PCR dan 3 µl loading dye digunakan dalam elektroforesis. Selanjutnya gel direndam dalam 0,5 µg/ml EtBr dalam ruang gelap selama 15 menit dan dibilas dalam H
; 0,01% gelatin); 200 mM dari dATP, dCTP, dGTP dan dTTP nukleotida; 50 ng DNA; 1,5 unit Taq polymerase dan 5 primer (forwad and reverse). Untuk reaksi PCR digunakan alat Biometra Thermocycler.
2O selama 10 menit. Visualisasi dilakukan diatas lampu ultraviolet dengan menggunakan alat BiodocAnalyze.
Penetapan jumlah kromosom kandidat hibrida somatik
Jumlah kromosom dihitung secara mikroskopik pada tahap metafase terhadap sel meristem ujung akar tanaman kandidat hibrida somatik. Ujung akar diambil dari tanaman yang dicangkok batangnya sehingga muncul akar-akar baru.
Metode penghitungan kromosom dilakukan menggunakan metode Gemitter et al. (1990). Pengambilan akar dilakukan sekitar pukul sembilan setelah kultur digelapkan selama 1-2 hari.
Ujung akar dipotong dengan panjang 1-2 cm kemudian dilakukan prefiksasi dengan β-chloronaphtalene selama 3 jam, kemudian difiksasi dengan alcohol-asetat (3:1) selama 24 jam. Selanjutnya, akar dibilas dengan aquades sebanyak 2-3 kali. Kemudian dihidrolisa dengan HCl 5 M selama 3 menit pada suhu kamar atau dengan HCl 1M pada suhu 60 0C selama 10 menit. Pewarnaan dilakukan dalam larutan Feulgen atau Schiff selama 1-3 jam. Kemudian dipotong bagian ujung akar yang
berwarna merah dengan ukuran 0.5-1 mm diletakkan di gelas preparat dan ditetesi dengan acetocarmine. Kemudian ditutup dengan gelas penutup dan di squash. Pengamatan dan penghitungan jumlah kromosom dilakukan secara mikroskopik perbesaran 400 kali.
Keragaan fenotipik hibrida somatik di rumah kaca
Keragaan fenotipik tanaman hibrida somatik di rumah kaca sangat penting dilakukan untuk mengetahui karakter morfologi tanaman sesungguhnya, seperti tinggi tanaman, jumlah daun dan morfologi daun.
Setiap individu hibrida somatik terlebih dahulu disambung dengan batang bawah (rootstock) Javaness Citroen (JC) yang telah berumur satu tahun di rumah kaca dengan metode minitopworking. Pemilihan metode tersebut dilakukan karena penyambungan sudah bisa dilakukan pada saat plantlet masih kecil dan dapat dilakukan secara in vivo di rumah kaca.
Tujuan dari minitopworking adalah untuk mempercepat proses pertumbuhan tunas dan adaptasi platlet tanpa melalui aklimatisasi akar. Selain itu teknik ini merupakan teknik yang lebih mudah dilakukan dan efisien waktu dan tenaga kerja karena masa generatifnya lebih cepat.
Persiapan batang bawah. Batang bawah JC dipotong dengan ketinggian ± 15 cm dari tanah. Selanjutnya di klupas kulit batangnya dengan ukuran panjang 0.5-1 cm dan lebar 0.3 cm pada bagian yang telah dipotong.
Persiapan batang atas . Materi batang atas yang akan disambungkan dengan batang bawah dikeluarkan dari botol dan dibersihkan dari sisa media in vitro. Bagian batang disayat tipis miring dengan menggunakan pisau scapel yang telah disterilkan dengan alkohol.
Penyambungan (grafting). Materi batang atas yang telah disayat di masukkan pada bagian kupasan kulit batang batang bawah. Selanjutnya sambungan diikat dengan menggunakan plastik parafilm dan disungkup dengan plastik. Tanaman yang telah disambung harus diletakkan dibawah naungan yang agak lembab untuk menghindari proses respirasi yang berlebihan.
Setelah satu bulan sungkup plastik dibuka ketika tanaman telah muncul tunas baru dari batang atas. Kemudian dipelihara dengan baik dengan cara menyiramnya setiap pagi hari. Pengamatan terhadap tinggi tunas, diameter batang, panjang daun, lebar daun dan panjang tangkai dilakukan setelah tanaman berumur 5 bulan setelah penyambungan.
Hasil dan Pembahasan Keragaan in vitro regeneran hasil fusi protoplas
Keragaan in vitro untuk menduga hibrida somatik (putatif) dari semua regeneran yang diperoleh dapat dilakukan pada tahap tunas. Keragaan tersebut sangat efisien dan efektif karena hanya membutuhkan media tumbuh yang dapat menunjukkan perbedaan pertumbuhan yang menyolok dari kedua tetuanya. Gopal dan Minocha (1998) mengatakan bahwa perbanyakan in vitro dapat digunakan untuk karakterisasi tanaman hibrida somatik pada tahap awal.
Keragaan in vitro dilakukan terhadap 19 regeneran hasil fusi protoplas jeruk siam Simadu dengan jeruk mandarin Satsuma (Tabel 23). Dari hasil keraan tersebut diperoleh 5 kandidat hibrida somatik berdasarkan respon pertumbuhan terhadap media kultur yang digunakan. Hal ini terlihat dari pola kecepatan pertumbuhan tinggi tunas dan jumlah helai daun yang dihasilkan pada umur satu bulan setelah kultur. Hal ini juga dibuktikan oleh Purwito (1999) pada tanaman kentang hasil fusi protoplas dan berkorelasi langsung dengan penampilan di lapang. Kecepatan pertumbuhan tinggi tunas dan banyaknya jumlah helai daun semakin jelas berada diantara kecepatan pertumbuhan jeruk siam Simadu dengan mandarin Satsuma pada umur dua bulan setelah kultur (Gambar 29). Sedangkan pertumbuhan regeneran lainnya ada yang menyerupai jeruk siam Simadu dan ada yang menyerupai jeruk mandarin Satsuma. Regeneran-regeneran tersebut adalah R6, R7, R10, R11 dan R19. Tinggi tunas dan jumlah helai daun masing-masing regeneran tersebut pada umur 2 bulan adalah 1.67 cm dengan 4 helai daun, 1.36 cm dengan 4 helai daun, dan 1.20 cm dengan 4 helai daun 1.72 cm dengan 3 helai daun, 1.08 cm dengan 4 helai daun. Sedangkan tinggi tunas dan jumlah helai daun jeruk siam Simadu pada waktu yang
Tabel 23. Keragaan in vitro regeneran hasil fusi protoplas umur 2 bulan. Regeneran Tinggi tunas (cm) Jumlah daun
(helai) R3 St 0.41 0.48 3 3 R16 0.64 3 R8 0.98 3 R9 1.06 4 R19 1.08 4 R10 1.20 4 R7 1.36 4 R6 1.67 4 R11 1.72 3 R13 1.77 7 R14 1.90 5 R17 2.00 6 R18 R1 2.06 2.24 5 5 R5 2.27 5 R4 2.32 6 R15 2.32 6 Sm 2.39 6 R2 2.43 7 R12 2.49 7
Gambar 29. Keragaan pertumbuhan in vitro regeneran hasil fusi protoplas dan kedua tetuanya (A= mandarin Satsuma, B= regeneran hasil fusi, dan C= siam
Simadu).
sama adalah 2.39 cm dengan 6 helai daun dan 0.48 cm dengan 3 helai daun. Berdasarkan hasil keragaan tersebut juga diperoleh duplikasi setiap individu regeneran sehingga individu-individu tersebut mempunyai duplikat apabila dilakukan pengamatan lebih lanjut di rumah kaca maupun di lapangan.
Evaluasi molekuler hibrida somatik dengan penanda ISSR
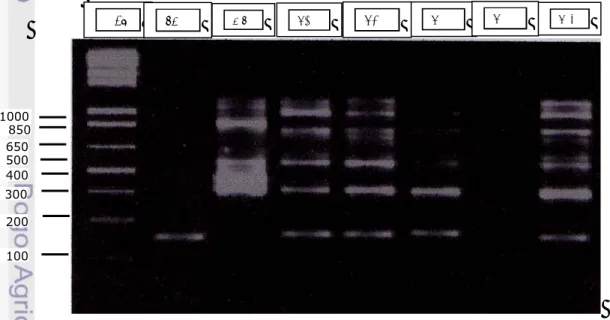
Evaluasi molekuler DNA terhadap hibrida somatik dilakukan terhadap 5 kandidat hibrida somatik yang diperoleh dari hasil keragaan in vitro menggunakan 8 primer ISSR. Hasil amplifikasi DNA yang dilakukan diperoleh satu primer yang dapat menghasilkan pola pita DNA yang dapat membedakan pola pita DNA hibrida somatik dengan pola pita kedua tetuanya (Gambar 30). Dari 5 kandidat hibrida somatik yang dievaluasi hanya diperoleh 4 regeneran yang teramplifikasi secara sempurna sehingga menghasilkan pola pita yang jelas (R6, R7, R10 dan R 19). Ke empat regeneran tersebut mempunyai pola pita gabungan dari kedua tetuanya yang ditunjukkan oleh pita DNA jeruk siam Simadu 165 bp dan pita DNA mandarin Satsuma sebesar 300 bp. Pita-pita DNA tersebut kedua-duanya terdapat pada
Gambar 30. Penggunaan primer ISSR8 (5’AGAGAGAGAGAGAGAGYC3’) dapat membedakan hibrida somatik (R6, R7, R10 dan R19) dengan kedua tetuanya (Sm=siam Simadu, MS= mandarin Satsuma, R6, R7, R10, R11, dan R19= kandidat hibrida somatik ).
1 Kb SM MS R6 R7 R10 R11 R19 1000 850 650 500 100 200 300 400
ke empat regeneran tersebut (heterosigot). Dengan demikian, keempat regeneran tersebut merupakan hibrida somatik dari jeruk siam Simadu dengan mandarin Satsuma.
Evaluasi jumlah kromosom kandidat hibrida somatik
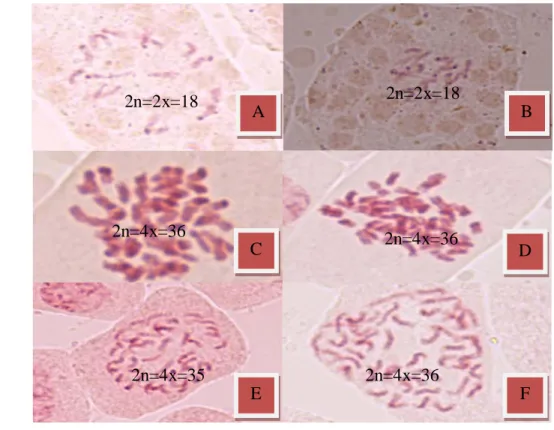
Untuk memperkuat dugaan tersebut dilakukan penghitungan terhadap jumlah kromosom karena jumlah kromosom hibrida somatik hasil fusi protoplas merupakan penjumlahan jumlah kromosom dari kedua tetuanya. Banyaknya jumlah kromosom dari ke empat regeneran tersebut juga merupakan penjumlahan kromosom dari kedua tetuanya (Tabel 24). Hal ini dapat dilihat dari perbandingan banyaknya jumlah kromosom hibrida somatik yang diduga dengan tetuanya (Gambar 31). Jumlah kromosom hibrida somatik R6, R7 dan R19 adalah sebanyak 36 pasang dan R10 sebanyak 35 pasang. Dengan demikian, data tersebut memperkuat dugaan bahwa keempat regeneran tersebut adalah hibrida somatik.
Tabel 24. Banyaknya jumlah kromosom dari f hibrida somatik yang dihasilkan dan kedua tetuanya (mandarin Satsuma dan siam Simadu).
Hibrida somatik Jumlah kromosom
Mandarin Satsuma Siam Simadu Putatif R6 Putatif R7 Putatif R10 Putatif R19 18 18 36 36 35 36
Gambar 31. Perbandingan jumlah kromosom antara putatif hibrida somatik yang dihasilkan dengan kedua tetuanya (A= Siam Simadu, B= mandarin Satsuma, C=R6, D= R17, E= R10 dan F= R19).
Keragaan hibrida somatik di rumah kaca
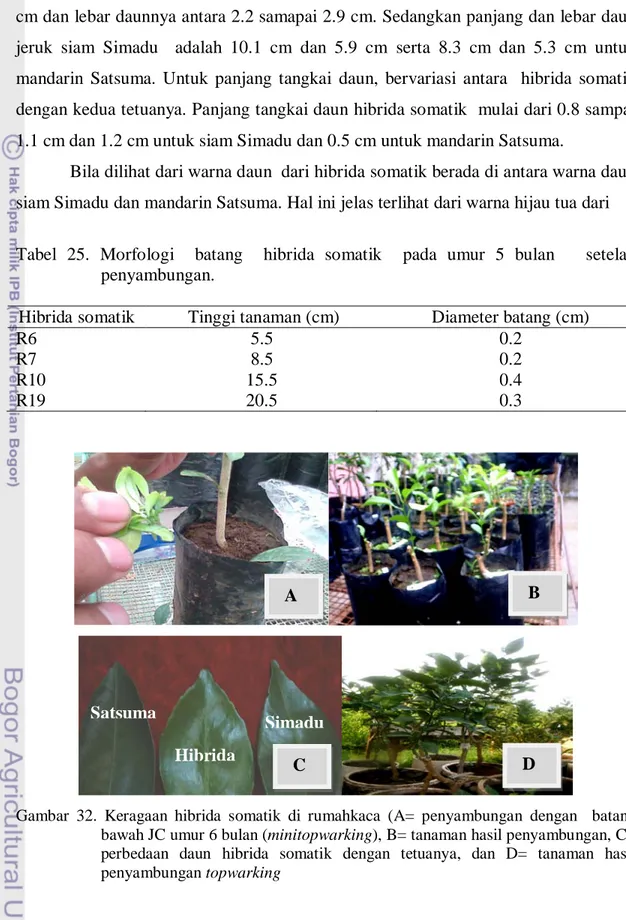
Keragaan hibrida somatik di rumah kaca dilakukan untuk melihat lebih lanjut kenampakan morfologi yang sesungguhnya. Tunas in vitro disambung (grafting) dengan bibit batang bawah Japhanise citrun (JC) umur 6 bulan menggunakan metode mini topworking (Gambar 32A ). Semua tunas berhasil disambung dan dapat hidup sehingga dapat diamati pertumbuhannya lebih lanjut (Gambar 32B). Dari pengamatan terhadap tinggi dan diameter batang diperoleh bahwa ukuran tinggi dan diameter batang tanaman hibrida somatik lebih kecil dari pada pertumbuhan kedua tetuanya (Tabel 25). Tinggi tanaman hibrida somatik mulai dari 5.5 sampai 20.5 cm dan diameter batangnya mulai dari 0.2 sampai 0.4 cm. Selain tinggi tanaman dan diameter batang, pengamatan juga dilakukan terhadap diameter batang, panjang daun, lebar daun, panjang tangkai dan kandungan klorofil daun. Dari hasil pengamatan terhadap ukuran panjang dan lebar daun dari hibrida somatik lebih kecil
A B C D E F 2n=2x=18 2n=2x=18 2n=4x=36 2n=4x=36 2n=4x=35 2n=4x=36
dari kedua tetuanya (Tabel 26). Ukuran panjang daun berkisar antara 4.2 samapi 6.0 cm dan lebar daunnya antara 2.2 samapai 2.9 cm. Sedangkan panjang dan lebar daun jeruk siam Simadu adalah 10.1 cm dan 5.9 cm serta 8.3 cm dan 5.3 cm untuk mandarin Satsuma. Untuk panjang tangkai daun, bervariasi antara hibrida somatik dengan kedua tetuanya. Panjang tangkai daun hibrida somatik mulai dari 0.8 sampai 1.1 cm dan 1.2 cm untuk siam Simadu dan 0.5 cm untuk mandarin Satsuma.
Bila dilihat dari warna daun dari hibrida somatik berada di antara warna daun siam Simadu dan mandarin Satsuma. Hal ini jelas terlihat dari warna hijau tua dari
Tabel 25. Morfologi batang hibrida somatik pada umur 5 bulan setelah penyambungan.
Hibrida somatik Tinggi tanaman (cm) Diameter batang (cm) R6 R7 R10 R19 5.5 8.5 15.5 20.5 0.2 0.2 0.4 0.3
Gambar 32. Keragaan hibrida somatik di rumahkaca (A= penyambungan dengan batang bawah JC umur 6 bulan (minitopwarking), B= tanaman hasil penyambungan, C= perbedaan daun hibrida somatik dengan tetuanya, dan D= tanaman hasil penyambungan topwarking Satsuma Hibrida Simadu A B C D
Tabel 26. Morfologi dan kandungan klorofil daun hibrida somatik pada umur 5 bulan setelah penyambungan.
Hibrida somatik Panjang daun (cm) Lebar daun (cm) Panjang tangkai (cm) Kandungan total klorofil R6 R7 R10 R19 Simadu Satsuma 4.6 6.0 4.2 5.7 10.1 8.3 2.3 2.9 2.2 2.6 5.9 5.5 1.1 1.1 0.9 1.1 1.2 0.5 65.2 64.6 66.6 65.7 57.2 74.9
daun mandarin satsuma lebih menonjol dibanding daun siam Simadu (Gambar 32C). Perbedaan ini didukung oleh kandungan klorofil daunnya yang berada diantara kandungan klorofil mandarin Satsuma dengan siam Simadu (Tabel 26). Kandungan klorofil daun mandarin satsuma sebesar 74.9 sedangkan kandungan klorofil daun siam Simadu sebesar 57.2. Perbedaan tersebut lebih jelas lagi terlihat dari tulang daun.
Tulang daun jeruk mandarin Satsuma lebih menonjol dari pada tulang daun jeruk siam Simadu (Gambar 32C). Berdasarkan keragaan dari morfologi tanaman di lapang juga diperoleh bahwa warna dan tulang daun dapat membedakan antara hibrida somatik dengan kedua tetuanya. Sampai saat ini, hibrida somatik yang diperoleh telah disambung kembali dengan jeruk batang bawah yang telah berproduksi (top working) untuk mendorong pertumbuhan dan perkembangannya agar lebih cepat berbunga (Gambar 32D).
Simpulan
1. Media tumbuh selektif MW (Morel dan Wetmor) +EM 500 mg/l dapat digunakan sebagai media seleksi awal untuk menduga regeneran hibrida somatik berdasarkan tinggi tunas dan jumlah daun.
2. Marka molekuler dengan penanda ISSR menggunakan primer ISSR8 dapat mengidentifikasi 4 kandidat hibrida somatik dari 5 regeneran yang diuji.
3. Jumlah kromosom dari kandidat hibrida somatik yang diperoleh merupakan penjumlahan dari jumlah kromosom kedua tetuanya (36 pasang) kecuali R10 dengan jumlah kromosom 35 pasang.
4. Warna daun, tulang daun, dan kandungan klorofil daun dari hibrida somatik merupakan intermediet dari kedua tetuanya.
Daftar Pustaka
Ammirato PV, Evan DA, Sharp WR, Yamada Y. 1983. Handbook of Plant Cell Culture. Vol.1. MacMillan Publ. Co. New York, London.
Cai XD, Fu J, Deng XX. 2007. Production and moleculer characterization of potential seedless cybrid plants between pollen sterile Satsuma mandarin and two seedy Citrus cultivars. Plant Cell Tiss Organ Cult. 90:275-283.
De Carvalho Costa MAP, Mendes BMJ, Filho FAAM. 2003. Somatic hybridization for improvement of citrus rootstock: production of five new combinations with potensial for improved disease resistance. Aust. J. Exp. Agr. 43: 1151-1156.
Doyle JJ, Doyle JL. 1990. Isolation of plant DNA from fresh tissue. Focus 12:13-15. Fu CH, Guo WW, Liu JH, Deng XX. 2003. Regeneration of Citrus Sinensis + C. lan
seatum intergeneric triploid and tetraploid somatic hybrids and their identification by molecular markers. In Vitro Cell Dev Biol Plant 39:360-364.
Gopal J, Minocha JL. 1998. Effectiveness of in vitro selection for agronomic characters in potato. Euphytica 103:67-74.
Gmitter FG Jr, Deng XX, Hearn CJ. 1990. Induction of triploid Citrus plants from endosperm calli in vitro. Theor. Appl. Genet.80:785-790.
Grosser JW, Moore GA, Gmitter FG. 1989. Interspecific somatic hybrid plants from the fusion of ‘Key’lime (Citrus aurantifolia) with ‘valencia’sweet orange (Citrus sinensis) protoplasts. Sci. Hortic, 39:23-29.
Grosser JW, Gmitter FG, Tusa T, Chandller JL. 1990. Somatic hybrid plant from sexually incompatible woody species: Citrus reticulate and Severinia gilletiana. Plant Cel. Rep. :656-659.
Grosser JW, Gmitter FG, Louzada ES, Chandler JL. 1992. Production of somatic hybrid and autotetraploid breeding parents for seedless citrus development . Hort Science. 27:1125-1127.
Jaskani MF. 1998. Interploidi hybridization and regeneration of konnow mandarin. A thesis submitted in partial fulfilment of the requirements for the degree of Doctor Philosophy. Fac. Agriculture University of Agriculture Faisalabad, Pakistan. 169 p.
Karsinah, Soedarsono, Aswidinoor H. 2002. Identifikasi kekerabatan beberapa jenis jeruk lokal Indonesia berdasarkan marka molekuler. Thesis Jurusan Agronomi Pascasarjana IPB.
Kijas JMH, Thomas MR, Fowler JCS, Roose ML. 1997. Integration of trinucleotide microsatellite into a linkage map of citrus. Theor Appl Genet 94:701-708. Kobayashi S, Ohgawara T. 1988. Production of somatic hybrid plant through
protplast fusion in Citrus. JARQ, 22:181-1888.
Louzada ES, Grosser JW, Gmitter JFG, Nielsen B, Chandler JL. 1992. Eight new somatic hybrid citrus rootstock with potential for improved disease resistance. HortScience, V. 27: 1033-1036.
Nicotra A. 2000. Mandarin-like hybrids of recent interest for fresh consumption. Problems and ways of control. Instituto Sperimentale per la frutticoltura, Rome-Italy. 14 p.
Ohgawara T, Kobayashi S, Ohgawara E, Uchimiya H, Ishii S. 1985. Somatic hybrid plants obtained by protoplast fusion between (Citrus sinensis and Poncirus trifoliate). Theor. Appl. Genet. 71:1-4.
Purwito A. 1999. Fusi protoplas intra dan interspesies pada tanaman kentang. Disertasi Program Pasca Sarjana. IPB. Bogor.
Sambrook J, Fritsch EF, Maniats T. 1989. Molecular Cloning: A Laboratory Cold Spring Harbor Laboratory, New York.
Sihachakar D, Haicour R, Chaput MH, Barrientos E. Herbreteau C, Ducreux G, Rossignol L. 1989.Somatic hybrid plants produced by electrofusion between Solanum melongena L. and S. torvum Sw. Theor. Appl. Genet. 77:1-6. Spiegel-Roy P, Goldschmidt EE. 1996. Biology Of Citrus. Cambridge University
Takami K, Matsumara A, Yahata M, Imayama T, Kunitake H, Komatsu H. 2004. Production of intergeneric somatic hybrids between round kumquat (Fortunella japonica Swingle) and ‘Morita navel’ orange (C. sinensis Osbeck). Plant Cell Rep. 23: 39-45. Wenzel G. 1980. Protplast techniques incorporated into applied breeding program. In:
Ferenczy L and Farkas GL, (eds.). Advences in Protoplast Research. Pergamon Press. Oxford, pp 327-340.
Xu XY, Liu JH, Deng XX. 2006. Isolation of cytoplasts from Satsuma Mandarin
(Citrus unshiu Marc) and production of alloplasmic hybrid calluse via cytoplast-protoplast male sterility. Plant Cell Rep. 25:533-539.
Yamamoto M, Kobayashi S. 1996. A cybrid plant produced by electrofusion bedween Citrus unshiu and C. sinensis. Plant Tiss. Cult. Lett. 12:131-137.