Prosiding Pertemuan dun Presentasi IImialr
PPNY.B//7:-I,V. Yog)'akarta 23.25 //pril/996 811.1.1/11
35
APLIKASI
ELEKTRODA
MEMBRANE
LaF 3 DALAM
PENENTUAN
KONST ANTE STABILIT AS KOMPLEKS
LARUTAN
UR.ANIL FLUORIDA
Muzakky, Iswani CS, Mintolo
Pusat Penelitian Nuklir Yogyakarta. BA7;'IN
ABSTRAK
APLIKASI ELEKTRODA MEMBRANE LaFJ D.-tLAM PENENTUAN KO/VSTANTE STABILITAS KO/\1PLEKS LARUTAN URANIL FLUOR/DA. Telah dilakukan aplikasi elektroda membrane LaF J dalam menentukan konstante stabilitas kompleks uranil fluorida. Penentuan berdasarakan deteksi fluorida bebas dalam larutan akibat terlepasnya dari senyawaan uranil fluorida. Diduga pelepasan terjadi karena peristiwa hidrolisis ion uranil menjadi uranil hidroksida pada rendah. Hasil percobaan menunjukkan bahwa kecepatan alir titran amonium karbonat 2 M tidak mempengaruhi respon terhadap elektroda, dan pelepasan fluoriada optimum pada pH= 1. Konsentrasi fluorida bebas dalam larutan dihitung berdasarkan
kurva standar pada pH= 1, setelah dilaJ..-ukan koreksi terhadap konsentrasi fluorida pada pH yang sarna. Dengan menggunakan grafik antara bilangan rerata ligan terikat (n) versus minus logarilam konsentrasi ligan bebas (-log (F]), didapat harga [31 = 4.4, [32 = 7,48. [33 = 9.73. dan [34 = 11.67.
ABSTRACT
APPLICATION OF MEMBRANE LaFJ ELECTRODE IN THE DETERMINATION OF STABILITY CONSTANTS OF URANYL FLUOR/DE COMPLEX IN SOLUTION. A membrane electrode LaF J has been applied in the determination of uranyl fluoride complexs stability constant in solution. The determination is based on the detection of free F ion in solution as a result of hydrolisis reaction (process) of uranyl ions into the uranyl hydroxide form at low pH. The experiment results showed /:,at there was no effect of ammonium carbonat 2,\-/ titran. flow rate on the electrode response. The F release is optimum at pH /. The free F ion in solution is calculated from the standard curve at pH I, after the fluoride concentration at the same pH has been corrected. Using the plot of average number of ligand binding (n) versus minus log of free ligand (-log F) the value ofl3/ = 4,4. 132 = 7.48. ~3 = 9,73. and ~4 = 1/.67.
PENDAHULUAN:
dengan mole U adalah 2. adapun reaksinya sbb:U01F1 + 2F2 -+ UF6 + 01 t.H= -122 kcaVmole
Menurut Chang,F .C.,(2), bila kedalam larutan uranil dimasukkan ion fluorida, maka akan terbentuk beberapa spesies uranil fluorida sebagai fungsi konsentrasi fluorida seperti :
VO] F+. VO] F]. VOl F} don VO] F;
Menurut Beck,M.T.,(3), pembentukan spesies-spesies tersebut di atas tidak lain me-rupakan pembentukan reaksi kompleksasi bertahap antara ion uranil (UO;+) dengan ion fluorida sebagai ligan. Untuk itu bila konstante stabilitas bertahap masing-masing spesies dapat diketahui, khususnya spesies UO2F1 kita harapkan memperkirakan derajat pembentukan UO2F1 (aUO2FJ yang terbentuk dalam larutan.
S ecara tehnologi aplikasi uranium hexatluorida
(UF6) penting adalah dalam hal pemisahan
isotop uranium secara "difusi gas" (I). Dimana pad a proses ini fraksi berat (kaya 23'U) dan fraksi ringan (miskin 23'U) dipisahkan lewat "halangan berpori" (poros barrier). Walaupun masih dipengaruhi oleh beberapa parameter seperti derajat pengayaan, jumlah state dan perbandingan antar fraksi tersebut efisiensi proses ini mencapai 0,22 % -0,4% fraksi ringan (I).
Dewasa ini banyak proses untuk meng-hasilkan UF6 dengan berbagai bahan baku seperti UF4, garam-garam U, oksida-oksida U hingga
logam U. Tetapi proses yang paling banyak dipakai dalam industri Uranium hexafluorida, adalah proses tluorinasi uranyl-tluorida yang dilakukan da!am reaktor tluidisasi. Proses tluidisasi terse but dilakukan pad a suhu 2700 C, dengan perbandingan stokiometri antara mole F
Prosidi/lg P.:rtemua/l dan Presentasi Jlmiah PPNY-BA7:-/,V. Yogyakarta 23.25 April 1996
36
BU.l.111lPenelitian ini akan memanfaatkan peranan elektrode membrane LaP) dengan alat potensiometer. untuk mendeteksi laju pelepasan ion fluorida bebas yang terlepas dari ikatan uranil-fluorida karena adanya ligan karbonat. Sawant,R.M.dkk.,(4) laju pelepasan ion fluorida yang terdeteksi dengan elektrode merupakan
derajat pembentukan kompleksasi yang terbalik. Berdasarkan fenomena tersebut clan menggunakan graflk antara bilangan Terata ligan yang terikat tiap ion uranil (n) versus minus logaritma ligan fluorida, sehingga konstante bertahap tiap spesies uranil fluorida dapat dihitung.
A-le + L .;:> MeL
(1)
TATAKERJA:
[MeL]
~ I = K, = 7M;j{ij
[ MeL]] ] ~] = KI.K] = [Me][L](2)
Bahan:
[ MeLN]
P N = KN = N (3}[Me][L]
.Bila T Me dan TL masing-masing merupakan tolal konsentrasi metal dan ligan yang ikut dalam reaksi kompleksasi, dapat dinyatakan :
K].K2
1. Amonium karbonat buatan Merck. 2. Sodium fluorida buatan Merck 3. UNH buatan Merck.
4. HNOJ dan NH4OH masing-masing 1 molar. 5. Aquatrides, buatan laboratorium KA&UK
PPNY-BATAN.
(4)
(5)
Beck,M.T.(J), memperkenalkan suatu
bilangan koordinat rerata yang merupakan
jumlah
pembentukan senyawaan
kompleks dalam larutan
dan merupakan fungsi ligan dari pembentukan
kompleks dinyatakan sebagai
notasi :
-[MeL]+2[MeL2J+...+n[MeLNJ
n=
ALAT:
1. Seperangkat alat potensiometer buatan Metrohm, dilengkapi dengan Titroprocessor 682, Dosimat 685, elektroda membrane LaF3, elektroda gelas, elektroda Pt daD elektroda pembantu AgiAgCI.
2. Personal Computer 386 DX, yang dilengkapi software Harvard Graphich versi 23.
3. Alat-alat gelas laborntorium. 4. Timbangan Sartorius. MeLNJ
[Me) + [MeL)+.
Tl- [L](6)
T...feCARi-\ KERJA
Maka persamaan
(4) dan (5) menjadi
1. Kurva baku Iluor pad., pH 1.
Ke dalarn beaker plastik pvc dimasukkan bcrturut-turut 9 ml larutan amonium karbon at 2
ISSN 0216-3128
Muzaky, dkk
Prosiding Pertemuan dan I'resenlasi Jlmiah
PPNY-BATAN. Yogyakarla 23-25 April/996 Buku II
37
molar dan 12 ml aquatrides, diatur pH = I dengan HNO) atau NH4OH. Pindahkan kedalam labu ukur 25 ml dan ditepatkan hingga tanda tera dengan
aquatrides. Dipipet sebanyak 20 ml larutan
tersebut ke dalam beaker plastik dengan kapasitas
80 ml, kemudian berturut-turut dimasukkan
larutan NaF sedemikian rupa sehingga konsentrasi
F dalam larutan mengandung dari 1000 ppb
-1000.000 ppb F. Dicatat harga potensialnya
kemudian hasil keluaran alat potensiometer yang
berupa log konsentrasi fluor versus potensial
digrafik dengan program Harvard Graphich
ver.23.
uranil dapat terdeteksi oleh elektroda membrane LaF) paling baik pad a kondisi pH=I, Pada pH=2
walaupun pelepasan fluorida dapat terdeteksi,
tetapi laju penurunan respon elektroda sangat
cepat sehingga menyulitkan perhitungan.
sedangkan pada pH=3 dan seterusnya hingga
pH=5 respon elektroda sudah tidak dapat untuk perhitungan konstante stabilitas kompleks lagi.
-.,..",' c~Y'
'.',
v ..~., 2M (.'1
, -,...
,
Titrasi campuran Uranium -Fluorida dengan Amonium Karbonat.
Gambar 1. Pengaruh pH terhadap titrasi UO1F 4-dengan Am. Karbonat menggunakan membrane LaF J
Ke dalam beaker plastik kapasitas 80 ml, dimasukkan berturut-turut larutan uranil nitrat clan NaF sehingga pada volume achir 25 ml, larutan mengandung UO;+ clan Fluor masing-masing 1,83.10.3 molar clan 0,0421 molar serta larutan dibuat pH = 1. Titrasi larutan tersebut diatas dengan larutan amonium karbon at 2 Molar, dengan kecepatan titran 0,5 ml / menit. Dicatat harga potensialnya pada setiap penambahan
amonium karbonat 2 M.
Variasi Keasaman.
Hal tersebut diatas menunjukkan bahwa pada pH=l secara pelan tetapi pasti ion fluorida akan terlepas daTi ikatannya dengan UO2F 4 menjadi fluorida bebas dalam larutan. clan laju pelepasan tersebut dapat diikuti dengan elektroda membrane LaFJ yang ditandai dengan penurunan harga potensial pada titik ekuivalen 9,3 mi.
Untuk memprediksi mekanisme reaksi, dan apa yang terjadi dalam peristiwa diatas kita ulang percobaan diatas tetapi memakai lektroda gelas (pH), dengan maksud melihat sejauh mana perubahan pH yang terjadi selama titrasi berlangsung adapun hasil percobaan dapat dilihat pada gambar 2.
3.
Pekerjaan sarna dengan no 2, hanya pH divariasi dari 1 hingga 5, kemudian dicatat harga potensialnya clan hasil keluaran alat potensiometer yang berupa log konsentrasi fluor versus potensial digrafik dengan program Harvard Graphich ver.23.
Variasi kecepatan alir.
4.
Pekerjaan sarna dengan no 2, hanya kecepatan alir titran divariasi dari 0,1 ml ; 0,5 ml dan 1 mV men it, kemudian dicatat harga potensialnya clan hasil keluaran alat potensiometer yang berupa log konsentrasi fluor versus potensial digrafik dengan program Harvard Graphich
ver.23. Gambar 2. Titrasi UO1F 4- dengan Am. Karbonat menggunakan elektroda gelas
HASIL DAN PEMBAHASAN
Dari gambar 1 clan 2, dapat diamati bahwaperubahan pH selama titrasi berlangsung dari awal penambahan volume amonium karbonat hingga tititl ckuivalen 9,3 ml (gambar I), pII hanya bergerak disekitar pH<2 (gambar 2). Menurut
.(5)
d
D o G (7)d
H dahGalkm,N.P., an onoarra, ., pa a p fen Dari gambar 1, dapat diperhatikan bahwa
hasil titrasi UO2F 4" dengan amonium karbon at 2 M, kecepatan alir 0,5 mVmenit pada beberapa kondisi pH dari 1 hingga 5. Temyata laju pelepasan ion fluorida dari ikatannya dengan ion
Muzaky, dkk
Prosiding Perli!mUan dan Presenlasi //miah PPNY-BATAN, Yogyakarla 23-25 Apri//996
38
BuJ..-u IIion uranil (UO;+) akan cenderung terhidrolisis dengan air membentuk UO2(OH)+ dengan har~a konstante hidrolisis sebesar (K=6,4.10' ). Sehingga timbulah asumsi pertama bahwa mekanisme yang terjadi pada garnbar I, adalah terhidrolisanya uranil tluorida oleh H2O yang reaksinya sbb :
Jadi mekanisme reaksi yang terjadi kemungkinan besar hanya asumsi pertama, yaitu peristiwa hidrolisis ion uranil (UO;+) menjadi UO2(OH)+ yang dapat melepaskan ion fluorida bebas ke dalam larutan, dan untuk mendukung asumsi pertama tersebut perlu diperkuat data lain yaitu besamya konstante kestabilan kompleks spesies-spesies uranil fluorida yang terbentuk dalam larutan.
Sebelum dapat menghitung konstante tersebut perlu diketahui terlebih dahulu bagaimana kecepatan respon elektroda membrane LaF) terhadap laju pelepasan ion fluor ida, yang ditandai dengan penurunan harga potensial terukur (my). Temyata dari gambar 4, dengan percobaan tetap seperti diatas tetapi kecepatan alir dari titran amonium karbonat diyariasi dari 0, I mVmenit hingga 1 mVmenit. Diperoleh kurva titrasi dengan harga potensial (my) hampir sarna yaitu dari 50 my sampai dengan -100 my, tetapi berbedajumlah vulume (ml) amonium karbonatnya. Hal ini dapat ditarik kesimpulan bahwa respon elektroda adalah tetap terhadap laju pelepasan ion walaupun terjadi perbedaan jumlah yolume amonium karbonat. Sehingga bila data potensial titrasi dengan beda kecepatan alir diplotkan kedalam kurva standar, dapat dipakai untuk menghitung konstante kestabilan kompleks spesies-spesies uranil fluorida dengan persamaan diatas
(.DjF4 + H]O~ (.Dj(all + ff +4F
Reaksi diatas mengakibatkan terlepasnya ion fluorida dari ikatannya dengan UO2F 4 menjadi ion bebas clan laju pelepasannya akan di deteksi oleh elektroda membrane LaF3"
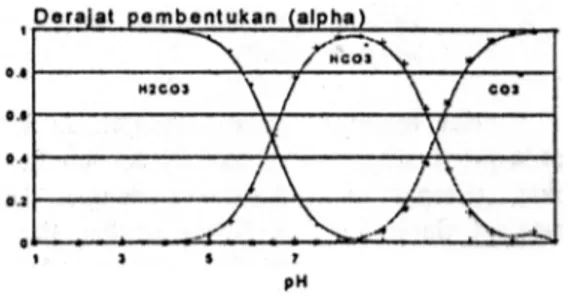
Kemudian asumsi kedua, bila dilihat dari derajat pembentukan (a) spesies-pesies asam
korbonat sebagai fungsi pH sbb:
Gambar
J.
Derajat pembentukan spesies karbonat!u'fgsi p/l
Potensiet (mV)
Temyata pada daerah kerja selama titrasi berlangsung pH<2 (galnbar 2) spesies H2CO3 paling dominan, dan boleh dikatakan bahwa spesies HCO3. dan CO3- dapat diabaikan.
Menurut Firshing, F.H.,(6) pada pH rendah terjad.i tiga kesetimbangan spesies H2CO3 yaitu :
HzCOj <=> HzO + COz K = 400 -670 Hz CO; <=> W + BCO} Kl = 4,16.10-7
Pengaruh kecepatan a/if titrall terhadap /aju pe/epasan ion flour
Gamba, 4.
Menurut Brewer,S.,(8)
derajat pembentukan
F(aF) dalam larutan sebagai fungsi pH dapat dinyatakan sbb:
HzCOJ ~ n+ + HCOj KH2CO3 = 3,16.10-4 HCOj ~ n+ + COj K2 = 4,84.10.\\
Karena K»> 1 asumsi kedua menjadi tidak benar, karena pada pH rendah sistim ini tidak memungkinkan terjadi reaksi kompetisi antara
H2CO3 dengan UO;+ untuk membebaskan ion tluorida, karena spesies H2CO3 yang ada dalam larutan akan selalu berubah menjadi CO2 dan air. peristiwa ini dapat dibuktikan dengan keluamya gelembung-gelembung gas selama titrasi uranil tluorida dengan amonium karbonat pada pH=l.
(8)
~]
(9)
Prosiding f'erlemuan don Presenlasi II/niGh
PPNY-BATAN. Yogyakarla 23-25 Apri//996 Sub 1/
39
KESIMPULAN
Kemungkinan besar pelepasan ion fluorida
bebas kedalam larutan dari ikatan UO2F 4
diakibatkan oleh adanya reaksi hidrolisis uranil fluorida oleh adanya H2O, yamng reaksinya dapat dinyatakan sbb:
UO2F" + H2O (:::> UO2(OH)+ + W + 4F"
Laju pelepasan tersebut akan dideteksi oleh elektroda membrane LaF3. Setealah dilakukan
koreksi terhadap konsentrasi fluorida, kurva standar pacta pH = I dapat digunakan untuk menghitung fluorida be bas dalam larutan, dari data-data potensial terukur. Dengan menggunakan metoda grafik pacta gambar 5, diadapat harga 131 = 4,4,132 = 7,48,133 = 9,73, clan 134 =.11,67.
UCAP AN TERIMA KASIH
Dengan terselesainya makalah ini, penulis mengucapkan terima kasih yang sebesar-besarnya kepada saudara "Mintolo" yang telah banyak membantu daTi awal percobaan hingga akhir pembuatan makalah ini.
DAFTARPUSTAKA:
1. GALKIN,N.P.,dkk.,"Tecnology of Uranium,
U.S.Aomic Energy Co., Israil for scientific
Tranlation,p.268-300.,
Jerusalem,
1964.
2. CHANG, F.C., dkk.,"Detennination of Th-U
and U-Zr alloy composition with a
fluorida-selective electrode., anal.chem. Acta.,no.71
,
p.477-481.,
1974.
3. BECK,M.T.,
Chemistry
of
Complex
Equilibria., Yon Nostrand Reinhold Co.,
p.32-137., London, 1969.
4. SAW ANT.,R.M., dkk,"Potentiometric studies
on Aqueous Fluoride Complexes of Actinides
Stability Constants of Th(IV)-U(IV) and
PU(IV)-Fluorides. Journal of Radioanalitycal
and Nuclear Chemistry, Articles, vol.143,
n.2.,p.295-306,
1990.
5. GALKIN,N.P.,dkk.,"Tecnology
of
the
treatment
of Uranium Concentrates.,
AEC-
TR-4515., Translation series, U.S.Atomic Energy
Commision.
P .11-12., 1974.
6. FIRSCHING.,H.F., MOHAMMADZADELj.,
Solubility Product of the rare-earth
carbonate.,
J.Chem.Eng.
Data., n.31., p.40-42., 1986
Oari persamaan (8) clan (9), dengan Ka.HF = 6,7.104 clan CF ={[HF] + [F-]}. Bila CF diketahui dari data penimbangan maka aF- clan aHF pafda pH=1 dapat dihitung yaitu aF" = 6,655.10"3% clan aHF= 0,9934%, sehingga konsentrasi (mole) as am fluorida clan ion fluorida pada pH= I dalam larutan dapat dikoreki menjadi:
[F"]TK = (6,655.10.J)CF (10) [HF )TK = 0,993 CF (II)
Oari [F"] terkoreksi clan potensial terukur dapat dibuat kuva standar fluorida pada pH=I, yaitu dari konsentrasi 1000 ppb hingga 100.000 ppb ion fluorida clan memghasilkan persamaan Y=-176,53 -55,499X dengan r=0,9996. Kemudian data-data potensial terukur larutan {yang terdiri [UO;+]=O, 1141 M, [F-] = 0,526 M clan pH dibuat
I} dititrasi dengan amonium karbonat 2 M clan kecepatan alir titran I mVmenit, di plotkan ke dalam kurva standar fluorida pada pH= I tersebut. Sehingga banyaknya laju ion fluorida yang terlepas dapat dihitung. Kemudian hila total ligan (T L) clan total metal (T Me]) diketahui maka besarnya tiap-tiap harga n (persamaan 6 clan 7) dapat diketahui melalui konsentrasi ion fluorida .{[F"]} yang dibebaskan tersebut. Hasil dibuat grafik antara n versus minus logarima [F"] (gambar 5). Harga K1,K2,K3,dan K4 dapat diperoleh pada
grafik dengan harga n = 0,5, 1,5 , 2,5,dan 3,5.
Kemudian ~I = KI, ~2 = KI.K2, ~3 = KI.K2.K3, clan ~4 = K1.K2.K3.K4.
Oari gambar 5, ternyata didapat bahwa masing-masing harga KI = -log 4,2; K2 = -log 1,7; K3 = -log 1,3 clan K4 = -log 1,2 atau ~l = 4,4, ~2 = 7 ,48, ~3 = 9,73, clan ~4 = 11,67. Oari harga-harga tersebut ternyata harga-harga K I =3,98.1 O.s lebih kecil dari pad a konstante hidrolisis UO2(OH)+ = 6,4.10-s, sehingga asumsi pertama dapat terjawab.
n
~-=~
log IF
Gambar 5. Kurva bilangan koordinat rerata Iowan log konsentrasi fluor
Muzaky, dkk
ISSN 0216-3128
Prosiding Perle,nuan dan Preselllasi Ilmiah PPNY.8ATA,V. Yog)'akarla 23-2.5 Apri//996
40
Buku II2. Terapan nantinya, mudah-mudahan data
yang diperoleh dapat digunakan untuk merancang bangun reaktor UO2Fz, yang
digunakan sebagai bahan dasar pembutan
UF4o
Djokowidodo.
8.
DONGARA.,G.,"The Stability of UO2 and UO2[HPO4hZ- complexes at 250 C., Geochimica et Cosmochimica Acta, V.44, p.1747-175I, Pergamon Press.Ltd., Great Britain,1980. BREWER,S.,"Solving Problems in Analitycal Chemistry, p-411, John Wiley & Sons, Inc., canada, 1980.
Anda
menduga bahwa
terjadinya
hidro/isis
Urani/
F/uorida, menjadi
Uranium hidroksida. Pada ha/ yang anda
tambahkan ada/ah amonium karbonat,
bagaimana cara
anda
mendeteksi
terjadinya urani/ hidroksida tersebut ??
TANYAJAWAB
Kris Tri Basuki.
J. Dari harga-harga konstanta
tidak. untuk menentukan
kesimpu/an? .
yang ado bisa
2. Hubungan apakah hasi/ ini dengan
terapan nantinya.
Muzakky.
1. Sampai saat ini yang bisa saya tarik
kesimpulan yaitu :
Pada pH = I, diduga ion Fluorida yang terlepas dari menjadi ion bebas disebabkan oleh reaksi hidrolisis, dan bukan karena reaksi dengan ion karbonat.
Dapat menghitung konstante kestabilan kompleks bertahap 131, 132, 133 dan 134.
Muzakky.
Sara tidak mendeteksi uranil hidroksida, itu hanya dugaan saya dengan berdasarkan data-data sebagai berikut :
1. Pacta pH = 1, H2COJ" sangat dominan didalam larutan dan selalu terurai menjadi H2O dan CO2 (Ka=400-670), clan peristiwa ini dapat mudah diamati selama percobaan dengan keluarnya gelembung gas.
2. HargaKa.l.«Kuo2(oH)+