1 BAB 1 PENDAHULUAN
1.1 Latar Belakang
Di Indonesia penyakit ginjal kronik (PGK) merupakan penyakit yang banyak dijumpai dan mencapai 29,1% dari populasi dengan berbagai faktor resiko (hipertensi, diabetes, proteinuria) (Suhardjono, 2009).
Prevalensi pasien dengan penyakit ginjal kronik semakin hari semakin meningkat, seiring dengan meningkatnya populasi lanjut usia dan meningkatnya jumlah pasien dengan diabetes dan hipertensi (Thomas et al, 2008). Pasien dengan penyakit ginjal kronik mempunyai resiko lebih besar untuk meninggal karena penyakit kardiovaskuler dibandingkan karena gagal ginjal. Pasien dengan penyakit ginjal kronik yang menjalani hemodialisa mempunyai resiko 10-30 kali lebih besar terjadi kematian karena penyakit kardiovaskuler, mempunyai resiko tinggi untuk menderita penyakit jantung, arterial vascular diseasedankardiomiopati (Sarnak et al, 2003).
Terdapat peningkatan morbiditas dan mortalitas pada pasien penyakit ginjal kronik terutama karena penyakit jantung vaskuler (PJV). Peningkatan terutama ditemukan pada pasien penyakit ginjal tahap akhir (PGTA) yang menjalani terapi pengganti ginjal (TPG). Angka mortalitas penyakit ginjal tahap akhir yang diterapi dengan hemodialisis tiga kali seminggu diperkirakan antara 14-26% di Eropa dan 24% di Amerika Serikat dan lebih dari 50% kematian disebabkan oleh komplikasi jantung vaskuler, oleh karena itu mortalitas jantung vaskuler 10-20 kali lebih tinggi daripada populasi umum (Rayner, 2004).
Peningkatan inflamasi dan stres oksidatif merupakan faktor resiko non tradisional yang penting untuk penyakit jantung vaskuler yang teridentifikasi pada pasienpenyakit ginjal kronik(Kendrick dan
Chonchol,2008). Dalam hal ini inflamasi kronis dan stres oksidatif lebih ditekankan dan mekanisme sinergiskeduanya mempresentasikan kontributor penting perkembangan dan progresi percepatan proses aterosklerosis yang dihubungkan dengan penyakit jantung vaskulerdanpenyakit ginjal kronik(Cachofeiroet al, 2008).Penyakit kardiovaskuler merupakan komplikasi yang sering terjadi pada pasienpenyakit ginjal kronikdibandingkan populasi umum yang dapat menyebabkan meningkatkan morbiditas dan mortalitas pasien penyakit ginjal kronik(Collins, 2003; Sarnak et al 2003).
Beberapa kelainan patologik dan manifestasi klinik penyakit kardiovaskuler pada penyakit ginjal kronikterdapat kelainan pada arteri (aterosklerosis, arteriosklerosis). Aterosklerosis adalah radang pada pembuluh darah disebabkan oleh penumpukan plak ateromatous pada tunika intima, sedangkan arteriosklerosis adalah suatu remodeling dari arteri besar disertai dengan kalsifikasi tunika media dan berkurangnya elastisitas arteri (Campean et al, 2005). Presentasi klinis terjadi pada populasi umum antara lain penyakit jantung iskemik, penyakit serebrovascular, penyakit vaskuler perifer atau gagal jantung (Suhardjono, 2009).
Beberapa faktor resiko kardiovaskular dan disfungsi endotel dapat merangsang Nicotinamide Adenine Dinucleotide Phosphate Oxidase (NADPH oksidase) pada mitokondria sehingga enzim tersebut akan mengekskresikan stres oksidatif. Stres oksidatif menyebabkan terjadinya disfungsi endotel. Disfungsi endotel akan meningkatkan progresifitas aterosklerosis (Gibbons GH, 1997).
Pasien penyakit ginjal kronikberada pada suatu kondisi dengan status inflamasi kronik yang dihubungkan dengan kalsifikasi vaskuler. Pada penelitian observasional menunjukkan adanya hiperphospatemia, tingginya kadar hormon paratiroid dan meningkatnya kalsifikasi vaskuler merupakan faktor resiko penyakit kardiovaskuler pada penyakit ginjal kronik.Pada pasien penyakit ginjal kronikdengan hiperparatiroid sekunder terjadi peningkatan kadar sitokin pro inflamasi sehingga regulasi dari inflamasi
vaskuler sistemik dan proses kalsifikasi merupakan masalah penting pada pasien penyakit ginjal kronikyang menjalani hemodialisis (Tentori et al, 2008).
Hormon Paratiroid (PTH) dan vitamin D berperan dalam homeostasis mineral dan tulang. Fungsi utama dari PTH-vitamin Dadalah untuk mempertahankan kadar kalsium serum dengan merangsang produksi 1,25-dihydroxyvitamin D atau 1,25(OH)2 vitamin D atau Calcitrioldan penurunan ekskresi kalsium urin olehginjal. Paratiroid Hormon meningkatkan kalsium dari tulang. Sekresi Paratiroid Hormon diatur oleh calsium sensing reseptor (CASR) terletak di kelenjar paratiroid, merespon kalsium serum terionisasi dengan meningkatkansekresi Paratiroid Hormon, 84 asam amino peptida dengan Paratiroid HormonReseptor 1 (PTHR1) G protein-coupled reseptor padatubulus ginjal dan osteoblas/osteosit dalam tulang. Paratiroid Hormonmerangsang produksi1,25(OH)2 vitamin Datau Calcitrioldalam tubulus proksimal dengan meningkatkanCytochrome p450 27B1 (CYP27B1) dan meningkatkan reabsorpsi kalsium di tubulus distal melalui regulasi Transient Receptor Potential Cation Channel Subfamily V
member 5(TRPV5)(De Groot,2009). Paratiroid Hormon dalam
tulang,meningkatkan kalsium dan fosfat melaluistimulasi Receptor
Activator of Nuclear Factor Kappa-B Ligand (RANKL) oleh osteoblas yang
pada gilirannya merangsang resorpsi tulang oleh osteoklas. Meningkatnya produksi 1,25(OH)2 vitamin Datau Calcitriol oleh ginjal dan usus kecil untuk meningkatkan penyerapan kalsium dan fosfat. Meningkatnya fosfat dari tulang dan masuknya dari jalur gastrointestinal adalahseimbang dengan efek Paratiroid Hormon menurunkan reabsorbsi fosfat oleh tubulus ginjal untuk menjaga keseimbangan fosfat netral.
Penelitian epidemiologi menyebutkan bahwa rendahnya kadar 25- hydroxyvitamin Datau 25(OH) vitamin D berhubungan dengan meningkatnya resiko penyakit jantung vaskuler (Yanet al, 2013). Penelitian lain menyebutkan bahwa rendahnya kadar vitamin D pada pasien penyakit ginjal kronik baik pre dialisis maupun yang menjalani dialisis berhubungan
erat dengan peningkatan mortalitas dan kejadian kardiovaskuler (Pilz et al, 2011).
Penurunan fungsi ginjal pada penyakit ginjal kronikdisertai dengan penurunan produksi 1,25-dihydroxyvitamin D atau 1,25(OH)2 vitamin D atau Calcitriol, dimulai pada penyakit ginjal kronikstadium 2 yang secara progresif bertambah rendah dengan bertambahnya stadium penyakit. Rendahnya kadar 1,25-dihydroxyvitamin D (Calcitriol) tersebut beberapa efek samping pada pasien penyakit ginjal kronikmeliputi gangguan pada homeostasis mineral tulang dan hormon paratiroid, kalsifikasi ekstraskeletal dan terganggunya fungsi biologi multiorgan (Moscovici dan Sprague, 2007).
1,25-dihydroxyvitamin D (Calcitriol)dikenal merupakan terapi lini pertama yang dapat menekan kadar hormon paratiroid pada pasien penyakit ginjal kronikdengan hiperpartiroid sekunder. Selain menekan kadar hormon paratiroid, vitamin D juga dapat memodulasi respon imun dan diferensiasi sel. Karena efek tersebut diharapkan dapat mengontrol status inflamasi pada pasien penyakit ginjal kronikdan pemberian vitamin D dapat menekan mortalitas pada pasien penyakit ginjal kronik. 1,25-dihydroxyvitamin D (Calcitriol)juga mencegah nefrosklerosis dan memperlambat progresivitas penyakit ginjal kronik melalui efek anti inflamasi dan anti proliferatifnya (Teng et al, 2003).
Peran 1,25-dihydroxyvitamin D (Calcitriol)sebagai anti inflamasi melalui penekanan pada jalur Nuclear Factor kB (NF-ĸB), dimana jalur Nuclear Factor kBini sangat berperan penting dalam progresivitas penyakit ginjal, karena jalur tersebut akan memicu inflamasi dan fibrogenesis melalui pelepasan sitokin pro inflamasi (Lang, 2014). Peran vitamin D aktif dalam mengatasifibrosis ginjal dan disfungsi ginjal pada beberapa jalur patogen berkorelasi antara menurunnya vitamin D aktif pada ginjaldan rendahnya kadar serum 1,25(OH)2D3atau Calcitriol sering dikaitkan denganpenurunan fungsi ginjal (Llach dan Yudd,1998).
Fibroblast Growth Factor-23(FGF-23) disekresi oleh tulang dan ginjal untuk mengatur metabolisme vitamin D dan fosfat di ginjal (Yamashita,Yoshioka, Itoh, 2000). Fibroblast Growth Factor-23berinteraksi dengan reseptor FGF (FGFRs) sebagai kofaktor klotho (Goetz, 2007). Klotho memfasilitasi pengikatanFibroblast Growth Factor-23ke Fibroblast Growth Factor Reseptor 1c (FGFR1c, FGFR3c dan FGFR4). (Kurosu, 2006; Urakawa, 2006). Fibroblast Growth Factor Reseptor (FGFRs) mengandung sinyal transducingekstraseluler liganbinding domain dan intraselulertirosine kinase domain. Ekspresi klothomenentukan spesifisitas fungsi jaringanFibroblast Growth Factor-23(Kurosu, 2006; Torres, 2007).
Fibroblast Growth Factor-23(FGF-23)adalah tumor yang melepaskanFibroblast Growth Factor-23, menghasilkan hypophosphatemiadan penurunan kadar serum 1,25 (OH)2 vitamin D (White KE,2000; Shimada, 2004).Sebaliknyatikus atau manusia denganpenurunanFibroblast Growth Factor-23atau denganpenghapusan Klotho sebagai koreseptor penting untukFibroblast Growth Factor-23, hyperphosphatemia dan peningkatan serum 1,25 (OH)2 vitamin D3
(Kurosu, 2006; Araya, 2005). Di samping
itu, klothomRNAdan protein yang ditampilkan,Fibroblast Growth Factor-23konsentrasinyajauh lebih besar di ginjaldaripada di setiaporgan. Ditentukanolehreseptor Klotho Fibroblast Growth Factor Reseptor 1c (FGFR1c) heterodimer di tubulusdistal ginjal (Farrow, 2009).
Klotho tidakhanya terdapat
di ginjal tetapi juga padaorgan lain.Ekspresi klotho terdapat di ginjal, sinoatrialnode hati,pleksus koroiddan paratiroid. Fibroblast Growth Factor-23mengikatKlotho-Fibroblast Growth Factor Reseptor
1c(FGFR1c) heterodimer dan mengaktifkanjalur
transduksi MitogenActivated ProteinKinase(MAPK), menyebabkanpenurunan Sodium Phosphate Cotransporter 2a(NaPi2a)
ginjal dan
p45027B1 (CYP27B1),penurunankadarserum 1,25(OH)2 vitamin D.
Pleksus koroid klotho memilikiperandalamtransfer kalsium yang dimediasi olehNatrium/ Kalium ATPase (Na+/K+ ATPase).(Kurosu, 2006; Urakawa, 2006).
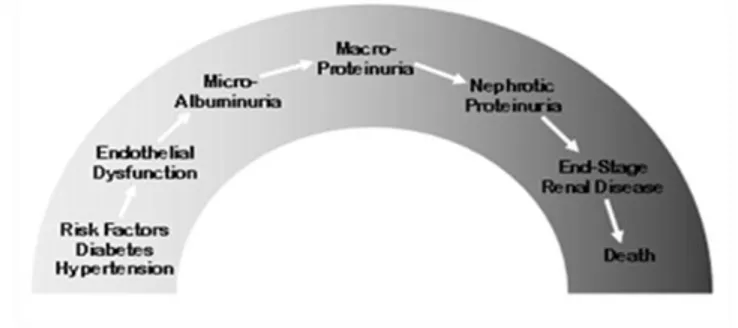
Albuminuria sangat penting sebagai marker disfungsi endotel pada seluruh pembuluh darah baik pada ginjal, jantung koroner dan serebral. Bila terjadi kenaikan albuminuri (mulai dari mikroalbuminuri) akan terjadi meningkatnya resiko reno kardio serebral vaskuler, sehingga perlu diantisipasi untuk mencegah peningkatan resiko tersebut. Keadaan mikroalbuminuri harus diperhatikan sebab merupakan tanda peningkatan resiko reno kardio serebro vaskuler dan kondisi tersebut masih reversibel, sehingga faktor pemberat (hipertensi, hiperlipidemi, diabetes mellitus) harus dikendalikan. Bila sudah terjadi makroalbuminuri, proses disfungsi endotel menjadi iriversible, sehingga tidak bisa membuat normal target organ tetapi hanya berusaha mengurangi progresifitas kerusakan target organ (Purwanto B, 2012).
Kaitan antara mikroalbuminuria dengan komplikasi kardiovaskular sebetulnya belum jelas, akan tetapi mikroalbuminuria dapat terjadi karena disfungsi endotel atau merupakan konsekuensi penyakit vaskular secara umum. Disfungsi endotel dan inflamasi kronik dapat menerangkan kaitan antara mikroalbuminuria dengan kelainan kardiovaskular yang terjadi kemudian (Brantsma, 2006).
Studi lain, mikroalbuminuria sebagai prediktor dan prognosis infark miokardial. Studi ini menunjukkan bahwa pendekatan melalui pengukuran albumin dalam urin ini cukup efektif dalam mencegah penyakit jantung dan pada beberapa kelompok dengan resiko tinggi terjadinya albuminuria menjadi sangat bermanfaat (Gansevort, 2009; Newman dan Price, 2001).
Studi tentang albuminuria sebagai predictor hemorrhagic transformation pada acute ischemic stroke dengan kesimpulan bahwa rata-rata kadar albuminuria pada derajat klinis ringan lebih rendah daripada
kadar albuminuria pada derajat klinis sedang dan terdapat hubungan bermakna antara derajat klinis penderita stroke iskemik dengan kadar albuminuria (Pedrinelli, 1994).
1.2 Rumusan Masalah
1.2.1 Adakah pengaruh 1,25 Dihydroxyvitamin D (Calcitriol) terhadap kadar Fibroblast Growth Factor-23 pada pasien Penyakit Ginjal Kronikstadium V yang menjalani hemodialisis
1.2.2 Adakah pengaruh 1,25Dihydroxyvitamin D(Calcitriol)terhadap albuminuria pada pasien Penyakit Ginjal Kronikstadium V yangmenjalani hemodialisis
1.3 Tujuan Penelitian 1.3.1 Tujuan umum
Penelitian ini bertujuan untuk mengetahui pengaruh 1,25 DihydroxyvitaminD (Calcitriol)terhadapkadar Fibroblast Growth Factor-23 dan albuminuria pada pasienPenyakit Ginjal Kronikstadium V yang menjalani hemodialisis
1.3.2 Tujuan khusus
1.3.2.1 Membuktikan adanya pengaruh1,25DihydroxyvitaminD (Calcitriol)terhadap kadar Fibroblast Growth Factor-23 pada pasien Penyakit Ginjal Kronikstadium V yang menjalani hemodialisis
1.3.2.2 Membuktikan adanya pengaruh 1,25DihydroxyvitaminD (Calcitriol) terhadap albuminuria pada pasien Penyakit Ginjal Kronikstadium V yang menjalani hemodialisis
1.4 Manfaat Penelitian 1.4.1 Manfaat Teoritis
Memberikan bukti empiris terhadap teori bahwa 1,25 DihydroxyvitaminD (Calcitriol)akan berpengaruh terhadap kadarFibroblast Growth Factor-23 dan albuminuria sehingga menurunkan kalsifikasi vaskuler yang pada akhirnya mengurangi progresifitas penurunan fungsi ginjal
1.4.2 Manfaat Terapan
1,25 DihydroxyvitaminD (Calcitriol)dapat menurunkan kalsifikasi vaskuler sehingga dapat menghambat aterosklerosis yang akhirnya mengurangi morbiditas dan mortalitas pasien penyakit ginjal kronik
BAB 2
TINJAUAN PUSTAKA
2.1 Kajian Teori
2.1.1Penyakit Ginjal Kronis
Penyakit Ginjal Kronis (PGK) adalah suatu proses patofisiologi dengan etiologi yang beragam yang dapat mengakibatkan penurunan fungsi ginjal secara progresif dan pada umumnya akan berakhir dengan gagal ginjal. Gagal ginjal adalah suatu keadaan klinis yang ditandai dengan penurunan fungsi ginjal yang ireversibel, dimana pada suatu derajat memerlukan terapi pengganti ginjal yang tetap, baik berupa dialisis atau transplantasi ginjal (Suwitra, 2014).
Batasan Penyakit Ginjal Kronik pada pedoman Kidney Disease Outcomes Quality Initiative (KDOQI) adalah kerusakan ginjal yang terjadi selama lebih dari tiga bulanberdasarkan kelainan patologik atau petanda kerusakan ginjal seperti proteinuria. Kidney Disease Outcomes Quality Initiative(KDOQI) membuat klasifikasi Penyakit Ginjal Kronik dalam 5 tahap berdasarkan tingkat penurunan fungsi ginjal yang dinilai dengan laju filtrasi glomerulus (LFG) seperti terlihat pada Tabel 2.1 (KDOQI, 2002). Tabel 2.1. Kriteria penyakit ginjal kronik (Suwitra, 2014)
Kriteria PGK
1. Kerusakan ginjal (renal damage) yang terjadi lebih dari 3 bulan, berupa kelainan struktural atau fungsional, dengan atau tanpa penurunan laju filtrasi glomerulus (LFG), dengan manifestasi :
Kelainan patologis
Terdapat tanda kelainan ginjal, termasuk kelainan dalam komposisi darah atau urin, atau kelainan dalam test pencitraan (imaging test)
Laju filtrasi glomerulus (LFG) kurang dari 60 ml/menit/1,73m2 selama 3 bulan dengan atau tanpa kerusakan ginjal.
Klasifikasi penyakit ginjal kronik di dasarkan atas dasar dua hal yaitu atas dasar derajat (stage) penyakit dan atas dasar diagnosis etiologi. Klasifikasi atas dasar derajat penyakit dibuat berdasar Laju filtrasi glomerulusyang dihitung menggunakan rumus Kockcroft-Gault sebagai berikut (Suwitra, 2014) :
(140 – umur) x BB (kg) LFG (ml/mnt/1,73 m2) = 72 x kreatinin plasma (mg/dl)
*) pada perempuan dikalikan 0,85
Pada pasienPenyakit Ginjal Kronik, klasifikasi stadium ditentukan oleh nilai laju filtrasi glomerulus yaitu stadium yang lebih tinggi menunjukkannilai laju filtrasi glomerulus yang lebih rendah (Tabel 2.2) (Suwitra, 2014).
Tabel 2.2 Klasifikasi penyakit ginjal kronik berdasar derajat penyakit (Suwitra, 2014) Derajat Penjelasan LFG 1 2 3 4 5
Kerusakan ginjal dengan LFG normal atau meningkat Kerusakan ginjal dengan LFG meningkat ringan Kerusakan ginjal dengan LFG meningkat sedang Kerusakan ginjal dengan LFG meningkat berat Gagal ginjal ≥ 90 60-89 30-59 15-29 < 15/ dialisis
2.1.2 Morbiditas dan Mortalitas Penyakit Kardiovaskuler pada Penyakit Ginjal Kronis
Morbiditas dan mortalitas kardiovaskular pada Penyakit Ginjal Kroniksangat tinggi, akan tetapi banyak pasien yang meninggal karena komplikasi kardiovaskular sebelum fungsi ginjal mencapai tahap terminal. Lebih dari separuh pasien Penyakit Ginjal Kronikmempunyai komplikasi penyakit jantung kongestif, sedangkan sekitar tiga perempatnya mempunyai hipertrofi ventrikel kiri. Selain itu penyakit kardiovaskular merupakan penyebab utama kematian pasien Penyakit Ginjal Kronik, terlebih lagi pasien yang menjalani dialisis (Suhardjono, 2009).
Penyakit jantung vaskuler merupakan penyebab utama morbiditas dan mortalitas pasien dengan Penyakit Ginjal Kronikpada semua stadium (Skorecki, 2005). Penyakit jantung merupakan penyebab kematian paling penting pada pasien yang menjalani hemodialisis yaitu 44% dari seluruh mortalitas. Sebagai gambaran, mortalitas penyakit kardiovaskuler pada populasi umum (~2.000 kematian) dibandingkan mortalitas pada pasien hemodialisis (~50.000 kematian). Hasil tersebut menunjukkan bahwa tingkat mortalitas penyakit kardiovaskuler per tahun jauh lebih tinggi pada pasien hemodialisis tanpa mempertimbangakan jenis kelamin, ras atau usia. Pasien hemodialisis yang masih muda memiliki peningkatan tingkat mortalitas hingga 500 kali dibandingkan usia yang sesuai pada populasi umum dan tingkat mortalitas tetap lima kali lipat lebih tinggi, meskipun pada pasien paling tua (Gambar 2.1) (Sarnaket al, 2003).
Gambar 2.1 Mortalitas penyakit kardiovaskuler pada populasi umum dibandingkan dengan pasien penyakit ginjal kronik stadium terminal yang menjalani dialisis. GP:general population(Sarnak, 2003).
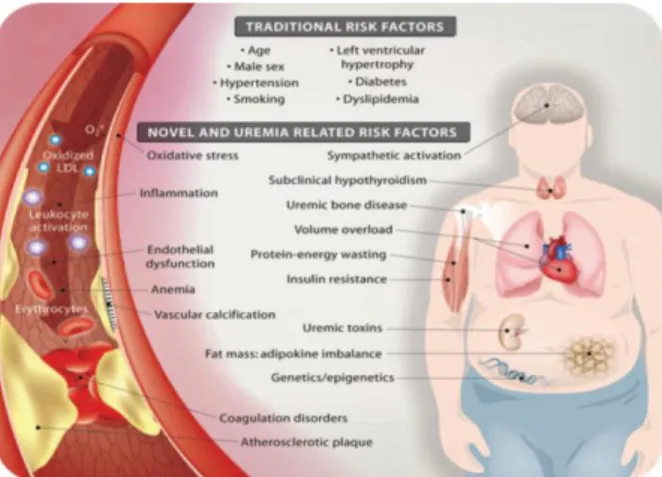
Salah satu komplikasi Penyakit Ginjal Kronikadalah adanya penyakit kardiovaskuler (PKV) yang di dasari oleh proses aterosklerosis. Angka mortalitaspasien Penyakit Ginjal Kronikdiakibatkan oleh penyakit kardiovaskuler semakin hari semakin meningkat mencapai 40-50% pada pasien dengan dialisis reguler. Faktor resiko kardiovaskuler pada Penyakit Ginjal Kronikterdiri dari faktor resiko klasik (tradisional) dan non klasik (non tradisional) seperti terdapat pada gambar 2.2, meskipun mekanismenya belum dimengerti (Filiopoulos dan Vlassopoulos, 2009).
Berbagai macam faktor resiko dan perubahan metabolik yang didapatkan pada kondisi uremia, berkontribusi terhadap terjadinya faktor resiko penyakit kardiovaskuler pada populasi tersebut. Faktor resiko tradisional (Framingham: usia, gaya hidup, hipertrofi ventrikel kiri, dislipidemia, hipertensi dan diabetes melitus) memprediksi mortalitas kardiovaskuler pada pasien dengan Penyakit Ginjal Kronikringan hingga sedang (Munter, 2005), sedangkan faktor resiko non tradisional untuk penyakit kardiovaskuler seperti inflamasi, disfungsi endotel, hiperaktivitas simpatis, protein-energy wasting (istilah baru yang diajukan untuk kehilangan protein tubuh dan cadangan energi), stres oksidatif, kalsifikasi vaskuler dan volume overload, memiliki prevalensi tinggi pada pasien-pasien tersebut (Stevinkel dan Peter, 2008).
Gambar 2.2 Faktor resiko kardiovaskuler tradisional dan non tradisional (terkait uremia) pada Penyakit Ginjal Kronik (Stevinkel, 2008)
Terdapat dua alasan potensial untuk peningkatan resiko mortalitas penyakit kardiovaskuler yang dramatis pada populasi hemodialisis.Pertama adalah tingginya prevalensi penyakit kardiovaskuler dan kedua adalah tingginya tingkat kasus kematian pada pasien yang telah memiliki penyakit kardiovaskuler.Berbagai data menunjukkan bahwa pasien hemodialisis memiliki prevalensi penyakit jantung iskemik dan gagal jantung kongestifyang lebih tinggi dibandingkan populasi umum.Sebagai tambahan prevalensi pasien dengan hipertrofi ventrikel kiri sejumlah 75% pada pasien dialisis (Sarnaket al, 2003).
Penting untuk digarisbawahi bahwa prevalensi penyakit kardiovaskulermeningkat pada semua pasien dengan Penyakit Ginjal Kronik, tidak hanya pasien dengan penyakit ginjal tahap akhir (PGTA). Prevalensi hipertrofi ventrikel kiri meningkat dengan menurunnya filtrasi glomerulus dan sebanyak 30% pasien penyakit ginjal tahap akhir telah memiliki bukti klinis adanya penyakit jantung iskemik atau gagal jantung.Juga perlu diperhatikan bahwa pasien dengan penurunan laju filtrasi glomerulus (LFG) lebih cenderung mengalami kematian akibat penyakit kardiovaskuler daripada berkembang ke penyakit ginjal tahap akhir (Sarnaket al, 2003).
2.1.3 Resiko kardiovaskuler pada penyakit ginjal kronik
Pasien Penyakit Ginjal Kronik lebih beresiko terjadinya Penyakit Kardio Vaskulardibandingkan individu tanpa Penyakit Ginjal Kronik dengan faktor resiko kardiovaskuler yang sama. Terapi ditujukan untuk menurunkan faktor resiko tradisional, sehingga faktor resiko tradisional saja tidak dapat menjelaskan angka kejadianPenyakit Kardio Vaskular yang tinggi pada pasienPenyakit Ginjal Kronik (Martens dan Edward, 2011).
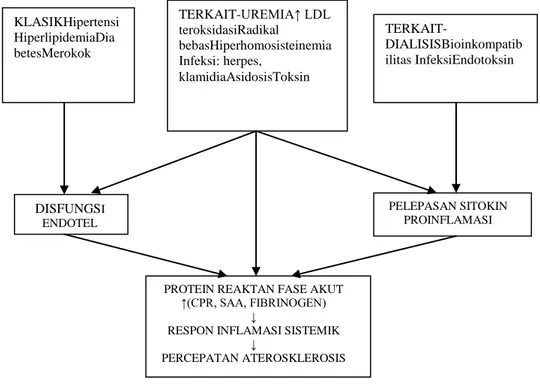
Pasien dengan hiperuremia kronis yang disebabkan oleh faktor-faktor renal maupun non-renal, faktor-faktor-faktor-faktor resiko penyakit jantung dan aterosklerosissaling mempengaruhi sebagai komorbiditas, seperti terlihat pada Gambar 2.3(Santoro dan Mancini, 2002).
Gambar 2.3Faktor resiko aterosklerosis pada uremia (Santoro danMancini, 2002).
Pada respon inflamasi yang berhubungan dengan uremia, khususnya respon seluler yang dimediasi oleh sel seperti monosit dan makrofag bukti telah menunjukan bahwa endotel vaskular berperan penting KLASIKHipertensi HiperlipidemiaDia betesMerokok TERKAIT-UREMIA↑ LDL teroksidasiRadikal bebasHiperhomosisteinemia Infeksi: herpes, klamidiaAsidosisToksin TERKAIT-DIALISISBioinkompatib ilitas InfeksiEndotoksin DISFUNGSI ENDOTEL PELEPASAN SITOKIN PROINFLAMASI
PROTEIN REAKTAN FASE AKUT
↑(CPR, SAA, FIBRINOGEN)
↓ RESPON INFLAMASI SISTEMIK
↓ PERCEPATAN ATEROSKLEROSIS
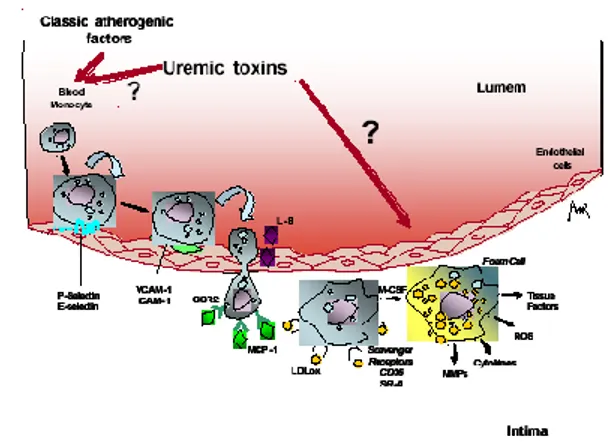
dalam kuatnya respon inflamasi. Inflamasi yang terus menerus menghasilkan respon vaskuler pada suatu proses yang diperantarai oleh mediator inflamasi lewat jalur kemotaktik dan haptotatik. Migrasi monosit ke tunika intima akan berubah menjadi makrophag, memakan lipid dan menjadi foam cells seperti terlihat pada Gambar 2.4 (Stinghen dan Pecoits-Filho, 2007).
Gambar 2.4Peranan uremia pada disfungsi endotel (Stinghen dan Pecoits-Filho, 2007).
2.1.4 Inflamasi pada Penyakit Ginjal Kronis
Inflamasi kronis yang terdapat pada penyakit ginjal kronis terjadi tanpa adanya infeksi akut atau penyakit sistemik aktif. Peningkatan kadar penanda inflamasi yang bersirkulasi seperti Interleukin 6 (IL-6, IL-18), S-albumin, leukosit, fibrinogen, hyaluronan, myeloperoxidase, C-Reactive Protein (CRP) dan pentraxin-3 (PTX3) berhubungan dengan morbiditas kardiovaskuler dan mortalitas pada pasien Penyakit Ginjal Kronis (Stevinkel dan Peter, 2008). Telah dibuktikan bahwa peningkatan CRP serum terdapat pada 30-60% pasien dialisis dan berkorelasi dengan prevalensi penyakit kardiovaskuler yang tinggi pada populasi tersebut.Hal tersebut tidak terbatas pada pasien dengan penyakit ginjal tahap akhir (PGTA) yang telah menjalani dialisis, bahkan pasien dengan gangguan
fungsi ginjal yang ringan menunjukkan tanda-tanda mikro inflamasi (Sarnaket al, 2003).Tampaknya bahwa peningkatan klirens sitokin proinflamasi yang bersirkulasi, endotoksemia akibat volume overload dan stres oksidatif berkontribusi pada fenomena tersebut (Alscher dan Thomas, 2005).
2.1.5Stres Oxidatif pada Penyakit Ginjal Kronik
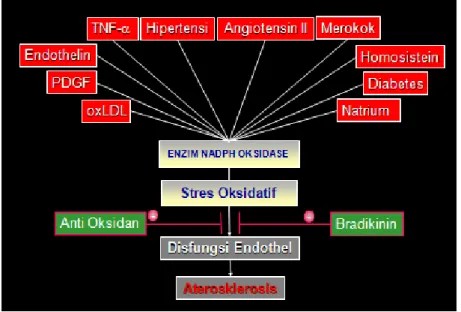
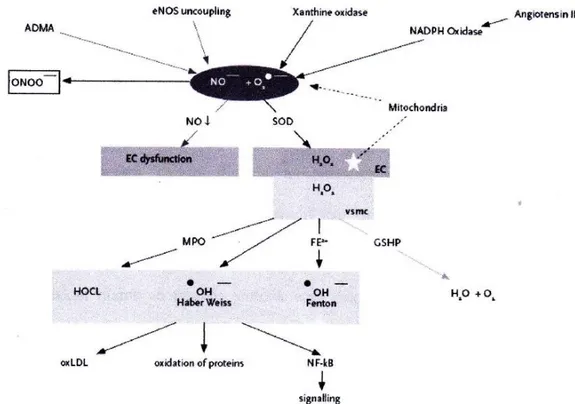
Faktor resiko kardiovaskular dan disfungsi endotel Oxidized Low Density Lipoprotein(OxLDL), hipertensi angiotensin II, merokok, homosistein, diabetes dan hipernatremia) dapat merangsang Nicotinmide Adenine Dinucleotide Phosphate Oxidase (NADPH oksidase) pada mitokondria sehingga enzim tersebut akan mengekskresikan stres oksidatif. Stres oksidatif akan menyebabkan disfungsi endotel. Disfungsi endotel akan meningkatkan progresifitas aterosklerosis seperti terlihat pada gambar 2.5 (Gibbons GH, 1997).
Gambar 2.5Faktor resiko kardiovaskular dan disfungsi endotel (Gibbons GH, 1997)
Ketidakseimbangan antara produksi Reactive Oxygen Species(ROS) dan pertahanan antioksidan menghasilkan kondisi stres oksidatif yang dapat muncul dari defisiensi anti oksidan (glutation, asam askorbat atau α tocoferol) atau peningkatan pembantukan Reactive Oxygen Species seperti peroksinitrit (OONO-), Hypochlorous Acid(HOCL) atau anion superoksida (Nanayakkara dan Gaillard, 2010; Sigma, 2011), Oksidasi Low Density Lipoprotein (ox-LDL) diyakini sebagai langkah kunci dalam inisiasi aterosklerosis, sehingga stres oksidatif juga diyakini sebagai salah satu mekanisme peningkatan resiko kardiovaskuler pada Penyakit ginjal Kronik (Himmelfarb, 2002).
Ketersediaan Nitrite Oxyde (NO) pada disfungsi ginjal terganggu oleh peningkatan kadar Asimetric Dimethylarginine (ADMA). Terdapat bukti yang mendukung hipotesis bahwa Asymetric Dimethylarginine (ADMA), suatu inhibitor endogen Nitrite Oxyde-Synthase terlibat dalam memperantarai Penyakit Jantung Vascular. Asimetric Dimethylarginine (ADMA) terutama diekskresikan melalui ginjal in vivo, diketahui meningkat kadarnya pada Penyakit ginjal Kronik. Asimetric Dimethylargininejuga merupakan prediktor independen disfungsi endotel dan merupakan prediksi buruk pada pasien hemodialisis.
Angiotensin II (Ang II) menstimulasi pembentukan Reactive Oxygen Species(ROS) intraseluler seperti anion superoksida dan hidrogen peroksida. Angiotensin II mengaktifkan beberapa subunit Nicotinmide Adenine Dinucleotide Phosphate Oxidase (NADPH oksidase) dan juga meningkatkan pembentukan Reactive Oxygen Speciesdi dalam mitokondria. Peningkatan O2-dibentuk oleh Nicotinmide Adenine Dinucleotide Phosphate Oxidasedan Xanthine Oxidase nantinya akan menurunkan ketersediaan Nitrite Oxyde (NO), menginduksi disfungsi sel endotel dan sel otot polos vaskuler. Superoksida juga bereaksi dengan Nitrite Oxydeuntuk membentuk peroksinitrit ONOO-yang merusak jaringan dan menginduksi disfungsi mitokondria (Oikawa, 2005; Nanayakkara dan Gaillard, 2010).
Superoksida Dismutase (SOD) mengubah superoksida menjadi Hidrogen Peroksidase(H2O2)yang dapat memasuki sel dengan mudah. Oksidan hidrogen peroksidase (H2O2) yang kurang aktif kemudian direduksi menjadi air dan oksigen oleh katalase dan glutation peroksidase. Sistem glutation sangat penting untuk perlindungan melawan stres oksidatif. Selain itu Hidrogen Peroksidase (H2O2)dapat dikonversi menjadiradikal hidroksil (OH-), Reactive Oxygen Speciespaling reaktif dan toksik melalui reaksi Harber-Weiss atau Fenton. Dengan adanya Myeloperoksidase (MPO) dari neutrofil, Hidrogen Peroksidase (H2O2)membentuk oksidantambahan (Gambar 2.6) (Nanayakkara dan Gaillard, 2010).
Gambar 2.6Representasi sederhana pembentukan superoksida dan hidrogen peroksida. ADMA = asymetric dimethylarginine; ROS = reactive oxigen species; SOD = superoxide dismutase; EC = endotelial cell; VSMC = vascular smooth muscle cell; GSHP = glutathioneperoxidase; MPO = myeloperoxidase; NF-kB = nuclear factor kB; AGE = advanced glycosilation end products (Nanayakkara dan Gaillard, 2010).
2.1.6Fibroblast Growth Factor-23 (FGF-23)
Fibroblast Growth Factor-23(FGF-23) merupakan
anggota subfamili FGF-19 dari FGFs endokrin
yang juga mencakup Fibroblast Growth Factor (FGF) 15/19 dan Fibroblast
Growth Factor21/23. Fibroblast
GrowthFactor-23pertamakali diidentifikasi dalam inti thalamicventrolateral dalamotak tikus pada Autosomal Dominan Hypophos phatemic Ricketsia (ADHR).Fibroblast Growth Factor-23 terutama terdapat di osteosit dan osteoblasdalam tulangtapi jugaterdapat pada kelenjar ludah, lambung dan jaringan lain termasuk otot rangka,otak,kelenjar susu dan hati. Gen Fibroblast Growth Factor-23 terletakpada kromosom 12 pada manusia dan kromosom 6 pada tikus oleh 3 exons, dipisahkan oleh 2 intron dan encode 32-kDa glikoproteinyang mengandung251 asam amino residu. Proteinterdiri dari 24 asam aminohidrofobik, 154 asam amino NH2 terminal yang mengandung inti homolog dan Fibroblast Growth Factor73 asam amino Carboxylic Acid(COOH)terminal domain. Setelah pembelahan24 asam amino dan O-glikosilasi olehUridine Diphosphate
N-Acetylglucosamine (UDP-GlcNAc): polipeptida Galactosaminyl N-Acetyl
Transferase3 (GALNT3), 25-251 proteinFGF 23 disekresike dalam sirkulasi. Dalam aliran darah, protein Fibroblast Growth Factor-23beredar dalam dua bentukyang berbeda yaitu bentuk matang penuh (25-FGF-23-251) dan bentuk yang lebih pendek (25-Fibroblast Growth Factor-23-179) kurang Carboxylic Acid(COOH)terminal 73 asam amino. Bentuk pendek munculdaripembelahan proteolitik pada 176RXXR179 yang mengikutiFibroblast Growth Factor10-12 inti homolog Fibroblast Growth Factor-23.Hanya bentuk panjangFibroblast Growth Factor-23 yang aktif, karena Carboxylic Acid(COOH-) terminal domain penting untuk interaksi dengan kofaktor Klotho dan aktivasi dari sinyalFibroblast Growth Factor Reseptor (FGFR). O-glikosilasi dari Fibroblast Growth Factor-23terjadi pada daerah 162–228
yang tumpang tindih dengan pembelahan176RXXR179 dan modifikasi ini untukmelindungi Fibroblast Growth Factor-23 dari pembelahan oleh subtilisin seperti proprotein convertases apabilamenggunakan rekombinan peptida secara in vitro. Sebaliknya, Fibroblast Growth Factor-23pada manusia dengan homozygous mutasi pada Fibroblast Growth Factor-23berkembang ke hiperfosfatemiaoleh 1,25 (OH)2Ddan kalsifikasi jaringan lunak. Gen klotho mengkodekan protein transmembran dengan ekstracellular domain terdiri dari dua domain homolog yang urutan homolog dengan β glukosidase (Kurosu, 2006; Urakawa, 2006).
Fibroblast Growth Factor-15 (FGF-15) danFibroblast Growth Factor-19 (FGF-19) adalah orthologs pada vertebrata danFibroblast Growth Factor-15 (FGF-15) terdapat pada manusia (Itoh N dan Ornitz DM,2004). FamiliFibroblast Growth Factor(FGF) dibagi menjadi tujuh filogenetiksubfamili menyusun tiga kelompok sesuai dengan mekanisme: intraseluler, kanonik dengan Fibroblast Growth Faktorseperti hormon (Itoh dan Ornitz DM,2008).Kelompok Fibroblast Growth Factorintraseluler termasuk subfamiliFibroblast Growth Factor11/12/13/14. Fibroblast Growth Factor (FGFs) ini bertindak sebagai sinyal molekul intraselulerdalam reseptor FGF (FGFR) (Goldfarb, 2007;Xiao, 2007). Kelompok Fibroblast Growth Factorkanonik termasuk FGF 1/2/5, Fibroblast Growth Factor3/4/6, Fibroblast Growth Factor7/10/22, Fibroblast Growth Factor8/17/18. Fibroblast Growth Factor (FGFs) Canonical memediasi respon biologis sebagai protein ekstraselulerdengan mengikat dan mengaktifkan permukaan seltyrosine kinase FGFR dengan heparin/ heparin sulfat sebagai kofaktor dan bertindak sebagai sinyal molekul autokrin/parakrin (Itoh dan Ornitz DM,2004, 2008; Thisse B dan Thisse C,2005). Kelompok endokrin Fibroblast Growth Factortermasuk subfamili Fibroblast Growth Factor19/21/23.Berbeda dengan kelompok Fibroblast Growth Factorkanonik, Fibroblast Growth Factor (FGFs) seperti hormonbertindak secara sistemik sebagai faktor endokrin. Namun jugamemediasi respon melalui mekanisme yang tergantung Fibroblast Growth Factor Reseptor
(FGFR).Gen Fibroblast Growth Factor Reseptor-15 seperti FGFs hormon dihasilkan darigen Fibroblast Growth Factor Reseptor-4 seperti FGFs kanonik oleh duplikasi gen pada vertebrata. KemudianFibroblast Growth Factor Reseptor 15/19,Fibroblast Growth Factor Reseptor-21dan Fibroblast Growth Factor Reseptor-23 dihasilkan dari Fibroblast Growth Factor Reseptor-15 seperti gen oleh duplikasi genom. FGFs Canonicalmengikat heparin untuk stabilitas FGFRs. Sebaliknya hormon seperti FGFs sebagai fungsi endokrin dengan mengikat pengurangan afinitas heparin dan COOH memungkinkan aktivasi reseptor FGF dengan tidak adanya heparin (Itoh,2010).
Fibroblast Growth Factor-23 bertanggung jawab atas gejala klinis pasien yang menderitaautosomal dominan hypophosphatemic riketsia. Mutasi ini mencegah proteolitik pembelahan protein Fibroblast Growth Factor-23, meningkatkan aktivitas biologis dan mengakibatkan kerusakan ginjal. Demikian pula peningkatan kadar serum Fibroblast Growth Factor-23 pasien dengan osteomalasia onkogenik menjadifaktor penyebab tumor ginjal yang diinduksi oleh fosfat(Simada, 2001).
Klotho sebagian besar terdapat pada tubulus distal ginjal, sel epitel, kelenjar paratiroid dan glandula hipofisis(Torres, 2007; NabeshimaY, 2006). Sumbu Fibroblast Growth Factor-23, tulang dan ginjal adalah bagian dari sistem biologis menghubungkan tulang dengan organ lain melalui jaringan endokrin yang kompleks, terintegrasi dengan axis Paratiroid hormon/ vitamin D dan memainkan peran yang sama (Yamashita, 2000). Fibroblast Growth Factor-23 dengan adanya klotho dapat mengaktifkan sinyal molekul, ditentukan oleh aktivasi atau fosforilasidari Fibroblast Growth FactorReseptor (FGFR) substrat-2a, ekstraseluler signalregulated kinase. Klotho juga meningkatkan reseptor Fibroblast Growth Factor-23 karena Fibroblast Growth Factor-23 memiliki afinitas yang lebih besar untuk kompleks klotho-Fibroblast Growth FactorReseptordibandingkan dengan Fibroblast Growth FactorReseptor saja (Goetz, 2007; Kurosu, 2006).
Fibroblast Growth Factor-23/ axis ginjal memiliki setidaknya dua fungsi fisiologis: 1) untuk memberikan sinyal phosphaturic yang berasal dari tulang untuk mengkoordinasikanfluks fosfat pada tulang karena perubahan pergantian tulang danmineralisasi dengan fosfat di ginjal 2)memberikan hormon counterregulatory untuk melindungi organismedari paparan vitamin D yang berlebihan dengan penekananFibroblast Growth Factor-23 dimediasi produksi 1,25 (OH)2 vitamin D dan peningkatan katabolisme oleh ginjal. Fibroblast Growth Factor-23memiliki fungsi lain untuk mengatur fosfat, fungsi kelenjar paratiroid.
Kalsifikasi vaskular diatur oleh proses yangmelibatkan interaksi antara molekul stimulator dan kalsifikasi inhibitor. Meskipun banyak molekul dan atau faktor yang diidentifikasi sebagai kalsifikasi stimulatortermasuk fosfat anorganik, kalsium,natrium fosfat co-transporter,
Runt-Related Transcription Factor 2 (Runx2), Tissue NonSpesific Alkaline Phosphase (TNAP), glukosa, asetat Low Density Lipoprotein(LDL), Tumor Necrosis Factor-α (TNF-α) dan bone morphogenetic protein-2 (El Abbadi dan Giachelli, 2007).
Mekanisme yang tepat untuk menginduksi kalsifikasi pembuluh darah daninteraksi dengan inhibitor kalsifikasi belumdipahami dengan jelas.Penelitian terbaru pada kalsifikasi vaskulardan terganggunya keseimbangan antara calcificationinhibiting dan faktor promoting dapat menyebabkan kalsifikasi ektopik. Beberapa faktor kunci yangterbukti secara langsung mengatur induksi dankalsifikasi vaskular, namun tidakterbatas pada faktor (misalnya fosfat, kalsium, pirofosfat dan hormon paratiroid) dan molekul matriks (misalnya Matriks GLA Protein (MGP) dan enzim katalis misalnyaTissue Non Spesific Alkaline Phosphase(TNAP). Fosfat dan kalsium serum penentu kalsifikasi vaskular dapat menyebabkan deposisi kalsium fosfat di dalam pembuluh darah dan jaringan lunak.Hiperfosfatemia pada pasien dialisis berkorelasi dengankalsifikasi vaskular, fosfat denganpengikat fosfat noncalcium berkorelasi dengan kalsifikasi vaskular (Raggi dan Ali, 2002).
Penelitian in vitro menunjukkan bahwa sel otot polosmengalami perubahan fenotipe ditandai dengandownregulation sel otot polos dan upregulation gen (Steitz, 2001). osteochondrogenic mirip dengan fosfor, keseimbangan kalsium positif terkait dengan kalsifikasi vaskular pada manusia secarain vitro. Kalsiummempromosikan mineralisasi dalam sel otot polos pembuluh darah dan mineralisasi kalsium yang disebabkan ekspresi cotransporters fosfat tergantung pada sodium(Yanget al, 2004).
Pirofosfat anorganik menghambat kalsifikasi vaskular denganmembatasi pembentukan hidroksiapatit dan propagasimelalui chelator seperti peran biofisik serta menstabilkanfenotip aorta, bertindak sebagai regulator (Towler DA,2005). Pirofosfat plasma berkurang pada pasien hemodialisis dan diperparah akibat pirofosfat clearance. Faktor lain Tissue Non Spesific Alkaline Phosphase (TNAP) dan enzim yang diproduksi dalam beberapa jaringan termasuk tulang, berfungsi sebagai fenotipe fungsionalpenanda osteoblas dan sering digunakan sebagai penanda molekuleruntuk kalsifikasi vaskular. Pirofosfat adalahsubstrat untuk Tissue Non Spesific Alkaline Phosphase dan fosfor adalah produk untukaktivitas katalitik dapat mengantisipasi Ekspresi Tissue Non Spesific Alkaline Phosphase bertindak sebagai prekursor untuk kalsifikasi vaskular hormon paratiroid. Sekresi yang tidak terkendali dari hormon paratiroiddapat melepaskan jumlah berlebihan kalsium daritulang, mengendap dalam pembuluh darah dan jaringan. Influenza B virus (BM2 protein) berperan dalam kalsifikasidengan mengerahkan efek osteogenik pada pembuluh darah. Selain itu, protein matriks, seperti Matrix Gla Protein (MGP) dapat menghambat kalsifikasi pembuluh darah. Korelasi positif antara ekspresi Matrix Gla Protein dan kalsifikasi pada arteri (Poole dan Reeve, 2005). Kalsifikasi vaskular histologis dibagi menjadi empatjenis utama: (1) Kalsifikasi intima aterosklerotik, (2)kalsifikasi arteri medial (Monckeberg sclerosis), (3)kalsifikasi katup jantung, (4) kalsifikasi arteri dibentuk calciphylaxis.
2.1.7 Albuminuria
Penyakit glomerular merupakan penyebab penting terjadinya Penyakit Ginjal Tahap Akhir yang menjalani dialisis. Kelainan urin asimptomatik berupa hematuria mikroskopik dan proteinuria merupakan tanda awal penyakit glomerular. Gejala klinik tersebut beresiko menimbulkan kerusakan glomerulus bermakna disertai hipertensi dan disfungsi ginjal progresif. Kelainan urin asimtomatik hematuri mikroskopik dan atau proteinuria merupakan tanda awal penyakit glomerular banyak di jumpai pada populasi umum (Feehally dan Johnson, 2003).
Derajat proteinuria diasosiasikan dengan penurunan ginjal progresif pada penyakit glomerular yang berkembang menuju Penyakit Ginjal Kronik. Proteinuria terjadi karena lintasan transglomerular abnormal akibat peningkatan permeabilitas dinding kapiler glomerulus dan gangguan reabsorbsi protein oleh sel epitel tubulus proksimal. Kerusakan dinding kapiler glomerulus berkorelasi dengan menurunnya sialoglycoprotein yang melapisi sel endotel, fusi dari foot processes podosit dan terangkatnya sel dari membran basal glomerulus (Glomerular Basment Membrane). Berkurangnya muatan negatif pada dinding kapiler menyebabkan albumin lolos dalam urin (Amico G dan Bazzi C, 2003).
Suatu studi baru menunjukkan bahwa adanya protein yang terbuang dalam urin dapat mengidentifikasi meningkatnya resiko penyakit reno kardio serebro vaskuler. Dari semua pasien yang memiliki peningkatan kadar protein urin, lebih dari setengahnya memulai dialisis atau melakukan transplantasi ginjal selama studi. Dari hasil penelitan tersebut para peneliti menyimpulkan bahwa pada individu dengan kadar proteinuria tinggi terjadi peningkatan resiko penurunan fungsi ginjal, akhirnya pasien memerlukan dialisis atau transplantasi ginjal. Semakin tinggi kadar protein urin, semakin tinggi resiko pasien memerlukan dialisis atau transplantasi ginjal dan semakin cepat penurunan fungsi ginjal (Gansevort, 2009).
Persisten mikroalbuminuria merupakan faktor resiko independen untuk berkembangnya penyakit kardiovaskular. Persisten mikroalbuminuria terbukti sebagai prediktor kematian akibat kardiovaskularpada orang normal, mikroalbuminuria ditemukan dengan prevalensi 7%. Sementara pada penderita hipertensi, diabetes, penyakit jantung koroner dan stroke prevalensi mikroalbuminuria berkisar antara 16-28% (Pedrinelli, 1994; Tabaei, 2005).
Gambar 2.7Renal Continum (Tabaei, 2005).
Albuminuria adalah fenomena yang ditunjukkan oleh adanya molekul albumin dalam urin. Penyebabnya karena adanya kerusakan pada alat filtrasi. Albuminuria merupakan kondisi patologis. Klasifikasi albuminuria seperti disajikan pada tabel 2.3 (Gendler SM, 1987).
Tabel 2.3 Klasifikasi Albuminuria(Gendler SM, 1987).
Kondisi Creatinin (µg/min) Time collect 24 hr collect
Normal < 30 < 20 < 30
Mikroalbuminuria 30 – 299 20 – 199 30 – 299
Makroalbuminuria ≥ 300 ≥ 200 ≥ 300
Albuminuria dibagi menjadi 5 jenis berdasarkan miligram protein yang ditemukan dalam tes urin 24 jam :
1. Microalbuminuria: 30-150 mg 2. Mild : 150-500 mg
3. Moderate : 500-1.000 mg 4. Heavy : 1.000-3.000 mg 5. Nephrotic :>3.500 mg
Proteinuria tak terdeteksi sering dijumpai pada stadium 1 Penyakit Ginjal Kronik dan beresiko berkembang menuju Penyakit Ginjal Kronik stadium 2, 3 dan 4 yang tidak terdeteksi dan akhirnya menjadi mencapai Penyakit Ginjal Tahap Akhir. Data dari survei Pernefri membuktikan dari 9400 individu yang diperiksa dengan tes celup urin di dapatkan proteinuria persisten sebesar 2,8% (Prodjosudjadi, 2009).
Di kenal tiga jenis proteinuria yaitu glomerular proteinuria, terjadi akibat kerusakan pada basal membran glomerulus sehingga terjadi peningkatan filtrasi glomerulus yang melebihi kemampuan tubulus untuk mereabsorbsi. Tubuler proteinuria, terjadi akibat tidak tereabsorbsinya Low Molecular Weight Protein seperti betamicroglobulin atau lyzozyme atau adanya defek pada tubulus proksimal sehingga tidak mampu mereabsorbsi protein filtrate glomerulus,sehingga tubuler proteinuria tidak pernah melebihi 2g/24 jam. Overflow proteinuria, terjadi bila kelebihan protein sistemik (Small Molekular Weight) diatas kemampuan tubulus untuk mereabsorbsinya (Suwitra, 2009).
Mekanisme terjadinya albuminuri pada prinsipnya ada dua, yaitu: 1. Masalah fisik. Pada keadaan ini kondisi sistem filtrasi berhubungan
dengan permeabilitas membran fitrasi (fenestra, kerusakan membran basalis, podosit, slit diafragma). Kondisi ini tergantung besarnya diameter fenestra dan kualitas slit diafragma. Pelebaran fenestra biasanya disebabkan karena rusaknya sistem autoregulasi pada spincter prekapiler vasa afferent akibat hipertensi yang kronis. Rusaknya autoregulasi ini membuat hipertensi sistemik langsung diteruskan pada kapiler glomerulus, sehingga menyebabkan permeabilitas meningkat yang akan mengakibatkan terjadinya pelebaran fenestra. Pelebaran fenestra ini akan
mempermudah keluarnya albumin, sehingga terjadi albuminuri. Hipertensi kronis meskipun tekanan sistolik hanya diatas 120 mmHg sudah menimbulkan stresor pada endotel. Endotel yang mendapatkan stresor ini akan mengekspresikan sitokin pro-inflamasi Tumor Necrosis Factor-α (TNF-), Interleukin-1 dan 6 (IL-1 dan IL-6), selain itu juga akan mengekspresikan Tumor Growth Factor β1 (TGF1). Sitokin-sitokin tersebut akan menyebabkan kerusakan pembuluh darah (aterosklerosis).
Bila terjadi peningkatan stres oksidatif akan meningkatkan jumlah apoptosis pada podosit atau slit diafragma sehingga akan menyebabkan kerusakan sistem filtrasi dan menyebabkan kebocoran sistem filtrasi akhirnya akan menyebabkan peningkatan albuminuria.
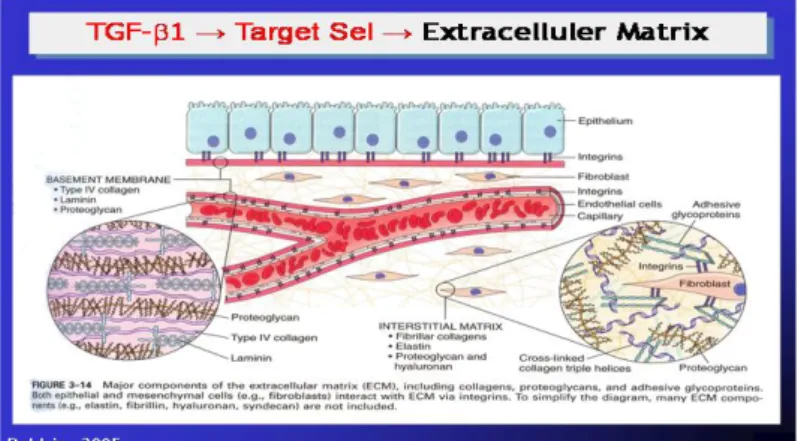
Gambar 2.9Adanya stresor terhadap sel tubulus proksimal akibat sel tubulus tersebut melakukan reabsorbsi albuminuri terus menerus. Dimana sel tubulus proksimal berubah fungsi seperti makrofag sehingga dapat mengekspresikan sitokin pro inflamasi maupun growht faktor (misalnya TGF1). TGF1 dapat menyebabkan remodeling sel otot polos pembuluh darah akibat terjadinya proliferasi sel otot polos pembuluh darah tersebut maupun pembentukan Extra Celluler Matrix (ECM) misalnya : kolagen, fibronektin, laminin, elastin, proteoglikan. Remodeling tersebutdiatas akan menyebabkan kerusakan pembuluh darah yang berakibat terjadinya aterosklerosis (Robbin, 2005).
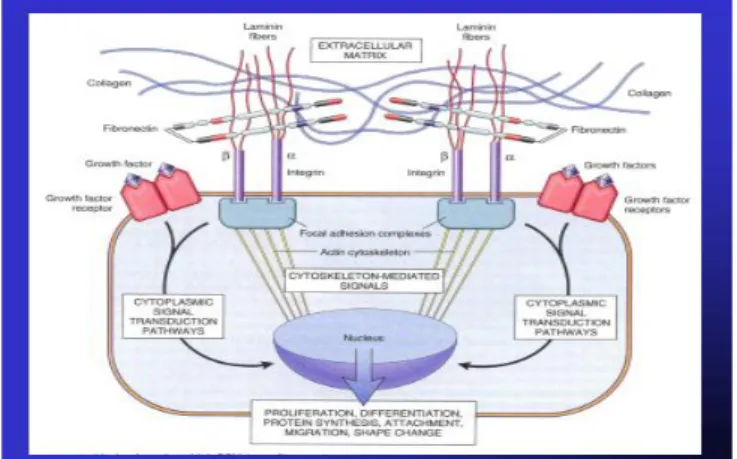
Gambar 2.10Proses growth faktor (TGF1) merangsang reseptor atau membran sel dan mengakibatkan Cystoplasmic Signal Transduction dan mengaktifkan nukleus (DNA & mRNA) sehingga terjadi reaksi transkripsi kemudian translokasi pembentukan protein ECM (kolagen, dll) juga proliferasi sel (Proliferation Differentation, Protein synthesis, Athachment, Migration, Shape Change) (Robbin, 2005). Tumor Growth Factor 1(TGF1) mempunyai reseptor pada target sel. Target sel pada glomerulus terutama sel mesangial yang dirangsang oleh Tumor Growth Factor 1 akan menghasilkan kolagen tipe-IV yang mengakibatkan glomerulosklerosis. Target sel yang lain misalnya fibroblast pada intertitial jaringan ginjal bila reseptornya terangsang oleh Tumor Growth Factor 1akan memproduksi kolagen tipe-I dan akhirnya menyebabkan intertitial fibrosis.Terjadinya disfungsi endotel pada pembuluh darah juga akan terjadi disfungsi endotel kapiler glomerulus yang akan mengurangi negatifitas sehingga terjadi albuminuria. Dengan kata lain,
adanya albuminuria maka besar kemungkinan telah terjadi juga disfungsi endotel pembuluh darah secara sistemik (Robbin, 2005).
Gambar 2.11 Pembentukan kolagen yang berlebihan akibat fibroblast yang dirangsang oleh Tumor Growth Factor 1 (TGF1) sehingga terjadi interstitial fibrosis (Robbin, 2005).
Gambar 2.12 Sistem filtrasi dan fenestra endotel kapiler glomerulus (Robbin, 2005).
Slit diafragma merupakan saringan untuk mencegah terjadinya albuminuri. Slit diafragma terutama terdiri dari protein nefrin. Angiotensin II akan merangsang Angiotensin I reseptor, Angiotensin I reseptor berfungsi untuk menghambat kerja dari enzim yang ada di podosit untuk memproduksi nefrin. Pemberian obat-obatan penghambat Agiotensin II (sartan), akan menghambat Angiotensin I reseptor akibatnya enzim tersebut akan memproduksi nefrin secara optimal. Akhirnya slit diafragma menjadi sempurna, hal tersebut akan mencegah terjadinya albuminuria.
Gambar 2.13 Struktur Fenestra (Robbin, 2005)
Gambar 2.14 Komponen slit diafragma (Robbin, 2005).
2. Masalah bioelektrik. Keadaan ini terjadi karena albumin bermuatan negatif, dilain pihak permukaan endotel, membrana basalis, lapisan luar dari podosit juga bermuatan negatif, sehingga keadaan tersebut menyebabkan terjadinya mekanisme tolakmenolak, akibatnya dapat dihindarinya albuminuri.Permukaan podosit banyak mengandung glikoprotein, glikoprotein inilah yang menyebabkan permukaan podosit bermuatan negatif. Bila terjadi peningkatan stres oksidatif akan merusak lapisan glikoprotein, sehingga muatan negatif (endotel) akan berkurang, tolak menolak dengan albumin berkurang, akibatnya albumin mudah keluar akhirnya terjadi mikroalbuminuria (Robbin, 2005; Purwanto B, 2010).
Membran basalis glomerulus menangkap protein besar (> 100 kDal) sementara foot processes dari epitel/ podosit akan memungkinkan lewatnya air dan zat terlarut kecil untuk transport melalui saluran yang sempit. Saluran ini ditutupi oleh anion glikoprotein yang kaya glutamate, aspartat dan asam silat yang bermuatan negatif pada pH fisiologis. Muatan negatif akan menghalangi transport molekul anion seperti albumin (Robbin, 2005; Purwanto B, 2010).
Reaksi inflamasi akibat infeksi, bahan-bahan kimiawi dan fragmentasi sel dapat menimbulkan aktivasi makrofag dimana Nuclear Factor kB(NfB) menjadi lebih aktif sehingga akan mengekspresikan sitokin-sitokin pro inflamasi antara lain Tumor Necrosis Factor-α(TNF-), Interleukin-1 atau Interleukin-6(IL-1,IL-6). Selain itu juga akan mengekspresikan Tumor Growth Factor β (TGF1). Tumor Necrosis Factor-αbersifat proteolitik, akan merusak glikoprotein sehingga muatan negatif permukaan podosit menjadi berkurang. Keadaan ini akan menyebabkan daya tolakmenolak antara podosit dan albumin berkurang, akhirnya albumin mudah menembus membran filtrasi dan akan terjadi albuminuria.
Gambar 2.15Bioelektrik membran basalis glomerulus (Robin, 2008; Purwanto B, 2010).
Membran filtrasi dipengaruhi oleh dua mekanisme yaitu (Robin, 2008; Purwanto B, 2010).
1. Fenestra, slit diafragma (terutama terdiri molekul nephrin).
2. Lapisan permukaan endotel, membrana basalis dan permukaan podosit mengandung glikoprotein bermuatan negatif karena albumin juga bermuatan negatif maka akan terjadi mekanisme tolak menolak sehingga mencegah albuminuria.
Gambar 2.16Skema membran filtrasi (Robin, 2008; Purwanto B, 2010).
Kerusakan ginjal juga dikaitkan dengan reabsorbsi protein pada sel epitel tubulus proksimal. Protein yang berlebih di dalam lumen tubulus menyebabkan kemampuan reabsorbsi sel tubulus terlampaui dan dapat menimbulkan kerusakan. Albumin melalui reseptor megalin dan cubilin yang terdapat pada sisi apikal sel tubulus mengalami endositosis dan degradasi oleh lisosom (Brunskill, 2001).
2.1.8 Hemodialisis
Hemodialisis merupakan salah satu terapi pengganti ginjal buatan dengan tujuan untuk mengeliminasi sisa-sisa produk metabolisme (protein) serta koreksi gangguan keseimbangan cairan dan elektrolit antara
kompartemen darah dan cairan dialisis melalui selaput membran semipermiabel yang berperan sebagai ginjal buatan (Cohen, 2007).
Hemodialisis pada umumnya sudah dilakukan pada pasien Penyakit Ginjal Kronik dengan bersihan kreatinin <10 ml/menit (<15 ml/menit pada pasien dengan nefropati diabetes) atau bila kadar kreatinin serum mencapai 8-10 mg/dL (Ross dan Caruso, 2005). Sebagian besar pasienPenyakit Ginjal Kronikdalam satu minggu membutuhkan hemodialisis antara 9-12 jam dibagi dalam 3 sesi yang sama (Sculman dan Himmelfarb, 2004; Singh dan Brenner, 2006).
Selama proses hemodialisis beberapa zat terlarut seperti albumin, fibrin, β2-mikroglobulin, komponen aktif komplemen, dan sitokin Interleukin-1(IL-1) dan Tumor Necrosis Factor-α (TNF-α) mengalami absorbsi kedalam membran dialiser dan sebagian dari zat tersebut akan dieliminasi dari darah (Tzanatoset al, 2000; Malaponte, 2002).
Hemodialisis mempunyai beberapa efek antara lainbioinkompatibilitas serta reaksi antara cairan dialisis terkontaminasi bakteri yang akan menghasilkan endotoksin (lipopolisakarida) dan berakibat pada terlepasnya sitokin (Boure dan Vanholder, 2004; Erten dan Bali M,2007). Proses ini tidak terlalu kuat bila menggunakan membran dialisis sintetik atau membran selulosa yang telah dimodifikasi. Beberapa membran sintetik mempunyai ukuran pori-pori besar yang akan memudahkan aliran air dan meningkatkan kekuatan ultrafiltrasi sehingga dapat memindahkan zat–zat dengan molekul besar seperti solute uremia dibandingkan dengan membran dengan ukuran pori-pori kecil (Boure dan Vanholder, 2004).
Kaskade aktivasi imunitas humoral dan seluler setelah kontak antara darah dan membran dialisis. Faktor komplemen yang teraktivasi seperti C3a dan C5a meningkat selama hemodialisis dan mencapai kadar maksimal 15-30 menit setelah inisiasi sesi hemodialisa, menyebabkan aktivasi leukosit, produksi dan pelepasan sitokin serta produksi ROS (Reactive Oxygen Species) yang berlebihan (Schindler, 2004). Terdapat
perbedaan besar antara membran dialisa dalam kapasitasnya untuk mengaktivasi sistem komplemen dengan cuprophan dan selulosa tanpa modifikasi lainnya dianggap paling bioinkompatibel.Sebaliknya membran sintetis yang terbuat dari polimer artifisial lebih sedikit mengaktifkan komplemen (Jacobs, 2004; Kerret al, 2007).
2.1.9 Vitamin D
Vitamin D berbentuk kristal putih, tidak larut dalam air tetapi larut dalam minyak dan zat pelarut lemak. Vitamin D tahan terhadap panas dan oksidasi. Penyinaran ultraviolet menimbulkan aktivitas vitamin D tetapi bila terlalu kuat dan lama akan terjadi pengrusakan zat-zat aktif tersebut (Norman, 2008).
Dalam kondisi normal manusia memperolehvitamin D baik dari makanan atau dari sintesis de novodi kulit akibat paparan langsung sinar matahari. Vitamin D3 awalnya dihidroksilasidalam hati oleh 25-hidroksilase untuk membentuk25-hydroxyvitamin D3 dengan hidroksilasi berikutnyadi ginjal untuk membentuk metabolit aktif1,25 dihydroxyvitamin D atau 1,25(OH)2Djuga dikenal sebagaicalcitriol, yang akhirnya dimetabolisme oleh25-hydroxyvitamin D-24-hidroksilase (24OHase). Pengikatan 1,25-dihydroxyvitamin D3 atau yang analog dengan reseptor vitamin D (VDR), mengaktifkanreseptor vitamin D(VDR) dan sebagai kofaktor seperti reseptor X retinoid (RXR), sehingga pembentukan VDR-RXRkofaktor kompleks yang mengikatelemen respon vitamin D (VDRE) pada gen target untuk mengatur transkripsi gen (Carlberg et al, 2001).
Beberapa jaringan memiliki 25-hydroxyvitamin D 1α-hidroksilase yang dapat mengkonversi 25-hydroxyvitaminD untuk 1,25 dihydroxyvitamin D (Zehnder, 2001).Namun pada serum 1,25 dihidroksivitamin Datau Calcitriol diatur oleh ginjal menjadi 25-hydroxyvitamin D 1α-hidroksilase. Dalam studi baru-baru ini evaluasi penyakit ginjal tahap awal, defisiensi calcitriol (didefinisikan bila kadar
vitamin D serum <22 pg/ ml) ditemukan pada 32% Chronic Kidney Disease stg 3 dan>60 % pada Chronic Kidney Disease stg 4dan 5 pasien pra-dialisis (Levin, 2005).
VDR ditemukan lebih dari 30 jaringan termasuk usus,tulang, ginjal, kelenjar paratiroid, b-sel pankreas,monosit, T-sel, keratinosit dan sel kanker, menunjukkan bahwa vitamin Dterlibat dalam mengatursistem kekebalan tubuh, pertumbuhan sel, diferensiasi danapoptosis (Feldman, 2005).
Vitamin D merupakan salah satu dari hormon steroid dan terdapat secara alami dalam berbagai macam makanan. Sejumlah makanan yang telah difortifikasi dan juga sinar matahari yang memproduksi vitamin D di kulit, merupakan prohormon yang akan mengalami 2 tahap hidroksilasi untuk menghasilkan bentuk hormon yang aktif. Hidroksilasi pertama terjadi di hati menghasilkan 25(OH)D3 dan hidroksilasi tahap dua terjadi di ginjal dengan bantuan enzim 1-hydroxylase yang menghasilkan bentuk aktif 1,25(OH)2D (Jia dan Zhang, 2013).
Gambar 2.17Sintesis, aktivasi dan katabolisme vitamin D3 (Dusso,2005).
Hidroksilasi tahap kedua ini terutama terjadi di ginjal, tetapi juga terdapat tipe sel-sel yang lain yang juga berkontribusi terhadap proses ini seperti prostat, payudara, kolon, paru, sel β pankreas, monosit dan sel
paratiroid. Tetapi bagaimanapun juga proses ekstrarenal yang memproduksi 1,25(OH)2D atau Calcitriol tersebut hanya berefek secara autokrin atau parakrin terhadap sel spesifik, sedangkan yang dihasilkan intrarenal akan berefek secara endokrin sebagaimana gambar 2.18 (Dusso,2005).
Gambar 2.18Produksi 1,25(OH)2D3 dari renal dan ekstrarenal yang berefek autokrin, parakrin dan endokrin (Dusso et al, 2005).
Sistem endokrin dari vitamin D memainkan peranan esensial dalam homeostasis kalsium dan metabolisme tulang, tetapi berbagai penelitian selama ±2 dekade menyatakan bahwa terdapat bermacam-macam aksi biologi dari vitamin D yang meliputi induksi terhadap deferensiasi sel, penghambatan pertumbuhan sel, imunomodulasi dan kontrol terhadap sistem hormon yang lain (Dusso, 2005).
Vitamin D memiliki fungsi klasik (calcemic function) dan non klasik (noncalcemic function). Fungsi klasik yaitu fungsi vitamin D dalam hal absorbsi kalsium, pembentukan tulang. Sedangkan fungsi non klasik adalah fungsinya dalam imunoregulator (Williams, 2009).
Tabel 2.4Efek langsung terapi vitamin D (Tang, 2009)
Terdapat 2 grup vitamin D yang tersedia di pasaran. Yang pertama antara lain ergocalciferol (viatamin D2) dan analognya, doxercalciferol dan paricalcitol. Grup kedua meliputi cholecalciferol (vitamin D3) dan analognya, calcidiol, alfacalcidiol dan calcitriol atau 1,25(OH)2D3 (Tang, 2009).
2..1.9.1 Vitamin D pada Penyakit Ginjal Kronis
Sasaran terapi vitamin D pada Chronic Kidney Disease melibatkan peradangan ginjal (sepertisel T dan sel-sel kekebalan lainnya), Renin angiotensin Sistem(RAS) danglomerular (sel mesangial dan podosit) dan fibrosis tubolointerstitial(sel epitel tubular dan interstitialfibroblas) sebagaimana terdapat pada gambar 2.19
Gambar 2.19 Patofisiologi vitamin D terhadap fibrosis ginjal pada Chronic Kidney Disease. Vitamin D aktif terbukti menghambat beberapa jalur patogen dalam fibrosis ginjal. Vitamin D aktif (1) memiliki efek anti inflamasi(2) menghambat proliferasi mesangial dan podosit (3) mengatur renin angiotensin system (RAS) dengan menghambat produksi renin (4) mencegah hipertrofi glomerulus yang diukur berdasarkan volume glomerulus (5) proteinuria menurun pada model binatang denganChronic Kidney Disease(6) menurunkan produksi sitokin fibrogenic di ginjal dengan mengatur Smad3 dan Tumor Growth Factor β (TGF-β) (7) memblokir Epitelial to Mesenchymal Transition(EMT) dan aktivasi myofibroblast. RAS (renin angiotensin sistem); PGC (pressure glomerularcapillary); SNGFR (single nefron glomerular filtration rate); α-SMA (α-smooth muscle actin); EMT (epitelial to mesenchymal transition).
Vitamin D dan hormon paratiroid (PTH) mempunyai hubungan yang sangat erat. Hormon Paratiroidmerupakan regulator utama dari aktivitas 1-hidroksilase, mempengaruhi sintesa vitamin D dan vitamin D sendiri juga sangat kuat dan efektif sebagai modulator terhadapHormon Paratiroid. Terapi dengan vitamin D akan mengurangi kadar serum Hormon Paratiroid melalui pencegahan hiperplasia glandula paratiroid, peningkatan calcium sensing receptor expression pada glandula paratiroid dan meningkatkan kadar serum kalsium. Kadar vitamin D mulai menurun pada Penyakit Ginjal Kronik stadium 2, sebaliknya kadarHormon Paratiroidsecara signifikan akan meningkat dan semakin tinggi pada Penyakit Ginjal Kronik stadium 4-5. Pada
penelitian cross sectional skala besar didapatkan kadar Hormon Paratiroid mencapai 800-900 pg/ml pada Penyakit Ginjal Kronik stadium akhir yang tidak mendapat terapi dan meskipun etiologinya multifaktorial tetapi penyebab utamanya adalah karena rendahnya kadar vitamin D, hiperfosfatemia dan hipokalsemia. Efek klinis dari tingginya kadar Hormon Paratiroid dan rendahnya kadar vitamin D sangat sulit dibedakan, karena keduanya terjadi secara bersamaan mulai padaPenyakit ginjal Kronik satdium 2-5. Tingginya kadar Hormon Paratiroid sangat berhubungan dengan penyakit kardiovaskuler (Tang, 2009).
Penurunan fungsi ginjal pada Penyakit Ginjal Kronik akan disertai dengan penurunan produksi 1,25-dihydroxyvitamin Datau Calcitrioldimulai pada Penyakit Ginjal Kronik stadium 2 yang secara progresif bertambah rendah dengan bertambahnya stadium penyakit. Rendahnya kadar 1,25dihydroxyvitamin D tersebut akan menyebabkan beberapa efek samping pada pasien Penyakit Ginjal Kronik, meliputi gangguan pada homeostasis mineral tulang dan hormon parathiroid, kalsifikasi ekstraskeletal dan terganggunya fungsi biologi multiorgan (Moscovici dan Sprague, 2007).
Vitamin D juga mencegah nefrosklerosis dan memperlambat progresivitas Penyakit Ginjal Kronik melalui efek anti inflamasi dan anti proliferatifnya. Pada pasien Penyakit Ginjal Kronik stadium 3-5, terapi dengan calcitriol dihubungkan dengan tren ke depan dapat memperlambat kebutuhan inisiasi dialisis. (Schwarz, 1998)
Gambar2.20Konsep model alur defisiensi vitamin D sampai menyebabkan progresivitas Penyakit Ginjal Kronik dan komplikasinya (Williams et al, 2009)
2.1.9.2 Pemberian Suplementasi Vitamin D pada Penyakit Ginjal Kronik
Penurunan fungsi dan massa renal pada Penyakit Ginjal Kronik akan menyebabkan kemampuan memproduksi 1,25(OH)2D3 atau Calcitriol menurun, sehingga untuk memenuhi kekurangan tersebut maka perlu pemberian calcitriol atau analognya. Pada Penyakit Ginjal Kronik suplementasi dengan 25(OH) vitamin D direkomendasikan pada permulaan penyakit dan pemberian calcitriol mulai diberikan mulai Penyakit Ginjal Kronik stadium 3. Data terbaru fokus pada efek non klasik dari vitamin D sehingga dilakukan revisi terhadap rekomendasi terbaru untuk kebutuhan harian antara orang normal dengan pasien Penyakit Ginjal Kronik (Jones, 2007). Penelitian baru menyarankan dosis 4000 IU/hari untuk pemeliharaan kadar optimum vitamin D pada populasi normal dan dosis lebih tinggi diperlukan pada pasien Penyakit Ginjal Kronikuntuk memenuhi kebutuhannya. Diperkirakan tiap 100 IU vitamin D dapat meningkatkan kadar serum vitamin D ±1ng/ml (2,5 nmol/L) meskipun terdapat variasi individu dalam merespon dosis tersebut. Toksisitas jarang menjadi problem yang signifikan pada pemberian viatmin D karena batas keamanannya cukup luas antara dosis yang direkomendasikan dengan dosis yang dianggap tidak aman (Heaney, 2008).
Kadar serum 25(OH)D digunakan untuk menilai status vitamin D dalam tubuh. Dikatakan defisiensi vitamin D jika kadar serum 25(OH)D<20 ng/ml, insuffisiensi vitamin D jika kadarnya <30ng/ml. Target pemberian vitamin D untuk mencapai kadar serum 25(OH) paling tidak 30 ng/ ml atau dalam rentang normal 40-80ng/ml, dikatakan toksik jika mencapai >150 ng/ml. Gejala dari hipervitaminosis D meliputi fatig,
mual, muntah dan kelemahan. Vitamin D yang berasal dari sinar matahari tidak dapat menyebabkan toksisitas (Kulie et al, 2009; Querfeld dan Mak, 2010). Resiko terjadinya hiperkalsemia dan hiperfosfatemia merupakan salah satu efek samping yang dikhawatirkan pada terapi vitamin D pada Penyakit Ginjal Kronik tetapi pada penelitian meta analisis yang dilakukan Praveen et al, 2011 menyebutkan bahwa pemberian vitamin D menurunkan kadar Hormon Paratiroid dan tidak didapatkan peningkatan yang signifikan pada kadar serum kalsium dan fosfat. Pada penelitian cohort eksperimental yang dilakukan oleh Jean G et al, 2008 menyatakan bahwa dengan pemberian preparat 25(OH)D3 per oral dengan dosis 10-30 µg/hari pada pasien Penyakit ginjal Kronik yang menjalani hemodialisis dapat memperbaiki keadaan defisiensi atau insufisiensi vitamin D pada pasien tersebut tanpa adanya efek toksisitas.
2.2 Penelitian yang Relevan
Penelitian terdahulu menyebutkan bahwa pemberian 1,25 Dihydroxyvitamin D (Calcitriol) pada pasien Penyakit Ginjal Kronik yang menjalani hemodialisis dapat menurunkan kadar Fibroblast Growth Factor-23 (FGF-Factor-23) serta menurunkan albuminuria (Sung JY et al, 2013).
Pada penelitian terdahulu menyebutkan bahwa rendahnya kadar 1,25 Dihydroxyvitamin D (Calcitriol)berhubungan dengan beberapa marker inflamasi seperti FGF-23 dan albuminuria serta marker stres oksidatif yang lain. Pada penelitian terdahulu menyebutkan bahwa pemberian pericalcitriol pada pasien Penyakit Ginjal Kronik dapat menurunkan albuminuria sehingga dapat menurunkan kalsifikasi vaskuler yang akhirnya mengurangi progresifitas penurunan fungsi ginjal (Alborzi P et al, 2008).
BAB 3
KERANGKA BERPIKIR 3.1. Kerangka berpikir
Gambar 3.1 Kerangka Berpikir Nephrin
Angiotensin 2 Angiotensin 1
Renin Apparatus Juncta Glomerulus
Iskemia Garam Ca Fosfat Aterosklerosis Renal Demineralisasi Tulang Osteoklas Fosfat PTH Ca Angiotensin 1 Reseptor Enzim Peroksidase Slid Diafragma Albuminuria
Penyakit Ginjal Kronik Stg V
Suplementasi Calcitriol Klotho Glikoprotein ROS NADPH Oxidase FGF-23 Fibroblast Extracellular Matrix Kolagen
Fibrosis Interstitial Ginjal Sel Tubulus Distal Ekskresi Fosfat
Keterangan :
: Mengaktivasi : Menghambat : Meningkatkan : Menurunkan
: Variabel yang diperiksa : Perlakuan yang diberikan
Ca : Calcium
FGF-23 : Fibroblast Growth Factor-23
NADPH Oxidase : Nicotinamide Adenine Dinucleotide Phosphaate Oxidase PTH : Paratiroid Hormon
ROS : Reactive Oxygen Species
Keterangan Bagan Kerangka Konsep
Gagal ginjal adalah suatu keadaan klinis yang ditandai dengan penurunan fungsi ginjal yang irreversibel, pada suatu derajat memerlukan terapi pengganti ginjal yang tetap, berupa dialisis atau transplantasi ginjal (Suwitra, 2014). Terdapat peningkatan stres oksidatif dan inflamasi kronis pada pasien Penyakit Ginjal Kronik dan dialisis (Nanayakkara dan Gaillard, 2010).
Penurunan fungsi ginjal pada Penyakit Ginjal Kronik akan disertai dengan penurunan produksi 1,25 dihydroxyvitamin D, dimulai pada Penyakit Ginjal Kronik stadium 2 yang secara progresif bertambah rendah dengan bertambahnya stadium penyakit. Rendahnya kadar 1,25 dihydroxyvitamin D tersebut akan menyebabkan beberapa efek samping pada pasien Penyakit Ginjal Kronik, meliputi gangguan pada homeostasis mineral tulang dan hormon paratiroid, kalsifikasi ekstraskeletal dan terganggunya fungsi biologi multiorgan (Moscovici dan Sprague, 2007). Fungsi non klasik dari vitamin D adalah sebagai imunoregulator (Williams, 2009). Dan peran vitamin D disini sebagai anti inflamasi dengan melalui penekanan/ supresi pada jalur Nuclear Factor kB (NF-ĸB), dimana jalur NF-ĸB ini sangat berperan penting dalam progresivitas
penyakit ginjal, karena jalur tersebut akan memicu inflamasi dan fibrogenesis melalui pelepasan sitokin pro inflamasi (Lang, 2014).
Albuminuria sangat penting sebagai marker disfungsi endotel pada seluruh pembuluh darah baik pada ginjal, jantung koroner dan serebral. Albuminuria sebagai prognosis infark miokard. Kenaikan albuminuri (mulai dari mikroalbuminuri) akan terjadi meningkatnya resiko renokardios erebral vaskuler. Derajat proteinuria diasosiasikan dengan penuruanan ginjal progresif pada penyakit glomerular, sering dijumpai pada Penyakit Ginjal Kronik stadium 1 dan beresiko berkembang menuju Penyakit Ginjal Kronik stadium 2,3,4 dan akhirnya mencapai Penyakit Ginjal Tahap Akhir. Proteinuria terjadi karena lintasan transglomerular abnormal akibat peningkatan permeabilitas dinding kapiler glomerulus dan gangguan reabsorbsi protein oleh sel epitel tubulus proksimal. Berkurangnya muatan negatif pada dinding kapiler menyebabkan albumin lolos dalam urin (Amico dan Bazzi, 2003).
Para peneliti menyimpulkan bahwa kadar proteinuria tinggi, terjadi peningkatan resiko penurunan fungsi ginjal, akhirnya pasien memerlukan dialisis atau transplantasi ginjal (Gansevort, 2009). Mikroalbuminuria ditemukan dengan prevalensi 7%. Sementara pada penderita hipertensi, diabetes, penyakit jantung koroner dan stroke prevalensi mikroalbuminuria berkisar antara 16-28% (Pedrinelli, 1994; Tabaei, 2005).
Penurunan fungsi ginjal pada Penyakit Ginjal Kronik akan disertai dengan penurunan produksi 1,25 dihydroxyvitamin D, dimulai pada Penyakit Ginjal Kronik stadium 2 yang secara progresif bertambah rendah dengan bertambahnya stadium penyakit. Rendahnya kadar 1,25 dihydroxyvitamin D tersebut akan menyebabkan beberapa efek samping pada pasienPenyakit Ginjal Kronik, meliputi gangguan pada homeostasis mineral tulang dan hormon parathiroid, kalsifikasi ekstraskeletal dan terganggunya fungsi biologi multiorgan (Moscovici dan Sprague, 2007).
3.2 Hipotesis Penelitian
1. Ada pengaruh pemberian 1,25 Dihydroxyvitamin D (Calcitriol) dapat menurunkan kadar Fibroblast Growth Factor-23 pada pasien Penyakit Ginjal Kronik stadium V yang menjalani hemodialisis
2. Ada pengaruh pemberian 1,25 Dihydroxyvitamin D (Calcitriol) dapat menurunkan Albuminuria pada pasien Penyakit Ginjal Kronik stadium V yang menjalani hemodialisis