TNJAUAN PUSTAKA
Kelapa Sawit
Kelapa sawit berasal dari daerah yang terletak di antara Guinea dan Angola di Afrika Barat. Tanaman kelapa sawit diintroduksi ke Indonesia pada Tahun 1848. Sebanyak empat bibit kelapa sawit ditanam di Kebun Raya Bogor.
Dari keempat bibit tersebut, dua bibit ditanam oleh Bourbon atau Mauritius pada Februari 1848 dan dua bibit yang lain diperoleh dari Amsterdam pada Maret 1848
(Pamin, 1998). Saat ini, kelapa sawit sudah berkembang pesat, khususnya di Indonesia dan Malaysia. Secara bersamaan, saat ini Indonesia dan Malaysia menguasai lebih dari 95% produksi kelapa sawit di dunia (Bakar, 2003).
Tanaman kelapa sawit termasuk dalam famili Arecaceae, subfamili
Cocoideae, tribe Cocoineae, dan genus Elaeis. Genus Elaeis terdiri dari dua
sepesies yaitu E. guineensis yang dikenal sebagai kelapa sawit dari Afrika dan E.
oleifera Cortez yang dikenal juga dengan kelapa sawit asal Amerika Latin. Kelapa sawit merupakan tanaman monokotil menyerbuk silang dengan genom
diploid mempunyai 16 pasang kromosom (2n = 2x = 32). Ukuran genom sawit yang diestimasi berdasarkan teknik flow cytometry adalah sebesar 3,79 pico
gram/2C setara dengan sekitar 1,8 x 109 pasang basa (Rival et al.1997).
Nama Elaeis guineensis diberikan oleh Jacquin pada tahun 1763 berdasarkan pengamatan pohon–pohon kelapa sawit yang tumbuh di Martinique,
kawasan Hindia Barat, Amerika Tengah. Kata Elaeis (Yunani) berarti minyak, sedangkan kata Guineensis dipilih berdasarkan keyakinan Jacquin bahwa kelapa
Tanaman kelapa sawit tumbuh tegak lurus dan dapat mencapai ketinggian
pohon sampai 20 m. Bagian tanaman yang perlu diketahui adalah akar, batang, daun, bunga, buah dan biji serta perkecambahan. Akar yang pertama muncul dari biji yang telah berkecambah adalah radikula yang panjangnya 15 cm. Selanjutnya
akan keluar akar primer yang keluar dari bagian bawah batang dengan arah 45º dari permukaan akar. Dari akar primer ini akan tumbuh akar sekunder dengan
arah horizontal. Dari akar sekunder tumbuh akar tertier dan kwarter yang berada dekat dengan permukaan tanah. Akar tertier dan akar kuarter adalah akar yang paling aktif dalam mengambil air dan hara. Penyebaran akar sangat dipengaruhi
oleh kondisi tanah. Sebagian besar akar cenderung berkembang ke bagian dalam tanah (positif geotropism) (Soehardjo, 1999).
Batang kelapa sawit tumbuh tegak (phototropi) dibalut pangkal pelepah daun. Batang berbentuk silinderis dan mempunyai diameter 45 cm-60 cm pada tanaman dewasa. Bagian bawah umumnya lebih besar dan mempunyai diameter
45 cm - 60 cm pada tanaman dewasa. Bagian bawah umumnya lebih besar yang disebut dengan bongkol batang. Bagian dalam batang merupakan serabut, yang
dilengkapi jaringan pembuluh sebagai penguat batang dan untuk menyalurkan hara (Soehardjo, 1999).
Daun pertama yang keluar dari stadia bibit berbentuk lanceolate,
kemudian muncul bifurcate dan selanjutnya bentuk pinnate. Pada bibit berumur 5 bulan misalnya akan dijumpai 5 lanceolate 4 bifurcate dan 3 pinnate. Pada bibit
(lidi). Panjang pelepah daun bervariasi dengan rataan pada tanaman dewasa bisa
mencapai sembilan meter. Pelepah daun pada batang menurut spiral, ada yang ke
arah kiri (bagian atas kiri ke kanan bawah) dan umumnya ke arah kanan (bagian atas kanan ke kiri bawah). Letak susunan daun ini disebut phyllotaxis
(Soehardjo, 1999).
Tanaman kelapa sawit setelah ditanam di lapangan mulai berbunga pada
umur 12-14 bulan tergantung dari varietas dan tipe umur bibit yang ditanam serta kondisi lingkungan. Pada satu pohon kelapa sawit, dari setiap ketiak pelepah daun akan keluar tandan bunga jantan atau bunga betina. Pada tanaman muda
terutama pada saat tanaman mulai berbunga sering dijumpai bunga banci (hermaprodit). Pada bunga ini dalam satu tandan dijumpai bunga jantan dan
bunga betina.Selain itu juga dapat dijumpai bunga andromorpic (androgynous) yaitu bunga yang secara morfologi adalah bunga jantan tapi sebagian spikeletnya dijumpai bunga betina yang dapat membentuk buah sawit kecil (Soehardjo, 1999).
Tandan bunga jantan dibungkus oleh seludang bunga dan akan pecah jika akan anthesis. Tandan bunga yang sedang anthesis akan berbau khas. Setiap
tandan bunga jantan, sesuai dengan umurnya dapat menghasilkan tepung sari sebanyak 25-60 gram dan jumlah ini dihasilkan dalam waktu 2-3 hari. Setelah anthesis selesai seluruh tandan bunga akan berwarna agak abu-abu dan ditumbuhi
cendawan. Tandan bunga betina dibungkus oleh seludang bunga yang akan pecah 15-30 hari sebelum anthesis. Satu tandan bunga betina akan anthesis secara
gading, hari ketiga berwarna jingga, dan hari keempat berwarna merah kehitaman.
Selama bunga anthesis, bunga berbau harum dan mengeluarkan lendir untuk menarik serangga (Soehardjo, 1999).
Buah akan matang 5-6 bulan setelah penyerbukan. Buah tersusun pada
spikelet dan karena kondisi terjepit maka buah yang terletak dibagian dalam akan lebih kecil dan kurang sempurna bentuknya dibandingkan buah yang terletak di
bagian luar. Kematangan buah khusunya yang digunakan sebagai kriteria matang panen di perkebunan lepasnya buah secara alami atau biasa disebut membrondol. Buah yang telah lepas disebut dengan brondolan (Soehardjo, 1999).
Fingerprinting
Sebagaimana diketahui bahwa di dalam lokus terdapat alel yang memuat DNA dalam jumlah yang bervariasi dan berbeda antara satu individu dengan
individu lainnya. Hal ini dikenal dengan sebutan DNA polymorphisme yang dapat dideteksi dengan PCR. Untuk mendeteksi DNA tersebut dikenal dengan nama DNA fingerprinting atau “DNA profilling” atau “DNA typing”. DNA
fingerprinting bekerja dengan cara mendeteksi pola pita yang terbentuk dari hasil PCR (Bathusha, 2013).
Fingerprinting diperkenalkan pertama kali oleh Jeffery pada tahun 1985 untuk menggambarkan barcode fragment DNA yang terdiri dari multilocus setelah elektoforesis genomik fragmen DNA. Kemunculan pola dari fragment
DNA tersebut memperlihatkan pola yang unik. Selanjutnya, DNA fingerprinting
digunakan adalah mikrosatelit untuk mendeteksi kultivar, membedakan genotipe
yang hampir mirip seperti padi dan gandum (ICAR, 2007).
DNA fingerprinting adalah teknik untuk mengidentifikasi seseorang berdasarkan pada profil DNA-nya. Ada dua aspek DNA yang digunakan dalam
DNA fingerprinting yaitu di dalam satu individu terdapat DNA yang seragam dan variasi genetik terdapat diantara individu. Prosedur DNA fingerprinting memiliki
kesamaan dengan mencocokkan sidik jari seseorang dengan orang lain. Hanya saja perbedaannya adalah prosesnya tidak menggunakan sidik jari, tetapi menggunakan DNA individu karena secara individu DNA seseorang itu unik
(Abaii, 2014).
Penggunaan fingerprinting dalam marka DNA adalah untuk
mengidentifikasi karakter-karakter spesifik pada tanaman yang diuji. Identifikasi pita-pita spesifik tersebut akan sangat bermanfaat dalam identifikasi karakter tertentu yang terdapat pada tanaman yang diuji (Istino et al. 2012). Selanjutnya,
berdasarkan hasil penelitian Istinoet al. (2012) terhadap tanaman gambir menunjukkan bahwa terjadinya polimorfisme antara gambir katekin tinggi dengan
katekin rendah menggunakan penanda RAPD disebabkan oleh kemampuan sekuen primer acak tersebut menghasilkan produk sesuai dengan binding site yang kompatibel dengan DNA templet pada katekin tinggi, serta adanya sekuen tertentu
yang keberadaannya dapat digunakan sebagai penciri kadar katekin pada gambir. Marka DNA dapat digunakan untuk mengidentifikasi sidik jari genetik,
dapat dilakukan dengan berbagai metode, bergantung pada tujuan dan kemudahan
dalam menginterpretasikan data. Metode yang sering digunakan untuk tujuan sidik jari genetik seperti marka berbasis PCR (Makful et al. 2010).
Pembentukan fingerprinting melalui penggunaan marka mikrosatelit akan
membentuk suatu pola motif tertentu. Pada penelitian yang telah dilakukan oleh Nyoman et al. (2008) melalui penanda molekul DNA mikrosatelit untuk
karakterisasi bibit jamur kuping telah menghasilkan 18 motif mikrosatelit. Namun, untuk karakterisasi bibit jamur kuping dipilih yang jumlah pengulangan motifnya lebih dari 3 kali dan kemunculan motif tersebut cukup sering untuk
beberapa klon. Kriteria motif DNA mikrosatelit seperti yang telah dipaparkan oleh Weber (1990) terdiri dari 4 motif, yakni sempurna; tidak sempurna; campuran
sempurna dan campuran tidak sempurna.
Penanda genetik hanya berguna apabila polimorfik dan terpaut dengan sifat yang akan diamati atau dengan penanda genetik lain. Syarat polimorfik
diperlukan karena penanda genetik harus bisa membedakan individu-individu dalam populasi yang diteliti. Suatu penanda genetik paling tidak harus bisa
mengelompokkan individu dalam dua kelompok. Syarat terpaut dengan penanda, gen atau sifat lain diperlukan karena fungsi penanda genetik adalah sebagai tanda pengenal yang harus melekat pada sifat yang diteliti (Sharma et al. 2008).
Polymerase Chain Reaction (PCR)
PCR adalah teknik biologi molekuler yang melakukan proses replikasi pada DNA dengan kuantitas yang kecil biasanya sampai 10 kb. Teknik ini
terus mengalami pengembangan danpada Tahun 1993 Kary Mullis memperoleh
penghargaan Nobel atas penemuannya tersebut. Akan tetapi, prosedur standar
PCR pertama kali dideskripsikan oleh Kleppe pada Tahun 1968 (Semagn et al. 2006).
PCR adalah proses amplifikasi enzim pada fragmen DNA. Penemuan PCR tersebut memungkinkan peneliti untuk membuat jutaan copy DNA baru dengan
hanya menggunakan satu copy DNA. Cara kerja mendasar dari teknik PCR yaitu
dengan menggunakan enzim untuk mengamplifikasi fragmen DNA dengan cara melipatgandakannya dengan menggunakan primer oligonukleutida
(Acquaah, 2007).
Aplikasi dari PCR telah banyak digunakan secara luas, diantaranya untuk
digunakan dalam menggandakan DNA spesifik, untuk menggandakan gen spesifik, kegunaan lain dari teknik PCR adalah berperan proses forensik, dan juga digunakan untuk penapisan sumberdaya genetik (Nicholl, 2002).
Salah satu alasan dari kelebihan teknik PCR ini adalah dapat menggunakan berbagai jenis primer, tergantung dari tujuan studi yang sedang
dilakukan.Sebagai contoh banyak bagian dari sekuen DNA yang menarik seperti primer-primer spesifik. Primer spesifik tersebut sebagai strategi untuk memilih dari gen yang diisolasi atau ditransfer ke suatu organisme. Dari sisi lainnya
adalah penggunaan primer acak yang dapat digunakan untuk mengontruksi
anonimus genomik DNA sekuen, primer acak digunakan pada proses
Spesifik, semi-spesifik dan primer acak dapat digunakan pada berbagai variasi
(Weising et al. 2005).
Metode PCR sangat efisien digunakan untuk menggandakan molekul DNA.Selain itu, DNA yang dibutuhkan tidak perlu murni, karena hanya yang
sesuai dengan primer yang disiapkan untuk digandakan. Secara umum bahwa proses PCR terdiri atas proses denaturasi, anneling, dan ekstension, ketiga
langkah ini terus berulang dan setiap siklus membutuhkan waktu empat sampai lima menit. Menurut Irawan (2008) secara umum ada tiga tahapan dalam proses PCR antara lain sebagai berikut :
1. DNA yang akan digandakan didenaturasi dengan pemanasan, biasanya sekitar 90°C-95°C, selama lebih kurang 5 menit. Perlu diperhatikan bahwa waktu
dan suhu tidaklah bersifat baku dalam penerapannya terdapat perbedaan karena dapat dipengaruhi oleh berbagai faktor.
2. Langkah kedua adalah proses anneling. Pada proses ini, suhu kemudian akan
diturunkan antara 50° dan 70°C. Pada tahapan ini primer akan menempel pada tempat yang tepat di pita tunggal DNA, yaitu segmen dengan ukuran
komplemennya.
3. Tahapan selanjutnya disebut dengan tahapan elongasi, pada tahapan ini suhu dijaga tetap stabil yaitu pada suhu optimal untuk ADN polymerase. Enzim
polymerase yang digunakan biasanya berasal dari bakteri Thermus aquaticus. Bakteri ini hidup di sumber air panas sehingga enzimnya juga tahan terhadap
Ada banyak faktor yang dapat mempengaruhi keberhasilan dari teknik
PCR dalam mengamplifikasi DNA diantaranya adalah tingkat kemurnian DNA. Jika DNA yang akan diperbanyak tidak murni maka akan menyebabkan gangguan pada saat proses penempelan primer dan hal tersebut juga akan dapat
menyebabkan terganggunya aktifitas enzim polymerase (Weising et al. 2005).
Simple Sequences Repeats (SSR)
Marka SSR saat ini masih merupakan marka yang popular digunakan
dalam studi genetik dan pemuliaan karena berbagai keunggulannya, diantaranya lokasinya yang menyebar di seluruh genom tanaman, multialelik, dan mudah
diamplifikasi dengan teknik PCR. Untuk kelapa sawit, saat ini marka SSR merupakan marka yang paling prospektif untuk menganalisis populasi dan mengetahui struktur genetik populasi kelapa sawit. Marka SSR ini juga telah
digunakan secara luas untuk mengkarakterisasi koleksi plasma nutfah kelapa sawit (Tasma dan Sekar, 2013).
SSR telah ditemukan sekitar tahun 1960 yang dibedakan kedalam dua tipe
yaitu mikrosatelit dan minisatelit. Mikrosatelit dikenal dengan sebutan SSR yang terbuat dari pengulangan nukleotida dengan panjang antara 2-6 bp sedangkan
minissatelit berikisar antara 10-100 bp. Karakterisasi dari mikoratelit ataupun minisatelit sangat bermanfaat untuk indentifikasi adanya polimorfik (Amrital, 2006).
Tanaman menyimpan informasi genetikanya di dalam genom inti, kloroplas dan mitokondria. Beberapa mekanisme seperti delesi, invers,
menyebabkan terjadinya perubahan basa nukleotida pada sekuen DNA.
Perubahan tersebut tidak selalu mengubah karakter morfologi sehingga penggunaan penanda yang langsung berintegrasi dengan sistem genetika akan lebih mampu menggambarkan keadaan genom yang sesungguhnya. Untuk
menanggulangi keterbatasan penanda morfologi maka penggunaan penanda molekular yang didasari oleh adanya polimorfisme pada tingkat protein atau DNA
(Donata, 2010).
Mikrosatelit dikenal dengan beberapa nama seperti simple sequence repeat
(SSR), simpletandem repeat (STR), sekuen tagged microsatelit site (STMS), dan
simple sequence length polimorphism (SSLP). SSR memberikan kandungan informasi yang tinggi, pada umumnya single lokus, bersifat kodominan,
membutuhkan jumlah DNA yang sangat sedikit, relatif sederhana, dan deteksi yang didasarkan pada PCR menandakan bahwa SSR merupakan alat ideal untuk banyak aplikasi genetika. Mikrosatelit mempunyai kandungan informasi
polimorfisme (PIC) atau tingkat heterozigositas yang tinggi. Mikrosatelit dapat digunakan untuk membandingkan genotipe dari individu yang memiliki hubungan
kekerabatan yang dekat. Penanda mikrosatelit sudah digunakan secara luas pada tanaman untuk fingerprinting, pemetaan gen dan analisis genetik (Donata, 2010).
DNA ruas berulang yang memiliki variasi paling tinggi dalam genom
tanaman adalah sekuen berulang dengan fragmen berulang sederhana atau pendek. Fragmen ini dikenal dengan nama minisatelit dan mikrosatelit. Minisatelit adalah
mikrosatelit (SSR) memiliki unit berulang lebih sedikit berkisar antara 1 – 6
pasang basa, terdapat dalam jumlah sangat banyak dan menyebar di dalam genom, dan banyak digunakan pada tanaman. Penanda atau marka molekuler berbasis DNA telah banyak digunakan karena memiliki kelebihan dalam hal sensitivitas
dan kecepatan mengidentifikasi spesies yang berbeda serta dapat membedakan individu yang mempunyai hubungan kekerabatan dekat (Ilbi, 2003).
Karakterisasi genetik yang akurat adalah dengan menggunakan penanda molekul. Mikrosatelit atau SSR merupakan salah satu penanda genetik molekuler yang didasarkan pada urutan DNA pendek yang tiap unit ulangannya terdiri dari
satu sampai enam nukleotida. Lokus mikrosatelit diapit oleh suatu urutan nukleotida yang terkonservasi, sehingga urutan DNA pengapit ini dapat dijadikan
primer spesifik yang bisa diamplifikasi menggunakan PCR (Treuren, 2000). Mikrosatelit merupakan runutan nukleutida sederhana, di-, tri- atau tetranukleotida, yang berulang dalam genom adalah segmen dari materi genetik
DNA, sehingga penggunaannya sebagai marka molekuler akan lebih mencerminkan struktur genetik populasi. Mikrosatelit pada umumnya bersifat
netral yaitu tidak menimbulkan kematian pada individu yang membawa alelnya. Genotip individu dalam populasi merupakan kombinasi antar alel mikrosatelit tetuanya (Jefri et al. 2013).
Mikrosatelit DNA terdapat dalam jumlah banyak dan menyebar di dalam genom. Bentuk umum pengulangan mikrosatelit DNA adalah pengulangan dua
dengan pengulangan 3-basa dan 4-basa ditemukan juga tetapi frekuensinya lebih
rendah dibandingkan pengulangan 2-basa (Liu, 1998).
Selanjutnya, Noorhariza, et al. (2012) dalam penelitiannya tentang Elaies olifeira Genomic-SSR Marker, telah menemukan beberapa motif hasil mikrosatelit
diantaranya adalah sebagai berikut (CT)14 pada primer sMo00018, (AG)15 pada primer sMo00020, (GAA)12 pada primer sMo00127, (AAT)12 pada primer
sMo00128, (ATTA)6 pada primer sMo00134, (AAAT)6 pada primer sMo00137, (TTTTC)6 pada primer sMo000138, dan (AAAAG)5
Lokasi sekuen berulang sederhana seperti mikrosatelit yang terletak di
antara gen atau yang berdekatan dengan suatu gen sangat penting dapat digunakan sebagai penanda sifat yang disandi oleh gen tersebut. Beberapa fragmen sekuen
berulang (SSR) yang terletak di dalam atau berdekatan dengan gen fungsional sudah ditemukan. Kirkpatrick (1992) melaporkan penggunaan keberadaan ulangan mikrosatelit (AC)n di dalam gen Insulin-like Growth Factor-1 (IGF-1)
manusia dan tikus.
pada primer sMo00147.
Problem teknis pada SSR antara lain: 1) Pemilihan primer untuk
mikrosatelit, banyak jenis primer yang telah didesain untuk analisis mikrosatelit pada tanaman. Primer-primer itu perlu diskrining dan dioptimasi sebelum diaplikasikan pada jenis tanaman tertentu, karena setiap tanaman mempunyai
karakteristik spesifik yang berbeda satu sama lain. 2) Slippage selama proses amplifikasi, termopolimerase dapat slip sehingga menghasilkan produk yang
disebabkan oleh taq-polimerase yang menambah nukleotida adenosin pada ujung
3’ produk amplifikasi (Asep, 2010).
Random Amplified Polymorphism DNA (RAPD)
RAPD merupakan salah satu marka molekuler yang bersifat dominan.
Fragmen DNA yang telah dihasilkan tidak dapat dibedakan antara genotipe homozigot (AA) dengan heterozigot (Aa), sedangkan yang tidak ada pita secara jelas menunjukkan genotipe resesif (aa). Fragmen DNA hasil amplifikasi RAPD
diskoring dengan ketentuan (1) untuk ada pita dan (0) untuk tidak ada pita, data tersebut kemudian digunakan untuk menghasilkan matrik biner untuk analisis
statistik selanjutnya. Keuntungan utama penanda RAPD adalah secara teknik
lebih sederhana dan cepat dalam pengujiannya, tidak memerlukan informasi sekuen DNA sehingga penanda ini dapat digunakan secara luas, jumlah
sampel DNA yang dibutuhkan sedikit dan primer tersedia secara komersial (Zulfahmi, 2013).
Pemilihan primer dalam aplikasi RAPD adalah salah satu hal yang sangat
mempengaruhi keberhasilan proses amplifikasi DNA target. Primer yang digunakan dalam teknik RAPD merupakan DNA pendek yang terdiri atas
beberapa nukleotida sebagai pemula pada proses sintesis DNA sehingga tidak membutuhkan primer forward dan reverse. Primer RAPD bersifat tunggal yang memiliki rangkaian nukleotida yang bersifat random sehingga dapat
Marka RAPD merupakan marka yang menggunakan oligonukleotida
tunggal pendek (primer), sepanjang 10-12 basa, untuk membentuk fragmen-fragmen DNA. RAPD akan dapat menunjukkan jumlah karakter yang tidak
terbatas sehingga sangat membantu dalam analisis keragaman genetik
(Pramudi et al. 2013).
Kelebihan penggunaan marka RAPD adalah lebih mudah dalam aplikasi,
lebih cepat, dan lebih murah jika dibandingkan dengan marka lainnya.Selain itu juga, marka RAPD telah digunakan secara luas untuk penelitian diversitas genetik dari suatu individu. Teknik RAPD telah digunakan untuk melihat perbedaan
antara individu dalam proses persilangan dan untuk memformulasikan strategi pemuliaan (Gunereen et al. 2010).
Salah satu kelemahan dari penggunaan marka RAPD dapat menyebabkan terjadinya multilokus dan RAPD bersifat dominan sehingga akan menyebaban keterbatasan pada kegiatan studi populasi genetik dan studi mapping. RAPD juga
sangat sensitif terhadap perubahan kondisi reaksi yang menyebakan gangguan pada pola pita pada saat melakukan eksperimen. Tingkat sensivitas yang tinggi
tersebut akan menyebabkan perbedaan pada hasil PCR. Oleh sebab itu, pengujian primer yang berulang sangat dianjurkan dan kemunculan multilokus pada RAPD dapat dibandingkan dengan hasil studi lainnya (Weising et al.2005).
Pemanfaatan Primer SSR pada Kelapa Sawit
Penelitian terkait dengan penggunaan marka SSR telah banyak dilakukan oleh penelitian terdahulu. Hal ini menunjukkan bahwa marka SSR merupakan
penggunaan marka SSR telah banyak diaplikasikan untuk berbagai kegiatan
molekuler.
Penelitian yang dilakukan oleh Tasma dan Arumsari (2013) menyimpulkan bahwa dua puluh marka yang diuji pada 49 aksesi sawit Kamerun
menghasilkan alel total sebanyak 175 dengan rataan jumlah alel per lokus 8,75 berkisar antara 4-15 alel per lokus SSR. Tingkat polimorfisme marka SSR yang
diuji tergolong tinggi dengan rataan nilai PIC 0,80 berkisar antara 0,63-0,91. Diversitas genetik dari 49 aksesi kelapa sawit dianalisis dengan 20 marka SSR berkisar antara 12,5- 57,72%. Uji filogenetik pada koefisien kemiripan genetik
52,28% membagi aksesi menjadi tujuh kelompok. Aksesi diversitas genetik tinggi dan berada pada klaster berbeda potensial digunakan sebagai calon tetua dalam
program pemuliaan kelapa sawit.
Hasil penelitian yang dilakukan oleh Taeprayon et al. (2015) untuk mengidentifikasi latar belakang genetik terhadap tiga populasi hasil persilangan di
Thailand dengan menggunakan marka SSR menunjukan adanya keragaman serta dikelompokkan menjadi empat kelompok. Penggunaan marka SSR juga telah
digunakan untuk mempelajari tingkat heterozigositas dan tingkat transfer marka SSR pada tanaman kopi. Penelitian oleh Priyono (2010) menunjukkan bahwa dengan menggunakan marka SSR tingkat heterozigositas kopi Robusta klon BP
409, BP 961 dan Q 121 berturut-turut 52%, 53% dan 40%. Dengan menyeleksi marka SSR dari peta genetik referensi dapat dibuat tiga peta genetik persilangan
yang sama dengan peta genetik referensi. Hasil ini menunjukkan bahwa marka
SSR mempunyai tingkat transfer yang tinggi pada peta genetik kopi Robusta. Selain marka SSR dikenal sebagai marka polimorfisme atau kodominan, marka SSR juga dapat juga bersifat monomorfik. Hasil penelitian Emad dan Soon
(2014) menyimpulkan bahwa marka SSR monomorphic dapat digunakan untuk mendeteksi adanya illegitimate palms sehingga marker SSR yang bersifat
monomorphic dapat dijadikan sebagai marker untuk pengujian illegitimacy pada tanaman kelapa sawit. Selain itu, marka SSR juga dapat digunakan untuk mendeteksi kemurnian suatu benih, hal ini berdasarkan penelitian Mulsanti et al.
(2013) yang menyatakan bahwa identifikasi kebenaran suatu genotipe tanaman menggunakan marka SSR monomorfik merupakan salah satu metode yang dapat
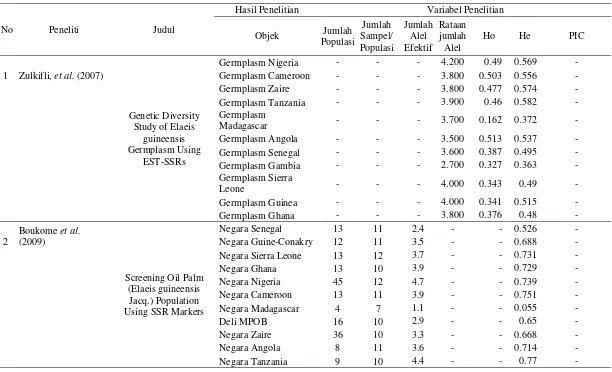
Tabel 1. Pemakaian marka SSR dalam penelitian keragaman genetik
No Peneliti Judul
Hasil Penelitian Variabel Penelitian
3 Noorhariza et al.
5 Putri (2010) Pendugaan Parameter
7 Ajambang et al.
Pemanfatan Primer RAPD pada Kelapa Sawit
Penerapan RAPD untuk kegiatan analisis molekuler telah digunakan untuk
berbagai keperluan. Hal ini disebabkan oleh marka RAPD relatif mudah dalam penggunaannya, efisien, ekonomis, dan efektif digunakan untuk mengidetifikasi
keragaman genetik suatu individu tanaman. RAPD dapat digunakan untuk mempelajari keragaman genetik, hal ini dilakukan oleh penelitian yang dilakukan oleh Yurna et al. (2002) yang melihat bagaimana keragaman genetik 24 individu
dari 2 famili kelapa sawit tenera origin binga menunjukkan hasil bahwa tanaman kelapa sawit tenera origin binga memiliki kesamaan genetik sebesar 36% yang
dapat dibagi menjadi lima kelompok.
Penggunaan RAPD untuk membedakan varietas Dura, Pisifera, Tenera, dan Virescenes dilakukan oleh Odenore et al. (2015) menggunakan 6 primer
RAPD telah mampu menunjukkan perbedaan genetik antar varietas Dura, Tenera, Pisifera dan Varietas Virescens. Hasil penelitian ini menunjukkan primer OP-OBI menunjukkan band 500 bp pada Dura dan Tenera dikonfirmasi dengan lapisan
shell, sehingga membedakannya dengan Pisifera. Band 220 bp varietas Virescens juga teramplifikasi pada Dura tetapi tidak teramplifikasi pada Tenera dan Pisifera,
yang menunjukkan secara genetik varietas Virescens lebih mitip dengan Dura. Pada primer OP-A02, Dura dan Tenera dapat mengamplifikasi band 850 bp tetapi tidak teramplifikasi pada Pisifera dan Virescens. Dua unik band 250 bp dan 900
di 600 bp yang tidak ditunjukkan oleh Parental Dura (P1), Pisifera (P2) dan
Varietas Virescens (H2), tetapi terindetifikasi pada Tenera.
Penelitian Satish dan Mohankumar (2007) menunjukkan hasil P7 (-GGCGGACTGT-) dan P10 (-GGACCCAACC-) mengidentifikasi Dura yang
membedakannya dengan Pisifera dan Tenera pada 700 bp dan 1000 bp, primer P10 (-GGACCCAACC-) dapat mengidentifikasi pisifera pada 700 bp dan primer
P28 (-ACCCGGTCAC-) dapat mengidentifikasi varietas tenera pada 1100 bp. RAPD dapat digunakan untuk melihat perbedaan genetik tanaman kelapa sawit abnormal. Hal ini dilakukan oleh Nurita et al. (2001) yang menunjukkan
primer RAPD yaitu OPC-08, SC10-19, OPC-07 dan OPW-19 mampu membedakan genotipe normal dan tidak normal dalam klon yang sama pada
seluruh klon uji. Kesamaan genetik antar klon normal lebih tinggi dibandingkan dengan kesamaan genetik antar genotipe normal dan abnormal maupun antar genotipe abnormal. Hasil analisis komponen utama menunjukkan dari 15 primer
yang diuji belum mampu menghasilkan pita DNA penciri untuk abnormalitas. Penerapan RAPD untuk analisis genetik untuk mendeteksi kelapa sawit
abnormal juga telah dilakukan Hetharine (2010) menunjukkan hasil bahwa Adanya perubahan sekuens DNA yang diamplifikasi oleh primer 08, OPC-09, OPD-15, SC10-19, dan W15 menunjukkan bahwa ada perubahan genetik
antara tanaman regeneran klon MK 152. Primer OPC-08, OPC-09 dan SC10- 19 mampu membedakan tanaman normal dan abnormal dengan pita-pita unik
regeneran abnormal. Primer OPC-09 menghasilkan tiga pita unik pada tanaman
normal. Primer SC10-19 menghasilkan satu pita unik pada tanaman normal meskipun diperoleh juga pita-pita unik pada regeneran abnormal. Primer OPC-08 sangat berpotensi digunakan untuk melacak tanaman normal dan abnormal namun
perlu diuji lebih lanjut pada klon-klon lain.
Selain telah diterapkan untuk kelapa sawit, marka RAPD telah diterapkan
pada tanaman Sengon (Paraseranthes falcataria (L) Nielsen) berdasarkan penelitian Ulfah dan Ranny (2010) yang menyimpulkan nilai keragaman genetik (He) sengon di Jawa tergolong tinggi dengan nilai rata-rata He= 0.2349. Nilai He
terendah terdapat pada populasi sengon berasal dari Wonosobo (He = 0.1328) dan nilai He tertinggi terdapat pada populasi Kediri (He= 0.2946). Berdasarkan jarak
genetik terlihat bahwa populasi sengon Tasikmalaya dan populasi sengon Lumajang memiliki jarak genetik terdekat (0.0123), sedangkan jarak genetik terjauh pada Garut dan Kediri (0.0814).
Penggunaan penanda RAPD juga telah diterapkan pada tanaman tebu (Putri, et al. 2016) yaitu untuk mengidentifikasi kemiripan genotipe tanaman tebu
di Sumatera Utara berdasarkan 8 penanda RAPD. Hasilnya menunjukkan bahwa tanaman kelapa sawit di Sumatera Utara di kelompokkan menjadi 3 kelompok. Kelompok I terdiri 8 genotipe (Gelagah Helvetia, G.Sunggal, G.Karo, PSCO 902,
PSBM 901, Merah Binjai Timur, Kuning Tanjung Jati, K . Hamparan perak), kelompok II terdiri 8 genotipe (BZ 134 Tanjung Jati, BZ 134 Sunggal, BZ 134
Sunggal) dan Kelompok III terdiri dari 5 genotipe ( Merah Hamparan Perak,
Merah Kabanjahe, Berastagi Sibolangit, B. Kabanjahe, B. Berastagi).
Selanjutnya aplikasi RAPD pada tanaman Nilam oleh Chandra (2011) menyimpulkan tanaman nilam hasil budidaya di Bali semuanya sekelompok
dengan nilam Aceh (Pogostemon cablin Benth). Secara morfologi dan molekuler nilam yang dibudidayakan di Bali memiliki kekerabatan dengan nilam Aceh
dengan jarak genetik dari 0,087 - 0,304. Penggunaan marka RAPD secara lebih luas juga telah diterapkan untuk mengidentifikasi keragaman Salak (Kaidah, 1999), jeruk (Karsinah et al. 2002), durian sukun (Durio zibethenus) (Ismi, et al.