BAB 2
TINJAUAN PUSTAKA
2.1. Aldehida
Aldehida merupakan suatu senyawa yang karbon karbonilnya ( karbon yang terikat pada oksigen )selalu terikat dengan paling sedikit satu atom hidrogen.adapun rumus aldehida ialah seperti gambar 2.1 berikut:
R C
O
Gugus karbonil H
Gambar 2.1. Struktur aldehida (Wilbraham, 1992)
Formaldehida (HCHO) merupakan aldehida paling sederhana ( Wilbraham, 1992 ). Aldehida mempunyai paling sedikit satu atom hidrogen pada gugus karbonilnya. Sedangkan gugus lainnya boleh berupa atom hidrogen, gugus alkil ataupun gugus aril ( Riswiyanto, 2009 ). Dalam sistem IUPAC, aldehida sederhana diberi nama berdasarkan alkana induknya dengan akhiran –ana diubah menjadi –anal
(-an untuk senyawa jenuh dan –al untuk aldehida). Misalnya pada senyawa 3-metil butanal seperti pada gambar 2.2 berikut ini
CH3CHCH2CH CH3 O
Gambar 2.2. Struktur 3-metil butanal (Fessenden dan Fessenden, 2010)
Aldehida sederhana ini disebut dengan nama trivialnya. Sebagian besar nama ini diturunkan dari nama trivial asam karboksilat yang bersangkutan dimana akhiran asam –at atau –oat diubah menjadi –aldehida( Fessenden dan Fessenden, 2010
).Adanya gugus karbonil menyebabkan aldehida bersifat polar dan mempunyai gaya intramolekul dan titik didih yang lebih besar daripada alkana yang bersesuaian. Atom
oksigen pada senyawa karbonil dapat membentuk ikatan hidrogen yang cukup kuat dengan molekul air. Senyawa karbonil dengan berat molekul yang rendah dapat larut
pengoksidasi yaitu pereaksi Tollens (Ag+ dalam larutan NH3), pereaksi Benedict (Cu2+ dalam larutan natrium sitrat) dan pereaksi Fehling (Cu2+ dalam larutan kalium natrium tartrat). Pereaksi ini mengoksidasi aldehida menjadi asam karboksilat dan ditandai dengan perubahan warna. Aldehida akan mereduksi pereaksi Fehling dan Benedict sedangkan ia sendiri akan teroksidasi dan ditandai dengan terbentuknya endapan merah bata Cu2O (Sarker dan Lutfun, 2007).
Aldehida dapat dioksidasi dengan permanganatdan kromat, namun dapat juga dioksidasi dengan zat pengoksidasi yang sangat lemah seperti Ag+ dan Cu2+. Reaksi Tollens digunakan sebagai reagensia uji untuk aldehida dimana uji positif ditandai dengan terbentuknya cermin perak pada dinding dan tabung reaksi. Tetapi dengan meluasnya penggunaan spektroskopi, uji ini tidak dilakukan lagi untuk identifikasi aldehida, namun terkadang cermin tersebut masih dibuat (Fessenden dan
Fessenden,1992).
Beberapa reaksi dari aldehida dengan beberapa senyawa antara lain: 1. Reaksi dengan air
Air dapat mengadisi suatu karbonil, untuk membentuk suatu 1, 1- iol, yang disebut gem-diol atau hidrat. Reaksi itu reversibel dan biasanya kesetimbangan terletak pada sisi karbonil. Adapun reaksi aldehida dengan air seperti dibawah ini:
R C
2. Reaksi dengan alkohol
Produk adisi suatu molekul alkohol pada suatu aldehida disebut suatu hemiasetal.
3. Reaksi dengan hidrogen sianida
Hidrogen sianida dapat mengadisi ke gugus karbonil suatu aldehida menghasilkan sianohidrin. Adapun reaksi aldehida dengan hidrogen sianida seperti pada gambar dibawah ini:
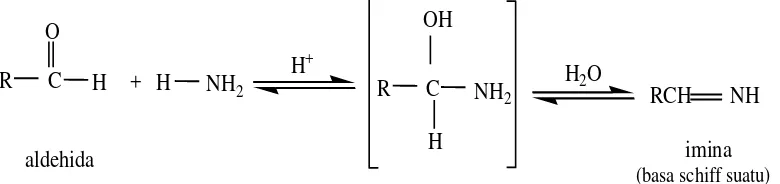
4. Reaksi dengan amonia dan amina primer
Amina adalah suatu nukleofilik yang dapat menyerang gugus karbonil dari suatu aldehida dalam reaksi. Adapun reaksi antara aldehida dengan amonia dan amina
primer seperti gambar dibawah ini (Fessenden, 1999).
R C
Gambar 2.3. Reaksi Aldehida dengan Beberapa Senyawa: air, alkohol, hidrogen sianida, dan amonia (Fessenden dan Fessenden, 1999)
2.2. Sinamaldehida
Sinamaldehida merupakan salah satu senyawa yang dikandung minyak sinamon dari kulit manis. Yang diperoleh dengan cara mengisolasi minyak kayu manis. Kandungan sinamaldehida pada kayu manis sekitar 74% ( Clark, 1991). Wen lin et al 2009,
Berikut beberapa uraian tentang sifat fisika dan sifat kimia sinamaldehida
antara lain:
Rumus molekul : C9H8O
Rumus struktur : 3 phenil 2-propenal Massa molekul relative : 132,15
Density (250C) : 1,048 – 1,052
Larut baik dengan pelarut : Alkohol, kloroform, eter
Titik didih pada tekanan 1 mmHg : 76,10C (The merck index, 1976)
Secara sintesis sinamaldehid dihasilkan dari reaksi kondensasi aldol antara benzaldehida dengan asetaldehida dilanjutkan dehidrasi secara spontan(cross aldol condensation). Dalam suasana basa, hidrogen α diabstaksi oleh nukleofil sehingga
terjadi pusat nukleofil pada pusat atom C α pada aldehida yang segera menyerang
gugus karbonil dari benzaldehid menghasilkan alkohol yang segera mengalami dehidrasi menghasilkan diena terkonjugasi menghasilkan sinamaldehid seperti pada
gambar 2.4 berikut ini:
C H O
CH3 C O
H
OH- C CH2
OH C
O
H
-H2O
CH CH C O
H
benzaldehida asetaldehida
Sinamaldehida
Sinamaldehida merupakan larutan berwarna dan berbau minyak serta memilki
titik didih 252oC. Dapat bereaksi dengan karbon yang memiliki ikatan rangkap dan gugus CHO. Adapun reaksi-reaksi sinamaldehida dengan senyawa lain seperti gambar 2.5 berikut ini:
1. Reaksi dengan larutan bromide akan menghasilkan sinamaldehida dibromida. Adapun reaksi sinamaldehida dengan larutan bromida seperti gambar dibawah ini:
C6H5 CH CH C
O H
+
BrBr C6H5
Br
Br CH CH C
O H
2. Reaksi dengan oksidator kuat seperti KMnO4 akan memutus ikatan C=C menjadi asam benzoat. Adapun reaksi sinamaldehida denga oksidator kuat seperti gambar dibawah ini:
C6H5CH=CHCHO + 2 [O] KMnO4
H+ C6H5COOH
Asam Benzoat
3. Jika direduksi dengan litium aluminium hidrate, LiAlH4 akan membentuk sinamil alkohol. Adapun reaksi reduksi sinamaldehida dengan litium aluminium hidrate seperti gambar dibawah ini:
C6H5CH=CHCHO + 2 [H] LiAlH4 C6H5CH=CHCH2OH
Gambar 2.5. Reaksi Sinamaldehida dengan Beberepa Senyawa: Larutan Bromida, KmnO4, dan LiAlH4 (Bahl.A, 2004)
2.3.Etilendiamin
Adapun struktur dari etilendiamin seperti gambar 2.6 berikut ini:
H2N C C
H H
H H
NH2
Gambar 2.6. Struktur Kimia Etilendiamin ( Anonimous,1976)
Etilendiamina merupakan poliamina primer yang larut dalam air dan sangat higroskopis. Etilendiamina harus dilindungi dari kelembaban atmosfer dan CO2 selama pemurniandan pemakaianya karena akan menyebabkan banyak kesalahan dalam hasil yang diperoleh.Etilendiamina anhidrat dapat dimurnikan untuk menghilangkan air dan CO2 dengan pengadukan amin tersebut dengan NaOH ataupun KOH pelet selama beberapa jam, kemudian airnya didestilasi. Jumlah air dapat dikurangi dengan menambahkan suatu bahan pengering berupa molekular sieves maupun alumina.Air yang diperoleh dapat dipindahkan dengan destilasi azeotrop. Etilendiamina dan air membentuk azeotrop yang negatif yang mempunyai titik didih 2°C diatas amin . Etilendiamina sebagai salah satu golongan kimia,merupakan antihistamin tertua yang bermanfaat dengan efek samping depresan sistem saraf pusat
dan gastrointestinal yang kejadiannya relatif tinggi(Roberts, 1982).
2.4.Fenilhidrazin
Fenilhidrazin (C6H8N2) mempunyai berat molekul 108, terdapat sebagai kristal kuning hingga coklat pucat atau sebagai cairan berminyak kekuningan, dengan berat jenis 1,1848 g/mL, titik beku 19,60C, titik didih 243,40C, dan tekanan uap 133 Pa pada 720C. larut dalam air (rentang nilai 145-837 g/L pada 240C) dan dapat bercampur dengan alkohol, eter, kloroform, benzene, dan aseton. Fenilhidrazin diproduksi secara komersil dengan diazosiasi dari aniline yang diikuti reduksi senyawa azo.Adapun struktur dari fenilhidrazi seperti gambar 2.7 berikut ini:
NH NH2
Fenilhidrazin digunakan secara luas terutama sebagai senyawa kimia
intermediet dalam farmakologi, agrokimia, dan kimia industri. Fenilhidrazin menyerap dengan kuat sinar ultraviolet dalam rentang yang signifikan dilingkungan kemungkinan akan berubah warna jika terkena cahaya matahari, lambat terjadi penguraian warna dalam difusi siang hari tanpa adanya oksigen. Adanya oksigen menyebabkan fenilhidrazin mengalami autoksidasi, reaksi dipercepat oleh cahaya dan panas, substansi akan menjadi coklat kemerahan pada udara terbuka sebagai hasil dari autoksidasi ini (WHO, 2000).
2.5.Basa Schiff
Suatu senyawa yang mengandung gugus azomethin (-CH=N-) dinamakan sebagai basa Schiff. Senyawa ini biasanya dibentuk oleh reaksi kondensasi antara suatu senyawa amina primer dengan suatu senyawa karbonil (Bell et al, 1963). Amina
primer dapat menjadi inhibitor lebih efektif apabila panjang rantainya bertambah, namun kebalikan bagi merkaptan alifatik primer dan beberapa aldehida justru efisiensinya menurun apabila panjang rantai bertambah (Widharto, 2004). Basa Schiff dalam penggunaannya sangat efektif sebagai inhibitor korosi yang dimana memiliki kemampuan secara spontan membentuk suatu lapisan untuk melindungi suatu bahan atau material tersebut dari ramah lingkungan (Li et al, 1999). Selain sebagai anti
korosi, basa Schiff juga memiliki kegunaan lain. Ligan basa Schiff yang mengandung atom pendonor (seperti N,O,S dan lainnya) menunjukkan aktivitas biologi yang baru sebagai anti jamur, antiviral, anti kanker, antimikroba, dan sebagai agen antibakteri (Gwaram , 2012).
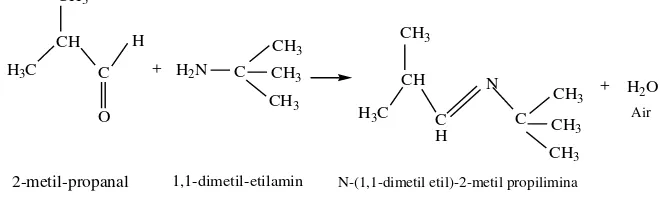
Contoh reaksi pembentukan Basa Schiff yaitu pembuatanN-(1,1-dimetil etil)-2-metil propilimina seperti pada gambar 2.8 berikut ini:
H3C
Basa Schiff pertama kali dikenalkan oleh bernema Hugo Schiff pada tahun
1864 dimana dengan melakukan kondensasi amina primer dengan senyawa karbonil (Cimerman et al, 2000). Pada umumnya basa Schiff dari turunan aldehida disebut
dengan aldimina dan turunan keton disebut dengan ketimina (Robert, 1982).
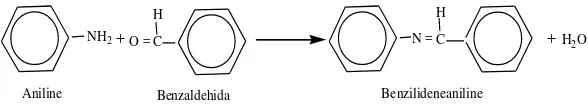
Senyawa yang mengandung gugus NH2 seperti amina primer dapat direaksikan dengan aldehida atau keton, akan tetapi hasil adisinya tidak stabil dan mengalami eliminasi air. Salah satu dari reaksi basa Schiff tersebut yaitu reaksi antara kondensasi aniline dengan benzaldehida menghasilkan benzilideneaniline seperti pada gambar 2.9 berikut ini:
C H =
+ N = C
H
+H2O Aniline Benzaldehida Benzilideneaniline
O NH2
Gambar 2.9. Reaksi Pembentukan Benzilideneaniline (Bahl.A, 2004)
Senyawa kompleks dapat dibentuk dari basa Schiff dengan logam-logam seperti kobalt, nikel, dan tembaga yang sudah diketahui sebagai pembawa oksigen (Calvin et al, 1946). Meskipun belum ada senyawa logam tersebut yang telah diuji
O H
Gambar 2.10.Reaksi sintesis basa schiff dengan turunan logam kobalt (Ernest.M.et al, 1964)
Basa Schiff memiliki kestabilan yang rendah yang menyebabkan basa Schiff
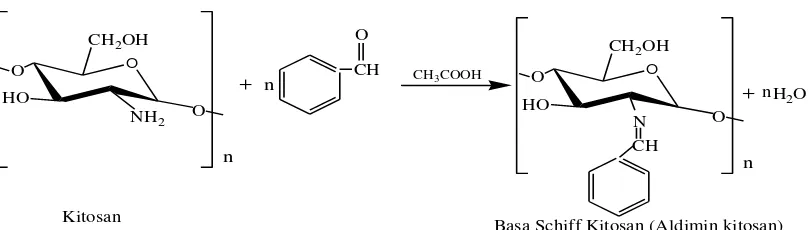
mudah mengalami hidrolisis asam dan telah digunakan sebagai proteksi terhadap gugus amina. Turunan basa Schiff dapat diperoleh dari reaksi filmkitosan dengan
aldeid alifatik, bukan saja yang linier asetaldehida ke dekanal juga yangbercabang dan aldehida aromatik.
Aldimin kitosan disebut juga sebagai basa Schiff kitosan. Aldimin kitosan merupakan aldehida dengan kitosan, dimana aldehida akan terikat pada gugus asam yang akan membentuk suatu gugus imina (C=N) yang merupakan ciri khas terbentuknya aldimin. Salah satu contoh pembentukan basa schiff dari kitosan seperti pada gambar 2.11 berikut ini:
O
Spektrum absorpsi dalam daerah-daerah ultra violet dan tampak umumnya
terdiri dari satu atau beberapa pita absorpsi yang lebar. Semua molekul dapat menyerap radiasi dalam daerah UV-Vis, oleh karena mereka mengandung elektronbaik yang dipakai bersama maupun tidak yang dapat dieksitasi ketingkat energi yang paling tinggi. Panjang gelombang pada waktu absorpsi terjadi tergantung pada bagaimana erat elektron terikat didalam molekul.
Elektron dalam ikatan rangkap dua atau tiga cukup mudah terekstasi ke orbital phi lebih tinggi. Suatu transisi ditandai dengan * apabila satu phi elektron
dinaikkan dari orbital phi bonding ke orbital phi anti-bonding. Absorpsi energi dalam
transisi demikian biasanya lebih kuat daripada transisi -*. Dalam molekul
terkonjugasi (yaitu mengandung sederatan ikatan rangkap berselang-seling) absorpsi tergeser ke panjang gelombang lebih panjang. Pergeseran ke panjang gelombang yang lebih panjang mencerminkan kenyataan bahwa elektron dalam suatu sistem berkonjugasi adalah kurang erat terikat daripada dalam satu ikatan yang tidak
berkonjugasi. Telah diketahui bahwa transisi -* dalam molekul-molekul yang mengandung gugus tak jenuh adalah sama dengan tidak mengindahkan atom-atom yang menyusun ikatan rangkapnya. Dalam sintesa basa Schiff dengan terbentuknya ikatan imina (C=N) akan terjadi pergeseran panjang gelombang seperti yang telah dilakukan Azzouz and R.T.Ali (2010) dimana terjadi pertambahan panjang gelombang
dari 247 nm menjadi 327 nm untuk basa schiff.
Spektrum inframerah menunjukkan nilai informasi mengenai gugus fungsi yang terikat pada logam. Spekta inframerah dapat direkam dari sampel berupa cairan,
2.6. Logam Seng
Seng (Zink) adalah logam yang cukup mudah ditempah dan diliat pada suhu 110-150oC. Seng melebur pada suhu 410oC dan mendidih pada suhu 906oC. Logamnnya murni, melarut lambat sekali dalam asam dan alkali (Vogel, 1985). Seng digunakan sebagai pelapis besi untuk mencegah terjadinya proses korosi. Proses pelapisan besi dikenal dengan proses galvanisasi dan dilakukan berdasarkan sifat elektokimia proses yang bersangkutan. Pelapisan ini mempunyai keuntungan bahwa logam seng akan teroksidasi terlebih dahulu sekalipun lapisan seng sudah terkoyak, sehingga besinya nampak keluar. Hal ini sebagai konsekuensi dari nilai potensial reduksi seng yang
negatif daripada besi, sehingga seng bertindak sebagai anoda yang terkorbankan.(Sugiyarto dan Suyanti, 2008)
Proteksi terhadap logam besi juga berhubungan dengan efek anode dimana
seng membentuk lapisan pada logam besi. Penggunaan lainnya pada seng termasuk pelapisan pada logam kuningan dan sebagai anoda pada bagian asam kering (Mahan, 1987).Seng jika dipanaskan dalam gas klorin secara perlahan-lahan akan menghasilakan ZnCl2. Sumber utama logam seng adalah bijih seng sulfide. ZnS, namun cara memperoleh logam ini tidaklah mudah dimana menggunakan pemanggangan pada suhu 800oC kemudian mereduksi oksidasinya dengan kokas berlebih pada suhu 1400oC.
Reaksi pembuatan Zink murni seperti gambar 2.11 berikut ini:
ZnS(s) + 3O2 2ZnO(s) + 2SO2(g)
ZnO(s) + C(s) Zn(l) +CO(g)
Gambar 2.12. Gambar reaksi pembentukan zink murni(Atkins, 1989)
2.7.Korosi
Korosi merupakan penurunan kualitas yang disebabkan oleh reaksi kimia bahan logam dengan unsur-unsur lain yang terdapat di alam (Fajar, 2013). Terkorosinya suatu logam dalam lingkungan elektrolit (air) adalah proses elektrokimia. Proses ini terjadi bila ada reaksi setengah sel yang melepaskan elektron dan reaksi setengah yang menerima elektron tersebut. Kedua reaksi ini akan terus berlangsung sampai terjadi kesetimbangan dinamis dimana jumlahh elektron yang dilepas sama dengan jumlah olektron yang diterima (Siti, 2008).
Adapun syarat-syarat proses ini dapat terjadi : a) Anoda
Anoda biasanya terkorosi dengan melepaskan elektron-elektron dari atom-atom logam netral untuk membentuk ion-ion yang bersangkutan. Ion-ion ini mungkin
tetap tinggal dalam larutan atau bereaksi membentuk hasil korosi yang tidak larut.
b) Katoda
Katoda biasanya tidak mengalami korosi, walaupun mungkin menderita
kerusakan dalam kondisi-kondisi tertentu. Reaksi yang terjadi pada katoda berupa reaksi reduksi.
c) Elektrolit
Elektrolit adalah larutan yang mempunyai sifat menghantarkan listrik. Elektrolit dapat berupa larutan asam, basa dan larutan garam. Larutan elektrolit mempunyai peranan penting dalam korosi logam karena larutan ini dapat menjadikan kontak listrik antara anoda dan katoda.
d) Anoda dan Katoda harus terhubung secara elektris
Beberapa jenis korosi yang terjadi dalam kehidupan sehari-hari yaitu: korosi
seragam, korosi galvanik, korosi erosi, korosi celah, korosi sumuran, korosi batas retak pengaruh lingkungan butir, korosi batas butir, dealloying, hydrogen damage (Jones, 1991). Umumnya problem korosi disebabkan oleh air, tetapi ada beberapa faktor selain air yang mempengaruhi laju korosi, diantaranya:
1. Faktor Gas Terlarut.
Oksigen (O2), adanya oksigen yang terlarut akan menyebabkan korosi pada metal seperti laju korosi pada mild stell alloys akan bertambah dengan meningkatnya kandungan oksigen. Reaksi korosi secara umum pada besi karena adanya kelarutan
oksigen adalah seperti gambar 2.12 berikut ini:
Fe Fe2+ + 2e
O2 + 2H
2O + 4e 4OH
-Reaksi katoda : Reaksi anoda :
Gambar 2.13. Reaksi korosi pada besi(Fajar, 2013)
Karbondioksida (CO2), jika karbondioksida dilarutkan dalam air maka akan terbentuk asam karbonat (H2CO3) yang dapat menurunkan pH air dan meningkatkan korosifitas, biasanya bentuk korosinya berupa pitting.
2. Faktor Temperatur
Penambahan temperatur umumnya menambah laju korosi walaupun kenyataannya kelarutan oksigen berkurang dengan meningkatnya temperatur. Apabila metal pada temperatur yang tidak uniform, maka akan besar kemungkinan terbentuk korosi.
3. Faktor pH
pH netral adalah 7, sedangkan pH< 7 bersifat asam dan korosif, sedangkan untuk pH
4. Faktor Bakteri Pereduksi atau Sulfat
Reducing Bacteria (SRB) Adanya bakteri pereduksi sulfat akan mereduksi ion sulfat menjadi gas H2S, yang mana jika gas tersebut kontak dengan besi akan menyebabkan terjadinya korosi.
5. Faktor Padatan Terlarut
Klorida (Cl-), klorida menyerang lapisan mild steel dan lapisan stainless steel. Padatan ini menyebabkan terjadinya pitting, crevice corrosion, dan juga
menyebabkan pecahnya alooys.
Karbonat (CO32-), kalsium karbonat sering digunakan sebagai pengontrol korosi dimana film karbonat
diendapkan sebagai lapisan pelindung permukaan metal, tetapi dalam produksi minyak hal ini cenderung menimbulkan masalah scale.
Sulfat (SO42-), ion sulafat ini biasanya terdapat dalam minyak. Dalam air, ion sulfat juga ditemukan dalam konsentrasi yang cukup tinggi dan bersifat kontaminan, dan oleh bakteri SRB sulfat diubah menjadi sulfide yang korosif (Fajar, 2013)
2.8.Dampak Korosi
Korosi yang terjadi pada logam tidak dapat dihindari, tetapi hanya dapat dicegah dan
dikendalikan sehingga struktur atau komponen mempunyai masa pakai yang lebih lama. Setiap komponen atau strukturmengalami tiga tahapan utama yaitu
perancangan, pembuatan dan pemakaian. Ketidakberhasilan salah satu aspek seperti korosi menyebabkan komponen akan mengalami kegagalan. Kerugian yang akan dialami dengan adanya korosi meliputi finansial dan safety, diantaranya :
1. Penurunan kekuatan material 2. Penipisan
3. Downtime dari equipment 4. Retak & Pitting
5. Kebocoran fluida 6. Embrittlement
N N
Inhibitor korosi adalah senyawa kimia yang dapat mencegah atau memperlambat proses korosi. Sejauh ini, penggunaan inhibitor merupakan salah satu cara yang paling efektif untuk mencegah korosi, Karena biayanya relative murah dan prosesnya yang sederhana (Indocor, 2011). Basa Schiff dapat bertindak sebagai inhibitor korosi karena memiliki pasangan elektron bebas, dimana pasangan electron bebas ini akan mendonorkan electron elektronnya pada permukaan logam tersebut. Ini menyebabkan molekul air dan ion agresif seperti Cl menjauh dari permukaan logam (Umoren et al,
2011).
Beberapa cara kerja dapat dibedakan melaui gambar berikut:
Gambar 2.14. Beberapa Cara Kerja Inhibitor pada Logam
a. Adanya protonasi atom nitrogen dari gugus -HC=N- akan menyebabkan molekul inhibitor bermuatan positif. Permukaan logam bermuatan negatif dalam larutan
asam sulfat. Pada saat ini akan terjadinya interaksi antara molekul inhibitor yang bermuatan positif dengan permukaan logam yang bermuatan negatif.
b. Elektron bebas pada atom nitrogen akan berinteraksi dengan permukaan logam c. Orientasi datar dari seluruh molekul dengan adanya ketertarikan dari permukaan
Dimana inhibitor korosi bekerja dengan cara membentuk lapisan pelindung pada
permukaan logam (Halimatuddahliana, 2003). Secara umum terdapat beberapa jenis inhibitor, yaitu
1. Inhibitor Anodik
Inhibitor Anodik adalah inhibitor yang menurunkan laju reaksi di aniodik dengan cara meningkatkan polarisasi anoda melalui reaksi dengan ion-ion logam untuk menghasilkan selaput-selaput pasif tipis berupa lapisan-lapisan garam yang kemudian menyelimuti permukaan logam.
2. Inhibitor Kationik
Inhibitor Kationik adalah inhibitor yang berpengaruh terhadap reaksi di katoda. Pembentukan hydrogen di katoda akan dikendalikan melalui peningkatan polarisasi sistem. Garam-garam logam seperti arsen, bismuth, dan antimon ditambahkan untuk membentuk selaput tipis hidrogen yang teradsorpsi pada
permukaan katoda. 3. Inhibitor Adsorpsi
Inhibitor Adsorpsi adalah inhibitor dimana molekul-molekul organik rantai panjang dengan rantai samping teradsorpsi dan terdesorpsi dari permukaan logam.
Molekul-molekul berukuran besar ini dapat membatasi difusi O2 ke permukaan logam atau menangksp ion-ion logam pada permukaan serta memantapkan lapisan ganda dan mereduksi laju pelarutan.
4. Inhibitor Amina
Inhibitor Amina adalah inhibitor dari suatu senyawa organik yang mengandung nitrogen trivalen yang terikat pada suatu atom karbon atau lebih seperti RNH2, R2NH, dan R3N. amina dapat digolongkan dalam tiga jenis yaitu amina primer, amina sekunder, dan amina tersier. Penggolongan ini berdasarkan banyaknya subsituen alkil pada aril yang terikat pada atom nitrogen (Ulmann, 1985).
Efisiensi amina organik sebagai unsur penghambat pengkaratan meningkat apabila terdapat ion halogen. Ion halogen dapat bertindak menghambat pengkaratan hingga tingkat tertentu pada larutan asam dimana ion iodide (I-)
2.10. Teknik Penentuan Efisiensi Inhibitor
Ada beberapa cara untuk menguji atau mengevaluasi efisinsi suatu inhibitor adalah dengan teknik kehilangan berat, teknik gasometrik, teknik elektrokimia, spektroskopi impedansi, dan pengukuraan polarisasi.
1. Teknik kehilangan berat
Untuk pengukuran kehilangan berat, persentasi efisiensi inhibitor dapat dihitung dengan variasi konsentrasi inhibitor menggunakan rumus berikut ini:
W0
EI(%) = W0-W1 x 100%
Dimana:
EI = efisiensi inhibitor
Wo = berat kehilangan tanpa inhibitor
W1 = berat kehilangan menggunakan inhibitor
2. Teknik gasometri
Untuk penetuan efisiensi inhibitor dengan teknik ini didasarkan pada volume gas hidrogen yang dibebaskan, dimana dihitung dengan cara berikut ini:
EI(%) = Vb-V1 x100%
Vb
Dimana :
Vb = volume gas yang bertambah didalam tidak adanya inhibitor V1 = volume gas yang bertambah dengan adanya inhibitor
3. Teknik elektrokimia
4. Spektroskopi Impedansi elektrokimia
Pada teknik ini dilakukan dengan bantuan komputer dengan mengukur perpindahan muatan resistansi pada logam dimana efisiensi inhibitor dapat dihitung dengan persamaan berikut ini:
EI(%) = x 100%
Rt(inh)-Rt(blank)
Rt(inh)
Dimana :
Rt(inh) = perpindahan muatan resistansi dengan adanya inhibitor Rt(blank) = perpindahan muatan resistansi tanpa adanya inhibitor