MAKALAH
KIMIA
Disusun Oleh:
Hanin Fairuz Salsabila
Irene Silva Pangedongan
Ratnasari Dwiningrum
Sherly Indriana
Tarukan, George Wiliam
Vidya Reza Andini
SMA Negeri 10 Samarinda
Tahun Ajaran 2014-2015
KATA PENGANTAR
Puji syukur kami panjatkan kepada Tuhan Yang Maha Esa, karena berkat limpahan karunia-Nya kami dapat menyelesaikan makalah kimia yang berjudul Senyawa Hidrokarbon dan sifatnya.
Kemudian, tak lupa juga kami ucapkan terima kasih kepada semua pihak yang telah membantu kami dalam penyusunan makalah ini.
Makalah ini berisi pembahasan tentang hidrokarbon, pengelompokan hidrokarbon, dan sifat-sifat yang ada pada hidrokarbon, baik sifat fisik maupun sifat kimianya.
Selanjutnya, kami hanya manusia biasa yang tak luput dari kesalahan. Oleh karena itu, kritik dan saran yang membangun sangat kami harapkan untuk perbaikan makalah ini.
Semoga makalah ini dapat bermanfaat bagi kita semua.
Samarinda, 25 September 2014
DAFTAR ISI
Kata Pengantar ...i
Daftar Isi...ii
BAB I PENDAHULUAN A. Latar Belakang...1
B. Rumusan Masalah...2
BAB II PEMBAHASAN A. Definisi Hidrokarbon ...3
B. Penggolongan Hidrokarbon ...4
C. Rumus Molekul dan Sifatnya ...4
D. Contoh Senyawa yang Mengandung Hidrokarbon ...11
E. Produk-produk Utama yang Bisa di Peroleh ...12
BAB III PENUTUP A. Kesimpulan...14
BAB I
PENDAHULUAN
A. Latar Belakang
Dalam kehidupan sehari-hari hampir semua yang kita gunakan dalam menjalankan aktifitas adalah hasil olahan dari senyawa hidrokarbon, seperti pakaian, alat masak, alat tulis, tempat pensil, dan sebagainya.
Dalam bidang kimia, hidrokarbon adalah sebuah senyawa yang tersusun dari atom hidrogen (H) dan atom karbon (C). Seluruh hidrokarbon memiliki rantai karbon dan atom-atom hidrogen yang berikatan dengan rantai tersebut. Dalam kehidupan sehari-hari banyak kita temui senyawa hidrokarbon, misalnya minyak tanah, bensin, gas alam, plastik, dan lain-lain.
Hingga saat ini terdapat lebih kurang dua juta senyawa hidrokarbon. Sifat senyawa-senyawa hidrokarbon ditentukan oleh struktur dan jenis ikatan koevalen antar atom karbon. Oleh karena itu, untuk memudahkan mempelajari senyawa hidrokarbon yang begitu banyak, para ahli melakukan penggolongan hidrokarbon berdasarkan strukturnya dan jenis ikatan kovalen antar atom karbon dalam molekulnya.
Sejalan dengan kemajuan industri dan teknologi, kebutuhan manusia akan sarana yang memadai makin bertambah. Salah satu sarana itu ialah bahan kimia,baik berupa unsur, senyawa ataupun campuran. Kita telah mengetahui bahwa terdapat 92 jenis unsur di alam. Kebayakan dari unsur tersebut terdapat sebagai persenyawaan. Hanya unsur-unsur yang kurang reaktif saja yang belum ditemukan dalam keadaan bebas. Tetapi, berkat kemajuan IPTEK, kita dapat membebaskan unsur unsur dari persenyawaan.
Begitu banyak manfaat yang diberikan oleh produk - produk dari hidrokarbon, namun masih ada beberapa orang yang belum mengetahui produk – produk yang dihasilkan dari hidrokarbon. Selain itu, tak banyak pula orang yang mengetahui sifat-sifat dari senyawa hidrokarbon, baik sifat kimia maupun sifat fisiknya. Untuk itu dalam makalah ini kami akan membahas mengenai sifat-sifat fisik dan kimia yang terdapat dalam senyawa hidrokarbon, serta produk – produk yang dihasilkan oleh hidrokarbon.
B. Rumusan Masalah
1. Apakah senyawa hidrokarbon itu?
2. Apakah yang dimaksud dengan alkana, alkena, dan alkuna?
4. Apa manfaat senyawa hidrokarbon?
BAB II PEMBAHASAN A. Definisi Hidrokarbon
Hidrokarbon adalah sebuah senyawa yang terdiri dari unsur karbon (C) dan hidrogen (H). Salah satu contoh senyawa hidrokarbon yang sederhana adalah metana, dengan rumus struktur CH4.
Seperti yang telah dikatakan sebelumnya bahwa hidrokarbon merupakan senyawa karbon yang paling sederhana. Namun demikian, hidrokarbon merupakan sumber utama untuk membentuk senyawa hidrokarbon yang lebih besar dan kompleks.
Untuk membuktikan bahwa senyawa hidrokarbon terdiri dari atom karbon dan atom hidrogen, dapat kita lakukan percobaan sederhana, yaitu dengan memanaskan gula dalam tabung reaksi. Bintik air yang terbentuk pada dinding dalam tabung reaksi membuktikan adanya hidrogen.selain itu, pada pembakaran kayu atau kertas akan diperoleh zat berwarna hitam. Zat yang berwarna hitam tersebut merupakan karbon atau arang.
Secara kimiawi, adanya karbon dan hidrogen dapat dilihat ada rumus atom pembentuk molekul atau senyawa tersebut. Misalnya metana (CH4) yang terdiri dari atom C dan atom H.
Dalam kehidupan sehari-hari, karbon lebih dikenal dalam bentuk arang, grafit dan intan. Arang merupakan karbon yang berasal dari kayu atau kertas yang terbakar. Arang sering digunakan sebagai bahan pengadsorpsi zat warna dan sebagai obat sakit perut. Grafit merupakan karbon yang bersifat licin dan dapat menghantarkan listrik. Grafit digunakan sebagai elektroda, bahan pelumas, bahan pembuat pensil, dan juga sebagai bahan pembuat komposit. Intan adalah zat padat bening yang berkilauan dan merupakan zat yang paling keras. Intan digunakan untuk perhiasan dan sebagai alat pemotong. Intan bubuk dugunakan sebagai ampelas.
Pada mulanya, senyawa karbon disebut sebagai senyawa organik karena senyawa itu berasal dari makhluk hidup. Namun seiring berjalannya waktu, senyawa karbon ternyata juga dapat dibuat oleh manusia, maka senyawa organik berubah namanya menjadi senyawa karbon.
Senyawa karbon dapat dibedakan menjadi 2, yaitu senyawa organik (berasal dari makhluk hidup) dan senyawa anorganik (bukan berasal dari makhluk hidup). Senyawa organik dan anorganik memiliki beberapa perbedaan yang terletak pada kereaktifan, titik cair, titik didih, dan juga kelarutannya. Kereaktifan, titik didih, dan titik cair senyawa organik lebih rendah daripada senyawa anorganik. Namun, dalam hal kelarutan, senyawa organik memiliki tingkat kelarutan yang lebih tinggi dibandingkan senyawa anorganik.
B. Penggolongan Hidrokarbon
rantai bercabang atau rantai melingkar. Sedangkan untuk hidrokarbon aromatik, rantainya mengandung cincin atom karbon yang sangat stabil.
C. Rumus Molekul dan Sifatnya
1. Alkana
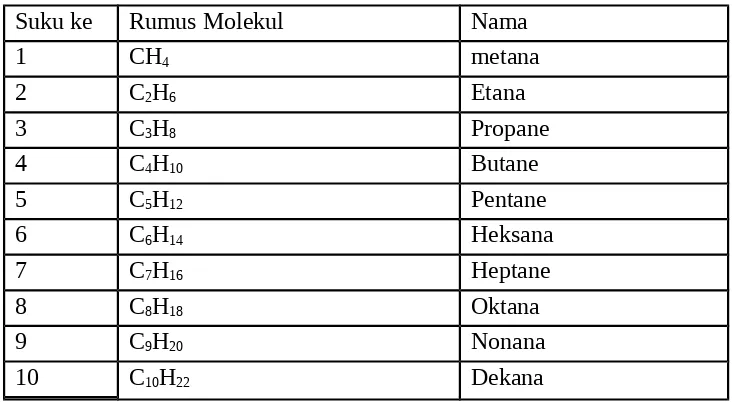
Hidrokarbon jenuh yang paling sederhana merupakan suatu deret senyawa yang memenuhi rumus umum CnH2n+2 dan dinamakan alkana atau parafin. Suku pertama sampai
dengan 10 senyawa alkana dapat diperoleh dengan mensubstitusikan harga n (n menyatakan jumlah atom karbon yang terdapat pada senyawa hidrokarbon) dan ditampilkan dalam tabel berikut.
Tabel Suku pertama sampai dengan 10 senyawa alkana
Suku ke Rumus Molekul Nama
1) Nama alkana bercabang terdiri dari 2 bagian:
Bagian pertama (di bagian depan) merupakan nama cabang
Bagian kedua (di bagian belakang) merupakan rantai induk
2) Rantai induk adalah rantai terpanjang dalam molekul. Jika terdapat 2 atau lebih rantai terpanjang, maka harus dipilih yang mempunyai cabang terbanyak.
3) Rantai induk diberi nama alkana sesuai dengan panjang rantai (lihat tabel diatas) 4) Cabang diberi nama alkil yaitu nama alkana yang sesuai, tetapi dengan mengganti
akhiran –ana menjadi –il. Gugus alkil mempunyai rumus umum: CnH2n+1 dan
dilambangkan dengan R
6) Jika terdapat 2 atau lebih cabang sejenis, harus dinyatakan dengan awalan di, tri, tetra, penta, dst.
7) Cabang-cabang yang berbeda disusun sesuai dengan urutan abjad dari nama cabang tersebut. Awalan primer, sekunder, dan tersier tersier diabaikan.
8) Jika penomoran ekivalen (sama) dari kedua ujung rantai induk, maka harus dipilih sehingga cabang yang harus ditulis terlebih dahulu mendapat nomor terkecil.
Sifat senyawa hidrokarbon alkana terbagi menjadi 2, yaitu:
o Sifat Fisis
1. Pada suhu biasa, metana, etana, propana, dan butana berwujud gas; pentena sampai heptadekana (C17H36) berwujud cair; sedangkan oktadekana (C18H38) dan
seterusnya berwujud padat.
2. Semua alkana merupakan senyawa non polar sehingga sukar larut dalam air. Pelarut yang baik untuk alkana adalah pelarut non polar, misalnya eter. Jika alkana bercampur dengan air, lapisan alkana berada di atas, sebab massa jenisnya lebih kecil daripada 1.
3. Semakin banyak atom C yang dikandungnya (semakin besar nilai Mr), maka titik didih semakin tinggi. Untuk alkana yang berisomer (jumlah atom C sama banyak), semakin banyak cabang, titik didih semakin kecil. Contoh : pada isomer C5H12
yang memiliki 3 isomer :
a. Pentana dengan titik didih 36oC
b. 2-metil butana dengan titik didih 28oC
c. 2,2 dimetil propana dengan titik didih 9oC
4. Alkana merupakan hidrokarbon jenuh (tidak ada ikatan atom C rangkap sehingga jumlah atom H nya maksimal)
5. Alkana disebut juga sebagai golongan parafin karena afinitas kecil (sedikit gaya gabung)
o Sifat Kimia
- Alkana memiliki 2 jenis ikatan kimia, yakni ikatan C-C dan C-H . katan C-C dan C-H tergolong kuat karena untuk memutuskan kedua ikatan tersebut diperlukan energi masingmasing sebesar 347 kJ/mol untuk C-C dan 413 kJ/mol untuk H-H. Energi tersebut dapat diperoleh dari panas seperti dari pemantik api pada pembakaran elpiji di atas.
- Alkana memiliki ikatan C-C yang bersifat non polar dan C-H yang dapat dianggap non polar karena beda keelektronegatifannya yang kecil. Ini yang menyebabkan alkana dapat bereaksi dengan pereaksi non polar seperti oksigen dan halogen.Sebaliknya, alkana sulit bereaksi dengn perekasi polar/ionik seperti asam kuat , basa kuat dan oksidator permanganat.
2. Reaksi alkana dengan oksigen diatas merupakan salah satu dari tiga reaksi alkana akan dibahas di sini, yakni: pembakaran alkana, perengkahan (craking)/eliminasi alkana, dan reaksi substitusi alkana oleh halogen.
- Pembakaran Alkana
- Perengkahan (reaksi eliminasi) Alkana
Alkana umumnya berasal dari gas alam dan minyak bumi. Alkana dapat dimanfaatkan sebagai bahan bakar, pelarut, sumber hidrogen, pelumas, bahan baku untuk senyawa organik lain, serta dapat dimanfaatkan pula sebagai bahan baku industri.
2. Alkena
Tergolong hidrokarbon tidak jenuh yang mengandung satu ikatan rangkap dua antara dua atom C yang berurutan, Alkena mempunyai 2 atom H lebih sedikit dari alkana. Oleh karena itu rumus umumnya menjadi CnH2n+2-2H = CnH2n.
Tabel lima suku pertama alkena
Suku ke Rumus Molekul Nama
1 CH2 = CH2 Etena
2 CH2 = CH - CH3 Propena
3 CH2 = CH - CH2 - CH3 1-Butena
4 CH2 = CH - CH2 - CH2 - CH3 1-Pentena
Aturan penamaan alkena, yaitu:
1) Nama alkena diturunkan dari nama alkana yang sesuai (yang jumlah atom C-nya sama), dengan mengganti akhiran –ana menjadi –ena
2) Rantai induk adalah rantai terpanjang yang mempunyai ikatan rangkap
3) Penomoran dimulai dari saah satu ujung rantai induk sedemikian sehingga ikatan rangkap mendapat nomor terkecil
4) Posisi ikatan rangkap ditunjukkan dengan awalan angka yaitu nomor dari atom C berikatan rangkap yang paling tepi / pinggir (nomor terkecil)
5) Penulisan cabang-cabang sama seperti pada alkana
Sifat senyawa hidrokarbon alkena terbagi menjadi 2, yaitu:
Sifat Fisis
1. Pada suhu kamar, tiga suku yang pertama adalah gas, suku-suku berikutnya adalah cair dan suku-suku tinggi berbentuk padat. Jika cairan alkena dicampur dengan air maka kedua cairan itu akan membentuk lapisan yang saling tidak bercampur. Karena kerpatan cairan alkena lebih kecil dari 1 maka cairan alkena berada di atas lapisan air.
2. Dapat terbakar dengan nyala yang berjelaga karena kadar karbon alkena lebih tinggi daripada alkana yang jumlah atom karbonnya sama
3. Titik didih dan titik leleh alkena naik dengan pertambahan ilai Mr
4. Alkena bersifat non-polar sehingga sukar larut dalam pelarut polar seperti air, tetapi mudah larut dalam pelarut organik non-polar seperti etanol
5. Sifat fisis alkena (titik didih dan titik leleh) dengan Mr yang sama (isomer) untuk rantai lurus lebih tinggi dan rantai bercabang
6. Titik didih senyawa alkena berisomer geomeri, struktur cis lebih tinggi dari trans. Misalnya cis-2-butena (3,7 ◦C) lebih tinggi dari trans-2-butena (0,8 ◦C)
7. C2-C4 berwujud gas C5-C17 berwujud cair, dan C18 dst berwujud padat
Sifat Kimia
Alkena jauh lebih reaktif daripada alkana karena adanya ikatan rangkap. Reaksi yang terjad pada alkena, antara lain:
1. Reaksi Adisi (penambahan atau penjenuhan)
Reaksi Adisi, yaitu pengubahan ikatan rangkap menjadi ikatan tunggal dengan cara mengikat atom lain. Zat-zat yang dapat mengadisi alkena adalah:
i. Gas hidrogen
(H2) CH2 = CH2 + H2 CH3-CH3
ii. Halogen (F2, Cl2, Br2, dan I2)
CH2 =CH – CH3 + Br2 CH2-CH-CH3
Jika alkena menangkap asam halida berlaku aturan markovnikov, yaitu atom H dari asam halida akan terikat pada atom C berikatan rangkap yang telah memiliki atom H lebih banyak
2. Reaksi Pembakaran (oksidasi dengan oksigen)
Pembakaran sempurna alkena menghasilkan CO2 dan H2O.C2H4 + 3O2 2CO2 +
2H2O Pembakaran tidak sempurna alkena menghasilkan CO dan H20.C2H4 + 2O2
2CO + 2H2O
3. Reaksi Polimerisasi
Reaksi polimerisasi adalah reaksi penggabungan molekul-molekul sederhana (monomer) menjadi molekul besar (polimer)
Dalam industri, alkena dibuat dari alkana melalui pemanasan dengan katalis, yaitu dengan proses yang disebut perengkahan atau cracking. Alkena, khususnya suku-suku rendah, adalah bahan baku industri yang sangat penting, misalnya untuk membuat plastik, karet sintetis, dan alkohol.
Di alam, sumber alkena berada dalam jumlah yang kecil, sehingga alkena harus disintesis dari gas alam dan minyak bumi melalui reaksi perekahan.
Kegunaan alkena sebagai bahan baku untuk sintesis senyawa organik di industri, seperti plastik, farmasi dan insektisida.
3. Alkuna
Alkuna merupakan deret senyawa hidrokarbon tidak jenuh yang dalam tiap molekulnya mengandung satu ikatan rangkap 3 diantara dua atom C yang berurutan. Untuk membentuk ikatan rangkap 3 atau 3 ikatan kovalen diperlukan 6 elektron, sehingga tinggal satu elektron pada tiap-tiap atom C tersisa untuk mengikat atom H. Jumlah atom H yang dapat diikat berkurang dua, sehingga rumus umumnya menjadi CnH2n+2 - 4H = CnH2n-2
Aturan penamaan alkuna, yaitu:
1) Nama alkuna diturunkan dari nama alkan yang sesuai dengan mengganti akhiran –ana
menjadi –una
2) Tata nama alkuna bercabang sama seperti penamaan alkena Ciri-ciri alkuna, antara lain adalah:
o Hidrokarbon tak jenuh mempunyai ikatan rangkap tiga
o Sifat-sifatnya menyerupai alkena, tetapi lebih reaktif
o Pembuatan : CaC2 + H2O → C2H2 + Ca(OH)2
o Sifat-sifat:
- Suatu senyawa endoterm, maka mudah meledek
- Suatu gas, tak berwarna dan baunya khas
- Pada pengelasan: dibakar dengan O2 memberi suhu yang tinggi (± 3000 ◦C), dipakai
untuk mengelas besi dan baja
- Untuk penerangan
- Untuk sintesis senyawa lain
Sifat senyawa hidrokarbon alkena terbagi menjadi 2, yaitu:
Sifat Fisis
Titik didih mirip dengan alkana dan alkena. Semakin tinggi suku alkena, titik didih semakin besar. Pada suhu kamar, tiga suku pertama berwujud gas, suku berikutnya berwujud cair sedangkan pada suku yang tinggi berwujud padat.
Sifat Kimia
1. Adanya ikatan rangkap tiga yang dimiliki alkuna memungkinkan terjadinya reaksi adisi, polimerisasi, substitusi dan pembakaran
2. Reaksi adisi pada alkuna
3. Reaksi alkuna dengan halogen (halogenisasi) 4. Reaksi alkuna dengan hidrogen halida 5. Reaksi alkuna dengan hidrogen 6. Polimerisasi alkuna
7. Substitusi alkuna Substitusi (pengantian) pada alkuna dilakukan dengan menggantikan satu atom H yang terikat pada C=C di ujung rantai dengan atom lain.
8. Pembakaran alkuna Pembakaran alkuna (reaksi alkuna dengan oksigen) akan menghasilkan CO2 dan H2O.CH = CH + 5O2 4CO2 + 2H2O
Alkuna yang mempunyai nilai ekonomis penting hanyalah etuna (asetilena), C2H2.
Gas asetilena digunakan untuk mengelas besi dan baja. Reaksi pebentukan etuna:
4CH4 (g) + 3O2 (g) 2C2H2 (g) + 6H2O (g)
CaC2 (s) + 2H2O (l) Ca(OH)2 (aq) + C2H2 (g)
D. Contoh Senyawa yang Mengandung Hidrokarbon
Senyawa yang paling banyak mengandung hidrokarbon adalah minyak bumi. Berdasarkan kandungan senyawanya, minyak bumi dapat dibagi menjadi golongan hidrokarbon serta senyawa-senyawa logam.
1. Hidrokarbon
Golongan hidrokarbon-hidrokarbon yang utama adalah parafin, olefin, naften, dan aromat.
Parafin adalah kelompok senyawa hidrokarbon jenuh berantai lurus (alkana), CnH2n+2.
Contohnya adalah metana (CH4), etana (C2H6), n-butana (C4H10), isobutana (2-metil
propana, C4H10), isopentana (2-metilbutana, C5H12), dan isooktana (2, 2, 4-trimetil
pentana, C8H18
1.2 Olefin
Olefin adalah kelompok senyawa hidrokarbon tidak jenuh, CnH2n. Contohnya etilena
(C2H4), propena (C3H6), dan butena (C4H8).
1.3 Aromatik
Aromatik adalah hidrokarbon-hidrokarbon tak jenuh yang berintikan atom-atom karbon yang membentuk cincin benzen (C6H6). Contohnya benzen (C6H6),
metilbenzen (C7H8), dan naftalena (C10H8).
1.4 Naftena
Naftena adalah senyawa hidrokarbon jenuh yang membentuk struktur cincin dengan rumus molekul CnH2n. Contohnya adalah siklopentana (C5H10), metilsiklopentana
(C6H12) dan sikloheksana (C6H12).
2. Non Hidrokarbon
Selain senyawa-senyawa yang tersusun dari atom-atom karbon dan hidrogen, di dalam minyak bumi ditemukan juga senyawa non hidrokarbon seperti belerang, nitrogen, oksigen, vanadium, nikel dan natrium yang terikat pada rantai atau cincin hidrokarbon.
2.1 Belerang
Belerang terdapat dalam bentuk hidrogen sulfida (H2S), belerang bebas (S),
merkaptan (R-SH, dengan R=gugus alkil), sulfida (R-S-R’), disulfida (R-S-S-R’) dan tiofen (sulfida siklik).
2.2 Oksigen
Oksigen biasanya terikat dalam gugus karboksilat dalam asam-asam naftenat (2,2,6-trimetilsikloheksankarboksilat, C10H18O2) dan asam-asam lemak (alkanoat), gugus
hidroksi fenolik dan gugus keton.
2.3 Nitrogen
Senyawa-senyawa nitrogen dibagi menjadi zat-zat yang bersifat basa seperti 3-metilpiridin (C6H7N) dan kuinolin (C9H7N) serta zat-zat yang tidak bersifat basa
seperti pirol (C4H5N), indol (C8H7N) dan karbazol (C12H9N).
3. Senyawa Logam
Minyak bumi biasanya mengandung 0,001-0,05% berat logam. Kandungan logam yang biasanya paling tinggi adalah vanadium, nikel dan natrium.
1. Gas-gas hidrokarbon ringan
Komponen-komponennya adalah senyawa-senyawa parafinik dengan titik didih normal < 30 oC dan pada tekanan atmosfer berwujud gas, yaitu metana (CH
4), etana (C2H6), propana
(C3H8), isobutana (i-C4H10) dan n-butana (n-C4H10). Gas-gas tersebut lazim disebut sebagai
gas kilang.
2. Bensin (gasolin)
Mulanya bensin adalah produk utama dalam industri minyak bumi yang merupakan campuran kompleks dari ratusan hidrokarbon dan memiliki rentang pendidihan antara 30-200 oC.
3. Minyak Bakar
Minyak bakar terbagi atas lima jenis, yaitu minyak bakar no. 1, no. 2, no. 4, no. 5 dan no. 6. Minyak bakar no. 1 sangat mirip kerosin tetapi memiliki titik tuang dan titik akhir rentang pendidihan yang lebih tinggi. Minyak bakar no. 2 (IDO=Industrial Diesel Oil) sangat mirip dengan minyak diesel otomotif. Minyak bakar no. 1 dan no. 2 serta kerosin, bahan bakar pesawat jet dan minyak diesel biasa disebut sebagai BBM distilat (distillate fuels). Minyak bakar no. 4, no. 5 dan no. 6 disebut BBM residu karena berasal dari sisa distilasi minyak bumi mentah pada tekanan atmosferik.
4. Karosin, Bahan Bakar pesawat jet, dan minyak diesel
Ketiga kelompok ini memiliki rentang pendidihan yang mirip. Kerosin disebut juga dengan minyak tanah dan digunakan sebagai bahan bakar rumah tangga. Rentang pendidihannya antara 175-275 oC
5. Produk-produk lain
Produk-produk lainnya seperti minyak pelumas, petroleum waxes (lilin), petroleum greases (gemuk), aspal dan kokas
A. KESIMPULAN
Senyawa hidrokarbon merupakan senyawa karbon yang paling sederhana. Dari namanya, senyawa hidrokarbon adalah senyawa karbon yang hanya tersusun dari atom hidrogen dan atom karbon. Dalam kehidupan sehari-hari banyak kita temui senyawa hidrokarbon, misalnya minyak tanah, bensin, gas alam, plastik dan lain-lain.
Hampai saat ini telah dikenal lebih dari 2 juta senyawa hidrokarbon. Untuk mempermudah mempelajari senyawa hidrokarbon yang begitu banyak, para ahli mengolongkan hidrokarbon berdasarkan susunan atom-atom karbon dalam molekulnya.
Hidrokarbon pada kehidupan sehari-hari sangatlah penting dan memiliki kegunaan yang tidak dapat digantkan oleh senyawa lain dalam penggunaan sehari-hari dalam bidang sandang, pangan serta papan. Dalam penggunaannya pun memiliki peran tersendiri dalam kegunaannya sehari-hari.
B. SARAN