BAB I PENDAHULUAN
A. Latar Belakang
Metode pemisahan merupakan aspek penting dalam bidang ilmu kimia karena kebanyakan materi yang terdapat dialam dapat berupa campuran. Untuk memperoleh materi murni dari suatu campuran , kita harus melakukan suatu pemisahan. Berbagai teknik pemisahan dapat diterapkan untuk memisahkan campuran .
Seiring dengan kemajuan zaman yang semakin pesat di negara-negara berkermbang akan selalu diikuti pula dengan kemajuan ilmu pengetahuan yang semakin marak di bidang teknologi. Salah satu diantaranya adalah pengembangan di bidang Biologi Molekuler. Bidang ilmu pengetahuan Biologi Molekuler ini telah dimulai pada akhir abad ke 19, setelah rnetode elektroforesis ditemukan dan dipakai untuk menganalisa berbagai kegiatan penelitian di bidang Kimia, Biologi (Genetika, Taksonomi dan Bio-sistematik). Ringkasnya metode elektroforesis ini mulai berkembang akhir abad ke 19 setelah ditemukan penelitian yang menunjukkan adanya efek dari listrik terhadap partikel-partikel atau molekul-molekul yang bermuatan listrik, dalam ha1 ini termasuk juga protein (Pornet, Quincke, Hardy. dalam Richardson dkk, 1986). menurut passteur dkk. (1988) elektroforesis berasal dari bahasa Junani yangmempunyai arti transport atau perpindahan melalui partikel-partikel listrik.
Penggunaan data khemotaksonomi pada level protein diketahui dapat digunakan untuk identifikasi organisme pada level spesies dan khususnya untuk subtypingbakteri dalam spesies yang sama berdasarkan analisis perbandingan profil protein dan polipeptida (Towner & Cockayne, 1995). Profil protein mikrobia diperoleh dengan melarutkan komponen sel mikrobia, baik yang diperoleh dari sel utuh ataupun dari fraksi subselular, dan kemudian dilakukan
pemisahan secara elektroforesis dalam suatu matriks gel seperti poliakrilamid atau pati. Tergantung pada tipe sistem elektroforesis yang digunakan, protein dipisahkan berdasarkan sifat-sifat fisikokimiawinya yang meliputi ukuran, muatan, dan titik isoelektriknya. Protein yang telah dipisahkan, atau subunit komponen protein, kemudian dapat dideteksi dengan teknik pewarnaan untuk menghasilkan profil protein.
Salah satu teknik yang sering digunakan untuk analisis protein adalah SDS-PAGE (Sodium Dodecylsulphate polyacrilamid Gel Electrophoresis). Pola pita protein sel mikrobia pada PolyAcrilamid GelEelectrophoresis(PAGE) bersifat spesifik dan reprodusibel. Protein didenaturasi dengan menggunakan panas atau deterjen, dan untuk menghasilkan subunit polipeptida yang kemudian dapat dipisahkan dalam elektroforesis berdasarkan berat molekulnya. Agar diperoleh hasil yang maksimal, maka kultur bakteri yang akan dianalisis ditumbuhkan terlebih dahulu dalam medium kaya dan dilakukan pemanenan sel pada akhir fase eksponensial atau awal fase stasioner.
Metode SDS-PAGE telah dibuktikan mampu membedakan sejumlah besar strain bakteri karena memiliki tingkat resolusi diskriminatif sampai level spesies dan subspesies atau antar strain dalam satu spesies. Metode ini juga terbukti memiliki kesesuaian dengan metode hibridisasi DNA-DNA. Nilai similaritas yang diperoleh dari SDS-PAGE cenderung sama dengan nilai similaritas hasil hibridisasi DNA sebesar 70 % (Towne & Cockayne, 1995; Vandamme et al., 1996).
B. Tujuan
a. Memahami konsep teknik elektroforesis khususnya SDS-PAGE dan memiliki kompetensi melakukannya
b. Mengidentifikasi suatu protein berdasarkan berat molekulnya
Pemfokusan isoelektrik adalah merupakan satu modifikasi elektroforesis. Dalam kes ini, protein dipisahkan oleh cas didalam suatu medan elektrik pada matrik gel yang telah diwujudkan kecerunan pH menggunakan amfolit (ampholytes). Protein difokuskan atau migrasi ke lokasi didalam kecerunan dimana pH sama dengan pI protein tersebut (Rajah 6).
BAB II
TINJAUAN PUSTAKA
A. Elektroforesis
Elektroforesis adalah metode pemisahan berdasarkan perbedaan mobilitas analit menunjukkan dalam medan listrik diterapkan. metode elektroforetik dapat diterapkan untuk pemisahan dari suatu sampel dengan variety luas, termasuk protein, asam nukleat, asam amino dan karbohidrat. pemisahan dapat dilakukan pada analisis serta skala preparatif. keuntungan utama atas metode khromatografi cair adalah efisiensi yang lebih tinggi dari pemisahan elektroforesis. hal ini terutama berlaku bagi molekul besar.(Andreas Manz, et.al, 2010)
Elektroforesis adalah pergerakan partikel bermuatan listrik atau molekul dalam medium konduktif di bawah pengaruh medan listrik diterapkan. media konduktif biasanya buffer berair, juga disebut sebagai elektrolit atau run penyangga. campuran analit dimasukkan ke dalam medium yang mengandung jangka penyangga dan medan listrik diterapkan. Dalam contoh yang ditunjukkan pada gambar 2.1 campuran analit mengandung molekul bermuatan negatif. berdasarkan atas permohonan dari medan listrik, anion mulai bergerak menuju elektroda positif (anoda). perbedaan muatan dan ukuran menyebabkan mobilitas
yang berbeda dan dengan demikian pemisahan komponen sampel yang berbeda. sama, ion bermuatan positif bergerak menuju katoda dalam medan listrik diterapkan.(Andreas Manz, et.al, 2010)
Gambar. 2.1. Prinsip Pemisahan Elektroforesis (Andreas Manz, et.al, 2010)
Pemisahan elektroforesis dapat dilakukan dalam larutan bebas atau dalam larutan yang mengandung matriks non-konduktif seperti agarosa atau poliakrilamid gel. gratis pemisahan berbasis solusi, capilaries bore sempit digunakan. pemisahan ion analit terjadi karena perbedaan dalam mobilitas, perbedaan yaitu di tuntut untuk rasio ukuran. dua analit hanya dapat dipisahkan jika mereka memiliki biaya yang berbeda untuk rasio ukuran. pemisahan analit dalam gel juga didasarkan pada perbedaan dalam mobilitas. tambahan, gel memiliki efek pemisahan. compoundes besar terbelakang lebih dari senyawa yang lebih kecil. ini berarti bahwa dalam elektroforesis gel dua senyawa dengan biaya dua rasio ukuran yang sama dapat dipisahkan selama mereka berbeda dalam ukuran. (Andreas Manz, et.al, 2010)
Jenis- Jenis Elektroforesis
Elektroforesis gel ialah elektroforesis yang menggunakan gel sebagai fase diam untuk memisahkan molekul-molekul. Awalnya elektoforesis gel dilakukan dengan medium gel kanji (sebagai fase diam) untuk memisahkan biomolekul yang
lebih besar seperti protein-protein. Kemudian elektroforesis gel berkembang dengan menjadikan agarosa dan poliakrilamida sebagai gel media.
Elektroforesis kertas adalah jenis elektroforesis yang terdiri dari kertas sebagai fase diam dan partikel bermuatan yang terlarut sebagai fase gerak, terutama ialah ion-ion kompleks. Pemisahan ini terjadi akibat adanya gradasi konsentrasi sepanjang sistem pemisahan. Pergerakan partikel dalam kertas tergantung pada muatan atau valensi zat terlarut, luas penampang, tegangan yang digunakan, konsentrasi elektrolit, kekuatan ion, pH, viskositas, dan adsorpsivitas zat terlarut.
Elektroforesis Gel (GE)
Elektroforesi gel merupakan salah satu teknik utama dalam biologi molekular. Prinsip dasar teknik ini adalah bahwa DNA, RNA, atau protein dapat dipisahkan oleh medan listrik. Dalam hal ini, molekul-molekul tersebut dipisahkan berdasarkan laju perpindahannya oleh gaya gerak listrik di dalam matriks gel. Laju perpindahan tersebut bergantung pada ukuran molekul bersangkutan. Elektroforesis gel biasanya dilakukan untuk tujuan analisis, namun dapat pula digunakan sebagai teknik preparatif untuk memurnikan molekul sebelum digunakan dalam metode-metode lain seperti spektrometer massa, PCR, kloning, sekuensing DNA, atau immuno-blotting yang merupakan metode-metode karakterisasi lebih lanjut.
Gel yang digunakan biasanya merupakan polimer bertautan silang (crosslinked) yang porositasnya dapat diatur sesuai dengan kebutuhan. Untuk memisahkan protein atau asam nukleat berukuran kecil (DNA, RNA, atau oligonukleotida), gel yang digunakan biasanya merupakan gel poliakrilamida, dibuat dengan konsentrasi berbeda-beda antara akrilamida dan zat yang memungkinkan pertautan silang (cross-linker), menghasilkan jaringan poliakrilamida dengan ukuran rongga berbeda-beda. Untuk memisahkan asam nukleat yang lebih besar (lebih besar dari beberapa ratus basa), gel yang digunakan adalah agarosa (dari ekstrak rumput laut) yang sudah dimurnikan.
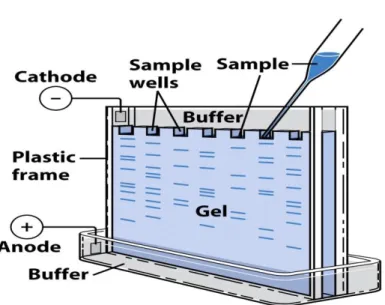
Dalam proses elektroforesis, sampel molekul ditempatkan ke dalam sumur (well) pada gel yang ditempatkan di dalam larutan penyangga, dan listrik dialirkan kepadanya. Molekul-molekul sampel tersebut akan bergerak di dalam matriks gel ke arah salah satu kutub listrik sesuai dengan muatannya. Dalam hal asam nukleat, arah pergerakan adalah menuju elektrodapositif, disebabkan oleh muatan negatif alami pada rangka gula-fosfat yang dimilikinya. Untuk menjaga agar laju perpindahan asam nukleat benar-benar hanya berdasarkan ukuran (yaitu panjangnya), zat seperti natrium hidroksida atau formamida digunakan untuk menjaga agar asam nukleat berbentuk lurus. Sementara itu, protein didenaturasi dengan deterjen (misalnya natrium dodesil sulfat, SDS) untuk membuat protein tersebut berbentuk lurus dan bermuatan negatif.
Setelah proses elektroforesis selesai, dilakukan proses pewarnaan (staining) agar molekul sampel yang telah terpisah dapat dilihat. Etidium bromida, perak, atau pewarna "biru Coomassie" (Coomassie blue) dapat digunakan untuk keperluan ini. Jika molekul sampel berpendar dalam sinar ultraviolet (misalnya setelah "diwarnai" dengan etidium bromida), gel difoto di bawah sinar ultraviolet. Jika molekul sampel mengandung atom radioaktif, autoradiogram gel tersebut dibuat.
Pita-pita (band) pada lajur-lajur (lane) yang berbeda pada gel akan tampak setelah proses pewarnaan; satu lajur merupakan arah pergerakan sampel dari "sumur" gel. Pita-pita yang berjarak sama dari sumur gel pada akhir elektroforesis mengandung molekul-molekul yang bergerak di dalam gel selama elektroforesis dengan kecepatan yang sama, yang biasanya berarti bahwa molekul-molekul tersebut berukuran sama. "Marka" atau penanda (marker) yang merupakan campuran molekul dengan ukuran berbeda-beda dapat digunakan untuk menentukan ukuran molekul dalam pita sampel dengan meng-elektroforesis marka tersebut pada lajur di gel yang paralel dengan sampel. Pita-pita pada lajur marka tersebut dapat dibandingkan dengan pita sampel untuk menentukan ukurannya. Jarak pita dari sumur gel berbanding terbalik terhadap logaritma ukuran molekul.
DNA dapat ditentukan ukurannya dengan melakukan migrasi didalam gel agarose atau gel poliakrilamid. Migrasi DNA didalam gel ini biasa disebut dengan elektroforesis. Untuk dapat divisualisasikan, maka DNA yang ada di gel harus diwarnai dengan ethidium bromida kemudian dilihat diatas sinar UV.
DNA merupakan molekul bermuatan negatif, sehingga bila diletakkan di medan listrik, DNA akan bergerak (migrasi) dari kutub negatif ke kutub positif. Pergerakan kecepatannya tergantung dari :
a. Ukuran molekul DNA
b. Kerapatan media gel yang dilalui DNA c. Arus listrik yang diberikan
Sebelum dilakukan elektroforesis, suspensi DNA harus dicampur dengan penyangga muatan perwarna loading buffer (dye), yang berfungsi untuk :
1. Menambah densitas, sehingga DNA berada dibagian bawah dari sumur
2. Perwarna untuk memudahkan meletakkan contoh DNA kedalam sumur.
3. Dapat bergerak ke arah anoda dengan laju yang dapat diperkirakan. Manfaat elektroforesis gel antara lain untuk mengetahui ukuran fragmen DNA dari produk PCR, memisahkan produk DNA dari hasil digesti yang berbeda ukuran, kemudian di-sequencing, dan juga untuk pemurnian atau purifikasi DNA. Elektroforesis dapat diaplikasikan untuk berbagai macam kegiatan sebagai berikut.
a. Membandingkan gen homolog dari sspesies yang berbeda, mengetahui susunan sekuens berbagai genom
b. DNA Fingerprinting
c. Mendeteksi kelainan genetik.
d. Mendeteksi lokasi dan jumlah mRNA dalam sel atau jaringan tertentu
e. Mengetahui aktivitas gen selama perkembangan berbagai tipe sel organisme atau percobaan perlakuan gen
f. Mempelajari evolusi tingkat molecular g. Mengetahui variasi genetik yang ada di alam
h. Menentukan atau mengidentifikasi berat molekul DNA, RNA, dan protein tertentu.
i. Mengidentifikasi persamaan dan perbedaan genetik antar individu j. Mengetahui jumlah fragmen DNA yang diklon dalam rekombinan
DNA plasmid
k. Menganalisa fragmen DNA yang diamplifikasi lewat PCR
Dalam elektroforesis gel, pemisahan terjadi dalam media hidrogel elektrik non-konduktif seperti agarosa atau poliakrilamid (PA) yang berisi, buffer elektrolit. pori-pori fungsi gel molekuler saringan, yang menghambat molekul bermigrasi menurut ukuran mereka. Selanjutnya, gel bertindak sebagai media pendukung anticonvective, yang dapat meminimalkan difusi dari molekul sampel, dan dengan demikian mengurangi pelebaran pita. karenanya, nomor plat tinggi dan resolusi tinggi dapat dicapai, terutama untuk molekul berat molekul tinggi seperti DNA atau protein.a jumlah yang sangat besar senyawa karenanya dapat dipisahkan dalam bentuk tunggal .. sebagai EOF ditekan dalam elctroporesis gel, hanya analit dengan muatan bersih dapat dipisahkan. senyawa netral tidak bermigrasi melalui gel bawah pengaruh medan listrik diterapkan. elektroforesis gel adalah agak lambat dan tenaga kerja - metode intensif, yang tidak mudah otomatis.
B. SDS-PAGE
SDS-PAGE merupakan suatu teknik elektroforesis yang menggunakan polyacrylamide sebagai bahan pemisah. SDS-PAGE banyak digunakan dalam praktikum biologi molekuler, genetik, biokimia, dan biomedik. SDS-PAGE biasanya digunakan untuk memisahkan protein berdasarkan sifat electrophoretic mobility (pemisahan komponen atau molekul bermuatan berdasarkan perbedaan tingkat migrasi dan berat molekulnya (BM) dalam sebuah medan listrik). Protein yang dipisahkan dengan SDS-PAGE dapat
dikarakterisasi berdasarkan berat molekulnya dengan satuan Kilo Dalton (kDa). Satu dalton sama dengan satu hidrogen molekul
SDS-PAGE merupakan teknik purifikasi skala kecil yang menghasilkan pemisahan suatu protein berdasarkan berat molekulnya dalam band (pita) spesifik yang tampak pada gel polyacrylamide. Teknik purifikasi dalam skala besar kita dapatkan degnan menggunakan chromatography.
Gel acrylamide alam SDS-PAGE diletakkan diantara dua plat kaca. Ada dua macam gel yang digunakan, yaitu main atai separating gel dan stacking gel. Main gel merupakan gel yang komposisinya paling banyak dan terletak dibagian bawah alat. Main gel berfungsi untuk memisahkan protein berdasarkan berat molekulnya. Stacking gel terletak pada bagian atas, digunakan untuk mencetak sumuran (sekat pemisah untuk penempatan sempel). Protein tertarik ke bagian bawah oleh arus listrik. Protein yang memiliki berat molekul paling kecil bergerak cepat sehingga tertarik sampai bagian bawah gel, sedangkan protein yang memiliki berat molekul paling besar akan berada pada bagian atas dari gel. Protein marker digunakan sebagai standart untuk menentukan berat molekul dari sampel.
Sejumlah mode pemisahan yang mungkin. Dalam gel native elektroforesis dibebankan analit dibedakan menurut mobilitas jelas mereka, dan ukuran. natrium dedocylsulfate-poliakrilamida gel elektroforesis (SDS-PAGE) analit diperlakukan sedemikian rupa sehingga mereka semua menunjukkan muatan yang sama untuk sixe rasio. maka mereka hanya dipisahkan oleh perbedaan ukuran mereka.
Gambar 2.3 Elektroforesis Gel (GE)
Gel Media
Elektroforesis Gel poliakrilamida termasuk salah satu elektroforesis yang umum digunakan selain elektroforesis gel Agarosa dan memiliki kelebihan yaitu : mudah atau cepat pengerjaanya, murah harganya, pemisahan suatu makromolekul biologic, biaya pemisahan yang sangat besar.
Menurut Stenesh dalam Titrawani (1996) teknik elektroforesis dapat dibedakan menjadi dua cara, yaitu : elektroforesis larutan (moving boundary electrophoresis) dan elektroforesis daerah (zone electrophoresis). Pada teknik elektroforesis larutan, larutan penyangga yang mengandung makro-molekul ditempatkan dalam suatu kamar tertutup dan dialiri arus listrik. Kecepatan migrasi dari makro-molekul diukur dengan jalan melihat terjadinya pemisahan dari molekul (terlihat seperti pita) di dalam pelarut. Sedangkan teknik elektroforesis daerah adalah menggunakan suatu bahan padat yang berfungsi sebagai media penunjang yang berisi (diberi) larutan penyangga. Media penunjang yang biasa dipakai adalah gel agarose, gel pati, gel poliakrilamida dan kertas sellulose poliasetat. Adapaun menurut Sargent & George (1975) elektroforesis daerah disebut sebagai elektroforesis gel dengan dua buah model yaitu horizontal dan vertikal. Metode yang biasa digunakan adalah model horizontal, karena mempunyai beberapa keuntungan yaitu peralatan yang digunakan sangat
sederhana, relatif murah dan pemisahan untuk enzim tertentu dapat menghasilkan pemisahan yang lebih baik.
Gel yang digunakan dalam elektroforesis ada 3 macam:
1. Gel poliakrilamida denaturasi, berfungsi dalam penanda oligonukleotida dan menganalisis pemanjangan primer.
2. Gel alkalin agarosa, berfungsi untuk memisahkan rantai DNA yang berukuran besar.
3. Gel agarosa formaldehid denaturasi, berfungsi untuk menyediakan sistem elektroforesis RNA pada Ukuran Standar (Davis dkk. 1994: 151).
Gel agarosa merupakan turunan desulfonated agar-agar, suatu senyawa yang dapat diisolasi dari membran sel ganggang. untuk persiapan gel, agarosa dilarutkan dalam buffer yang dipilih, dipanaskan sampai titik didih dan dituangkan ke dalam tangki elektroforesis. pada pendinginan gelasi terjadi. pori-pori di agarosa gel cukup besar mulai dari 150 nm konsentrasi 1% (10 mg mL-1) sampai 500 nm FUNDS konsentrasi 0,16% (1,6 mg/mL-1). pori-pori besar hanya terbatas untuk protein berat molekul yang sangat tinggi atau asam nukleat. untuk sebagian analit, agarosa gel nonrestrictive.
Gel Poliakrilamida disiapkan oleh co-polimerisasi akrilamida dan agen cross-linking, NN metilen - bisacrylamide dalam buffer elektroforesis dipilih. ukuran pori dan sifat pengayakan maka molekul PA gel tergantung pada konsentrasi total serta tingkat silang C%
Pergerakan DNA pada elektroforesis dipengaruhi oleh beberapa faktor sebagaberikut:
1. Ukuran molekul DNA.
Molekul DNA kecil akan melintasi gel lebih cepat karena ruang gerak yang tersedia untuk melintasi gel lebih banyak.
Konsentrasi agarosa yang semakin tinggi menyebabkan molekul-molekul DNA sukar melewati gel. Konsentrasi gel tinggi mempermudah DNA berukuran kecil melewati gel, sedangkan konsentrasi gel rendah mempermudah molekul DNA berukuran besar untuk melintasi gel.
3. Bentuk Molekul
Molekul yang berbentuk supercoil atau elips akan bergerak lebih cepat melewati gel.
4. Densitas muatan
Molekul dengan densitas tinggi akan lebih cepat bergerak dibandingkan molekul dengan densitas yang rendah. Densitas merupakan jumlah muatan per unit volume molekul.
5. Pori-pori gel.
Pori-pori yang lebih besar akan mempermudah pergerakan DNA melewati gel, sedangkan pori-pori yang lebih kecil akan lebih sulit dilalui oleh molekul DNA.
6. Voltase.
Voltase tinggi akan menyebabkan cepatnya pergerakan molekul DNA. Hal tersebut dikarenakan oleh tingginya muatan positif yang ditimbulkan. 7. Larutan buffer.
Buffer dengan kadar ion tinggi akan menaikkan konduktansi listrik sehingga migrasi DNA akan lebih cepat.
Aliran Elektroforentik.
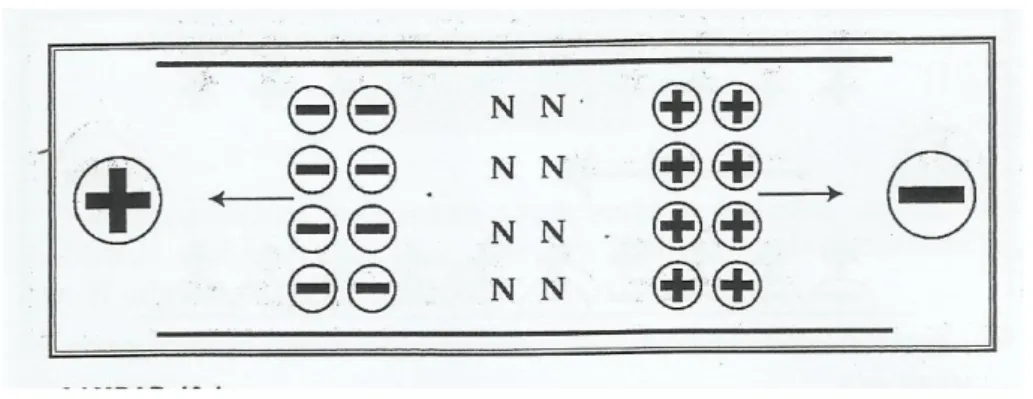
Sifat alamiah ion-ion selalu bergerak menuju kutub listrik yang berlawanan, kation akan bergerak menuju katoda (kutub listrik negatif), sebaliknya anion akan bergerak menuju anoda (kutub listrik positif). Akan tetapi, molekul netral tidak akan bergerak. Aliran ion-ion menuju kutub listrik yang berlawanan ini disebut aliran elektroforetik yang diperlihatkan dalam gambar 2. Aliran elektroforetik inilah yang merupakan dasar pemisahan dalam elektroforesa klasik (Sumar Hendayana, Ph.D, 2006).
Gambar 2.4. pengaruh medan listrik terhadap ion-ion (aliran elektroforetik) (sumber: L. Thompson, et.al (1997))
Aliran elektroosmotik.
Dalam elektroforesik kapiler, pipa kapiler yang terbuat dari gelas menggantikan media kertas atau lempeng silika gel pada elektroforesis klasik. Di sini, latutan buffer dipakai sebagai pengisis pipa kapiler. Bila permukaan pipa kapiler tersebut berkontak dengan larutan dalam air maka permukaan gelas akan dilapisi anion (SiO-) yang berasal dari reaksi hidrolisis silika dengan air sehingga permukaan pipa kapiler tersebut bermuatan negatif. Akibatnya kation-kation yang berasal dari buffer menutupi lapisan negatif pipa kapiler dan merupakan lapisan kedua pada permukaan pipa kapiler. Kalau arus listrik searah bertegangan tinggi dialirkan diantara ujung-ujung pipa kapiler maka kation-kation yang melapisi permukaan pipa kapiler tersebut akan bergerak menuju katoda (kutub negatif). Aliran lapisan kation yang cepat ke katoda ini dikenal dengan aliran elektrostatik. Aliran elektroosmotik diilustrasikan dalam gambar 3(Sumar Hendayana, Ph.D, 2006).
Gambar 2.5. Pengaruh medan listrik terhadap ion-ion (aliran elektroosmotik) (sumber: L. Thompson, et.al (1997))
Karena cepatnya aliran elektroosmotik maka aliran elektroosmotik akan lebih dominan dibandingkan dengan aliran elektroforetik. Dengan demikian secara keseluruhan aliran menuju ke satu arah yaitu ke katoda. Jadi dalam kenyataannya semua molekul baik yang bermuatan maupun netral akan terbawa ke katoda. Tentunnya ion positif (kation) bergerak menuju katoda paling cepat karena aliran elektroforetiknya searah dengan aliran elektroosmotik. Molekul netral menepati urutan tercepat kedua dan ion negatif (anion) paling lambat karena aliran elektroforentiknya berlawanan dengan aliran elektroosmotik(Sumar Hendayana, Ph.D, 2006).
Gerakan ion-ion atau molekul menuju katoda dalam eksperimen elektroforesis kapiler diperhatikan dalam gambar 3. Untuk lebih memahami konsep gerakan ion-ion atau molekul netral ke katoda dapat digunakan suatu analogi. Aliran elektroosrnotik dapat dianalogikan sebagai aliran sungai yang deras. Ion positif (kation) dapat dianalogikan sebagai ikan yang sedang berenang ke hilir sedangkan ion negatif (anion) dapat dianalogikan sebagai ikan yang sedang berenang ke hulu, dan molekul netral dapat dianalogikan sebagai ikan mati. Bila air sungai mengalir dengan deras maka semua ikatan yang ada dalam sungai akan menuju ke hilir.
Kecepatan ion-ion atau molekul bermuatan (solut) menuju katoda dipengaruhi oleh medan listrik yang dapat di formulasi sebagai berikut
V =
efE +
eoE
V menyatakan kecepatan solut menuju katoda, ef adalah mobilitas elektroforetik, eo adalah mobilitas elektroosmotik, dan E adalah tegangan listrik(Sumar
Gambar 2.6 Pengaruh aliran elektroosmotik dalam elektroforesis kapiler (sumber: L. Thompson, et.al (1997)
C. Instrumentasi Elektroforesis 1. Elektroforesis Gel
Sebuah ruang elektroforesis dengan waduk penyangga dan thermostat pendingin dan komponen utama yang diperlukan untuk elektroforesis gel. pemisahan dapat dilakukan secara vertikal atau horizontal. catu daya memberikan tegangan typi xallally 200-500 V dengan arus listrik cof 400 Artikel Baru 100. elektroda dicelupkan ke dalam waduk penyangga di setiap sisi gel. untuk sebagian pemisahan biomolekuler, pH Sochen bahwa analit bermuatan negatif. sehingga analit bermigrasi ke arah pada anoda. Seluruh instrumen dalam kotak isolasi untuk melindungi pengguna dari tegangan tinggi .
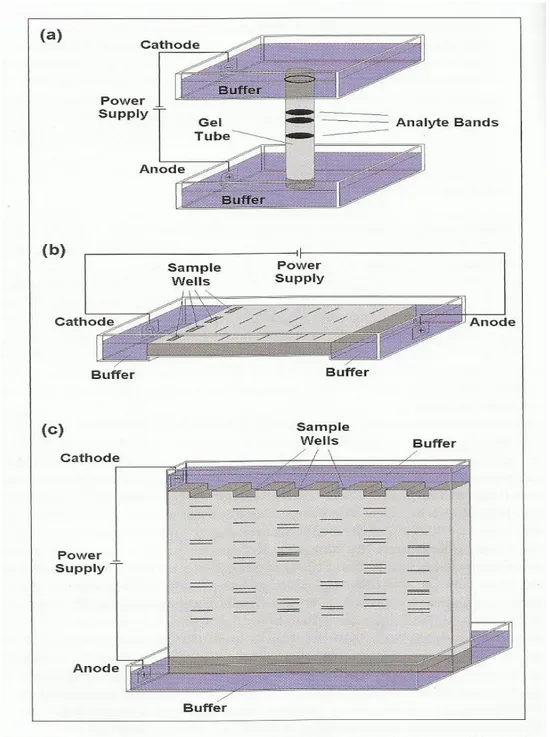
Ruang elektroforesis mengandung matriks gel direndam dalam buffer elektrolit. gel vertikal dapat dipolimerisasi dalam tabung kaca atau Perspex dengan 0,5 sampai 1 cm id dan 3 sampai 10 cm panjangnya. alternatif gel dapat berperan sebagai lempengan persegi panjang tipis di mana beberapa sampel dapat dijalankan secara paralel. gel slab dapat dipolimerisasi pada foil lembam untuk pemisahan horizontal atau dituangkan ke dalam tangki vertikal. ketebalan gel slab adalah sekitar 1-3 mm. minigel yang memiliki panjang dan lebar sekitar 8cm x 8 cm, tapi gel lebih besar hingga 40 x 20 cm juga umumnya digunakan.
Untuk pemisahan vertical,Sampel dilarutkan dalam gliserol atau sukrosa solusi kepadatan tinggi untuk mencegah mereka dari pencampuran dengan penyangga di upper reservoir. sumur sampel dalam gela slab dibuat selama pengecoran dengan menggunakan sisir atau pembentuk yang tepat. karena bentuk dari sampel sumur, bergerak analit dalam bentuk pita yang sempit dan lebar
Termostat diperlukan untuk kontrol tempratur. ruang dikontrol temperatrue memastikan lebih direproduksi separatios Dan karena mereka membantu untuk mengusir panas dan melindungi analit sensitif dari degradasi termal. Pemisahan dapat memnggunakan waktu beberapa jam. setelah selesai gel
dihapus dari pemegangnya. Pita analit daripada divisualisasikan, biasanya dengan pewarnaan.
Gambar 2.7 Bentuk –bentuk Elektroforesis Gel; a. bentuk tabung; b. bentuk horizontal; c. bentuk vertical (Andreas Manz, et.al, 2010).
Bentuk Pita dipisahkan yang paling sering divisualisasikan dengan pewarnaan dengan warna, pewarna fluorescent atau dengan perak. pewarna dan commomly digunakan adalah coomassie brilian biru. gel direndam dalam larutan alkohol asam ini temperatur tinggi pewarna dan dibiarkan selama beberapa jam, pewarna Kelebihan ini kemudian dihapus oleh jumlah mencuci langkah. Deteksi batas untuk protein berkisar sekitar 100 ng ke 1. pewarnaan perak lebih sensitif dengan batas deteksi, 1 ng. proses pewarnaan ini mirip dengan protografhy
Metode Gel Elektroforesis
A. Sodium Dodecyl Sulfate – Polyacrylamide Gel Elektrforesis (SDS – PAGE) Prinsip pemisahan SDS_PAGE semata-mata didasarkan pada perbedaan ukuran protein dan berat molekul. protein yang benar-benar didenaturasi dengan adanya deterjen anionik natrium dedocyl asetat (SDS). Preparasi sampel biasanya melibatkan pemanasan protein pada temperature 950C. dengan adanya SDS yang berbih dan agen tiol-reducing seperti
ᵝ
mercapto etanol. Hasilnya lengkap diperoleh terjadi pada struktur sekunder dan tersier. Molekul melintang melalui jembtan yaitu sulfide dan ikatan SDS dengan asam aminoB. Isoelektrik Focussing (IEF)
Isoelektrik Focussing (IEF) memungkinkan pemisahan analit zwitterionic seperti protein atau peptida menurut ke titik isoelektrik mereka. ief diterapkan untuk pemisahan dan pemurnian protein peptida dan asam amino pada analitis serta skala preparatif. Gel agarose dan PA keduanya digunakan pada metode IEF. C. Dua Dimensi Gel Elektroforesis (2D-GE)
Pada 2D-GE, dua metode elektroforesis dikombinasikan dengan gel tunggal. Bagian yang satu akan terpisah yang dibentuk dengan satu dimensi, berikutnya yang lain akan terpisah sama dengan yang pertama. Dengan metode ini, pencampuran seribu protein atau asam nukleat dapat dipisahkan dengan resolusi yang tinggi. Hasil fingerprint dapat dibandingkan dengan database
elektronik. Hasilnya bisa, bagaimanapun, sulit untuk mereproduksi dan metode ini secara teknis menantang membutuhkan pengalaman personil dalam operasi.