UJI TOKSISITAS SUBKRONIS INFUSA DAUN SIRIH MERAH (Piper crocatum Ruiz & Pav.) PADA TIKUS : STUDI TERHADAP GAMBARAN
MIKROSKOPIS HATI DAN KADAR SGPT DARAH
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Farmasi
Oleh:
Yuningsih Wulan Oei
NIM : 098114064
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
i
UJI TOKSISITAS SUBKRONIS INFUSA DAUN SIRIH MERAH (Piper crocatum Ruiz & Pav.) PADA TIKUS : STUDI TERHADAP GAMBARAN
MIKROSKOPIS HATI DAN KADAR SGPT DARAH
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Farmasi
Oleh:
Yuningsih Wulan Oei
NIM : 098114064
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
vi
HALAMAN PERSEMBAHAN
Ku percaya kau Tuhan yang tak pernah gagal,
menjadikanku lebih dari pemenang……
Ku percaya kau Tuhan yang tak pernah lalai,
menepati janti-janjimu….
karena satu hal yang Ku tahu,
tiada hal yang sia-sia di dunia ini
Karena bagiku hidup adalah kristus dan mati adalah
keuntungan
Filipi 1:21
Hasil 4 tahun kuliah ini kupersembahkan kepada
Tuhan Yesus
yang telah membimbing dan menuntun aku,
keluarga-Ku
papa, mama, dan ke pada ke tiga adik-adik-Ku Tian,
Cu, dan Vensya yang telah mensuportku
kepada sahabat-sahabatku yang selama ini telah berbagi suka dan
duka
vii PRAKATA
Puji dan syukur penulis panjatkan kepada Tuhan Yang Maha Esa, karena
atas berkat dan rahmat-Nya, penulis dapat menyelesaikan tugas akhir yang
berjudul “Uji Toksisitas Subkronis Infusa Daun Sirih Merah (Piper crocatum
Ruiz & Pav.) Pada Tikus Wistar : Studi Terhadap Gambaran Mikroskopis Hati
Dan Kadar SGPT”. Tugas akhir ini dikerjakan demi memenuhi salah satu syarat
untuk memperoleh gelar sarjana Farmasi di Universitas Sanata Dharma.
Penulis menyadari bahwa, terselesaikannya tugas ini tak lepas dari
dorongan dan batuan dari berbagai pihak. Oleh karena itu, penulis ingin
mengucapkan terima kasih kepada :
1. Dekan Fakultas Farmasi Universitas Sanata Dharma, yang telah memimpin,
menyelenggarakan, pendampingan dan tuntunan selama perkuliahan.
2. Prof. Dr. C. J. Soegihardjo, Apt., selaku Dosen Penguji yang telah
membimbing, membantu, dan memberi saran dalam proses pengerjaan skripsi
ini.
3. Phebe Hendra, M.Si., Ph.D., Apt., selaku Dosen Penguji yang telah
membimbing, membantu, dan memberi saran dalam proses pengerjaan skripsi
ini.
4. Ipang Djunarko,M.Sc., Apt., selaku Dosen Pembimbing dan Dosen Penguji.
Yang telah membimbing, membantu, memberi saran dalam proses pengerjaan
viii
5. Rini Dwiastuti, M.Si.,Apt., selaku Kepala Penanggung jawab Laboratorium
Fakultas Farmasi yang telah memberikan izin dalam penggunaan semua
fasilitas laboratorium untuk kepentingan penelitian skripsi ini.
6. Yohanes Dwiatmaka, M.Si., yang telah memberikan bantuan dalam
determinasi tanaman sirih merah (Piper crocatum Ruiz & Pav.) dan juga
bersedia memberikan tanaman tersebut untuk digunakan dalam penelitian
skripsi ini.
7. Pak Parjiman, Pak Kayat, Pak Heru, Pak Wagiran, Mas Andri, selaku laboran
laboratorium Fakultas Farmasi yang telah banyak memberikan bantuan
selama proses pelaksanaan penelitian.
8. Papa, Mama, Sii dan Siitiung yang telah mendukung, memberi saran dan
masukan selama proses penulisan skripsi ini.
9. Teman-teman kelompok skripsiku, Herta, Charlie, dan Catur atas segala
kerjasama, bantuan, dan masukkan dalam pengerjaan penelitian.
10. Sahabat-sahabatku Herta, Chissa, Raisa, Riri, Ina, Nggek, Ree, atas segala
motivasi, dukungan dan kebersamaannya, selama ini.
11. Seluruh dosen dan teman-teman FSM B 09, FST B 09 serta seluruh angkatan
2009 Fakultas Farmasi Universitas Sanata Dharma.
12. Semua pihak yang penulis tidak dapat menyebutkan satu-persatu yang telah
ikut membantu selama penyusunan skripsi ini.
Penulis menyadari bahwa skripsi ini masih jauh dari sempurna oleh
ix
Penulis juga berharap, skripsi ini dapat bermanfaat bagi ilmu pengetahuan
khususnya bidang Farmasi, serta semua pihak, mahasiswa maupun masyarakat.
Yogyakarta, 2 Juli 2013
x DAFTAR ISI
Halaman
HALAMAN JUDUL i
HALAMAN PERSETUJUAN PEMBIMBING ... ii
HALAMAN PENGESAHAN ... iii
PERNYATAAN KEASLIAN KARYA ... iv
LEMBAR PERNYATAAN PERSETUJUAN PUBLIKASI KARYA ILMIAH ... v
HALAMAN PERSEMBAHAN ... vi
PRAKATA ... vii
DAFTAR ISI ... x
DAFTAR TABEL ... xiv
DAFTAR GAMBAR ... xv
DAFTAR LAMPIRAN ... xvi
INTISARI ... xviii
ABSTRACT ... xix
BAB I. PENGANTAR ... 1
A. Latar Belakang ... 1
1. Perumusan masalah ... 3
2. Keaslian penelitian ... 3
3. Manfaat penelitian ... 4
B. Tujuan Penelitian ... 5
xi
2. Tujuan khusus ... 5
BAB II. PENELAAHAN PUSTAKA... 6
A. Daun Sirih Merah (Piper crocatum Ruiz & Pav.) ... 6
1. Morfologi tanaman ... 6
2. Taksonomi daun sirih merah ... 6
3. Kandungan kimia dan kegunaannya ... 7
B. Toksikologi ... 8
C. Toksisitas Subkronis ... 10
D. Hati ... 13
E. Patologi Hati ... 15
F. Serum Aminotransferase ... 16
G. Sediaan Infusa ... 17
H. Keterangan Empiris ... 17
BAB III. METODE PENELITIAN ... 18
A. Jenis dan Rancangan Penelitian ... 18
B. Variabel Penelitian ... 18
1. Variabel utama ... 18
2. Variabel pengacau ... 18
C. Definisi Operasional ... 19
1. Infusa ... 19
2. Kriteria efek toksisitas subkronis meliputi histopatologi hati dan kadar SGPT ... 19
xii
E. Alat dan Instrumen Penelitian ... 20
F. Tata Cara Penelitian ... 20
1. Determinasi tanaman ... 20
2. Pengumpulan daun sirih merah ... 21
3. Pembuatan serbuk daun sirih merah ... 21
4. Penetapan kadar air serbuk daun sirih merah... 21
5. Penetapan dosis infusa daun sirih merah ... 22
6. Penetapan dosis aquadest sebagai kontrol negatif ... 22
7. Pembuatan infusa daun sirih merah ... 22
8. Penyiapan hewan uji ... 23
9. Pengelompokan hewan uji ... 23
10.Prosedur pelaksanaan toksisitas subkronis ... 23
11.Prosedur pembedahan ... 24
12.Histopatologi hati ... 25
13.Pengamatan ... 25
a. Pengamatan berat badan hewan uji ... 25
b. Pengukuran asupan pakan hewan uji ... 25
c. Pengukuran asupan minum hewan uji ... 26
14.Analisis Data ... 26
a. Pemeriksaan kadar SGPT darah ... 26
b. Pengamatan berat badan hewan uji ... 27
c. Pengukuran asupan pakan hewan uji ... 27
xiii
e. Histopatologi hati ... 27
BAB IV. HASIL DAN PEMBAHASAN ... 28
A. Determinasi Tanaman Sirih Merah ... 28
B. Serbuk dan Kadar Air Daun Sirih Merah ... 28
C. Kadar SGPT Darah Tikus Akibat Pemberian Infusa Daun Sirih Merah ... 29
D. Histopatologi Hati ... 33
E. Perubahan Berat Badan Tikus Jantan dan Betina Akibat Pemberian Infusa Daun Sirih Merah ... 38
F. Asupan Pakan Tikus Jantan dan Betina Akibat Pemberian Infusa Daun Sirih Merah ... 41
G. Asupan Minum Tikus Jantan dan Betina Akibat Pemberian Infusa Daun Sirih Merah ... 44
BAB V. KESIMPULAN DAN SARAN ... 46
A. Kesimpulan ... 46
B. Saran ... 46
DAFTAR PUSTAKA ... 47
LAMPIRAN ... 50
xiv
DAFTAR TABEL
Halaman
Tabel I. Nilai pre dan post pemberian infusa daun sirih merah serta
nilai p kadar glukosa darah tikus jantan tiap kelompok 31
Tabel II. Nilai pre dan post pemberian infusa daun sirih merah serta
nilai p kadar glukosa darah tikus betina tiap kelompok 32
Tabel III. Hasil pemeriksaan histopatologis hati pada tikus jantan 34
Tabel IV. Hasil pemeriksaan histopatologis hati pada tikus betina 35
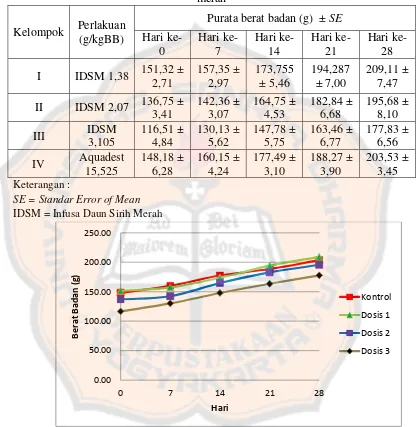
Tabel V. Purata berat badan ± SEM tikus jantan akibat pemberian
infusa daun sirih merah 39
Tabel VI. Purata berat badan ± SEM tikus betina akibat pemberian
xv DAFTAR GAMBAR
Halaman
Gambar 1. Daun Sirih Merah 6
Gambar 2. Diagram batang rata-rata pengaruh pemberian infusa daun
sirih merah terhadap kadar SGPT darah tikus jantan antar
kelompok perlakuan 31
Gambar 3. Diagram batang rata-rata pengaruh pemberian infusa daun
sirih merah terhadap kadar SGPT darah tikus betina antar
kelompok perlakuan 32
Gambar 4. Histopatologi hati normal. Anak panah hitam menunjukkan
vena sentralis, anak panah hijau menunjukkan sinusoid, dan
anak panah biru menunjukkan hepatosit 36
Gambar 5. Gambaran perubahan struktur histopatolohi hati. (A)
Multifokal nekrosis, (B) degenerasi melemak, (C) degenerasi
hidropik, dan (D) hepatitis 36
Gambar 6. Grafik perubahan berat badan tikus jantan selama pemberian
infusa daun sirih merah 39
Gambar 7. Grafik perubahan berat badan tikus betina selama pemberian
infusa daun sirih merah 40
Gambar 8. Grafik asupan pakan tikus jantan selama pemberian infusa
daun sirih merah menurut 42
Gambar 9. Grafik asupan pakan tikus betina selama pemberian infusa
xvi
Gambar 10.Grafik asupan minum tikus jantan selama pemberian infusa
daun sirih merah 44
Gambar 11.Grafik asupan minum tikus betina selama pemberian infusa
xvii
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Foto daun sirih merah 50
Lampiran 2. Foto infusa daun sirih merah 50
Lampiran 3. Foto serbuk daun sirih merah 50
Lampiran 4. Perhitungan penetapan peringkat dosis infusa daun sirih
merah pada kelompok perlakuan 51
Lampiran 5. Perhitungan konversi dosis untuk manusia 51
Lampiran 6. Perhitungan rendemen serbuk daun sirih merah dan kadar air 52
Lampiran 7. Surat pengesahan determinasi tanaman sirih merah 53
Lampiran 8. Surat ethics committee approval 54
Lampiran 9. Hasil Histopatologi 55
Lampiran 10. Analisis Statistik Kadar SGPT Darah Pre dan Post pada
Tikus Jantan melalui Paired T-Test 57
Lampiran 11. Analisis Statistik Kadar Glukosa Darah Pre dan Post pada
Tikus Betina melalui Paired T-Test 58
Lampiran 12. Analisis Statistik Kadar SGPT Darah Post pada Tikus Jantan 59
Lampiran 13. Analisis Statistik Kadar SGPT Darah Post pada Tikus Betina 61
Lampiran 14. Analisis Statistik Berat Badan Tikus Jantan 63
xviii
INTISARI
Sirih merah (Piper crocatum Ruiz & Pav.) dimanfaatkan sebagai obat tradisional di masyarakat. Penelitian bertujuan mengetahui keamanan sirih merah jika digunakan dalam jangka panjang serta melihat spektrum efek toksik penggunaan infusa daun sirih merah.
Penelitian bersifat eksperimental murni rancangan acak pola searah. Empat puluh tikus wistar (20 jantan dan 20 betina) 2-3 bulan, dibagi secara acak ke dalam 4 kelompok. Kelompok I sebagai kontrol aquadest 15,525 g/Kg BB, kelompok II sampai kelompok IV dipejankan infusa daun sirih merah selama 28 hari, dengan dosis berturut-turut 1,38 ; 2,07 ; 3,105 g/Kg BB. Pada hari ke-0 dan 28 dan diukur kadar SGPT darah, sedangkan pada hari ke-28 dan 42 dibedah. Kriteria pengamatan efek toksisitas subkronis meliputi histopatologi hati dan kadar SGPT. Kadar SGPT dianalisis dengan Kolmogrov-Smirnov, kemudian diuji dengan One-Anova dengan taraf kepercayaan 95% dan juga, uji paired-T.
Dari analisis Kolmogrov-Smirnov diketahui distribusi datanya normal tetapi setelah uji One-Anova tidak terdapat perbedaan yang signifikan. Dari
paired-T, pada kontrol betina didapatkan nilai p = 0,310B. Dari histopatologi hati,
diketahui bahwa pemberian infusa daun sirih merah tidak mengakibatkan kerusakan pada hati.
Disimpulkan bahwa, pemberian infusa daun sirih merah tidak berpengaruh terhadap kadar SGPT darah hewan uji dan juga tidak menimbulkan kerusakan pada organ hati.
xix ABSTRACT
Red betel (Piper crocatum Ruiz & Pav.) Used as traditional medicine in the community. The research aims to determine the safety of red betel if used in the long term and look at the spectrum of toxic effects of the use of red betel leaf infusion.
Experimental research design pure random unidirectional pattern. Forty Wistar rats (20 males and 20 females) 2-3 months, were randomly divided into 4 groups. I distilled water as a control group 15.525 g / kg bw, the group II to group IV dipejankan red betel leaf infusion for 28 days, at a dose of 1.38 respectively; 2.07; 3.105 g / kg bw. On day 0 and 28 measured blood levels of alanine aminotransferase, while some test animals dissected in order to see the damage to the liver. Observation criteria subchronic toxicity effects include liver histopathology and SGPT levels. SGPT levels were analyzed by One-ANOVA with a level of 95% and a paired-T test.
The results showed no significant changes, the ALT levels and body weight when given a red betel leaf infusion for 28 days. Reading of rat liver preparations showed no specific changes were observed after pemejanan.
Concluded that, giving the red betel leaf infusion has no effect on blood levels of alanine aminotransferase test animals and also cause damage to the liver.
1
BAB I PENGANTAR A. Latar Belakang
Sirih merah (Piper crocatum Ruiz & Pav.), di masyarakat pada mulanya
untuk menjaga kebersihan gigi dan mulut dengan menyusur (makan sirih). Selain
dengan menyusur, juga dapat dengan cara meminum air rebusan daun sirih merah,
sesuai dengan keperluan masing-masing orang (Handita, 2010).
Menurut Werdhany, Marton, dan Setyorini (2008), daun sirih merah
memiliki kandungan kimia antara lain : minyak atsiri, hidroksikavikol, kavikol,
kavibetol, allylprokatekol, karvakrol, eugenol, p-cymene, cineole, caryfelen,
kadimen estragol, terpena, dan fenil propada. Selain itu, juga banyak mengandung
senyawa fitokimia seperti alkaloid, saponin, tanin, dan flavonoid.
Seiring dengan perkembangan zaman, khasiat sirih merah mulai teruji
secara klinis dengan adanya penelitian. Khasiat sirih merah antara lain,
antioksidan, antidiabetes, antikanker, antiseptik, meringankan penyakit jantung
dan antiinflamasi (Handita, 2010).
Penelitian tentang khasiat sirih merah telah banyak dilakukan di
antaranya daun sirih merah yang diremas-remas dan kemudian dioleskan pada
perut dapat mengurangi rasa panas, sakit panas, dan sakit empedu; pada penyakit
empedu cairan hasil perasan diminum juga (Heyne, 1987). Selain itu berdasarkan
penelitian diketahui bahwa pemberian infusa daun sirih merah secara topikal
Fimani, 2010) dan dapat menurunkan kadar gula darah pada pemberian secara
oral (Salim, 2006).
Diabetes merupakan salah satu penyakit yang dapat menyebabkan
komplikasi akibat dari tingginya gula darah, misalnya pada organ hati, ginjal, dan
sebagainya (Choirul, 2013). Hati merupakan filter utama untuk menghilangkan
racun seperti obat-obatan dan alkohol, dan juga membantu dalam pencernaan
dengan memproduksi empedu untuk memecah lemak dan menyerap lemak dan
vitamin yang larut air dan mineral. Selain itu juga membantu dalam pengaturan
kadar glukosa, tekanan darah, insulin, estrogen, testoteron, imun, dan produksi
kolesterol darah dan pembuangannya (Berkowitz, 2013).
Kegagalan pada hati dapat menyebabkan penyakit kuning, akumulasi
cairan dalam tubuh dan muntah darah (Bengaluru, 2013). Kerusakan pada hati
dapat terdeteksi dengan uji AST (aspartate aminotransferase), ALT (alanine
aminotransferase), atau MRI (Magnetic Resonance Imaging) untuk mendapatkan
gambaran hati (Berkowitz, 2013).
Oleh karena itu, perlu adanya dilakukan penelitian mengenai keamanan
dari penggunaan daun sirih merah jika digunakan secara terus – menerus, dalam
hal ini, penelitian subkronis tentang penggunaan infusa daun sirih merah.
Penelitian ini, ingin mengetahui spektrum efek toksik infusa daun sirih merah dan
juga, hubungan efek dan dosis terhadap wujud efek toksiksitas subkronis infusa
daun sirih merah pada histopatologi hati (struktural) dan kadar SGPT (biokimia)
darah tikus putih jantan dan betina galur Wistar. Infusa dilakukan dengan cara
Dipilih infusa karena, merupakan salah satu bentuk sederhana dalam pembuatan
obat tradisional yang sering digunakan oleh masyarakat.
1. Perumusan masalah
Berdasarkan latar belakang diatas, permasalahan yang dapat diuraikan
sebagai berikut :
a. Seberapa besar spektrum efek toksik (perubahan biokimia dan struktural)
infusa daun sirih merah (Piper crocatum) terhadap kerusakan hati yang
dinilai dari perubahan kadar SGPT dan histopatologi hati?
b. Apakah terdapat hubungan kekerabatan antara dosis infusa daun sirih
merah (Piper crocatum) dengan spektrum efek toksik pada kadar SGPT
dan histopatologi hati?
2. Keaslian penelitian
Sepengetahuan penulis penelitian yang telah ada sebelumnya yaitu :
a. Potensi Rebusan Daun Sirih Merah (Piper crocatum) Sebagai Senyawa
Antihiperglikemia Pada Tikus Putih Galur Wistar, diperoleh bahwa pada
dosis 20g/KgBB dapat menurunkan kadar glukosa darah tikus diabetes
galur Wistar yang diinduksi aloksan tetrahedrat hingga 17,76, 40,17,
38,44% pada hari ke-5, dan 13 setelah induksi aloksan (Salim, 2006).
b. Uji Aktivitas Fagositosis Makrofag Senyawa Kode Pc-2 dari Daun Sirih
Merah (Piper crocatum Ruiz & pav.) Secara In-vivo, diperoleh bahwa
senyawa kode Pc-2 yang diisolasi dari ekstrak metanolik daun sirih merah
pada dosis 10 mg/Kg BB mampu meningkatkan aktivitas fagositosis
monocytogenes baik pada parameter indeks fagositosis,persen fagositosis,
maupun efisiensi fagositosisnya (Hartini, Wahyuono, Widyarini,
Yuswanto, 2013)
c. Pengaruh Pemberian Infusa Daun Sirih Merah (Piper cf.fragile,Benth)
Secara Topikal Terhadap Penyembuhan Luka Pada Tikus Putih Diabet,
diperoleh bawa pemberian infusa daun sirih merah secara topikal dengan
konsentrasi 40% memiliki pengaruh lebih baik terhadap peningkatan
presentase penyembuhan luka (Abdul, Azizahwati dan Fimani, 2010).
Dengan demikian, dapat dipastikan bahwa penelitian toksisitas subkronis
infusa daun sirih merah (Piper crocatum) terhadap histopatologi hati dan kadar
SGPT darah tikus jantan dan betina belum pernah dilakukan sebelumnya.
d. Manfaat penelitian
a. Manfaat teoretis Penelitian ini diharapkan dapat bermanfaat bagi
perkembangan ilmu pengetahuan untuk memberikan kajian efek toksik
secara subkronis tentang penggunaan daun sirih merah (Piper crocatum).
b. Manfaat praktis Penelitian ini diharapkan dapat memberikan tambahan
informasi mengenai spektrum efek toksik toksisitas subkronis infusa
daun sirih merah (Piper crocatum) terhadap kadar SGPT dan
B. Tujuan Penelitian 1. Tujuan umum
Secara umum ingin mengetahui ada tidaknya potensi efek toksik dari
daun sirih merah (Piper crocatum).
2. Tujuan khusus
a. Mengungkapkan spektrum efek toksik (perubahan biokimia dan
struktural) infusa daun sirih merah terhadap kerusakan hati yang dinilai
dari perubahan kadar SGPT dan histopatologi hati.
b. Mengungkapkan kekerabatan antara dosis infusa daun sirih merah dengan
6
BAB II
PENELAHAAN PUSTAKA
A. Daun Sirih Merah (Piper crocatum Ruiz & Pav.) 1. Morfologi tanaman
Sirih merah (Piper crocatum Ruiz & Pav.) merupakan salah satu jenis
Piper betle. Sirih merah merupakan tanaman merambat dengan daun berbentuk
hati yang berwarna kemerah-merahan, rasanya lebih pahit dan aromanya lebih
tajam dibandingkan dengan sirih hijau. Tumbuhnya di dataran tinggi. Bila terkena
panas matahari langsung, maka batang sirih merah akan cepat mengering dan zat
warna pada daun secara perlahan akan memudar (Nurmalina dan Valley, 2012).
Gambar daun sirih merah dapat dilihat pada Gambar 1.
Gambar 1. Daun Sirih Merah (Plantamor, 2011)
2. Taksonomi daun sirih merah
Kingdom : Plantae (Tumbuhan)
Subkingdom : Tracheobionta (Tumbuhan berpembuluh)
Super Divisi : Spermatophyta (Menghasilkan biji)
Divisi : Magnoliophyta (Tumbuhan berbunga)
Kelas : Magnoliopsida (berkeping dua / dikotil)
Sub Kelas : Magnoliidae
Ordo : Piperales
Genus : Piper
Spesies : Piper crocatum Ruiz & Pav. (Plantamor, 2011)
3. Kandungan kimia dan kegunaannya
Kandungan kimia sirih merah yaitu, flavonoid, polifenol, alkaloid,
tannin, minyak atsiri, saponin, hidroksikaficol, kaficol, allyprokatekol, karfokrol,
eugenol, P-cymene, cineole, coryofelen, kadimen, ekstragol, terpenana, dan fenil
propoda (Nurmalina dan Valley, 2012).
Secara empiris, khasiat kandungan senyawa dari sirih merah antara lain,
flavonoid dan polifenol berfungsi sebagai antioksidan, antidiabetes, antikanker,
antiseptik, dan antiinflamasi. Senyawa eugenol berfungsi sebagai analgetik,
senyawa tanin sebagai penyembuh sakit perut pada diare dan antiseptik pada luka
(Nurmalina dan Valley, 2012).
Senyawa fitokimia seperti alkaloid, saponin, tanin, dan flavonoid dapat
berpotensi sebagai antikanker (Yulianti, Rahayu, Mercuriani, 2009). Minyak
atsiri, fenil propanoid, dan tanin berpotensi sebagai antimikroba dan anti jamur
yang kuat dan dapat menghambat pertumbuhan beberapa jenis bakteri antara
Escherichia coli, Salmonella sp, Staphylococcus aureus, Klebsiella, Pasteurella,
dan dapat mematikan Candida albicans (Kartasapoetra, 1992, Depkes, 1989,
Mahendra, 2005, Agusta, 2000, Hariana, 2007 cit.,Revendy, 2011). Karvakol
bersifat desinfektan, anti jamur, sehingga bisa digunakan untuk obat antiseptic
pada bau mulut dan keputihan. Eugenol dapat digunakan untuk mengurangi rasa
B. Toksikologi
Menurut Doull dan Bruce, semua senyawa adalah racun, tidak satupun
yang bukan racun, takaran atau dosis yang tepatlah yang membedakan racun dan
obat. Berdasarkan pernyataan tersebut maka dapat disimpulkan, toksikologi
adalah ilmu yang mempelajari pengaruh kuantitatif zat kimia atas sistem biologi,
dan yang paling terpenting bagaimana zat kimia tersebut berbahaya bagi sistem
biologi (Donatus, 2005).
Uji toksikologi dibagi menjadi dua yaitu uji ketoksikan tak khas dan uji
ketoksikan khas. Uji ketoksikan tak khas adalah uji toksikologi yang dirancang
untuk mengevaluasi keseluruhan efek toksik suatu senyawa pada aneka ragam
jenis hewan uji. Yang termasuk dalam uji ketoksikan tak khas yaitu uji ketoksikan
akut, sub kronis dan kronis. Uji ketoksikan khas adalah uji toksikologi yang
dirancang untuk mengevaluasi secara rinci efek toksik yang khas dari suatu
senyawa pada semua hewan uji. Yang termasuk dalam uji ketoksikan khas adalah
uji potensiasi, kekarsinogenetikan, kemutagenetikan, keteratogenetikan,
reproduksi, kulit dan mata, dan perilaku (Donatus, 2005).
Asas toksikologi dibagi menjadi tiga yaitu
1. Kondisi pemberian dan makhluk hidup
Kondisi pemberian ialah Semua faktor yang menentukan keberadaan
racun di tempat aksinya. Jalur pemberian seperti intravena, inhalasi,
intraperitonial, subkutan, intramuskular, dermal, dan oral akan menentukan
ketersediaan senyawa induk atau metabolit di tempat aksi. Saat pemberian, serta
tempat aksi tertentu dan kerentanan makhluk hidup terhadap racun. Kondisi
makhluk hidup adalah keadaan fisiologi (berat badan, umur, jenis kelamin, dan
kehamilan) serta patologi (penyakit) makhluk hidup dapat mempengaruhi
ketersediaan racun di sel sasaran dan keefektifan antaraksi antara kedua ubahan
ini (Donatus, 2005).
2. Mekanisme aksi toksik
Mekanisme aksi toksik racun digolongkan menjadi tiga, yakni
mekanisme berdasarkan sifat dan tempat kejadian, berdasarkan sifat antaraksi
antara racun dan tempat aksinya, dan berdasarkan risiko penumpukan racun dalam
gudang penyimpanan tubuh. Berdasarkan sifat dan tempat kejadian mekanisme
aksi toksik digolongkan menjadi dua yaitu mekanisme luka intrasel dan
mekanisme luka ekstrasel. Mekanisme luka intrasel diawali oleh racun pada
tempat aksinya di dalam sel sasaran. Racun akan berinteraksi dengan sasaran
molekuler yang khas atau tak khas, melalui mekanisme reaksi kimia. Tubuh akan
memberi respon berupa perbaikan atau adaptasi sebelum terjadi efek yang tidak
diinginkan, tetapi apabila mekanisme pertahanan tubuh tidak lagi mampu
memperbaiki akan timbul respon toksik berupa perubahan biokimia, fungsional,
atau struktural. Mekanisme luka ekstrasel terjadi secara tidak langsung karena
racun bereaksi diluar sel sasaran (Donatus, 2005).
3. Wujud dan sifat efek toksik
Wujud efek toksik sesuatu racun dapat berupa perubahan biokimia,
fungsional, dan struktural. Berbagai perubahan ini memiliki ciri yang khas, yakni
menunjukkan bukti secara langsung terhadap patologi organ, apabila mekanisme
homeostatis normal makhluk hidup masih dapat bekerja maka perubahan biokimia
bersifat timbal balik (Donatus, 2005).
C. Toksisitas Subkronis
Toksisitas subkronis merupakan salah satu jenis uji toksikologi. Uji
ketoksikan subkronis adalah uji ketoksikan sesuatu senyawa yang diberikan
dengan dosis berulang pada hewan uji tertentu, selama kurang dari tiga bulan. Uji
ini ditujukan untuk mengungkapkan spektrum efek toksik senyawa uji, serta untuk
memperlihatkan apakah spektrum efek toksik tersebut berkaitan dengan takaran
dosis (Donatus, 2005). Uji toksisitas subkronis tidak difokuskan pada titik akhir
tertentu, melainkan untuk mengeksplorasi secara luas keseluruhan efek biologis
yang ditimbulkan pada tempat aksi yang diberikan pada rentang dosis tertentu. Uji
toksisitas subkronis dapat menentukan toksisitas secara kualitatif (organ target dan
efek yang ditimbulkan) dan kuantitatif (pengaruh atau efek yang ditimbulkan
terhadap jaringan dan plasma darah) dari pemberian dosis berulang pada hewan
uji (Gad, 2002).
Hewan uji yang disarankan paling tidak satu jenis hewan dewasa sehat,
baik jantan maupun betina. Hewan uji dipilih yang peka dan memiliki pola
metabolisme terhadap senyawa uji yang semirip mungkin dengan manusia
(Donatus, 2005). Spesies hewan dapat digunakan rodent dan non-rodent. Spesies
hewan rodent menggunakan tikus. Hewan dimasukkan dalam dua kategori
(Gad, 2002). Jumlah kelompok hewan uji paling tidak sebanyak empat kelompok
yaitu satu kelompok kontrol dan tiga kelompok peringkat dosis. Jumlah hewan uji
untuk jangka waktu penelitian selama empat minggu, paling tidak terdapat lima
jantan dan lima betina dalam satu kelompok (Derelanko and Mannfred, 2002).
Jalur pemberian sesuai dengan jalur yang digunakan manusia dan peringkat dosis.
Pengamatan dan pemeriksaan yang dilakukan dalam uji ketoksikan subkronis,
meliputi:
1. Perubahan berat badan yang diperiksa paling tidak 7 hari sekali,
2. asupan makanan untuk masing-masing hewan atau kelompok hewan, diukur
paling tidak 7 hari sekali,
3. gejala-gejala klinis umum yang diamati setiap hari,
4. pemeriksaan terhadap hematologi, paling tidak diperiksa dua kali, pada awal
akhir uji coba,
5. pemeriksaaan kimia darah, paling tidak diperiksa dua kali, pada awal akhir uji
coba,
6. analisis urin, paling tidak sekali,
7. pemeriksaan histopatologi organ pada akhir uji coba
(Donatus, 2005)
Keterbalikan toksisitas terjadi apabila efek buruk atau efek yang tidak
diinginkan yang dapat dikembalikan apabila pemaparan dihentikan. Keterbalikan
toksisitas tergantung pada sejumlah faktor, termasuk tingkat pemaparan (waktu
dan jumlah racun) dan kemampuan jaringan yang terkena untuk memperbaiki atau
Ada banyak cara organisme dapat menanggapi senyawa beracun, jenis
respon tergantung pada banyak faktor. Meskipun banyak efek toksik dari senyawa
asing memiliki dasar biokimia, ekspresi efeknya mungkin berbeda. Oleh karena
itu jenis respon beracun dibedakan menjadi :
1. Tindakan beracun secara langsung,
2. farmakologi, fisiologi, efek biokimia,
3. teratogenesis,
4. imuno toksisitas, dan
5. karsinogenesis (Timbrell, 2008).
Sarana utama dalam mendeteksi respon beracun apabila tidak terdapat
kematian seperti organisme atau jaringan adalah :
1. Perubahan biokimia, melibatkan efek pada enzim seperti inhibitor atau
perubahan jalur metabolik tertentu. Munculnya enzim atau substansi lain dalam
cairan tubuh dapat menunjukkan kebocoran dari jaringan karena merusak dan
merupakan indikasi perubahan patologis.
2. Perubahan status normal, terdapat sejumlah penanda toksisitas. Dengan
demikian, perubahan berat badan, asupan makanan dan minum, luaran urin,
dan berat organ merupakan indikator yang umum dan spesifik untuk toksisitas.
Oleh karena itu, hewan yang mengonsumsi lebih sedikit makanan dan
kehilangan bobot setelah terpapar senyawa beracun atau peningkatan berat
organ karena terpapar senyawa beracun, perubahan ini dikonfirmasi dengan
pengukuran kimia, biokimia, dan histopatologi
Ada dua basis yang berbeda untuk jenis farmakologi, fisiologi, dan efek
biokimiawi, basis ini dibedakan menjadi farmakokinetika dan farmakodinamika.
Farmakokinetika berbasis pada efek toksik yang disebabkan oleh meningkatnya
konsentrasi senyawa atau metabolik aktif di sisi target. Hal ini dikarenakan,
peningkatan dosis, perubahan metabolisme, atau kejenuhan proses eliminasi.
Basis efek toksik farmakodinamika terdapat respon yang berubah pada sisi target,
kemungkinan karena adanya variasi reseptor (Timbrell, 2008).
Untuk penelitian subkronis parameter biokimia yang diuji adalah
glutamat piruvat transaminase (GPT). Dan organ atau jaringan yang diperiksa
adalah histopatologi hati (Harmita dan Maksum, 2008).
D. Hati
Hepar atau hati merupakan organ atau kelenjar terbesar di dalam tubuh.
Disebut kelenjar karena menghasilkan empedu (exokrin) dan juga mengeluarkan
hasil produksi dari makanan (endokrin). Hepar terletak di regio hypochondrium
kanan dan epigastrium, dan sebagian besar tertutup dinding thorax. Bagian atas
hepar tertutup diafragma dan mencapai ketinggian iga kelima kanan. Hepar
berbentuk seperti segitiga dengan basis di sebelah kanan dan apex di sebelah kiri
(Wibowo, Daniel, dan Paryana, Widjaya, 2009).
Hati mempunyai dua facies yaitu facies diaphragmatica dan facies
visceralis yang dipisahkan oleh tepi tajam yang disebut margo inferior atau
margo anterior. Facies diaphragmatica terdapat di sebelah atas dengan bentuk
Permukaan ini terdiri dari bagian anterior dan prosterior yang kadang-kadang
disebut juga sebagai facies tersendiri. Facies visceralis atau prosteroinferior
menghadap viscera sehingga permukaannya ireguler karena berbatasan dengan
gaster, duodenum, oesophagus, flexura coli dextra, rend extra, dan vesica fellea.
Facies visceralis menghadap ke bawah dan ke belakang; mempunyai fissure dan
fossa ayng bentuknya seperti huruf ‘H’ dengan garis horizontal berupa porta
hepatis. Porta hepatis adalah hilium dari hepar yang merupakan tempat masuk
dan keluar pembuluh darah (vena porta dan arteria hepatica), saluran empedu
(ductus hepaticus), pembuluh getah bening, dan plexus nervorum (Wibowo,
Daniel, dan Paryana, Widjaya, 2009).
Fungsi hati :
1. Mengubah zat makanan yang diabsorpsi dari usus dan yang disimpan di suatu
tempat dalam tubuh, dikeluarkan sesuai dengan pemakaiannya dalam
jaringan,
2. Mengubah zat buangan dan bahan racun untuk diekskresi dalam empedu dan
urine,
3. Menghasilkan enzim glikogenik (glukosa menjadi glikogen),
4. Sekresi empedu, garam empedu dibuat di hati, din=bentuk dalam system
retikuloendetelium, dialirkan ke empedu,
5. Pembentukan ureum, hati menerima asam amino diubah menjadi ureum,
dikeluarkan dari darah oleh ginjal dalam bentuk urine,
6. Menyiapkan lemak untuk pemecahan terakhir asam karbonat dan air.
E. Patologi Hati
Hati merupakan organ yang sering mengalami kerusakan. Hal ini
disebabkan antara lain sebagian besar toksikan memasuki tubuh melalui sistem
gastrointestinal, dan setelah diserap toksikan dibawa oleh vena porta ke hati (Lu,
2006). Beberapa kerusakan yang dapat ditemui di hati, antara lain :
1. Nekrosis hati
Nekrosis hati adalah kematian hepatosit, dapat bersifat fokal (sentral,
pertengahan, perifer) atau difus. Nekrosis hati merupakan suatu manifestasi
toksik yang berbahaya tetapi tidak selalu kritis karena hati mempunyai
kapasitas regenerasi yang luar biasa (Lu, 2006).
2. Sirosis
Sirosis hati adalah penyakit kronis pada hepar dengan inflamasi dan fibrosis
hepar dan hilangnya sebagaian besar fungsi hepar. Yang terjadi adalah
kematian sel-sel hepar, terbentuknya sel-sel fibrotic (sel mast), regenerasi sel
dan jaringan parut yang menggantikan sel normal (Baradero, Dayrit, Siswadi,
2008). Menurut Lu (2006), sirosis ditandai oleh adanya septa kolagen yang
tersebar di sebagian besar hati. Kumpulan hepatosit muncul sebagai nodul
yang dipisahkan oleh lapisan berserat ini.
3. Degenerasi hidropik
Cheville (2006) melaporkan bahwa degenerasi sel dalam bentuk hidropis
adalah adanya akumulasi cairan pada sitoplasma sel sehingga tampak
membentuk vakuola. Kadang-kadang vakuola kecil bersatu membentuk
mikroskopis terlihat bahwa sel mengandung ruang-ruang jernih yang
mengelilingi inti.
4. Steatosis (perlemakan hati/degenarasi hati)
Perlemakan hati ini bersifat reversible dan ditandai dengan penimbunan
trigliserida di hepatosit dan dipercaya terjadi pada hingga 90% pecandu
alkohol kronis (Corwin, 2009). Hati dikategorikan mengalami perlemakan
bila mengandung berat lipid lebih dari 5% (Lu, 2006).
F. Serum Aminotransferase
Serum aminotransferase merupakan enzim intraseluler yang dikeluarkan
dari hepatosit yang luka dan sangat berguna sebagai penanda dari jaringan hati
yang luka (inflamasi atau nekrosis sel). Serum aminotransferase terdiri dari 2
yaitu :
1. Aspartate aminotransferase (AST, SGOT [serum glutamic oxaloacetic
transaminase]), ditemukan di sitosol dan mitokondria. Terdapat di liver,
tulang otot, jantung, ginjal, otak dan pankreas.
2. Alanin aminotransferase (ALT, SGPT [serum glutamic pyruvic
transaminase]), ditemukan di sitosol. Konsentrasi tertinggi terdapat di liver
(lebih sensitif dari AST untuk inflamasi liver dan hepatosit nekrosis)
(Lawrence and Emmet, 2011).
Peningkatan aminotransferase merupakan kelainan biokimia yang
hepatitis, tingkat peningkatan mungkin berkorelasi dengan tingkat kerusakan hati,
tetapi umumnya bukan dari prognosis yang signifikan (Lawrence, et.al., 2011).
G. Sediaan Infusa
Infus adalah sediaan cair yang dibuat dengan cara mengekstraksi
simplisia nabati dengan air pada suhu 900C selama 15 menit. Pembuatan infus
merupakan sediaan herbal dari bahan lunak seperti daun dan bunga. Dapat
diminum panas atau dingin. Serkai selagi panas melalui kain flanel, lalu
menambahkan air panas secukupnya melalui ampas hingga diperoleh volume
infus yang dikehendaki (BPOM RI, 2010).
H. Keterangan Empiris
Penelitian ini merupakan penelitian eksploratif untuk mendapatkan bukti
adanya efek toksisitas subkronis dari infusa daun sirih merah (Piper crocatum
Ruiz & Pav.) terhadap kadar SGPT darah serta gambaran mikroskopis hati tikus
18
BAB III
METODE PENELITIAN
A. Jenis dan Rancangan Penelitian
Jenis penelitian ini adalah penelitian eksperimental murni dengan
rancangan acak pola searah. Eksperimental murni adalah penelitian dengan cara
mengendalikan variabel pengacau. Rancangan acak merupakan cara menetapkan
sampel yang digunakan dalam penelitian dengan pengacakan agar setiap sampel
memperoleh kesempatan yang sama untuk dapat masuk ke dalam kelompok
perlakuan dan kelompok kontrol. Pola searah ditunjukkan dengan diberikannya
perlakuan yang sama pada kelompok perlakuan, yaitu pemberian infusa daun sirih
merah secara per oral dengan dosis yang berbeda.
B. Variabel Penelitian 1. Variabel utama
a. Variabel bebas : Varibel bebas dari penelitian ini adalah dosis infusa daun sirih merah perberat badan tikus (g/Kg BB).
b. Variabel tergantung Variabel tergantung dari penelitian ini adalah kadar
SGPT dan hisotopatologi hati setelah pemberian infusa daun sirih merah.
2. Variabel pengacau
a. Variabel pengacau terkendali Variabel pengacau terkendali dari penelitian
ini adalah subyek uji berupa tikus (umur 2-3 bulan, jenis kelamin betina,
merah (daun sirih merah diambil yang masih muda dan waktu
pengambilannya pagi hari, diperoleh di kaliurang).
b. Variabel pengacau tak terkendali Variabel pengacau tak terkendali dari
penelitian ini adalah kondisi patologis dan fisiologis hewan uji.
C. Definisi Operasional
1. Infusa
a. Infusa yang dianalisis merupakan ekstraksi simplisia daun sirih merah
(Piper crocatum) sebanyak 20 g pada suhu 900C dengan akuadest, selama
15 menit, sehingga menghasilkan infusa daun sirih merah dengan
konsentrasi 20% b/v.
b. Dosis infusa daun sirih merah yang diberikan pada kelompok perlakuan
yaitu sebesar 1,38 ; 2,07 ; 3,105 g/kgBB.
2. Kriteria efek toksisitas subkronis meliputi histopatologi hati dan kadar SGPT.
a. Kadar SGPT (Serum Glutamic Piruvic Transaminase) merupakan salah
satu serum aminotransferase yang paling banyak terdapat di hati untuk
mendeteksi inflamasi liver dan hepatosit nekrosis.
b. Histopatologi hati adalah kerusakan jaringan dari organ tertentu dalam hal
ini hati. Kerusakan ini dapat diketahui dengan cara membuat preparat dari
D. Bahan Penelitian
Bahan yang digunakan pada penelitian ini adalah empat puluh tikus putih
galur Wistar, 20 jantan dan 20 betina berumur 2-3 bulan, berat badan 100 – 200
gram. Daun sirih merah diambil yang masih muda dan waktu pengambilannya
pagi hari, diperoleh dari Pak Yohanes Dwiatmaka M.Si.,. Aquadest untuk asupan
minum dan sebagai pelarut dalam pembuatan infusa. Pelet BR-2 untuk asupan
pakan.
E. Alat dan Instrumen Penelitian
Alat – alat yang digunakan dalam penelitian ini adalah
1. Alat Alat-alat pembuatan serbuk kering daun sirih merah antara lain : mesin
penyerbuk Retsch bv, timbangan, oven.
2. Alat-alat pembuatan infusa daun sirih merah antara lain : Bekker glass,
timbangan, batang pengaduk, gelas ukur, panci infusa, heater, stopwatch,
kain flanel.
3. Alat-alat uji toksisitas antara lain : kandang tikus (metabolic cage),
timbangan, Bekker glass, jarum suntik per oral, spuit injeksi, effendorf, pipa
kapiler (haematokrit).
F. Tata Cara Penelitian 1. Determinasi tanaman
Determinasi dilakukan di Laboratorium Farmakognosi Fitokimia
Fakultas Farmasi Universitas Sanata Dharma Yogyakarta hingga ke tingkat
2. Pengumpulan daun sirih merah
Bahan uji yang digunakan adalah daun sirih merah. Daun yang dipilih
adalah daun dalam kondisi segar dan berwarna hijau pada bagian tengah antara
pucuk dan pangkal daun. Daun yang diperoleh berasal dari Pak Yohanes
Dwiatmaka M.Si., pada bulan Maret 2013.
3. Pembuatan serbuk daun sirih merah
Daun sirih merah yang telah dipetik, dicuci, dikeringkan, kemudian
dimasukkan ke dalam oven dengan suhu ± 50oC selama 24 jam. Daun yang telah
kering kemudian diserbuk dan diayak dengan menggunakan ayakan no. 30, dan
dilakukan perhitungan rendemen serbuk daun sirih merah.
Rendemen serbuk daun sirih merah dihitung dengan menggunakan
rumus : 𝑏𝑒𝑟𝑎𝑡𝑘𝑒𝑟𝑖𝑛𝑔
𝑏𝑒𝑟𝑎𝑡𝑠𝑎𝑚𝑝𝑒𝑙x 100 % (Sharief, 2006).
4. Penetapan kadar air serbuk daun sirih merah
Penetapan kadar air menggunakan metode gravimetri dengan bantuan
alat Moisture Balance. Dimasukkan ±5 g serbuk daun sirih merah ke dalam alat,
kemudian diratakan. Timbang bobot zat sebagai bobot sebelum pemanasan (bobot
a) panaskan pada suhu 1100C selama 30 menit. Setelah itu, ditimbang bobot zat
setelah pemanasan (bobot b). Selisih bobot a dan bobot b merupakan kadar air
yang diselidiki.
5. Penetapan dosis infusa daun sirih merah
Penggunaan infusa daun sirih merah di masyarakat adalah 7 – 8 lembar
Sehingga, dosis yang yang digunakan adalah 23g/70Kg BB untuk konversi
manusia (70 kg ke tikus 200 g) = 0,018 (Laurence and Bacharach, 1964).
Dosis untuk 200g tikus = 0,018 x 23g
= 0,414g/200g BB
= 2,07x10-3g/g BB
= 2,07 g/Kg BB
Dalam penelitian ini dibuat 3 peringkat dosis, dengan cara menggunakan
kelipatannya. Angka kelipatan yang digunakan sebesar satu setengah kalinya,
sehingga diperoleh tiga peringkat dosis yaitu 1,38 ; 2,07 ; 3,105 g/kgBB.
6. Penetapan dosis aquadest sebagai kontrol negatif
Untuk penentuan dosis aquadest digunakan dosis tertinggi untuk
mengetahui jumlah volume maksimum yang diberikan kepada hewan uji. Dosis
tertinggi 3,105 g/kgBB, berdasarkan rumus didapatkan volume maksimum yaitu :
D x BB = C x V
3,105g/Kg BB x 200g = 20% x V
V = 3,105 ml/200g BB
Maka dosis aquadest adalah :
V = 0,015525 ml/g BB
V = 0,015525 g/g BB (karena 1ml aquadest sama dengan 1g)
V = 15,525 g/Kg BB
7. Pembutan infusa daun sirih merah
Sebanyak 20 g daun sirih merah direbus selama 15 menit dengan 100 ml
dan di tambahkan volumenya dengan akuadest hingga 100 ml. Konsentrasi infusa
yang didapat adalah 20%.
8. Penyiapan hewan uji
Hewan uji yang digunakan terdiri dari tikus jantan dan betina, galur
Wistar, umur 2- 3 bulan, berat badan 100 – 200 g, berjumlah 40 ekor (20 jantan
dan 20 betina) disiapkan dan ditempatkan dalam metabolic cage. Pada setiap
metabolic cage berisi satu tikus. Tiga hari sebelum dilakukan perlakuan hewan uji
diadaptasikan pada metabolic cage.
9. Pengelompokan hewan uji
Pada penelitian ini digunakan empat puluh ekor tikus, dibagi menjadi
empat kelompok secara acak, yaitu satu kelompok kontrol dan tiga kelompok
perlakuan, masing-masing kelompok uji terdiri dari sepuluh ekor tikus (lima
jantan dan lima betina). Kelompok II sampai IV diberi perlakuan infusa daun sirih
merah dengan peringkat dosis berturut-turut, yaitu 1,38 ; 2,07 ; 3,105 g/kgBB
tikus. Kelompok I, yaitu kelompok kontrol negatif diberi aquadest dengan dosis
15,525 g/Kg BB.
10.Prosedur pelaksanaan toksisitas subkronis
Sediaan uji berupa infusa daun sirih merah diberikan pada hewan uji
sesuai dosis pemberian dengan kekerapan pemberian satu kali sehari selama 28
hari pada tikus jantan dan betina dengan tetap diberi makan dan minum. Pada
awal masa uji, yaitu pada hari ke-1, darah semua tikus diambil melalui sinus
orbital mata, ditampung pada effendorf berisi heparin untuk diambil serum darah
SGPT darah dilakukan di Parahita Medical Lab. Pemberian infusa daun sirih
merah dilakukan selama 28 hari pada setiap kelompok perlakuan sesuai dengan
peringkat dosis. Pada hari ke-29 darah semua tikus diambil melalui vena orbital
mata, ditampung pada effendorf berisi heparin untuk diambil serum darah
kemudian dilakukan pengukuran kadar SGPT darah tikus. Pada hari ke-29 juga
dilakukan pembedahan setengah dari hewan uji baik jantan maupun betina.
Sebelum pembedahan, hewan uji dikorbankan dengan cara cervical dislocation
(dislokasi leher). Dislokasi leher adalah cara mematikan hewan uji dengan cara
menarik leher dan ekor secara bersamaan sehingga tulang leher patah. Kemudian
pada hari ke-42 (14 hari setelah 28) dilakukan pembedahan hewan uji yang tersisa
untuk melihat reversibilitas.
11.Prosedur pembedahan
Pertama-tama disiapkan pot organ yang yag telah diberi label dan yang
sesuai dengan nomor tikus yang akan dibedah dan telah diisi dengan formalin
10% untuk menyimpan organ. Kemudian, menyiapkan alat-alat bedah yang akan
digunakan (gunting bedah, pinset, papan bedah, pins, beker gelas). Beker gelas
digunakan untuk menampung NaCl 0,9% mencuci organ setelah dibedah. Setelah
itu, tikus yang akan dibedah di dislokasi leher terlebih dahulu kemudian posisikan
tikus pada papan bedah menggunakan pins. Bedah dimulai dari bagian perut
sampai bagian leher menggunakan gunting bedah. Kemudian, ambil dan pisahkan
masing-masing organ menggunakan gunting bedah dengan bantuan pinset,
pastikan tiap-tiap organ tidak tercampur, kemudian organ tersebut dicuci dengan
tikus yang dibedah dengan label yang ada di pot organ. Sisa organ tikus yang
tidak terpakai dimasukkan ke dalam kantong plastik dan ditutup rapat agar tidak
ada bau yang keluar, kemudian di kubur.
12. Histopatologi hati
Organ hati diambil dengan cara nekropsi setelah tikus mati. Selanjutnya
pembuatan preparat histopatologi tersebut secara berurutan difiksasi di dalam
larutan buffer netral formalin, trimming, dehidrasi, infiltrasi dengan parafin, diiris
dengan mikrotom dan diwarnai dengan hematosilin-eosin (HE). Pewarnaan
dilakukan dengan cara menginkubasi preparat otot dengan larutan Mayer’s
hematoxilyn selama 5 menit, kemudian diinkubasi dalam larutan Eosin 0,5% yang
sudah ditambah asam asetat (100 : 1).
13.Pengamatan
a. Pengamatan berat badan hewan uji
Pengamatan berat badan terhadap hewan uji dilakukan dengan cara
menimbang hewan uji dengan timbangan. Penimbangan berat badan hewan uji
dilakukan setiap hari. Perhitungan purata berat badan tikus dilakukan dengan cara
menambahkan berat badan tikus kemudian dibagi dengan jumlah tikus ditiap
kelompok dilakukan pada hari 0, 7, 14, 21, 28.
b. Pengukuran asupan pakan hewan uji
Hewan uji diberikan asupan pakan setiap hari sebanyak 20 g dan
dilakukan penggantian pakan setiap harinya. Cara mengukur besarnya asupan
pakan tikus yaitu dengan menimbang pakan yang diberikan pada hari pertama,
Selisih penimbangan antara berat pakan hari kedua dengan berat badan hari
pertama, dihitung sebagai asupan makanan yang dihabiskan pada hari pertama.
c. Pengukuran asupan minun hewan uji
Hewan uji diberikan minum berupa aquadest sebanyak 150 ml. Minuman
diberikan dalam wadah botol kaca yang diberi pipa seperti tabung reaksi yang
diberi lubang pada ujungnya. Pengukuran asupan minum hewan uji dilakukan
dengan cara memasukkan 150 ml air pada wadah dihari pertama, kemudian pada
hari kedua jumlah sisa air yang masih terdapat dalam botol dihitung. Air minum
yang dihabiskan tikus pada hari pertama dihitung dengan cara mengurangkan
jumlah air minum yang diberikan pada hari pertama dengan jumlah air minum
sisa pada hari kedua.
14.Analisis data
a. Pemerikasaan kadar SGPT darah
Data kadar SGPT darah tikus dianalisis dengan uji Kolmogorov Smirnov
untuk melihat distribusi data tiap kelompok. Apabila distribusi data normal maka
analisis dilanjutkan dengan analisis pola searah (One Way ANOVA) dengan taraf
kepercayaan 95% , jika teerdapat perbedaan yang bermakana (p<0,05) maka
dilanjutkan dengan uji Scheffe untuk mengetahui perbedaan masing-masing
kelompok. Apabila hasil analisis dengan uji Kolmogorov Smirnov data
menunjukkan distribusi yang tidak normal maka analisis dilanjutkan dengan
analisis non parametrik, yaitu Kruskal Walis untuk melihat perbedaan kadar
SGPT darah antar kelompok, dilanjutkan dengan uji Mann Whitney untuk
Untuk mengetahui ada tidaknya perbedaan bermakna sebelum dan
sesudah perlakuan dilakukan paired-T test untuk tiap kelompok.
b. Pengamatan berat badan hewan uji
Data perubahan berat badan merupakan data pendukung dengan dihitung
purata kenaikan berat badan pada hari ke 0, 7, 14, 21, dan pada hari ke 28. Data
perubahan berat dilakukan dianalisis dengan menggunakan General Linier Model
(dengan metode multivariate).
c. Pengukuran asupan pakan hewan uji
Data pengukuran asupan pakan hewan uji dilakukan dengan menghitung
purata harian asupan pakan hewan uji. Setelah 28 hari, profil pola makan dibuat
dengan menggunakan grafik.
d. Pengukuran asupan minum hewan uji
Data pengukuran asupan minum hewan uji dilakukan dengan menghitung
purata harian asupan minum hewan. Setelah 28 hari, profil pola minum dibuat
dengan menggunakan grafik.
e. Histopatologi hati
Pembacaannya preparat dilakukan di Fakultas Kedokteran Hewan
Universitas Gadjah Mada. Perubahan hati yang diamati meliputi kejadian
degenerasi dan nekrosis dari sel hati di sekitar vena porta dan vena sentralis.
Pengamatan dilakukan di bawah mikroskop cahaya pembesaran 400x dengan
28
BAB IV
HASIL DAN PEMBAHASAN
Penelitian ini bertujuan untuk membuktikan ada atau tidaknya potensi
efek toksik dari infusa daun sirih merah, terutama untuk mengetahui spektrumnya
terhadap kadar SGPT darah dan hati yang dinilai dari perubahan kadar SGPT
darah dan histopatologi hati serta mengungkapkan kekebaratan antara dosis
dengan spektrum efek toksik.
A. Determinasi Tanaman Sirih merah
Determinasi tanaman bertujuan untuk menentukan nama atau jenis
tanaman dengan spesifik dan tepat karena tumbuhan memiliki berbagai jenis
varietas. Hal ini berguna dalam pemanfaatan tanaman tersebut sehingga tidak
menimbulkan masalah. Determinasi dilakukan dengan cara mencocokkan
tanaman pada determinasi tanaman sirih merah yang telah dilakukan oleh
Martinus Supriadi Krisanto.
Setelah dilakukan determinasi, disimpulkan bahwa tanaman sirih merah
yang digunakan dalam penelitian ini adalah benar tanaman sirih merah dengan
nama ilmiah Piper crocatum Ruiz & Pav. Determinasi ini telah disahkan oleh Pak
Yohanes Dwiatmaka, M.Si. Surat determinasi dapat dilihat pada lampiran 7.
B. Serbuk dan Kadar Air Daun Sirih Merah
Daun sirih merah basah sebanyak 1 Kg, dicuci, ditiriskan kemudian
dikeringkan dengan bantuan oven pada suhu ±500C selama 24 jam. Setelah itu
nomor 30. Tujuan dari pengayakan ini adalah untuk mendapatkan ukuran serbuk
yang seragam. Dari penyerbukkan dan pengayakan tersebut didapatkan sejumlah
230,18 g serbuk daun sirih merah, lalu dilakukan perhitungan rendemen.
Perhitungan rendemen dilakukan untuk mengetahui berapa persen serbuk daun
sirih merah dari daun sirih merah basah yang diperoleh. Rendemen yang
didapatkan sebesar 23,018%.
Serbuk yang telah dibuat diuji kadar airnya untuk memenuhi syarat
serbuk yang baik, yaitu tidak lebih dari 10% (Menteri Kesehatan RI, 1994).
Penetapan kadar air ini menggunkan metode gravimetri. Prinsip dari metode ini
yaitu analisis kuantitatif berdasarkan berat tetapnya (berat konstan) (Sudjadi,
2010). Dari serbuk sirih merah yang dibuat diperoleh kadar air sebesar 9,48 %,
kadar air ini telah memenuhi syarat Menteri Kesehatan. Sehingga dapat
disimpulkan bahwa serbuk yang dibuat sudah baik.
C. Kadar SGPT Darah Tikus Akibat Pemberian Infusa Daun Sirih Merah
Tujuan dari penelitian ini adalah untuk memenentukan spektrum efek
toksik infusa daun sirih merah terhadap kadar SGPT darah dan hati, maka
dilakukan pemeriksaan terhadap kadar SGPT darah untuk mengungkapkan
spektrum efek toksik. Pemeriksaan kadar SGPT darah dilakukan sebelum (pre)
dan sesudah (post) pemberian infusa daun sirih merah selama 28 hari. Tujuan dari
pengambilan pada hari ke-28 yaitu untuk melihat kebermaknaan perbedaan kadar
SGPT darah diantara sebelum dan setelah perlakuan. Dari hasil uji tersebut
uji yang digunakan sama namun memiliki perlakuan yang berbeda dan melihat
apakah terdapat pengaruh pemberian infusa daun sirih merah yang bermakna pada
pre (sebelum) dan post (setelah) perlakuan ditiap kelompok perlakuan.
Pengukuran kadar SGPT menggunakan ARCHITECT 7D56 ALT,
menggunakan metode NADH (tanpa P-5’-p). Prinsip dari metode ini, yaitu
mengukur tingkat penurunan absorbansi pada 340 nm karena oksidasi NADH ke
NAD. SGPT atau ALT (Alanin Aminotransferase) yang ada di sampel akan
mengkatalisis transfer gugus amino L-alanin ke α-ketoglutarat, membentuk
piruvat dan L-glutamat. Piruvat dengan adanya NADH dan laktat dehydrogenase
(LD) direduksi menjadi L-laktat.
Pada penelitian ini terdapat empat kelompok perlakuan, yaitu kelompok
perlakuan infusa daun sirih merah dosis 1,38 ; 2,07 ; 3.105 g/Kg BB dan
kelompok kontrol negatif aquadest dengan dosis 15,525 g/Kg BB. Pelarut yang
digunakan pada infusa daun sirih merah yaitu aquadest maka, aquadest dijadikan
sebagai kelompok kontrol negatif. Tujuannya untuk melihat apakah penggunaan
aquadest sebagai pelarut infusa daun sirih merah dapat memberikan pengaruh
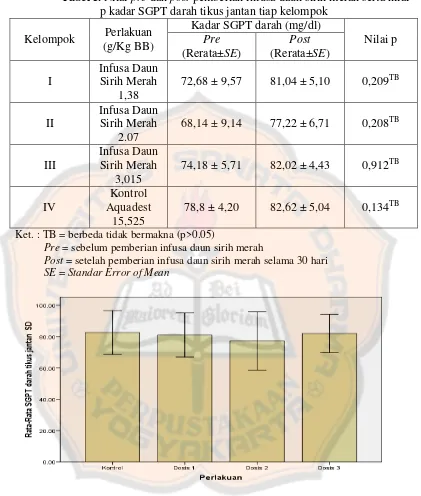
Tabel I. Nilai pre dan post pemberian infusa daun sirih merah serta nilai p kadar SGPT darah tikus jantan tiap kelompok
Kelompok Perlakuan (g/Kg BB)
Kadar SGPT darah (mg/dl)
Nilai p
Ket. : TB = berbeda tidak bermakna (p>0.05)
Pre = sebelum pemberian infusa daun sirih merah
Post = setelah pemberian infusa daun sirih merah selama 30 hari SE = Standar Error of Mean
Gambar 2. Diagram batang rata-rata pengaruh pemberian infusa daun sirih merah terhadap kadar SGPT darah tikus jantan antar kelompok perlakuan
Dari tabel I dapat dilihat bahwa kadar SGPT darah jantan berbeda tidak
dengan One-Way Anova juga didapatkan bahwa tidak ada perbedaan yang
signifikan antara kelompok perlakuan dengan kontrol negatif ini dilihat dari tidak
adanya nilai p<0,05. Maka dapat disimpulkan bahwa pemberian infusa daun sirih
merah tidak berpengaruh terhadap kadar SGPT darah pada hewan uji jantan.
Tabel II. Nilai pre dan post pemberian infusa daun sirih merah serta nilai p kadar SGPT darah tikus betina tiap kelompok
Kelompok Perlakuan (g/kgBB)
Kadar SGPT darah (mg/dl)
Nilai p
III Infusa Daun Sirih
Merah 3,015 59,2 ± 3,24 71,3 ± 3,73 0,321
TB
IV Kontrol Aquadest
15,525 66,16 ± 5,81 65,32 ± 2,44 0,022
B
Ket. : TB = berbeda tidak bermakna (p>0.05) B = berbeda bermakna (p<0.05) Pre = sebelum pemberian infusa daun sirih merah
Post = setelah pemberian infusa daun sirih merah selama 30 hari SE = Standar Error of Mean
Gambar 3. Diagram batang rata-rata pengaruh pemberian infusa daun sirih merah terhadap kadar SGPT darah tikus betina antar kelompok perlakuan
Dari tabel II, diketahui bahwa terdapat perbedaan bermakna (p>0,05) antara
One-Way Anova, terdapat perbedaan yang tidak signifikan sehingga dapat diketahui
bahwa pada perbedaan yang terjadi masih dalam batas normal. Hasil dari uji
One-Way Anova, didapatkan bahwa terdapat perbedaan yang tidak signifikan pada kadar
SGPT tikus betina antara kontrol dan perlakuan setelah penelitian sehingga diketahui
bahwa pemberian infusa daun sirih merah tidak mempengaruhi kadar SGPT darah
tikus betina.
D. Histopatologi Hati
Tujuan dari penelitian ini adalah untuk mengetahui spektrum efek toksik
dari pemberian infusa daun sirih merah terhadap histopatologi hati pada tikus
jantan dan tikus betina. Maka, perlu dilakukan pembuatan preparat histopatologi
hati tikus jantan dan betina setelah pemberian infusa daun sirih merah selama 28
hari. Selain itu, juga ingin mengetahui sifat dari efek toksik (terbalikan atau tak
terbalikan) yang muncul, sehingga juga dibuat preparat pada hari ke-42. Dari
penelitian ini ditemukan adanya perubahan gambaran struktur histopatologis hati
berupa degenerasi melemak, degenerasi hidropik, hepatitis, dan multifokal
nekrosis. Hasil pemeriksaan histopatologi hati tikus dapat dilihat pada tabel III.
Tabel III. Hasil pemeriksaan histopatologis hati pada tikus jantan
Kelompok Perlakuan (g/Kg BB)
Gambaran Histologis Hati
Hari ke-28 Hari ke-42
Kontrol
aquadest
15,525
Ditemukan satu tikus mengalami perubahan multifokal nekrosis (terdapat nekrosis sel yang banyak pada satu tempat), satu tikus mengalami degenerasi hidropik (ditandai dengan adanya vakuola berbatas tidak jelas), sedangkan satu tikus tidak mengalami perubahan yang spesifik pada vena sentral, sinusoid, dan hepatosit.
Dari dua tikus jantan tidak ditemukan adanya perubahan yang spesifik pada vena sentral, sinusoid, dan hepatosit.
IDSM 1,38
Dari tiga tikus jantan tidak ditemukan adanya perubahan yang spesifik pada vena sentral, sinusoid, dan hepatosit.
Ditemukan satu tikus jantan mengalami hepatitis (dilihat dari adanya pembengkakan pada hepatosit), dan satu tikus lainnya tidak mengalami perubahan yang spesifik pada vena sentral, sinusoid, dan hepatosit.
IDSM 2,07
Ditemukan satu dari tiga tikus jantan mengalami degenerasi hidropik (ditandai dengan adanya vakuola berbatas tidak jelas) dan yang dua lainnya tidak mengalami perubahan yang spesifik pada vena sentral, sinusoid, dan hepatosit
Dari dua tikus jantan tidak ditemukan adanya perubahan yang spesifik pada vena sentral, sinusoid, dan hepatosit.
IDSM 3,105
Dari tiga tikus jantan tidak ditemukan adanya perubahan yang spesifik pada vena sentral, sinusoid, dan hepatosit.
Dari dua tikus jantan tidak ditemukan adanya perubahan yang spesifik pada vena sentral, sinusoid, dan hepatosit.
Tabel IV. Hasil pemeriksaan histopatologis hati pada tikus betina
Kelompok Perlakuan (g/Kg BB)
Gambaran Histologis Hati
Hari ke-28 Hari ke-42
Kontrol
aquadest
15,525
Dari tiga tikus betina tidak ditemukan adanya perubahan yang spesifik pada vena sentral, sinusoid, dan hepatosit.
Ditemukan satu tikus betina mengalami degenerasi melemak (ditandani dengan adanya vakuola yang berbatas jelas) sedangkan tikus betina yang satunya tidak ditemukan adanya perubahan yang spesifik pada vena sentral, sinusoid, dan hepatosit. IDSM 1,38 Dari tiga tikus betina ditemukan,
satu tikus betina yang
mengalami degenerasi hidropik (ditandai dengan adanya vakuola berbatas tidak jelas). Sedangkan dua tikus betina lainnya tidak ditemukan adanya perubahan yang spesifik pada vena sentral, sinusoid, dan hepatosit.
Dari kedua tikus betina tidak ditemukan adanya perubahan yang spesifik pada vena sentral, sinusoid, dan hepatosit.
IDSM 2,07 Dari tiga tikus betina tidak ditemukan adanya perubahan yang spesifik pada vena sentral, sinusoid, dan hepatosit.
Dari dua tikus betina tidak ditemukan adanya perubahan yang spesifik pada vena sentral, sinusoid, dan hepatosit.
IDSM 3,105 Dari tiga tikus betina ditemukan, satu tikus mengalami degenerasi melemak (ditandani dengan adanya vakuola yang berbatas jelas) sedangkan dua tikus lainnya mengalami degenerasi hidropik (ditandai dengan adanya vakuola berbatas tidak jelas).
Dari dua tikus betina ditemukan, satu tikus mengalami degenerasi hidropik (ditandai dengan adanya vakuola berbatas tidak jelas) dan tikus yang satunya tidak ditemukan adanya perubahan yang spesifik pada vena sentral, sinusoid, dan hepatosit.
Gambar 4. Histopatologi hati normal. Anak panah hitam menunjukkan vena sentralis, anak panah hijau menunjukkan sinusoid, dan anak panah biru
menunjukkan hepatosit
Gambar 5. Gambaran perubahan struktur histopatologi hati. (A)Multifokal nekrosis, (B) degenerasi melemak, (C) degenerasi hidropik,
dan (D) hepatitis.
Degenerasi hidropik ditandai dengan adanya vakuola berbatas tidak jelas
di dalam sitoplasma hepatosit. Degenerasi ini terjadi akibat adanya gangguan
oksidasi pada sel, sehingga sel tidak dapat mengeliminasi air dan air tertimbun di
A B
dalam sel, sehingga terjadi pembengkakan. Degenerasi hidropik terjadi pada
kelompok perlakuan dosis 2,07 g/Kg BB jantan, kontrol jantan, dan dosis 1,38
g/Kg BB betina pada hari ke-28, tetapi tidak terdapat pada hari ke-42, sehingga
diketahui bahwa degenerasi hiropik yang terjadi sifatnya reversible. Selain itu,
degenerasi hiropik juga terjadi pada kelompok perlakuan dosis 3,105 g/Kg BB
betina pada hari ke-28 dan ke-42, sehingga diketahui bahwa degenerasi hidropik
yang terjadi sifatnya ireversibel. Degenerasi hidropik, merupakan perubahan yang
sifatnya reversible jika ditemukan pada kelompok perlakuan dosis 3,105 g/Kg BB
betina pada hari ke-42 masih terdapat degenerasi hidropik maka dapat
disimpulkan bahwa waktu istirahat setelah pemejanan masih belum cukup
sehingga masih terjadi degenerasi lemak.
Degenerasi melemak ditandai dengan adanya vakuola-vakuola berbatas
jelas di dalam sitoplasma. Degenerasi melemak terjadi pada kelompok betina
dosis 3,105 g/Kg BB pada hari ke-28, tetapi pada hari ke-42 tidak terdapat
degenerasi melemak. Selain itu, degenerasi melemak juga terdapat pada kelompok
kontrol aquadest dosis 15,525 g/Kg BB betina pada hari ke-42, tetapi tidak
terdapat pada hari ke-28. Sehingga dapat diketahui bahwa degenerasi melemak
yang terjadi sifatnya individual dan tidak terpengaruh oleh pemberian infusa daun
sirih merah.
Multifokal nekrosis merupakan nekrosis yang terjadi secara
berkelompok, dapat terjadi karena adanya infeksi bakteri. Nekrosis merupakan
kerusakan pada sel hati. Multifokal nekrosis ini hanya terjadi pada kontrol jantan
terjadi adalah nekrosis yang bersifat individual dan tidak terpengaruh oleh
pemberian infusa daun sirih merah.
Hepatitis, ditemukan adanya infiltrasi limfosit dan sel Kuffer yang
bersifat multifokal di parenkim hati. ini dilihat dari adanya sel-sel hepatosit yang
rusak. Hepatitis ini hanya terjadi pada kelompok perlakuan jantan dosis 1,38 g/Kg
BB pada hari ke-42, sehingga dapat diketahui bahwa hepatitis yang terjadi bukan
akibat dari pemberian infusa daun sirih merah. Hal ini dapat disebabkan oleh
kerusakan hepar sebelumnya selain itu juga dapat dipengaruhi oleh beberapa
faktor lainnya misalnya faktor stress tikus, pengaruh zat atau penyakit lain, serta
faktor internal lain seperti daya tahan tikus.
E. Perubahan Berat Badan Tikus Jantan dan Betina Akibat Pemberian Infusa Daun Sirih Merah
Pada penelitian penimbangan berat badan tikus percobaan dilakukan
setiap hari selama 28 hari, kemudian setiap minggu di rata-rata per kelompok
perlakuan. Tujuannya untuk mengetahui kesehatan hewan uji, karena perubahan
berat badan hewan uji merupakan salah satu data pendukung dalam uji toksisitas.
Selain itu, berat badan juga mempengaruhi volume pemberian dari infusa daun
sirih merah dan kontrol. Analisis perubahan berat badan tikus jantan dan betina
dilakukan dengan uji General Linear Model (dengan metode Multivariate).
Hewan uji yang mengalami penurunan dan peningkatan berat badan setelah
terpapar senyawa beracun dapat dikonfirmasi dengan adanya pemeriksaan seperti
tikus jantan dan tikus betina. Hasil penimbangan berat badan tikus disajikan pada
Tabel V dan VI.
Tabel V. Purata berat badan ± SE tikus jantan akibat pemberian infusa daun sirih merah
Kelompok Perlakuan (g/kgBB) IDSM = Infusa Daun Sirih Merah
Gambar 6. Grafik perubahan berat badan tikus jantan selama pemberian infusa daun sirih merah
Keterangan :
Dosis 1 = kelompok pemberian infusa daun sirih merah 1.38 g/Kg BB Dosis 2 = kelompok pemberian infusa daun sirih merah 2,07 g/Kg BB Dosis 3 = kelompok pemberian infusa daun sirih merah 3,105 g/Kg BB Kontrol = kontrol aquadest 15,525 g/Kg BB
Tabel VI. Purata berat badan ± SE tikus betina akibat pemberian infusa daun sirih merah
Kelompok Perlakuan (g/kgBB) IDS = Infusa Daun Sirih Merah
Gambar 7. Grafik perubahan berat badan tikus betina selama pemberian infusa daun sirih merah
Keterangan :
Dosis 1 = kelompok pemberian infusa daun sirih merah 1.38 g/Kg BB Dosis 2 = kelompok pemberian infusa daun sirih merah 2,07 g/Kg BB Dosis 3 = kelompok pemberian infusa daun sirih merah 3,105 g/Kg BB Kontrol = kontrol aquadest 15,525 g/Kg BB
Dari tabel V dan VI menunjukkan purata berat badan tiap kelompok ±
SE, yaitu apabila purata berat badan dikurangi atau ditambah dengan SE maka
nilai ini akan menggambarkan rentang nilai berat badan tikus paling ringan
sampai berat badan tikus yang paling tinggi. Hasil analisis dengan uji General
Linear Model (metode Multivariate) terhadap tikus jantan menunjukkan hasil
yang berbeda bermakna antara kelompok perlakuan dan kontrol aquadest
(p<0,05), sedangkan pada tikus betina menunjukkan hasil yang berbeda tidak
bermakna antara kelompok perlakuan dan kontrol aquadest (p>0,05). Pada
gambar 6 dan gambar 7, dapat dilihat bahwa terdapat kenaikan berat badan hewan
uji selama percobaan.
Dari hasil tersebut dapat disimpulkan bahwa infusa daun sirih merah
mempengaruhi berat badan tikus jantan tetapi ini hanya karena proses
pertumbuhan dari tikus jantan. Sedangkan, pada tikus betina pemberian infusa
daun sirih merah tidak mempengaruhi berat badan tikus betina, peningkatan berat
badan yang terjadi akibat dari pertumbuhan tikus sendiri.
F. Asupan Pakan Tikus Jantan dan Betina Akibat Pemberian Infusa Daun Sirih Merah
Asupan pakan tikus juga merupakan salah satu data pendukung dalam uji
toksisitas. Pengukuran asupan pakan ini dilakukan setiap hari dan dirata-rata
untuk masing-masing kelompok perlakuan. Pola makan dapat mempengaruhi
perubahan berat badan tikus jantan dan betina. Apabila terjadi perbedaan
bermakna pada perubahan berat badan tikus maka kemungkinan hal tersebut
disebabkan adanya efek dari pemberian infusa daun sirih merah atau pola makan
tikus. Data asupan pakan tikus jantan dan betina tidak dianalisis menggunakan uji