III. METODOLOGI PENELITIAN
A. Waktu dan Tempat Penelitian
Penelitian ini telah dilaksanakan pada bulan Maret – Agustus 2015 di Laboraturium Biokimia Jurusan Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Lampung.
B. Alat dan Bahan
Peralatan yang digunakan pada penelitian ini adalah autoclave (model S-90N), laminar air flow (CURMA model 9005-FL), timbangan digital, inkubator, sentrifuga, magnetic stirer, tabung sentrifuga, mikropipet, waterbath, oven, shaker, spektrofotometer UV-Vis, inkubator, kasa, kapas, rak tabung, jarum ose, penangas, dan alat-alat gelas lain seperti tabung reaksi, cawan petri, erlenmeyer, beaker gelas, gelas ukur, labu ukur, pipet tetes, batang pengaduk, serta pemanas bunsen, dan kompor gas.
Bahan-bahan yang digunakan adalah Potato Dextrose Agar (PDA), agar bakteri, (NH4)2SO4, KH2PO4 CaCl2, MgSO4·7H2O, urea, FeSO4·7H2O, pepton, yeast ekstrak, dekstrosa, KCl, ekstrak kentang, Carboxymethyl Cellulase (CMC), reagen folin-ciocalteu, akuades, Na(K)- Tartarat, NaH2PO4, Na2HPO4, pereaksi DNS
(dinitrosalisilic acid), fenol, NaOH, Na2SO4, CuSO4·5H2O, Na2CO3, HCl, KI, I2, buffer fosfat, aseton, etanol, asam trikloroasetat, larutan kasein 1%, fenolftalein 1%, minyak zaitun, dan pati. Mikroorganisme yang akan digunakan adalah jamur Trichodermakoningii yang diperoleh dari Laboratorium Hama dan Penyakit Jurusan Agroteknologi Fakultas Pertanian Universitas Lampung.
C. Prosedur Penelitian
a. Pembuatan Medium
1. Medium Padat Saboroud Agar
Prosedur pertama dalam pembuatan medium padat saboroud agar adalah dengan menimbang 40 g/L dektrosa, 20 g/L agar, dan 15 g/ L pepton. Kemudian dimasukkan semua bahan ke dalam Erlenmeyer 250 mL,
ditambahkan akuades sebanyak 100 mL dan dipanaskannya di atas kompor gas. Selanjutnya dilakukan sterilisasi dengan menggunakan autoclave pada suhu 121 ºC dengan tekanan 1 atm selama 15 menit. Setelah itu medium saboroud agar dituangkan ke beberapa tabung reaksi atau dimasukkan ke dalam cawan petri dilakukan di dalam laminar air flaw dan dibiarkan dalam posisi tabung miring hingga memadat pada suhu kamar.
2. Pembuatan Medium Cair
Medium cair starter digunakan untuk adaptasi awal pertumbuhan jamur pada medium cair, sedangkan untuk kultur digunakan medium cair dengan volume yang lebih besar. Prosedur pertama pembuatan medium cair dengan
(NH4)2SO4, 0,1 g/L CaCl2, 5 g/L pepton; 5 g/L CMC; dan 5 g/L yeast ekstrak . Kemudian dimasukkan semua bahan ke dalam Erlenmeyer 250 mL, lalu ditambahkan akuades sebanyak 100 mL dan dipanaskannya di atas kompor gas. Selanjutnya disterilisasi dengan menggunakan autoclave pada suhu 121 ºC dengan tekanan 1 atm selama 15 menit. Didiamkan medium cair di dalam laminar air flaw hingga mencapai suhu kamar kemudian jamur dapat
diinkulasi ke media cair. Untuk media cair starter di shaker dengan kecepatan 110 rpm selama 24 jam dan untuk kultur komposisinya sama hanya
volumenya lebih besar dan waktunya menyesuaikan dengan kurva pertumbuhannya.
b. Pembuatan Pereaksi 1. Pereaksi Lowry.
Pereaksi Lowry terdiri atas 4 macam, yang meliputi Pereaksi A, B, C, dan D. Masing-masing pereaksi tersebut dibuat dengan cara sebagai berikut: Pereaksi A: dilarutkan 2 g Na2CO3 dalam 100 mL NaOH 0,1 N; Pereaksi B:
ditambahkan 5 mL larutan CuSO4.5H2O 1% (w/v) ke dalam 5 mL larutan Na(K)-tartarat 1% (w/v); Pereaksi C: ditambahakan 2 mL pereaksi B ke dalam 100 mL pereaksi A; dan Pereaksi D: diencerkan reagen Folin-Ciocelteau dengan akuades 1:1.
2. Pereaksi Mandels
Pereaksi Mandels merupakan DNS (dinitrosalisilic acid), yang dibuat dengan menimbang 1g DNS, 1 g NaOH, 0,2 g fenol, 0,05 g Na2SO4, dan ditambahkan
1 mL Na/ K tartarat 40% dan dimasukkan dalam labu ukur 100 mL kemudian ditambahkan sedikit akuades kocok hingga larut dan ditambahkan akuades sampai batas miniskus.
3. Pereaksi Fuwa
Pereaksi Fuwa terdiri dari pembuatan larutan iodine dengan cara 2 g KI dilarutkan dalam 100 mL akuades; pembuatan larutan HCl 0,1 N ; dan pembuatan larutan pati sebagai substrat dengan 0,1 g pati dilarutkan dalam 100 mL akuades kemudian dipanaskan hingga larut.
4. Pereaksi Kunitz
Pereaksi kunitz terdiri dari larutan kasein 1% yaitu 1gr kasein dilarutkan dalam buffer fosfat pH 7 dan dipanaskan hingga larut, kemudian larutan TCA 5% yaitu 5 gr asam trikloroasetat (TCA) dilarutkan dalam 100 mL akuades, dan larutan standar yaitu sebanyak 5 mL tirosin dengan kadar 20-250 ppm.
5. Pereaksi Lipase
Pereaksi yang digunakan dalam penentuan aktivitas enzim lipase ini adalah buffer fosfat 0,05 M (pH: 8), aseton:etanol (1:1), fenolftalein 1%, NaOH 0,05 N, dan minyak zaitun sebagai substrat.
c. Isolasi Jamur Patogen (Phytophthorapalmivora) pada Busuk Buah Kakao
Jamur patogen diisolasi dari sampel buah kakao yang terkena penyakit. Dan diambil dari Pringsewu yang merupakan salah satu daerah penghasil kakao
terbesar di Lampung. Melakukan isolasi patogen dari buah kakao bagian yang sakit kurang lebih dipotong (0,5cm x 0,5cm), kemudian direndam ke dalam alkohol 70% selama ±3 menit, lalu dicuci dengan akuades steril dan diletakkan di atas kertas saring hingga sedikit kering kemudian ditanam atau diisolat di dalam media saboroud agar atau PDA, selanjutnya diletakkan isolat di inkubator selama 7- 9 hari, setelah itu dipindahkan hasil isolat ke media saboroud agar yang baru atau dimurnikan.
d. Penumbuhan Jamur Antagonis (Trichoderma koningii)
Menginokulasi jamur Trichoderma koningii pada media padat saboraud agar. Dilakukan inokulasi dengan metode tusuk ke dalam cawan petri ataupun tabung reaksi. Kemudian diinkubasi dalam inkubator selama ±2-3 hari hingga jamur yang diinginkan tumbuh dan tidak terkontaminasi dengan jamur lain.
e. Uji Antagonisitas Trichoderma koningii dalam Menekan Perkembangan
Phytophthora palmivora pada Buah Kakao
Melakukan uji antagonisitas Trichodermakoningii terhadap Phytophthora palmivora dengan cara menyiapkan medium PDA steril dalam cawan petri
(diameter 9 cm), kemudian dua kertas bentuk bulatan masing- masing mempunyai diameter 4 mm (seperti yang dilakukan oleh Tondje, et al., 2007) masing-masing meletakkan di bagian pinggir cawan dengan arah berlawanan. Menginokulasi kertas bulatan yang pinggir sebelah kanan dengan suspensi konidia Trichoderma koningii sebanyak 0,1 mL dan kertas bulatan sebelah kiri dengan suspensi
zoospora P. palmivora sebanyak 0,1 mL. Pembuatan kontrol, yakni Phytophthora palmivora tanpa berdampingan dengan Trichodermakoningii (diganti air steril).
Selanjutnya menginkubasi selama 5x24 jam, kemudian mengukur diameter koloni Phytophthora palmivora masing-masing yang berdampingan dengan Trichoderma koningii, yang diberi simbol (Pt) dan kontrol (tanpa Trichodermakoningii) diberi simbol (Pk). Persentase antagonisitas Trichodermakoningii ditentukan dengan rumus:
Persentase antagonis :{( Pk – Pt) / Pk } x 100% Keterangan:
Pt : diameter koloni Phytophthora palmivora berdampingan dengan Trichoderma koningii (cm)
Pk : diameter kontrol (tanpa Trichodermakoningii) (cm) (Singh, et al., 2002).
f. Produksi Enzim
Melakukan produksi enzim dengan menyiapkan medium starter dan medium kultur. Starter disiapkan dengan menginokulasikan 2 ose isolat ke dalam 5 mL medium cair, kemudian diinkubasi pada shaker dengan kecepatan 110 rpm selama 24 jam. Starter selanjutnya akan digunakan untuk menginokulasikan ke dalam medium kultur. Medium kultur menggunakan medium yang mengandung CMC, pepton, yeast extract, KH2PO4, MgSO4·7H2O,CaCl2, urea, dan(NH4)2SO4. Kemudian diinkubasi media ke dalam media kultur dan shaker dengan kecepatan 110 rpm selama 10 hari kemudian sampel diambil secara berkala 24 jam, 48 jam, sampai 240 jam. Melakukan proses sampling pada media kultur dengan cara sentrifugasi untuk mendapatkan ekstrak kasar enzim yang kemudian dapat menentukan pertumbuhan selnya, dan menguji aktivitasnya.
g. Penentuan Pertumbuhan Sel
Penentuan pertumbuhan sel digunakan untuk mengetahui pertumbuhan dari sel bakteri dengan cara mengencerkan sampel kultur. Sebanyak 0,3 mL kultur dimasukan ke tabung reaksi, lalu menambahkan 2,7 mL akuades, dan mengukur serapannya menggunakan spektrofotometer UV-VIS pada panjang gelombang 600 nm.
h. Uji Aktivitas Ekstrak Kasar Enzim 1. Uji Kadar Protein Enzim
Menambahkan sebanyak 100 µL larutan enzim ke dalam 0,9 mL akuades dan ditambah 0,5 mL pereaksi D, kemudian diaduk dan didiamkan selama 30 menit pada suhu kamar, lalu absorbansinya diukur pada λmaks 750 nm. Untuk kontrol, mengganti enzim dengan akuades. Selanjutnya diperlakukan sama seperti sampel.
2. Uji Aktivitas Enzim Selulase
Metode ini berdasarkan glukosa yang terbentuk (Mandels et al., 1976). Dimasukkan sebanyak 0,25 mL enzim, 0,25 mL larutan CMC 0,5% dalam akuades lalu menginkubasi selama 60 menit pada suhu 50oC. Kemudian menambahkan 1 mL pereaksi DNS (dinitrosalisilic acid) dan mendidihkan selama 10 menit pada penangas air. Selanjutnya menambahkan 1,5 mL akuades lalu didinginkan. Setelah dingin, serapannya diukur menggunakan spektrofotometer UV-Vis pada λ 510 nm. Menentukan kadar glukosa yang terbentuk dengan menggunakan kurva standar glukosa.
3. Uji Aktivitas Enzim Amilase
Sebanyak 0,25 mL enzim, 0,25 mL pati kemudian diiinkubasi selama 10 menit dengan suhu 60 oC lalu ditambahkan 0,25 mL HCl 0,1 N, 0,25 mL I2 tambah 4 mL akuades diaduk dan diukur pada λ 600 nm ini untuk perlakuan pada sampel, sedangkan untuk kontrol sebanyak 0,25 mL enzim, 0,25 mL HCl 0,1 N kemudian diinkubasi selama 10 menit dengan suhu 60 oC lalu ditambahkan 0,25 mL pati , 0,25 mL I2 ditambahkan 4 ml akuades diaduk dan diukur pada λ 600 nm.
4. Uji Aktivitas Enzim Protease dengan Metode Kunitz
Larutan kasein (substrat) sebanyak 1 mL dengan 1 mL larutan enzim dalam tabung reaksi dan diinkubasi pada suhu 60 oC selama 30 menit. Kemudian tabung reaksi dikeluarkan dan ditambahkan 3 mL TCA, lalu diaduk dan didiamkan selama 30 menit pada suhu kamar hingga mengendap sempurna. Setelah itu dilakukan penyaringan atau sentrifugasi untuk memisahkan endapan. Filtrat diukur pada λ 280 nm. Membuat kontrol dengan menambahkan larutan TCA sebelum enzim, kemudian diinkubasi.
5. Uji Aktivitas Enzim Lipase
Pengukuran aktivitas enzim ekstrak kasar dilakukan dengan metode titrimetri (Tunggala, 2010). Sebanyak 2 ml minyak zaitun dalam Erlenmeyer 100 ml, ditambah 1 ml buffer fosfat 0,05 M (pH 8) dan 1 ml larutan enzim. Campuran substrat enzim ini kemudian dikocok menggunakan shaker inkubator pada 30 °C selama30 menit. Setelah 30 menit substrat enzim diinaktifkan dengan
menggunakan campuran aseton: etanol (1:1) sebanyak 1 mL. Campuran tersebut ditambahkan 5 tetes fenolftalein 1% sebagai indikator dan dititrasi dengan menggunakan larutan NaOH 0,05 N. Titrasi dihentikan setelah campuran berubah menjadi merah muda (Nurhasanah dan Herasari, 2008). Aktivitas enzim lipase ditunjukkan dengan perubahan warna saat titrasi dari tidak berwarna menjadi berwarna merah muda. Perlakuan untuk kontrol dilakukan sama seperti perlakukan untuk uji aktivitas enzim dimana enzim digantikan oleh akuades. Aktivasi lipase dapat dihitung dengan cara sebagai berikut:
Aktivitas lipase (U/mL)
Keterangan :
A = Volume (mL) NaOH untuk titrasi sampel B = Volume (mL) NaOH untuk titrasi blanko 1000 = Konversi dari mmol ke µmol
30 = Waktu inkubasi VE = Volume enzim
i. Pemurnian enzim
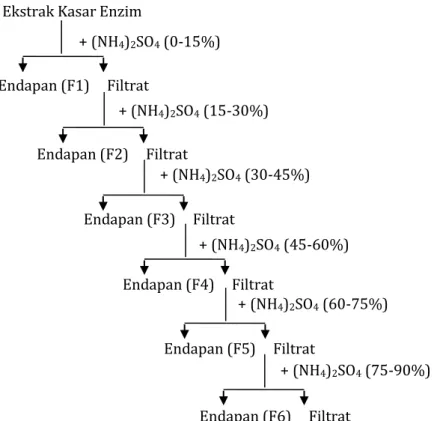
Pemurnian enzim dilakukan dengan fraksinasi menggunakan ammonium sulfat. Fraksinasi dengan ammonium sulfat [(NH4)2SO4] yaitu ekstrak kasar enzim yang diperoleh dimurnikan dengan metode fraksinasi menggunakan garam ammonium sulfat pada berbagai derajat kejenuhan yaitu 0-15%; 15-30%; 30-45%; 45-60% dan 60-80%. Skema proses pengendapan protein enzim dengan penambahan ammonium sulfat ditunjukkan pada Gambar 11. Adapun proses pengerjaannya yaitu ekstrak kasar enzim yang diperoleh diukur volume, selanjutnya dilakukan penambahan garam ammonium sulfat yang telah dihaluskan secara perlahan
sambil diaduk dengan magnetik stirer pada suhu 4 oC. Endapan protein enzim yang didapatkan pada tiap fraksi kejenuhan amonium sulfat selanjutnya
dipisahkan dari filtratnya dengan sentrifugasi dingin pada kecepatan 5000 rpm selama 20 menit. Kemudian endapan yang diperoleh dilarutkan dengan buffer fosfat 0,1 M pH 6,0 dan diuji aktivitasnya dengan metode Mandels, serta diukur kadar proteinnya dengan metode Lowry untuk mengetahui fraksi-fraksi yang mengandung enzim selulase dengan aktivitas spesifik yang tinggi. Filtrat yang didapat dari fraksi 0-15% digunakan untuk diendapkan kembali dengan fraksi kejenuhan 15-30% dengan prosedur yang sama dan seterusnya sampai fraksi 60-80%. Setelah diketahui fraksi-fraksi yang mengandung enzim selulase dengan aktivitas spesifik tertinggi, maka langkah selanjutnya adalah melakukan fraksinasi ulang pada tingkat fraksi tersebut, sehingga enzim dapat terendapkan secara maksimal (Yandri et al., 2010).
Gambar 7. Skema pengendapan protein enzim dengan ammonium sulfat.
j. Uji Antagonisitas Enzim yang Dihasilkan Trichoderma koningii dalam Menekan Perkembangan Phytophthora palmivora pada Buah Kakao
Uji ini dilakukan dengan menggunakan media cawan petri yang sudah ada jamur patogen penyebab busuk buah kakao kemudian di sebalah kiri dan kanan diberi kertas whartman yang mempunyai diameter 4 mm kemudian ditetesi ekstrak kasar enzim kemudian diamati dan usahakan kertasnya tidak boleh kering jadi harus selalu basah dengan ekstrak kasar enzim. Diamati pertumbuhan jamur patogen.
+ (NH4)2SO4 (0-15%)
+ (NH4)2SO4 (15-30%)
Ekstrak Kasar Enzim
Endapan (F1) Filtrat Endapan (F2) Filtrat Endapan (F3) Filtrat + (NH4)2SO4 (30-45%) Endapan (F4) Filtrat + (NH4)2SO4 (45-60%) + (NH4)2SO4 (60-75%) Endapan (F5) Filtrat Endapan (F6) Filtrat + (NH4)2SO4 (75-90%)
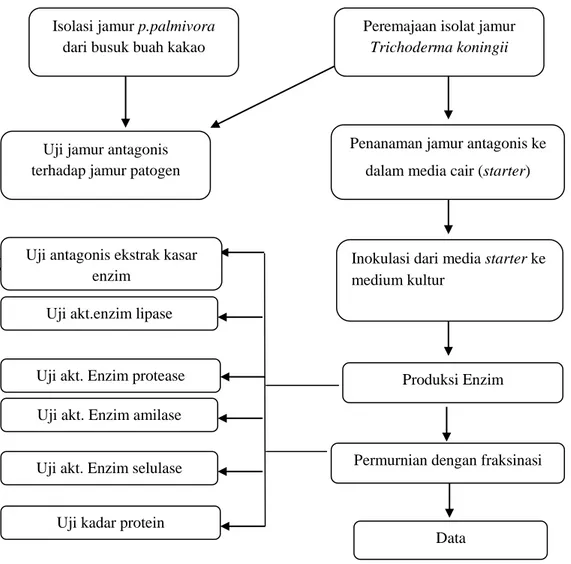
33 Diagram Alir Prosedur Penelitian
316 + (NH4)2SO4 (15-30%) Endapan(F1) Filtrat Endapan(F2) Filtrat Endapan(F3) Filtrat + (NH4)2SO4 (30-45%) Endapan(F4) Filtrat + (NH4)2SO4 (45-60%) + (NH4)2SO4 (60-80%) Endapan(F5) Filtrat
Isolasi jamur p.palmivora dari busuk buah kakao
Peremajaan isolat jamur Trichoderma koningii
Uji jamur antagonis terhadap jamur patogen
Penanaman jamur antagonis ke dalam media cair (starter)
Inokulasi dari media starter ke medium kultur
Uji antagonis ekstrak kasar enzim
Uji akt.enzim lipase
Uji akt. Enzim protease Uji akt. Enzim amilase
Uji akt. Enzim selulase
Uji kadar protein
Permurnian dengan fraksinasi
Data Produksi Enzim