SKRIPSI
PENGARUH INTENSITAS CAHAYA TERHADAP KANDUNGAN KAROTENOID Chlorella sp.
Oleh:
AGUS PARIAWAN LAMONGAN – JAWA TIMUR
FAKULTAS PERIKANAN DAN KELAUTAN UNIVERSITAS AIRLANGGA
SKRIPSI
PENGARUH INTENSITAS CAHAYA TERHADAP KANDUNGAN KAROTENOID Chlorella sp.
sebagai Salah Satu Syarat untuk Memperoleh Gelar Sarjana Perikanan pada Fakultas Perikanan dan Kelautan Universitas Airlangga
Oleh :
AGUS PARIAWAN NIM. 141011010
Menyetujui, Komisi Pembimbing,
Pembimbing Pertama Pembimbing Kedua
SKRIPSI
PENGARUH INTENSITAS CAHAYA TERHADAP KANDUNGAN KAROTENOID Chlorella sp.
sebagai Salah Satu Syarat untuk Memperoleh Gelar Sarjana Perikanan pada Fakultas Perikanan dan Kelautan Universitas Airlangga
Oleh :
AGUS PARIAWAN NIM. 141011010
Telah diuji pada
Tanggal : 17 Juli 2014
KOMISI PENGUJI SKRIPSI
Ketua : Moch. Amin Alamsjah, Ir., M.Si., Ph.D Anggota : Dr. Endang Dewi Masithah, Ir., MP.
Sapto Andriyono, S. Pi., M.T. Sudarno, Ir., M. Kes.
Rahayu Kusdarwati, Ir., M.Si.
Surabaya,
Fakultas Perikanan dan Kelautan Universitas Airlangga
Dekan,
Yang bertanda tangan di bawah ini, saya : N a m a : Agus Pariawan N I M : 141011010
Menyatakan dengan sebenarnya bahwa skripsi yang berjudul :
PENGARUH INTENSITAS CAHAYA TERHADAP KANDUNGAN
KAROTENOID Chlorella sp.
adalah benar hasil karya saya sendiri. Hal-hal yang bukan karya saya dalam skripsi tersebut diberi tanda citasi dan ditunjukkan dalam daftar pustaka.
Apabila dikemudian hari terbukti pernyataan saya tidak benar, maka saya bersedia menerima sanksi akademik yang berlaku di Universitas Airlangga, termasuk berupa pencabutan gelar kesarjanaan yang telah saya peroleh.
Demikian surat pernyataan yang saya buat ini tanpa ada unsur paksaan dari siapapun dan dipergunakan sebagaimana mestinya.
Surabaya, 20 Juli 2014 Yang membuat pernyataan,
Agus Pariawan --- NIM.141011010
RINGKASAN
AGUS PARIAWAN. Pengaruh Intensitas Cahaya terhadap Kandungan Karotenoid Chlorella sp. Dosen Pembimbing: Sudarno, Ir., M.Kes. dan
Rahayu Kusdarwati, Ir., M.Si.
Karotenoid adalah pigmen tumbuhan yang terdiri dari 40 atom karbon per molekul (Tetraterpenoid). Karotenoid berfungsi untuk memberi warna pada ikan dan juga bermanfaat bagi kesehatan manusia. Chlorella sp. didominasi oleh warna hijau (chlorophyll), selain itu Chlorella sp. juga mengandung karotenoid lutein. Intensitas cahaya mampu meningkatkan level mRNA carotenoid hydroxylase (CH) dan phytoene synthase (PSY). Dengan meningkatnya level mRNA carotenoid hydroxylase (CH) dan phytoene synthase (PSY) maka phytoene yang
merupakan penyusun karotenoid juga meningkat. Meningkatnya phytoene dapat mempengaruhi meningkatnya karotenoid yang disintesis. Cahaya dapat menyebakan naiknya produk fotosintesis. Cahaya dapat menyebakan meningkatkan ATP yang dihasilkan pada fotosintesis, sehingga mempercepat metabolisme sel.
Tujuan penelitian ini adalah untuk mengetahui pengaruh intensitas cahaya yang berbeda terhadap kandungan karotenoid Chlorella sp. serta untuk mengetahui intensitas cahaya yang mampu menghasilkan karotenoid paling tinggi. Penelitian ini menggunakan metode eksperimen (percobaan) dengan rancangan acak lengkap. Terdapat empat perlakuan pencahayaan (A=500 lux, B=3.700 lux, C=7.400 lux dan D=11.700 lux) dan 5 ulangan sehingga terdapat 20 satuan percobaan. Hasil penelitian menunjukan bahwa kandungan karotenoid tertinggi terdapat pada perlakuan C (0,298080 µg/ml), disusul perlakuan B (0,255392 µg/ml) kemudian perlakuan D (0,220056 µg/ml). Kandungan karotenoid terendah terdapat pada perlakuan A (0,207552 µg/ml). Hasil analysis of variance (ANOVA) menunjukkan bahwa setiap perlakuan intensitas cahaya memberikan pengaruh yang berbeda nyata terhadap kandungan karotenoid Chlorella sp. (p<0,05).
AGUS PARIAWAN. Effect of Light Intensity on the Carotenoid Content of
Chlorella sp. Advisor: Sudarno, Ir., M.Kes. and Rahayu Kusdarwati, Ir.,
M.Si.
Carotenoids are plant pigments which consists of 40 carbon atoms per molecule (Tetraterpenoid). Carotenoids function are for pigmentation of fishes, furthermore it also beneficial to human health. Chlorella sp. dominated by green pigment (chlorophyll), but its so had carotenoid lutein. Light intensity increase of carotenoid hydroxylase mRNA levels (CH) and phytoene synthase (PSY). Increased of mRNA levels of carotenoid hydroxylase (CH) and phytoene synthase (PSY) simultaneous increased of phytoene. The inclined of phytoene stimulate carotenoid synthesized. High light intensity stimulate increase of photosynthesis product. Hight light intensity stimulate increase of Adenosin Triphospat (ATP), so it increased of metabolism rate.
KATA PENGANTAR
Segala Puji dan Syukur penulis panjatkan kehadirat Tuhan Yang Maha Pengasih dan Penyayang, oleh karena rahmat-Nya penulis telah menyelesaikan penulisan skripsi ini. Penulis menyadari bahwa penulisan ini tidak terlepas dari dukungan moril dan materil dari semua pihak. Melalui kesempatan ini, dengan kerendahan hati, perkenankan penulis menghaturkan terima kasih yang sebesar-besarnya kepada :
1. Dosen Pembimbing, Bapak Sudarno, Ir., M.Kes dan Ibu Rahayu Kusdarwati, Ir., M.Si, yang telah memberikan saran dan nasehat yang berguna bagi penulis selama penyusunan skripsi ini.
2. Dosen penguji, Bapak Moch. Amin Alamsjah, Ir., M.Si., Ph.D, Ibu Dr. Endang Dewi Masithah, Ir., MP. dan Bapak Sapto Andriyono, S.Pi., M.T., yang telah memberi banyak masukan demi kesempurnaan skripsi ini. 3. Dekan Fakultas Perikanan dan Kelautan Universitas Airlangga, Ibu Prof.
Dr. Hj. Sri Subekti, drh., DEA.
4. Ibunda dan Ayahanda tercinta, Ngadiso dan Partik yang senantiasa memberikan semangat dan dukungan do’a selama penyusunan skripsi ini. 5. Teman-teman angkatan 2010 yang senantiasa memberi semangat dan
dukungan penulis untuk menyelesaikan penyusunan skripsi ini.
7. Teman-teman yang dengan sukarela meminjamkan laptopnya untuk penulisan skripsi ini.
8. Semua pihak yang telah membantu dalam pelaksanaan penelitian dan penyelesaian skripsi ini.
Semoga Allah Yang Maha Pengasih dan Penyayang melimpahkan berkah-Nya, atas segala bantuan dan kebaikan yang telah diberikan oleh semua pihak kepada penulis
Surabaya, Juli 2014
DAFTAR ISI
2.2 Struktur dan morfologi Chlorella sp. ... 6
2.3 Habitat ... 7
2.4 Pertumbuhan Chlorella sp... 8
2.5 Media Kultur ... 10
2.6 Intensitas Cahaya ... 11
2.7 Karotenoid ... 13
2.8 Faktor-faktor Pembentuk Karotenoid ... 16
III KERANGKA KONSEP 3.1 Kerangka Konseptual ... 20
IV METODOLOGI
4.1 Tempat dan Waktu ... 24
4.2 Materi Penelitian 4.2.1 Peralatan Penelitian ... 24
4.2.2 Bahan Penelitian ... 24
4.3 Metode Penelitian 4.3.1 Rancangan Penelitian ... 25
4.3.2 Prosedur Kerja ... 26
4.3.3 Parameter ... 31
4.3.4 Analisa Data ... 31
V HASIL DAN PEMBAHASAN 5.1 Hasil ... 32
5.1.1 Kandungan Karotenoid ... 32
5.1.2 Populasi Chlorella sp. ... 34
5.1.3 Analisis Korelasi Eksponensial Kandungan Karotenoid dengan Kepadatan populasi Chlorella sp. ... 36
5.1.4 Kualitas Air ... 36
5.2 Pembahasan ... 37
VI SIMPULAN DAN SARAN 6.1 Kesimpulan ... 46
6.2 Saran ... 46
DAFTAR PUSTAKA ... 47
DAFTAR TABEL
Tabel Halaman
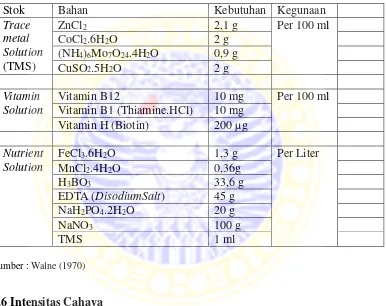
2.1 Kandungan Walne ... 11
5.1 Hasil rata-rata kandungan karotenoid Chlorella sp... 32
5.2 Hasil rata-rata kepadatan populasi Chlorella sp. ... 35
DAFTAR GAMBAR
Gambar Halaman
2.1. Chlorella sp. ... 5 2.2 Intensitas cahaya (Illuminance)... 12 2.3 Steradian dan solid angel ... 12 ... 2.4. Struktur beberapa karotenoid ... 14 3.1. Kerangka konseptual penelitian ... 22 4.1. Denah penempatan perlakuan ... 25 ... 4.2. Diagram alir penelitian ... 26 5.1 Grafik kandungan karotenoid Chlorella sp. ... 33 5.2 Grafik pertumbuhan Chlorella sp.. ... 35 5.3 Analisis korelasi eksponensial kandungan karotenoid dengan kepadatan
DAFTAR LAMPIRAN
Lampiran Halaman
1. Kandungan karotenoid Chlorella sp. (µg/ml). ... 51
2. Kepadatan populasi Chlorella sp. (per unit percobaan) ... 52
3. Kisaran suhu per hari, kisaran salinitas per hari dan kisaran pH per hari ... 53
4. SPSS kandungan karotenoid ... 54
5. SPSS kepadatan populasi Chlorella sp. selama 6 hari ... 57
I PENDAHULUAN
1.1 Latar Belakang
Karotenoid adalah pigmen tumbuhan yang terdiri dari 40 atom karbon per molekul (Tetraterpenoid) (Britton et al, 2008 dalam Biolab Medical Unit, 2010). Lebih dari 750 struktur karotenoid ditemukan di alam yaitu pada tumbuhan darat, algae, bakteri termasuk cyanobacteria dan bakteri fotosintesis, archaea, jamur
dan hewan (Britton et al., 2004 dalam Takaichi, 2011).
Karotenoid berfungsi untuk memberi warna pada kulit ikan (Britton, 1976 dalam Siegler, 1998). Pewarnaan sangat penting bagi hewan akuakultur seperti
pewarnaan merah dan kuning pada ikan, pewarnaan pada daging ikan salmon, pada eksoskeleton dan otot epitelium udang maupun lobster serta pada karapas krustacea lain (Sigurgisladottir et al.,1997 dalam Bjerkeng, 2000). Pewarnaan akan meningkatkan nilai ekonomis ikan di pasar. Karotenoid juga bermanfaat bagi kesehatan manusia. Karotenoid mampu meningkatkan respon imun serta mampu mereduksi resiko kanker, penyakit jantung dan katarak (Amstrog, 1997 dalam Rodriguez-Amaya and Kimura, 2004).
Terdapat dua macam karotenoid yang digunakan dalam budidaya perairan yaitu sintetik dan alami. Turunan karotenoid alami diantaranya zeaxanthin, lutein, α-caroten, β-caroten, cryptoxanthin dan lain-lain, sedangkan untuk karoten
penggunaannya dalam formula pakan ikan sangat terbatas sesuai dengan spesies masing-masing. (Gupta et al., 2007).
Chlorella sp. merupakan produsen dalam rantai makanan makhluk hidup yang kaya gizi (Merizawati, 2008). Chlorella sp. adalah organisme kosmopolit. Alga ini mampu tumbuh pada salinitas 0 – 35 ppt. Chlorella sp. masih dapat bertahan hidup pada suhu 40oC. Rentang suhu antara 25o-30oC merupakan suhu yang optimal untuk pertumbuhan (Alim dan Kurniastuty, 1995 dalam Merizawati, 2008). Chlorela sp. dengan sifatnya yang seperti di atas sangat cocok untuk dikembangan di Indonesia.
Chlorella sp. didominasi oleh warna hijau (chlorophyll), selain itu
Chlorella sp. juga mengandung karotenoid lutein (Shi et al., 2002 dalam Geetha
et al., 2010). Dalam proses fotosintesis, karotenoid dan klorofil dibutuhkan oleh
rantai peptida untuk membentuk pigmen protein komplek pada membran tilakoid (Neilson and Durnford, 2010 dalam Takaichi, 2011). Karotenogenesis pada Haematococcus pluvialis diinduksi dengan penambahan NaCl (0,2 dan 0,8 %),
Enzim yang berpengaruh dalam biosintesis karotenoid yaitu phytoene synthase (PSY), phytoene desaturase (PDS), ζ-carotene desaturase (ZDS),
lycopene cyclase (LCYB), β-carotene ketolase dan carotenoid hydroxylase (CH)
(Cunningham and Gantt, 1998 dalam Steinbrenner and Linden, 2001). Intensitas cahaya mampu meningkatkan level mRNA carotenoid hydroxylase (CH) dan phytoene synthase (PSY) (Steinbrenner and Linden, 2001). Dengan meningkatnya
level mRNA carotenoid hydroxylase (CH) dan phytoene synthase (PSY) maka phytoene yang merupakan penyusun karotenoid juga meningkat. Meningkatnya
phytoene dapat mempengaruhi meningkatnya karotenoid yang disintesis.
Cahaya dapat menyebabkan naiknya produk fotosintesis (Peel and Wveatherly, 1962 dalam Servaites and Geiger, 1974). Cahaya dapat menyebabkan meningkatkan Adenosine Triphosphate (ATP) yang dihasilkan pada fotosintesis (Plaut and Reinhold, 1969 dalam Servaites and Geiger, 1974).
Berdasarkan latar belakang tersebut, perlu dilakukan penelitian tentang pengaruh intensitas cahaya terhadap kandungan karotenoid Chlorella sp.
1.2 Perumusan Masalah
1. Apakah intensitas cahaya yang berbeda, berpengaruh terhadap kandungan karotenoid Chlorella sp.?
1.3 Tujuan
Penelitian ini bertujuan untuk
1. Mengetahui pengaruh intensitas cahaya yang berbeda terhadap kandungan karotenoid Chlorella sp.
2. Mengetahui intensitas cahaya yang mampu menghasilkan karotenoid paling tinggi.
1.4 Manfaat
II. TINJAUAN PUSTAKA
2.1 Klasifikasi Chlorella sp.
Menurut Bougis (1979) dalam Merizawati (2008) Chlorella sp. termasuk dalam : Filum : Chlorophyta
Kelas : Chlorophyceae Ordo : Chlorococcales Famili : Chlorellaceae Genus : Chlorella Spesies : Chlorella sp.
Gambar 2.1. Chlorella sp. (Sumber:http://ccala.butbn.cas.cz, diakses Desember 2013)
Alga hijau atau Chlorophyta, merupakan yang terbesar diantara semua filum alga. Mereka digolongkan sebagai alga hijau karena warna hijau yang merupakan gabungan pigmen klorofil a dan b, karoten (α, β dan γ) dan beberapa
2.2 Struktur dan morfologi Chlorella sp.
Chlorella sp. adalah salah satu jenis mikroalga yang mengandung klorofil
serta pigmen lainnya untuk melakukan fotosintesis. Kata Chlorella berasal dari bahasa latin yaitu ”Chloros” yang berarti hijau dan ”ella” yang berarti kecil. Chlorella sp. merupakan pakan dasar biota yang ada di perairan termasuk ikan. Chlorella sp. merupakan produsen dalam rantai makanan makhluk hidup yang kaya akan gizi. Bentuk sel Chlorella sp. bulat atau bulat telur, merupakan alga bersel tunggal (uniseluler) dan kadang - kadang bergerombol (Merizawati, 2008). Warna hijau pada alga ini disebabkan selnya mengandung klorofil a dan b dalam jumlah yang besar selain itu juga mengandung karoten dan xantofil (Volesky, 1970 dalam Rostini, 2007).
Diameter sel Chlorella sp. berkisar antara 2−8 mikron. Dinding selnya keras terdiri dari selulosa dan pektin. Sel ini mempunyai protoplasma yang berbentuk cawan. Chlorella sp. dapat bergerak (motil) tetapi sangat lambat sehingga pada pengamatan seakan-akan tidak bergerak (non motil) (Merizawati, 2008).
homogen ini disebabkan oleh arus, unsur hara, dan aktifitas pemangsaan (Merizawati, 2008).
Absorbansi Chlorella sp. diukur menggunakan spektrofotometer dengan panjang gelombang ultraviolet dan cahaya tampak. Dari hasil pengukuran diperoleh bahwa Chlorella sp. memiliki nilai absorbansi yang tinggi untuk panjang gelombang 687 nanometer dan 490 nanometer (Merizawati, 2008).
2.3 Habitat
Chlorella sp. dapat tumbuh di semua tempat (kosmopolit), kecuali pada tempat yang sangat kritis bagi kehidupan. Alga ini mampu tumbuh pada salinitas 0-35 ppt. Salinitas 10-20 ppt merupakan salinitas optimum untuk pertumbuhannya. Chlorella sp. masih dapat bertahan hidup pada suhu 40oC. Rentang suhu antara 25o–30oC merupakan suhu yang optimal untuk pertumbuhan. Chlorella sp. bereproduksi secara aseksual dengan pembelahan sel dan pemisahan autospora dari sel induknya (Alim dan Kurniastuty, 1995 dalam Merizawati, 2008).
Kebanyakan spesies Chlorella mampu tumbuh menggunakan fotosintetik atau pada kondisi dimana tidak terdapat cahaya dengan mengambil bahan organik secara langsung dari mediumnya. Selain itu, beberapa spesies Chlorella dapat tumbuh baik pada air tawar maupun air laut (Hoff and Snell, 1989 dalam Shah et al., 2003). Chlorella secara umum merupakan genus air tawar, namun beberapa
Ordo chlorococcales kurang memiliki daya mengapung dan tidak memiliki flagella sehingga membuatnya tidak dapat bergerak secara aktif. Oleh karena itu Chlorococcales tergantung pada turbulensi air yang mempertahankannya tetap tersuspensi. Pada saat stratifikasi suhu stabil, sel atau koloni cenderung mengendap. Ketika rata-rata pertumbuhan sel yang bertahan pada zona eupotik lebih besar daripada rata-rata populasi yang hilang karena pengendapan, maka kondisi itu disebut dengan pertumbuhan yang ditunjukan oleh kenaikan populasi fitoplankton. Pertumbuhan pada alga tergantung pada perubahan yang seimbang antara fotosintesis (terwujud dengan peningkatan sel) dan proses metabolisme (respirasi dan sedimentasi pada populasi) (Happey-Wood, 1988).
Penyebaran populasi tergantung pada turbulensi air pada zona epilimnion. Bantuk sel dan keberadaan getah (perekat cair) akan cenderung mengurangi hilangnya populasi karena sedimentasi (Happey-Wood, 1988).
2.4 Pertumbuhan Chlorella sp.
menurun dan sudah tidak ada lagi penambahan kepadatan sel. Fase stasioner kemudian diikuti oleh fase senescent, yang mana kepadatan sel menurun (Creswell, 2010).
Hal yang paling menarik dan paling penting untuk diperhatikan dalam ekologi fitoplankton air tawar yaitu antara pertumbuhan dan kematian terjadi secara serentak bersama-sama yang ditengahi (dibatasi) oleh pasokan nutrisi, pertukaran tropik dan pengadukan (mixing) faktor fisik pada sistem (Reynolds et al., 1982 dalam Sandgren, 1988).
Sandgren (1988) menyatakan bahwa kebanyakan fitoplankton air tawar menggabungkan diri menjadi fase istirahat untuk bertahan sebagai strategi hidupnya. Beberapa percobaannya menyebutkan “Packaging Plans” merupakan solusi revolusioner atas masalahnya terhadap kondisi stress dan habitat planktonik yang berubah secara berkala (Sandgren, 1988).
Alga nonmotil mampu mengalami pertumbuhan jika kondisi cahaya dan turbulensi air dalam kondisi seimbang yang menyebabkan peningkatan kepadatan populasi lebih tinggi daripada proses kematian atau sedimendasi (Happey-Wood, 1988).
Sze (1993) menyatakan bahwa pertumbuhan populasi fitoplakton tergantung pada selisih antara sel baru yang dihasilkan dengan rata-rata sel yang mati. Sel baru yang diproduksi, sebagian besar tergantung pada cahaya dan ketersediaan nutrisi.
Sutomo (2005), menyatakan bahwa pola pertumbuhan Chlorella sp.
Chlorella sp. mempunyai daya adaptasi yang cukup cepat dan juga mempunyai pola pertumbuhan dengan dua puncak populasi. Secara umum pertumbuhan mikroalga akan menurun setelah mencapai puncak I dan kemudian naik kembali sampai mencapai puncak II. Pertumbuhan mikroalga akan turun kembali setelah mencapai puncak II.
Puncak kepadatan Chlorella sp. umumnya dicapai relatif lambat yaitu pada hari ke 9 atau lebih, kecuali hasil penelitihan Sutomo tahun 1990 pada percobaan ke 2 yang dicapai pada hari ke 5. Pencapaian puncak kepadatan yang lebih cepat ini disebabkan karena kepadatan awal pelakuan yang lebih tinggi. Volume air media pemeliharaan berpengaruh terhadap puncak kepadatan maksimal sel Chlorella sp. Volume air yang lebih besar akan menghasilkan kepadatan sel maksimal yang lebih rendah dan sebaliknya (Sutomo, 2005).
2.5 Media Kultur
Air laut merupakan medium komplek yang terdiri beragam senyawa organik. Mengkultur alga hanya dengan menggunakan air laut kadang-kadang bisa juga dilakukan. Penambahan medium artifisial untuk optimalisasi hasil budidaya menjadi penting karena tanpa penambahan beberapa nutrisi dan trace metal, hasil budidaya biasanya sangat rendah (Harrison and Berges, 2004). Tetelepta (2011) menggunakan medium Walne untuk mengkultur Chlorella sp. Medium Walne terdiri dari beragam senyawa (Tabel 2.1.).
culture, semi-continues culture dan continues culture. Batch culture merupakan metode yang paling konsisten dan dapat diandalkan. Pada metode batch culture, mikroalga dikultur pada sebuah wadah dan semuanya dipanen keseluruhan ketika populasinya hampir mencapi kepadatan maksimal.
Tabel 2.1. Kandungan Walne
Stok Bahan Kebutuhan Kegunaan
Trace
Vitamin B1 (Thiamine.HCl) 10 mg Vitamin H (Biotin) 200 µg
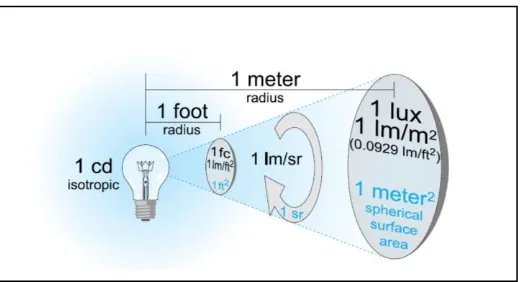
Gambar 2.2. Intensitas cahaya (Illuminance) (Ryer, 1998).
Pada gambar diatas (Gambar 2.2.), bola lampu menghasilkan 1 kandela. Kandela adalah unit dasar pengukuran cahaya. Juga bisa didefinisikan 1 kandela sumber cahaya memancarkan 1 lumen per steradian ke segala arah. Steradian adalah sudut padat (solid angel) yang didapat dari inti bola yang memotong sebuah area persegi pada titik radiusnya. Nilai steradian pada sebuah sinar sama dengan proyeksi area dibagi kuadrat jarak (Ryer, 1998).
Gamber 2.3. Steradian dan solid angel (Ryer, 1998).
intensitas cahaya bervariasi tergantung jarak penampang dengan sumber cahaya (Ryer, 1998).
2.7 Karotenoid
Karotenoid adalah pigmen tanaman dengan 40 atom karbon per molekul (tetraterpenoids) (Britton et al. 2008 dalam Biolab Medical Unit, 2010). Karotenoid yang berikatan dengan oksigen dikenal dengan sebutan xanthophylls, sedangkan yang tidak berikatan dengan oksigen dikenal dengan karoten. Pada tumbuhan, karotenoid bertindak sebagai pigmen tambahan saat fotosintesis dan juga berfungsi untuk melindungi dari radikal bebas yang dilepaskan dari chloroplast selama fotosintesis (Miller et al., 1996 dalam Biolab Medical Unit,
2010). Karotenoid juga melindungi tanaman dari foto-oksidatif perusak melalui disipasi suhu (siklus xanthophyll). Proses ini terjadi ketika eksesif cahaya meningkatkan pH tilakoid, yang mana aktivitas enzim violaxanthin de-epoxidase (VDE), mengkonversi violaxanthin menjadi zeaxanthin. Molekul zeaxanthin dan foton mengubah konformasi di light harvesting complexes (LHC), membantu disipasi suhu (Baroli and Nigoyi, 2000 dalam Stange and Flores, 2012 ).
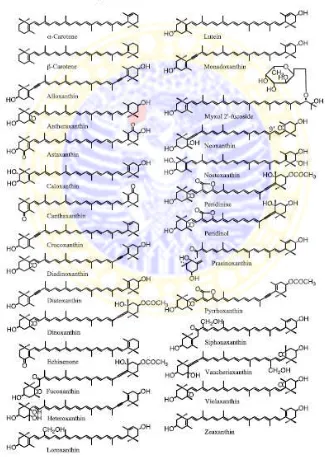
Lebih dari 750 struktur karotenoid ditemukan di alam yaitu pada tumbuhan darat, algae, bakteri termasuk cyanobacteria dan bakteri fotosintesis, archaea, jamur dan hewan (Britton et al., 2004 dalam Takaichi, 2011). Berbagai
jenis karotenoid yang ditemukan dari spesies algae telah dipelajari. Struktur beberapa karotenoid penting dalam algae diilustrasikan pada Gambar 2.4.
Di antara struktur tersebut, sekitar 30 jenis mungkin memiliki fungsi dalam fotosintesis, dan lainnya berfungsi untuk akumulasi karotenoid atau karotenogenesis. Beberapa karotenoid hanya ditemukan di beberapa divisi atau kelas algae, karena itu, karotenoid dan klorofil juga dapat digunakan sebagai penanda kemotaksonomi (Rowan, 1989 dalam Takaichi, 2011).
Karotenoid telah banyak ditemukan pada alga. Fucoxanthin ditemukan pada algae coklat dan diatom. 19'-acyloxyfucoxanthin ditemukan pada Haptophyta dan Dinophyta. Peridinin hanya ditemukan pada dinoflagellata. Alloxanthin, crocoxanthin dan monadoxanthin ditemukan pada Cryptophyta.
Diadinoxanthin dan diatoxanthin ditemukan pada Heterokontophyta, Haptophyta,
Dinophyta dan Euglenophyta (Takaichi, 2011).
Karotenoid berfungsi untuk memberi warna pada kulit ikan (Britton, 1976 dalam Siegler, 1998). Pewarnaan sangat penting bagi hewan akuakultur seperti
pewarnaan pada daging ikan salmon, eksoskeleton dan otot epitelium udang, lobster dan kaparas krustacea lain, integumen merah dan kuning pada ikan (Sigurgisladottir et al.,1997 dalam Bjerkeng, 2000). Karotenoid juga bermanfaat bagi kesehatan manusia. Karotenoid mampu meningkatkan respon imun dan mereduksi resiko kanker, penyakit jantung dan katarak (Amstrog, 1997 dalam Rodriguez-Amaya and Kimura, 2004).
gene (CrtR-b) dan β-karoten ketolase (CtrW, BKT) (Lemione and Schoefs, 2010
dalam Takaichi, 2011).
Enzim yang berpengaruh dalam biosintesis karotenoid yaitu phytoene synthase (PSY), phytoene desaturase (PDS), ζ-carotene desaturase (ZDS),
lycopene cyclase (LCYB), β-carotene ketolase, dan carotenoid hydroxylase (CH)
(Cunningham and Gantt, 1998 dalam Steinbrenner and Linden, 2001). Menurut Steinbrenner and Linden (2001), Intensitas cahya mampu meningkatkan level mRNA carotenoid hydroxylase (CH) dan phytoene synthase (PSY).
2.8 Faktor-faktor Pembentuk Karotenoid 2.8.1 Cahaya
Pada proses fotosintesis, cahaya diserap oleh pigmen dan dikonversi menjadi energi kimia ATP dan NADPH, yang mana digunakan untuk mensintesis bahan organik dari karbondioksida. Cahaya yang digunakan untuk proses fotosintesis berada pada rentang spektrum elektromagnetik 400-700 nm, yang biasa disebut photosynthetically active radiation (PAR). Sebuah pigmen secara selektif mengabsorbsi panjang gelombang PAR tertentu. Pigmen utama pada semua alga adalah klorofil A, tetapi proses absorsinya juga dibantu oleh pigmen lain (pigmen asesoris). Pigmen asesoris mengabsorbsi panjang gelombang PAR yang berbeda dan mentransfer energi cahaya ke klorofil A. Pigmen fotosintetik berasosiasi dengan protein dalam membran tilakoid untuk membentuk light harvesting complexes. Masing-masing fotosistem terdiri dari ratusan
bersama-sama untuk mereduksi NADP+ menjadi NADPH dan mengkonversi ADP menjadi ATP. Fotosistem I hanya terdiri dari klorofil a saja, sedangkan fotosistem II terdiri dari klorofil a dan pigmen asesoris. Alga dapat mengatur aliran elektron pada fotosistem I dan fotosistem II untuk merespon cahaya di lingkungan sekitarnya sehingga efisiensi fotosintesis tetap terjaga (Chow et al., 1990 dalam Sze, 1993).
Cahaya yang dipancarkan oleh sinar matahari berfungsi dalam proses fotosintesis, tetapi hanya panjang gelombang tertentu yang dimanfaatkan untuk proses fotosintesis tersebut, masing-masing jenis cahaya berbeda pengaruhnya terhadap proses fotosintesis terkait dengan jenis pigmen penangkap cahaya. Semakin banyak cahaya yang diserap pada saat fotosintesis maka spektrum karotenoid semakin terlihat yaitu peningkatan dan penampakan warna jingga (Pamungkas dan Kurniady, 2006).
Menurut Cifuentes et al. (2003), karotenogenesis paling baik pada H. pluvialis dipicu oleh intensitas cahaya yang tinggi. Hal ini hampir sama dengan
Enzim yang berpengaruh dalam biosintesis karotenoid yaitu phytoene synthase (PSY), phytoene desaturase (PDS), ζ-carotene desaturase (ZDS),
lycopene cyclase (LCYB), β-carotene ketolase, dan carotenoid hydroxylase (CH)
(Cunningham and Gantt, 1998 dalam Steinbrenner and Linden, 2001). Intensitas cahya mampu meningkatkan level mRNA carotenoid hydroxylase (CH) dan phytoene synthase (PSY) (Steinbrenner and Linden, 2001). Dengan meningkatnya
level mRNA carotenoid hydroxylase (CH) dan phytoene synthase (PSY) maka phytoene yang merupakan penyusun karoten juga meningkat. Meningkatnya
phytoene dapat memempengaruhi meningkatnya karotenoid yang disintesis.
2.8.2 Salinitas
Penambahan NaCl dapat menyebabkan kematian (mortalitas 45%), tetapi pada sel yang hidup (survive) terjadi peningkatan warna merah. Kenaikan total karotenoid per sel dan kadar astaxantin per berat bersih terjadi ketika dikombinasi dengan intensitas cahaya tinggi ( 85 µmol/m2/s). Hal ini menunjukan bahwa NaCl merupakan faktor pemicu karotenogenik pada alga jenis H. pluvialis (Cifuentes et al., 2003).
Harker et al. (1995) dalam Cifuentes et al. (2003) telah mempelajari keefektifan penambahan NaCl pada karotenogenesis H. pluvialis strain CCAP 34/7 dan menyatakan bahwa peningkatan astxanthin saat panen terjadi saat mereka mengkobinasikan kadar NaCl yang lebih rendah dengan intensitas cahaya yang sangat tinggi ( 1600-1700 µmol/m2/s). Menurut Sarada et al. (2002) dalam
memicu produksi astaxanthin pada kultur yang distreskan dengan pemicu salinitas. Kultur yang lebih muda (umur dua sampai delapan hari) sangat sensitif terhadap penambahan NaCl, sedangkan kultur yang lebih tua ( umur 12-16 hari) resisten dan mengakumulasi lebih banyak astaxanthin ketika NaCl ditambahkan dengan sodium acetate dan setelah masa inkubasi panjang ( selama 20 hari).
III KONSEPTUAL PENELITIAN DAN HIPOTESIS
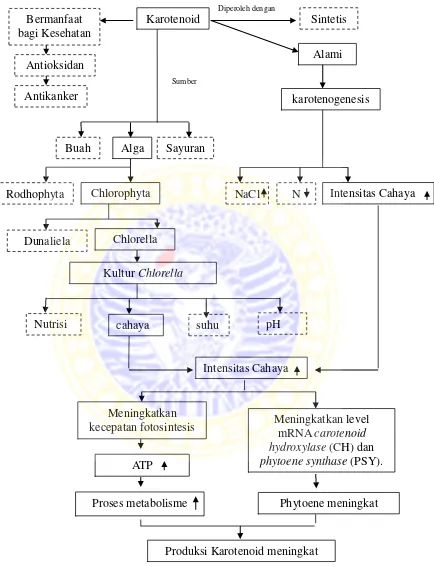
3.1 Kerangka Konseptual
Karotenoid berfungsi untuk memberi warna pada kulit ikan (Britton, 1976 dalam Siegler, 1998). Pewarnaan sangat penting bagi hewan akuakultur seperti
pewarnaan merah dan kuning pada ikan, pewarnaan pada daging ikan salmon, pada eksoskeleton dan otot epitelium udang maupun lobster serta pada karapas krustacea lain (Sigurgisladottir et al.,1997 dalam Bjerkeng, 2000). Pewarnaan akan meningkatkan nilai ekonomis ikan di pasar. Karotenoid juga bermanfaat bagi kesehatan manusia. Karotenoid mampu meningkatkan respon imun dan mereduksi resiko kanker, penyakit jantung dan katarak (Amstrog, 1997 dalam Rodriguez-Amaya and Kimura, 2004).
Ada banyak faktor yang mempengaruhi pembentukan karotenoid pada Haematococcus pluvialis yaitu dengan penambahan NaCl (0,2 and 0,8 %), pengurangan nitrogen dan intensitas cahaya yang tinggi (150 µmol/m2/s atau 11.700 lux) (Cifuentes, 2003). Pada lingkungan yang tidak sesuai seperti cahaya yang tinggi, radiasi UV dan nutrisi yang tidak sesuai, beberapa Chlorophyceae, seperti Haematococcus, Chlorella dan Scenedosmus, mengakumulasi karotenoid, canthaxanthin dan astaxanthin, yang disintesis oleh kombinasi β-carotene hydroxylase gene (CrtR-b) dan β-karoten ketolase (CtrW, BKT) (Lemione and
Schoefs, 2010 dalam Takaichi, 2011). Enzim yang berpengaruh dalam biosintesis karotenoid yaitu phytoene synthase (PSY), phytoene desaturase (PDS), ζ-carotene desaturase (ZDS), lycopene cyclase (LCYB), β-carotene ketolase, dan carotenoid
2001). Menurut Steinbrenner and Linden (2001), Intensitas cahya mampu meningkatkan level mRNA carotenoid hydroxylase (CH) dan phytoene synthase (PSY).
Cahaya dapat menyebakan naiknya produk fotosintesis (Peel and Wveatherly, 1962 dalam Servaites and Geiger, 1974). Cahaya dapat menyebakan meningkatkan ATP yang dihasilkan pada fotosintesis (Plaut and Reinhold, 1969 dalam Servaites and Geiger, 1974). Naiknya ATP akan memicuh semakin cepatnya laju metabolisme dan akan mempengaruhi metabolisme karotenoid dalam sel alga. Peri et al. (2009) menyatakan bahwa intensitas cahaya memiliki hubungan positif terhadap kecepatan fotosintetik dan konduksi stomata. Kecepatan fotosintetik menurun dengan menurunya intensitas cahaya, begitu pula sebaliknya.
3.2 Hipotesis
H1 :Intensitas cahaya yang berbeda, akan memberikan pengaruh terhadap kandungan karotenoid Chlorella sp.
IV METODOLOGI
4.1 Tempat dan Waktu
Kegiatan penelitian ini telah dilakukan di Laboratorium Basah dan Laboratorium Kering Fakultas Perikanan dan Kelautan Universitas Airlangga Surabaya pada bulan Mei-Juni 2014.
4.2 Materi Penelitian 4.2.1 Peralatan Penelitian
Alat-alat yang digunakan antara lain: tabung kaca, selang aerator, aerator, Erlenmeyer, gelas ukur, neraca digital dengan ketelitian 0,1 gram, pipet, mikroskop binokuler, haemacytometer, spektrofotometer, lampu TL, refraktometer, kertas pH , lux meter, autoclave, rak, papan penyekat, hand counter, kabel, cover glass, terminal listrik, steker listrik, gunting, tabung reaksi
dan sentrifus.
4.2.2 Bahan Penelitian
Bahan-bahan yang digunakan pada penelitian ini adalah inokulan Chlorella berasal dari koleksi Balai Besar Pengembangan Budidaya Air Payau
4.3 Metode Penelitian 4.3.1 Rancangan Penelitian
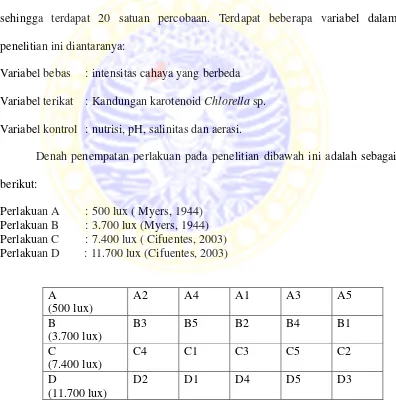
Metode penelitian digunakan untuk memecahkan suatu masalah yang dapat dilakukan dengan pengumpulan data melalui pengamatan, survei, ataupun melalui percobaan (Kusriningrum, 2008). Penelitian ini menggunakan metode eksperimen (percobaan) dengan rancangan acak lengkap. Terdapat empat perlakuan pencahayaan (500, 3.700, 7.400 dan 11.700 lux) dan 5 ulangan sehingga terdapat 20 satuan percobaan. Terdapat beberapa variabel dalam penelitian ini diantaranya:
Variabel bebas : intensitas cahaya yang berbeda Variabel terikat : Kandungan karotenoid Chlorella sp. Variabel kontrol : nutrisi, pH, salinitas dan aerasi.
Denah penempatan perlakuan pada penelitian dibawah ini adalah sebagai berikut:
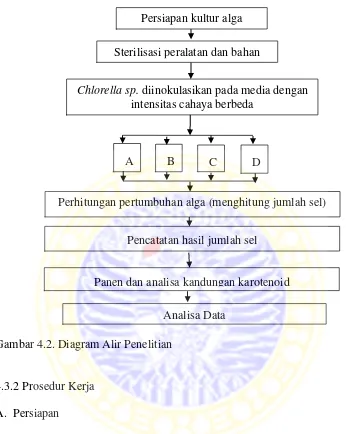
Gambar 4.2. Diagram Alir Penelitian
4.3.2 Prosedur Kerja A. Persiapan
Medium kultur yang digunakan adalah medium Walne yang diperoleh dari Balai Besar Pengembangan Budidaya Air Payau (BBPBAP) Jepara. Terdapat 20 satuan percobaan sehingga dibutuhkan 20 tabung kaca. Setiap tabung kaca diisi 500 ml medium cair (0,5 ml Walne solution dan 499,5 ml air laut steril).
Perlakuan pencahayaan diperoleh dengan lampu TL yang penempatannya diatur pada ruang kultur. Intensitas cahaya dipengaruhi oleh jarak lampu dengan tabung kultur. Penentuan jarak ini dilakukan dengan bantuan lux meter. Sensor
Chlorella sp. diinokulasikan pada media dengan intensitas cahaya berbeda
Perhitungan pertumbuhan alga (menghitung jumlah sel)
Pencatatan hasil jumlah sel
Analisa Data Persiapan kultur alga
B
A C
Panen dan analisa kandungan karotenoid Sterilisasi peralatan dan bahan
lux meter dimasukkan ke dalam tabung dan jarak antara tabung dengan sumber lampu diatur sehingga didapat intensitas yang diharapkan sesuai perlakuan. Posisi tabung diberi tanda sehingga kedudukannya terhadap sumber cahaya tidak berubah. Tanda diberikan di bagian alas tempat tabung kultur.
Ruang kultur dipersiapkan dengan membuat sekat dan penutup. Kerangka kotak tempat kultur terbuat dari kayu, bagian atap dan alasnya terbuat dari kayu triplek dan sisi-sisinya terbuat dari bahan steryofoam kecuali bagian pintu yang terbuat dari plastik gelap (trash bag) supaya fleksibel untuk membuka dan menutup.
B. Sterilisasi Peralatan dan Bahan
Sterilisasi didefinisikan sebagai sebuah proses untuk menjamin semua kehidupan mikroba tidak aktif. Steril merupakan suatu syarat yang harus diperhatikan dan dipenuhi dalam budidaya alga. Kondisi ini dapat dicapai melalui desinfektan volatile (mudah menguap) dan non volatile, metode uap yaitu dengan menggunakan autoclave dan metode pemanasan udara dengan oven atau mesin pengering (Masithah dkk., 2012). Sterilisasi dilakukan untuk membunuh kontaminan yang dapat menggangu pertumbuhan Chlorella sp. Sterilisasi dalam kultur Chlorella sp. skala laboratorium terdiri atas sterilisasi ruang, peralatan dan bahan penelitian.
Sterilisasi ruangan diawali dengan membersihkan ruang kultur lalu dilakukan penyemprotkan alkohol 70% beberapa kali sampai merata. Ruang kultur ditutup rapat dan lampu tetap dinyalakan unyuk menjaga kesterilan ruangan.
Sterilisasi peralatan diawali dengan pencucian menggunakan detergen dan air hingga bersih kemudian di dikeringkan. Peralatan kemudian dibungkus dengan kertas, pada bagian mulut pipet ditutup dengan menggunakan kapas yang dibungkus dengan gauze (kain kasa). Peralatan kemudian disetrilisasi dengan autoclave pada suhu 121oC dengan tekanan 1 kg/cm2 selama 15 menit. Sebelum digunakan peralatan perlu dikeringkan terlebih dahulu.
Sterilisasi medium dilakukan dengan memasukan medium ke dalam Erlemeyer atau tabung kaca yang steril kemudian Erlemeyer atau tabung kaca ditutup dengan menggunakan kapas dan gauze. Kapas dan gauze pada Erlemeyer atau tabung kaca dibungkus dengan aluminium foil. Erlemeyer atau tabung kaca yang berisi medium disetrilisasi dengan autoclave pada suhu 121oC dengan tekanan 1 kg/cm2 selama 15 menit.
C. Inokulasi
Chlorella sp. selanjutnya dikultur dalam wadah kultur berupa tabung kaca
Menurut Satyantini dan Masithah (2008), penghitungan jumlah bibit plankton yang diperlukan untuk kultur menggunakan rumus :
1
V1 = Volume bibit untuk penebaran awal (ml) N1 = Kepadatan bibit plankton (unit/ ml)
V2 = Volume media kultur yang dikehendaki (ml)
N2 = Kepadatan bibit plankton yang dikehendaki (unit/ ml)
D. Pengukuran Pertumbuhan Chlorella sp.
Pertumbuhan kultur Chlorella sp. diukur dengan menghitung kepadatan selnya setiap hari. Pengukuran dilaksanakan setiap pagi hari pukul 08.00 WIB. Pengambilan sampel dilakukan dengan menggunakan pipet. Penghitungan kepadatan sel dilakukan dengan bantuan haemacytometer dan hand counter serta dilakukan di bawah mikroskop cahaya binokuler dengan pembesaran 400 kali. Selanjutnya data diformulasikan dengan rumus small block untuk mengetahui kuantitas kepadatan sel. Pengamatan terhadap kepadatan sel kultur dilakukan selama 6 hari.
Menurut Aujero (1982) dalam Saputro (2010), penghitungan menggunakan metode “Small Block” sebagai berikut : Pertama, sel fitoplankton
dihitung mulai dari sisi kiri kotak ke arah kanan kotak dan menghitung sel yang berada di dalam garis atau yang mendekati garis batas bagian dalam kotak. Kedua, penghitungan pada blok A, B, C, D, E dijumlahkan. Ketiga, kepadatan fitoplankton (sel/mL) dihitung dengan menggunakan rumus penghitungan “Small
Keterangan :
nA, nB, nC, nD: jumlah sel fitoplankton pada blok A, B, C, D dan E 5 : jumlah blok yang dihitung
4 x 10-6 : luas kotak kecil (A, B, C, D atau E)
(Sumber : Aujero, 1982 dalam Saputro, 2010)
E. Penghitungan Kandungan Karotenoid
Penghitungan karotenoid dilaksanakan setelah 6 hari budidaya. Sample kemudian dibawa ke laboratorium kering FPK UNAIR untuk dilakukan proses ekstraksi. Pengukuran kadar karotenoid menggunakan metode yang berasal dari Davies (1976) dalam Pramusinta (2012). Sebanyak 10 mL hasil kultur Chlorella sp. disentrifus pada kecepatan 3000 rpm selama 15 menit. Hasil supernatan sentrifus dibuang dan pellet Chlorella sp. yang berada di dasar tube diekstraksi dengan 5 ml metanol dan 5 ml dietil eter. Karotenoid pada fraksi metanol dengan bantuan larutan NaCl ditambahkan ke dalam dietil eter. Gabungan fraksi eter disaponifikasi dengan 2 ml metanol-KOH (konsentrasi akhir basa 5%), diinkubasi selama 12 sampai 16 jam pada suhu ruang. Kelebihan basa pada filtrat dihilangkan dengan menambahkan air. Fase dietil eter kemudian diukur serapannya pada panjang gelombang 452 nm.
Karotenoid (µg/ml) = 3,68 A452 dengan:
A = Absorban ( serapan pada panjang gelombang maksimum sampel) Kepadatan fitoplankton (sel/mL) = nA + nB + nC + nD + nE
4.3.3 Parameter
4.3.3.1Parameter Utama
Parameter utama yang diamati adalah kandungan karotenoid Chlorella sp. yang dilihat dari analisa karotenoid setelah fase panen.
4.3.3.2Parameter Pendukung
Parameter pendukung penelitian ini adalah kepadatan sel alga dan kualitas air yaitu suhu, pH dan salinitas.
4.3.4 Analisa Data
Data hasil percobaan dapat dianalisis dengan analisis ragam atau analysis of variance (ANOVA). Dalam analisis ragam terdapat nilai F hitung dan juga F
tabel. Nilai F hitung dibandingkan dengan F tabel sehingga dapat disimpulkan ada tidaknya pengaruh perlakuan yang diberikan. Apabila terdapat pengaruh perlakuan yang diberikan, maka unutk menentukan perlakuan mana yang berbeda dengan yang lain perlu dilakukan uji perbandingan berganda (Kusriningrum, 2008). Uji perbandingan berganda yang digunakan yaitu Uji Jarak Berganda Duncan
V HASIL DAN PEMBAHASAN
5.1 Hasil
Hasil pengamatan penelitian berupa data kandungan karotenoid dan kepadatan populasi Chlorella sp. Hasil tersebut digunakan untuk mengetahui pengaruh intensitas cahaya terhadap kandungan karotenoid Chlorella sp. Hasil pengamatan penelitian berupa populasi Chlorella sp. digunakan untuk mengambil korelasi hubungan antara populasi Chlorella sp. dengan kandungan karotenoid Chlorella sp. Parameter kualitas air berupa kisaran pH, suhu dan salinitas selama
penelitian ditampilkan sebagai data pendukung untuk melengkapi pembahasan.
5.1.1 Kandungan Karotenoid
Hasil pengamatan penelitian berupa kandungan karotenoid Chlorella sp. pada hari keenam yang dikultur dengan intensitas cahaya berbeda disajikan pada Lampiran 1. Hasil rata-rata kandungan karotenoid Chlorella sp. disajikan pada Tabel 5.1.
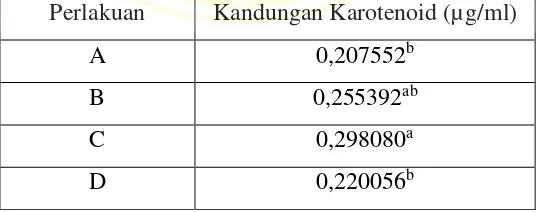
Tabel 5.1. Hasil rata-rata kandungan karotenoid Chlorella sp.
Perlakuan Kandungan Karotenoid (µg/ml)
A 0,207552b
B 0,255392ab
C 0,298080a
D 0,220056b
Keterangan : Superskrip berbeda dalam satu kolom menunjukkan ada perbedaan yang nyata (p<0,05).
Data kandungan karotenoid Chlorella sp. kemudian dianalisis dengan analysis of variance (ANOVA). Hasil analysis of variance (ANOVA)
menunjukkan bahwa setiap perlakuan intensitas cahaya memberikan pengaruh yang berbeda nyata terhadap kandungan karotenoid Chlorella sp. (p<0,05). Analisis dilanjutkan menggunakan uji jarak berganda Duncan dengan derajat kepercayaan 0,05. Hal ini untuk menentukan perlakuan mana yang berbeda dengan yang lain.
Hasil uji jarak berganda Duncan memperlihatkan bahwa perlakuan C berbeda nyata (p<0,05) dengan perlakuan A dan D. Perlakuan A tidak berbeda nyata (p>0,05) dengan perlakuan D.
Nilai ulangan setiap perlakuan dirata-rata sehingga didapat nilai rata-rata kandungan karotenoid Chlorella sp. setiap perlakuan. Grafik kandungan karotenoid Chlorella sp ditampilkan pada Gambar 5.1.
Gambar 5.1. Grafik kandungan karotenoid Chlorella sp. (µg/ml).
Keterangan :
Grafik di atas memperlihatkan bahwa kandungan karotenoid tertinggi terdapat pada perlakuan C (0,29808µg/ml). Kandungan karotenoid terendah terdapat pada perlakuan A (0,207552 µg/ml).
5.1.2 Populasi Chlorella sp.
Hasil pengamatan penelitian berupa penghitungan kepadatan populasi Chlorella sp. (per unit percobaan) ditampilkan pada Lampiran 2. Grafik
pertumbuhan Chlorella sp. ditampilkan pada Gambar 5.2.
Data yang diperoleh selama penelitian kemudian dianalisis dengan analysis of variance (ANOVA). Hasil analysis of variance (ANOVA)
menunjukkan bahwa setiap perlakuan intensitas cahaya memberikan pengaruh yang berbeda nyata terhadap kapadatan populasi Chlorella sp. (p<0,05). Analisis dilanjutkan menggunakan uji jarak berganda Duncan dengan derajat kepercayaan 0,05. Hal ini untuk menentukan perlakuan mana yang berbeda dengan yang lain. Hasil kepadatan populasi Chlorella sp. dapat dilihat pada Tabel 5.2.
Tabel 5.2. Hasil rata-rata kepadatan populasi Chlorella sp.
Perlakuan Rata-rata kepadatan populasi Chlorella sp. (sel/ml)
A 0,34b
B 5,5067a
C 8,0417a
D 0,6067b
Keterangan : Superskrip berbeda dalam satu kolom menunjukkan ada perbedaan yang nyata (p<0,05).
Perlakuan A : Intensitas 500 Lux Perlakuan B : Intensitas 3700 Lux Perlakuan C : Intensitas 7400 Lux Perlakuan D : Intensitas 11700 Lux
Gambar 5.2. Grafik pertumbuhan Chlorella sp.
Puncak populasi tertinggi terdapat pada perlakuan C (14,62x106 sel/ml)
5.1.3 Analisis Korelasi Eksponensial Kandungan Karotenoid dengan Kepadatan populasi Chlorella sp.
Analisis korelasi eksponensial dilakukan untuk mengetahui hubungan antara kandungan karotenoid dengan kepadatan populasi Chlorella sp.
Gambar 5.3 Grafik korelasi eksponensial kandungan karotenoid dan kepadatan populasi Chlorella sp.
Grafik korelasi eksponensial antara kandungan karotenoid dan kepadatan populasi Chlorella sp. terdapat pada Gambar 5.3. Hasil analisis menunjukan adanya hubungan antara kandungan karotenoid dengan kepadatan populasi Chlorella sp. yang ditunjukan dengan R2=0,861.
5.1.4 Kualitas Air
pemeliharaan dapat dilihat pada Tabel 5.3. Kisaran nilai kualitas air yang lebih detail (kisaran suhu per hari, kisaran salinitas per hari dan kisaran pH per hari) terdapat pada Lampiran 3.
Tabel 5.3. Kisaran nilai kualitas air
Perlakuan
Urutan kandungan karotenoid Chlorella sp. dari yang tertinggi adalah perlakuan C disusul kemudian perlakuan B, lalu perlakuan D sampai yang terendah yaitu perlakuan A. Urutan rata-rata kepadatan populasi Chlorella sp. dari yang tertinggi yaitu perlakuan C disusul kemudian perlakuan B, D sampai yang terendah yaitu perlakuan A. Ini menunjukan ada hubungan yang relevan antara kandungan karotenoid dengan kepadatan populasi Chlorella sp. Hubungan ini dipertegas dari analisis korelasi linier antara kandungan karotenoid dengan kepadatan populasi, yang menyatakan terdapat hubungan diantara keduanya (R2=0,8327).
yang berbeda nyata terhadap kandungan karotenoid Chlorella sp. (p<0,05). Ini berarti intensitas cahaya berpengaruh terhadap kandungan karotenoid Chlorella sp. Semakin tinggi intensitas cahaya maka kandungan karotenoid yang dihasilkan akan semakin tinggi. Hal ini karena pada kondisi intensitas cahaya tinggi, enzim bekerja secara optimal untuk menghasilkan karotenoid. Karotenogenesis ini disintesis oleh kombinasi β-carotene hydroxylase gene (CrtR-b) dan β-karoten ketolase (CtrW, BKT). Intensitas cahaya mampu meningkatkan level mRNA
carotenoid hydroxylase (CH) dan phytoene synthase (PSY) (Steinbrenner and
Linden, 2001). Dengan meningkatnya level mRNA carotenoid hydroxylase (CH) dan phytoene synthase (PSY) maka phytoene yang merupakan penyusun karoten juga meningkat. Meningkatnya phytoene dapat mempengaruhi meningkatnya karotenoid yang disintesis. Simkin et al. (2003) dalam Kurniawan (2010) menyatakan bahwa biosintesis karotenoid dipengaruhi oleh adanya gen psy-1 kemudian gen psy-1 yang akan menyandi enzim phytoen synthase. Adanya enzim tersebut akan mengawali biosintesis karotenoid. Johnson and An (1991) dan Albrecht and Sandman (1994) dalam Kurniawan (2010) mengemukakan bahwa cahaya merupakan salah satu faktor penting dalam biosintesis karotenoid. Menurut Bramley (2002) dalam Kurniawan (2010) peran cahaya tersebut adalah untuk meningkatkan aktivitas enzim yang berperan dalam biosintesis karotenoid.
dalam Servaites and Geiger, 1974). Naiknya ATP akan memicuh semakin cepatnya laju metabolisme dan akan mempengaruhi metabolisme karotenoid dalam sel alga. Peri et al. (2009) menyatakan bahwa intensitas cahaya memiliki hubungan positif terhadap kecepatan fotosintetik bersih dan konduksii stomata. Kecepatan fotosintetik menurun dengan menurunya intensitas cahaya begitu sebaliknya.
Terlihat dari data kandungan karotenoid bahwa semakin tinggi intensitas cahaya semakin tinggi pula kandungan karotenoid yang didapatkan kecuali pada perlakuan D. Jika dibandingkan antara perlakuan A (500 lux) dengan perlakuan D (11.700 lux) terlihat bahwa kandungan karotenoid perlakuan A lebih rendah dari pada perlakuan D meskipun tidak berbeda nyata.
Kandungan karotenoid pada perlakuan D lebih rendah dari perlakuan C juga dikarenakan kepadatan populasi Chlorella sp. perlakuan D lebih rendah dibanding perlakuan C. Akumulasi sel Chlorella sp. akan mempengaruhi akumulasi akhir karotenoid yang dihasilkan. Dengan begitu perlakuan C yang jumlah selnya lebih banyak mampu mengoptimalkan penyerapan cahaya dibandingkan dengan perlakuan yang lain sehingga Chlorella sp. pada perlakuan C bisa mengakumulasi karotenoid lebih banyak.
Hasil analysis of variance (ANOVA) terhadap kepadatan populasi Chlorella sp. menunjukkan bahwa setiap perlakuan intensitas cahaya memberikan
pengaruh yang berbeda nyata terhadap kepadatan populasi Chlorella sp. (p<0,05). Ini berarti intensitas cahaya berpengaruh terhadap kepadatan populasi Chlorella sp.
Hal ini karena intensitas cahaya merupakan faktor yang sangat penting untuk memaksimalkan konversi dari energi cahaya menjadi biomasa alga (Edwards et al.,2006 dalam Choochote et al., 2012). Dalam penelitiannya (Choochote et al., 2012), terlihat bahwa intensitas cahaya 5000 lux menghasilkan kepadatan tertinggi (3,88x 108 sel/ml) dibandingkan perlakuan 4000 lux dan 3000
Untuk perlakuan D (11.700 lux) dimana memiliki intensitas yang tinggi namun memiliki kepadatan yang lebih rendah dari perlakuan C dan B. Hal ini karena intensitas cahaya berpengaruh pada suhu dan salinitas sehingga perlakuan D (11.700 lux) memiliki kendala dalam pertumbuhan yang berakibat pada rendahnya kepadatan populasi akhirnya. Menurut Alim dan Kurniastuty (1995) dalam Merizawati (2008), Chlorella sp. adalah organisme kosmopolit yang mampu tumbuh pada salinitas nol sampai dengan 35 ppt. Chlorella sp. masih dapat bertahan hidup pada suhu 40oC. Pengaruh intensitas cahaya seperti yang disebutkan oleh Choochote et al. (2012) bahwa intensitas cahaya mampu menghasilkan kepadatan yang tinggi, terbukti dalam penelitian ini. Terlihat bahwa perlakuan A dan D yang sama-sama dalam kondisi ekstrem (keduannya tidak berbeda nyata dalam pertumbuhan) namun perlakuan D menunjukan hasil mampu mencapai kepadatan populasi yang lebih tinggi dibanding perlakuan A.
rata-rata pertumbuhan alga adalah saling berhubungan. Eppley and Stricland (1968) and Middlebooks and Porcella (1971) dalam Goldman and Carpenter (1974) telah mendiskusikan pentingnya interaksi antara intensitas cahaya, suhu dan konsentrasi nutrisi pada rata-rata pertumbuhan alga.
Suhu yang tinggi dapat mempengaruhi metabolisme sel. Ini berefek pada pertumbuhan, seperti pendapat Reynolds (1988), bahwa rata-rata pertumbuhan tergantung pada temperatur. Dalam metabolisme, enzim berfungsi sebagai biokatalisator dan sangat dibutuhkan keberadaannya. Enzim merupakan biokatalisator yang mampu mempercepat jalannya reaksi tanpa ikut bereaksi. Salah satu sifat enzim yaitu sangat peka terhadap faktor-faktor yang menyebabkan denaturasi protein misalnya suhu. Enzim bekerja maksimum pada suhu 40oC (Worthington Biochemical Corporation, 1972). Pengaruh suhu terhadap reaksi enzim terlihat pada Gambar 5.4.
Gambar 5.4. Pengaruh suhu terhadap reaksi enzim (Worthington Biochemical Corporation, 1972)
Kisaran kualitas air terutama suhu dan salinitas berada dalam kondisi fluktuatif bahkan ada yang memperlihatkan kondisi ekstrem. Percobaan pada laboratorium oleh Lund (1949) dalam Reynolds (1988) menunjukkan bahwa beberapa spesies menunjukkan respon yang berbeda terhadap suhu. Foy et al. (1976) dalam Reynolds (1988) menambahkan bahwa beberapa spesies memliki sensitivitas yang berbeda terhadap intensitas cahaya dan fotoperiode. Menurut Reynolds (1988), kajian ini untuk menekankan bahwa hasil rata-rata pertumbuhan tergantung pada beberapa proses pokok, yang mana masing-masing respon fluktuatif pada temperatur (suhu) luar. Transpor intraseluler, asimilasi fotosintesis dan nutrisi lain serta penyusunan material sel baru, tergantung pada temperatur, khususnya ketika proses perakitan organel. Pada proses ini fotosintesis sangat tergantung pada cahaya.
pengukuran suhu air selama penelitian berkisar antara 29-40oC. Tingginya suhu disebabkan oleh intensitas cahaya yang tinggi pada perlakuan C (7.400 lux) dan D (11.700 lux). Salinitas pada media pemeliharaan Chlorella sp. berkisar antara 22-60 ppt. Fast (1983) dalam Satyantini (2006) mengklasifikasikan air berdasarkan salinitasnya, yang mana salah satunya yaitu kelompok hypersaline. Hypersaline adalah air yang memiliki salinitas diatas 40 ppt.
Air payau mempunyai salinitas kurang dari 25 ppt sementara air hipersalinitas memiliki salinitas lebih dari 40 ppt. Salinitas bervariasi tergantung antara penguapan dan presipitasi, serta besarnya pencampuran antara air permukaan dan air kedalaman. Salinitas air dapat mencapai maksimum jika penguapan melampaui presipitasi. Salinitas cenderung tinggi apabila penguapan sangat tinggi sedangkan aliran air terbatas (Universitas Diponegoro, 2007). Oxtoby et al. (2001) menyatakan bahwa setiap larutan memiliki titik jenuh, begitu pula kadar garam. Titik tercapainya keadaan jenuh larutan sangat dipengaruhi oleh beberapa faktor lingkungan, seperti suhu, tekanan dan kontaminasi. Secara umum kelarutan suatu zat sebanding terhadap suhu.
VI KESIMPULAN
6.1 Kesimpulan
Kesimpulan penelitian ini adalah :
1. Intensitas cahaya memberikan pengaruh yang berbeda nyata terhadap kandungan karotenoid Chlorella sp.
2. Cahaya dengan intensitas 7.400 lux dapat menghasilkan karotenoid yang tertinggi sebesar 0,298080 µg/ml.
6.2 Saran
Perlu dilakukan penelitian lebih jauh terkait kultur semi-massal Chlorella sp. menggunakan tabung fotobioreaktor dengan memanfaatkan
DAFTAR PUSTAKA
Biolab Medical Unit. 2010. Carotenoid. BIOLAB. Ltd. London, England. P. 1. Biranti, F., M. Nursid dan B. Cahyono. 2009. Analisis Kuantitatif β-karotenoid
dan Uji Aktivitas Karotenoid dalam Alga Coklat Turbinaria decurrens. Jurnal Sains & Matematika (JSM). Jakarta. Vol. 17 No.2. hal. 90.
Bjerkeng, B. 2000. Carotenoid Pigmentation of Salmonid Fishes - Recent Progress. AKVAFORSK, Institute of Aquaculture Research AS, Sunndalsøra, Norway. p. 71.
Cifuentes A. S., M.A Gonzalez, S. Vargas, M. Hoeneisen and N. Gonzalez. 2003. Optimization of Biomass, Total Carotenoids and Astaxanthin Production in Haematococcus pluvialis Flotow Strain Steptoe (Nevada, USA) under Laboratory Conditions. Chile. Biol Res 36. pp. 343-357.
Choochote, W., K. Paiboonsin, S. Ruangpan and A. Pharuang. 2012. Effects of Urea and Light Intensity on the Growth of Chlorella sp. The 8th International Symposium on Biocontrol and Biotechnology. Bangkok p.130-131.
Creswell, L. 2010. Phytoplankton Culture for Aquaculture Feed. SRAC Publication No.5004. Florida. USA. p.2.
Geetha, B.V., R.Navasakthi and E. Padmini. 2010. Investigation of Antioxidant Capacity and Phytochemical Composition of Sun Chlorella -An Invitro Study. Journal of Aquaculture Research & Development. Tamilnadu, India. P. 1
Goldman, J. C. and E. J. Carpenter. 1974. A Kinetic Approach to the Effect of Temperature on Algal Growth. Woods Hole Oceanographic Institution. Woods Hole. Massachusetts Vol. 19 (5). p. 756.
Gupta, S.K., A.K. Jha, A.K Pal and G. Venkateshwarlu. 2007. Use of Natural Karotenoids for Pigmentation in Fishes. Natural Product Radiance, Vol.6(1). pp. 46-49.
Happey-Wood, C. M. 1988. Ecology of Freshwater Planktonic Green Algae. In: C. D. Sandgren (Eds.). Growth and Reproductive Strategies of Freshwater Phytoplankton. Cambridge University Press. Cambridge. pp. 175, 218-219.
Huboyo, H. S. dan B. Zaman. 2007. Analisis Sebaran Temperatur dan Salinitas Air Limbah PLTU-PLTGU Berdasarkan Sistem Pemetaan Spasial (Studi Kasus: PLTU-PLTGU Tambak Lorok Semarang). Jurnal PRESIPITASI. Vol. 3 No.2. Semarang. hal. 44.
Isnansetyo, A. dan Kurniastuty. 1995. Teknik Kultur Phytoplankton dan Zooplankton. Kanisius. Yogyakarta. hal. 34-85.
Kurniawan, M., M. Izzati, dan Y. Nurchayati. 2010. Kandungan Klorofil, Karotenoid dan Vitamin C pada Beberapa Spesies Tumbuhan Akuatik. Buletin Anatomi dan Fisiologi. Semarang. vol. XVIII, No.1. 34 hal.
Kusriningrum R.S. 2008. Perancangan Percobaan. Airlangga University Press. Surabaya. hal. 1,11,77.
Masithah, E.D, W. H. Satyantini, M. A. Alamsjah, Prayogo dan S. Andriyono. 2012. Penuntun Praktikum Budidaya Pakan Alami. Fakultas Perikanan dan Kelautan Universitas Airlangga. Surabaya. hal. 20-39.
Merizawati. 2008. Analisis Sinar Merah, Hijau, dan Biru (RGB) untuk Mengukur Kelimpahan Fitoplankton (Chlorella sp.). Skripsi Program Studi Ilmu dan Teknologi Kelautan Fakultas Perikanan dan Ilmu Kelautan Institut Pertanian Bogor. 87 hal.
Myers, J. 1944. The Growth of Chlorella pyrenoidosa Under Varius Cunture Conditions. Plant Physiology. Austin, Texas. p. 579.
Oxtoby, D.W, H.P. Gilis, dan N.H Nachtrieb. 2001. Prinsip-Prinsip Kimia Modern. Edisi ke-4. Jilid 1. Diterjemahkan oleh S.S. Achmadi. Erlangga. Jakarta. hal 346-347.
Pamungkas, W. A dan Y. E. Kurniady. 2006. Optimasi Proses Ekstraksi Pigmen Karotenoid dari Spirulina platensis. Jurusan Teknik Kimia. Fakultas Teknik. Universitas Diponegoro. Semarang. 33 hal.
Peri, P. L., G. M. Pastur and M. V. Lencinas. 2009. Light Intensities and Water Status of Two Main Nothofagus Species of Southern Patagonian Forest, Argentina. Journal of Forest Science, 55, 2009 (3). Santa Croz. Argentina. P.105, 107.
Pramusinta, G. 2012. Pengaruh Pemberian Pupuk Cair Limbah Ikan Lemuru Terhadap Kandungan Karotenoid Spirulina platensis. Skripsi. Fakultas Perikanan dan Kelautan. Universitas Airlangga. Surabaya. 57 hal.
Reynolds, C. S. 1988. Fungtional Morphology and The Adaptive Strategies of Freshwater Phytoplankton. Cambridge University Press. Cambridge. 405 p.
Rodriguez-Amaya, D. B. and M. Kimura. 2004. HarvestPlus Handbook for Carotenoid Analysis. HarvestPlus. Washington, DC. pp. 2-3.
Rostini, I. 2007. Kultur Fitoplankton (Chlorella sp. dan Tetraselmis chuii) Pada Skala Laboratorium. Universitas Padjadjaran Fakultas Perikanan dan Ilmu Kelautan. Jatinangor. 10 hal.
Ryer, A. 1998. Light Measurement Handbook. Technical Publications Dept. International Light, Inc. 17 Graft Road Newburyport, MA. USA. pp. 29-32.
Sandgren, C. D. 1988. The Ecology of Chrysophyte Flagellates: Their Growth and Perennation Strategies As Freshwater Phytoplanton. In: C. D. Sandgren (Eds.). Growth and Reproductive Strategies of Freshwater Phytoplankton. Cambridge University Press. Cambridge. pp. 1-2.
Saputro, H. 2010. Pemanfaatan Blotong Kering sebagai Pupuk untuk Peningkatan Pertumbuhan Populasi Dunaliella salina. Skripsi. Fakultas Perikanan dan Kelautan. Universitas Airlangga. Surabaya. 64 hal.
Satriyanto, B., S. B. Widjanarko dan Yunianta. 2012. Stabilitas Warna Ekstrak Buah Merah (Pandanus conoideus) Terhadap Pemanasan Sebagai Sumber Potensial Pigmen Alami. Jurnal Teknologi Pertanian. Malang. Vol. 3 No. 2 . 158 hal.
Satyantini, W. H. 2006. Diktat Kuliah Dasar-Dasar Akuakultur. Fakultas Perikanan dan Kelautan Universitas Airlangga. Surabaya. 5 hal. (tidak diterbitkan)
Satyantini, W. H. dan E. D. Masithah. 2008. Diktat Penuntun Praktikum Budidaya Pakan Alami. Fakultas Perikanan dan Kelautan Universitas Airlangga. Surabaya. hal. 28 – 49.
Seigler, D. S. 1998. Tetraterpenes or Carotenoids. Springer. US. pp. 486-505. Servaites, J. C. and D. R. Geiger. 1974. Effects of Light Intensity and Oxygen on
Photosynthesis and Translocation in Sugar Beet. Plant Physiol. 54. Ohio. P. 575.
Stange, C. and C. Flores. 2012. Carotenoids and Photosynthesis - Regulation of Carotenoid Biosyntesis by Photoreceptors In Advances in Photosynthesis - Fundamental Aspects. InTech. Rijeka, Croatia. p.77.
Steinbrenner, J. and H. Linden. 2001. Regulation of Two Carotenoid Biosynthesis Genes Coding for Phytoene Synthase and Carotenoid Hydroxylase during Stress-Induced Astaxanthin Formation in the Green Alga Haematococcus pluvialis. Plant Physiol. American Society of Plant Biologists. America. Vol. 125. pp. 811-815.
Sutomo. 2005. Kultur Tiga Jenis Mikroalga (Tetraselmis sp., Chlorella sp. dan Chaetoceros gracilis) dan Pengaruh Kepadatan Awal Terhadap Pertumbuhan C. gracilis di Laboratorium. Jurnal Oseanografi dan Limnologi di lndonesia. No. 37. hal. 43 – 58.
Sze, P. 1993. A Biology of The Algae. Second Edition. wm. C. Brown Communications. Inc. Dubuque. USA. p. 3.
Takaichi, S. 2011. Carotenoids in Algae: Distributions, Biosyntheses and Functions. Mar. Drugs. Kawasaki 211-0063, Japan. 9. pp. 1101-1118. Tetelepta, L. D. 2011. Pertumbuhan Kultur Chlorella spp. Skala Laboratorium
Pada Beberapa Tingkat Kepadatan Inokulum. Prosiding Seminar Nasional: Pengembangan Pulau-Pulau Kecil. 199 hal.
Universitas Diponegoro. 2007. Buku Ajar Mata Kuliah Oseanografi Fisika. Program Studi Ilmu Kelautan Jurusan Ilmu Kelautan Fakultas Perikanan dan Ilmu Kelautan Universitas Diponegoro. Semarang. hal. 10-13.
Walne, P. R. 1970. Studies on the Food Value of Nineteen Genera of Algae to Juvenile Bivalves of the Genera Ostrea, Crassostrea, Mercenaria, and Mytilis. Fish. Invest. 26. pp. 1-62.
Lampiran 1. Kandungan Karotenoid Chlorella sp. (µg/ml)
ULANGAN
PERLAKUAN
A B C D
1 0,19504 0,27600 0,33856 0,24288
2 0,22448 0,19872 0,29072 0,20976
3 0,19504 0,23920 0,20976 0,21344
4 0,21712 0,27600 0,36432 0,23920
5 0,20608 0,28704 0,28704 0,19500
Keterangan:
Lampiran 3. Kisaran suhu per hari, kisaran salinitas per hari dan kisaran pH per hari
Tabel kisaran suhu per hari
Lampiran 4. SPSS kandungan karotenoid
000 .19120429 .22389971 .195040 .224480
B 5 .255392
00 .036485859
.016316
972 .21008882 .30069518 .198720 .287040
C
5 .298080
00 .059166802
.026460
198 .22461471 .37154529 .209760 .364320
D 5 .220056
00 .020402267
.009124
171 .19472324 .24538876 .195000 .242880
Total 20 .245270
00 .049436198
.011054
270 .22213315 .26840685 .195000 .364320
Test of Homogeneity of Variances
D 1 .242880
2 .209760
3 .213440
4 .239200
5 .195000
Total N 5
Mean .22005600
Std. Deviation .020402267
Minimum .195000
Maximum .242880
Total N 20
Mean .24527000
Std. Deviation .049436198
Minimum .195000
Maximum .364320
Lampiran 5. SPSS kepadatan populasi Chlorella sp. selama 6 hari
Oneway
Descriptives
KEPADATAN POPULASI Chlorella sp.
N Mean
KEPADATAN POPULASI Chlorella sp
Levene
Statistic df1 df2 Sig.
10.330 3 20 .000
ANOVA
KEPADATAN POPULASI Chlorella sp
14.62 1 C
Total N 1
Mean 3.0000
Minimum C
Maximum C
Std. Deviation .
Variance .
Total N 24
Mean 2.5000
Minimum A
Maximum D
Std. Deviation 1.14208
Variance 1.304