TESIS
TASRIF HAMDI
PROGRAM STUDI MAGISTER - KLINIK SPESIALIS ANESTESIOLOGI DAN TERAPI INTENSIF
FAKULTAS KEDOKTERAN UNIVERSITAS SUMATERA UTARA M E D A N
2 0 1 5
PERBANDINGAN DURASI ANALGESIA KETAMIN 0,5 mg/KgBB/IV DAN MORFIN 0,1 mg/KgBB/IV SEBAGAI ANALGESIA PASCAOPERASI PADA
PASIEN OPERASI SESAR DENGAN ANESTESI SPINAL
TESIS Oleh Tasrif Hamdi NIM : 107114008
PEMBIMBING I :
dr. Asmin Lubis, DAF, Sp.An KAP KMN PEMBIMBING II :
dr. Muhammad Ihsan, Sp.An KMN
Untuk memperoleh gelar Magister Klinik di bidang Anestesiologi dan Terapi Intensif / M. Ked (An) pada Fakultas Kedokteran Universitas Sumatera Utara
PROGRAM STUDI MAGISTER - KLINIK SPESIALIS ANESTESIOLOGI DAN TERAPI INTENSIF
FAKULTAS KEDOKTERAN UNIVERSITAS SUMATERA UTARA M E D A N
2 0 1 5
ANALGESIA PASCAOPERASI PADA PASIEN OPERASI SESAR DENGAN ANESTESI SPINAL
Nama Mahasiswa : Tasrif Hamdi
NIM : 107114008
Program : Magister Kedokteran Klinik Konsentrasi : Anestesiologi dan Terapi Intensif
Menyetujui, Komisi Pembimbing
Pembimbing I
dr. Asmin Lubis, DAF, Sp.An KAP KMN NIP 1953 0121 1979 0210 01
Pembimbing II
dr. Muhammad Ihsan, Sp.An KMN NIP 1975 0414 2008 0110 20
Sekretaris Program Studi Program Magister Kedokteran Klinik
FK USU
Dekan
Fakultas Kedokteran USU
dr. Murniati Manik, MSc, SpKK, SpGK NIP. 1953 0719 1980 0320 01
Prof. dr. Gontar A. Siregar, SpPD, KGEH NIP. 1954 0220 1980 1110 01
Telah diuji pada Tanggal : 11 Juli 2015 Penguji Tesis :
Penguji I Penguji II
dr. Hasanul Arifin, SpAn KAP KIC NIP. 1951 0423 1979 0210 03
dr.Chairul M.Mursin,Sp.An KAO
Penguji III
Prof. dr. Achsanuddin Hanafie, Sp.An KIC KAO NIP. 1952 0826 1981 0210 01
Ketua Departemen / SMF Anestesiologi dan Terapi Intensif FK USU - RSUP H. Adam Malik Medan
Ketua Program Studi Anestesiologi dan Terapi Intensif FK USU - RSUP H. Adam Malik Medan
Prof. dr. Achsanuddin Hanafie, SpAn, KIC, KAO NIP. 1952 0826 1981 0210 01
dr. Hasanul Arifin, SpAn, KAP, KIC NIP. 1951 0423 1979 0210 03
Allah SWT, karena atas rahmat dan ridho – Nya saya berkesempatan mengikuti Program Pendidikan Dokter Spesialis Anestesiologi dan Terapi Intensif Fakultas Kedokteran Universitas Sumatera Utara serta menyusun tesis ini sebagai salah satu syarat kelulusan dari pendidikan spesialisasi di bidang Anestesiologi dan Terapi Intensif. Sholawat dan salam saya sampaikan kepada Nabi Muhammad SAW beserta keluarga dan sahabat – nya Radhiallahu’anhum ajmai’in yang telah membawa perubahan dari masa jahiliyah ke masa penuh ilmu pengetahuan dan mengangkat kebodohan pada umumnya seperti yang kita rasakan saat ini. Semoga karya tulis ini merupakan sumbangsih bagi perkembangan ilmu anestesiologi dan terapi intensif di Indonesia pada umumnya dan Departemen Anestesiologi dan Terapi Intensif Fakultas Kedokteran USU pada khususnya.
Pada kesempatan ini, saya ingin menyampaikan rasa terima kasih dan penghargaan yang sebesar-besarnya kepada :
Bapak Rektor Universitas Sumatera Utara, yang telah memberikan kesempatan kepada saya untuk mengikuti Program Pendidikan Dokter Spesialis di universitas ini.
Bapak Dekan Fakultas Kedokeran Universitas Sumatera Utara, yang telah memberikan kesempatan kepada saya untuk mengikuti Program Pendidikan Dokter Spesialis di fakultas ini.
Bapak Direktur Rumah Sakit Umum Pusat H. Adam Malik Medan, yang telah memberikan kesempatan kepada saya untuk belajar dan bekerja di lingkungan Rumah Sakit ini.
v
Dengan penuh rasa hormat, saya sampaikan terima kasih tak terhingga kepada (Alm) dr. Muhammad AR, Sp.An KNA, dr. Asmin lubis, DAF, Sp.An KAP KMN dan dr. Muhammad Ihsan, Sp.An KMN sebagai pembimbing penelitian saya, dimana atas bimbingan, pengarahan, dan sumbang saran yang telah diberikan, saya dapat menyelesaikan penelitian ini tepat pada waktunya.
Juga dengan penuh rasa hormat, saya sampaikan terima kasih yang tak terhingga kepada dr. Hasanul Arifin, Sp.An KAP KIC, sebagai Ketua Program Studi, dr. Akhyar Hamonangan Nasution, Sp.An KAKV, sebagai Sekretaris Program Studi, Prof. dr. Achsanuddin Hanafie, Sp.An KIC KAO sebagai Ketua Departemen dan Dr. dr. Nazaruddin Umar Sp.An, KNA yang telah banyak membimbing dan banyak memberikan nasihat selama masa pendidikan saya.
Rasa hormat dan terima kasih yang tidak terhingga saya sampaikan kepada guru-guru saya : dr. A. Sani P. Nasution, Sp.An KIC;
dr. Chairul M. Mursin, Sp.An KAO; (Alm) dr. Nadi Zaini Bakri, Sp.An; (Alm ) dr. Muhammad AR, Sp.An KNA; dr. Soejat Harto, Sp.An KAP; dr. Yutu Solihat, Sp.An KAKV; dr. Ade Veronica H. Y. Sp.An KIC; dr. Muhammad.
Ihsan Sp.An KMN; Dr. dr. Dadik Wahyu Wijaya Sp.An; dr. Romi F.
Nadeak, Sp.An; dr. RR Shinta Irina, Sp.An; dr. Guido M. Solihin, Sp.An KAKV; dr. Qadri F. Tanjung, Sp.An KAKV; dr. Syamsul Bahri Siregar, Sp.An; dr. Tumbur, Sp.An; dr. Walman S Sp.An; dr. Nugroho Kunto Subagio, Sp.An dan lain lain yang tidak dapat saya sebutkan satu persatu yang dengan keikhlasan dan ketulusannya telah mendidik dan memberikan bimbingan kepada saya selama mengikuti program pendidikan ini.
Ucapan terima kasih saya sampaikan kepada dr. Taufik Ashar, MKM yang telah meluangkan waktu sebagai pembimbing metode penelitian dan analisis statistik pada penelitian ini yang banyak
memberikan masukan, arahan, kritikan yang bersifat membangun demi kesempurnaan karya tulis ilmiah ini.
Kepada perawat / paramedik dan seluruh karyawan/karyawati RSUP H. Adam Malik Medan, RSUD dr. Pirngadi Medan, RS Haji Medan, dan Rumkit Tk. II Putri Hijau Medan yang telah banyak membantu dan bekerja sama dengan baik selama ini dalam menjalani tugas pendidikan dan pelayanan kesehatan, serta kesempatan yang diberikan sehingga saya dapat melaksanakan penelitian ini, saya juga mengucapkan terima kasih yang setulus-tulusnya.
Kepada seluruh pasien dan keluarganya di RSUP H. Adam Malik Medan dan rumah sakit jejaring yang besar perannya sebagai “guru”
kedua saya dalam menempuh pendidikan spesialis. Khususnya yang berperan serta dalam penelitian ini, rasa sakit mereka telah memotivasi saya untuk dapat memberikan yang terbaik dari ilmu yang saya dapatkan dan pelajari, saya ucapkan banyak terima kasih dan mohon maaf bila pelayanan saya kurang berkenan di hati.
Ucapan terima kasih juga saya sampaikan kepada seluruh teman- teman Program Pendidikan Dokter Spesialis Anestesiologi dan Terapi Intensif FK USU yang telah banyak membantu dalam penyelesaian program pendidikan dan penelitian ini.
Sembah sujud, rasa syukur dan terima kasih yang tak terhingga saya persembahkan kepada kedua orang tua saya tercinta, ibunda Ermidawati dan ayahanda tercinta Syahril atas segala jerih payah, pengorbanan, do’a dan kasih sayang beliau berdua dalam mengasuh, membesarkan, dan membimbing saya dengan keringat dan air mata sampai akhir hayatnya. Semoga Allah SWT mengampuni segala dosa dan kesalahan dan mengekalkan segala amal jariyah yang telah beliau berdua kerjakan selama ini. Demikian halnya kepada kedua mertua saya Ibunda Suryani Br Sipahutar dan ayahanda Ono Tariono Mastari, yang
vii
senantiasa memberi nasihat, motivasi, teladan, dan telah banyak memberikan bantuan moril dan materil selama saya mengikuti program pendidikan ini.
Dari hati yang tulus saya mengucapkan terima kasih yang tidak terkira kepada istri tercinta dr. Ekawaty Suryani Mastari dan putraku tersayang Habib Muhammad Hamdi bin Tasrif Hamdi atas pengertian, do’a, dorongan semangat, kesabaran, dan kesetiaan yang tulus dalam suka dan duka mendampingi saya selama pendidikan ini.
Terimakasih juga kepada teman-teman saya sekaligus relawan saya dr. Taor Marpaung, dr. Andrias dan dr. Angga P Putra yang banyak membantu demi keberlangsungan penelitian ini.
Akhirnya hanya kepada Allah SWT jualah kita berlindung dan kembali, semoga kita semua senantiasa diberi limpahan rahmat dan karunia-Nya. Amin ya Robbal’alamin.
Medan, 20 Juni 2015
dr. Tasrif Hamdi
sesar dengan anestesi spinal.
Metode : Uji klinis acak tersamar ganda pada 42 pasien, usia rata-rata31 tahun, PS-ASA 2 yang akan menjalani operasi sesar elektif dan emergensi dengan anestesi spinal di Rumah Sakit Haji Adam Malik dan jejaring.
Sampel dibagi menjadi dua kelompok masing-masing terdiri dari 21 orang.
Kelompok kontrol adalah pasien-pasien yang mendapat perlakuan obat analgetik morfin dosis 0,1 mg/kgBB/IV yang diberikan setelah jahit kulit.
Grup perlakuan yaitu kelompok yang diberikan ketamin dosis 0.5 mg/kgBB/IV setelah kulit dijahit. Efektifitas obat morfin dan ketamin dinilai dengan menilai skor VAS dalam 24 jam pascaoperasi.
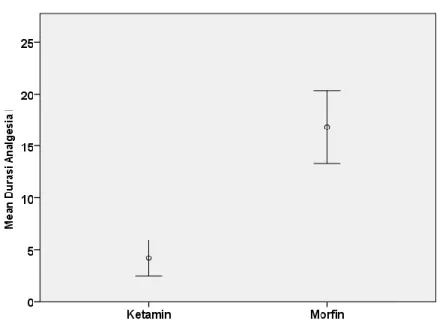
Hasil : Rerata durasi analgesia pada kelompok ketamin adalah 5,05 jam sedangkan pada kelompok morfin jauh lebih lama dengan rerata durasi 16,81 jam dengan p=0,0001(bermakna jika p < 0.05). Secara klinis kelompok ketamin dan morfin sebagian besar tidak lagi membutuhkan analgeticrescue kedua dalam 24 jam pascaoperasi. Efek samping kedua obat ditemukan perbedaan yang tidak bermakna.
Kesimpulan : Durasi analgesia ketamin belum dapat nengungguli durasi analgesia dari morfin yang digunakan sebagai analgetik pascaoperasi sesar dengan anestesi spinal.
Kata kunci :Analgesia pascaoperasi, durasi analgesia
ABSTRACT
Objective : This research is aimed to obtain a more effective alternative drugs as postoperative analgesia for patient with cesarian section using spinal anesthesia.
Method: Double-blind randomized clinical trial in 42 patients, mean aged 31 years, PS-ASA 2 which will undergo elective cesarian section and emergency surgery with spinal anesthesia in Haji Adam Malik Hospital and networking hospital. The samples were divided into two groups, each composed of 21 people. The control group were patients who receive treatment morphine 0,1 mg/kgBB/IV after skin closure. Treatment group, who received ketamine 0,5 mg/kgBB/IV after skin closure.The effectiveness of the drug morphine and ketamine aspostoperative analgesia, assessed by VAS score within 24 hours postoperatively.
Result:Mean duration of first analgesia in ketamine group is 5,05 hours and morphine groupis longer than ketamine which is 16,81 hourswith p=0,0001(significant if p value < 0.05). Clinically, ketamine and morphine group didn’t need second analgesicrescue in 24 hours. No significant differencefoundin the side effects of both drugs.
Conclusion: Duration of analgesia ketamine can’t defeat duration of analgesia morphine as postoperative analgesia for caesarean section patient undergone spinal anaesthesia.
Keywords : Postoperative analgesia, Duration
LEMBAR PRASYARAT... ... i
LEMBAR PENGESAHAN... ... ii
LEMBAR PENGUJI... ... iii
KATA PENGANTAR... ... iv
ABSTRAK... ... viii
ABSTRACT... ... ix
DAFTAR ISI... ... x
DAFTAR TABEL... ... xii
DAFTAR GAMBAR…...………... xiii
DAFTAR SINGKATAN... ... xiv
DAFTAR LAMPIRAN... xvi
BAB 1 PENDAHULUAN ... 1
1.1 Latar Belakang... 1
1.2 Rumusan Masalah ... 6
1.3 Hipotesa... 6
1.4 Tujuan Penelitian ... 6
1.5 Manfaat Penelitian ... 7
BAB 2 TINJAUAN PUSTAKA ... 9
2.1 Definisi Nyeri... 9
2.2 Patofisiologi Nyeri ... 9
2.3 Penilaian Nyeri ... 13
2.4 Klasifikasi Nyeri………... 15
2.5 Ketamin ... 18
2.6 Morfin ... 25
2.7 Kerangka Teori ... 32
2.8 Kerangka Konsep ... 33
BAB 3 METODOLOGI PENELITIAN ... 34
xi
3. 1 Desain Penelitian ... 34
3. 2 Tempat dan Waktu... 34
3. 3 Populasi dan sampel... 34
3. 4 Perkiraan Besar Sampel ... 34
3. 5 Kriteria inklusi, ekslusi dan putus uji ... 36
3. 6 Identifikasi Variabel ... 36
3. 7 Defenisi Operasional... 36
3. 8 Analisis Statistik ... 38
3. 9 Alat dan Bahan ... 38
3.10Cara Kerja... 39
3.11Kerangka Kerja ... 43
BAB 4 HASILPENELITIAN ... 44
4.1Karakteristik Subyek Penelitian ... 44
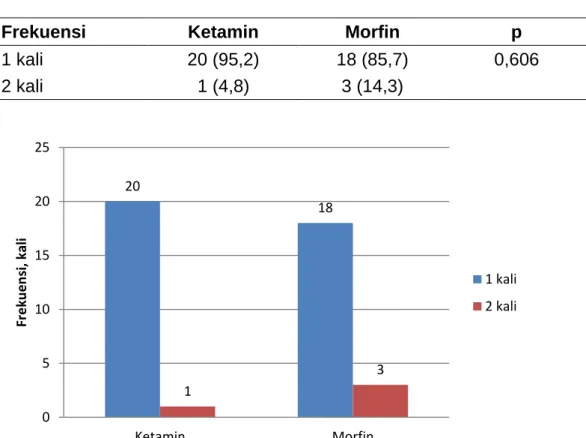
4.2 Perbedaan Frekuensi Pemberian Analgetic Rescue (AR)... 46
4.3 Perbedaan Durasi Analgesia ... 47
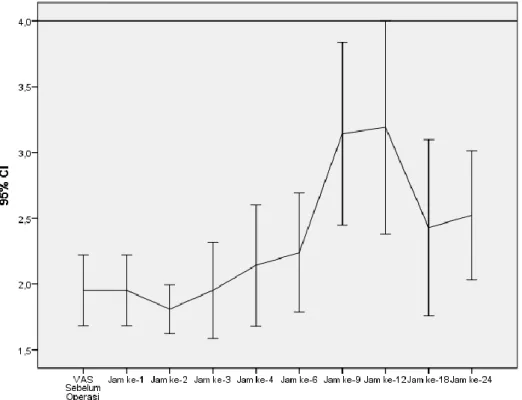
4.4Perbedaan VAS antara Kelompok Ketamin dan Morfin ... 48
4.5 Perbedaan VAS Kelompok Ketamin ... 49
4.6 Perbedaan VAS Kelompok Morfin ... 50
4.7 Perbedaan Efek Samping... 52
BAB 5 PEMBAHASAN ... 54
BAB 6 KESIMPULAN DAN SARAN ... 59
6.1 Kesimpulan ... 59
6.2 Saran ... 59
DAFTAR PUSTAKA... 60
Tabel 1 Karakteristik Subyek Penelitian 45 Tabel 2
Perbedaan Perbedaan Frekuensi Analgetic Rescue antara Kelompok Ketamin dan Morfin
46
Tabel 3 Perbedaan Durasi Analgesia antara Kelompok Pasien yang Menerima Ketamin dengan Kelompok Pasien yang Menerima Morfin
47
Tabel 4 Perbedaan VAS Pre dan Pascaoperasi Sampai Pengamatan Jam ke 24 antara Kelompok Ketamin dan Morfin
48
Tabel 5 Perbedaan VAS Pre dan Pascaoperasi Sampai Pengamatan Jam ke 24 pada Kelompok Ketamin
49
Tabel 6 Perbedaan VAS Pre dan Pascaoperasi Sampai Pengamatan Jam ke 24 pada Kelompok Morfin
51
Tabel 7 Perbedaan Efek Samping antara Kelompok yang Mendapatkan Ketamin dan Kelompok yang Mendapatkan Morfin
52
DAFTAR GAMBAR
NO JUDUL HAL
Gambar 1 Wong Baker Faces Pain Rating Scale 13 Gambar 2 Verbal Rating Scale Numerical Rating Scale 14
Gambar 3 Numerical Rating Scale 14
Gambar 4 Visual Analoge Scale 15
Gambar 5 Sruktur Bangun Ketamin 18
Gambar 6 Struktur Bangun Morfin
25 Gambar 7 Grafik Batang Perbedaan Frekuensi Pemberian
Analgetic Rescue antara Dua Kelompok Studi 46
Gambar 8 Grafik Error Bar Durasi Analgesia
pada Kelompok Ketamin dan Morfin 47
Gambar 9 Grafik Error Bar VAS untuk Setiap
Jam Pengamatan pada Kelompok Ketamin 50
Gambar 10 Grafik Error Bar VAS untuk Setiap
Jam Pengamatan pada Kelompok Morfin 51
Gambar 11 Grafik Batang Perbedaan Efek Samping Sedasi pada kelompok Ketamin dan Morfin 53 Gambar 12 Grafik Batang Perbedaan Efek Samping Mual
pada kelompok Ketamin dan Morfin 53
NMDA : N-methyl-D-aspartat PG : Prostaglandin
TXA2 : Thromboxane PGI2 : Prostacyclin PS : Physical Status
ASA : American Society of Anesthesiologists LT : Leukotriene
LTD4 : Leukotriene D4 LTB4 : Leukotriene B4 IL : Interleukin
PMN : Poly Morph Nuclear
AINS : Anti-inflammatory Non-Steroid
NSAID : Non-Steroid Anti-Inflammatory Drugs GABA : Gama Amino Butyric Acid
VRS : Verbal Rating Scale NRS : Numerical Rating Scale VAS : Visual Analogue Scale M6G : Morphine 6-Glucoronide M3G : Morphine 3-Glucoronide CYP : Cytochrome
cAMP : Cyclic AMP
RVM : Rostral Ventromedial Medulla PAG : Periaqueductal Gray Matter CTZ : Chemoreceptor Trigger Zone
xv PCA : Patient Control Analgesia
Mg : Milligram
KgBB : Kilogram Berat Badan IM : Intramuscular
IV : Intravenous
ETT : Endotracheal Tube
Lampiran 1 Riwayat Hidup Peneliti 65
Lampiran 2 Jadwal Tahapan Penelitian 66
Lampiran 3 Lembar Penjelasan Kepada Subjek Penelitian
67
Lampiran 4 Lembar Persetujuan Setelah Penjelasan
“Inform Consent”
69
Lampiran 5 Lembaran Observasi Pasien 71
Lampiran 6 Rencana Anggaran 72
Lampiran 7 Tabel Randomisasi 73
Lampiran 8 Surat Izin Komisi Etik FK-USU dan RSUPHAM
75
Lampiran 9 Surat Izin Penelitian Rumah Sakit Haji Medan 76
BAB 1 PENDAHULUAN
1.1. Latar Belakang Masalah
Operasi sesar saat ini menjadi populer di dunia terutama di negara berkembang. Menurut survei demografi dan kesehatan Indonesia pada tahun 2002 sampai 2003 tercatat angka persalinan dengan operasi kurang dari 4% dari jumlah total persalinan. Saat ini jumlah operasi sesar berkisar 20% sampai 25% dari total persalinan, sedangkan di rumah sakit swasta jumlahnya sangat tinggi yaitu berkisar 30% sampai 80% dari total persalinan.1,2
Di Amerika Serikat lebih dari 73 juta pasien telah menjalani operasi setiap tahunnya dan lebih dari 75% pasien tersebut masih mengalami nyeri pascaoperasi.Penelitian terbaru menunjukkan semakin banyak operasi termasuk operasi sesar maka semakin banyak nyeri yang muncul segera setelah melahirkan. Oleh karena itu jika nyeri tidak ditangani dengan baik maka dapat memicu timbulnya nyeri menetap pascaoperasi atau nyeri kronik yang berjumlah 1% sampai 3 % dan dapat memicu timbulnya depresi pascaoperasi.3,4
Untuk mengurangi nyeri pascabedah banyak cara yang telah dilakukan yaitu memilih teknik pembiusan serta penggunaan oat-obatan.
Pemilihan teknik pembiusan untuk operasi sesar dapat berpengaruh terhadap nyeri pascabedah. Anestesi spinal dinilai lebih mampu meningkatkan kualitas analgesia pascaoperasi dibandingkan dengan anestesi umum selain biaya yang lebih murah. Hal ini sejalan dengan penelitian yang dilakukan oleh Fabris L dkk (2009) dengan membandingkan anetesi spinal dengan umum pada 64 pasien. Dari hasil penelitian ini didiapati pasien bebas nyeri lebih lama pada anestesi spinal
versus anestesi umum (159±39 versus 119±44 menit) dengan p-value
<0,05.5
Ada beberapa golongan obat yang sering digunakan untuk mengatasi nyeri pascabedah seperti golongan nonopioid (parasetamol), NSAID, opioid lemah (kodein, tramadol), opioid kuat (morfin), dan adjuvan (ketamin dan klonidin).Analgesia setelah pembedahan dapat dicapai dengan menggunakan beragam opioid. Efektifitas pemakaian opioid (morfin) sebagai analgesia sudah lama dipercaya dapat meningkatkan kualitas analgesia pascabedah.6,7Morfin bekerja berikatan dengan reseptor opioid (mu, delta, kappa, sigma) di medula spinalis dan otak sehingga dapat menghambat proses terjadinya nyeri sehingga nyeri pascabedah dan kebutuhan analgetik pascaoperasi dapat dikurangi.
Manfaat morfinterlihat pada penelitian yang dilakukan oleh Klickan L (2001) pada 60 pasien yang dilakukan total abdominal histerektomi dengan anestesi umum. Dari hasil penelitian ini didapati morfin 0,15mg/kgBB/IV yang diberikan saat induksi atau penjahitan peritoneum dapat meningkatkan kualitas analgesia pascaoperasi.8
Ulugenc H dkk (2003) melakukan penelitian pada 90 pasien yang dilakukan operasi besar di abdomen dengan anestesi umum dan ditambah setiap grup diberikan tambahan morfin0,1 mg/kgBB/IV saat penjahitan peritonium. Sampel dibagi 3 grup, grup I (tramadol 1mg/kgBB/IV), grup II (morfin 0,1 mg/kgBB/IV) dan grup III (salin 0,9% IV) kesemua grup diberikan sebelum insisi dilakukan. Dari penelitian ini didapati pemberian opioid intravena sebelum insisi memberikan kualitas analgesia yang baik karena ketiga grup skor VRS (Verbal Rating Scale) berada di rentang nyeri ringan sampai sedang (VRS= 1-4,7).9
Penelitian yang dilakukan oleh Collis BR dkk (1995) pada 60 pasien yang menjalani abdominal histerektomi total dengan anestesi umum dibagi menjadi dua grup. Grup I diberikan 10 mg morfin IV saat induksi
3
anestesi umum dan penjahitan peritoneum dan grup II diberikan 20 mg morfin IV saat induksi anestesi umum. Didapati jumlah permintaan analgetik morfin pascaoperasi lebih tinggi pada grup I (43,1 mg) dibandingkan grup II (33,1 mg) tetapi secara statistik tidak bermakna dengan p-value 0.17 (bermakna p-value < 0,05). Tetapi VAS kedua grup dalam rentang 20 mm-40mm (ringan-sedang) sehingga dapat disimpulkan morfin dapat mengurangi nyeri pascaoperasi.10
Beberapa penelitian tentang morfin tadi menunjukkan secara jelas manfaat analgesianya tetapi tidak bisa dipungkiri bahwa efek analgesia morfin pascabedah sering dibatasi efek samping yang sering muncul dalam praktik klinis seperti depresi napas, sedasi, pruritus, mual, muntah.6,7Makin besar dosis yang digunakan tentunya kejadian efek samping akan lebih besar. Oleh karena efek samping ini, banyak para klinisi mencoba mencari alternatif obat lain yang efektivitas analgesianya baik tetapi efek sampingnya minimal.
Trauma jaringan yang terjadi selama pembedahan dapat mengubah jalur sentral persepsi nyeri. Terjadi perubahan sensitisasi sentral melalui peningkatan sensitivitas terhadap rangsang nyeri sehingga ambang rangsang nyeri akan menurun akibatnya nyeri akan semakin sulit untuk diatasi. Adanya nyeri akan memperlambat pemulihan atau memperpanjang waktu rawat inap. Salah satu penyebab munculnya sensitisasi sentral adalah aktivitas dari N-methyl-D-aspartat (NMDA).11
Sebenarnya satu-satunya cara untuk mencegah sensitisasi nosisepsi (nyeri) adalah benar-benar langsung memblokir sinyal nyeri yang berasal dari luka bedah dari waktu sayatan sampai akhir penyembuhan luka misalnya dengan continous wound infiltration. Tetapi cara ini dinilai tidak praktis, mahal dan rawan akan terjadinya infeksi.Saat ini ketamin sebagai antagonis reseptor non-kompetitif NMDA mulai mendapat perhatian besar karena obat ini memiliki peran mencegah
sensitisasi sentral akibat trauma selama operasi sehingga nyeri akan lebih mudah ditangani. Menurut beberapa ahli sebaiknya ketamin diberikan sebelum insisi (prainsisi) agar NMDA reseptor tidak aktif saat pembedahan dimulai sehingga sensitisasi sentral tidak terjadi.Efek pemberian ketamin diawal pembedahan sebenarnya masih kontroversi.
Beberapa peneliti melaporkan adanyaefek terhadap pemberian analgetik selanjutnya, namun peneliti lain tidak. Perbedaan ini mungkin disebabkan oleh variasi prosedur pembedahan, dosis dan waktu pemberian obat.12-14
Manfaat ketamin prainsisi mungkin dapat ditemukan pada penelitian Hassan AA (2006) yang melakukan penelitian dengan membandingkan efektivitas ketamin dosis 0,4 mg/kgBB/IV dan magnesium sulfatdosis 25 mg/kgBB/IV yang diberikan sebelum anestesi spinal pada pasien yang akan dilakukan operasi sesar. Dari penelitian ini didapati ketamin meningkatkan mula kerja anestesi lokal, durasi blok sensorik dan motorik serta memperlama waktu pemberian analgetik tambahan pertama dengan p-value <0,05 (secara statisktik bermakna).15
Behdad S dkk (2010) melakukan penelitian tentang manfaat ketamin dalam mengurangi nyeri pascaoperasi sesar sekaligus memperpanjang durasi analgesia pascaoperasi. Penelitian ini dilakukan pada 60 pasien dengan anestesi spinal dan dibagi menjadi dua grup (masing-masing 30 pasien) yaitu grup ketamindan midazolam. Grup ketamindan midazolam diberikan sesaat setelah anestesi spinal dilakukan.
Dari hasil penelitian dijumpai grup ketamin menurunkan skor VAS 1 jam pertama pascaoperasi dengan p = 0.00 (bermakna p-value <0,05). Serta ditemukan jumlah kebutuhan total pethidin yang lebih rendah dibandingkan dengan kontrol (54.17 ± 12.86 versus 74.44 ± 33.82 mg, p
= 0.02).16
Hasil yang bertolak belakang justru ditemukan pada penelitian yang dilakukan oleh Dahl V dkk (2000). Ia membandingkan ketamin dosis 0.4
5
mg/kgBB/IV sebelum sayatan dan ketamin dosis 0.4 mg/kgBB/IV sesudah sayatan pada pembedahan abdominal histerektomi. Dahl dkk (2000) menyimpulkan pemberian ketamin dosis 0.4 mg/kgBB/IV sebelum sayatan gagal memberikan efek analgesia.17
Hal yang sama juga ditemukan pada penelitian yang dilakukan oleh Nuno-N B dkk (2014) melihat manfaat ketamin yang diberikan sebelum insisi pembedahan kolon dengan anestesi umum. Ia memberikan ketamin 0,5 mg/kgBB/IV sebelum insisi. Dari hasil penelitian ini disebutkan bahwa ketamin yang diberikan sebelum insisi pembedahan ternyata tidak berbeda bermakna jika dibandingkan dengan plasebo dalam hal nyeri dan analgesia pascabedah dengan p-value >0,05.18
Metaanalisis oleh Ong dkk (2005) yang mencakup 66 RCT (3261 pasien) menyimpulkan bahwa pemberiaan antagonis NMDA (dan opioid) sistemik prainsisi tidak terbukti memberikan efek menguntungkan yang bermakna. Sementara itu tinjauan sistematik yang lain menyimpulkan bahwa dosis kecil ketamin merupakan adjuvan yang berguna untuk analgesia opioid (Subramaniam dkk 2004).19-21
Penggunaan ketamin dosis tunggal sebagai analgesia sebelum insisi tidak akan menghasilkan analgesia yang berlangsung lama hingga periode pascabedah, mengingat masa kerja ketamin yang singkat. Hasil negatif tersebut mungkin juga diakibatkan penggunaan ketamin dengan dosis yang lebih kecil sehingga obat akan lebih cepat habis. Penggunaan ketamin kontinu dinilai lebih baik untuk menjaga agar kadar obat tetap dalam keadaan dosis terapi. Tetapi penggunaan ketamin kontinu terbatas oleh ketersediaan alat seperti infuse pump atau syringe pump diruangan dan juga akan meningkatkan pembiayaan sewa alat dalam pengobatan.Untuk itu pemberian ketamin diakhir pembedahan atau intermitten bolus dapat menjadi pilihan dalam menurunkan tingkat nyeri pascaoperasi.
Ketamin dapat digunakan untuk penanganan nyeri berat pascaoperasi ketika morfin sulit ditemukandan digunakan dengan dosis 0,1-0,5 mg/kgBB/IV. Selalu menjadi keraguan dalam menggunakan ketamin adalah efek penurunan kesadaran dan halusinasi (efek psikomimetik). Efek ini akan berkurang jika menggunakan ketamin low dose (< 1 mg/kgBB/IV). Ditemukan 50% pasien yang menggunakan dosis 0,25 mg/kgBB/IV mengalami penurunan kesadaran. Efek ini akan muncul 20 menit setelah pemberian serta akan menghilang dalam waktu 90-180 menit.22,23
Dengan melihat manfaat ketamin dan morfin tadi maka penulis bermaksud meneliti perbandingan durasi analgesia ketamin dosis 0,5 mg/kgBB/IV dan morfin dosis 0,1 mg/kgBB/IV sebagai analgesia pascaoperasi pada pasien operasi bedah sesar dengan anestesi spinal menggunakan bupivakain 12,5 mg.
1.2. Rumusan Masalah
Apakah ada perbedaan durasi analgesiaantara ketamin dosis 0,5 mg/kgBB/IV dibandingkan dengan morfin dosis 0,1 mg/kgBB/IV sebagai analgesia pascaoperasi bedah sesar dengan anestesi spinal.
1.3. Hipotesa
Ada perbedaan durasi analgesia ketamin dosis 0,5 mg/kgBB/IV dibandingkan dengan morfin dosis 0,1 mg/kgBB/IV sebagai analgesia pascaoperasi bedah sesar dengan anestesi spinal.
1.4. Tujuan Penelitian 1.4.1. Tujuan Umum
Mengetahui perbandingan durasi analgesia ketamin dan morfin sebagai analgesia pascaoperasi pada pasien operasi sesar dengan anestesi spinal.
1.4.2. Tujuan Khusus
7
1. Untuk mengetahui durasi analgesiaketamin dosis 0,5 mg/kgBB/IV dan morfin dosis0,1 mg/kgBB/IVsebagai analgesia pascaoperasi pada pasien operasi sesar dengan anestesi spinal.
2. Untuk mengetahui seberapa banyak ketamin dosis 0,5 mg/kgBB/IV yang diberikan sebagai analgeticrescuepada pasien yang diberikan ketamin dosis 0,5 mg/kgBB/IV sebagai analgesia pascaoperasi pada pasien operasi sesar dengan anestesi spinal.
3. Untuk mengetahui seberapa banyak morfin dosis0,1 mg/kgBB/IVyang diberikan sebagai analgeticrescuepada pasien yang diberikan morfin dosis0,1 mg/kgBB/IVsebagai analgesia pascaoperasi pada pasien operasi sesar dengan anestesi spinal.
4. Untuk mengetahui efek samping ketamin dosis 0,5 mg/kgBB/IV dan morfin dosis0,1 mg/kgBB/IVsebagai analgesia pascaoperasi pada pasien operasi sesar dengan anestesi spinal.
1.5. Manfaat Penelitian 1.5.1. Manfaat Akademik
1. Sebagai sumber informasi dan bahan referensi bagi penelitian selanjutnya.
2. Hasil penelitian ini diharapkan dapat dipergunakan sebagai bahan acuan untuk meningkatkan pelayanan manajemen nyeri pascabedah.
3. Hasil penelitian ini diharapkan dapat menambah ilmu pengetahuan terutama ilmu anestesi.
1.5.2. Manfaat Pelayanan
1. Dari hasil penelitian ini diharapkan dapat memberikan kenyamanan pascabedah yang lebih baik.
2. Diharapkan dari hasil penelitian ini dapat mengurangi biaya operasional (cost benefit).
3. Diharapkan dari hasil penelitian ini dapat mengurangi efek samping (risk benefit).
1.5.3. Pengembangan Penelitian
1. Sebagai data untuk penelitian lanjutan dengan menggunakan dosis ketamin atau morfin yang berbeda.
2. Dapat dipakai sebagai pedoman penelitian untuk penanganan nyeri pascabedah.
BAB 2
TINJAUAN PUSTAKA
2.1. Definisi Nyeri
Pada tahun 1968, McCaffery mendefinisikan nyeri sebagai “whatever the experiencing person says it is, existing whenever she says it does”.
Defenisi ini menegaskan bahwa nyeri itu sangat subjektif dan tidak ada alat ukur objektif terhadap nyeri.Pada tahun 1979, International Association for the Study of Pain(IASP, 1979) mendefinisikan nyeri adalah pengalaman sensori dan emosi yang tidak menyenangkan yang berhubungan dengan kerusakan jaringan.Nyeri adalah pengalaman, sifatnya subjektif, penilaiannya tergantung apa yang dilaporkan pasien.
Sensasi nyeri adalah fenomena neurobiokimia yang melibatkan banyak zat-zat biokimia yang diwujudkan dalam bentuk neurotransmiter nyeri.
Neurotransmiter ini teraktivasi akibat rangsangan yang diterima oleh nosiseptor. Nosiseptor adalah reseptor sensorik khusus yang bertanggung jawab untuk rangsangan noxious (tidak menyenangkan) misalnya rasa sakit.24,25
2.2. Patofisologi Nyeri
Ada empat proses yang terlibat dalam nyeri yaitu transduksi, transmisi, modulasi dan persepsi. Transduksi adalah proses merubah sinyal nyeri dari mekanik, suhu, kimia menjadi suatu sinyal-sinyal listrik yang akan diterima diujung-ujung saraf. Kerusakan jaringan menyebabkan terlepasnya substansi kimiawi endogen seperti bradikinin, substansi P, serotonin, histamin, ion H, ion K, prostaglandin. Zat kimia ini terlepas ke dalam cairan ekstraseluler yang melingkupi nosiseptor.26,27
Kerusakan membran sel akan melepaskan senyawa fosfolipid yang mengandung asam arakhidonat dan terjadi aktivasi ujung nosiseptifaferen.
Asam arakhidonat atas pengaruh prostaglandin (PG) endoperoxide synthaseakan membentuk cyclic endoperoxide(PGG2 dan PGH2) dan akan membentuk mediator inflamasi sekaligus mediator nyeri seperti tromboksan (TXA2), prostaglandin (PGE2, PG2α), prostasiklin (PGI2).
Terbentuk pula leukotrien (LT) atas pengaruh 5-lipooksigenase. Setelah kerusakan jaringan, timbul mediator nyeri atau inflamasi berupa substansi P, PGs, LTs dan bradikinin.26
Sel mast juga aktif dan akan melepaskan histamin. Kombinasi senyawa ini menimbulkan vasodilatasi lokal dan peningkatan permeabilitas pembuluh darah lokal sehingga membantu gerakan cairan ekstravasasi ke dalam ruang interstisial jaringan yang rusak. Proses ini mengawali mekanisme respon inflamasi yang merupakan langkah pertama dalam proses pertahanan terhadap cedera jaringan dan reparasi luka.26
Pada akhirnya mediator juga mengaktifkan nosiseptor. PGs dan LTs tidak langsung diaktifkan melainkan mensensitisasi nosiseptor agar dapat dirangsang oleh senyawa lain seperti bradikinin, histamin sehingga terjadi hiperalgesia, yaitu respon stimuli yang meningkat, pada kondisi normal sudah menimbulkan sakit. Pelepasan mediator kimiawi terus menerus dapat menyebabkan stimulasi dan sensitisasi terus menerus pula sehingga terjadi hiperalgesia, allodinia dan proses ini berakhir sesudah terjadi proses penyembuhan.26
Selanjutnya lekotrien D4 (LTD4) mengaktifkan makrofag dan basofil yang akan menstimulus dan meningkatkan pelepasan eikosanoid, yaitu metabolit yang terlepas akibat terjadinya metabolisme asam arakhidonat.
Lekotrien D4 juga melepas substansi P dan secara tidak langsung bekerja pada neuron sensoris dengan menstimulus sel lain untuk melepaskan bahan neuron aktif. Leukosit Poli Morfo Nuklear (PMN) melepaskan leukotrien B4 (LTB4). Keduanya berperan dalam sensitisasi nosiseptor.
11
Pada inflamasi, sistem imun akan melepaskan sitokin proinflamasi:
interleukin IL1β, IL6, TNF, IFN. Sitokin ini dengan cepat akan berinteraksi dengan saraf perifer melalui mediator. IL1β berinteraksi dengan neuron sensoris, mengaktifkan eikosanoid dalam sel seperti fibroblas dan menyebabkan terlepasnya prostaglandin. Platelet dan sel mast melepaskan serotonin yang langsung mengaktifkan atau mensensitisasi nosiseptor dan menimbulkan hiperalgesia. Proses transduksi dapat dihambat oleh obat anti inflamasi non steroid atau non-steroid antiinflamatory drugs (AINS/NSAID).Transmisi adalah proses berikutnya dari transduksi berupa penyaluran sinyal-sinyal nyeri berupa sinyal listrik.
Dalam keadaan hiperalgesia intensitas impuls akan membesar yang kemudian ditransmisi oleh serabut aferen nosiseptif primer lewat radiks posterior menuju kornu posterior medula spinalis. Serabut perifer terdiri dari serabut sensoris, motorik somatik, motorik otonomik. Akson dari neuron primer bermielin atau tidak bermielin, dibungkus neurolema.
Terbagi atas serabut A,B,C. Serabut A terbagi menjadi Aα, Aβ, Aγ dan Aδ.
Akson berakhir pada kulit dan bangunan lain sebagai anyaman rapat, dekat ujung akhir saraf, bungkus perineural terbuka dan sel schwan menjadi ireguler.26
Serabut aferen primer nosispetif khusus menghantarkan impuls nosispetif, yang terdapat di kulit, periosteum, sendi, ligamen, otot, visera.
Serabut yang menyampaikan impuls nosiseptif hanya Aδ dan C, sehingga serabut tersebut tidak bermielin atau bermielin halus. Stimulus yang dapat direspon adalah mekanik, mekanotermal. Impuls di neuron aferen primer melewati radiks posterior masuk ke medula spinalis pada berbagai tingkat membentuk sel bodi dalam ganglia radiks posterior. Serabut ini membelah dua, mengirim banyak cabang kolateral. Serabut aferen primer berakhir pada lamina I, substansia gelaitnosa (lamina II, III), lamina V, lamina IV.26
Impuls ditransmisi ke neuron sekunder dan masuk ke traktus spinotalamikus lateralis. Kornu posterior berfungsi sebagai jalur masuk
decendens dari otak untuk melakukan modulasi impuls dari perifer. Impuls selanjutnya disalurkan ke daerah somatosensorik di korteks serebri dan diterjemahkan. Proses transmisi ini dapat dihambat oleh obat anestesi lokal.26
Modulasi adalah proses modifikasi terhadap rangsangan nyeri yang terjadi ditingkat medula spinalis. Modifikasi ini dapat terjadi pada sepanjang titik dari sejak transmisi pertama menuju korteks serebri.
Modifikasi dapat berupa augmentasi (peningkatan) ataupun inhibisi (penghambatan). Impuls setelah mencapai kornu posterior medula spinalis akan mengalami penyaringan intensitas yang bisa diperbesar atau dihambat. Sistem pengendali modulasi ini adalah sistem gerbang kendali spinal atau the gate control theory ofpain. Terdiri dari substansia gelatinosa sebagai penghambat sel transmisi T, serabut aferen diameter besar akan menutup gerbang, diameter kecil akan membuka gerbang.
Cabang serabut decendens dari otak ke substansia gelatinosa akan menambah hambatan sel transmisi T. Apabila impuls melebihi ambang sel T maka akan melewati sistem kendali gerbang spinal dan diteruskan ke pusat supraspinal di korteks somatosensoris. Impuls akan dipersepsi sebagai pengalaman nyeri. Substansi yang bekerja sebagai modulator nyeri di medulla spinalis yaitu dinorfin, enkefalin, noradrenalin, dopamin 5 HT2, GABA (Gama Amino Butiric Acid) akan menghambat nyeri.
Substansi yang meningkatkan nyeri yaitu substansi P, ATP (Adenosin Tripisphat), asam amino eksitatori.26,27
Persepsi adalah proses terakhir saat stimulasi tersebut mencapai korteks otak sehingga mencapai tingkat kesadaran dan pada akhirnya diterjemahkan dan ditindak lanjuti berupa tanggapan terhadap nyeri tersebut.Hasil akhir dari proses interaksi yang kompleks dari proses tranduksi, transmisi dan modulasi yang pada akhirnya akan menghasilkan suatu proses subjektif yang dikenal sebagai persepsi nyeri, yang diperkirakan terjadi pada thalamus dengan korteks sebagai diskriminasi
13
dari sensorik. Sel transmisi T didalam sistim gerbang spinal kendali nyeri menerima impuls sensoris yang datang dari perifer. Apabila impuls melebihi atau sama dengan ambang T, impuls nosiseptif tersebut dapat melewati sistem gerbang kendali dan diteruskan ke pusat-pusat supraspinal yang lebih tinggi di korteks somatosensoris, korteks transisional dan sebagainya. Semua impuls nyeri sensoris perifer serta sinyal kognitif pada korteks afeksi dan kognisi akan berintergrasi dan menimbulkan persepsi yang diterima sebagai pengalaman nyeri. Secara sederhana persepsi adalah hasil integrasi dari apa yang ada pada pusat kognisi, pusat afeksi dan sistem sensoris diskriminatif yang dirasakan oleh individu, serta bagaimana cara individu tersebut menghadapinya.26,27 2.3. Penilaian nyeri
Penilaian nyeri merupakan elemen yang penting untuk menentukan terapi nyeri pascapembedahan yang efektif. Skala penilaian nyeri dan keterangan pasien digunakan untuk menilai derajat nyeri. Intensitas nyeri harus dinilai sedini mungkin selama pasien dapat berkomunikasi dan menunjukkan ekspresi nyeri yang dirasakan.28 Ada beberapa skala penilaian nyeri:
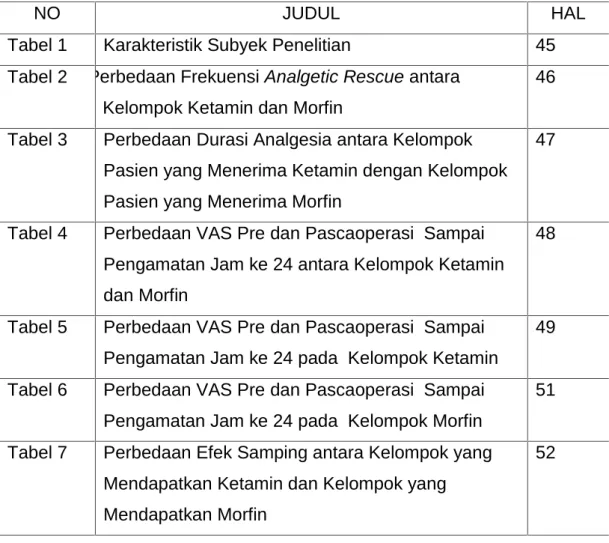
1. Wong-Baker Faces Pain Rating Scale28
Skala dengan enam gambar wajah dengan ekspresi yang berbeda, dimulai dari senyuman sampai menangis karena kesakitan. Skala ini berguna pada pasien dengan gangguan komunikasi, seperti anak- anak, orang tua, pasien yang kebingungan atau pada pasien yang tidak mengerti dengan bahasa lokal setempat.
Gambar 1.Wong Baker Faces Pain Rating Scale28
2. Verbal Rating Scale (VRS)28
Pasien ditanyakan tentang derajat nyeri yang dirasakan berdasarkan skala lima poin ; tidak nyeri, ringan, sedang, berat dan sangat berat.
Gambar 2.Verbal Rating Scale.28
3. Numerical Rating Scale (NRS)28
Pertama sekali dikemukakan oleh Downie dkk pada tahun 1978, dimana pasien ditanyakan tentang derajat nyeri yang dirasakan dengan menunjukkan angka 0 – 5 atau 0 – 10, dimana angka 0 menunjukkan tidak ada nyeri dan angka 5 atau 10 menunjukkan nyeri yang sedang sampai hebat.
Gambar 3.Numerical Rating Scale28
4. Visual Analogue Scale (VAS)28
Skala yang pertama sekali dikemukakan oleh Keele pada tahun 1948 yang merupakan skala dengan garis lurus 10 cm, dimana awal garis
15
(0) penanda tidak ada nyeri dan akhir garis (10) menandakan nyeri hebat.
Gambar 4.Visual Analogue Scale.28
Pasien diminta untuk membuat tanda digaris tersebut untuk mengekspresikan nyeri yang dirasakan. Penggunaan skala VAS lebih gampang, efisien dan lebih mudah dipahami oleh penderita dibandingkan dengan skala lainnya. Penggunaan VAS telah direkomendasikan oleh Coll dkk karena selain telah digunakan secara luas, VAS juga secara metodologis kualitasnya lebih baik, dimana juga penggunaannya mudah hanya menggunakan beberapa kata sehingga kosa kata tidak menjadi permasalahan. Willianson dkk juga melakukan kajian pustaka atas tiga skala ukur nyeri dan menarik kesimpulan bahwa VAS secara statistik paling baik dalam menilai derajat nyeri.
Nilai VAS antara 0 – 4 cm dianggap sebagai tingkat nyeri yang rendah dan digunakan sebagai target untuk tatalaksana analgesia.Nilai VAS >
4 dianggap nyeri sedang menuju berat sehingga pasien merasa tidak nyaman sehingga perlu diberikan obat analgetik penyelamat (analgetic rescue).
2.4. Klasifikasi Nyeri
Kejadian nyeri unik pada setiap individual kadang disertai dengan rasa takut, marah, kecemasan, depresi dan kelelahan dan sering mempengaruhi bagaimana nyeri itu dirasakan. Subjektivitas nyeri membuat sulitnya mengkategorikan nyeri dan mengerti mekanisme nyeri.
15
(0) penanda tidak ada nyeri dan akhir garis (10) menandakan nyeri hebat.
Gambar 4.Visual Analogue Scale.28
Pasien diminta untuk membuat tanda digaris tersebut untuk mengekspresikan nyeri yang dirasakan. Penggunaan skala VAS lebih gampang, efisien dan lebih mudah dipahami oleh penderita dibandingkan dengan skala lainnya. Penggunaan VAS telah direkomendasikan oleh Coll dkk karena selain telah digunakan secara luas, VAS juga secara metodologis kualitasnya lebih baik, dimana juga penggunaannya mudah hanya menggunakan beberapa kata sehingga kosa kata tidak menjadi permasalahan. Willianson dkk juga melakukan kajian pustaka atas tiga skala ukur nyeri dan menarik kesimpulan bahwa VAS secara statistik paling baik dalam menilai derajat nyeri.
Nilai VAS antara 0 – 4 cm dianggap sebagai tingkat nyeri yang rendah dan digunakan sebagai target untuk tatalaksana analgesia.Nilai VAS >
4 dianggap nyeri sedang menuju berat sehingga pasien merasa tidak nyaman sehingga perlu diberikan obat analgetik penyelamat (analgetic rescue).
2.4. Klasifikasi Nyeri
Kejadian nyeri unik pada setiap individual kadang disertai dengan rasa takut, marah, kecemasan, depresi dan kelelahan dan sering mempengaruhi bagaimana nyeri itu dirasakan. Subjektivitas nyeri membuat sulitnya mengkategorikan nyeri dan mengerti mekanisme nyeri.
15
(0) penanda tidak ada nyeri dan akhir garis (10) menandakan nyeri hebat.
Gambar 4.Visual Analogue Scale.28
Pasien diminta untuk membuat tanda digaris tersebut untuk mengekspresikan nyeri yang dirasakan. Penggunaan skala VAS lebih gampang, efisien dan lebih mudah dipahami oleh penderita dibandingkan dengan skala lainnya. Penggunaan VAS telah direkomendasikan oleh Coll dkk karena selain telah digunakan secara luas, VAS juga secara metodologis kualitasnya lebih baik, dimana juga penggunaannya mudah hanya menggunakan beberapa kata sehingga kosa kata tidak menjadi permasalahan. Willianson dkk juga melakukan kajian pustaka atas tiga skala ukur nyeri dan menarik kesimpulan bahwa VAS secara statistik paling baik dalam menilai derajat nyeri.
Nilai VAS antara 0 – 4 cm dianggap sebagai tingkat nyeri yang rendah dan digunakan sebagai target untuk tatalaksana analgesia.Nilai VAS >
4 dianggap nyeri sedang menuju berat sehingga pasien merasa tidak nyaman sehingga perlu diberikan obat analgetik penyelamat (analgetic rescue).
2.4. Klasifikasi Nyeri
Kejadian nyeri unik pada setiap individual kadang disertai dengan rasa takut, marah, kecemasan, depresi dan kelelahan dan sering mempengaruhi bagaimana nyeri itu dirasakan. Subjektivitas nyeri membuat sulitnya mengkategorikan nyeri dan mengerti mekanisme nyeri.
Salah satu pendekatan yaitu dengan mengklasifikasi nyeri berdasarkan durasi (akut, kronik), patofisiologi (nosiseptif, nyeri neuropatik) dan etiologi (pascapembedahan, kanker dan sebagainya).28
2.4.1. Nyeri Akut dan Kronik
Nyeri akut dihubungkan dengan kerusakan jaringan dan durasi yang terbatas. Nyeri akut ini dialami segera setelah pembedahan sampai 7 hari dan diakibatkan langsung adanya kerusakan jaringan misalnya pembedahan. Sedangkan nyeri kronik bisa dikategorikan sebagai malignan atau nonmalignan yang dialami pasien paling tidak 1 – 6 bulan.Nyeri kronik malignan biasanya disertai kelainan patologis dan indikasi adanya penyakit seperti kanker, end-stage organ dysfunction, infeksi HIV dan lain-lain. Nyeri kronik mungkin mempunyai elemen nosiseptif dan neuropatik. Nyeri kronik nonmalignan (nyeri punggung, migrain, artritis, diabetik neuropati) sering tidak disertai kondisi patologis yang terdeteksi dan perubahan neuroplastik yang terjadi pada lokasi sekitar (medulla spinalis) membuat pengobatan menjadi lebih sulit.Pasien dengan nyeri akut dapat memperlihatkan tanda dan gejala sistem saraf otonom (takikardi, tekanan darah yang meningkat, diaforesis, nafas cepat) pada saat nyeri muncul tetapi nyeri kronik bisa tanpa disertai adanya respon otonom.Nyeri kronik dapat berupa hiperalgesia dan allodinia yang pengobatan untuk nyeri ini sangat sulit sehingga, penanganan untuk nyeri akut harus baik agar dapat mencegah timbulnya nyeri kronik.27-29
2.4.2. Nosiseptif dan Nyeri Neuropatik
Nyeri organik bisa dibagi menjadi nosiseptif dan nyeri neuropatik. Nyeri nosiseptif adalah nyeri inflamasi yang dihasilkan oleh rangsangan kimia, mekanik dan suhu yang menyebabkan aktivasi maupun sensitisasi pada nosiseptor perifer (saraf yang bertanggung jawab terhadap rangsang nyeri).Nyeri neuropatik merupakan nyeri yang ditimbulkan akibat kerusakan jaringan saraf pada saraf perifer maupun pada sistem saraf pusat yang meliputi jalur saraf aferen sentral dan perifer dan biasanya
17
digambarkan dengan rasa terbakar dan menusuk.Dampak dari cedera serabut saraf adalah perubahan dalam fungsi saraf baik di lokasi cedera dan ataupun daerah sekitar cedera. Pasien yang mengalami nyeri neuropatik sering memberi respon yang kurang baik terhadap analgesik opioid.27-29
2.4.3. Nyeri Viseral
Nyeri viseral biasanya menjalar, lokalisasi yang difus dan mengarah ke daerah permukaan tubuh jauh dari tempat nyeri namun berasal dari dermatom yang sama dengan asal nyeri. Sering kali, nyeri viseral terjadi seperti kontraksi ritmis otot polos. Nyeri viseral seperti keram sering bersamaan dengan gastroenteritis, penyakit kantung empedu, obstruksi ureteral, menstruasi, dan distensi uterus pada tahap pertama persalinan.
Nyeri viseral, seperti nyeri somatik dalam, mencetuskan refleks kontraksi otot-otot lurik sekitar, yang membuat dinding perut tegang ketika proses inflamasi terjadi pada peritoneum.Nyeri viseral karena invasi malignan dari organ lunak dan keras sering digambarkan dengan nyeri difus, menggrogoti, atau keram jika organ lunak terkena dan nyeri tajam bila organ padat terkena (Ashburn dan Lipman, 1993).27-29
Penyebab nyeri viseral termasuk iskemia, peregangan ligamen, spasme otot polos, peregangan struktur lunak seperti kantung empedu, saluran empedu, atau ureter. Peregangan pada organ lunak terjadi nyeri karena peregangan jaringan dan mungkin iskemia karena kompresi pembuluh darah karena distensi berlebih dari jaringan.Impuls nyeri yang berasal dari sebagian besar abdomen dan toraks menjalar melalui serat aferen yang berjalan bersamaan dengan sistem saraf simpatis, dimana impuls dari esofagus, trakea dan faring melalui aferen vagus dan glossopharyngeal, impuls dari struktur yang lebih dalam pada pelvis dihantar melalui saraf parasimpatis di sakral. Impuls nyeri dari jantung menjalar dari sistem saraf simpatis ke bagian tengah ganglia cervical, ganglion stellate, dan bagian pertama dari empat dan lima ganglion
thorasik dari sistem simpatis. Impuls ini masuk ke korda spinalis melalui nervus thorak ke 2, 3, 4 dan 5. Penyebab impuls nyeri yang berasal dari jantung hampir semua berasal dari iskemia miokard. Parenkim otak, hati, dan alveoli paru adalah tanpa reseptor. Adapun, bronkus dan pleura parietal sangat sensitif pada nyeri.27-30
2.4.4. Nyeri Somatik
Nyeri somatik digambarkan dengan nyeri yang tajam, menusuk, mudah dilokalisasi dan rasa terbakar yang biasanya berasal dari kulit, jaringan subkutan, membran mukosa, otot skeletal, tendon, tulang dan peritoneum.
Nyeri insisi bedah, tahap kedua persalinan, atau iritasi peritoneal adalah nyeri somatik.Nyeri somatik biasanya lebih akut, intens, tajam, lokal, dan diperburuk oleh gerakan.27-30
2.5. Ketamin
Semenjak ditemukan adanya N-methyl-D-aspartate (NMDA) reseptor yang berperan dalam persepsinyeri, banyak para klinis khususya praktisi nyeri memulai penelitian baru terhadap ketamin yang saat ini digunakan sebagai multimodal analgesia dalam penanganan nyeri.31
2.5.1. Farmakologi Ketamin
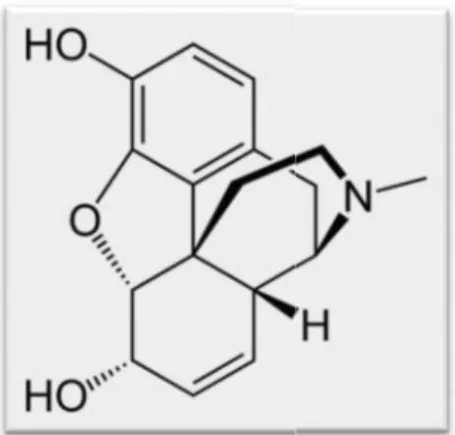
Ketamine,2-(o-chlorophenyl)-2 (methylamine)-cycloexanone pertama kali disintesis pada tahun 1963 dan pertama sekali digunakan pada manusia pada tahun 1965 oleh Corssen dan Domino.32
Gambar 5. Sruktur Bangun Ketamin34
Obat ini larut dalam lemak dengan berat molekul 238g/mol, pKa 7,5 dan digunakan dalam bentuk rasemik atau isomer levogyrous s(+) ketamine.Karena ketamin memiliki atom karbon asimteris sehingga ketamin memiliki 2 isomer yaitu S(+)-ketamin dan R(-)-ketamin. S(+)-
19
ketamin 3 sampai 4 kali lebih poten dari isomer R(-)-ketamin untuk penanganan nyeri, sedikit menimbulkan agitasi dari pada yang bentuk rasemik dan dextrogyrous tetapi sediaan R(-)-ketamin yang banyak diproduksidi Indonesia contohnya ketalar ® yang merupakan R(-)-ketamin.
S(+)-ketamin dua kali lebih poten dari rasemik dalam mencegah sensitisasi sentral.(S+)-ketamin diproduksi dalam bentuk ketanesth® yang banyak diproduksi di Jerman, Itali dan Belanda.26,33
Ketamin dapat diberikan melalui oral, intramuskular (IM), intravena (IV) bahkan saat ini berkembang penelitian ketamin epidural. Ketamin memiliki bioavaibilitas 93% dan waktu paruh sampai 186 menit. Volume distribusi besar diperkirakan mencapai 3L/kg. Plasma puncak setelah pemberian intravena terjadi dalam waktu 1 menit, intramuskular dalam waktu 5 menit dan pemberian secara oral dalam waktu 30 menit.Ketaminterdistribusi ke organ yang memiliki perfusi yang tinggi seperi otak dengan empat sampai lima kali dari kadar plasma dengan eliminasi obat melalui redistribusi obat dari organ yang perfusinya baik ke tempat yang kurang baik. Ketamin mengalami metabolisme konjugasi di hati melalui enzim sitokrom P 450.31,34,35
Ketamin memiliki waktu eliminasi 2-3 jam. Norketamin adalah hasil metabolit ketamin yang masih aktif tetapi, potensiasinya sepertiga sampai seperlima dari ketamin dan pada akhirnya metabolit tadi dikonjugasikan menjadi larut air sampai akhirnya diekskresikan melalui urin.Norketamin muncul 2-3 menit setelah pemberian ketamin.Menurut sumber lain menyebutkan bahwa norketamindapat bertahan hingga 5 jam setelah pemberian ketamin.Hal ini mungkin dapat menjelaskan bahwa waktu eliminasi yang panjang 2-3 jam. Dengan adanya norketaminmembuat efek analgesia ketamin dapat lebih panjang.Ketamin memiliki kelarutan lemak yang tinggi sehingga obat ini mudah melewati sawar darah otak. Ketamin memiliki ikatan dengan protein plasma 12% dan waktu paruh tercapai dalam 10 menit.35-37
2.5.2. Mekanisme Kerja Ketamin
Ketamin bekerja pada susunan saraf pusat (otak dan sumsum tulang berlakang) dan menurut beberapa penelitian ketamin memiliki aktivitas perifer. Ketamin bekerja pada reseptor NMDA (N-methyl-D-aspartate) pada bagian kutub kalsium. Aktivasi reseptor NMDA menyebabkan hambatan influx kalsium ekstraseluler ke intraseluler.Peran kalsium adalah sebagai second messanger untuk reaksi nyeri selanjutnya melalui pelepasan neurotransmitter nyeri yang lain.38,39
Blok pada NMDA reseptor adalah cara kerja utama dari ketamin di susunan saraf pusat dan medula spinalis. Sebagai tambahan bahwa ketamin juga menghambat pelepasan dari glutamat yang bertindak sebagai neurotransmitter eksitatori yang berperan sebagai neurotransmitter nyeri. Mekanisme yang lain ketamin berikatan dengan reseptor opioid yaitu mu dan kappa. Interaksi ini terjadi sangat kompleks.
Afinitas ketamin terhadap reseptor opioid ini 10 kali lebih lemah dari ikatannya terhadap reseptor NMDA dengan adanya bukti bahwa naloxon yang merupakan antagonis opioid tidak mengantagonis efek analgetik dari ketamin. Ada bukti juga bahwa reseptor seperti monoaminergik, muskarinik dan nikotinik menjadi tempat ikatan ketamin sekaligus ketamin menimbulkan efek takikardi dan bronkodilator.29,34,35
2.5.3. Efek Ketamin pada Fungsi Organ
Ketamin memiliki kombinasi unik terhadap fungsi kardiovaskular, seperti takikardi, peningkatan tekanan darah, dan cardiac output. Mekanisme yang tepat munculnya respon simpatik masih belum diketahui. Namun, dengan tidak adanya kontrol otonom, ketamin memiliki efek depresi otot jantung secara lansung, yang biasanya diganti oleh respon sentral. Hal ini dimungkinkan untuk mengurangi efek yang tidak diinginkan dari kardiovaskular dengan memberikan ketamin sebagai infus berkala dan bersama benzodiazepin.34
21
Ketamin memiliki efek minimal pada pusat pernapasan, meskipun penurunan sementara ventilasi dapat terjadi setelah pemberian bolus intravena. Ketamin menyebabkan relaksasi otot polos bronkus, sehingga memiliki peran khusus pada pasien asma. Ketamin meningkatkan sekresi saliva, yang dapat menghasilkan potensial masalah pada anak-anak yang dapat menyebabkan obstruksi jalan nafas atas. Meskipun refleks menelan, batuk, bersin, dan refleks muntah relatif utuh dengan ketamin, tetapi aspirasi dapat terjadi selama pasien terbius dengan ketamin.Sering dilaporkan adanya bunyi nyaring pada penggunaan ketamin yang disangkakan laringospasme. Hal ini sebenarnya terjadi karena posisi saluran napas yang tidak bebas, dan masalah tersebut dapat dikelola hanya dengan reposisi kepala pasien. Laringospasme dapat terjadi pada penggunaan ketamin yang disebabkan oleh stimulasi dari pita suara oleh instrumentasi atau sekresi. Sekret dapat dikurangi dengan memberikan premedikasi glikopirolat.34
Emergence reaction merupakansensasi psikis setelah penggunaan ketamin yaitu sensasi mengambang, mimpi atau ilusi dan sesekali delirium. Mimpi-mimpi dan ilusi biasanya menghilang pada saat pulih.
Namun penting untuk mendiskusikan dengan pasien efek dari ketamin tersebut dan efek ini muncul 5-30 % dari penggunaan ketamin.Emergence reaction lebih tinggi terkait dengan faktor-faktor seperti meningkatnya usia, perempuan, pasien yang biasanya bermimpi, pemberian intravena yang cepat dan dosis besar.Ketamin telah diamati dapat mengaktifkan psikosis pada pasien dengan skizofrenia. Namun, belum terlihat adanya reaksi psikotik jangka panjang pada pasien tanpa penyakit kejiwaan yang dikenal.Premedikasi dapat diberikan untuk mengurangi emergence reactionseperti midazolam (0,07-0,1 mg kg/BB), diazepam ( 0,15 - 0,3 kg/BB ), danlorazepam ( 2-4 mg) intravena yang telah terbukti efektif.
Insiden ini juga menurun bila digunakan bersama dengan obat sedasi hipnotik yang lain dan anestesi umum.34
Ketamin menghasilkan apa yang disebut 'disosiatif' anestesia yang telah digambarkan sebagai disosiasi fungsional dan elektrofisiologi antara sistem thalamo-neokorteks dan limbik. EEG menunjukkan aktivitas theta yang dominan dengan penghapusan irama alfa. Keadaan klinis yang unik yang dihasilkan oleh ketamin adalah biasanya keadaan ayan dimana mata tetap terbuka dengan memperlambat tatapan nistagmus, sedangkan refleks kornea dan cahaya tetap utuh. Berbagai tingkat hipertonus dan sesekali gerakan yang tidak terkait dengan stimulus yang menyakitkan dapat muncul. Ketamin tidak akan mungkin dapat menyebabkan kejang pada pasien dengan gangguan kejang oleh karena data eksperimen menunjukkan bahwa ketamin memiliki antikejang dan bahkan memiliki efek pelindung saraf.34
Analgesia terjadi pada konsentrasi darah lebih rendah daripada induksi. Hal ini berlaku untuk ketamin yang rasemik dan untuk S-(+)- ketamin. Ketamin meningkatkan metabolisme otak, aliran darah otak, dan tekanan intrakranial. Pengaruh S-(+)- ketamin pada tekanan intrakranial belum diketahui. Ketamin belum terbukti memiliki efek buruk pada hati dan sistem ginjal.Tekanan intraokular sedikit meningkat setelah pemberian ketamin. Ketamin menghasilkan peningkatan tonus otot dan kadang- kadang kejang otot, meskipun telah digunakan dengan aman pada miopati dan hipertermia ganas. Efek dijumpai bervariasi pada kontraksi uterus serta emesis, ruam sementara, dan agitasi.34
2.5.4. Penggunaan Klinis Ketamin
Campuran rasemik komersial ketamin adalah campuran R-(-)- dan S-(+)- isomer tersedia sebagai 10, 50, dan 100 mg/ml dengan pengawet, benzathonium hidroklorida. Isomer optik S-(+)-ketamin tersedia dalam 5 dan 25 mg/ml (tidak berlisensi di Inggris, saat ini). Ketamindapat diberikan intravena, intramuskular, oral, rektal, dan sediaan bebas pengawet untuk epidural. Dosis tergantung pada rute pemberian dan efek terapi yang diinginkan. Benzodiazepin dapat diberikan baik secara oral (diazepam 10-
23
30 mg, lorazepam 2-5 mg) 60-90 menit sebelum induksi atau intravena dengan dosis yang lebih kecil yang diberikan segera sebelum induksi.
Dosis induksi anestesi ketamin yaitu 0.5–1.5 mg/kgBB/IV atau 4–10 mg/kgBB/IM. Dosis pemeliharaan untuk anestesi 10-30 uq/kgBB/menit/IV.
Sedasi analgesia 0.2–0.75 mg kg/BB/IV atau 2–4 mg/kgBB/IM diikuti infus berkala 5–20 ug kgBB/IV/menit.34
Ketamin dapat digunakan untuk sedasi sekaligus analgesia pada prosedur-prosedur singkat. Munculnya reaksi pada anak-anak yang kurang intens, sehingga dapat digunakan untuk obat penenang dan anestesi umum dalam prosedur seperti kateterisasi jantung, radioterapi, radiologi investigasi, dan luka bakar. Ketamin dapat digunakan sebagai suplemen (IV atau IM) selama anestesi regional. Hal ini juga dapat diberikan melalui rute epidural sebagai tambahan untuk anestesi lokal dalam memperpanjang durasi analgesia. Dosis rendah ketamin juga telah digunakan bersama dengan propofol untuk meningkatkan kualitas sedasi.
Dosis rendah ketamin didefinisikan sebagai dosis ketamin yang diberikan kurang dari atau sama dengan 2 mg/kgBB/IM atau kurang dari 1 mg/kgBB/IV. Dosis rendah ini sering digunakan untuk suplementasi anestesi yang lain. Sumber lain menyebutkan bahwa analgesia ketamin dapat dicapai dalam dosis 0,2-0,5mg/kgBB/IV.Ditemukan 50% pasien yang menggunakan dosis 0,25 mg/kgBB/IV mengalami penurunan kesadaran. Efek ini akan muncul 20 menit setelah pemberian serta akan menghilang dalam waktu 90-180 menit.Efek anestesi ketamin sebagai NMDA antagonis mencegah sensitisasi sentral terhadap rangsangan yang menyakitkan. Ketamin adalah satu-satunya NMDA antagonis dan penelitian telah menunjukkan bahwa dosis kecil ketamin dapat megurangi kebutuhan analgetik opioid.22,23,34
Ketamin telah banyak digunakan pada luka bakar untuk pembiusan terutama untuk debridemen dan prosedur pencangkokan kulit pada anak- anak dan orang dewasa. Namun hati-hati dengan reaksi intoleran pada
pasien dengan penggunaan ketamin berulang. Pasien dengan gangguan kardiorespirasi (kecuali penyakit jantung iskemik) merupakan kandidat utama untuk diberikan ketamin.Pengalaman yang luas dengan ketamin pada anak dengan katerisasi jantung telah menunjukkan efektifitas penggunaan ketamin dengan kejadian aritmia yang kurang dari anestesi umum lainnya.34
Ketamin mungkin berbahaya pada pasien dengan peningkatan tahanan diventrikel kanan. Pada pasien dengan penyakit saluran napas reaktif, ketamin (rasemik) dapat berguna karena memiliki efek bronkodilator dan analgesia mendalam yang memungkinkan peningkatan oksigen inspirasi. Ketamin jika dikombinasikan dengan benzodiazepin atau benzodiazepin dengan opioid, menurunkan takikardia yang tidak diinginkan, hipertensi dan juga reaksi psikomimetik pascaoperasi.Teknik ini menghasilkan gangguan hemodinamik minimal, analgesia yang mendalam, amnesia dan pemulihan yang baik.34
Ketamin bebas pengawet telah ditambahkan ke bupivakain untuk meningkatkan durasi analgesia, tanpa mempengaruhi intensitas analgesik.Minat penggunaan ketamin tumbuh pesat dan dalam survei terbaru, 32% dari anestesi pediatrik Inggris melaporkan penggunaan ketamin epidural.34,36
Secara historis, telah diyakini bahwa ketamin merupakan kontraindikasi pada pasien dengan peningkatan tekanan intrakranial, namun adanya laporan tentang efek neuroregeneratif telah dihasilkan dari penelitian ini. Ketamin dapat mencegah influks ion kalsium abnormal atau glutamat melalui interaksi dengan reseptor NMDA. Peningkatan aliran darah otak setelah pemberian ketamin kurang dari peningkatan CMRO2 (cerebral metabolic rate). S-(+)- ketamin mempertahankan metabolisme serebral pada sebagian besar wilayah otak.34
25
Meskipun ketamin memiliki sedikit efek pada endotel pembuluh darah, penelitian telah menunjukkan penurunan yang signifikan dalam aktivasi leukosit selama hipoksemia atau sepsis. Ketamin menekan produksi sitokin pro-inflamasi dalam darah seluruh manusia secara in vitro. Dalam sebuah studi tentang efek isomer berbeda pada hati babi, S- (+)- ketamin efektif dalam mengurangi perlengketan neutrofil, sedangkan R-(-)- ketamin memiliki efek negatif yaitu memperburuk kebocoran dari pembuluh darah koroner sekitar jaringan.34
2.6. Morfin
Morfinditemukan sebagai alkaloid aktif pertama diekstrak dari tanaman poppy opiumdan pada 1805, morfin pertama kali diisolasi dari opium oleh FWA apoteker Jerman Serturner, yang bernama obat “morphium” dari Morpheus, Dewa Mimpi Yunani. Penggunaanmorfinpertama sekali pada PerangSaudara Amerikadan diyakini menjadiawalkecanduanopiatluas untukinjeksi.Kecanduan morfindisebut “penyakit tentara”karena lebih dari400.000tentara yang terlukadikirim pulangdengan morfinuntukmenghilangkan rasa sakit.40
2.6.1. FarmakologiMorfin
Morfin terdiri dari cincin benzenadengan kelompokhidroksil fenolikpada posisi3 dankelompokalkoholhidroksilpada posisi6 danpadaatom nitrogen. Kedua kelompokhidroksildapat dikonversi menjadieteratau ester. Sebagai contoh,kodeinadalahmorfinyangO-alkohol
pada posisi3,
sementaraheroinadalahmorfinO-asetat pada posisi 3dan 6(morphine diacetyl).
Gambar 6. Struktur Bangun Morfin
25
Meskipun ketamin memiliki sedikit efek pada endotel pembuluh darah, penelitian telah menunjukkan penurunan yang signifikan dalam aktivasi leukosit selama hipoksemia atau sepsis. Ketamin menekan produksi sitokin pro-inflamasi dalam darah seluruh manusia secara in vitro. Dalam sebuah studi tentang efek isomer berbeda pada hati babi, S- (+)- ketamin efektif dalam mengurangi perlengketan neutrofil, sedangkan R-(-)- ketamin memiliki efek negatif yaitu memperburuk kebocoran dari pembuluh darah koroner sekitar jaringan.34
2.6. Morfin
Morfinditemukan sebagai alkaloid aktif pertama diekstrak dari tanaman poppy opiumdan pada 1805, morfin pertama kali diisolasi dari opium oleh FWA apoteker Jerman Serturner, yang bernama obat “morphium” dari Morpheus, Dewa Mimpi Yunani. Penggunaanmorfinpertama sekali pada PerangSaudara Amerikadan diyakini menjadiawalkecanduanopiatluas untukinjeksi.Kecanduan morfindisebut “penyakit tentara”karena lebih dari400.000tentara yang terlukadikirim pulangdengan morfinuntukmenghilangkan rasa sakit.40
2.6.1. FarmakologiMorfin
Morfin terdiri dari cincin benzenadengan kelompokhidroksil fenolikpada posisi3 dankelompokalkoholhidroksilpada posisi6 danpadaatom nitrogen. Kedua kelompokhidroksildapat dikonversi menjadieteratau ester. Sebagai contoh,kodeinadalahmorfinyangO-alkohol
pada posisi3,
sementaraheroinadalahmorfinO-asetat pada posisi 3dan 6(morphine diacetyl).
Gambar 6. Struktur Bangun Morfin
25
Meskipun ketamin memiliki sedikit efek pada endotel pembuluh darah, penelitian telah menunjukkan penurunan yang signifikan dalam aktivasi leukosit selama hipoksemia atau sepsis. Ketamin menekan produksi sitokin pro-inflamasi dalam darah seluruh manusia secara in vitro. Dalam sebuah studi tentang efek isomer berbeda pada hati babi, S- (+)- ketamin efektif dalam mengurangi perlengketan neutrofil, sedangkan R-(-)- ketamin memiliki efek negatif yaitu memperburuk kebocoran dari pembuluh darah koroner sekitar jaringan.34
2.6. Morfin
Morfinditemukan sebagai alkaloid aktif pertama diekstrak dari tanaman poppy opiumdan pada 1805, morfin pertama kali diisolasi dari opium oleh FWA apoteker Jerman Serturner, yang bernama obat “morphium” dari Morpheus, Dewa Mimpi Yunani. Penggunaanmorfinpertama sekali pada PerangSaudara Amerikadan diyakini menjadiawalkecanduanopiatluas untukinjeksi.Kecanduan morfindisebut “penyakit tentara”karena lebih dari400.000tentara yang terlukadikirim pulangdengan morfinuntukmenghilangkan rasa sakit.40
2.6.1. FarmakologiMorfin
Morfin terdiri dari cincin benzenadengan kelompokhidroksil fenolikpada posisi3 dankelompokalkoholhidroksilpada posisi6 danpadaatom nitrogen. Kedua kelompokhidroksildapat dikonversi menjadieteratau ester. Sebagai contoh,kodeinadalahmorfinyangO-alkohol
pada posisi3,
sementaraheroinadalahmorfinO-asetat pada posisi 3dan 6(morphine diacetyl).
Gambar 6. Struktur Bangun Morfin
Bentuktersiernitrogentampaknyapenting
untukanalgesiadarimorfin;membuatnitrogenkuartenersangatmengurangian algesia,karena tidak dapatmasuk ke dalamsistim saraf
pusat.Perubahangugus metilpadanitrogenakan
menurunkananalgesiajuga,menciptakanantagonissepertinalorphine.
27,33,36
Secara farmakologis morfin memiliki kelarutan dalam lemak yang rendah. Morfin memiliki pKa (8.0) yang lebih tinggi dari pKa tubuh. Hanya 10% sampai 20% dari morfin dalam bentuk tidak terionisasi. Distribusi dan penetrasi morfin kedalam dan keluar otak diperkirakan lebih lambat dari opioid lainnya. Diperkirakan hanya 20% sampai 40% terikat pada albumin dengan waktu 5-20 menit dan kadar puncak tercapai dalam waktu 20 menit sampai 60 menit setelah suntikan. Setelahpemberian oral, hanya sekitar 40sampai50 persendari dosismencapaisistem saraf pusat.27,33,36
Hepatic extraction ratiomorphinecukup tinggi, maka bioavaibilitas morfin yang diberikan secara oral sangat rendah (20% sampai 30%) dibandingkanpemberian intramuskular atau subkutan. Morfin dimetabolisme melalui proses konjugasi di hati tetapi ginjal memiliki peran yang utama dalam metabolisme dan ekskresi morfin. Di hati morfindimetabolisme melalui prosesdemetilasidanglukuronidasi;
glukoronidasiadalahmetabolismemorfin, menghasilkan Morphine 6- glucuronide(M6G) dan Morphine 3-glucuronide(M3G) dalamrasio6:1.
Glukuronidasiterjadisegera setelahmorfin memasukiserumbaikdi hati
dandiluar hati. M3Gdalam konsentrasi cukup
tinggidiyakiniberpotensimenyebabkanhiperalgesia.
DemetilasimelaluiCYP3A4danCYP2C8menghasilkannormorfin.Ferr aridkkmenemukan bahwa hanya8dari 12 pasienpadanormorfinyang diproduksi.Morphine 3-glucuronide (M3G) adalah metabolit utama dari morfin, tetapi tidak terikat pda opioid reseptor dan tidak memiliki aktivitas analgetik. M3G mungkin dapat bertindak sebagai antagonisasi dari efek morfindan hal ini mungkin bisa menerangkan perannya dalam