1
LEBIH TINGGI PADA KARSINOMA ADENUM ASINUS PROSTAT DERAJAT TINGGI
DIBANDINGKAN DENGAN DERAJAT RENDAH
NI MADE MAHASTUTI
PROGRAM PASCASARJANA UNIVERSITAS UDAYANA
DENPASAR
2015
i
LEBIH TINGGI PADA KARSINOMA ADENUM ASINUS PROSTAT DERAJAT TINGGI
DIBANDINGKAN DENGAN DERAJAT RENDAH
NI MADE MAHASTUTI NIM 1114098201
PROGRAM MAGISTER PROGRAM STUDI ILMU BIOMEDIK
PROGRAM PASCASARJANA UNIVERSITAS UDAYANA
DENPASAR
2015
ii
DENGAN DERAJAT RENDAH
Tesis untuk Memperoleh Gelar Magister pada Program Magister, Program Studi Ilmu Biomedik
Program Pascasarjana Universitas Udayana
NI MADE MAHASTUTI NIM 1114098201
PROGRAM MAGISTER
PROGRAM STUDI ILMU BIOMEDIK PROGRAM PASCASARJANA
UNIVERSITAS UDAYANA DENPASAR
2015
iii
Pembimbing I, Pembimbing II,
dr. AAAN. Susraini, Sp.PA (K) dr. Herman Saputra, Sp.PA (K)
NIP. 195903131989012001 NIP. 197303112002121002
Mengetahui
Ketua Program Studi
Pendidikan Dokter Spesialis-1 Patologi Anatomi FK Universitas Udayana/RSUP Sanglah Denpasar
Dr. dr. I Gusti Ayu Sri Mahendra Dewi, Sp.PA (K) NIP. 196502011996012001
iv
pada 5 Agustus 2015
Panitia Penguji Tesis Berdasarkan SK Rektor Universitas Udayana, Nomor 1969/UN 14.4/HK/2015, tanggal 1 Juli 2015
Ketua : dr. AAAN. Susraini, SpPA (K)
Anggota :
1. dr. Herman Saputra, Sp.PA (K)
2. Dr. dr. I Gusti Ayu Sri Mahendra Dewi, Sp.PA (K) 3. dr. I Ketut Mulyadi, Sp.PA (K)
4. Prof. dr. N. Tigeh Suryadhi, MPH, PhD
vi
kepada Tuhan Yang Maha Esa atas semua berkat, rahmat dan anugerahNya sehingga penulis dapat menyelesaikan tesis ini. Penulis sangat menyadari bahwa penulis tidak mungkin dapat menyelesaikan tesis ini tanpa bantuan banyak pihak. Pada kesempatan ini, perkenankanlah penulis menghaturkan rasa terima kasih yang sebesar-besarnya dan penghargaan kepada dr. AAAN. Susraini, Sp.PA (K) selaku pembimbing I dan Kepala Bagian/SMF Patologi Anatomi Fakultas Kedokteran Universitas Udayana/RSUP Sanglah Denpasar Periode 2014-2018, dr. Herman Saputra, Sp.PA (K) selaku pembimbing II dan dosen pengajar Program Studi Ilmu Patologi Anatomi Fakultas Kedokteran Universitas Udayana yang telah memberikan bimbingan, masukan dan pengarahan dan koreksi selama menjalani pendidikan spesialisasi maupun dalam penyelesaian tesis ini. Penulis juga menyampaikan rasa terima kasih yang tidak terhingga dan penghargaan kepada Dr. dr. I Gusti Ayu Sri Mahendra Dewi, SpPA (K) sebagai Ketua Program Studi Ilmu Patologi Anatomi Fakultas Kedokteran Universitas Udayana periode 2014-2018 sekaligus tim penguji yang telah memberikan kesempatan mengikuti program pendidikan spesialisasi, memberikan bimbingan, masukan dan pengarahan selama menjalani pendidikan spesialisasi maupun dalam penyelesaian tesis ini. Ucapan terima kasih juga penulis sampaikan untuk dr. I Ketut
vii
memberikan bimbingan, dorongan, semangat, masukan, saran dan koreksi dari awal pendidikan hingga selesainya tesis ini. Selain itu penulis juga menyampaikan rasa terima kasih kepada :
1. Rektor Universitas Udayana, Prof. Dr. dr. Ketut Suastika, SpPD-KEMD, FINASIM dan Dekan Fakultas Kedokteran Universitas Udayana, Prof. Dr.
dr. Putu Astawa, Sp.OT (K), M.Kes yang memberikan kesempatan dan fasilitas untuk mengikuti dan menyelesaikan Program Magister Pascasarjana dan Program Pendidikan Dokter Spesialis I di Universitas Udayana.
2. Direktur Program Pascasarjana Universitas Udayana, Prof. Dr. dr. A. A.
Raka Sudewi, Sp.S (K), atas kesempatan dan fasilitas yang diberikan untuk menjadi mahasiswa Program Pascasarjana Universitas Udayana.
3. Dr. dr. Gde Ngurah Indraguna Pinatih, MSc,Sp.GK selaku Ketua Program Studi Ilmu Biomedik (Combined Degree) Program Pascasarjana Universitas Udayana yang telah memberikan kesempatan mengikuti program pendidikan Combined Degree.
4. Direktur RSUP Sanglah Denpasar, dr. Anak Ayu Saraswati, M.Kes atas kesempatan dan fasilitas yang diberikan untuk melanjutkan pendidikan di Bagian Ilmu Patologi Anatomi dan melakukan penelitian di RSUP Sanglah Denpasar.
viii
2009-2014 yang telah memberikan kesempatan mengikuti program pendidikan spesialisasi, memberikan petunjuk, nasehat serta dukungan yang luar biasa selama menjalani pendidikan spesialisasi.
6. dr. Luh Putu Iin Indrayani Maker, Sp.PA(K) selaku Kepala Instalasi Laboratorium Patologi Anatomi Rumah Sakit Sanglah Denpasar, yang telah memberikan kesempatan mengikuti program pendidikan spesialisasi, memberikan bimbingan, petunjuk, nasehat selama menjalani pendidikan spesialisasi dan memberikan fasilitas dan ijin kepada penulis untuk melakukan penelitian ini.
7. dr. Ni Wayan Winarti, Sp.PA, sebagai Kepala Bagian/SMF Patologi Anatomi Fakultas Kedokteran Universitas Udayana/RSUP Sanglah Denpasar periode 2009-2014 yang telah memberikan kesempatan mengikuti program pendidikan spesialisasi dan memberikan bimbingan selama menjalani pendidikan spesialisasi.
8. Seluruh staf dosen/pengajar di Bagian/SMF Patologi Anatomi Fakultas Kedokteran Universitas Udayana/RSUP Sanglah dan seluruh dosen Pascasarjana Program Magister Ilmu Biomedik Combined Degree, yang telah membimbing, memberikan masukan, nasehat, petunjuk dan bekal pendidikan dari awal pendidikan hingga terselesaikannya tesis ini.
ix
saran serta dorongan semangat selama penulis menyelesaikan tesis ini.
10. Drs. I Ketut Tunas, Msi, yang telah membantu dan memberi masukan saran dalam pengolahan data dan statistik mulai dari awal hingga akhir penulisan tesis ini.
11. Seluruh rekan-rekan sejawat residen dan senior residen Patologi Anatomi Universitas Udayana atas bantuan, bimbingan dan kerjasamanya selama ini serta kepada seluruh staf karyawan di Bagian/SMF Patologi Anatomi FK Unud/RSUP Sanglah Denpasar atas bantuan dan kerjasamanya selama ini.
Penulis memohon maaf yang sebesar-besarnya apabila selama menjalankan pendidikan spesialisasi dan selama proses penyelesaian tesis ini penulis banyak membuat kesalahan yang membuat pembimbing, tim penguji dan seluruh staf dosen merasa tidak nyaman.
Ungkapan terima kasih yang sebesar besarnya penulis sampaikan kepada suami tercinta drg. Gd Indra Sucipta Maker, SpProst serta anak-anakku tercinta Putu Shintadewi Indrastuti dan Made Satyadharma Indraswara atas pengertian dan dukungannya selama penulis mengikuti pendidikan spesialisasi ini.
Terimakasih yang besar juga penulis sampaikan kepada orang tua Drs . I Ketut
Medan dan ibu Wayan Karniadi, SE serta dr. Made Maker, SpF dan dr. Moestikaningsih, SpPA(K) , begitupula seluruh keluarga besar atas doa serta
dukungan dan dorongan semangatnya. Kakak dan adik tercinta Ni Putu Maharani
x
Semoga Ida Sanghyang Widhi Wasa/Tuhan Yang Maha Esa selalu melimpahkan rahmatnya kepada kita semua.
Denpasar, Agustus 2015 Penulis
xi
Agresivitas karsinoma adenum asinus prostat salah satunya ditentukan oleh peningkatan derajat diferensiasi yang dinilai berdasarkan skor Gleason.
Peningkatan agresivitas ini diiringi oleh peningkatan kemampuan invasi dan metastasis yang merupakan salah satu penyebab kematian karena kanker. Matriks metalloproteinase-9 merupakan salah satu enzim proteolitik yang terlibat pada proses invasi dan metastasis karsinoma prostat. Beberapa penelitian yang menghubungkan MMP-9 dengan agresivitas karsinoma prostat yang dinilai berdasarkan skor Gleason tampaknya masih menunjukkan ketidaksesuaian hasil.
Tujuan penelitian ini adalah untuk membuktikan bahwa ekspresi matriks metalloproteinase-9 lebih tinggi pada adenokarsinoma tipe asinus derajat tinggi dibandingkan dengan derajat rendah pada prostat.
Penelitian ini menggunakan metode analitik potong lintang. Sampel penelitian adalah sediaan blok parafin dari penderita karsinoma adenum prostat derajat tinggi dan derajat rendah yang diperiksa secara histopatologi di Bagian/SMF Patologi Anatomi FK UNUD/RSUP Sanglah dan Laboratorium Patologi Anatomi RS Prima Medika di Denpasar dari tanggal 1 Januari 2012 sampai dengan 31 Desember 2014. Dilakukan pulasan imunohistokimia MMP-9 pada masing-masing 18 sampel karsinoma adenum prostat derajat tinggi dan rendah yang memenuhi kriteria inklusi dan eksklusi. Hasil penelitian dianalisis dengan uji Mann-Whitney dengan kemaknaan α=0,05.
Ekspresi MMP-9 pada kelompok derajat tinggi lebih tinggi dibandingkan derajat rendah (U=13,5 dan p= 0,001) dengan median ekspresi MMP-9 kelompok derajat tinggi adalah 7,5 (6,0-9,0) dan derajat rendah adalah 4,0 (2,0-6,0).
Distribusi kasus karsinoma adenum asinus prostat menunjukkan jumlah kasus terbanyak berada pada kelompok umur 60-69 tahun (55,55%).
Pemeriksaan ekspresi MMP-9 penting dilakukan untuk menentukan tingkat agresivitas tumor yang didasarkan pada derajat diferensasi tumor sehingga dapat direncanakan terapi yang lebih efektif.
Kata kunci: karsinoma adenum asinus prostat, derajat tinggi, derajat rendah, ekspresi MMP-9.
xii
The aggressiveness of acinar adenocarcinoma prostate determined by an increase in the degree of differentiation assessed by Gleason score. Increased aggressiveness is accompanied by an increase in the ability of invasion and metastasis, which is one cause of cancer death. MMP-9 is one of the proteolytic enzymes involved in the process of invasion and metastize of prostate carcinoma.Some studies linking MMP-9 with aggressiveness of acinar adenocarcinoma prostate that based on Gleason score still show conflicting result.
This study aimed to prove that the expression of MMP-9 in high grade was higher compared with low grade acinar adenocarcinoma of prostate.
This study was performed using a cross sectional analytical method.
Samples of this study were parafin blocks supply gathered from high grade and low grade acinar adenocarcinoma prostate that had been studied histophatologically at Pathology Anatomy Department Udayana University/
RSUP Sanglah Denpasar and private laboratory, Prima Medika in Denpasar from 1st January 2012 to 31st December 2014. Immunohistochemical staining of MMP- 9 was performed in each of the 18 samples of high and low degree adenocarcinoma that met the inclusion and exclusion criteria. The study result was then analyzed by Mann-Whitney test with significancy level at α=0.05.
MMP-9 immunoreactivity was significantly higher in high grade than low grade (p=0.001), with the MMP-9 expression median of 7.5 (6.0-9.0) on high grade and 4.0 (2.0- 6.0) on low grade. The highest number of cases was in the 60- 69 years age group (55.55%).
MMP-9 expression was an important examination to determine the level of tumour aggresiveness that were predetermined by its grade for more effective therapies.
Keywords: acinar adenocarcinoma prostate, high grade, low grade, MMP-9 expression.
xiii
SAMPUL DALAM ... i
PRASYARAT GELAR ... ii
LEMBAR PERSETUJUAN PEMBIMBING ... iii
LEMBAR PENETAPAN PANITIA PENGUJI ... iv
SURAT PERNYATAAN BEBAS PLAGIAT ... v
UCAPAN TERIMA KASIH ... vi
ABSTRAK ... xi
ABSTRACT ... xii
DAFTAR ISI ... xiii
DAFTAR TABEL ... xviii
DAFTAR GAMBAR ... xix
DAFTAR SINGKATAN ... xxii
DAFTAR LAMPIRAN ... xxv
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Rumusan Masalah ... 5
1.3 Tujuan Penelitian ... 5
xiv
1.4.2 Manfaat Praktis ... 6
BAB II KAJIAN PUSTAKA ... 7
2.1 Struktur Normal dan Fungsi Prostat ... 7
2.1.1 Anatomi Makroskopik Prostat ... 7
2.1.2 Anatomi Mikroskopik Prostat Dewasa ... 9
2.1.3 Fungsi Prostat ... 10
2.2 Adenokarsinoma Asinar Prostat ... 10
2.2.1 Epidemiologi ... 10
2.2.2 Etiologi dan Faktor Risiko ... 13
2.2.3 Gambaran Klinik ... 15
2.2.4 Patogenesis Adenokarsinoma Prostat ... 15
2.2.5 Morfologi dan Grading Karsinoma Invasif ... 21
2.2.6 Marka Biologi Adenokarsinoma Asinar Prostat ... 29
2.3 Matriks Metalloproteinase ... 32
2.3.1 Struktur, Jenis dan Fungsi Umum MMP ... 32
2.3.2 Peranan MMPs pada Karsinoma Prostat ... 37
2.3.3 MMP-9 dan Peranannya pada Karsinoma Prostat ... 39
xv
BAB III KERANGKA BERPIKIR, KONSEP DAN HIPOTESIS
PENELITIAN ... 53
3.1 Kerangka Berpikir ... 53
3.2 Konsep Penelitian ... 56
3.3 Hipotesis Penelitian ... 56
BAB IV METODE PENELITIAN ... 57
4.1 Rancangan Penelitian ... 57
4.2 Tempat dan Waktu Penelitian ... 58
4.3 Ruang Lingkup Penelitian ... 58
4.4 Penentuan Sumber Data ... 58
4.4.1 Populasi ... 58
4.4.1.1 Populasi Target ... 58
4.4.1.2 Populasi Terjangkau... 58
4.4.2 Sampel ... 59
4.4.3 Kriteria Inklusi dan Eksklusi ... 59
4.4.3.1 Kriteria Inklusi ... 59
4,4.3.2 Kriteria Ekslusi ... 59
xvi
4.5 Variabel Penelitian ... 61
4.5.1 Klasifikasi Variabel ... 61
4.5.2 Definisi Operasional Variabel ... 61
4.6 Bahan Penelitian ... 64
4.7 Instrumen Penelitian ... 65
4.8 Prosedur Penelitian ... 65
4.8.1 Cara Pengumpulan ... 65
4.8.2 Prosedur Pemeriksaan Bahan ... 67
4.8.3 Alur Penelitian ... 70
4.9 Analisis Data ... 72
BAB V HASIL PENELITIAN ... 73
5.1 Karakteristik Subyek Penelitian ... 73
5.2 Ekspresi MMP-9 ... 75
BAB VI PEMBAHASAN ... 78
6.1 Karakteristik Subyek Penelitian ... 78
6.2 Hubungan Ekspresi MMP-9 pada adenokarsinoma Asinar Prostat Derajat Tinggi dan Rendah ... 79
xvii
7.2 Saran ... 84 DAFTAR PUSTAKA ... 85 DAFTAR LAMPIRAN... 90
xviii
Tabel 2.1 Kriteria untuk Gleason Grading ... 23 Tabel 5.1 Hasil Uji Normalitas Data Ekspresi MMP-9 ... 74
Tabel 5.2 Distribusi sampel berdasarkan umur dan diagnosis histopatologi ... 74 Tabel 5.3 Perbandingan ekspresi MMP-9 antar kelompok ... 75
xix
Gambar 2.1 Zona pada Prostat ... 8
Gambar 2.2 Kelenjar Prostat Normal dengan Lapisan Sel Sekretori dan Sel Basal ... 10
Gambar 2.3 Mekanisme androgen-dependent progression dan androgen- independent progression pada karsinogenesis adenokarsinoma asinar prostat ... 17
Gambar 2.4 a. Fokus kecil adenokarsinoma asinar prostat diantara kelenjar jinak berukuran besar ... 22
Gambar 2.4 b. Kelenjar ganas berukuran kecil dengan inti besar, anak inti menonjol dan sitoplasma gelap, bila dibandingkan dengan kelenjar jinak besar ... 22
Gambar 2.5 Gambar skematik Gleason Grading System ... 24
Gambar 2.6 Adenokarsinoma asinar prostat Gleason pattern 1 ... 26
Gambar 2.7 Adenokarsinoma asinar prostat Gleason pattern 2 ... 26
Gambar 2.8 Adenokarsinoma asinar prostat Gleason pattern 3 ... 27
Gambar 2.9 Adenokarsinoma asinar prostat Gleason pattern 4 ... 27
Gambar 2.10 Adenokarsinoma asinar prostat Gleason pattern 5 ... 28
xx
Gambar 2.12 Peranan MMP pada progresi kanker prostat... 38
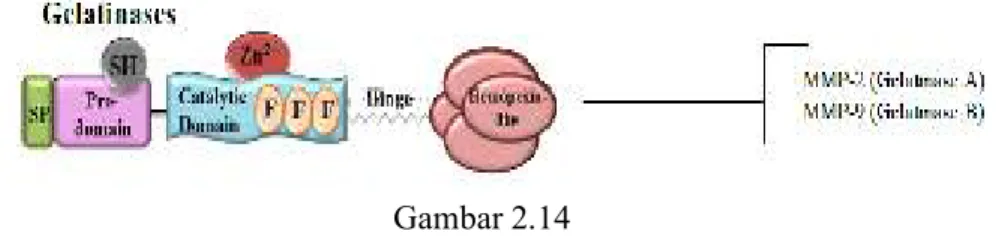
Gambar 2.13 Interaksi antara MMP-2, -7, -9 dan -14 pada perkembangan kanker prostat ... 39 Gambar 2.14 Struktur MMP-9 (Gelatinase B) ... 40
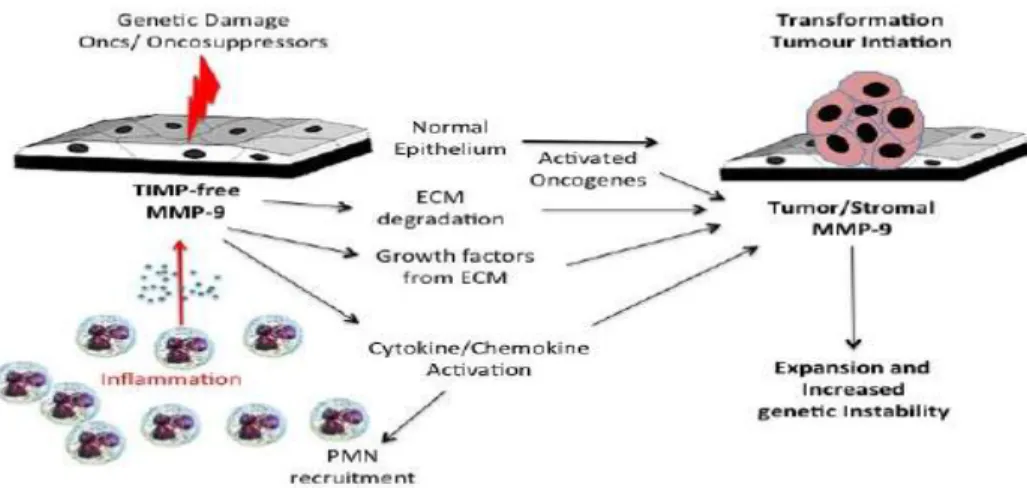
Gambar 2.15 Peranan MMP-9 yang tidak terikat TIMP yang berasal dari sel radang PMN sel tumor dalam inisiasi tumor dan promosi instabilitas genetik. melalui degradasi matriks ekstraseluler (ECM), pelepasan dan aktivasi kemokin, sitokin dan growth factor ... 42 Gambar 2.16 Transisi epitelial menjadi mesenkimal (EMT) yang dipicu MMP-9
... 44
Gambar 2.17 Peranan MMP-9 bebas TIMP dari sel radang PMN, MMP-9 tumor/
stroma onkogen dan hipoksia dalam mengaktifkan angiogenesis ... 45
Gambar 2.18 Kaitan MMP-9 dengan kemampuan metastasis tumor ... 46 Gambar 2.19 a. Pulasan positif lemah MMP-9 pada hyperplasia kelenjar prostat
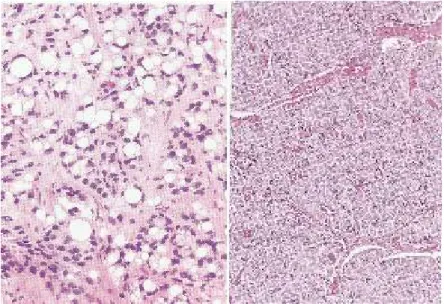
... 50 Gambar 2.19 b. Pulasan positif kuat MMP-9 pada sitoplasma sel tumor dan sel stroma ... 50
xxi
Gambar 3.1 Bagan Konsep Penelitian ... 56
Gambar 4.1 Bagan Rancangan Penelitian ... 57 Gambar 5.1 MMP-9 pada Adenokarsinoma Asinar Prostat Derajat Rendah ...
... 76 Gambar 5.2 MMP-9 pada Adenokarsinoma Asinar Prostat Derajat Rendah ...
... 76 Gambar 5.3 MMP-9 pada Adenokarsinoma Asinar Prostat Derajat Tinggi
... 77
xxii ACT = α-1-Anti-Chymotrypsin
AMACR = Alpha-Methylacyl-CoA Racemase AMG = α-2-Macroglobulin
APC = Adenomatous Polyposis Colli
AR = Androgen Receptor
BPH = Benign Prostatic Hyperplasia BRCA2 = Breast Cancer Antigen 2
BS = Buffer Saline
CAG = Cytosine Adenine Guanine
CSMD 1 = CUB and Sushi Multiple Domain 1 DHT = Dihydrotestosterone
DNA = Deoxyribonucleic Acid DRE = Digital Rectal Examination ECM = Extra Cellular Matrix
EGFR = Epidermal growth factor receptor EMT = Epithelial to Mesenchymal Transition ETS = E26 Transformation-Specific
xxiii
GSTP1 = Glutathione S-Transferase 1 H&E = Hematoksilin dan Eosin
IL = Interleukin
ISH = In situ Hybridization
MLH1 = MutL Homolog 1
MMP = Matrix Metalloproteinase
MT-1 MMP = Membrane Type-1 Matrix Metalloproteinase PBS = Phosphate Buffer Saline
PCA = Prostate Cancer Gene PCR = Polymerase Chain Reaction PDEF = Prostate Derived ETS Factor PI-3K = Phosphatidylinositol-3-Kinase PIN = Prostatic Intraepithelial Neoplasia PSA = Prostate Spesific Antigen
PSAD = Prostate-Spesific Antigen Density PSMA = Prostate Spesific Membrane Antigen PTEN = Phospatase and Tensin Homolog
xxiv SDF = Stroma Derived Factor
SRD5A2 = Steroid 5-Alpha Reductase Type II TGFβ = Transforming Growth Factor β
TIMP = Tissue Inhibitors of Matrix Metalloproteinases TMPRSS2 = Transmembrane Protease Serine 2
TURP = Transurethral Resection of the Prostate uPA = urokinase-type Plasminogen Activator VEGF = Vascular Endothelial Growth Factor
xxv
Lampiran 1. Karakteristik ekspresi MMP dan TIMP pada kanker prostat ... 90 Lampiran 2. Keterangan Kelaikan Etik ... 93 Lampiran 3. Amandemen Keterangan Kelaikan Etik ... 94 Lampiran 4. Surat Ijin ... 95 Lampiran 5. Amandemen Surat Ijin ... 96 Lampiran 6. Data Subyek Penelitian ... 97 Lampiran 7. Uji Normalitas Data Umur dan MMP-9 ... 98 Lampiran 8. Uji Mann-Whitney Data MMP-9 antar Derajat Tumor ... 98
1 BAB I PENDAHULUAN
1.1 Latar Belakang
Akhir-akhir ini insiden kanker sebagai salah satu jenis penyakit tidak menular semakin meningkat. Peningkatan ini terjadi salah satunya karena perubahan pola hidup dan meningkatnya kesadaran masyarakat untuk melakukan deteksi dini.
Salah satu kanker yang peningkatannya cukup signifikan beberapa tahun terakhir ini adalah kanker prostat.
Karsinoma prostat khususnya karsinoma adenum asinus prostat merupakan keganasan yang paling sering ditemukan pada laki-laki dan penyebab kematian karena kanker kedua di dunia barat (Eipstein et al., 2011). Setiap tahunnya tercatat 10.000 pasien meninggal dunia akibat kanker prostat di Inggris (Jemal et al., 2008; Bickers dan Aukim-Hastie, 2009;). Sementara di Amerika Serikat tercatat 28.600 kematian dari 186.000 kasus baru pada tahun 2008. Peningkatan jumlah kematian karena karsinoma prostat di dunia terjadi pada tahun 1990 hingga 2010 dimana jumlah kematian meningkat dari 156.000 hingga 256.000 (Lozano et al., 2012).Di Indonesia sendiri, berdasarkan data dari Direktorat Jenderal Pelayanan Medik Departemen Kesehatan RI tahun 2009, karsinoma adenum asinus prostat berada di peringkat ke sepuluh dari seluruh keganasan dan merupakan peringkat pertama dari keganasan yang paling sering terjadi pada laki-laki. Berdasarkan data registrasi kanker berbasis patologi pada tahun 2009 di Denpasar, karsinoma
adenum asinus prostat berada pada peringkat ketujuh dan merupakan peringkat pertama keganasan pada laki-laki (Anonim, 2009).
Karsinoma prostat merupakan keganasan yang cukup menakutkan karena
gejala awalnya seringkali tidak spesifik sehingga penderita cenderung datang untuk berobat pada stadium yang sudah lanjut. Dikatakan 75% penderita dapat hidup dalam 10 tahun bila saat didiagnosis ditemukan kanker yang terbatas pada organ prostat, 55% bila mengalami perluasan regional dan 15% bila telah mengalami metastasis jauh (Raphael, 2010).
Kemampuan invasi dan metastasis suatu karsinoma sangat penting pada progresivitas dan agresivitas sel ganasnya karena merupakan penyebab utama kesakitan dan kematian akibat kanker (Xu et al., 2010). Pada karsinoma prostat khususnya adenokarsinoma asinar, agresivitas ini ditentukan oleh derajat tumor yang dinilai berdasarkan skor Gleason. Semakin besar nilai skor Gleason maka semakin buruk dan agresif sifat tumor tersebut. Perubahan fenotip sel kanker menjadi agresif umumnya berhubungan dengan perilaku invasif dan melibatkan peningkatan ekspresi proteinase yang mampu merusak komponen matriks ekstraselular sehingga memudahkan penyebaran sel kanker (Gong et al., 2014).
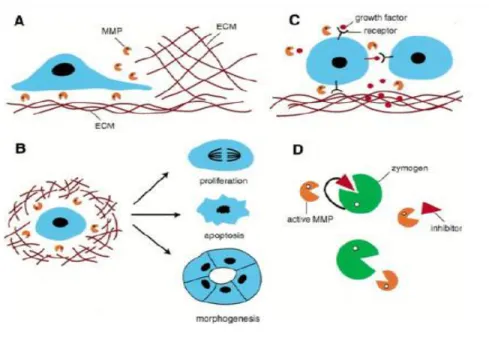
Matriks metalloproteinase (MMP) adalah kelompok endopeptidase yang tergantung pada zinc dan terlibat dalam degradasi matriks ekstraselular baik pada proses fisiologis maupun patologis. Pada keadaan fisiologis MMP membantu proses morfogenesis, angiogenesis, dan perbaikan jaringan. Sementara pada proses patologis, MMP terlibat pada terjadinya sirosis, arthritis dan kanker.
Berdasarkan struktur, MMP diklasifikasikan menjadi empat kelompok yaitu
archetypal MMPs, matrilysins, gelatinases dan furin-activatable MMPs. Diantara semua kelompok MMP, MMP-9 (Gelatinase B) lebih banyak mendapat perhatian karena aktivitas dan regulasinya lebih kompleks dibandingkan MMP yang lain (Gong et al., 2014).
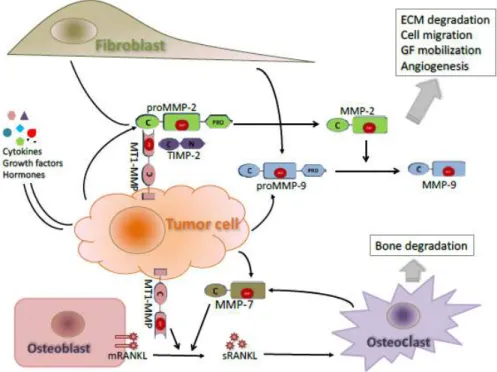
Pada karsinoma prostat MMP-9 mengalami regulasi melalui interaksi antara sel tumor dengan lingkungan mikro di sekitarnya seperti sel stroma, sel endotel, dan sel radang. Peranan sel radang seperti makrofag, netrofil, sel mast sel dendritik dan sel T pada inisiasi dan progresi tumor sudah sangat diakui. Sel tumor mampu menghasilkan faktor-faktor pro-inflamasi dan MMP yang berperan pada agresivitas tumor (Deryugina dan Quigley, 2006). Co-culture sel tumor dengan sel stroma secara in vitro mampu meningkatkan ekspresi pro-MMP-9 di sel tumor dan menekan regulasi inhibitornya (TIMPs) di sel stroma. Selain itu, co- culture sel tumor dengan sel endotel juga mampu meningkatkan ekspresi MMP-9 dan kemampuan invasi sel tumor melalui peningkatan sekresi IL-6 oleh sel endotel dimana aktivasinya dilakukan melalui jalur TGF-β. CXC chemokin receptor-4 (CXCCR4) adalah sitokin lain yang berperan penting pada metastasis karsinoma prostat melalui peningkatan regulasi VEGF dan MMP-9 baik secara in vitro maupun in vivo. Hal ini semakin menguatkan bukti bahwa sitokin dan faktor pertumbuhan yang dikeluarkan oleh sel tumor, endotel dan sel radang di lingkungan mikro tumor bersama-sama meregulasi ekspresi MMP-9 melalui jalur autokrin maupun parakrin (Gong et al., 2014).
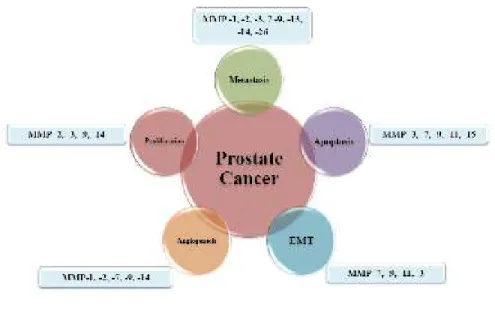
Matriks metalloproteinase-9 pada karsinoma prostat terlibat pada semua tahap progresivitas sel kanker mulai dari proliferasi, angiogenesis, apoptosis,
epithelial-mesenchymal transition (EMT) dan metastasis (Gong et al., 2014).
MMP-9 mampu mendegradasi matriks ekstraselular dari stem cell niche yang mengakibatkan terjadinya perubahan bentuk stem cell niche menjadi bentuk bebas yang selanjutnya meningkatkan promosi c-KIT terkait proliferasi sel. Proses angiogenesis pada karsinoma prostat dipicu melalui mobilisasi dan aktivasi mitogen angiogenik dari matriks penyimpanannya. Proses ini difasilitasi oleh MMP-9 yang tidak terikat TIMP-1 yang sekaligus mampu melepaskan faktor pertumbuhan FGF dan VEGF dari matriks. Proses metastasis dimudahkan oleh kemampuan sel tumor untuk berubah dari bentuk sel epitel yang tidak mampu bergerak menjadi sel mesenkimal yang mampu bergerak (EMT). MMP-9 dikatakan juga terlibat pada proses ini (Farina dan Mackay, 2014).
Beberapa penelitian yang menghubungkan ekspresi MMP-9 dengan derajat diferensiasi berdasarkan skor Gleason sudah pernah dilakukan, diantaranya penelitian oleh Castellano, et al (2008) dan Trudel, et al (2010) menemukan bahwa ekspresi kuat MMP-9 erat hubungannya dengan skor Gleason yang tinggi.
Penelitian lain yang menilai tingkat ekspresi MMP-9 pada sel kanker prostat menemukan terjadi peningkatan ekspresi MMP-9 seiring dengan meningkatnya skor Gleason namun tidak terdapat perbedaan bermakna antara tumor dengan skor Gleason 2 hingga 6 dan kanker derajat tinggi dengan skor Gleason 7 hingga 10 (Oguic et al., 2014). Penelitian lain juga menunjukkan tidak tampak hubungan yang signifikan antara kadar MMP-9 serum dengan skor Gleason (Incorvaia et al., 2007; Gonzales et al., 2010).
Meskipun penelitian yang menghubungkan MMP-9 dengan derajat diferensiasi sudah pernah dilakukan namun masih terdapat ketidaksesuaian hasil.
Di samping itu, penelitian yang menghubungkan antara agresivitas karsinoma adenum asinus prostat yang ditentukan berdasarkan skor Gleason dengan MMP-9 sampai saat ini belum pernah dilakukan di Bali, sehingga sangat menarik untuk dilakukan penelitian tersebut agar dapat memahami mekanisme molekular dan keterlibatan MMP-9 pada agresivitas karsinoma tersebut.
1.2 Rumusan Masalah
Apakah ekspresi matriks metalloproteinase-9 lebih tinggi pada karsinoma adenum asinus prostat derajat tinggi dibandingkan dengan derajat rendah?
1.3 Tujuan Penelitian
Membuktikan bahwa ekspresi matriks metalloproteinase-9 lebih tinggi pada karsinoma adenum asinus prostat derajat tinggi dibandingkan dengan derajat rendah.
1.4 Manfaat Penelitian 1.4.1 Manfaat Akademik
1. Memberikan informasi data epidemiologi mengenai tingkat ekspresi MMP-9 pada karsinoma adenum asinus prostat derajat tinggi dan rendah.
2. Mengetahui peranan MMP-9 sebagai marka biologi prediktif agresivitas karsinoma adenum asinus prostat.
1.4.2 Manfaat Praktis
1. Penentuan tingkat ekspresi MMP-9 pada karsinoma adenum asinus prostat derajat tinggi dan derajat rendah diharapkan dapat digunakan sebagai dasar penemuan target terapi.
2. Parameter prediktif biologi MMP-9 diharapkan dapat dipakai sebagai pegangan oleh klinisi untuk dapat memberikan penjelasan kepada pasien karsinoma adenum asinus prostat tentang kemungkinan kekambuhan dan metastasis.
7 BAB II KAJIAN PUSTAKA
2.1 Struktur Normal Prostat
2.1.1 Anatomi Makroskopik Prostat
Prostat merupakan organ retroperitoneal yang memiliki berat 30 gram dengan bentuk menyerupai corong dan posisi melingkari kandung kemih serta uretra.
Bagian apeksnya terletak di atas diafragma urogenital sementara bagian basal prostat terletak tepat dibawah leher kandung kemih. Pada bagian posterior, prostat dipisahkan dengan rektum oleh selapis jaringan ikat tipis yang disebut sebagai Denonvilliers fascia. Uretra pars prostatika berjalan secara vertikal pada bagian tengah prostat yang kemudian berbelok ke anterior setingkat verumontanum (Eipstein dan Netto, 2010; Eipstein et al., 2011).
Parenkim prostat dewasa dibagi menjadi empat zona anatomi dan biologi yang berbeda yaitu zona perifer, sentral, transisional dan area stroma fibromuskular anterior (Gambar 2.1). Perbedaan zona ini mempengaruhi jenis lesi pada prostat. Lesi hiperplasia paling sering terjadi di zona transisional sedangkan keganasan lebih sering terjadi di zona perifer (Eipstein dan Netto, 2010; Eipstein et al., 2011; Eipstein dan Lotan, 2015).
Aliran darah pada prostat berasal dari arteri vesika inferior yang merupakan cabang dari arteri iliaka interna dan berakhir pada arteri uretral dan kapsular (Eipstein et al., 2011).
Aliran limfatik pada prostat terdiri dari jaringan limfatik intraprostatika yang mengalir menuju kelenjar getah bening obturator kemudian ke kelenjar getah bening iliaka interna. Sejumlah kecil drainase limfatik mengalir ke kelenjar getah bening presakral dan kelenjar getah bening iliaka eksterna. Pada 4% kasus prostatektomi radikal ditemukan adanya aliran limfatik yang tidak umum yang menuju ke kelenjar getah bening periprostatika maupun ke kelenjar getah bening perivesikula seminalis (Eipstein et al., 2011).
Gambar 2.1
Zona pada prostat (PZ: peripheral zone/zona perifer;TZ: transisional zone/zona transisional; CZ: central zone/zona sentral) (Eipstein et al., 2011)
Prostat memiliki persarafan simpatis dan parasimpatis yang berasal dari pleksus pelvis. Nervus-nervus ini berjalan bersama-sama dengan arteri kapsularis yang kemudian menembus prostat. Serat parasimpatis berjalan menuju asini dan menstimulasi sekresi sedangkan serat simpatis menyebabkan terjadinya kontraksi dari outer band capsular dan otot polos intraprostatika (Eipstein et al., 2011).
2.1.2 Anatomi Mikroskopik Prostat Dewasa
Prostat terdiri dari epitel kelenjar dan stroma fibromuskular. Sistim duktus dan kelenjar prostat tersusun dalam pola arsitektur yang kompleks. Duktus terdiri dari struktur tubular bercabang yang memanjang yang kemudian berakhir pada asini.
Duktus pada potongan melintang tidak dapat dibedakan dengan asini. Permukaan luminal dari kelenjar prostat yang jinak memiliki kontur yang bergelombang dengan papillary infolding (Gambar 2.2) (Eipstein dan Netto, 2010; Eipstein et al., 2011).
Epitel normal kelenjar prostat memiliki dua lapis sel yaitu lapisan sel luminal atau sel sekretori dan lapisan sel basal. Pada epitel normal kelenjar prostat juga terdapat tipe sel lainnya yaitu sel neuroendokrin, namun sel ini jarang ditemukan dan biasanya hanya dapat ditemukan dengan pewarnaan khusus dan imunohistokimia. Sel sekretori berbentuk kolumnar yang menghadap ke lumen kelenjar dan memiliki sitoplasma yang jernih karena mengandung vakuola sekretori yang jernih serta memiliki inti berukuran kecil berbentuk bulat dengan kromatin halus yang tesebar dan biasanya tidak terlihat memiliki anak inti. Sel basal terletak di bagian tepi dari kelenjar diantara sel sekretori dan membrana basalis, biasanya berbentuk bulat namun dapat pula berbentuk flat, kuboid, triangular atau menyerupai cerutu (cigar-shaped) dengan aksis panjangnya paralel dengan membrana basalis. Sel basal memiliki sitoplasma yang sedikit dan memiliki inti yang hiperkromatik dan berukuran kecil (Eipstein dan Netto, 2010;
Eipstein et al, 2011).
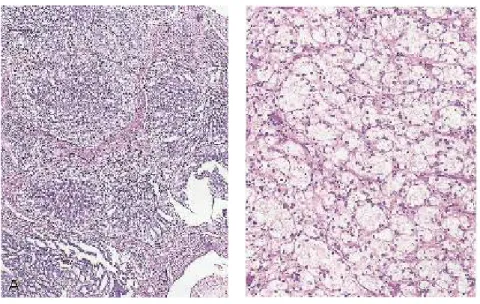
Gambar 2.2
Kelenjar prostat normal dengan lapisan sel sekretori dan sel basal (Eipstein dan Lotan, 2015)
2.1.3 Fungsi Prostat
Fungsi utama kelenjar prostat adalah membentuk sekret yang menyusun setengah dari volume cairan ejakulasi. Manfaat biologis yang pasti dari substansi biokimia yang disekresikan ke dalam plasma seminal masih belum diketahui dengan jelas (Eipstein et al., 2011).
2.2 Karsinoma adenum asinus prostat 2.2.1 Epidemiologi
Karsinoma adenum asinus prostat merupakan tumor ganas epithelial yang mengandung sel sekretori (Sakr et al., 2004). Karsinoma ini paling sering terjadi pada laki-laki dan merupakan peringkat kedua penyebab kematian yang disebabkan karena karsinoma pada laki-laki. Setiap tahunnya tercatat 10.000 pasien meninggal dunia akibat karsinoma adenum asinus prostat di Inggris (Bickers dan Aukim-Hastie, 2009). Diperkirakan terdapat 28.600 kematian yang disebabkan oleh karsinoma adenum asinus prostat di Amerika Serikat pada tahun
2008. Pada tahun 2007, karsinoma adenum asinus prostat menempati urutan pertama dari seluruh keganasan pada laki-laki yaitu sebanyak 29% di Amerika Serikat (Eipstein dan Netto, 2010). Di seluruh dunia, karsinoma adenum asinus prostat berada pada peringkat keenam penyebab kematian karena keganasan pada laki-laki (Eipstein et al., 2011). Di Indonesia sendiri, berdasarkan data dari Direktorat Jenderal Pelayanan Medik Departemen Kesehatan RI tahun 2009, karsinoma adenum asinus prostat berada di peringkat ke sepuluh dari seluruh keganasan dan merupakan peringkat pertama dari keganasan yang paling sering terjadi pada laki-laki. Berdasarkan data registrasi kanker berbasis patologi pada tahun 2009 di Denpasar, karsinoma adenum asinus prostat berada pada peringkat ketujuh dan merupakan peringkat pertama keganasan pada laki-laki (Anonim, 2009).
Insiden karsinoma adenum asinus prostat sangat berubah pada dua abad terakhir terutama dua puluh tahun terakhir. Pada pertengahan abad kedua puluh, terdapat peningkatan insiden karsinoma adenum asinus prostat di Amerika Serikat. Hal ini disebabkan karena meningkatnya lama hidup individu, penggunaan digital rectal examination (DRE) untuk mendeteksi karsinoma adenum asinus prostat , dan penggunaan mikroskop cahaya untuk mendiagnosis keganasan pada jaringan biopsi prostat atau jaringan prostat yang didapatkan dari transurethral resection of the prostate (TURP) dan open prostatectomy sebagai tatalaksana untuk BPH. Pada akhir abad kedua puluh jumlah pasien karsinoma adenum asinus prostat di Amerika Serikat meningkat secara drastis dimana insidennya meningkat sebanyak 85% yang kemudian diikuti penurunan sebanyak
28%. Hal ini disebabkan karena adanya pentapisan menggunakan prostate- spesific antigen (PSA). Penurunan insiden dianggap dikarenakan deteksi karsinoma pada stadium awal (Eipstein et al., 2011).
Secara keseluruhan terdapat peningkatan insiden karsinoma adenum asinus prostat di seluruh dunia. Peningkatan yang paling menonjol terjadi pada negara- negara dengan insiden karsinoma adenum asinus prostat yang tinggi seperti Amerika Serikat, namun peningkatan juga terjadi pada negara-negara dengan insiden rendah seperti Cina dan Jepang (Eipstein et al., 2011).
Terdapat perbedaan insiden karsinoma adenum asinus prostat yang sangat bermakna diantara negara-negara dan wilayah di dunia. Insiden tertinggi terjadi di Amerika Utara, Australia, Selandia Baru, Eropa dan Karibia. Insiden tertinggi terjadi pada laki-laki Jamaika dengan angka kejadian 300/100.000 laki-laki.
Angka kejadian karsinoma adenum asinus prostat jauh lebih rendah di Asia dengan perbedaan insiden di Amerika Utara dengan Cina lebih dari 80 kali lipat.
Faktor genetik dan lingkungan memiliki peranan pada perbedaan ini (Eipstein et al., 2011).
Tingginya prevalensi karsinoma adenum asinus prostat terutama pada laki- laki berusia lanjut menimbulkan anggapan bahwa karsinoma adenum asinus prostat merupakan suatu fenomena normal yang berkaitan dengan peningkatan usia (Hughes et al., 2005).
Karsinoma adenum asinus prostat sebagian besar terdapat pada zona perifer di bagian posterolateral atau posterior yaitu sebanyak 70%. Tujuh persen kasus karsinoma adenum asinus prostat terjadi pada zona perifer bagian anterior dan
hanya lima persen terletak pada zona sentral. Fokus-fokus karsinoma adenum asinus prostat juga dapat dijumpai pada zona transisional dan perifer (Eipstein et al., 2011).
2.2.2 Etiologi dan Faktor Risiko
Karsinoma adenum asinus prostat merupakan keganasan multifaktorial dengan penyebab yang masih belum diketahui sampai saat ini. Faktor risiko yang telah diakui selama ini antara lain usia, ras, dan riwayat keluarga penderita kanker.
Sementara kemungkinan faktor risiko yang lain berupa diet dan hormonal (Eipstein et al., 2011).
Risiko karsinoma adenum asinus prostat meningkat seiring usia. Karsinoma adenum asinus prostat paling sering terjadi pada usia diatas 64 tahun dan jarang pada usia dibawah 50 tahun. Tercatat sekitar lima kasus terjadi pada usia dibawah 10 tahun dan 21 kasus terjadi pada usia antara 10 dan 21 tahun (Eipstein et al., 2011). Perubahan gaya hidup termasuk pola diet juga memiliki implikasi terhadap perkembangan karsinoma adenum asinus prostat . Terdapat banyak sekali faktor lingkungan yang diduga terlibat dalam peningkatan insiden karsinoma adenum asinus prostat namun belum satupun terbukti. Diet tinggi protein hewani terutama daging merah dikatakan berhubungan kuat dengan risiko karsinoma adenum asinus prostat . Beberapa penelitian menduga pria yang mengkonsumsi makanan atau suplemen kaya kalsium mungkin memiliki risiko menderita karsinoma adenum asinus prostat lebih tinggi. Bahan makanan lain yang diduga dapat mencegah atau memperlambat perkembangan karsinoma adenum asinus prostat antara lain lycopenes di dalam buah tomat, selenium, produk olahan dari kedelai
dan vitamin D (Eipstein dan Lotan, 2015). Namun faktor diet ini tidak mampu menjelaskan perbedaan tingginya risiko karsinoma adenum asinus prostat antara pria kulit hitam dan kulit putih (Anonim, 2015).
Faktor genetik dan ras tampaknya memainkan peranan penting pada insiden karsinoma adenum asinus prostat . Terjadi 5 hingga 11 kali peningkatan risiko karsinoma adenum asinus prostat pada pria dengan riwayat karsinoma adenum asinus prostat pada keturunan pertamanya. Penelitian yang membandingkan karsinoma adenum asinus prostat pada pria kulit putih, kulit hitam dan asia menemukan prevalensi riwayat keluarga menderita karsinoma adenum asinus prostat lebih rendah pada pria Asia dibandingkan kulit hitam. Hal ini sepertinya berkaitan dengan faktor pengulangan kodon cytosine, adenine, guanine (CAG) yang lebih sedikit pada pria kulit hitam dimana semakin sedikit pengulangannya maka semakin besar risiko menderita karsinoma adenum asinus prostat (Eipstein et al., 2011; Eipstein dan Lotan, 2015)
Hormon seks pada pria memainkan peranan penting pada perkembangan dan pertumbuhan kanker prostat. Testosteron meresap ke dalam kelenjar dan diubah menjadi metabolit aktif berupa dihydrotestosterone ( DHT ) oleh enzim steroid 5- alpha reductase type II (SRD5A2). Dihydrotestosterone dan testosterone berikatan dengan reseptor androgen (AR) yang selanjutnya masuk ke dalam inti dan mengaktifkan gen yang mengatur pembelahan sel (Eipstein dan Lotan, 2015).
2.2.3 Gambaran Klinik
Karsinoma adenum asinus prostat biasanya asimptomatik pada stadium awal dan baru memberikan gejala klinis apabila telah mencapai stadium lanjut. Di Amerika Serikat pasien yang didiagnosis memiliki karsinoma adenum asinus prostat sebagian besar tidak memberikan gejala dimana karsinoma adenum asinus prostat tersebut terdeteksi karena adanya abnormalitas pada serum PSA atau melalui pemeriksaan colok dubur (digital rectal examination/DRE) (Eipstein et al., 2011).
Gejala lokal yang timbul menyerupai BPH berupa peningkatan frekuensi dan sulit buang air kecil. Retensi urin akut dan hematuria merupakan gejala yang tidak umum terjadi dan merupakan gambaran yang nonspesifik. Gejala lain dapat berupa hematospermia dan impotensi namun hal ini jarang terjadi. Invasi ke rektum, priapism, dan uremia sangat jarang terjadi dan merupakan manifestasi lanjut dari karsinoma adenum asinus prostat (Eipstein et al., 2011).
Gejala klinis pertama yang timbul pada karsinoma adenum asinus prostat biasanya merupakan akibat dari metastasis. Kelenjar getah bening regional dan tulang merupakan tempat yang paling sering menjadi tujuan metastasis namun hanya metastasis tumor ke tulang yang menghasilkan gejala klinis yang jelas.
Pasien akan merasa nyeri pinggang, dada, punggung, kaki dan bahu bergantung pada letak tulang yang terlibat (Eipstein et al., 2011).
2.2.4 Patogenesis Karsinoma adenum asinus prostat
Hormon seks pada pria memainkan peranan penting pada perkembangan dan pertumbuhan kanker prostat. Testosteron didalam kelenjar prostat dikonversi menjadi dihydrotestosteron (DHT), suatu metabolit yang lebih aktif, oleh enzim
steroid 5-alpha reductase tipe II (SRD5A2). Dihydrotestosterone dan testosterone berikatan dengan reseptor androgen (AR) . Gen AR berlokasi di kromosom X lengan panjang. Gen ini mengandung highly polymorphic region yang terdiri dari ulangan kodon cytosine, adenine, guanine (CAG) di exon 1 dengan rentang normal antara 6-39 pengulangan. Beberapa penelitian mendapatkan pria dengan pengulangan yang rendah memiliki risiko kanker prostat lebih tinggi ( Eipstein et al., 2011; Eipstein dan Lotan, 2015).
Reseptor androgen berperan pada pertumbuhan sel kanker melalui mekanisme androgen-dependent progression dan androgen-independent progression (Gambar 2.3). Mekanisme yang pertama diawali dengan terlepasnya ikatan heat shock protein dengan reseptor androgen inaktif. Terlepasnya ikatan ini karena adanya androgen dihydrotestosteron (DHT) yang berikatan dengan reseptor androgen di sitoplasma. Lalu ikatan reseptor androgen ini akan masuk ke dalam inti dan berikatan dengan elemen respon androgen yang kemudian mengaktivasi gen-gen yang terlibat pada pertumbuhan sel. Sementara pada mekanisme berikutnya, pertumbuhan sel kanker bisa melalui jalur selular yang bervariasi, beberapa masih melibatkan reseptor androgen sedangkan yang lain tanpa melibatkan reseptor androgen (bypassing androgen receptor). Pada jalur yang melibatkan reseptor androgen terjadi mutasi reseptor androgen sehingga dapat diaktifkan oleh ligan non-androgen. Di samping itu deregulasi faktor pertumbuhan dan sitokin serta koaktivator reseptor androgen dapat pula mengaktifkan reseptor androgen. Reseptor androgen dapat mengalami amplifikasi sehingga menjadi hipersensitif terhadap kadar androgen yang rendah sekalipun
(De Torres, 2007; Hsu et al., 2011; Eipstein dan Lotan, 2015). Pada jalur yang tidak melibatkan reseptor androgen, hilangnya PTEN menghalangi inhibisi phosphatidylinositol 3-kinase (PI3-K)-akt yang menyebabkan aktivasi Akt ke phosphorylate bad. Setelah itu akan terjadi pelepasan Bcl-2 yang berperan pada pertahanan hidup sel. Androgen-independent cell dapat meningkatkan ekspresi Bcl-2 (Hsu et al., 2011).
Sel kanker prostat dapat pula memiliki perilaku seperti sel neuroendokrin yang dapat mengeluarkan neuropeptide yang merangsang pertumbuhan sel disekitarnya sehingga kanker prostat menjadi kebal terhadap terapi (Hsu et al., 2011).
Gambar 2.3
Mekanisme androgen-dependent progression dan androgen-independent
progression pada karsinogenesis karsinoma adenum asinus prostat (Tindall dan Lonergan, 2011)
Pentingnya keterlibatan androgen dalam pertumbuhan dan pertahan hidup sel karsinoma prostat tampak pada efek terapi kastrasi dengan menggunakan anti- androgen yang umumnya menekan progresi tumor. Namun sayangnya, sebagian
besar tumor kadang-kadang menjadi kebal terhadap androgen blockade dan berkembang melalui jalur androgen-independent seperti yang dijelaskan sebelumnya (Eipstein dan Lotan, 2015).
Penelitian terkini yang menggunakan metode pemeriksaan microarrays jaringan radikal prostatektomi pada pasien yang tidak mendapatkan terapi hormonal awal menunjukkan bahwa tingginya ekspresi reseptor androgen berhubungan secara signifikan dengan berkurangnya biochemical relapse-free survival dan parameter klinikopatologi yang mengindikasikan peningkatan agresivitas tumor (De Torres et al., 2007; Bjartell et al., 2011).
Selain itu, ada pula peranan tumor-spesific acquired somatic mutation dan perubahan genetik dalam perkembangan karsinoma adenum asinus prostat. Salah satu somatic mutation yang umumnya terjadi adalah chromosomal rearrangements yang mensejajarkan coding sequence dari E26 transformation specific (ETS) family transcription factor gene bersebelahan dengan Androgen- Regulated Transmembrane Protease Serine 2 (TMPRSS2) promoter dengan hasil berupa peningkatan ekspresi ETS pada karsinoma adenum asinus prostat (Tindall dan Lonergan, 2011; Eipstein dan Lotan, 2015). Peningkatan ekspresi ETS transcription factor membuat sel normal prostat berubah menjadi invasif yang mungkin disebabkan karena peningkatan regulasi matriks metalloprotease (Yabluchanskiy et al., 2013; Eipstein dan Lotan, 2015).
Matriks metalloproteinase (MMP) yang telah dikenal peranannya sebagai suatu molekul penting dalam proses metastasis salah satunya adalah MMP-9.
Protein ini mendapat perhatian besar pada karsinoma adenum asinus prostat
karena kemampuannya merusak kolagen tipe IV dari sel epitel dan membran basal vaskular serta merangsang pelepasan VEGF (Kumar et al., 2015).
Hilangnya kromosom 8p23 pada region CUB dan Sushi multiple domains 1 gene (CSMD1) dihubungkan dengan karsinoma adenum asinus prostat stadium lanjut. Gen Retinoblastoma yang merupakan suatu tumor suppressor gene dan berada di dalam lokus kromosom 13q juga mengalami delesi. Kromosom lokus 10q yang mengandung tumor suppressor gene MX11 dan PTEN ikut hilang pada 45% kanker prostat. Perubahan molekuler ini selanjutnya akan berdampak terhadap perubahan morfologi sel prostat normal hingga menjadi karsinoma invasif dan berakhir pada metastasis sel-sel ganas (Eipstein dan Lotan, 2015).
Perubahan epigenetik berupa hipermetilasi gen gluthatione S-transferase (GSTP1) paling sering terjadi pada kanker prostat. Hipermetilasi ini menyebabkan down-regulation gen GSTP 1 yang penting untuk mencegah kerusakan luas akibat karsinogen. Gen-gen lain yang mengalami silencing akibat modifikasi histon pada karsinoma adenum asinus prostat adalah sejumlah tumor suppressor gene seperti PTEN, RB, p16/INK, MLH1 dan adenomatous polyposis coli (APC) (Eipstein dan Lotan, 2015).
Perkembangan karsinoma adenum asinus prostat juga dipengaruhi oleh peranan inherited polymorphism. Laki-laki dengan riwayat keluarga karsinoma adenum asinus prostat berisiko mengalami karsinoma adenum asinus prostat lebih tinggi dan cenderung timbul pada usia yang lebih muda. Germline mutation pada tumor suppressor gene Breast Cancer Antigen 2 (BRCA2) meningkatkan risiko seseorang sebanyak 20 kali lipat untuk mengalami karsinoma adenum
asinus prostat namun peningkatan risiko karsinoma adenum asinus prostat familial sebagian besar terjadi karena adanya variasi pada lokus-lokus gen tertentu. Beberapa penelitian juga mengidentifikasi sejumlah lokus yang berkaitan dengan peningkatan risiko terjadinya karsinoma adenum asinus prostat seperti 8q24. Sejumlah kandidat gen pada region ini terlibat pada innate immunity sehingga menimbulkan pemikiran bahwa inflamasi memiliki peranan dalam perkembangan karsinoma adenum asinus prostat seperti pada proses keganasan lainnya (Eipstein dan Lotan, 2015).
Seperti halnya kanker solid ditempat lain, karsinoma adenum asinus prostat juga memiliki perilaku agresif seperti invasi dan metastasis ke organ lain terutama metastasis ke tulang. Sebuah penelitian menunjukkan sekitar 80% pria yang meninggal karena karsinoma adenum asinus prostat mengalami metastasis ke tulang. Selain ke tulang, karsinoma adenum asinus prostat juga bisa mengalami metastasis ke hepar, paru dan otak. Metastasis karsinoma adenum asinus prostat melibatkan beberapa tahap diantaranya angiogenesis, migrasi lokal, invasi, intravasasi, sirkulasi dan ekstravasasi sel tumor kemudian kolonisasi dan angiogenesis di organ yang lain (Jin et al., 2011).
Secara umum proses invasi dan metastasis membutuhkan interaksi antara sel kanker dengan tiga lingkungan mikro yang berbeda yaitu organ primer, sirkulasi dan organ target dimana sel kanker metastasis dapat berkembang. Keberhasilan sel kanker untuk metastasis tergantung pada beberapa tahap salah satunya adalah degradasi matriks ekstraselular (ECM) (Kumar et al., 2015). Kelompok proteinase yang sangat berhubungan dengan proses degradasi ini adalah urokinase-type
plasminogen activator (uPA) dan matriks metalloproteinase seperti MMP-9.
Enzim ini berada dalam bentuk inaktif dan dapat diaktifkan oleh MMP-2 (Jin et al., 2012)
Sebuah penelitian mendapatkan, pada karsinoma adenum asinus prostat , kadar MMP-9 dan rasio MMP-2/MMP-9 terhadap inhibitornya (TIMP-1) relatif meningkat dibandingkan epitel prostat normal. Sejauh ini kadar dan rasio tersebut berhubungan dengan tingginya skor Gleason dan kelangsungan hidup penderita yang buruk. Sehingga baik MMP-9 maupun MMP-2 dikatakan dapat berfungsi sebagai marka prognosis pada karsinoma adenum asinus prostat (Jin et al., 2012).
2.2.5 Morfologi dan Grading Karsinoma Invasif
Secara histologis sebagian besar kanker prostat adalah adenokarsinoma. Terdapat beberapa temuan histologis yang mendasari diagnosis karsinoma adenum asinus prostat diantaranya arsitektur kelenjar, gambaran inti dan temuan histologis lain seperti invasi perineural. Arsitektur kelenjar tampak berukuran lebih kecil dibandingkan kelenjar normal dan dilapisi oleh selapis epitel kuboid atau kolumnar rendah tanpa lapisan sel basal. Kelenjar tampak kehilangan struktur branching dan papillary infolding serta tersusun lebih padat dan bertumpuk.
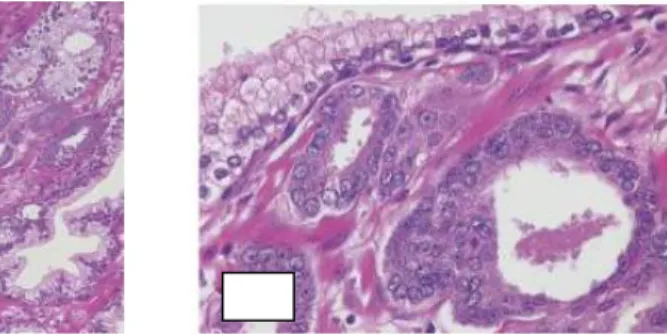
Sitoplasma sel tumor berwarna jernih pucat hingga amphophilic. Inti sel berukuran besar dan mengandung satu hingga lebih anak inti yang juga berukuran besar. Bentuk dan ukuran inti dapat bervariasi tapi secara umum pleomorfia inti pada sel tumor tidak tampak jelas. Mitosis juga jarang ditemukan (Gambar 2.4) (Eipstein dan Lotan., 2015).
Gambar 2.4 a. Fokus kecil karsinoma adenum asinus prostat diantara kelenjar jinak berukuran
besar. b. Kelenjar ganas berukuran kecil dengan inti besar, anak inti menonjol dan sitoplasma gelap, bila dibandingkan dengan kelenjar jinak besar (kiri atas)
(Eipstein dan Lotan, 2015)
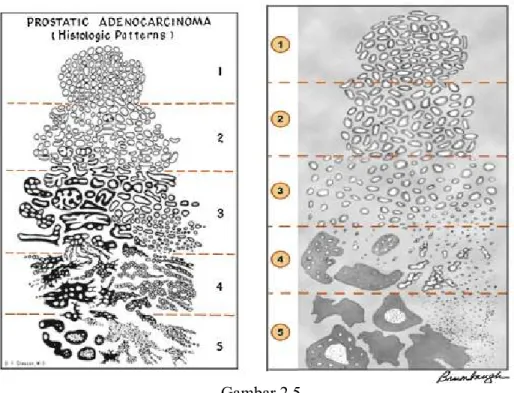
Derajat diferensiasi karsinoma adenum asinus prostat dinilai menggunakan Gleason Grading System. Sistim ini menilai karsinoma adenum asinus prostat berdasarkan pola arsitektur dari tumor (Tabel 2.1). Arsitektur primer (pola arsitektur terbanyak dalam tumor) maupun sekunder (pola arsitektur kedua terbanyak dalam tumor) dibagi menjadi 5 pattern yaitu pattern 1 hingga 5, dimana pattern 1 menunjukkaan diferensiasi paling baik sedangkan 5 menunjukkan diferensiasi paling buruk (Gambar 2.5). Grading tumor ditentukan dengan menjumlahkan dua pola yang terbanyak dan dilaporkan dalam bentuk Gleason score. Bila tumor memiliki satu pola arsitektur saja maka pola primer maupun sekunder diberikan pattern yang sama (Eipstein et al., 2011).
Tabel 2.1 Kriteria untuk Gleason Grading (Eipstein et al., 2011)
Pattern 1:
Nodul berbatas tegas dari asini berukuran sedang (lebih besar dari kelenjar di pattern 3), berbentuk bulat oval, uniform, terpisah namun tersusun rapat Pattern 2:
Menyerupai pattern 1, masih berbatas tegas namun pada tepi nodul dapat ditemukan infiltrasi yang minimal
Kelenjar-kelenjar tersusun lebih longgar dan tidak uniform seperti Gleason pattern 1
Pattern 3:
Discrete glandular unit
Kelenjar-kelenjar berukuran lebih kecil dari Gleason pattern 1 dan Gleason pattern 2
Menginfiltrasi ke dalam dan diantara asini prostat yang non-neoplastik Ukuran dan bentuk kelenjar yang sangat bervariasi
Pattern 4:
Kelenjar mikroasinar yang berfusi
Kelenjar-kelenjar tidak berbatas tegas dengan lumen kelenjar yang tidak terbentuk dengan baik
Kelenjar-kelenjar berbentuk kribiform Hipernefromatoid
Pattern 5:
Tidak ada diferensiasi glandular, terdiri dari lembaran solid, cord, atau sel- sel tunggal
Komedokarsinoma dengan nekrosis sentral dikelilingi oleh massa berbentuk papiler, kribiform atau solid
Gambar 2.5 Gambar skematik Gleason Grading System (Kiri: Gleason grading original;
kanan: Gleason grading modifikasi) (Brimo et al., 2013)
Gleason pattern 1 terdiri dari nodulus-nodulus yang berbatas tegas yang tersusun dari kelenjar-kelenjar prostat neoplastik yang uniform, single, terpisah- pisah, dan tersusun padat (Gambar 2.6) (Eipstein et al., 2011).
Gleason pattern 2 memiliki gambaran mikroskopis yang hampir menyerupai Gleason pattern 1 dan masih berbatas tegas namun terdapat infiltrasi minimal dari kelenjar-kelenjar prostat neoplastik pada tepi-tepi tumor ke jaringan sekitar.
Kelenjar-kelenjar prostat neoplastik tersebut tersusun lebih longgar dan dengan ukuran sedikit lebih bervariasi apabila dibandingkan dengan Gleason pattern 1 (Gambar 2.7) (Eipstein et al., 2011).
Karsinoma adenum asinus prostat dengan Gleason pattern 3 terdiri dari kelenjar-kelenjar prostat neoplastik tunggal, terpisah-pisah dengan ukuran dan
bentuk yang sangat bervariasi dan berukuran lebih kecil dari Gleason pattern 1 dan 2. Kelenjar-kelenjar neoplastik tersebut infiltratif diantara kelenjar prostat normal (Gambar 2.8) (Eipstein et al., 2011).
Gleason pattern 4 sebelumnya hanya terdiri dari kelenjar dengan bentukan hypernefromatoid saja. Namun saat ini ditambahkan pula kelenjar-kelenjar berbentuk kribiform, fused gland atau kelenjar dengan batas yang tidak jelas dengan lumen kelenjar yang tidak teratur. Kelenjar-kelenjar prostat neoplastik pada Gleason pattern 4 tidak lagi single dan terpisah-pisah seperti pada Gleason pattern 1 hingga 3 (Gambar 2.9) (Eipstein et al., 2011).
Karsinoma adenum asinus prostat dengan Gleason pattern 5 hanya memperlihatkan sedikit sekali bentukan kelenjar dan lebih banyak mengandung struktur lembaran solid, cords, sarang-sarang, atau sel-sel single. Tumor dengan sarang-sarang solid dan kelenjar kribiform dengan komedo nekrosis sentral diklasifikasikan ke dalam Gleason pattern 5. Sarang-sarang solid dengan mikroasinar yang samar atau dengan beberapa bentukan kelenjar juga dianggap masih merupakan bagian dari Gleason pattern 5 (Gambar 2.10) (Eipstein et al., 2011)
Gambar 2.6 Karsinoma adenum asinus prostat Gleason pattern 1 (Eipstein et al., 2011)
Gambar 2.7.
Karsinoma adenum asinus prostat Gleason pattern 2 (Eipstein et al., 2011)
Gambar 2.8
Karsinoma adenum asinus prostat Gleason pattern 3 (Eipstein et al., 2011)
Gambar 2.9 Karsinoma adenum asinus prostat Gleason pattern 4 (Eipstein et al., 2011)
Gambar 2.10 Karsinoma adenum asinus prostat Gleason pattern 5 (Eipstein et al., 2011)
Gleason grading system merupakan salah satu indikator prognostik kuat pad karsinoma adenum asinus prostat . Skor Gleason berhubungan dengan semua parameter patologis pada sediaan prostatektomi radikal, prognosis setelah prostatektomi radikal dan keluaran setelah radioterapi. Derajat diferensiasi juga sangat mempengaruhi pilihan terapi definitif, penanganan dan terapi spesifik yang akan diberikan (Eipstein et al., 2011)
Derajat diferensiasi histopatologi menurut WHO dikelompokkan menjadi empat sesuai dengan skor Gleason yaitu tumor dengan derajat yang tidak dapat ditentukan (GX), tumor berdiferensiasi baik dengan skor Gleason 2-4 (G1), tumor diferensiasi sedang dengan skor Gleason 5-6 (G2), dan tumor dengan diferensiasi buruk/tidak berdiferensiasi dengan skor Gleason 7-10 (Sakr et al., 2004).
Adapula yang mengelompokkan menjadi lima kelompok yaitu skor Gleason 2-6 (diferensiasi baik), skor Gleason 3+4=7 (diferensiasi sedang), skor Gleason
4+3=7 (diferensiasi sedang-buruk), skor Gleason 8 (diferensiasi buruk) dan skor Gleason 9-10 (tidak berdiferensiasi). Skor Gleason 7 dikatakan memiliki prognosis yang lebih buruk dibandingkan skor Gleason 5-6, namun memiliki prognosis yang lebih baik dibandingkan skor Gleason 8-10. Dikatakan pula skor Gleason 2-4, 5 atau 6 dapat diberikan terapi yang sama (Eipstein et al., 2011).
Sementara European Urological Association menggunakan Gleason score bersama-sama dengan klasifikasi TNM dan PSA untuk menentukan prognosis pada karsinoma adenum asinus prostat (Heidenreich et al., 2012).
2.2.6 Marka Biologi Karsinoma adenum asinus prostat
Prostatic specific antigen (PSA) adalah petanda biologi penting dan sering digunakan pada kanker prostat, baik sebagai screening maupun untuk memperkirakan kekambuhan penyakit. Petanda biologi penting lainnya seperti EZH-2(enhancer of zeste-2) yang berkaitan dengan hilangnya E-cadherin; alpha- methlyacyl-CoA racemase (AMACR) dan PCA (Eipstein dan Lotan, 2015). PSA dihasilkan oleh sel epitel pelapis duktus dan asini prostat dan secara normal disekresikan ke dalam sistem duktal(Bjartell et al., 2011). Gen PSA atau dengan nama lain Human Kallikrein 3 (KLK3) berlokasi pada kromosom 19q 13-4 dan androgen regulated transcription-nya dihasilkan melalui sintesa prekursor PSA asam amino 26 (Bjartell et al., 2011). Prekursor menjadi aktif karena pelepasan proteolitik dari a small amino-terminal fragment. Perubahan dari pro PSA menjadi PSA aktif membutuhkan exogenous prostatic protease seperti hK2, prostin (hK15), protease (hK4) atau trypsin (Sakr et al., 2004).
Fungsi PSA adalah untuk mencairkan cairan semen pada saat ejakulasi.PSA dapat dideteksi pada serum maupun sampel darah pasien. Pada pria normal, PSA yang beredar didalam serum hanya sedikit, dengan cut off point sebesar 4ng/ml (Eipstein dan Lotan, 2015). PSA ini berbentuk komplek PSA yang mengandung PSA bebas dan 2 kelompok utama protease inhibitor ekstraselular yang disintesis di dalam hepar. PSA merupakan suatu serin protease yang berikatan dengan α-1- anti-chymotrypsin (ACT) dan α-2-macroglobulin (AMG) di dalam serum (Bickers et al., 2009). Ikatan PSA dan ACT dapat dideteksi di dalam serum dengan menggunakan antibodi monoklonal. Selain pada kanker prostat, kadar PSA juga dapat meningkat pada kondisi prostatitis, infark dan saat ejakulasi (Eipstein et al., 2011).
Secara umum serum PSA berhubungan dengan besarnya ukuran tumor, stadium patologi yang sudah lanjut dan derajat tumor yang lebih tinggi. Meskipun sel tumor dengan derajat yang lebih tinggi menghasilkan lebih sedikit serum PSA dibandingkan tumor dengan derajat lebih rendah, secara keseluruhan , tumor dengan diferensiasi buruk memiliki tingkat serum PSA yang lebih tinggi karena ukuran tumor tersebut cenderung lebih besar (Eipstein et al., 2011). Namun pada tumor dengan derajat yang sangat tinggi dan diferensiasi buruk justru menunjukkan serum PSA yang sangat rendah sehingga diperlukan pemeriksaan tambahan terbaru seperti antibody anti-PSMA dan P501S (Bickers et al., 2009;
Eipstein et al., 2011).
Metode yang dapat diterapkan dalam menginterpretasi nilai PSA antara lain : menghitung rasio serum PSA dan volume kelenjar (PSA density), rasio PSA bebas
dan terikat di dalam serum, menentukan tingkat perubahan PSA dalam hitungan waktu (PSA velocity), dan menentukan nilai PSA yang disesuaikan dengan usia (Age Specific PSA). PSA density (PSAD) dikatakan lebih berguna dalam menetukan adanya kanker dibandingkan PSA saja. Hal ini dikarenakan sel-sel kanker menghasilkan lebih banyak PSA per gram jaringan(Eipstein dan Netto, 2010). Nilai PSAD normal sebesar ≤ 0,050 ng/ml/cm3, intermediate 0,051-0,099 ng/ml/cm3, dan patologis sebesar ≥ 0,1 ng/ml/cm3 . PSA velocity mengalami peningkatan pada kanker prostat dibandingkan prostat normal. Untuk mendapatkan hasil yang akurat serum PSA velocity harus dihitung paling tidak sebanyak tiga kali dalam kurun waktu 18 bulan (Sakr et al., 2004). Age Specific PSA dapat digunakan sebagai metode screening pada kanker prostat (Eipstein dan Netto, 2010). Kadar PSA usia 40-49 tahun nilai maksimalnya sebesar 2,5ng/ml, 50-59 tahun sebesar 3,5ng/ml, 60-69 tahun sebesar 4,5ng/ml dan 6,5ng/ml untuk usia 70-79 tahun. Peningkatan PSA sebanyak 0,75ng/ml pertahun menunjukkan perubahan yang signifikan antara pria tanpa kanker prostat dan pria dengan kanker prostat. Pemeriksaan dikatakan valid apabila pemeriksaan dilakukan paling tidak sebanyak tiga kali selama periode 1,5 hingga 2 tahun (Eipstein dan Lotan, 2015).
PSMA (Prostat Spesific Membrane Antigen) adalah suatu membrane-bound glycoprotein yang memiliki spesifisitas tinggi untuk mendeteksi adanya sel epitel prostat jinak maupun ganas. Antigen ini spesifik untuk mendiagnosis dan menentukan terapi kanker prostat karena terekspresi pada semua stadium tumor (Bjartell et al., 2011). Pemeriksaan PSMA dilakukan dengan menggunakan
antibodi monoklonal dimana peningkatan konsentrasinya berhubungan dengan kanker prostat (Sakr et al., 2004).
PSA merupakan petanda tumor yang paling sering digunakan. Nilai total PSA(tPSA), PSA bebas (fPSA) dan PSA kompleks dengan ACT adalah faktor prognostik independent untuk menentukan rata-rata lamanya hidup pasien. Kadar serum PSA merupakan prognostik kuat pada pasein yang mendapatkan radioterapi dan dapat memberikan nilai tambahan pada faktor prognostik independent lain seperti stadium dan derajat tumor. Peningkatan kadar PSA setelah prostatektomi radikal mengindikasikan adanya kemungkinan kekambuhan penyakit. Penelitian yang dilakukan oleh Kuriyama et al menemukan kadar serum PSA sebelum operasi memiliki kemampuan prediksi yang tinggi untuk menilai kekambuhan setelah dilakukan radikal prostatektomi (Buhmeida et al., 2006).
2.3 Matriks Metalloproteinase (MMP)
2.3.1 Struktur, Jenis dan Fungsi Umum MMP
Matriks metalloproteinase adalah kelompok endopeptidase yang tergantung pada zinc. Protein ini terlibat dalam degradasi matriks ekstraselular, serta berperan penting pada proses fisiologis maupun patologis.Pada keadaan fisiologis MMP membantu proses morfogenesis, angiogenesis, dan perbaikan jaringan. Sementara pada proses patologis, MMP terlibat pada terjadinya sirosis, arthritis dan kanker (Yabluchanskiy et al., 2013; Gong et al, 2014). Jerome Gross dan Charles Lapiere adalah orang yang pertama kali menemukan MMP pada metamorphosis ekor kecebong di tahun 1962. Triple helix kolagen didegradasi jika ekor kecebong
ditempatkan pada matriks kolagen kecebong yang bermetamorfosis (Loffek et al., 2011Ansari et al., 2013).
Matriks metalloproteinase mengandung beberapa komponen dengan fungsi yang berbeda-beda berupa :
1) Pro-peptida yang berperan menjaga enzim dalam bentuk tidak aktif.
Domain ini mengandung “Cystein switch” yakni residu cystein unik dan selalu terjaga, yang berinteraksi dengan zinc pada bagian aktif. Saat aktivasi enzim, bagian ini akan dipecah secara proteolitik oleh furin secara intraseluler atau MMP lainnya dan protease serin secara ekstraseluler.
2) Domain katalitik yang menjadi penanda struktural corak pengikat zinc. Ion Zn2+, diikat oleh tiga residu histidin membentuk area aktif. Area aktif ini berjalan secara horizontal melewati molekul sebagai celah dangkal dan berikatan dengan substrat.
3) Bagian penghubung (hinge region) merupakan sebuah jembatan lentur atau bagian penghubung yang terbuat dari 75 rantai asam amino berfungsi untuk menghubungkan domain katalitik dengan domain terminal-C.
Bagian ini sangat penting untuk menjaga stabilitas enzim.
4) Domain terminal-C yang menyerupai hemopexin ( hemopexin like-domain ) merupakan domain yang rangkaiannya
menyerupai protein serum hemopexin. Rantai polipeptida domain ini tersusun dalam empat lembaran β yang simetris. Permukaan datar yang disediakan oleh struktur ini dipercaya terlibat dalam interaksi antar protein