a
LAPORAN AKHIR
PENELITIAN UNGGULAN PERGURUAN TINGGI
The Development and Upgrading of Seven Universities In Improving the Quality and Relevance of
Higher Education in Indonesia
OPTIMALISASI POTENSI KERBAU DALAM USAHA PENINGKATAN KETAHANAN PANGAN DI ACEH DENGAN
METODE PEMBEKUAN SPERMATOZOA
Tahun ke 2 dari rencana 2 tahun
Dr. Kartini Eriani, M.Si 0021047001 Dr. Rosnizar, M.Sc 0009037102
Dibiayai oleh Direktorat Penelitian Pengabdian kepada Masyarakat, Direktorat Jenderal Penguatan Riset dan Pengembangan Kementerian Riset, Teknologi dan Pendidikan Tinggi sesuai
dengan Surat Perjanjian Penugasan Program Penelitian Nomor:
025/SP2H/LT/DRPM/II/2016 tanggal 17 Februari 2016
UNIVERSITAS SYIAH KUALA
OKTOBER, 2016
i
ii RINGKASAN
Kualitas dan morfologi abnormal spermatozoa kerbau aceh sangat perlu dilakukan untuk pelestarian plasma nutfah. Penelitian ini dilakukan untuk mengamati kualitas dan morfologi abnormal spermatozoa kerbau sampai ke tahap pembekuan dengan menggunakan 2 ekor kerbau pejantan. Penelitian dilaksanakan di Laboratorium Prosesing Spermatozoa Beku BIB, Saree dan Laboratorium Riset Biologi FMIPA Unsyiah. -karoten dan glutation merupakan suatu kelompok senyawa antioksidan yang memiliki peran dalam menangkap radikal bebas yang terbentuk akibat proses dari metabolisme spermatozoa pada saat pengenceran dan pembekuan berlangsung. Radikal bebas yang dihasilkan berupa suatu senyawa yang disebut dengan reactive oxygen species (ROS) yang dapat mengoksidasi lipid pada membran plasma sel spermatozoa. Tujuan penelitian ini adalah mengetahui perbandingan antioksidan -karoten dan glutation dengan berbagai konsentrasi yang ditambahkan ke dalam pengencer tris kuning telur terhadap kualitas semen beku kerbau lumpur. Penelitian ini menggunakan Rancangan Acak Lengkap (RAL) satu arah dengan 7 perlakuan (kontrol (P0); -karoten : 0,00625 g (P1), 0,0125 (P2) g, 0,025g (P3); glutation: 0,05 g (P4), 0,10 g (P5), 0,15 g (P6)) dan 3 ulangan.
Semen segar kerbau (Bubalus bubalis) diencerkan menggunakan modifikasi bahan pengencer tris kuning telur dengan penambahan antioksidan sesuai perlakuan dan diekulibrasi selama 4 jam. Kualitas spermatozoa dievaluasi sebanyak 3 kali, yakni pengenceran, ekuilibrasi, dan pasca thawing (pencairan kembali). Data yang diperoleh dari hasil penelitian ini dianalisa dengan ANAVA menggunakan SPSS. Perbedaan antar perlakuan diuji lanjut dengan uji beda nyata terkecil (BNT). Hasil penelitian menunjukkan bahwa penambahan -karoten dan glutation ke dalam bahan pengencer semen memberikan pengaruh yang nyata (p<0,05) dalam memperbaiki kualitas spermatozoa kerbau setelah pembekuan dilakukan. Persentase motilitas perlakuan P1 (44,3%), P4 (45,0%), P5 (40,3%); persentase spermatozoa hidup P1 (57,6%), P4 (48,0%), P5 (44,7%); persentase TAU P1 (46,0%), P4 (51,0), P5 (45,0%); dan persentase MPU P1 (57,0%), P4 (54,3%), P5 (51,0%). Konsentrasi antioksidan -karoten 0,0625 g (P1), glutation 0,05 g (P4) merupakan konsentrasi antioksidan terbaik dalam mempertahankan kualitas spermatozoa kerbau lumpur.
Kata kunci: Kerbau lokal Aceh (Bubalus bubalis), pembekuan spermatozoa, ROS, peroksidasi lipid, antioksidan, -karoten, glutation.
iii PRAKATA
Puji syukur penulis panjatkan kehadirat Allah SWT atas rahmat dan kasih sayang-Nya sehingga laporan kemajuan penelitian yang berjudul “Optimalisasi Potensi Kerbau dalam Usaha Meningkatkan Ketahanan Pangan di Aceh dengan Metode Pembekuan Spermatozoa” telah diselesaikan. Shalawat dan salam kepada Nabi Muhammad SAW yang telah membawa perubahan mendasar dalam ilmu pengetahuan.
Laporan kemajuan penelitian tahap satu guna memenuhi salah satu persyaratan dalam pelaksanaan penelitian yang didanai oleh 7in1 melalui Lembaga Penelitian Universitas Syiah Kuala. Laporan kemajuan penelitian ini disusun berdasarkan hasil penelitian yang dilaksanakan di Balai Inseminasi Saree.
Penulis banyak mendapatkan bantuan dan bimbingan dari berbagai pihak selama pelaksanaan penelitian yang masih terus berlangsung sampai saat ini. Oleh karenanya penulis mengucapkan terimakasih kepada:
1. Prof. Dr. Ir. H. Hasanuddin, M.S, selaku Ketua Lembaga Penelitian Universitas Syiah Kuala.
2. Dr. Tarmizi, M.Sc, selaku koordinator IDB Unsyiah yang mendanai penelitian 7in1 3. Syahrial, M.Si, selaku Kepala BIB Saree yang telah mengizinkan penulis untuk
penelitian di BIB Saree dengan segala fasilitas yang ada
4. Dr. Drh. Dasrul, M.Si, selaku staf ahli di BIB Saree yang telah membantu pelaksanaan penelitian ini
5. Serta seluruh teknisi lapangan dan Laboratorium BIB Saree yang tidak mungkin disebut satu persatu.
Harapan penulis semoga penelitian ini dapat kami selesaikan sesuai proposal yang kami ajukan dan dapat bermanfaat bagi perkembangan ilmu pengetahuan, masyarakat dan pemerintah.
Banda Aceh, 31 Oktober 2016
Penulis
iv
Bab 1. PENDAHULUAN ... 1
Bab 2. TINJAUAN PUSTAKA... ... 4 Bab 3. TUJUAN DAN MANFAAT... ... 8 Bab 4. METODE PENELITIAN... 9
Bab 5. HASIL YANG DICAPAI... 17
Bab 6. RENCANA TAHAPAN BERIKUTNYA... 33
Bab 7. KESIMPULAN DAN SARAN... 34
DAFTAR PUSTAKA ... 35
DAFTAR ISI Halaman Halaman Pengesahan ... i
Ringkasan ... ii
Prakata ... iii
Daftar Isi . . . i v Daftar Tabel ... v
1 BAB 1. PENDAHULUAN
Kerbau merupakan salah satu ternak yang dapat hidup dan berkembang baik di Daerah Aceh, namun sampai saat ini pemanfaatan ternak kerbau belum maksimal karena masih dipergunakan hanya untuk membajak sawah dan dikonsumsi dagingnya oleh sebahagian masyarakat. Padahal di Aceh populasi kerbau sangat banyak dibandingkan daerah lain dan memiliki keragaman genetik yang luar biasa karena kerbau tersebar di beberapa daerah seperti pulau Aceh, Simeulu, Aceh Selatan, Aceh Barat, Aceh Besar dan lain sebagainya. Berdasarkan data yang diperoleh, jumlah ternak kerbau di Indonesia pada tahun 2005 diperkirakan sebanyak 2.428.000 ekor (Ditjen Peternakan, 2005) dan tersebar di seluruh propinsi. Populasi tertinggi dijumpai di Propinsi NAD diikuti Sumatera Barat dan Sumatra Utara. Sehingga sudah selayaknya untuk memanfaatkan kerbau sebagai sumber protein seperti daging dan susu di daerah Aceh seperti yang sudah dimanfaatkan dibeberapa daerah lainya seperti Sumatra Barat.
Potensi kerbau yang belum dioptimalkan ini seharusnya dapat dioptimalkan untuk memenuhi berbagai tuntutan kebutuhan masyarakat, jika mendapat perhatian yang serius dari berbagai pihak yang terkait langsung sebagai praktisi di bidang peternakan. Seiring dengan itu juga untuk meningkatkan potensi ekonomi peternak di pedesaan dan sekaligus menjawab tantangan kemungkinan ekspor daging dan susu kerbau di masa yang akan datang.
Upaya yang harus ditempuh untuk menjawab tantangan tersebut adalah bagaimana meningkatkan populasi dalam waktu yang relatif singkat dan memperbaiki mutu genetik secara bertahap. Tantangan tersebut perlu didekati dengan penerapan teknologi di bidang peternakan yang telah berkembang dengan pesat dewasa ini, khususnya teknologi reproduksi. Penerapan teknologi reproduksi pada kerbau menjadi suatu hal yang penting, karena selama ini memang belum mendapat ruang yang memadai dari para peneliti. Hal ini ditandai oleh langkanya informasi hasil penelitian di bidang reproduksi pada kerbau.
Salah satu teknologi reproduksi yang cukup aplikatif dan efisien untuk diterapkan adalah teknologi Inseminasi Buatan (IB). IB merupakan teknik yang
cukup efektif dan ampuh untuk dimanfaatkan dalam upaya meningkatkan populasi dan mutu genetik kerbau, namun khusus pada kerbau belum begitu populer karena terdapat kendala pada plasma semen kerbau. Dengan demikian untuk meningkatkan kualitas spermatozoa perlu memodifikasi media pengencer dengan penambahan antioksidan dan krioprotektan di dalam pengencer semen.
Dalam proses pembekuan (kriopreservasi) semen, spermatozoa memperoleh perlakuan suhu yang ekstrim sangat rendah (-196˚C) yang dapat mengakibatkan dampak negatif terhadap spermatozoa. Pada suhu rendah di bawah titik beku akan terjadi perubahan-perubahan fisik dan kimiawi di dalam sel spermatozoa seperti terbentuknya kristal-kristal es dan meningkatnya konsentrasi elektrolit intraseluler, sehingga menyebabkan terjadinya kejutan dingin pada spermatozoa.
Untuk mengurangi pengaruh negatif ini, beberapa perlakuan dapat dicobakan seperti dengan menambahkan berbagai senyawa berupa krioprotektan dan antioksidan di dalam pengencer semen.
Dengan demikian, kerusakan spermatozoa selama proses kriopreservasi semen dapat diminimalkan, sehingga kualitas semen beku yang diperoleh lebih baik.
Ada dua jenis krioprotektan, yaitu krioprotektan ektraseluler berupa gula seperti laktosa, maltosa dan sukrosa tidak dapat memasuki sel, sehingga senyawa tersebut melindungi sel dengan cara membungkus membran plasma sel. Sedangkan krioprotektan intraseluler seperti gliserol, etilen glikol dan dimethyl sulfoxside (DMSO) dapat memasuki sel, sehingga dapat melindungi sel dari dalam dengan cara menyeimbangkan osmolaritas intra dan ekstra sel serta memodifikasi struktur permukaan kristal-kristal es sehingga tidak terlalu tajam (Supriatna dan Pasaribu, 1992). Penggunaan kedua jenis krioprotektan ini secara bersamaan dapat lebih optimal dalam melindungi sel spermatozoa dari kerusakan selama proses produksi semen beku ( Rizal, 2005).
Penggunaan laktosa dan gliserol sebagai krioprotektan telah banyak dilakukan untuk pembekuan semen pada berbagai hewan ternak. Namun pada kerbau belum diketahui konsentrasi yang optimum untuk mempertahankan kualitas semen.
Glutation dan β-karoten sebagai senyawa anti oksidan mampu mengikat radikal bebas hidroksil (OH-) dan singlet oksigen (O2-) (Tuminah 2000) yang sangat reaktif dan menyebabkan terjadinya peroksidasi lipid pada membran plasma sel, sehingga memungkinkan digunakan dalam pengenceran semen. Namun demikian, pemakaian glutation dan β-karoten sebagai anti oksidan di dalam pengenceran semen beku masih jarang sehingga memerlukan pengkajian yang lebih mendalam pada semen berbagai jenis hewan. Menurut Suryohudoyo (2000) glutation bersifat hidrofilik dan berperan dalam sitosol, sedangkan β-karoten bersifat lipofilik dan berperan pada membran plasma sel. Dengan demikian diharapkan kedua senyawa anti oksidan ini dapat secara optimal melindungi sel spermatozoa dari kerusakan akibat pemakaian senyawa oksidan dan senyawa radikal bebas selama proses pembekuan semen.
2 Permasalahan yang muncul yaitu semakin menurunnya produktivitas kerbau di Aceh karena terjadi penurunan mutu genetik. Hal ini terjadi karena belum dilakukan seleksi pejantan dan belum diaplikasikan bioteknologi reproduksi dalam rangka menjaga, mempertahankan serta meningkatkan mutu genetik kerbau di Aceh. Untuk itu perlu dilakukan seleksi kerbau pejantan yang dapat digunakan sebagai sumber material genetik
Kerbau pejantan unggul dapat dijadikan sebagai donor semen dengan tujuan memperbaiki mutu genetik, melalui pendekatan teknologi reproduksi. Spermatozoa yang dikoleksi dari pejantan unggul dapat dimanfaatkan secara optimal sebagai salah satu alternatif sumber spermatozoa untuk memenuhi kebutuhan dalam penerapan berbagai teknologi reproduksi.
Berdasarkan hal tersebut, maka sudah selayaknya penelitian ke arah pembekuan spermatozoa kerbau dalam rangka memberikan pelayanan IB bagi masyarakat peternak dilaksanakan. Sehingga Perguruan Tinggi memberi kontribusi aktif bagi perkembangan ilmu pengetahuan dan meningkatkan taraf hidup masyarakat.
BAB 2. TINJAUAN PUSTAKA 2.1 Krioprotektan
Krioprotektan merupakan suatu zat kimia non elektrolit yang berfungsi mereduksi letal proses kriopreservasi sel baik yang berupa efek larutan maupun pembentukan kristal es ekstraseluler dan intraseluler sehingga dapat menjaga viabilitas sel setelah kriopreservasi. Terdapat dua kelompok krioprotektan dilihat dari sisi fisika/kimia dan membran sel yaitu krioprotektan ekstraseluler dan intraseluler. Krioprotektan intraseluler yaitu krioprotektan yang dapat keluar masuk membran sel dan biasanya memiliki ukuran molekul yang kecil seperti gliserol, dimethylsulfosida (DMSO), etilin glikol (EG) dan 2 propanediol. Krioprotektan ekstraseluler biasanya dengan molekul besar sehingga tidak menembus membran sel seperti fruktosa, sukrosa, protein, lipoprotein, kuning telur, serum darah dan susu (Supriatna dan Pasaribu, 1991).
3 Dalam proses pembekuan (kriopreservasi) semen, spermatozoa memperoleh perlakuan suhu yang sangat ekstrim rendah. Perlakuan suhu ekstrim yang mencapai –196oC akan mengakibatkan dampak negatif terhadap spermatozoa. Pada suhu rendah di bawah titik beku akan terjadi perubahan- perubahan yang sangat hebat di dalam sel spermatozoa, serta terbentuknya kristal-kristal es. Kesemua faktor tersebut akan berakibat buruk terhadap sel spermatozoa, khususnya keutuhan membran plasma sel. Keutuhan membran plasma sel spermatozoa menjadi hal yang sangat penting karena membran plasma memiliki fungsi ganda terhadap sel. Selain berfungsi melindungi organel-organel sel dari perusakan mekanik, membran plasma juga berfungsi dalam mengatur lalu lintas zat-zat makanan dan elektrolit-elektrolit keluar masuk sel yang sangat dibutuhkan dalam proses metabolisme. Dengan demikian dapat dikatakan bahwa rusaknya membran plasma sel berarti awal dari proses berakhirnya kehidupan sel itu.
Untuk menjaga integritas membran plasma sel dari kerusakan selama proses produksi semen beku, maka ke dalam pengencer semen harus ditambahkan senyawa yang berfungsi melindungi membran plasma, sehingga dapat mengurangi efek negatif tersebut. Salah satu senyawa yang sudah dikenal dan telah diterapkan secara luas untuk mengatasi hal tersebut adalah krioprotektan. Selain itu dalam beberapa tahun belakangan ini telah dengan cukup intensif diterapkan pemakaian senyawa antioksidan di dalam pengencer semen. Seperti halnya dengan krioprotektan, pemakaian senyawa antioksidan juga dimaksudkan untuk mengurangi kerusakan spermatozoa selama proses kriopreservasi semen.
Dikenal dua golongan krioprotektan, yakni krioprotektan ekstraseluler dan intraseluler.
Krioprotektan ekstraseluler seperti laktosa, maltosa, dan sukrosa tidak dapat memasuki sel, sehingga mereka melindungi sel dengan cara “membungkus” membran plasma sel. Sedangkan krioprotektan intraseluler seperti gliserol, etilen glikol, dan dimethyl sulfoxide (DMSO) dapat memasuki sel, sehingga dapat melindungi sel dari dalam dengan cara menyeimbangkan osmolaritas intra dan ekstrasel serta memodifikasi struktur kristal-kristal menjadi lebih lembut. Penggunaan kedua jenis krioprotektan ini secara bersamaan diharapkan tercipta sinergi yang baik antara keduanya sehingga lebih optimal dalam melindungi sel spermatozoa dari kerusakan selama proses produksi semen beku.
2.2 Antioksidan
Telah dilakukan penelitian pembekuan spermatozoa pada domba garut menggunakan berbagai krioprotektan dan antioksidan untuk mempertahankan kualitas spermatozoa beku (Rizal, 2005). Hasil penelitian tersebut menunjukkan adanya hubungan positif antara kualitas spermatozoa dengan penambahan antioksidan.
4 Pemakaian laktosa dan gliserol sebagai krioprotektan telah dikenal luas dalam proses kriopreservasi semen berbagai jenis hewan ternak. Namun pada sapi aceh belum diketahui konsentrasi yang optimal dalam mempertahankan kualitas semen beku. Demikian pula halnya dengan penggunaan antioksidan glutation dan -karoten dalam pengencer semen yang belum lazim digunakan dalam proses kriopreservasi semen.
Glutation dan -karoten sebagai senyawa antioksidan dapat dipahami karena mampu membersihkan radikal bebas hidroksil (OH) yang sangat reaktif (Tuminah 2000) dan menyebabkan terjadinya peroksidasi lipida pada membran plasma sel, sehingga memungkinkan digunakan di dalam pengencer semen. Namun demikian, pemakaian glutation dan -karoten sebagai antioksidan di dalam pengencer semen beku masih jarang dibandingkan dengan antioksidan lain seperti vitamin C, vitamin E, butylated hydroxytoluene (BHT), dan lain-lain, sehingga memerlukan pengkajian yang lebih mendalam pada semen berbagai jenis hewan. Menurut Suryohudoyo (2000) glutation bersifat hidrofilik dan berperan di dalam sitosol, sedangkan -karoten bersifat lipofilik dan berperan pada membran plasma sel. Dengan demikian diharapkan bahwa dengan kombinasi antara kedua antioksidan ini dapat secara optimal melindungi sel spermatozoa dari kerusakan akibat serangan zat oksidan dan radikal bebas.
Demikian pula halnya dengan upaya kriopreservasi spermatozoa yang diaspirasi dari epididimis perlu dikaji lebih mendalam. Hal ini dimaksudkan sebagai antisipasi terhadap hewan- hewan jantan yang bermasalah dalam melakukan ejakulasi secara normal padahal hewan-hewan ini tergolong hewan langka atau memiliki mutu genetik yang unggul. Dengan metode ini pelestarian sumberdaya hewan yang mati secara mendadak masih dapat dilakukan, serta dapat juga diterapkan pada hewan-hewan liar dan buas.
Informasi-informasi seperti tersebut di atas belum tersedia dalam jumlah yang memadai pada kerbau Aceh, bahkan belum pernah dilaporkan. Hal inilah yang melandasi diadakannya penelitian ini.
2.3 Peta Jalan Penelitian
Penelitian ini bagian dari tujuan jangka panjang yaitu untuk mendapatkan spermatozoa beku dengan nilai ekonomi tinggi, dapat digunakan sebagai sumber material genetik kerbau jantan unggul, disamping publikasi. Penelitian ini mencakup pekerjaan seleksi kerbau pejantan unggul dan mengkoleksi spermatozoa untuk dibekukan. Pada penelitian ini akan dilakukan analisis kualitas dan viabilitas spermatozoa beku dan uji fertilitas spermatozoa.
5 Belum
- Belum pernah dilakukan - Keberhasilan belum optimal
Penelitian pada kerbau Aceh - Menggunakan kerbau lokal Jawa
Glutation dan β-karoten sudah berhasil untuk membekukan spermatozoa domba garut
Aceh merupakan daerah yang memiliki populasi kerbau terbanyak dan memiliki kualitas yang baik (Hasinah dan Handiwirawan, 2007)
Pemanfaatan kerbau di Aceh belum optimal (daging dan susu) Kebutuhan bahan pangan hewani belum tercukupi
Penambahan Antioksidan telah digunakan dalam pembekuan spermatozoa kerbau lumpur (Dasrul, 2005)
Penambahan Glutation bertingkat Penambahan β- karoten bertingkat
6 BAB 3. TUJUAN DAN MANFAAT
Secara umum hasil penelitian ini bertujuan untuk mendapatkan spermatozoa kerbau dalam bentuk beku yang dapat digunakan untuk inseminasi buatan guna meningkatkan mutu genetik dan populasi kerbau di Aceh. Selanjutnya hasil penelitian ini diharapkan akan bermanfaat bagi pemerintah daerah untuk memenuhi kebutuhan akan protein hewani
Kerbau pejantan unggul dapat dijadikan sebagai donor semen dengan tujuan memperbaiki mutu genetik, melalui pendekatan teknologi reproduksi. Spermatozoa yang dikoleksi dari pejantan unggul dapat dimanfaatkan secara optimal sebagai salah satu alternatif sumber spermatozoa untuk memenuhi kebutuhan dalam penerapan berbagai teknologi reproduksi.
Berdasarkan hal tersebut, maka sudah selayaknya penelitian ke arah pembekuan spermatozoa kerbau dalam rangka memberikan pelayanan IB bagi masyarakat peternak dilaksanakan. Sehingga Perguruan Tinggi memberi kontribusi aktif bagi perkembangan ilmu pengetahuan dan meningkatkan taraf hidup masyarakat.
Adapun keutamaan dari penelitian ini sehingga penting untuk dilakukan antara lain adalah:
1. Mengoptimalkan potensi kerbau dalam aspek meningkatkan mutu genetik dan populasi kerbau dengan cara seleksi pejantan dan membekukan semen (spermatozoa kerbau) sehingga dapat diperoleh stok spermatozoa beku yang unggul dengan cara inseminasi buatan.
2. Hasil penelitian ini diharapkan dapat memberikan manfaat kepada daerah Aceh khususnya petani dan peternak kerbau terhadap pengembangan kerbau sehingga dapat meningkatkan ketahanan pangan di Aceh. Selain itu, manfaat jangka pangjang yang diperoleh dari penelitian ini membuka peluang untuk ekspor.
3. Memberi wawasan terhadap pengembangan IB pada kerbau dengan penyediaan teknik kriopreservasi menggunakan pengencer yang baik.
4. Sebagai salah satu sarana alternatif yang dapat diterapkan dalam upaya meningkatkan populasi dan mutu genetik kerbau.
5. Menghasilkan publikasi ilmiah.
BAB 4. METODE PENELITIAN 4.1 Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan di Laboratorium Embriologi Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Syiah Kuala dan BIB Sare., Penelitian ini dimulai bulan Januari 2015 sampai Desember 2016.
7 4.2 Materi Penelitian
Hewan Percobaan
Hewan percobaan yang digunakan adalah empat ekor kerbau pejantan dewasa kelamin asal Simeulu dengan kondisi tubuh dan kesehatan yang baik, berat badan sekitar 400 – 500 kg dan umur sekitar 3 – 5 tahun sebagai sumber semen yang akan diuji kualitasnya. Pejantan dikandangkan secara individu dan diberikan pakan berupa rumput dan leguminosa setiap hari. Untuk menjaga kesehatan, pejantan dimandikan setiap minggu.
4.3 Bahan dan Alat
Tabel 1. Komposisi pengencer dasar
Bahan Jumlah
Tris(hydroxymethyl)aminomethanea (g) Asam sitrat-monohidratb (g)
D(-)Fruktosac (g) Kuning telurd (ml) Penisilin-Ge (IU/ml)
Streptomisin sulfatf (g/ml) Akuabidestilatag ad (ml)
3.32 1.86 1.37 20 1000 1000 100 Keterangan: a = Merck, Germany, cat. K27219882 003
b = Merck, Germany, cat. K22939944 632 c = Merck, Germany, cat. K27917123 038 d = Telur ayam ras
e = Meiji, Japan, cat. APG 0598 J f = Meiji, Japan, cat. SSL 1095 A g = Supracointra, Indonesia.
Bahan-bahan penelitian yang digunakan adalah: semen segar kerbau, bahan pengencer dasar (Tabel 1), krioprotektan laktosa-monohidrat (Merck, Germany, cat. K27650960 033) dan gliserol (Merck, Germany, cat. K28328694 044), antioksidan glutation (Merck, Germany, cat. 336 K20146490) dan -karoten (Merck, Germany, cat. K22585936 632), formaldehida (Merck, Germany, cat. K25421403 828), NaCl (Merck, Germany, cat. 3.9 K19690004) fisiologis, NaCl 3%, larutan hipoosmotik (Revell dan Mrode 1994), pewarna eosin B (Merck, Germany, cat. 509 K5003834), alkohol, nitrogen cair, KY jelly (Johnson and Johnson, Indonesia), dan lain-lain.
Proses kriopreservasi semen akan menggunakan peralatan sebagai berikut: vagina buatan/elektrik ejakulator, tabung spermatozoa, tabung reaksi, gelas erlenmeyer, gelas piala, gelas ukur, termometer, mikroskop cahaya, gelas objek, gelas penutup, pipet tetes, hemositometer, pH
8 meter, bunsen, timbangan mikro, konteiner N2 cair dan perlengkapannya, straw mini (0.25 ml), rak straw, penangas air, lemari es, styrofoam, dan lain-lain. Sedangkan untuk mengetahui angka fertilitas dilakukan dengan analisis progesteron plasma darah dan ultrasonografi (USG).
4.4 Prosedur Penelitian
Penelitian ini meliputi pembekuan semen hasil ejakulasi dan IB. Penelitian ini terdiri atas tiga tahap percobaan, sedangkan penelitian kedua terdiri atas satu tahap.
Percobaan Tahap Pertama
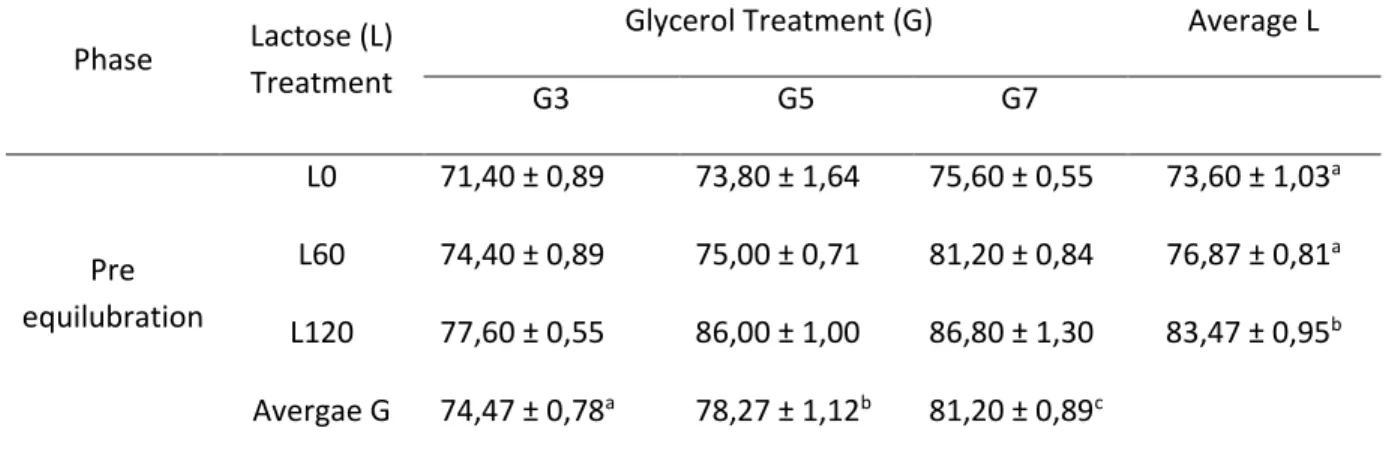
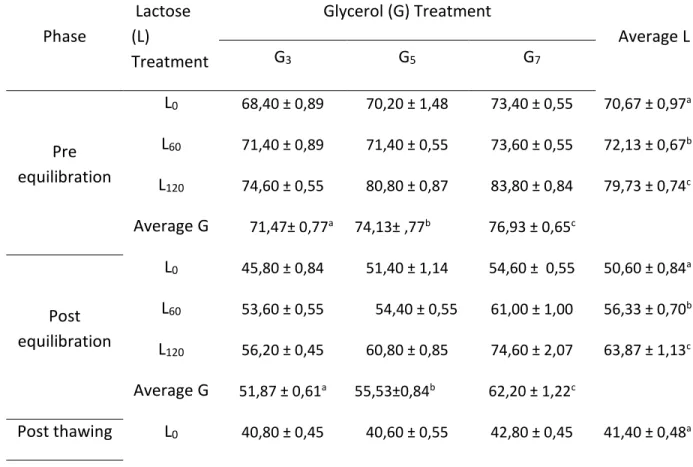
Percobaan tahap pertama ini dilakukan untuk menguji efektivitas krioprotektan ekstraseluler (laktosa) dan intraseluler (gliserol) terhadap kualitas semen beku.
1. Penampungan Semen
Semen ditampung menggunakan vagina buatan satu kali dalam satu minggu. Segera setelah ditampung, semen dinilai secara makroskopik dan mikroskopik. Penilaian makroskopik meliputi:
volume, warna, konsistensi (kekentalan), derajat keasaman (pH). Penilaian mikroskopik meliputi:
gerakan massa, persentase motilitas, persentase hidup, konsentrasi, persentase abnormalitas, dan integritas membran plasma spermatozoa, yakni persentase tudung akrosom utuh (TAU) dan persentase membran plasma utuh (MPU).
2. Pengenceran dan Ekuilibrasi Semen
Semen segar yang memenuhi syarat (motilitas 70%, konsentrasi 2000 juta sel per ml, gerakan massa ++ atau +++, dan abnormalitas <15%) diencerkan sesuai dengan perlakuan yang dicobakan. Perlakuan krioprotektan yang dicobakan adalah sebagai berikut:
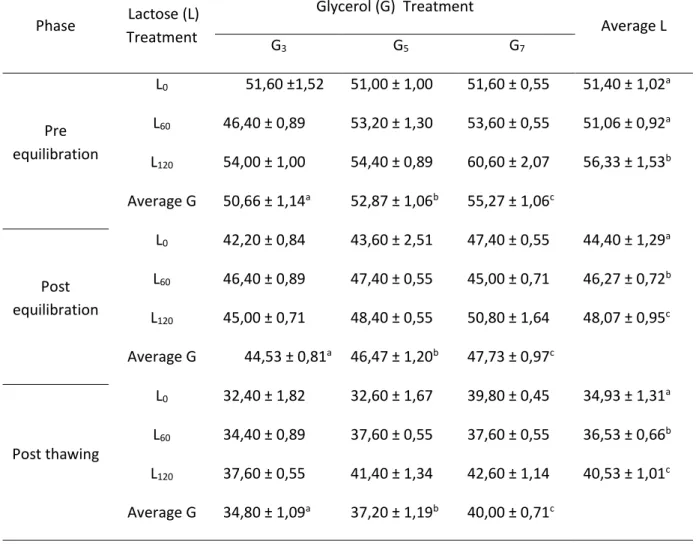
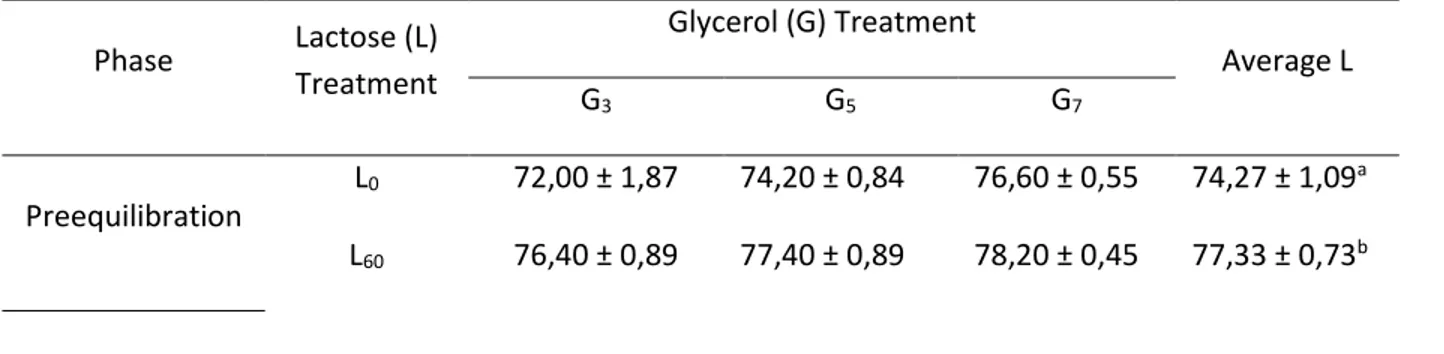
Krioprotektan ekstraseluler berupa laktosa dalam tiga tingkat konsentrasi, yakni: 0 mM (L0) (kontrol), 60 mM (L60), dan 120 mM (L120).
Krioprotektan intraseluler berupa gliserol dalam tiga tingkat konsentrasi, yakni: 3% (G3), 5%
(G5), dan 7% (G7).
Dengan demikian terdapat sembilan kombinasi perlakuan, yakni: L0G3, L0G5, L0G7, L60G3, L60G5, L60G7, L120G3, L120G5, dan L120G7.
Semen yang telah diencerkan dikemas ke dalam straw mini (0.25 ml) dengan konsentrasi 200 juta sperma motil per straw kemudian diekuilibrasikan di dalam lemari es pada sekitar 5oC selama tiga jam.
3. Kriopreservasi dan Thawing (Pencairan Kembali) Semen
9 Pembekuan semen dilakukan dengan cara meletakkan straw 10 cm di atas permukaan nitrogen cair (suhu sekitar –130oC) selama 15 menit. Kemudian straw dimasukkan ke dalam nitrogen cair (suhu sekitar –196oC) dan disimpan di dalam konteiner. Setelah disimpan satu minggu, setiap sampel straw masing-masing perlakuan dicairkan kembali untuk dinilai kualitasnya. Semen beku dicairkan kembali dengan cara memasukkan straw ke dalam air hangat bersuhu 37oC selama 30 detik.
Percobaan Tahap Kedua
Percobaan tahap kedua ini dilakukan untuk menguji efektivitas antioksidan glutation dan - karoten terhadap kualitas semen beku. Proses kriopreservasi semen menggunakan prosedur yang sama dengan percobaan tahap pertama. Semen diencerkan dengan komposisi pengencer terbaik dari hasil percobaan tahap pertama.
Perlakuan yang dicobakan dalam percobaan tahap kedua ini adalah sebagai berikut:
Pengencer tris terbaik pada percobaan tahap pertama (kontrol).
Penambahan glutation dengan tiga tingkat konsentrasi, yakni: 0.05 g (Glu0.05), 0.10 g (Glu0.10), dan 0.15 g (Glu0.15) per 100 ml pengencer.
Penambahan -karoten dengan tiga tingkat konsentrasi, yakni: 0.00625 g (Kt0.00625), 0.0125 g (Kt0.0125), dan 0.025 g (Kt0.025) per 100 ml pengencer.
Percobaan Tahap Ketiga
1. Uji Fertilitas Semen Beku
Percobaan ini dilakukan untuk menguji tingkat fertilitas semen beku empat perlakuan terbaik hasil percobaan tahap kedua dengan melakukan IB. Pada percobaan ini digunakan dosis IB sebesar 200 juta per straw.
Inseminasi dilakukan 18 – 24 jam setelah awal berahi. Hal ini dilakukan dengan pertimbangan bahwa ovulasi pada kerbau terjadi 26 jam setelah awal berahi, fertilisasi terjadi 2 – 3 jam setelah ovulasi dan waktu minimum yang dibutuhkan spermatozoa fungsional di dalam tuba fallopii sekitar 6 – 8 jam (Hunter 1985).
Diagnosis kebuntingan dilakukan dengan pengukuran kadar hormon progesteron serum setiap induk 16 hari setelah inseminasi (Reichenbach et al. 1996). Pemeriksaan kebuntingan dilakukan kembali 30 hari setelah inseminasi menggunakan ultrasonografi (USG).
4.5 Parameter yang Diamati
10 Parameter kualitas semen yang diamati adalah:
Persentase motilitas, persentase hidup, persentase TAU, dan persentase MPU spermatozoa masing- masing setelah tahap pengenceran, ekuilibrasi, dan thawing. Konsentrasi malondialdehida (MDA) setiap perlakuan percobaan tahap kedua dianalisis pada tahap setelah thawing.
Fertilitas semen beku (angka kebuntingan).
Persentase motilitas: persentase spermatozoa yang bergerak progresif. Ditentukan secara subjektif pada delapan pandang yang berbeda dengan mikroskop cahaya pembesaran 400 kali. Angka yang diberikan berkisar antara 0% hingga 100% dengan skala 5%.
Persentase hidup: persentase spermatozoa yang hidup. Ditentukan dengan menggunakan pewarnaan eosin (Toelihere 1993). Spermatozoa yang hidup ditandai oleh kepala yang berwarna putih, sedangkan yang mati ditandai oleh kepala yang berwarna merah dengan. Jumlah spermatozoa yang dievaluasi minimal 200.
Persentase TAU: persentase spermatozoa yang memiliki tudung akrosom utuh. Tudung akrosom utuh ditandai oleh ujung kepala spermatozoa yang berwarna hitam tebal apabila semen dipaparkan di dalam larutan NaCl fisiologis-1% formalin (modifikasi metode Saacke dan White 1972). Jumlah spermatozoa yang dievaluasi minimal 200.
Persentase MPU: persentase spermatozoa yang memiliki membran plasma utuh. Ditentukan dengan menggunakan metode osmotic resistance test (Revell dan Mrode 1994). Spermatozoa yang memiliki membran plasma utuh ditandai oleh ekor yang melingkar atau menggembung, sedangkan yang rusak ditandai oleh ekor yang lurus apabila semen dipaparkan di dalam larutan hipoosmotik dan diinkubasi pada suhu 37oC selama 60 menit. Spermatozoa dievaluasi dengan mikroskop pembesaran 400 kali.
Jumlah spermatozoa yang dievaluasi minimal 200.
Konsentrasi MDA: dianalisis dengan menggunakan pereaksi asam tiobarbiturat (TBA).
Fertilitas (angka kebuntingan): jumlah betina yang bunting dibagi jumlah betina yang diinseminasi dikali 100%. Ditentukan dengan cara analisis hormon progesteron dari sampel plasma darah betina 16 hari setelah inseminasi. Diagnosis kebuntingan dilakukan kembali pada hari ketiga puluh setelah inseminasi menggunakan USG.
4.6 Luaran Penelitian
Target penelitian adalah berhasil melakukan pembekuan spermatozoa kerbau dalam bentuk straw dan memiliki kualitas yang layak untuk diinseminasikan. Spermatazoa dalam bentuk beku ini dapat disimpan dalam waktu yang lama walaupun pejantan unggulnya sudah mati. Upaya ini
11 diharapkan dapat meningkatkan mutu genetik dan populasi kerbau di Aceh khususnya daerah yang banyak populasi kerbau seperti Daerah Simeulu, Aceh Barat dan lain-lain dalam meningkatkan ketahanan pangan terutama protein hewani dalam bentuk daging dan susu.
4.7 Indikator terukur
Indikator terukur dalam penelitian ini adalah: (1) persentase kebuntingan kerbau betina yang di IB dengan spermatozoa beku kerbau di Aceh meningkat, (2) spermatozoa beku dengan menggunakan berbagai krioprotektan dan penambahan antioksidan lebih baik, (3) persentase sel telur yang dibuahi meningkat.
4.8 Analisis Data
Percobaan tahap pertama dirancang ke dalam rancangan acak lengkap (RAL) pola faktorial 3 x 3. Jumlah penampungan semen sebanyak enam kali sebagai ulangan. Perbedaan antarperlakuan diuji dengan uji beda nyata terkecil (BNT) (Steel dan Torrie 1993).
Percobaan tahap kedua dirancang ke dalam RAL dengan tujuh perlakuan dan sembilan kali ulangan. Perbedaan antar perlakuan diuji dengan uji BNT (Steel dan Torri 1993). Data percobaan tahap ketiga dianalisis dengan metode chi square (X2) (Steel dan Torrie 1993) dengan model matematika sebagai berikut:
(Ri)(Cj) Eij = G
dimana: Eij = nilai harapan sel (i,j).
Ri = jumlah baris ke-i.
Cj = jumlah lajur ke-j.
G = jumlah umum.
r c (nij – Eij)2 X2 =
i=1 j=1 Eij
dimana: X2 = nilai pengamatan.
nij = nilai pengamatan dalam kelas peubah baris ke-i dan peubah lajur ke-j.
Eij = nilai harapan sel (i,j).
r = baris.
c = lajur.
db = (r-1)(c-1).
12
13 4.9 Fishbone Diagram
Bentuk umum diagram tulang ikan dalam mengindentifikasi masalah dalam penelitian ini adalah sebagai berikut :
Mendapatkan spermatozoa beku yang berkualitas dan meningkatkan keberhasilan kebuntingan kerbau
Pembekuan spermatozoa pada kerbau belum berhasil karena plasma semen mudah rusak.
Penampungan semen untuk seleksi tahap 1.
Pengenceran dan ekuilibrasi semen.
Kriopreservasi dan thawing semen
Penngenceran sperma terbaik dari hasil tahap 1 ditambahkan dengan bahan antioksidan
Uji fertilitas
Vagina buatan/ elektrik ejakulator
- Krioprotektan intraseluler - Krioprotektan
intraseluler
- Penambahan antioksidan glutation
- Penambahan antioksidan β- karoten
- Kualitas dan viabilitas - Uji kebuntingan
Kualitas dan viabilitas sperma
14 BAB 5. HASIL YANG DICAPAI
5.1. Kualitas Semen Segar
Semen segar yang digunakan dalam penelitian ini diperoleh dari kerbau lumpur jantan berumur 3,5 tahun yang dijaga kondisi kesehatannya sehingga layak digunakan sebagai pejantan.
Semen yang memenuhi standar selanjutnya diproses lebih lanjut untuk dilakukan proses ekuilibrasi dan kriopreservasi. Parameter yang diamati untuk menilai baik buruknya suatu semen meliputi volume, warna, konsistensi, konsentrasi, gerakan massa, motilitas, spermatozoa hidup dan abnormalitas. Hasil analisa kualitas semen kerbau lumpur yang diperoleh dalam penelitian ini dapat dilihat pada Tabel 5.1.
Tabel 5.1. Hasil rata-rata evaluasi semen segar kerbau
Parameter Hasil
Volume (ml) 1,16 0,21
Warna Putih susu
Konsistensis Sedang
Konsentrasi (106/ml) 1267 26,60
Gerakan massa ++
Motilitas (%) 81,8
Spermatozoa hidup (%) 82,2
Abnormalitas (%) 10,2
Keterangan: (++) = gerakan massa spermatozoa seperti gelombang-gelombang kecil, tipis, jarang, kurang jelas dan bergerak lamban.
Berdasarkan Tabel 5.1 dapat dilihat bahwa semen kerbau lumpur yang digunakan telah memenuhi standar sebagai semen yang layak untuk diencerkan dan disimpan sebagai semen beku.
Warna semen segar semen kerbau lumpur yang diperoleh adalah putih susu. Menurut Herdis (1997), semen kerbau lumpur memiliki warna krem, krem keputihan atau putih susu dengan konsistensi sedang. Hasil rataan volume semen segar kerbau lumpur yang diperoleh adalah 1,16 ml. Menurut Toelihere (1993), volume semen pada tiap individu dipengaruhi oleh bobot hidup, pakan, individu, libido, frekuensi penampungan dan bangsa. Volume ejakulat kerbau lumpur di Indonesia berkisar antara 0,05 ml sampai dengan 2,5 ml (Toelihere, 1985). Rataan nilai konsentrasi, gerakan massa, motilitas, spermatozoa hidup dan abnormalitas secara berurutan adalah 1267 juta/ml ++, 81,8%, 82,2% dan 10,2 %. Konsentrasi spermatozoa kerbau lumpur umumnya lebih rendah dibandingkan
15 dengan sapi. Konsentrasi spermatozoa kerbau lumpur di Indonesia berkisar antara 200 – 1000 juta per ml (Toelihere, 1985). Gerakan massa kerbau lumpur di Indonesia berkisar antara 1(+) sampai 3 (+++).
Abnormalitas berbagai jenis spermatozoa kerbau lumpur di Indonesia berkisar antara 9,93 0,12 % pada kerbau lumpur mehsana (Bhavsar et al., 1990) dan 6,52 0,43% pada kerbau lumpur murrah (Krishna dan Rao, 1987).
5.2. Kualitas Spermatozoa Dalam Tiga Tahapan Pengolahan Semen 5.2.1. Motilitas Spermatozoa
Motilitas spermatozoa sangat mempengaruhi keberhasilan fertilisasi spermatozoa dengan ovum, baik yang dilakukan dengan teknik perkawinan secara langsung maupun menggunakan teknik inseminasi buatan. Penambahan antioksidan dengan konsentrasi yang optimum ke dalam bahan pengencer tris kuning telur dapat mempertahankan kualitas semen beku kerbau lumpur. Hal ini dapat dilihat dari motilitas spermatozoa yang ditambahkan antioksidan lebih tinggi dibandingkan dengan kontrol setelah thawing dilakukan. Menurut Toelihere (1993), semen beku yang layak digunakan dalam program inseminasi buatan (IB) harus memiliki persentase motilitas paling sedikit 40% . Hasil pengamatan motilitas spermatozoa pada setiap perlakuan dapat dilihat pada Tabel 5.2.
Tabel 5.2. Rata-rata persentase motilitas spermatozoa kerbau lumpur dalam penambahan berbagai konsentrasi -karoten dan glutation
Perlakuan Tahap pengolahan semen (%)
Pengenceran Ekuilibrasi Pasca thawing P0 66,7±2,89a 56,7±5,77ab 39,0±1,73c P1 70,0±0,00ab 61,3±3,21b 44,3±5,13de P2 70,0±0,00ab 46,7±11,5a 32,0±1,73b P3 68,3±2,89ab 63,0±4,58b 0,00±0,00a P4 70,0±0,00ab 62,3±8,73b 45,0±4,00e P5 70,6±1,15b 61,7±2,89b 40,3±1,15cde P6 68,3±2.89ab 62,3±4,04b 39,3±1,52cd
16 Keterangan: Huruf dalam kolom yang sama menunjukkan perbedaan yang nyata (p<0,05)
P0 = glutation/ -karoten 0 g; P1,P2,P3 = -karoten 0.00625 g, 0,0125 g, 0,025 g; P4,P5,P6 = glutation 0,05 g, 0,10 g, 0,15 g.
Secara statistik (p<0,05), perlakuan pengenceran menunjukkan hasil bahwa P0 (kontrol) tidak berbeda nyata terhadap perlakuan P1 ( -karoten 0,00625 g), P2 ( -karoten 0,0125 g), P3 ( -karoten 0.025 g), P4 (glutation 0,05 g), dan P6 (glutation 0,15 g), tetapi berbeda nyata terhadap P5 (glutation 0,10 g). P1 menunjukkan nilai persentase motilitas sebesar 66,7 % dan P5 sebesar 70,6%. P1 memperoleh nilai persentase motilitas terendah sedangkan P5 memperoleh nilai persentase motilitas tertinggi dibandingkan dengan perlakuan lainnya. Diduga pada perlakuan kontrol, telah terjadi sedikit reaksi peroksidasi akibat berkontaknya semen dengan lingkungan yang mengandung oksigen.
Menurut Siregar (1992), 90% oksigen akan masuk ke dalam mitokondria dan terlibat di dalam proses respirasi sel untuk meghasilkan ATP dengan mengikutsertakan enzim - enzim respirasi. Dalam proses respirasi, oksigen mengalami reduksi dalam rangkaian elektron transfer di dalam mitokondria. Proses reduksi oksigen tersebut dapat menghasilkan radikal bebas dan hidrogen peroksida sebagai senyawa antara. Kemudian dinyatakan bahwa radikal bebas bersifat sangat reaktif, jika bereaksi dengan asam lemak tak jenuh akan menghasilkan lipid peroksida. Dalam hal ini, antioksidan akan berperan dalam mendonorkan satu elektronnya untuk senyawa radikal agar senyawa tersebut menjadi lebih aman.
Namun, pada perlakuan kontrol tidak ada penambahan antioksidan sehingga diduga tidak ada agen yang dapat mencegah reaksi peroksidasi ini. Akibatnya terjadi kerusakan membran plasma beserta mitokondria sehingga produksi ATP menipis yang menyebabkan turunnya daya motil spermatozoa.
Selanjutnya pada perlakuan ekuilibrasi diperoleh hasil bahwa perlakuan P0 (56,7%) tidak berbeda nyata terhadap semua perlakuan, sedangkan P2 (46,7%) menunjukkan hasil yang berbeda nyata terhadap semua perlakuan. Nilai persentase motilitas terhadap semua perlakuan menurun pada tahap ini. Diduga reaksi antara radikal bebas terutama ROS terhadap membran plasma spermatozoa semakin tinggi. Menurut Kardivel et al. (2008), senyawa ini meningkatkan peroksidasi lipida terhadap kandungan asam lemak tak jenuh yang terdapat pada membran plasma. Proses penghasilan energi melalui mekanisme respirasi sel dan jumlah spermatozoa yang mati merupakan sumber utama dihasilkannya senyawa ROS (Vishwanath dan Shannon, 1997).
Setelah dilakukannya proses ekuilibrasi, selanjutnya dilakukan proses pembekuan atau kriopreservasi. Fungsi kedua tahapan yang dilakukan sebelum kriopreservasi dilaksanakan adalah untuk menurunkan suhu pengencer secara bertahap. Penurunan suhu secara bertahap ini berfungsi
17 agar spermatozoa sedikitnya mampu beradaptasi pada suhu yang sangat rendah ketika proses pembekuan dilakukan. Berdasarkan hasil analisa data terlihat bahwa penambahan antioksidan - karoten dan glutation dengan konsentrasi yang tepat dapat mempertahankan motilitas spermatozoa kerbau lumpur pasca thawing.
Penambahan -karoten dengan konsentrasi 0,00625 g (P1) merupakan perlakuan konsentrasi -karoten terbaik dibandingkan dengan kontrol dan -karoten pada konsentrasi lainnya. Hal ini dapat dilihat dari nilai persentase motilitas spermatozoa meningkat (44,3%) dibandingkan dengan kontrol (39,0%), P2 (44,3%) dan P3 (0,00%). Ketiga perlakuan ini berbeda nyata secara statistik (p<0,05). - karoten merupakan senyawa kimia yang mampu menangkal radikal bebas dengan cara memutus rantai reaksi peroksidasi lipid. Namun, kadar -karoten yang berlebih juga dapat berakibat buruk bagi tubuh.
Menurut Schweigert dan Zucker (1988), kadar -karoten di dalam sel cukup rendah dan dapat bersifat toksik jika konsentrasinya berlebih. Hasil menunjukkan bahwa penambahan -karoten dengan konsentrasi terendah dapat meningkatkan motilitas spermatozoa. Sedangkan penambahan -karoten dengan konsentrasi tertinggi (P3) yakni 0,025 g dapat menghilangkan daya motil spermatozoa. Rata- rata motilitas spermatozoa (P3) pasca thawing adalah 0,00%. Rizal (2005), melaporkan bahwa penambahan -karoten dengan konsentrasi 0,002 g (56,78%) ke dalam bahan pengencer tris kuning telur menunjukkan persentase motilitas spermatozoa domba garut terbaik dibandingkan dengan konsentrasi yang lainnya (0,001 g (56,78%) dan 0,003 g (53,33%)). Gunawan et al. (2012), menyatakan hal yang sama bahwa penambahan -karoten dengan konsentrasi 0,002 % dapat mempertahankan motilitas spermatozoa sapi bali pasca thawing. Sedangkan penambahan -karoten pada konsentrasi lebih dari 0,003 % mengakibatkan penurunan kualitas spermatozoa sapi bali. Hasil ini mendukung pernyataan peneliti bahwa penambahan -karoten yang berlebih akan menurunkan motilitas spermatozoa. Nilai persentase motilitas terbaik pada perlakuan -karoten dalam penelitian ini lebih rendah dibandingkan dengan nilai persentase motilitas perlakuan -karoten pada penelitian Rizal (2005). Namun, nilai persentase motilitas pada perlakuan -karoten terbaik pada penelitian ini telah memenuhi standar semen beku (motilitas minimum 40%) yang dapat diproses untuk inseminasi buatan. Penambahan glutation dengan konsentrasi 0,05 g (P4) merupakan perlakuan konsentrasi glutation terbaik dibandingkan kontrol, glutation 0,10 g (P5) dan glutation 0,15 g (P6). Hal ini dapat dilihat dari meningkatnya motilitas spermatozoa pada P4 (45,0%) dibandingkan dengan kontrol (39,0%), P5 (40,3%) dan P6 (39,3%). Hasil ini yang sama dilaporkan oleh Rizal (2005) bahwa penambahan glutation sebesar 0,05 g (52,78%) ke dalam media pengencer tris kuning telur dapat meningkatkan motilitas spermatozoa domba garut dibandingkan dengan kontrol (46.67%). Ansari et
18 al. (2011), melaporkan hal yang serupa, penambahan glutation dengan konsentrasi 0,05 mM (56,7%) pada media pengencer tris kuning telur secara nyata mampu mempertahankan motilitas spermatozoa kerbau lumpur pasca thawing dibandingkan dengan kontrol (51%). Hasil persentase yang penelitian Herdis (2012) juga menunjukan hasil yang sama, yaitu penambahan glutation dengan konsentrasi 0,05 g dan 0,10 g ke dalam bahan pengencer andromed dapat meningkatkan motilitas spermatozoa sapi bali. Penambahan glutation sebesar 0,05 mM (53,33%) dan 0,10 mM (56,67%) juga mampu mempertahankan motilitas spermatozoa sapi bali (Syarifuddin, 2012).
Penambahan baik -karoten maupun glutation dengan persentase berlebih menunjukkan persentase motilitas yang lebih rendah. Hal ini diduga karena terganggunya tekanan osmotik pada membran plasma spermatozoa. Menurut Gunawan (2012), senyawa antioksidan dalam jumlah banyak akan semakin meningkatkan tekanan osmotik larutan pengencer dan spermatozoa kurang mampu untuk beradaptasi sehingga berakibat buruk terhadap berlangsungnya proses metabolisme spermatozoa.
5.2.2. Spermatozoa hidup
Spermatozoa hidup merupakan salah satu parameter penting yang harus diamati untuk menentukan kualitas semen. Selain motilitas spermatozoa, semen yang memiliki kualitas yang baik adalah semen yang memiliki jumlah spermatozoa hidup yang tinggi. Salah satu upaya untuk menjaga daya hidup spermatozoa selama proses kriopreservasi dilakukan adalah dengan menambahkan antioksidan ke dalam bahan pengencer semen. Penambahan ini bertujuan untuk melindungi spermatozoa dari radikal bebas yang dapat merusak membran plasma sel spermatozoa. Penambahan antioksidan dengan konsentrasi yang optimum dapat menjaga atau meningkatkan daya hidup spermatozoa. Persentase hidup mati spermatozoa pada berbagai macam perlakuan dapat dilihat pada Tabel 4.3.
Tabel 5.3. Rata-rata persentase spermatozoa hidup kerbau lumpur dalam penambahan berbagai konsentrasi -karoten dan glutation
Perlakuan Tahap pengolahan semen
Pengenceran Ekuilibrasi Pasca thawing
P0 95,7±4,04d 83,0±12,1b 45,3±7,50bc
P1 94,8±3,01d 82,7±4,61b 57,6±0,057d
P2 63,3±5,77a 46,7±11,5a 38,7±7,50b
P3 74,7±5,03b 72,3±6,80b 0,00±0,00a
P4 87,3±0,57cd 77,5±12,9b 48,0±4,35c
19
P5 89,0±0,00cd 74,3±4,04b 44,7±1,52bc
P6 84,3±7,23c 75,7±5,13b 43,7±5,50bc
Keterangan: Huruf dalam kolom yang sama menunjukkan perbedaan yang nyata (p<0,05)
P0 = glutation/ -karoten 0 g; P1,P2,P3 = -karoten 0.00625 g, 0,0125 g, 0,025 g; P4,P5,P6 = glutation 0,05 g, 0,10 g, 0,15 g.
Pengamatan terhadap spermatozoa hidup dilakukan dengan cara membuat preparat ulasan dengan penambahan zat warna berupa eosin. Spermatozoa yang berwarna merah menandakan spermatozoa yang mati, sedangkan spermatozoa hidup tidak menyerap warna (Toelihere, 1993).
Perlakuan pada pengenceran secara statitistik (p<0,05) menunjukkan hasil bahwa P0 (kontrol) tidak berbeda nyata terhadap P1 ( -karoten 0,0625 g), P4 (glutation 0,05 g) dan P5 (glutation 0,10 g), tetapi berbeda nyata terhadap P2 ( -karoten 0,0125 g), P3 ( -karoten 0,025 g) dan P6 (glutation 0,15 g).
Diduga konsentrasi antioksidan yang terlalu tinggi menimbulkan efek tingginya tekanan osmotik.
Menurut Rizal (2005), penambahan senyawa antioksidan dalam jumlah yang lebih banyak akan semakin meningkatkan tekanan osmotik larutan pengencer dan hal ini kurang dapat diadaptasi dengan baik oleh spermatozoa.
Selanjutnya pada pengamatan perlakuan ekuilibrasi menunjukkan penurunan persentase daya hidup dibandingkan sebelumnya. Perlakuan P2 ( -karoten 0,0125 g) secara statistik (p<0,05) berbeda nyata terhadap semua perlakuan. Nilai persentase daya hidup pada P2 paling kecil (46,7%) diantara perlakuan yang lain. Diduga -karoten pada konsentrasi ini belum memadai untuk mempertahankan daya hidup spermatozoa selama ekuilibrasi berlangsung.
Setelah penurunan suhu secara bertahap dilakukan, selanjutnya semen di bekukan dan di- thawing beberapa saat kemudian. Berdasarkan hasil amatan menunjukkan bahwa penambahan antioksidan -karoten dan glutation dengan dosis yang tepat mampu mempertahankan daya hidup spermatozoa kerbau. Dalam penelitian ini konsentrasi dari antioksidan -karoten yang mampu mempertahankan daya hidup spermatozoa adalah 0,00625 g (P1) dengan persentase daya hidup spermatozoa sebesar 57,6 %. Sedangkan pada -karoten 0,0125 g (P2) dan -karoten 0,025 g (P3) mengalami penurunan. P2 menunjukkan persentase daya hidup sebesar 38,7 % dan P3 0,00%. Hal ini diduga karena konsentrasi -karoten pada P2 dan P3 terlalu tinggi sehingga meningkatkan tekanan osmotik yang dapat menggangu proses metabolisme spermatozoa. Selain itu, konsentrasi antioksidan yang sangat tinggi dapat merubah pH pengencer menjadi menurun (semakin asam). Rizal (2005), melaporkan bahwa penambahan -karoten dengan konsentrasi 0,002 % memberikan nilai persentase
20 terbaik dibandingkan kontrol (52,33%), -karoten 0,001 % (52,89%) dan -karoten 0,003 % (53.33%). Gunawan et al. (2012), melaporkan bahwa penambahan antioksidan -karoten dengan konsentrasi 0,002 % (68,33%) mampu mempertahankan persentase daya hidup spermatozoa sapi dibandingkan dengan kontrol (51,67%). Hal yang sama juga dilaporkan oleh Siahaan et al. (2012) bahwa penambahan -karoten sebesar 0,002% (62,0%) mampu meningkatkan daya hidup spermatozoa sapi bali. Konsentrasi -karoten terbaik dari hasil penelitian Rizal (2005) dan Siahaan et al. (2012) lebih rendah dibandingkan dengan konsentrasi -karoten yang digunakan dalam penelitian ini. Sehingga memungkinkan persentase daya hidup spermatozoa akan semakin meningkat bila konsentrasi -karoten diturunkan.
-karoten memiliki kemampuan memproteksi liposom (suatu vesikel yang memiliki fosfolipida bilayer tunggal) dari kerusakan akibat serangan singlet oksigen. Salah satu turunan ROS (reactive oxygen species) seperti singlet oksigen merupakan senyawa yang menjadi penyebab menurunnya kualitas spermatozoa pasca thawing. Singlet oksigen merupakan salah satu jenis senyawa oksigen reaktif yang dapat merusak sel dengan cara menimbulkan reaksi rantai peroksida lipida (Oshima et. al., 1993). Sikka (1996) mengatakan spermatozoa mamalia kaya akan asam lemak tak jenuh dan mudah terpengaruh oleh kelompok oksigen ROS yang mampu menurunkan motilitas dan meningkatkan kerusakan morfologi spermatozoa.
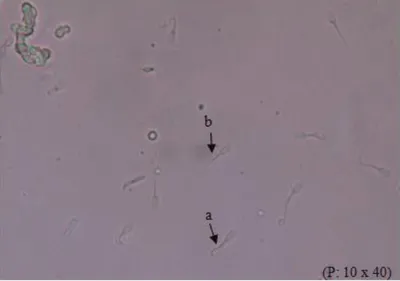
21 Gambar. 4.1. Spermatozoa hidup (a) dan mati (b)
Penambahan antioksidan glutation dengan konsentrasi yang tepat ke dalam media pengencer semen juga secara nyata dapat meningkatkan daya hidup spermatozoa. Penambahan glutation dengan konsentrasi 0,05 g (P4) merupakan konsentrasi glutation yang efektif meningkatkan daya hidup spermatozoa. Persentase yang diperoleh pada P4 (48,0%). Perlakuan glutation 0,10 g (P5) juga menunjukkan nilai yang cukup baik (44,7%) dan secara statistik tidak berbeda nyata meskipun persentase spermatozoa hidup P4 lebih tinggi dibandingkan P5. Hasil ini didiukung oleh penelitian Rizal (2005) bahwa penambahan glutation dengan konsentrasi 0,05 g (58,78%) dan 0,10 g (59,67%) memberikan hasil terbaik untuk mempertahankan daya hidup spermatozoa domba garut. Syarifuddin et. al (2012), menambahkan bahwa penambahan glutation ke dalam bahan pengencer andromed dengan konsentrasi 0,5 mM (56,67%) dan 1 mM (63,33%) nyata dapat mempertahankan daya hidup spermatozoa sapi bali setelah thawing lebih tinggi dibandingkan perlakuan kontrol (53%). Berikut juga dilaporkan oleh Gunawan et. al (2012), penambahan glutation ke dalam pengencer andromed dengan konsentrasi 1 mM dapat mempertahankan daya hidup spermatozoa sapi bali (68,33%) dibandingkan dengan kontrol (51,67%). Menurut Triwulanningsih et al. (2003), glutation dapat mengkontrol homeostatik baik di dalam maupun di luar sel. Glutation adalah antioksidan sulfhydril (- SH), antitoksin dan kofaktor enzim. Berdasarkan sifat antioksidan yang dapat menetralkan radikal bebas, maka penambahan glutation sebagai antioksidan primer diharapkan dapat mengurangi kerusakan membran plasma yang mengakibatkan kematian spermatozoa dalam jumlah yang tinggi serta meningkatkan persentase daya hidup spermatozoa.
5.2.3. Tudung Akrosom Utuh (TAU)
Akrosom merupakan bagian anterior dari kepala spermatozoa yang sangat esensial bagi spermatozoa dalam kemampuannya membuahi sel telur. Benturan spermatozoa yang terjadi akibat proses fertilisasi spermatozoa dengan ovum pada saat membuahi sel telur difasilitasi oleh akrosom.
Akrosom berfungsi untuk melindungi kepala spermatozoa yang mengandung materi genetik agar tidak rusak pada saat proses fertilisasi terjadi. Menurut Bailey et al. (2000), keutuhan akrosom merupakan bagian vital dalam proses fertilisasi. Akrosom utuh merupakan salah satu evaluasi terpenting untuk menentukan keberhasilan pembuahan. Penurunan persentase akrosom utuh berhubungan dengan menurunnya antioksidan serta meningkatnya produksi ROS (reactive oxygen species). Persentase tudung akrosom utuh pada setiap perlakuan dapat dilihat pada Tabel 5.4.
22 Tabel 5.4. Rata-rata persentase TAU spermatozoa kerbau lumpur dalam penambahan berbagai konsentrasi -karoten dan glutation
Perlakuan Tahap pengolahan semen
Pengenceran Ekuilibrasi Pasca thawing
P0 84,5±7,79c 67,0±6,92b 44,7±4,61b
P1 88,3±9,01c 86,0±6,50c 46,0±1,00b
P2 63,3±5,77a 46,7±11,5a 44,0±12,1b
P3 69,7±4,50ab 67,0±7,00c 0,00±0,00a
P4 90,7±5,50c 78,3±1,15bc 51,0±7,00b
P5 87,3±0,057c 71,7±2,89b 45,0±0,00b
P6 80,05±7,85bc 70,7±3,05b 43,7±3,05b
Keterangan: Huruf dalam kolom yang sama menunjukkan perbedaan yang nyata (p<0,05)
P0 = glutation/ -karoten 0 g; P1,P2,P3 = -karoten 0.00625 g, 0,0125 g, 0,025 g; P4,P5,P6 = glutation 0,05 g, 0,10 g, 0,15 g.
Spermatozoa yang memiliki tudung akrosom rusak ditandai dengan warna kehitaman dibagian ujung kepala spermatozoa setelah dipaparkan dengan larutan NaCl fisiologis 1% formaldehid (formasaline). Larutan formasaline dapat memfiksasi enzim-enzim yang terdapat di vesikel akrosom bagian ujung kepala spermatozoa sehingga menyebabkan munculnya warna kehitaman (Rizal, 2005).
Berdasarkan hasil analisa statistik diperoleh hasil bahwa pada perlakuan pengenceran, penambahan -karoten dengan konsentrasi 0,0125 g (P2) berbeda nyata terhadap perlakuan kontrol, -karoten 0,00625 g (P1), glutation 0,05 g (P4), glutation 0,10 g (P5) dan glutation 0,15 g (P6). - karoten 0,025 g (P2) berbeda nyata terhadapa semua perlakuan, tetapi tidak berbeda nyata terhadap P6. Perlakuan P2 (63,3%) dan P3 (69,7%) merupakan perlakuan dengan hasil persentase TAU terkecil dibandingkan dengan perlakuan yang lainnya. Diduga pada perlakuan ini, konsentrasi yang digunakan merupakan konsentrasi yang tidak tepat untuk mencegah peroksidasi lipida terjadi.
Selanjutnya perlakuan pada ekuilibrasi, nilai persentase TAU semakin menurun untuk semua perlakuan. Diduga hal ini terjadi akibat konsumsi oksigen oleh spermatozoa yang mengakibatkan terbentuknya zat sisa metabolisme. Zat sisa metabolisme ini merupakan salah satu sumber dihasilkannya radikal bebas. Secara statistik (p<0,05), P2 berbeda nyata terhadap semua perlakuan.
Nilai persentase TAU P2 (46,7%) merupakan nilai persentase TAU terendah diantara semua perlakuan. Diduga pada konsentrasi ini, antioksidan -karoten tidak memadai dalam menghambat peroksidasi lipida oleh radikal bebas. Menurut Gunawan et al.(2012), penambahan antioksidan - karoten dalam jumlah yang tidak memadai belum mampu mencegah terjadinya peroksidasi lipida.
Setelah melewati tahapan penurunan suhu pada ekuilibrasi, selanjutnya semen dibekukan.
Tahapan ini merupakan bagian yang paling kritis diantara kedua tahapan sebelumnya. Perubahan suhu
23 yang drastis mengakibatkan spermatzoa mengalami cold shock, terbentuknya kristal es, serta peroksidasi lipida. Timbulnya peroksidasi lipid selama proses pembekuan semen mempengaruhi kerusakan pada sel spermatozoa. Menurut Maxwell dan Watson (1996), kerentanan spermatozoa terhadap peroksidasi lipid disebabkan oleh fosfolipid membran plasma sel spermatozoa mamalia mengandung asam lemak tak jenuh yang sangat rentan terhadap serangan radikal bebas dan merangsang terjadinya reaksi autokatalitik yang akan merusak ikatan gandanya Sehingga dibutuhkan antioksidan sebagai agen untuk meredam aktifitas radikal bebas.
Penambahan antioksidan -karoten 0,00625 g (P1) menunjukkan persentase TAU yang lebih tinggi dibandingkan kontrol (P0) dan kedua perlakuan -karoten yang lain. Persentase TAU pada P1 sebesar 46,0% dan P0 adalah sebesar 44,7 %. Secara statistik (p<0,05) keduanya tidak berbeda nyata.
Sedangkan pada kedua perlakuan -karoten lainnya, yakni -karoten 0,0125 g (0,0125 g) dan - karoten 0,025 g (P3) menunjukkan persentase TAU yang lebih rendah. Nilai persentase keduanya secara beurutan adalah 44,0 % dan 0,00 %. Diduga konsentrasi antioksidan yang terlalu tinggi mempengaruhi tekanan osmotik pada sel spermatozoa. Rizal (2005), melaporkan bahwa penambahan -karoten 0,002% (51,00 %) menunjukkan nilai persentase TAU lebih tinggi dibandingkan dengan kontrol (47,11%). Menurut Rizal dan Herdis (2010), pemakaian -karoten sebagai salah satu zat tambahan pengencer semen belum banyak dilaporkan. Tetapi dikarenakan fungsinya sebagai salah satu senyawa antioksidan, maka pemakaian senyawa tersebut untuk meningkatkan kualitas semen sangat memungkinkan. Suryohudoyo (2000), menambahkan bahwa -karoten merupakan salas satu senyawa antioksidan yang larut dalam lemak dan berfungsi memutus reaksi rantai peroksidasi lipida yang terjadi pada membran plasma sel.
Penambahan antioksidan glutation memberikan hasil yang tidak jauh berbeda. Pada tahapan pengenceran, glutation 0,05 g (P4) menunjukkan nilai persentase TAU yang lebih tinggi dibandingkan perlakuan kontrol. Nilai persentase TAU P4 sebesar 51 % sedangkan pada perlakuan kontrol sebesar 44,7 %, namun keduanya tidak berbeda nyata secara statistik (p<0,05). Hasil ini didukung oleh penelitian Rizal (2005), penambahan glutation 0,05 g (54,22%) dan glutation 0,10 g (54,00%) mampu meningkatkan persentase TAU spermatzoa domba garut dibandingkan dengan kontrol (47,11%).
Ansari (2011), menambahkan bahwa penambahan glutation 0,5 Mm (86 ,3 %) mampu mempertahankan persentase TAU kerbau lumpur pakistan dibandingkan kontrol (84,0%) setelah 3 hari disimpan pada suhu 5 .
Proses penampungan dan pengolahan semen dilakukan, terjadi kontak antara semen dengan lingkungan yang mengandung oksigen. Hal ini menyebabkan meningkatnya proses metabolisme sel
24 akibat konsumsi oksigen sel yang tinggi. Produk sampingan hasil dari proses ini adalah zat sisa metabolisme yang bersifat radikal. Menurut Rizal (2005), pada tahapan ini antioksidan berperan dalam meredam daya rusak radikal bebas dengan cara mencegah terjadinya atau memutus rantai reaksi peroksidasi lipida pada membran plasma sel spermatozoa.
5.2.4. Membran Plasma Utuh (MPU)
Membran plasma utuh merupakan salah satu parameter yang digunakan untuk menguji kualitas spermatozoa. Membran plasma adalah salah satu bagian sel yang sangat mudah terkena dampak radikal bebas. Radikal bebas seperti singlet oksigen merupakan senyawa yang sangat reaktif karena mengalami kekurangan elektron. Senyawa ini reaktif terhadap lipid yang merupakan komponen dasar penyusun membran sel. Antioksidan berperan dalam meredam reaksi antara singlet oksigen dengan membran plasma sel dengan cara mendonorkan elektronnya sehingga mengubah singlet oksigen menjadi senyawa yang relatif lebih aman. Persentase membran plasma utuh terhadap setiap perlakuan dapat dilihat pada Tabel 5.5.
Tabel 5.5. Rata-rata persentase MPU spermatozoa kerbau lumpurdalam penambahan berbagai konsentrasi -karoten dan glutation
Perlakuan Tahap pengolahan semen
Pengenceran Ekuilibrasi Pasca thawing
P0 86,3±8,94bc 83,7±8,37de 47,7±3,17c
P1 94,1±3,61c 88,3±0,76d 57,0±2,00c
P2 63,3±5,77a 46,7±11,5a 38,7±7,50b
P3 63,0±11,2a 59,3±8,62b 0,00±0,00a
P4 88,7±0,057bc 68,7±1,15bc 54,3±8,14c
P5 78,0±8,67b 72,0±1,7cd 51,0±1,00c
P6 85,7±3,05bc 78,0±5,56cde 50,3±5,50c
Keterangan: Huruf dalam kolom yang sama menunjukkan perbedaan yang nyata (p<0,05)
P0 = glutation/ -karoten 0 g; P1,P2,P3 = -karoten 0.00625 g, 0,0125 g, 0,025 g; P4,P5,P6 = glutation 0,05 g, 0,10 g, 0,15 g.
Spermatozoa yang memiliki membran plasma utuh ditandai dengan bagian kepala spermatozoa yang menggembung dan bagian ekor spermatozoa yang melengkung ke atas setelah dipaparkan dengan larutan hipoosmotik. Sperma yang berada dalam lingkungan hipotonik akan mengalami penggembungan sesaat karena cairan dari lingkungan bergerak masuk ke dalam sel. Hal ini diakibatkan karena konsentrasi kadar zat terlarut di dalam sel lebih tinggi dibandingkan di lingkungan sekitar sel.
25 Perlakuan pengenceran, diperoleh hasil bahwa -karoten 0,0125 g (P2) dan -karoten 0,025 g (P3) berbeda nyata terhadap semua perlakuan. Kedua perlakuan ini memiliki nilai persentase MPU terendah diantara perlakuan yang lainnya, yaitu 63,3% dan 63,0 %. Diduga pada konsentrasi ini, antioksidan -karoten tidak mampu bekerja dengan optimal dalam menangkal radikal bebas. Hipotesis yang bisa dimunculkan yakni tingginya konsentrasi -karoten di dalam pengencer menyebabkan meningginya tekanan osmotik pada sel spermatozoa.
Setelah semen diekulibrasi selama 4 jam, selanjutnya semen dievaluasi kembali. Secara statistik (p<0,05) diperoleh hasil bahwa, -karoten 0,0125 g (P2) berbeda nyata terhadap semua perlakuan. Nilai persentase yang diperoleh (46,7%) lebih rendah dibandingkan dengan kontrol (83,7%). Penambahan -karoten pada konsentrasi ini tidak jauh lebih baik dibandingkan dengan semen tanpa penambahan -karoten. Diduga penambahan -karoten pada konsentrasi ini tidak berfungsi dalam menangkal radikal bebas, tetapi memberikan pengaruh buruk terhadap metabolisme spermatozoa. Seperti laporan Gunawan et al. (2012), penambahan -karoten dalam jumlah yang sedikit belum mampu mencehag reaksi peroksidasi lipida, sebaliknya penambahan -karoten dalam jumlah yang berlebih dapat mengakibatkan tinggi tekanan osmotik di dalam bahan pengencer.
Selanjutnya semen dibekukan ke dalam dengan menggunakan nitrogen cair setelah di freezing selama 15 menit. Kemudian setelah beberapa saat semen di thawing. Pada tahap ini terlihat bahwa nilai persentase MPU semakin menurun akibat pengaruh suhu yang terlalu rendah (-196 ). Menurut Amann (1999), terdapat dua tipe kerusakan pada sel akibat kejutan dingin, yakni secara langsung dan tak langsung. Kerusakan langsung akan mempengaruhi struktur dan fungsi seluler, sedangkan keursakan tidak langsung sulit untuk diamati dan baru terlihat setelah proses pencairan kembali (thawing). Pengaruh utama dari kejutan dingin terhadap sel spermatozoa adalah penurun motilitas dan daya hidup, perubahan permeabilitas dan perubahan komponen lipid pada membran. Berdasarkan hasil pengamatan, diperoleh bahwa penambahan -karoten 0,0125 g (P2) dan 0,025 g (P3) berbeda nyata terhadap semua perlakuan. Hasil terbaik dapat dilihat pada penambahan -karoten 0,00625 g (P1), glutation 0,05 g (P4) dan glutation 0,10 g (P5).
Penambahan -karoten dengan konsentrasi 0,00625 g (P1) merupakan penambahan antioksidan -karoten dengan konsentrasi terbaik. Hasil persentase MPU P1 (57,0%) lebih tinggi dibandingkan dengan P0 (47,7%), P2 (38,7%) dan P3 (0,00%). Pengenceran sperma tanpa penambahan -karoten diduga belum mampu mempertahankan kualitas MPU spermatzoa. Hal ini disebabkan karena tidak adanya agen yang mampu mempertahankan keutuhan membran plasma spermatozoa. Menurut Pryor et al. (2002), -karoten merupakan salah satu senyawa antioksidan yang
26 baik dalam menangkal radikal bebas. -karoten memiliki kecenderungan tinggi untuk mengoksidasi, lebih dari lemak makanan yang paling jenuh. Suryohudoyo (2000), menambahkan bahwa -karoten bekerja dengan cara memutuskan rantai reaksi antara senyawa radikal dengan membran plasma spermatozoa.
Gambar 4.2. Membran plasma (a) utuh dan (b) tidak utuh
Penambahan glutation dengan konsentrasi yang tepat juga menunjukkan nilai persentase MPU yang baik. Penambahan glutation 0,05 g (P4) dan 0,10 g (P5) merupakan perlakuan glutation dengan konsentrasi yang optimum. Nilai persentase yang diperoleh pada perlakuan P4 (54,3%) lebih tinggi dibandingkan dengan kontrol (P0), glutation P5 (51,0%), dan glutation 0,15 g (P6). Hasil ini didukung oleh penelitian Rizal (2005), penambahan glutation 0,05 % (58,22%), mampu mempertahankan persentase nilai MPU domba garut dibandingkan dengan kontrol (48,44%). Ansari (2011) menambahkan bahwa penambahan glutation dengan konsentrasi 0,5 mM (61,7%) ke dalam bahan pengencer tris kuning telur menunjukkan persentase MPU kerbau lumpur pakistan yang lebih tinggi dibandingkan kontrol (50,0) dan glutation 0,10 mM (61,7%). Triwulanningsih et al. (2003) juga melaporkan bahwa penambahan glutation ke dalam bahan pengencer tris kuning telur dalam kadar yang tepat mampu mempertahankan kualitas membran plasma utuh sapi FH. Konsentrasi glutation yang paling optimal dalam mempertahankan membran plasma utuh sapi FH adalah 0,5 mM (69,75 %) lebih tinggi dibandingkan kontrol (66,01%) dan 1,0 mM (68,38%). Total nilai persentase parameter yang diamati lebih rendah dibandingkan dengan penelitian terhadap semen dari berbagai maca jenis