LAPORAN AKHIR
PENELITIAN UNGGULAN PERGURUAN TINGGI
Pengaruh Ko-ekspresi Sec4p Pichia pastoris Terhadap Tingkat Sekresi
-Amilase Saccharomycopsis fibuligera oleh
Pichia pastoris rekombinan
Tahun ke-1 dari rencana 2 tahun
Ketua Peneliti
Dr. Shabarni Gaffar, M.Si. (NIDN: 0025047105) Anggota Peneliti
Dr. Yeni Wahyuni Hartati (NIDN: 0024097101)
DIBIAYAI OLEH:
DIPA BLU Nomor 023.04.2.189726/2013Tanggal 5 Desember 2012 Sesuai dengan Keputusan Rektor Unpad No. 7632/UN6.RKT/KU/2013
Tanggal 1 Februari 2013
UNIVERSITAS PADJADJARAN
NOVEMBER, 2013
3 DAFTAR ISI LEMBAR PENGESAHAN... 2 DAFTAR ISI ... 3 DAFTAR GAMBAR... 5 DAFTAR TABEL... 6 DAFTAR LAMPIRAN... 7 RINGKASAN ... 8 PRAKATA... 10 BAB I. PENDAHULUAN ... 11
1.1. Latar belakang dan permasalahan yang akan diteliti ... 11
1.2. Permasalahan yang akan dikaji ... 12
BAB II. KAJIAN PUSTAKA ... 14
2.1. Jalur sekresi protein ... 13
2.2. Eksositosis ... 15
2.3. Protein Sec4p ... 16
2.4. Peran Sec4p dalam penargetan dan penambatan vesikel sekresi ... 18
2.5. Jalur sinyal dari Sec4p dalam mengarahkan vesikel ke proses fusi ... 21
2.6. Sistem ekspresi P. pastoris dan vektor pPIC3.5K untuk P. pastoris ... 22
BAB III. TUJUAN DAN MANFAAT PENELITIAN... 25
3.1. Tujuan Khusus... 26
3.2. Penelitian pendahuluan yang telah dilakukan... 27
BAB IV. METODE PENELITIAN ... 29
4.1. Disain Penelitian ... 29
4.2. Metoda Penelitian ... 29
4.2.1. Amplifikasi SEC4 P. pastoris dan subkloning dalam E. coli... 29
4.2.2. Karakterisasi pJET1.2-SEC4 rekombinan ... 30
4.2.3. Penentuan urutan Nukleotida SEC4 dalam pJET1.2─SEC4 ... 32
4.2.4. Kloning fragmen SEC4 menggunakan vektor pPIC3.5K ... 32
4.2.5. Penentuan urutan nukleotida SEC4 dalam pPIC3.5K-SEC4... 33
4.2.6. Transformasi P. pastoris menggunakan plasmid pPIC3.5K-SEC4... 33
4.2.7. Seleksi dan karakterisasi transforman P. pastoris... 34
4
4.2.8. Analisis aktivitas -amilase... 35
4.2.9. Karakterisasi -amilase dan Sec4p intra dan ekstraselular... 35
4.3. Bagan alir penelitian... 36
BAB V. HASIL YANG DICAPAI... 38
5.1. Amplifikasi SEC4 P. pastoris dan subkloning dalam E. coli... 38
5.2. Konstruksi plasmid pPIC3.5K-SEC4 dan kloning dalam E. coli... 39
5.3. Isolasi plasmid pPIC3.5K-SEC4 dari E. coli TOP10F’ dan linearisasi... 42
5.4. Uji kuantitatif P. pastoris WT-68 dan WT-78... 44
5.5. Transformasi P. pastoris menggunakan plasmid pPIC3.5K-SEC4... 45
5.6. Seleksi dan karakterisasi transforman P. pastoris ... 46
5.7. Ekspresi -amilase oleh P. pastoris rekombinan... 47
5.8. Aktivitas -amilase hasil ekspresi... 49
5.9. Kadar protein... 51
VII. KESIMPULAN DAN SARAN... 54
7.1. Kesimpulan... 54
7.2. Saran... 54
DAFTAR PUSTAKA ... 55
5 DAFTAR GAMBAR
Gambar 2.1 Diagram jalur sekresi protein... 14
Gambar 2.2 Siklus aktivasi/inaktivasi dan translokasi protein Rab... 17
Gambar 2.3 Tahapan lanjut eksositosis pada membran plasma... 19
Gambar 2.4 Kompleks eksosis... 20
Gambar 2.5 Model jalur sinyal Sec4p dalam peranannya meregulasi proses eksositosis... 22
Gambar 2.6 Peta vektor pPIC3.5K... 24
Gambar 2.7 Urutan multiple cloning sites pada vektor pPIC3.5K... 24
Gambar 3.1 Amplikon SEC4... 27
Gambar 4.1 Bagan alir penelitian tahap 1... 36
Gambar 4.2 Bagan alir penelitian tahap 2... 36
Gambar 5.1 Produk PCR gen SEC4 dan koloni transforman E. coli [pJET1.2-SEC4]... 38
Gambar 5.2 Hasil restriksi plasmid pJET1.2-SEC4 dengan enzim EcoRI... 39
Gambar 5.3 Hasil restriks pJET1.2-SEC4 dan vektor pPICK3.5K dengan enzim EcoR1... 39
Gambar 5.4 Koloni E. coli [pPIC3.5K-SEC4] yang diremajakan... 40
Gambar 5.5 Peta plasmid pPIC3.5K-SEC4 hasil konstruksi... 40
Gambar 5.6 Homologi urutan nukleotida SEC4 hasil subkloning dengan urutan SEC4 nomor NCBI... 41
Gambar 5.7. Hasil isolasi plasmid pPIC3.5K-SEC4... 42
Gambar 5.8 Hasil linearisasi plasmid pPIC3.5K-SEC4... 44
Gambar 5.9 Hasil uji aktivitas -amilase secara kualitatif... 44
Gambar 5.10 Koloni P. pastoris[ALP1-SEC4] hasil transformasi... 45
Gambar 5.11 Koloni P. pastoris[ALP1-SEC4] pada media YPD padat... 46
Gambar 5.12 Seleksi fenotipe His+... 47
Gambar 5.13 Hasil peremajaan transforman P. pastoris... 47
Gambar 5.14 Densitas optik P. pastoris [ALP1-68/SEC4] dan [ALP1-78/SEC4]... 49
Gambar 5.15 Hasil reaksi penentuan aktivitas dengan metoda DNS... 50
6 DAFTAR TABEL
Tabel 5.1 Pengaruh ko-ekspresi Sec4p terhadap level ekspresi -amilase... 52
Tabel L1. Penentuan serapan standar glukosa dengan metoda DNS... 61
Tabel L.2 Aktivitas P. pastoris [ALP1-68/SEC4]... 62
Tabel L.3 Aktivitas P. pastoris [ALP1-68]... 62
Tabel L.4 Aktivitas P. pastoris [ALP1-78]... 62
Tabel L.5 Aktivitas P. pastoris setelah transformasi [ALP1-78/SEC4]... 62
Tabel L.6 Kurva Standar Protein... 64
Tabel L.7 Kadar protein supernatan P. pastoris [ALP1-68]... 65
Tabel L.8 Kadar protein supernatan P. pastoris [ALP1-68/SEC4]... 66
Tabel L.9 Kadar protein supernatan P. pastoris [ALP1-78]... 66
Tabel L.10 Kadar protein supernatan P. pastoris [ALP1-78/SEC4]... 66
7 DAFTAR LAMPIRAN
Lampiran 1. Instrumen penelitian... 57
Lampiran 2. Evaluasi capaian luaran kegiatan... 58
Lampiran 3. Sertifikat seminar nasional... 59
Lampiran 4. Abstrak seminar nasional... 60
Lampiran 5. Penentuan Serapan Standar Glukosa... 61
Lampiran 6. Penentuan Aktivitas -amilase dengan Metoda DNS... 62
Lampiran 7. Penentuan kadar protein... 64
8 RINGKASAN
Produksi -amilase rekombinan oleh sistem ekspresi P. pastoris dapat dimanfaatkan untuk berbagai industri. Enzim -amilase dibutuhkan oleh industri pangan, tekstil, farmasi dan bioetanol. Inang ekspresi yang dapat mensekresikan protein keluar sel lebih disukai karena memudahkan proses pemurnian. Protein yang akan disekresikan ke luar sel akan melalui suatu jalur sekresi protein yang melibatkan banyak protein dan kompartemen di dalam sel. Sec4p merupakan suatu protein Rab yang berperan penting dalam tahap akhir sekresi protein. Protein ini berfungsi untuk menargetkan vesikel sekresi yang membawa protein yang akan disekresikan ke membran plasma pada proses pasca-Golgi untuk kemudian mengalami penggabungan dengan membran plasma dan mensekresikan protein yang dikandungnya ke luar sel. Ko-ekspresi Sec4p dalam suatu inang ekspresi ragi diketahui dapat meningkatkan tingkat sekresi protein asing.
Penelitian ini bermaksud untuk mempelajari pengaruh ko-ekspresi protein Sec4p P. pastoris terhadap tingkat sekresi -amilase S. fibuligera oleh P. pastoris. Pada penelitian pendahuluan yang telah dilakukan, gen SEC4 yang berukuran 615 pb telah diamplifikasi dari genom P. pastoris dengan metoda PCR dan di subkloning menggunakan vektor pJET1.2 dalam inang E. coli.
Pada penelitian ini fragmen SEC4 hasil subkloning telah ditentukan urutan nukleotidanya dengan metoda Dye terminator. Selanjutnya fragmen SEC4 di kloning mengggunakan vektor ekspresi pPIC3.5K untuk P. pastoris menghasilkan plasmid rekombinan pPIC3.5K-SEC4. Plasmid pPIC3.5K-SEC4 dikarakterisasi melalui pemotongan dengan enzim restriksi dan penentuan urutan nukleotida. Plasmid pPIC3.5K-SEC4 selanjutnya digunakan untuk mentransformasi P. pastoris rekombinan yang telah mengandung gen pengode -amilase (ALP1) S. fibuligera.
Inang P. pastoris [ALP1/SEC4] digunakan untuk mempelajari pengaruh
ko-ekspresi Sec4p terhadap tingkat sekresi -amilase oleh P. pastoris rekombinan.
-Amilase hasil ekspresi dianalisis aktivitasnya dan ditentukan kadar proteinnya, serta dibandingkan dengan hasil ekspresi tanpa ko-ekspresi Sec4p. Ko-ekspresi Sec4p diharapkan meningkatkan level sekresi -amilase oleh P. pastoris. Inang P. pastoris yang mensekresikan -amilase level tinggi dapat digunakan untuk produksi enzim
-amilase yang dapat diaplikasikan untuk berbagai industri, seperti industri pangan, farmasi, tekstil dan detergen.
9 Hasil penelitian yang telah diperoleh dan dilaporkan pada laporan ini adalah: Gen SEC4 berhasil diamplifikasi dari genom P. pastoris menggunakan metode PCR. Fragmen SEC4 dengan ukuran 615 pb diligasi ke vektor pJET1.2 menghasilkan plasmid rekombinan pJET1.2-SEC4 dan disubkloning dalam E. coli TOP10F’. Gen SEC4 dari plasmid pJET1.2-SEC4 yang telah dikarakterisasi, dipotong menggunakan enzim restriksi EcoR1. Fragmen SEC4 hasil pemotongan dengan enzim EcoR1 diligasi ke vektor pPIC3.5K menghasilkan vektor ekspresi rekombinan pPIC3.5K-SEC4 dan selanjutnya dikloning dalam E. coli TOP10F’. Hasil analisis restriksi dan penentuan urutan nukleotida gen SEC4 dalam plasmid pPIC3.5K-SEC4 hasil kloning menunjukkan bahwa vektor ekspresi yang mengandung gen SEC4 berhasil dikonstruksi dan gen SEC4 dengan ukuran 615 pb memiliki urutan nukleotida yang identik dengan urutan SEC4 P. pastoris di Genbank. .
Selanjutnya gen SEC4 telah berhasil diintroduksi ke dalam P. pastoris [ALP1] sehingga diperoleh P. pastoris [ALP1-SEC4]. Hasil analisis aktivitas -amilase pada supernatan P. pastoris [ALP1-SEC4] menunjukkan ko-ekspresi Sec4p meningkatkan level sekresi -amilase 2x lipat dibanding tanpa ko-ekspresi. Berdasarkan hasil penelitian diperoleh waktu induksi yang paling optimum adalah 72 jam, dengan aktivitas spesifik 36, 91 U/mg.
10
PRAKATA
Segala puji bagi Allah SWT yang telah melimpahkan rahmat dan karunia-Nya kepada kami tim peneliti untuk melaksanakan penelitian dan menyelesaikan penulisan Laporan Akhir Penelitian Unggulan Perguruan Tinggi tahun 2013 berjudul ”Pengaruh Ko-ekspresi Sec4p Pichia pastoris Terhadap Tingkat Sekresi -Amilase Saccharomycopsis fibuligera oleh Pichia pastoris rekombinan”.
Pada kesempatan ini perkenankanlah peneliti mengucapkan terima kasih yang sebesar-besarnya kepada :
1. Direktorat Jenderal Pendidikan Tinggi, Departemen Pendidikan Nasional atas dana yang telah disediakan sehingga penelitian ini dapat terlaksana.
2. Universitas Padjadjaran dan Lembaga Penelitian UNPAD atas pengelolaan administrasi yang baik bagi proyek penelitian ini.
3. Dekan Fakultas MIPA, Ketua Jurusan Kimia, serta kepala Laboratorium Penelitian Jurusan Kimia, yang telah menyediakan fasilitas bagi peneliti untuk melaksanakan penelitian ini.
4. Semua pihak yang telah banyak membantu dalam pelaksanaan penelitian ini.
Akhir kata dengan penuh harapan dan rasa optimis, mudah-mudahan hasil penelitian ini dapat memberikan kontribusi ilmu pengetahuan di bidang biologi molekul khususnya dalam kajian produksi enzim rekombinan.
Bandung, November 2013
11 BAB I. PENDAHULUAN
1.1 Latar Belakang dan Permasalahan yang akan Diteliti
Tingkat ekspresi sekresi protein rekombinan dalam suatu inang ekspresi dipengaruhi oleh banyak faktor, diantaranya adalah jenis kodon yang digunakan dari gen yang diekspresikan; jumlah gen yang digunakan; efisiensi dan kekuatan promoter; efisiensi sinyal translasi; jenis peptida sinyal; proses dan pelipatan protein di dalam retikulum endoplasma dan badan Golgi; faktor lingkungan dalam sekresi ekstraseluler; serta hidrolisis protein oleh protease. Modifikasi salah satu atau beberapa faktor yang mempengaruhi ekspresi protein dilaporkan dapat meningkatkan sekresi protein.
Gaffar (2011) melaporkan bahwa kombinasi manipulasi genetik yang meliputi modifikasi peptida sinyal, peningkatan jumlah kopi gen dan ko-ekspresi protein yang berperan dalam pelipatan protein di retikulum endoplasma dapat meningkatkan sekresi α-amilase Saccharomycopsis fibuligera (Sfamy) oleh Pichia pastoris hingga 20 kali lipat dibandingkan dengan P. pastoris wildtype. Produksi Sfamy dan protein rekombinan lain oleh P. pastoris dapat dioptimalkan dengan memperhatikan faktor-faktor lainnya, salah satunya adalah faktor lingkungan dalam sekresi ekstraseluler.
Protein yang akan disekresikan ke luar sel akan melalui suatu jalur sekresi protein yang melibatkan organel sel dan protein pembantu. Secara garis besar, protein yang baru terbentuk akan melewati retikulum endoplasma (RE), kompleks Golgi, dan kemudian menuju membran plasma untuk selanjutnya disekresikan ke luar sel. Transportasi protein antar kompartemen di dalam sel dimediasi oleh suatu vesikel.
Salah satu protein yang berperan pada sekresi ekstraseluler adalah Sec4p. Peningkatan level Sec4p dalam inang ekspresi ragi dapat meningkatkan sekresi protein asing. Hal ini dibuktikan melalui penelitian yang dilakukan oleh Shi-Hwei dan koleganya (2004) yang melibatkan overekspresi SEC4 Pichia pastoris dalam manipulasi genetik terhadap sistem ekspresi P. pastoris yang telah mengandung gen asing. Dari hasil studi ini dilaporkan adanya peningkatan level sekresi protein glukoamilase hingga mencapai 100 kali. Meskipun fungsi Sec4p di P. pastoris jarang dibahas dalam hal perannya dalam sekresi protein, urutan asam amino Sec4p dari P. pastoris mirip dengan urutan Sec4p ragi lain pada domain yang terlibat dalam pengikatan dan hidrolisis nukleotida. Penelitian tersebut membuktikan bahwa Sec4p memiliki kontribusi peran yang penting dalam proses produksi protein rekombinan, khususnya dalam proses sekresi protein.
12 Sec4p merupakan protein berukuran 24 kDa yang dikode gen SEC4 dari Saccharomyces cerevisiae. Protein ini termasuk keluarga protein Rab dari protein pengikat GTP yang merupakan regulator penting pada semua aktivitas peredaran vesikuler. Sec4p berperan penting dalam tahap akhir sekresi protein, berfungsi untuk menargetkan vesikel sekretori ke membran plasma pada proses pasca-Golgi dalam sekresi protein pada ragi.
Menurut Cowan (1996), sebagian besar (sekitar 45%) enzim yang digunakan di industri merupakan enzim hasil rekayasa, baik rekayasa pada tingkat genetik maupun protein. Salah satu metode yang umum digunakan dalam rekayasa genetik adalah dengan cara kloning, yaitu dengan memindahkan gen pengode enzim atau protein tertentu ke suatu inang dengan tujuan gen tersebut akan mengalami perbanyakan di dalam sel inang. Penelitian-penelitian selanjutnya berkembang ke arah peningkatan tingkat ekspresi protein rekombinan dari suatu inang ekspresi.
Berdasarkan latar belakang tersebut, penelitian ini bermaksud mempelajari pengaruh ko-ekspresi Sec4p P. pastoris terhadap tingkat sekresi -amilase S. fibuligera oleh P. pastoris rekombinan. Gen SEC4 mengode protein Sec4p yang berperan pada sekresi protein ke luar sel ragi. Sec4p berikatan dengan vesikel sekresi yang berisi protein yang akan disekresikan dan membantu mengarahkannya ke membran plasma. Ko-ekspresi Sec4p dalam inang ekspresi ragi telah terbukti dapat meningkatkan level sekresi glukoamilase Rizhopus orizae (Shi-Hwei et al., 2005).
1.2. Permasalahan yang akan dikaji
Berdasarkan latar belakang yang telah diungkapkan, maka permasalahan yang akan dikaji dalam penelitian ini adalah:
1. Apakah gen SEC4 Pichia pastoris dapat dikonstruksi dalam vektor ekspresi untuk P. pastoris dan dikloning dalam E. coli.
2. Bagaimana homologi urutan nukleotida gen SEC4 Pichia pastoris hasil kloning dalam E. coli dengan urutan gen SEC4 NCBI (nomor akses: XM_002492307.1). 3. Apakah gen SEC4 P. pastoris berhasil di ko-ekspresikan dalam inang P. pastoris
yang telah membawa gen ALP1.
4. Bagaimana pengaruh ko-ekspresi Sec4p terhadap tingkat ekspresi -amilase oleh P. pastoris rekombinan.
13 Enzim -amilase bekerja menghidrolisis ikatan -1,4-glikosidik dalam pati untuk menghasilkan maltosa dan oligosakarida berbagai ukuran. Enzim -amilase banyak digunakan dalam berbagai industri, dengan demikian pengembangan produksi -amilase perlu dilakukan. Sistem ekspresi Pichia pastoris banyak digunakan untuk memproduksi protein rekombinan karena tingkat ekspresinya yang tinggi, mudah dilakukan untuk peningkatan skala produksi, adanya modifikasi pasca translasi, serta mampu mensekresikan protein heterolog. Sampai saat ini, Indonesia masih mengimpor enzim ini dari beberapa negara, karena belum adanya industri yang memproduksi enzim ini. Padahal Indonesia memiliki sumber mikroba penghasil -amilase yang melimpah dan telah banyak dilaporkan, salah satunya adalah Saccharomycopsis fibuligera (Gaffar, 2011). -Amilase S. fibuligera merupakan salah suatu enzim ekstraseluler yang mampu memecah pati mentah sehingga dapat menghemat energi dalam pemrosesan pati, dengan demikian memiliki potensi untuk dikembangkan dan diaplikasikan dalam industri. State
of the art dari penelitian ini adalah penggunaan sistem ekspresi P. pastoris untuk
produksi enzim -amilase dan mempelajari faktor-faktor yang mempengaruhi tingkat sekresi protein, pada proposal ini yang menjadi kajian utama adalah yaitu protein Sec4p yang berperan pada transport protein ke luar sel.
14 BAB II. KAJIAN PUSTAKA
2. 1 Jalur Sekresi Protein
Protein larut (soluble protein) dan protein membran disintesis dalam ribosom yang terikat pada retikulum endoplasma (RE) kasar dan kemudian bergerak ke tujuan akhir dari masing-masing protein melalui jalur sekresi. Pada sel eukariot, jalur sekresi protein melibatkan suatu migrasi vesikuler. Sebuah prinsip mengatur semua lalu-lintas peredaran protein dalam jalur sekresi, yaitu transportasi protein dari satu kompartemen ke kompartemen lain yang dibatasi membrane, dimediasi oleh vesikel. Vesikel ini akan mengumpulkan protein "kargo" dalam bentuk bud atau tunas vesikel yang timbul dari suatu membran kompartemen, kemudian protein kargo dikirim ke kompartemen berikutnya melalui fusi vesikel dengan membran kompartemen target (Lodish et al, 2003).
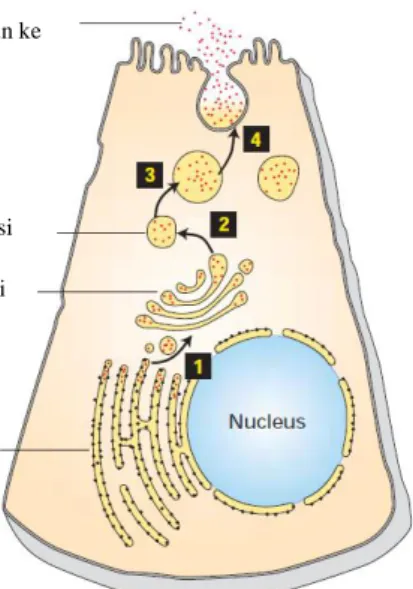
Sekresi protein merupakan suatu proses kompleks yang melibatkan banyak organel dan molekul pembantu (Gambar 2.1). Secara garis besar, protein yang akan disekresikan akan melalui jalur sekresi protein dimana protein yang baru terbentuk akan melewati retikulum endoplasma, kompleks Golgi, dan kemudian menuju membran plasma untuk selanjutnya disekresikan ke luar sel (Oliveira et al., 2010; Salminen & Novick, 1989).
Gambar 2.1 Diagram jalur sekresi protein. Setelah protein disintesis oleh ribosom di RE kasar, protein yang akan disekresikan dikemas dalam vesikel dan dikirim ke komples Golgi (1), kemudian protein yang siap untuk disekresikan akan dikemas dalam vesikel sekresi dan diarahkan ke membran plasma (2)(3), vesikel sekresi berfusi untuk mengeluarkan protein kargo (4) (Lodish et al, 2003).
Protein disekresikan ke luar sel Vesikel sekresi seksekresi Vesikel Golgi aparatus RE kasar
15 Transportasi protein yang dimediasi oleh vesikel melibatkan beberapa protein untuk menjalankan proses pertumbuhan tunas vesikel dan fusi membran, diantaranya yaitu (Lodish et al., 2003):
1. Protein pelapis. Berfungsi untuk mengarahkan vesikel yang mengandung protein kargo ke kompartemen tujuannya masing-masing. Contohnya COPI (dari cis-Golgi ke RE/vesikel retrograde), COPII (dari RE kasar ke cis-Golgi/vesikel anterograde), Clathrin (dari membran plasma dan jaringan trans-Golgi ke endosom).
2. Protein reseptor integral membran soluble N-ethylmaleimide-sensittive factor attachment protein receptors (SNARE). Berfungsi dalam proses fusi vesikel dengan membran target. Terdiri atas v-SNARE yang terletak pada vesikel dan t-SNARE yang terletak pada membran target.
3. Protein Rab (protein pengikat GTP). Berfungsi dalam proses perakitan protein pelapis dan penargetan vesikel ke membran target.
Protein pada jalur sekresi yang ditujukan untuk kompartemen lain selain retikulum endoplasma dan Golgi (protein yang akan diskresikan), pada akhirnya akan sampai pada jaringan kompleks membran dan vesikel yang disebut sebagai jaringan trans-Golgi (trans-Golgi network/TGN). Protein yang ditujukan untuk disekresikan ke luar sel akan diarahkan ke membran plasma melalui vesikel sekresi yang tumbuh dari TGN, vesikel ini kemudian akan berfusi dengan membran plasma dan mengeluarkan protein kargo ke luar sel melalui proses eksositosis (Lodish et al., 2003).
2. 2. Eksositosis
Eksositosis adalah mekanisme perpindahan molekul (protein dan polisakarida, hormon, neurotransmitter, dll) melintasi membran plasma dari dalam ke luar sel (sekresi) dengan cara menggabungkan (fusi) vesikel berisi molekul dengan membran plasma. Vesikel yang lepas dari Golgi aparatus dipindahkan oleh sitoskeleton ke membran plasma. Ketika membran vesikel dan membran plasma bertemu, kandungan vesikelnya kemudian disekresikan ke luar sel (Campbel et al., 2002; Madigan et al., 2006).
Proses eksositosis adalah langkah penting dalam mengeluarkan enzim-enzim dan protein-protein lain yang berguna untuk proses fisiologis di luar sel atau untuk mengeluarkan molekul-molekul yang membantu komunikasi antar sel satu dengan sel
16 yang lain. Eksositosis terbagi atas jalur sekresi konsitutif dan jalur sekresi yang diregulasi (Thomas, 2009);
1. Jalur sekresi konstitutif. Vesikel sekresi konstitutif membawa protein yang disekresikan sel secara terus menerus. Vesikel ini berasal dari sisi trans-Golgi, bergerak sepanjang lintasan mikrotubulus, dan dengan segera berfusi dengan membran plasma melepaskan isinya. Beberapa protein yang tidak saling berkaitan dapat dikemas dalam vesikel sekresi konstitutif tunggal.
2. Jalur sekresi yang diregulasi. Vesikel sekresi pada jalur ini juga berasal dari sisi trans-Golgi, namun vesikel ini akan berfusi dengan membran plasma apabila sel menerima sinyal sekresi. Vesikel sekresi ini seringkali mengandung protein hormon, enzim pencernaan, dan neuro-peptida, tergantung pada jenis selnya.
2.3 Protein Sec4p
Analisis biokimia telah mengidentifikasi beberapa faktor yang diperlukan untuk transportasi vesikuler melalui Golgi aparatus. Analisis genetik jalur sekresi ragi mengungkapkan 26 gen yang produknya diperlukan untuk transportasi protein dari retikulum endoplasma ke membran plasma. Sepuluh dari gen-gen tersebut mengatur peredaran vesikuler dari Golgi aparatus ke membran plasma pada tahap lanjut sekresi protein. Salah satu dari sepuluh gen ini, SEC4, mengkode protein pengikat GTP yang berasosiasi dengan sisi sitoplasmik dari vesikel sekresi dan membran plasma. Protein Sec4 (Sec4p) diperlukan pada eksositosis konstitutif pada ragi dan mengalami siklus antara membran plasma dan vesikel sekresi. Siklus lokalisasi Sec4p dirangkai dengan siklus pengikatan dan hidrolisis GTP yang berfungsi untuk mengontrol peredaran vesikuler (Salminen & Novick, 1989).
Gen SEC4 dari Saccharomyces cerevisiae mengkode protein pengikat GTP (Sec4p) berukuran 24 kDa yang memainkan peran penting dalam tahap akhir sekresi protein. Sec4p termasuk ke dalam keluarga protein Rab dari protein pengikat GTP yang merupakan regulator penting pada semua aktivitas peredaran vesikuler. Sec4p berperan penting untuk menargetkan vesikel sekresi ke membran plasma pada proses pasca-Golgi pada sekresi protein ragi (Shi-Hwei et al., 2004; Walworth et al., 1989).
Selama proses sekresi protein, Sec4p tertahan (anchored) pada membran vesikel melalui geranil-geranilasi pada C-terminal dan selanjutnya diangkut ke membran plasma setelah docking vesikel. Analisis genetik menunjukkan bahwa Sec4p berperan pada awal
17 proses dari eksosis, sebuah efektor untuk Sec4p, dan menargetkan vesikel sekresi situs eksositosis dalam ragi (Shi-Hwei et al., 2004).
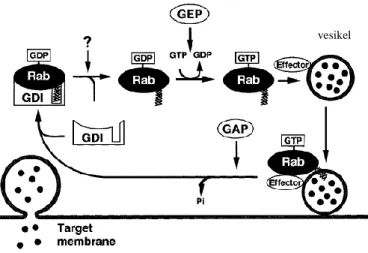
Siklus antara bentuk inaktif dan bentuk aktif protein Rab dimediasi oleh hidrolisis GTP (aktivitas GTPase) dan pertukaran GTP menjadi GDP pada protein. Siklus aktivasi, inaktivasi, dan translokasi diatur oleh setidaknya tiga jenis regulator, yaitu: GDP/GTP exchange factor (GEF), GDP dissociation inhibitor (GDI), dan GTPase-activating protein (GAP). Dalam sitosol, protein Rab dipertahankan dalam bentuk inaktif (mengikat GDP) oleh aktivitas GDI. Rab-GDP dilepaskan terlebih dahulu dari GDI dengan mekanisme yang masih belum diketahui, dan kemudian dikirim ke kompartemen membran spesifik; protein Rab selanjutnya diubah menjadi bentuk Rab yang terikat GTP (Rab-GTP) dengan bantuan GEF. Bentuk Rab-GTP ini kemudian berinteraksi dengan efektor hilir (downstream). Setelah itu, Rab-GTP dikonversi ke bentuk Rab-GDP oleh suatu protein GAP. Bentuk Rab-GDP yang dihasilkan ini terletak pada membran dan kemudian dapat membentuk kompleks dengan GDI sehingga akan kembali ke sitosol sebagai kompleks protein (Rab-GDP)-GDI (Gambar 2.2). Dari penjelasan di atas dapat diketahui bahwa karakteristik dari protein Rab adalah siklus asosiasi-disosiasi membrannya berhubungan dengan siklus pertukaran GDP-GTP pada protein tersebut (Rothman, 1996; Takai et al., 2001).
Gambar 2.2 Siklus aktivasi/inaktivasi dan translokasi protein Rab. Siklus ini mengatur protein Rab dalam bentuk aktif-inaktif dan lokalisasinya pada membran-sitosol (Takai et
al., 2001)
Sebagai protein Rab, Sec4p berosilasi antara bentuk inaktif yang mengikat GDP dan bentuk aktif yang mengikat GTP, dengan demikian Sec4p berfungsi sebagai molekul pertukaran untuk mengatur pengiriman vesikel. Sec4p diaktifkan oleh Sec2p, dan
Membran target
18 bersama dengan Sec2p, Sec4p berasosiasi secara reversibel dengan vesikel sekresi dan kompleks protein eksosis pada membran plasma, dengan demikian vesikel dapat diarahkan menuju situs sekresi. Sec2p adalah protein GEF (GDP/GTP exchange factor) yang bekerja pada protein Sec4p ragi, dan keduanya berpartisipasi dalam transportasi vesikel sekresi menuju membran plasma (Chavrier et al., 1990).
2.4 Peran Sec4p dalam Penargetan dan Penambatan Vesikel Sekresi
Eksositosis yang melibatkan proses docking dan fusi vesikel, merupakan proses yang penting dalam pelepasan protein kargo ke luar sel. Dalam perjalanannya menuju tujuan akhir, vesikel akan ditambatkan ke membran plasma yang kemudian akan diarahkan ke arah fusi vesikel sekresi dengan membran plasma. Komponen kunci yang terlibat dalam proses penambatan ini adalah kompleks protein eksosis dan GTPase kecil, dan fusi vesikel pada membran plasma meliputi keterlibatan protein reseptor SNARE. (Orlando & Guo, 2009).
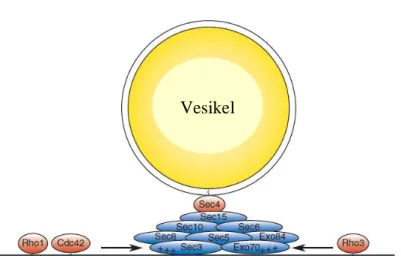
Eksosis adalah suatu protein kompleks yang bertindak sebagai faktor docking, terdiri dari delapan subunit lestari yang terlibat dalam docking vesikel eksositik : Sec3p, Sec5p, Sec6p, Sec8p, Sec10p, Sec15p, Exo70p dan Exo84p (Gambar 2.3). Kompleks protein ini pada awalnya diidentifikasi pada ragi S. cerevisiae, dimana eksosis telah terbukti berperan penting untuk eksositosis. Enam protein 'Sec', dinamakan demikian karena mutasi dalam gen mereka menghambat proses sekresi, berinteraksi secara fisik satu sama lain (Walworth et al., 1989; Lipschutz & Mostov, 2002).
Eksosis terlibat dalam pengarahan vesikel ke situs yang tepat pada membran plasma. Eksosis berfungsi untuk mengarahkan dan mengirimkan vesikel ke situs docking pada membran plasma yang kemudian dilanjutkan dengan reaksi perakitan SNARE dan fusi vesikel. Semua komponen eksosis merupakan suatu protein hidrofilik yang berinteraksi satu sama lain untuk membentuk kompleks periferal yang berasosiasi dengan membran plasma. Kompleks eksosis berfungsi sebagai kompleks penambat yang memediasi koneksi awal antara vesikel sekresi dan membran plasma sebelum docking dan fusi. Meskipun sudah jelas bahwa eksosis memainkan peranan sentral dalam eksositosis, namun masih sedikit yang diketahui tentang bagaimana proses ini dikendalikan (Orlando & Guo, 2009; Brennwald, 2000; Guo et al., 1999).
19 Gambar 2.3 Tahapan lanjut eksositosis pada membran plasma. (1) vesikel sekresi yang mengandung protein Rab (bulatan merah), subunit kompleks eksosis (bulatan hijau), dan v-SNARE (lengkungan merah) diarahkan sepanjang sitoskeleton (garis merah) ke membran plasma melalui sebuah motor (bulatan biru). (2) vesikel ditambatkan ke membran plasma melalui interaksi kompleks eksosis. (3)(4) t-SNARE (lengkungan biru) pada membran plasma berikatan dengan v-SNARE pada vesikel, perakitan kompleks v-SNARE ini selanjutnya akan mengacu pada fusi vesikel dengan membran plasma (Orlando & Guo, 2009).
Sejumlah GTPase kecil mengatur eksosis. GTPase pertama yang ditemukan untuk berinteraksi dengan eksosis yang adalah Sec4p. Analisis genetik membuktikan bahwa Sec4p berperan pada awal proses eksositosis pada ragi. Sec4p dan Sec2p akan mengontrol perakitan kompleks eksosis yang diperlukan untuk menambatkan vesikel ke membran plasma (Orlando & Guo, 2009; Guo et al., 1999).
Aktivasi Sec4p oleh Sec2p diperlukan untuk pengiriman vesikel sekresi yang terpolarisasi. Sec4p dalam bentuk aktif (Sec4p-GTP) dapat membantu pergerakan vesikel sekresi yang tergantung pada myosin sepanjang kabel aktin. Namun, bagaimana vesikel yang mengandung Sec4p terhubungkan dengan motor myosin belum diketahui secara pasti. Sec4p dan Sec2p kemudian akan berinteraksi dengan salah satu komponen kompleks eksosis, yaitu Sec15p, yang akan mengarahkan transportasi vesikel sekresi ke membran plasma (Grosshans et al., 2006b; Chavrier et al., 1990).
Sec15p membutuhkan Sec10p untuk berasosiasi dengan kompleks eksosis. Sec10p diperlukan untuk menghubungkan Sec15p ke kompleks yang tersisa. Sec15p berikatan langsung dengan Sec10p. Pengikatan subkompleks Sec10p/Sec15p ke seluruh eksosis ini dimediasi oleh interaksi Sec10p dengan Sec5p. Sec5p juga membuat mata rantai dengan
Membran plasma plaplasma Vesikel Vesikel Vesikel Vesikel
20 Exo70p, Sec6p dan Sec3p. Jadi, Sec5p tampaknya berada pada inti kompleks. Sec5p juga mempunyai peranan penting dalam menghubungkan Sec3p ke Sec8p, mungkin melalui asosiasi Sec5p dengan Sec6p dan Sec6p dengan Sec8p. Sec3p mungkin juga terikat langsung ke Sec8p atau Sec6p (Gambar 2.4) (Guo et al., 1999).
Gambar 2. 4 Kompleks eksosis. Gambaran penambatan vesikel ke membran plasma melalui interaksinya dengan kompleks eksosis. Subunit komponen eksosis digambarkan dengan bulatan biru, GTPase digambarkan dengan bulatan merah. GTPase ini dapat meregulasi aktivasi dan polarisasi eksosis pada membran plasma. Sec4p berikatan dengan vesikel sekresi dan berinteraksi dengan Sec15p pada eksosis (Orlando & Guo, 2009).
Dua subunit eksosis yaitu: Exo70p dan Sec3p, berfungsi sebagai penanda yang terdapat di membran plasma. Komponen eksosis lainnya bergabung dengan vesikel sekresi bergerak sepanjang kabel aktin dan kemudian diarahkan ke membran plasma dimana Exo70p dan Sec3p berada. Perakitan kompleks eksosis dapat menambatkan vesikel sekresi ke membran plasma. Exo70p dan Sec3p berikatan dengan membran plasma melalui suatu ikatan lipid, ikatan ini lestari dari mulai ragi hingga mamalia. Interaksi ini penting untuk perekrutan Exo70p, Sec3p, dan komponen eksosis lainnya ke membran plasma untuk penambatan vesikel (Orlando & Guo, 2009).
Perakitan kompleks eksosis dapat terjadi selama proses docking vesikel, dan kelainan pada Sec4p dapat mempengaruhi perakitan kompleks eksosis. Belum diketahui apakah semua protein eksosis terakit di dalam sel. Ada kemungkinan bahwa mutasi pada Sec4p akan mempengaruhi perakitan subunit eksosis dengan Sec3p pada membran target. Pada sel wild type, Sec3p bermigrasi secara eksklusif di kompleks eksosis. Perekrutan protein eksosis untuk kemudian diarahkan ke Sec3p membutuhkan Sec4p yang
Vesikel
21 fungsional. Penempatan Sec3p ke situs eksositosis adalah tidak tergantung pada lalu lintas membran yang sedang berlangsung, sementara komponen lainnya dari eksosis memerlukan fungsi Sec4p untuk penempatannya (Guo et al., 1999).
Penempatan Sec3p ke domain tertentu pada membran plasma dan interaksi Sec15p dengan Sec4p-GTP menunjukkan bahwa kompleks eksosis memainkan peran penting dalam docking dan fusi membran yang diarahkan oleh Rab/GTPase. Sec4p memiliki peranan dalam mengaktivasi perakitan komponen eksosis tersebut ke Sec3p, yang menandai lokasi sekresi (Guo et al., 1999).
2.5 Jalur Sinyal dari Sec4p dalam Mengarahkan Vesikel ke Proses Fusi
Protein Rab juga mempengaruhi proses fusi vesikel melalui peranannya dalam meregulasi perakitan kompleks protein reseptor SNARE. Setelah vesikel sekresi tertambat pada membran plasma melalui interaksi Sec4p-GTP dengan kompleks protein eksosi, vesikel sekresi akan diarahkan ke proses penggabungan protein reseptor SNARE yang terdapat pada vesikel sekresi (v-SNARE) dengan protein reseptor SNARE yang terdapat pada membran plasma (t-SNARE). v-SNARE dan t-SNARE akan membentuk kompleks trans-SNARE yang mengarah pada proses fusi vesikel dengan membran plasma (Grosshans et al., 2006a; Grosshans et al., 2006b).
SNARE merupakan protein transmembran yang bagian C-terminalnya tertahan pada membran dan domain N-terminalnya menghadap ke sitosol. SNARE diperlukan pada tahap fusi membran pada sebagian besar proses transportasi intraseluler. Untuk terjadinya fusi, protein SNARE pada membran donor dan target harus membentuk suatu kompleks trans-SNARE. Pada ragi, perakitan kompleks SNARE antara SNARE vesikel sekresi (Sncp) dan SNARE membran plasma (Ssop dan Sec9p) terjadi pada tahap lanjut dari reaksi eksositosis (Grote et al., 2000).
Sec4p berperan dalam regulasi perakitan SNARE melalui efektornya yang lain dalam proses fusi vesikel, yaitu Sro7p. Sro7p akan berikatan dengan Sec9p yang merupakan SNARE pada membran plasma target dan memediasi fusi vesikel dengan membran plasma (Grosshans et al., 2006a).
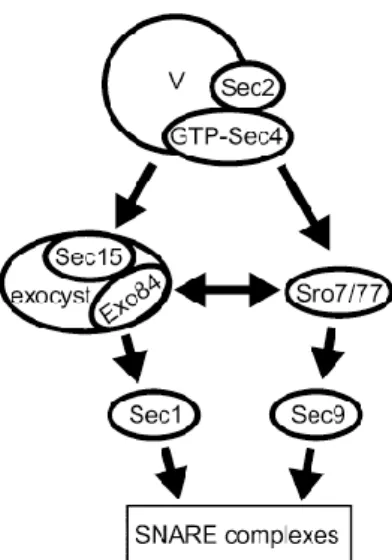
Terdapat dua jalur sinyal dari Sec4p yang saling bertemu dalam mengarahkan vesikel ke proses fusi pada ragi (Gambar 2.5). Vesikel sekresi (V) berikatan dengan Rab GTPase Sec4p dan Sec2p (GEF Sec4p). Sec2p akan menjaga Sec4p tetap berada dalam bentuk aktifnya. Kemudian proses penambatan vesikel pada eksositosis terjadi dengan
22 adanya interaksi antara Sec4p pada vesikel dengan Sec15p yang merupakan salah satu subunit dari eksosis, interaksi ini diperlukan untuk perakitan kompleks eksosis. Eksosis Sec1p berikatan dengan kompleks t-SNARE, tetapi tidak dengan Ssop bebas, kemudian akan berinteraksi dengan Sec1p, yang diperlukan untuk mengubungkannya dengan fungsi SNARE pada proses eksositosis (Grosshans et al., 2006a).
Gambar 2. 5 Model jalur sinyal Sec4p dalam peranannya meregulasi proses eksositosis (Grosshans et al., 2006a).
Sro7p yang merupakan efektor lain dari Sec4p, meneruskan sinyal dari Sec4p ke fungsi SNARE melalui interaksinya dengan t-SNARE eksositik Sec9p. Sro7p berasosisasi dengan eksosis melalui intraksinya dengan subunit Exo84p pada eksosis. Tanda panah pada gambar di atas mengindikasikan interaksi fisik yang mungkin terjadi (Grosshans et al., 2006a; Grote et al., 2000).
2.6 Sistem ekspresi P. pastoris dan vektor ekspresi pPIC3.5K untuk P. pastoris Penggunaan sistem ekspresi P. pastoris memberikan keuntungan dibandingkan dengan sistem ekspresi lain. Sistem ini merupakan satu-satunya sistem yang menggabungkan keuntungan penggunaan E. coli (tingkat ekspresi tinggi, mudah dilakukan peningkatan skala produksi, dan murah) dengan sistem ekspresi eukariot (adanya komponen pelipatan protein dan modifikasi pasca-translasi) (Glick & Pasternak, 2003).
Ekspresi protein asing pada P. pastoris membutuhkan tiga tahap penting, yaitu: insersi gen ke vektor ekspresi, introduksi vektor ekspresi ke genom P. pastoris, dan
23 pengujian galur yang mempunyai potensi untuk mengekspresikan produk gen asing (Gaffar, 2010b).
Sama seperti S. cerevisiae, transformasi P. pastoris akan menghasilkan integrasi kaset ekspresi ke kromosom pada lokus spesifik untuk menghasilkan transforman yang stabil secara genetik. Integrasi dapat dilakukan dengan dua cara. Cara yang paling sederhana adalah dengan memotong vektor pada sisi yang unik dalam gen penanda (seperti HIS4) atau pada fragmen promotor AOX1 (Romanos, 1995; Gaffar, 2010b). Pemotongan vektor P. pastoris dalam urutan yang sama dengan genom inang, akan menstimulasi peristiwa rekombinasi homolog yang merupakan target yang efisien untuk integrasi vektor ke lokus genom (Cregg & Madden, 1988).
Vektor ekspresi P. pastoris pada umumnya memiliki format yang sama. Semua vektor ekspresi telah didisain sebagai shuttle vektor E. coli/P. pastoris, yang mengandung titik awal replikasi untuk mempertahankan plasmid di E. coli dan marker fungsional di satu atau kedua organisme. (Cregg et al., 1985)
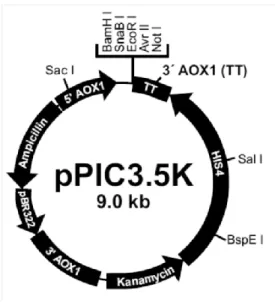
Vektor pPIC3.5K (Gambar 2.6) merupakan vektor ekspresi berukuran 9004 bp yang dirancang untuk memungkinkan identifikasi dari gen sisipan secara in vivo dalam genom Pichia pastoris. Vektor ini mempunyai gen penanda yang berfungsi sebagai marker penyeleksi transforman di E. coli dan P. pastoris, yaitu resisten kanamisin di E. coli dan resistan geneticin di P. pastoris. Selain itu vektor ini juga memiliki gen marker HIS4 untuk seleksi menggunakan media yang mengandung histidin. Gen histidin dehidrogenase (HIS4) fungsional dapat digunakan sebagai marker penyeleksi setelah transformasi ke dalam P. pastoris his4 (galur yang defisien histidin dehidrogenase) melalui metode transformasi integrasi yang dipilih. Vektor ini merupakan vektor ekspresi, memiliki kaset ekspresi yang terdiri dari fragmen AOX1 yang mengandung urutan promoter 5’ dan urutan pendek fragmen AOX1 yang mengandung urutan yang dibutuhkan untuk terminasi transkripsi. Di antara urutan promotor dan terminator terdapat multiple cloning site (MCS) untuk insersi urutan pengode gen asing (Gambar 2.7) (Invitrogen, 2006).
24 Gambar 2.6 Peta vektor ekspresi pPIC3.5K (Invitrogen, 2006).
25 BAB III. TUJUAN DAN MANFAAT PENELITIAN
Meningkatnya kebutuhan berbagai industri terhadap produksi protein rekombinan yang tinggi mendorong dilakukannya berbagai upaya untuk meningkatkan tingkat sekresi protein rekombinan dengan cara rekayasa di tingkat genetika. Menurut Shi-Wei et al. (2004), tingkat sekresi suatu protein oleh suatu sel inang dapat dipengaruhi oleh beberapa faktor, yaitu : (1) jenis penggunaan kodon dari gen yang diekspresikan, (2) jumlah gen yang digunakan, (3) efisiensi dan kekuatan promotor, (4) efisiensi sinyal translasi, (5) jenis peptida sinyal, (6) proses dan pelipatan di dalam retikulum endoplasma dan badan Golgi, (7) faktor lingkungan dalam sekresi ekstraseluler, dan (8) hidrolisis protein oleh protease.
Dalam jalur sekresi protein, eksositosis merupakan suatu proses penting yang melibatkan transportasi vesikular pasca-Golgi untuk mensekresikan protein ke luar sel. Proses eksositosis diregulasi oleh suatu protein anggota keluarga protein kecil Rab GTPase, Sec4p. Sec4p merupakan protein berukuran sekitar 24 kDa yang berperan dalam menargetkan vesikel sekresi ke membran plasma pada proses pasca-Golgi dalam sekresi protein pada ragi.
Pada penelitian terdahulu dari kelompok kami, telah dipelajari pengaruh peptida sinyal dan ko-ekspresi Protein Disulfida Isomerase terhadap tingkat sekresi -amilase Saccharomycopsis fibuligera dalam P. pastoris dan diperoleh 20x peningkatan sekresi (Gaffar et al, 2009; Gaffar et al 2011). Tujuan penelitian ini adalah untuk mempelajari
pengaruh ko-ekspresi SEC4 terhadap tingkat sekresi -amilase S. fibuligera oleh P. pastoris.
Penelitian ini merupakan rangkaian penelitian yang dikembangkan oleh kelompok ekspresi protein rekombinan menggunakan sistem ekspresi P. pastoris. Pada penelitian terdahulu dari kelompok kami telah dibuktikan bahwa peptida sinyal, jumlah kopi gen dan pelipatan protein mempengaruhi level sekresi protein. Penelitian ini secara khusus akan mempelajari pengaruh protein yang berperan pada sekresi ekstraselular, yaitu Sec4p terhadap tingkat sekresi -amilase S. fibuligera oleh sistem ekspresi P. pastoris.
Penelitian ini akan menghasilkan inang P. pastoris yang mengandung tambahan gen SEC4 dan gen ALP1 serta mensekresikan -amilase level tinggi. Pada penelitian terdahulu telah diperoleh P. pastoris yang mengandung gen ALP1 dan mensekresikan
26 tambahan ko-ekspresi Sec4p pada inang P. pastoris yang telah mengandung gen ALP1 akan menambah jumlah Sec4p yang dapat membantu sekresi -amilase oleh P. pastoris. Ko-ekspresi Sec4p diharapkan akan meningkatkan sekresi -amilase oleh P. pastoris. Hasil penelitian ini akan dipublikasikan pada jurnal nasional terakreditasi.
Inovasi dari penelitian ini adalah dihasilkan galur P. pastoris rekombinan yang mengandung tambahan gen SEC4 dan ALP1. Ko-ekspresi Sec4p oleh inang P. pastoris diharapkan dapat meningkatkan sekresi -amilase oleh P. pastoris rekombinan. Manfaat dari penelitian ini secara khusus adalah diperolehnya informasi pengaruh ko-ekspresi protein Sec4p terhadap tingkat sekresi -amilase S. fibuligera oleh P. pastoris, dan diperolehnya galur P. pastoris yang dapat memproduksi -amilase S. fibuligera level tinggi. Secara umum, inovasi dari penelitian ini adalah penggunaan sistem ekspresi P. pastoris untuk produksi enzim rekombinan dari mikroba galur lokal, dan mempelajari faktor-faktor yang mempengaruhinya. Manfaat jangka panjang dari penelitian ini adalah sangat bermanfaat dalam rangka produksi enzim rekombinan lain menggunakan system ekspresi P. pastoris.
3.1 Tujuan Khusus
Maksud penelitian ini adalah mendapatkan transforman P. pastoris yang mengandung tambahan gen SEC4 dan ALP1, serta mempelajari pengaruh ko-ekspresi Sec4p terhadap tingkat sekresi -amilase oleh P. pastoris. Sedangkan tujuan khusus penelitian ini adalah:
1. Konstruksi vektor ekspresi pPIC3.5K-SEC4 untuk Pichia pastoris dan kloning dalam E. coli.
2. Mengetahui homologi urutan nukleotida gen SEC4 Pichia pastoris hasil kloning dalam E. coli dengan urutan gen SEC4 NCBI (nomor akses: XM_002492307.1). 3. Mendapatkan transforman P. pastoris yang mengandung gen ALP1 dan gen
SEC4.
4. Mengkarakterisasi transforman P. pastoris.
5. Mengetahui pengaruh ko-ekspresi Sec4p terhadap tingkat ekspresi -amilase S. fibuligera oleh P. pastoris rekombinan.
27 3.2 Penelitian Pendahuluan yang Sudah Dilaksanakan
Studi pendahuluan telah dilakukan amplifikasi gen SEC4 P. pastoris dengan metoda PCR dan subkloning menggunakan vektor pJet1.2 dalam E. coli. Templat diperoleh dari genom P. pastoris. Amplifikasi gen SEC4 dilakukan menggunakan primer maju dan balik yang keduanya telah mengandung sisi pengenalan enzim restriksi EcoRI (5’ G↓AATTC 3’) sehingga akan menghasilkan fragmen gen SEC4 yang memiliki sisi pengenalan enzim EcoRI di ujung 5’ dan 3’-nya (Shi-Hwei et al., 2004). Adanya sisi pengenalan enzim ini akan mempermudah dalam karakterisasi transforman yang mengandung plasmid rekombinan serta mendapatkan dan menyisipkan fragmen gen SEC4 yang diinginkan pada subkloning menggunakan vektor pJET1.2 maupun kloning menggunakan vektor pPIC3.5K. Vektor pJET1.2 merupakan vektor linear yang tidak memiliki sisi pengenalan EcoRI, sehingga pada saat plasmid rekombinan pJET1.2-SEC4 direstriksi menggunakan enzim ini akan dihasilkan dua fragmen, vektor pJET1.2 dan SEC4. Sedangkan vektor pPIC3.5K merupakan vektor sirkular yang memiliki sisi pengenalan EcoRI, sehingga pada saat vektor ini direstriksi menggunakan enzim EcoRI, vektor ini akan komplemen dengan fragmen gen SEC4 hasil subkloning.
Tahapan reaksi PCR untuk amplifikasi gen SEC4 meliputi tahap denaturasi awal pada suhu 95oC selama 5 menit; denaturasi pada suhu 95oC selama 1 menit; penempelan primer (annealing) pada suhu 51oC selama 1 menit; dan polimerisasi pada suhu 72oC selama 1 menit, reaksi PCR dilakukan sebanyak 30 siklus.
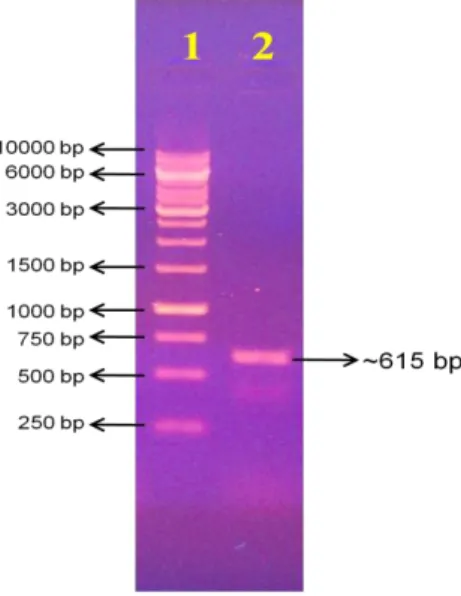
28 Menurut literatur urutan DNA SEC4 dari NCBI (nomor akses: XM_002492307.1), gen SEC4 memiliki 615 bp nukloetida. Amplikon SEC4 dikarakterisasi dengan elektroforesis menggunakan gel agarosa 1%. Hasil karakterisasi memperlihatkan pita amplikon SEC4 (Gambar 2.11 lajur 2) berada diantara pita 500 bp dan 750 bp, sehingga dapat disimpulkan bahwa pita lajur 2 pada gel agarosa merupakan pita fragmen SEC4 yang berukuran ~615 pb.
Fagmen SEC4 hasil PCR selanjutnya telah diligasi ke vektor pJet1.2 menghasilkan plasmid rekombinan pJet1.2-SEC4. Plasmid ini telah digunakan untuk mentransformasi E. coli TOP10F’, dan telah diperoleh transforman yang mengadung plasmid rekombinan (data tidak diperlihatkan). Hasil karakterisasi melalui pemotongan dengan enzim restriksi EcoR1 memperlihatkan bahwa fragmen SEC4 telah berhasil disubkloning.
Jadi pada penelitian pendahuluan yang telah dilakukan, sudah diperoleh transforman E. coli yang mengandung plasmid rekombinan pJet1.2-SEC4. Selanjutnya pada penelitian ini akan dilakukan: (1) penentuan urutan nukleotida SEC4 hasil subkloning; (2) Ligasi fragmen SEC4 ke vektor pPIC3.5K; (3) Transformasi E. coli menggunakan plasmid pPIC3.5K-SEC4; (4) penentuan urutan nukleotida SEC4 hasil cloning; (5) Transformasi P. pastoris menggunakan plasmid pPIC3.5K-SEC4; (6) Karakterisasi dan seleksi tranforman P. pastoris; (7) Ekspresi -amilase dan ko-ekspresi Sec4p; (8) Analisis aktivitas -amilase; (9) Karakterisasi -amilase dan Sec4p intra dan ekstraselular.
29 BAB IV. METODE PENELITIAN
4.1 Desain Penelitian
Penelitian yang akan dilakukan merupakan ekspreimen laboratorium secara kuantitatif, dengan rincian sebagai berikut:
1. Amplifikasi gen SEC4 dan subkloning dalam E. coli.
2. Karakterisasi dan penentuan urutan nukleotida SEC4 hasil subkloning
3. Ligasi fragmen SEC4 ke vektor pPIC3.5K menghasilkan plasmid pPIC3.5K-SEC4
4. Transformasi E. coli menggunakan plasmid pPIC3.5K-SEC4 5. Penentuan urutan nukleotida SEC4 hasil kloning
6. Transformasi P. pastoris menggunakan plasmid pPIC3.5K-SEC4 7. Seleksi dan karakterisasi transforman P. pastoris
8. Ekspresi -amilase dan ko-ekspresi Sec4p
9. Analisis aktivitas -amilase dan penentuan kadar protein 10. Karakterisasi -amilase dan Sec4p intra dan ekstraselular.
4.2. Metodologi Penelitian
4.2.1 Amplifikasi SEC4 P. pastoris dan subkloning dalam E. coli.
Gen SEC4 P. pastoris diamplifikasi dengan teknik PCR. Campuran reaksi PCR terdiri atas 1 μL hasil isolasi DNA genom P. pastoris; bufer PCR 1X; primer 5’Sec4f (5’-TTGAATTCATGGCATCAAGAGGCACATCA-3’) 0,4 μM; primer 3’Sec4r (5’-TT GAATTCTCAACAACAAGACGATTTGGT-3’) 0,4 μM (urutan yang digarisbawahi merupakan urutan sisi pengenalan enzim restriksi EcoR1); dNTP 0,2 mM (Fermentas); MgCl2 2,5 mM; 1,25 U enzim Taq DNA polymerase (Fermentas) dan air bebas nuklease hingga 50 μL. Proses PCR dilakukan menggunakan mesin Mastercycler® 5330 (Eppendorf) sebanyak 30 siklus, dengan masing-masing siklus terdiri dari tahap-tahap denaturasi templat pada suhu 95oC selama 1 menit, tahap penempelan primer (annealing) pada suhu 51oC selama 1 menit, dan tahap pemanjangan primer pada suhu 72oC selama 1 menit. Hasil PCR dianalisis dengan elektroforesis gel agaros 1% (b/v), kemudian dimurnikan menggunakan GeneJET Gel Extraction Kit (Fermentas). Fragmen DNA hasil pemurnian, di analisis dengan elektroforesis agaros 1 %(b/v).
30 Setelah dimurnikan, hasil PCR diligasi ke vektor pJet1.2 (Fermentas). Reaksi ligasi dilakukan dengan perbandingan molar antara vektor pJET1.2 dan insert gen SEC4 1:3. Campuran reaksi ligasi terdiri dari 10 μL buffer 2x reaksi; 5 μL purified SEC4 hasil PCR; 1 μL (0.05 pmol ends) vektor pJET1.2; 1 uL blunting enzyme, air bebas nuklease hingga 19 μL; dan 1 μL T4 DNA ligase. Volume total reaksi ligasi adalah 20 μL. Campuran kemudian divortex dan disentrifugasi selama 3-5 detik. Campuran diinkubasi pada suhu 22C selama 15 menit.
Vektor pJet1.2 yang telah membawa gen SEC4 (pJet1.2-SEC4) digunakan untuk mentransformasi E. coli TOP10F’. Pembuatan sel kompeten dilakukan mengikuti prosedur CaCl2 (Sambrook, et al., 1989). Sejumlah 5 μL DNA hasil ligasi ditambahkan ke dalam tabung yang berisi 50 μL sel kompeten, kemudian diinkubasi selama 30 menit pada suhu 4C, kemudian dilakukan heat shock pada suhu 42C selama 90 detik. Kemudian segera didinginkan di dalam es selama 10 menit. Campuran ini kemudian ditambahkan 950 μL media LB cair dan diinkubasi pada suhu 37C selama 2 jam dengan laju pengocokan 150 rpm. Kemudian disentrifugasi pada 12000 rpm selama 30 detik. Sebanyak 900 μL supernatan dibuang, pelet sel diresuspensi dengan supernatan sisa sebanyak 100 μL dan kemudian ditumbuhkan pada media LB padat yang telah mengandung Tetrasiklin 15 μg/mL dan Ampicillin 100 μg/mL, kemudian diinkubasi pada suhu 37C selama 16-18 jam.
Koloni transforman E. coli yang tumbuh berwarna putih dikarakterisasi melalui isolasi plasmid rekombinan (Sambrook, et al., 1989), analisis restriksi menggunakan EcoR1, kemudian ditentukan urutan nukleotidanya. Urutan nukleotida gen SEC4 hasil isolasi dari E. coli TOP10F’ dengan konsentrasi DNA sekitar 100 ng/μL ditentukan dengan metode dideoksi Sanger (Dye Terminator) di Macrogene (Korea). Primer yang digunakan untuk sekuensing adalah pasangan primer pJetfor dan pJetref (primer universal untuk vektor pJet1.2). Hasil sekuensing di jajarkan menggunakan program Seqman DNAStar.
4.2.2. Karakterisasi pJET1.2-SEC4 rekombinan
a. Isolasi Transforman E. coli TOP10 F’ (pJET1.2-SEC4 ) dengan Metode Miniprep Transforman E.coli TOP 10F’ yang mengandung pJET1.2─SEC4 diinokulasi dalam LB cair 6 mL yang ditambahkan Tetrasiklin 15 μg/mL dan Ampicillin 100 ug/mL selama 16-18 jam, 37oC, dengan laju pengocokan 150 rpm. Kemudian sejumlah kultur
31 transforman E.coli TOP 10F’ yang telah ditumbuhkan dimasukan ke dalam tabung mikrosentrifugasi 1.5 mL lalu disentrifugasi dengan kecepatan 12000 rpm selama 30 detik untuk mengumpulkan pelet. Pelet ditambahkan dengan 500 μL buffer STE (NaCl 0,1 M, tris–Cl 10 mM pH 8,0, EDTA pH 8,0), divortex hingga pelet larut, dan kemudian disentrifugasi dengan kecepatan 10000 rpm selama 30 detik. Pelet diresuspensi dengan larutan A sebanyak 300 μL, lalu ditambahkan dengan larutan III sebanyak 150 μL, kemudian larutan diinversi. Campuran didiamkan selama 3 menit, kemudian disentrifugasi dengan kecepatan 14000 rpm selama 5 menit. Supernatan dipipet sebanyak 400 μL ke tabung mikrosentrifugasi 1.5 mL baru. Supernatan ditambahkan dengan etanol p.a 100% sebanyak 800 μL (2X volume supernatan), divortex selama 10 detik, didiamkan selama 5 menit, dan kemudian disentrifugasi dengan kecepatan 12000 rpm selama 5 menit. Pelet yang diperoleh dicuci dengan etanol p.a 70% sebanyak 1 mL, divortex selama 10 detik, dan disentrifugasi dengan kecepatan 12000 rpm selama 3 menit. Supernatannya dibuang, kemudian pelet dalam tabung mikrosentrifugasi dikeringkan di dalam konsentrator. Pelet kemudian dilarutkan dengan 50 μL ddH2O steril. Larutan kemudian dianalisis dengan elektroforesis gel agarosa 1% (b/v).
b. Pemurnian DNA Plasmid Hasil Isolasi dengan Metode Presipitasi Etanol
Larutan hasil isolasi ditambahkan natrium asetat 3M sebanyak 0.1 x volume dan etanol p.a 100% 2 x volume, campuran larutan kemudian diinversi dan diinkubasi pada suhu -20oC semalaman. Larutan kemudian disentrifugasi dengan kecepatan 12000 rpm selama 30 menit pada suhu 4oC. Supernatan dibuang, pelet dicuci dengan penambahan etanol p.a 70% sebanyak 5 x volume. Larutan disentrifugasi dengan kecepatan 12000 rpm selama 10 menit pada suhu 4oC. Supernatan dibuang, pelet kemudian dikeringkan di dalam konsentrator. Pelet kemudian dilarutkan dengan 50 μL ddH2O steril. Larutan kemudian dianalisis dengan elektroforesis gel agarosa 1% (b/v).
c. Restriksi Plasmid pJET1.2─SEC4
Sebanyak 10 uL plasmid pJET1.2-SEC4 hasil isolasi ditambahkan 2 uL buffer EcoRI 10x, 2 uL enzim EcoRI (10 U/mL), dan air bebas nuklease hingga volume total reaksi 20 uL. Kemudian diinkubasi pada suhu 37oC selama 2 jam. Setelah itu dikarakterisasi dengan elektroforesis gel.
32 4.2.3 Penentuan Urutan Nukleotida pJET1.2─SEC4
Urutan nukleotida gen SEC4 hasil isolasi dari E. coli TOP10F’ dengan konsentrasi DNA sekitar 100 ng/μL ditentukan dengan Metode dideoksi Sanger (Dye Terminator) di Macrogene (Korea) dengan menggunakan primer pJet-for dan pJet-rev.
4.2.4 Kloning Fragmen SEC4 dalam E. coli TOP10F’
a. Isolasi/ Restriksi Plasmid pJET1.2─SEC4 dan vektor pPIC3.5K
Koloni positif mengandung plasmid pJET1.2─SEC4 diisolasi dengan menggunakan GeneJET Plamid Miniprep Kit (Fermentas) mengikuti prosedur. DNA hasil isolasi dilarutkan dalam 50 uL ddH2O steril kemudian direstriksi dengan enzim
EcoRI dan dikarakterisasi dengan elektroforesis agarosa. Hal yang sama dilakukan pada vektor pPIC3.5K.
b. Pemurnian fragmen SEC4 dan pPIC3.5K GeneJET Extraction Kit (Fermentas) Masing-masing fragmen DNA (SEC4 dan pPIC3.5K) hasil restriksi pada gel agarosa dimurnikan menggunakan GeneJET Extraction Kit (Fermentas) mengikuti prosedur seperti sudah dijelaskan diatas.
c. Ligasi Fragmen DNA SEC4 dengan Vektor pPIC3.5K
Reaksi ligasi dilakukan dengan perbandingan molar antara vektor pPIC3.5K dan insert gen SEC4 1:5. Campuran reaksi ligasi terdiri dari 2 μL buffer 10x reaksi; 1.22 μL purified SEC4; 1 μL vektor pJET1.2; air bebas nuklease hingga 19 μL; dan 1 μL T4 DNA ligase. Volume total reaksi ligasi adalah 20 μL. Campuran kemudian divortex dan disentrifugasi selama 3-5 detik. Campuran diinkubasi pada suhu 220C selama 1 jam. d. Transformasi E. coli TOP10F’ Menggunakan Plasmid pPIC3.5K-SEC4
Proses transformasi dimulai dengan pembuatan sel kompeten metoda CaCl2 (Sambrook et al., 1986). Sejumlah 5 μL DNA hasil ligasi digunakan untuk mentransformasi E. coli TOP10 dengan metoda heat shock pada suhu 420C selama 90 detik. Transforman E. coli ditumbuhkan pada media LB padat yang telah mengandung Tetrasiklin 15 μg/mL dan Ampicillin 100 μg/mL, kemudian diinkubasi pada suhu 370
C selama 16-18 jam.
e. Restriksi Plasmid pPIC3.5K─SEC4
Sebanyak 10 uL plasmid pJET1.2-SEC4 hasil isolasi ditambahkan 2 uL buffer EcoRI 10x, 2 uL enzim EcoRI (10 U/mL), dan air bebas nuklease hingga volume total
33 reaksi 20 uL. Kemudian diinkubasi pada suhu 37oC selama 2 jam. Setelah itu dikarakterisasi dengan elektroforesis gel.
4.2.5 Penentuan Urutan Nukleotida pPIC3.5K─SEC4
Urutan nukleotida gen SEC4 dalam plasmid pPIC3.5K-SEC4 hasil isolasi dari E. coli TOP10F’ dengan konsentrasi DNA sekitar 100 ng/μL ditentukan dengan Metode dideoksi Sanger (Dye Terminator) di Macrogene (Korea) dengan menggunakan primer 5’AOX dan 3’AOX.
4.2.6 Transformasi P. pastoris menggunakan plasmid pPIC3.5K-SEC4 a. Linearisasi plasmid pPIC3.5K-SEC4
Sebanyak 1-5 μg plasmid rekombinan pPIC3.5K-SEC4 dilinearisasi menggunakan enzim restriksi BspE1. Campuran reaksi mengandung 1-5 μg plasmid rekombinan, 10 Unit BspE1 dan buffer Tango 1X. Restriksi dilakukan dalam volume 20 L, dan diinkubasi pada suhu 37C selama 16 jam. Hasil restriksi di elektroforesis dengan gel agarosa 1%.
b. Transformasi P. pastoris metode EasyCompTM (Invitrogen, 2006)
Persiapan sel kompeten P. pastoris MS-20 [ALP1]. Koloni tunggal P. pastoris
MS-20 [ALP1] diinokulasi ke dalam 10 mL YPD. Kemudian ditumbuhkan semalam pada suhu 28-30C dengan pengocokan pada 250 rpm. Sebanyak 500 μL kultur dipindahkan ke dalam 10 mL media YPD baru dan diinkubasi pada suhu 28-30C dengan pengocokan hingga mencapai OD0,6-1,0 (kira-kira 5 jam). Prosedur persiapan sel kompeten dilakukan mengikuti protokol (Invitrogen, 2006).
Transformasi P. pastoris. Sebanyak 3 μg (volume 5 μL) plasmid pPIC3.5K– SEC4 yang telah linear ditambahkan ke dalam suspensi sel kompeten. Kemudian ditambahkan 1 mL larutan II dan dihomogenkan menggunakan vorteks. Setelah itu diinkubasi pada suhu 30C selama 1 jam dalam penangas air. Campuran dihomogenkan setiap 15 menit dengan vorteks. Kemudian dilakukan heat shock menggunakan heating block atau penangas air pada suhu 42C selama 10 menit. Sel dipisahkan ke dalam dua tabung 1,5 mL (kira-kira 525 μL per tabung), ditambah 1 mL media YPD cair. Sel diinkubasi pada suhu 30C selama 1 jam, kemudian disentrifugasi pada 12000 g selama 5 menit pada suhu ruang, supernatan dibuang. Pelet diresuspensi dalam 500 μL larutan III
34 dan pelet digabungkan ke dalam satu tabung. Pelet disentrifugasi pada kecepatan 12000 g selama 5 menit pada suhu ruangan lalu supernatan dibuang. Pelet diresuspensi dalam 150 μL larutan III. Semua transforman disebarkan pada cawan petri berisi media YPD padat. Kemudian diinkubasi selama 3 sampai 10 hari pada suhu 30C (Invitrogen, 2006).
4.2.7 Seleksi dan karakterisasi tranforman P. pastoris
Seleksi transforman P. pastoris. Seleksi akan dilakukan dengan menumbuhkan transforman dalam media padat MMH (minimal methanol medium+ histidin: YNB 1,34% (b/v), biotin 4x10-5% (b/v), metanol 0,5% (v/v), histidin 0,004% (b/v) dan MM (minimal methanol medium: YNB 1,34% (b/v), biotin 4x10-5% (b/v), metanol 0,5% (v/v). Galur His+ akan tumbuh normal pada kedua media, sementara galur His- tumbuh normal pada media MMH tetapi menunjukkan pertumbuhan lambat atau sama sekali tidak tumbuh pada media MM.
Karakterisasi transforman P. pastoris. Karakterisasi dilakukan untuk mengetahui apakah gen SEC4 dan gen ALP1 sudah terintegrasi ke kromosom P. pastoris. Karakterisasi dilakukan dengan metoda PCR, menggunakan pasangan primer untuk mengamplifikasi gen SEC4 dan ALP1 dan templat genom P. pastoris.
4.2.8 Ekspresi -amilase dan ko-ekspresi Sec4p
Satu koloni tunggal transforman P. pastoris diinokulasi dalam 10 mL media YPD cair, dan diinkubasi semalam pada suhu 30C dengan pengocokan 200 g. Sebanyak 1 mL kultur cair dipindahkan ke 10 mL media BMGY+ Histidin (buffered glycerol complex medium: ekstrak ragi 1% (b/v), bakto pepton 2% (b/v), kalium fosfat 100 mM (pH 6), YNB 1,34% (b/v), biotin 4x10-5% (b/v), gliserol 1% (v/v)) menggunakan labu 100 mL. Sel ditumbuhkan pada suhu 28–30C dalam inkubator pengocok 250 g hingga mencapai OD600 = 6-10 (kira-kira 18-20 jam). Sel di panen dengan sentrifugasi pada 1500 – 3000 g selama 5 menit pada suhu ruang. Supernatan didekantasi dan pelet sel diresuspensi dalam 25 mL media BMMH (buffered minimal methanol-histidin: YNB 1,34% (b/v), kalium fosfat 100 mM pH 6, biotin 4x10-5% (b/v), metanol 1% (v/v), histidin 0,004%) menggunakan labu 250 mL. Labu ditutup dengan kapas steril dan inkubasi dilanjutkan dengan pengocokan. Induksi dilakukan dengan menambahkan metanol dengan konsentrasi akhir 0,75% setiap 24 jam, pada jam ke 24, 36, 72, 96, 120, dan 144. Pengambilan sampel dilakukan setiap jam induksi dengan mengambil 1 mL kultur hasil
35 ekspresi dipindahkan ke dalam tabung mikro 1,5 mL. Sampel disentrifugasi pada kecepatan maksimum selama 2-3 menit pada suhu ruang. Supernatan dan pelet disimpan pada pendingin suhu -20C sampai siap untuk di uji (Invitrogen, 2006).
4.2.9 Analisis aktivitas -amilase
Hasil ekspresi protein pada supernatan dan pelet sel diuji aktivitas amilase intra dan ekstraselularnya dengan metode DNS (Bernfeld, 1948) ditentukan kadar protein (metode Lawry, 1975).
4.2.10 Karakterisasi -amilase dan Sec4p intra dan ekstraselular.
Sec4p intraselular P. pastoris dan -amilase hasil ekspresi intra dan ekstraseluler P. pastoris akan dikarakterisasi dengan metoda SDS-PAGE (Sambrook et al., 1989). menggunakan gel dengan komposisi 10% separating gel dan 4% stacking gel.
Persiapan supernatan: 50 μL supernatan dicampur dengan sampel bufer (Tris-Cl
50 mM, pH 6,8, gliserol 1% (v/v), β-merkapoetanol 100 mM, SDS 2% (b/v), bromofenol biru 0,1% b/v) dan dipanaskan dalam air mendidih selama 5 menit dan didinginkan.
Persiapan pelet sel: Pelet sel diresuspensi dalam 300 μL aquadest, dan
ditambahkan 100 μL TCA 50%, diaduk segera. Sampel dibekukan pada suhu -80C selama 30 menit. Sel disentrifugasi pada suhu ruang dengan kecepatan 14.000 g selama 5 menit. Pelet sel dicuci dua kali dengan 500 μL aseton 80% dingin, dilanjutkan dengan sentrifugasi pada 14.000 g selama 5 menit pada suhu ruang. Supernatan dibuang dengan hati-hati, dan pelet dibiarkan mengering. Pelet dilarutkan dalam 100 μL SDS 1% dalam natrium hidroksida 0,1N. Kemudian ditambahkan sampel buffer (Tris-Cl 50 mM pH 6,8, gliserol 1% v/v, β-merkaptoetanol 100 mM, SDS 2% b/v, bromofenol biru 0,1% b/v) dan dipanaskan dalam air mendidih selama 5 menit dan didinginkan. Kemudian dikarakterisasi dengan SDS-PAGE.
36 4.3 Bagan Alir Penelitian
38 BAB V. HASIL YANG DICAPAI
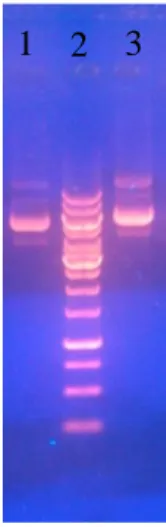
5.1 Amplifikasi SEC4 P. pastoris dan subkloning dalam E. coli.
Amplifikasi gen SEC4 dengan teknik PCR menggunakan pasangan primer 5’Sec4f dan 3’Sec4r menghasilkan fragmen berukuran 615 pb (Gambar 1a) sesuai dengan panjang gen SEC4 P. pastoris di GenBank (nomor akses: XM_002492307.1). Selanjutnya gen SEC4 telah berhasil disubkloning menggunakan vektor pJet1.2 dalam E. coli (Gambar 1b). Sebanyak 104 koloni transforman E. coli telah diperoleh dan diremajakan untuk pencarian koloni yang mengandung plasmid rekombinan.
a. b.
Gambar 5.1. (a) Produk PCR gen SEC4. (lajur 1) marker 1 kb, (lajur 2) SEC4. (b) Koloni transforman E. coli [pJET1.2-SEC4].
Hasil isolasi plasmid dan karakterisasi dengan enzim EcoR1 diperoleh koloni yang positif mengandung gen SEC4 (Gambar 2). Hasil restriksi plasmid yang ditunjukkan pada Gambar 2 menunjukkan bahwa koloni 92 (lajur 6) positif mengandung plasmid pJET-SEC4, ditunjukkan dengan adanya pita pada daerah ~3000 bp yang sesuai dengan ukuran plasmid pJET1.2 dan pita pada daerah ~615 bp yang sesuai dengan ukuran gen SEC4. Koloni 64 dan 68 (lajur 3 dan 4) diduga mengandung vektor pJET1.2 yang mengalami re-ligasi, ditunjukkan dengan pita plasmid yang tidak terpotong oleh enzim EcoRI karena vektor pJET1.2 tidak memiliki sisi pengenal EcoRI. Namun, seharusnya koloni ini tidak tumbuh pada media seleksi karena vektor pJET1.2 yang tidak disisipi DNA sisipan akan mengekspresikan protein yang mematikan bagi transforman E. coli. Diduga hal ini terjadi karena adanya kontaminasi nuklease. Kontaminasi ini dapat
39 merusak integritas dari gen mematikan dengan rusaknya ujung vektor pJET1.2 oleh aktivitas nuklease. Hasil restriksi koloni 21 dan 50 (lajur 2 dan 5) menghasilkan plasmid yang terpotong oleh enzim EcoRI, namun tidak menunjukkan pita spesifik pET1.2 maupun SEC4. Diduga hal ini terjadi karena proses restriksi yang kurang sempurna sehingga menghasilkan plasmid pJET-SEC4 linear, ditunjukkan dengan pita yang terletak diantara daerah ~3500 pb.
Gambar 5.2. Hasil restriksi plasmid pJET1.2-SEC4 dengan enzim EcoRI. (lajur 1) marker 1 kb, (lajur 2) pJET-SEC4 koloni 21 cut/ EcoRI, (lajur 3) pJET-SEC4 koloni 64 cut/
EcoRI, (lajur 4) pJET-SEC4 koloni 68 cut/EcoRI, (lajur 5) pJET-SEC4 koloni 50 cut/ EcoRI, (lajur 6) pJET-SEC4 koloni 92 cut/EcoRI.
5.2 Kostruksi plasmid ekspresi pPIC3,5K-SEC4 dan kloning dalam E. coli
Gen SEC4 hasil subkloning dipotong dari plasmid pJet1.2-SEC4 menggunakan enzim EcoR1. Pemotongan plasmid ini dengan enzim EcoR1 menghasilkan dua pita DNA yaitu 3000 pb (vektor pJet1.2) dan 615 pb (gen SEC4). Sedangkan pemotongan plasmid pPIC3.5K dengan enzim EcoR1 menghasilkan satu pita dengan ukuran 9000 pb (Gambar 5.3)
Gambar 5.3. Hasil restriks pJET1.2-SEC4 dan vektor pPICK3.5K dengan enzim EcoR1. (lajur 1) marker 1 kb, (lajur 2) pPICK3.5K cut/ EcoR1, (lajur 3) pJET1.2-SEC4 cut/
40 Fragmen 9000 pb (pPIC3.5K) dan 615 pb(SEC4) dipotong dari gel agaros, kemudian dimurnikan menggunakan GeneJet Gel Extraction Kit (Fermentas). Kedua fragmen DNA ini diligasi dengan perbandingan molar fragmen SEC4:vektor pPIC3.5K = 5:1. Hasil ligasi dikloning dalam E. coli TOP10F’ dan diperoleh 104 transforman E. coli (Gambar 5.4).
a. b.
Gambar 5.4. Koloni E. coli [pPIC3.5K-SEC4] yang diremajakan.(a) koloni 1-52, (b) koloni 53-104.
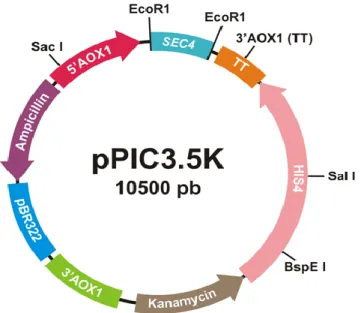
Peta plasmid rekombinan pPIC3.5K-SEC4 hasil konstruksi diperlihatkan pada gambar 5.5. Plasmid ini membawa dua gen marker seleksi yaitu gen pengode resistan ampisilin dan kanamisin. Gen SEC4 berada dibawah kontrol promotor dan terminator AOX1. Induksi ekspresi dilakukan dengan menambahkan penginduksi metanol.
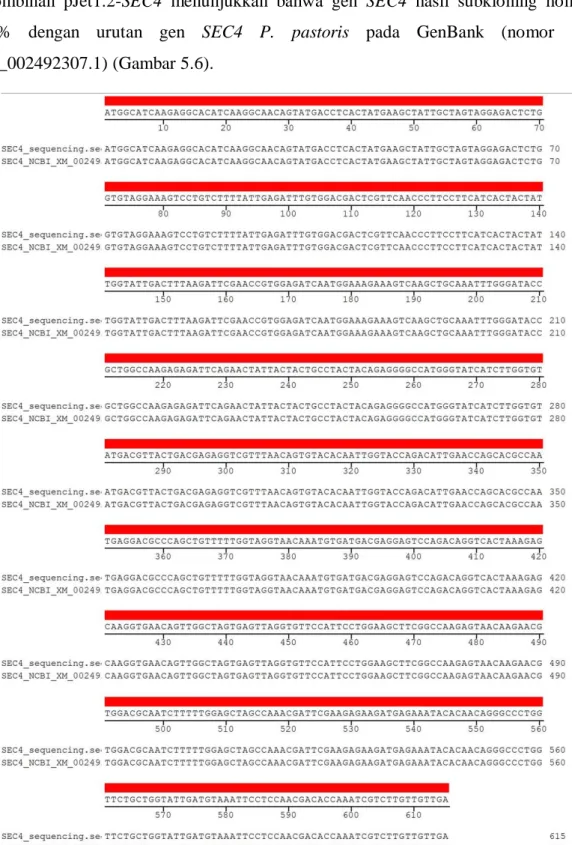
41 Hasil penentuan urutan nukleotida terhadap urutan gen SEC4 dalam plasmid rekombinan pJet1.2-SEC4 menunjukkan bahwa gen SEC4 hasil subkloning homologi 100% dengan urutan gen SEC4 P. pastoris pada GenBank (nomor akses: XM_002492307.1) (Gambar 5.6).
Gambar 5.6 Homologi urutan nukleotida SEC4 hasil subkloning dengan urutan SEC4 nomor NCBI. Warna merah menunjukkan tingkat homologi 100%.