a
LAPORAN AKHIR
PENELITIAN UNGGULAN PERGURUAN TINGGI
The Development and Upgrading of Seven Universities In Improving the Quality and Relevance of
Higher Education in Indonesia
OPTIMALISASI POTENSI KERBAU DALAM USAHA PENINGKATAN KETAHANAN PANGAN DI ACEH DENGAN METODE PEMBEKUAN
SPERMATOZOA
Tahun ke 1 dari rencana 2 tahun
Dr. Kartini Eriani, M.Si 0021047001 Dr. Rosnizar, M.Sc 0009037102 Widya Sari, S.Si, M. Si 0030087301
Dibiayai oleh Direktorat Penelitian Pengabdian kepada Masyarakat, Direktorat Jenderal Pendidikan Tinggi, Kementerian Pendidikan dan Kebudayaan sesuai dengan Surat Perjanjian Penugasan Pelaksanaan Hibah Penelitian bagi Dosen Perguruan Tinggi Batch I Universitas Syiah
Kuala Tahun anggaran 2015 Nomor 035/SP2H/PL/Dit.Litabmas/II/2015 tanggal 5 Februari 2015
UNIVERSITAS SYIAH KUALA
Desember, 2015
i
ii RINGKASAN
Pembekuan spermatozoa kerbau aceh sangat perlu dilakukan untuk meningkatkan populasi dan mutu genetik kerbau di Aceh. Penelitian ini dilakukan untuk mengamati kualitas dan morfologi abnormal spermatozoa kerbau sampai ke tahap pembekuan dengan menggunakan 2 ekor kerbau pejantan. Penelitian dilaksanakan di Laboratorium Prosesing Spermatozoa Beku BIB, Saree dan Laboratorium Riset Biologi FMIPA Unsyiah. Hasil pengamatan kualitas dan morfologi abnormal spermatozoa yang diperoleh secara berturut-turut: volume 1,49±1,49 ml, pH semen 7±0. Konsentrasi spermatozoa adalah 4072±67 juta/ml. Persentase motilitas 74,33%±4,04, Persentase spermatozoa hidup sebesar 78,33%±2,88. Persentase spermatozoa abnormal sebesar 22%±2,64 Hasil penelitian menunjukkan bahwa kualitas semen dapat dilanjutkan untuk proses pembekuan.
iii PRAKATA
Puji syukur penulis panjatkan kehadirat Allah SWT atas rahmat dan kasih sayang-Nya sehingga laporan kemajuan penelitian yang berjudul “Optimalisasi Potensi Kerbau dalam Usaha Meningkatkan Ketahanan Pangan di Aceh dengan Metode Pembekuan Spermatozoa” telah diselesaikan. Shalawat dan salam kepada Nabi Muhammad SAW yang telah membawa perubahan mendasar dalam ilmu pengetahuan.
Laporan kemajuan penelitian tahap satu guna memenuhi salah satu persyaratan dalam pelaksanaan penelitian yang didanai oleh 7in1 melalui Lembaga Penelitian Universitas Syiah Kuala. Laporan kemajuan penelitian ini disusun berdasarkan hasil penelitian yang dilaksanakan di Balai Inseminasi Saree.
Penulis banyak mendapatkan bantuan dan bimbingan dari berbagai pihak selama pelaksanaan penelitian yang masih terus berlangsung sampai saat ini. Oleh karenanya penulis mengucapkan terimakasih kepada:
1. Prof. Dr. Ir. H. Hasanuddin, M.S, selaku Ketua Lembaga Penelitian Universitas Syiah Kuala.
2. Dr. Tarmizi, M.Sc, selaku koordinator IDB Unsyiah yang mendanai penelitian 7in1 3. Syahrial, M.Si, selaku Kepala BIB Saree yang telah mengizinkan penulis untuk
penelitian di BIB Saree dengan segala fasilitas yang ada
4. Dr. Drh. Dasrul, M.Si, selaku staf ahli di BIB Saree yang telah membantu pelaksanaan penelitian ini
5. Serta seluruh teknisi lapangan dan Laboratorium BIB Saree yang tidak mungkin disebut satu persatu.
Harapan penulis semoga penelitian ini dapat kami selesaikan sesuai proposal yang kami ajukan dan dapat bermanfaat bagi perkembangan ilmu pengetahuan, masyarakat dan pemerintah.
Banda Aceh, 30 November 2015
iv
Bab 1. PENDAHULUAN ... 1
Bab 2. TINJAUAN PUSTAKA... ... 4 Bab 3. TUJUANDAN MANFAAT... ... 8 Bab 4. METODE PENELITIAN... 9
Bab 5. HASIL DAN PEMBAHASAN... 17
Bab 6. RENCANA TAHAPAN BERIKUTNYA... 24
Bab 7. KESIMPULAN DAN SARAN... 25
DAFTAR PUSTAKA ... 26
Penulis DAFTAR ISI Halaman Halaman Pengesahan ... i
Ringkasan ... ii
Prakata ... iii
Daftar Isi . . . i v Daftar Tabel ... v
1 BAB 1. PENDAHULUAN
Kerbau merupakan salah satu ternak yang dapat hidup dan berkembang baik di Daerah Aceh, namun sampai saat ini pemanfaatan ternak kerbau belum maksimal karena masih dipergunakan hanya untuk membajak sawah dan dikonsumsi dagingnya oleh sebahagian masyarakat. Padahal di Aceh populasi kerbau sangat banyak dibandingkan daerah lain dan memiliki keragaman genetik yang luar biasa karena kerbau tersebar di beberapa daerah seperti pulau Aceh, Simeulu, Aceh Selatan, Aceh Barat, Aceh Besar dan lain sebagainya. Berdasarkan data yang diperoleh, jumlah ternak kerbau di Indonesia pada tahun 2005 diperkirakan sebanyak 2.428.000 ekor (Ditjen Peternakan, 2005) dan tersebar di seluruh propinsi. Populasi tertinggi dijumpai di Propinsi NAD diikuti Sumatera Barat dan Sumatra Utara. Sehingga sudah selayaknya untuk memanfaatkan kerbau sebagai sumber protein seperti daging dan susu di daerah Aceh seperti yang sudah dimanfaatkan dibeberapa daerah lainya seperti Sumatra Barat.
Potensi kerbau yang belum dioptimalkan ini seharusnya dapat dioptimalkan untuk memenuhi berbagai tuntutan kebutuhan masyarakat, jika mendapat perhatian yang serius dari berbagai pihak yang terkait langsung sebagai praktisi di bidang peternakan. Seiring dengan itu juga untuk meningkatkan potensi ekonomi peternak di pedesaan dan sekaligus menjawab tantangan kemungkinan ekspor daging dan susu kerbau di masa yang akan datang.
Upaya yang harus ditempuh untuk menjawab tantangan tersebut adalah bagaimana meningkatkan populasi dalam waktu yang relatif singkat dan memperbaiki mutu genetik secara bertahap. Tantangan tersebut perlu didekati dengan penerapan teknologi di bidang peternakan yang telah berkembang dengan pesat dewasa ini, khususnya teknologi reproduksi. Penerapan teknologi reproduksi pada kerbau menjadi suatu hal yang penting, karena selama ini memang belum mendapat ruang yang memadai dari para peneliti. Hal ini ditandai oleh langkanya informasi hasil penelitian di bidang reproduksi pada kerbau.
Salah satu teknologi reproduksi yang cukup aplikatif dan efisien untuk diterapkan adalah teknologi Inseminasi Buatan (IB). IB merupakan teknik yang
2 cukup efektif dan ampuh untuk dimanfaatkan dalam upaya meningkatkan populasi dan mutu genetik kerbau, namun khusus pada kerbau belum begitu populer karena terdapat kendala pada plasma semen kerbau. Dengan demikian untuk meningkatkan kualitas spermatozoa perlu memodifikasi media pengencer dengan penambahan antioksidan dan krioprotektan di dalam pengencer semen.
Dalam proses pembekuan (kriopreservasi) semen, spermatozoa memperoleh perlakuan suhu yang ekstrim sangat rendah (-196˚C) yang dapat mengakibatkan dampak negatif terhadap spermatozoa. Pada suhu rendah di bawah titik beku akan terjadi perubahan-perubahan fisik dan kimiawi di dalam sel spermatozoa seperti terbentuknya kristal-kristal es dan meningkatnya konsentrasi elektrolit intraseluler, sehingga menyebabkan terjadinya kejutan dingin pada spermatozoa. Untuk mengurangi pengaruh negatif ini, beberapa perlakuan dapat dicobakan seperti dengan menambahkan berbagai senyawa berupa krioprotektan dan antioksidan di dalam pengencer semen. Dengan demikian, kerusakan spermatozoa selama proses kriopreservasi semen dapat diminimalkan, sehingga kualitas semen beku yang diperoleh lebih baik.
Ada dua jenis krioprotektan, yaitu krioprotektan ektraseluler berupa gula seperti laktosa, maltosa dan sukrosa tidak dapat memasuki sel, sehingga senyawa tersebut melindungi sel dengan cara membungkus membran plasma sel. Sedangkan krioprotektan intraseluler seperti gliserol, etilen glikol dan dimethyl sulfoxside (DMSO) dapat memasuki sel, sehingga dapat melindungi sel dari dalam dengan cara menyeimbangkan osmolaritas intra dan ekstra sel serta memodifikasi struktur permukaan kristal-kristal es sehingga tidak terlalu tajam (Supriatna dan Pasaribu, 1992). Penggunaan kedua jenis krioprotektan ini secara bersamaan dapat lebih optimal dalam melindungi sel spermatozoa dari kerusakan selama proses produksi semen beku ( Rizal, 2005).
Penggunaan laktosa dan gliserol sebagai krioprotektan telah banyak dilakukan untuk pembekuan semen pada berbagai hewan ternak. Namun pada kerbau belum diketahui konsentrasi yang optimum untuk mempertahankan kualitas semen.
Glutation dan β-karoten sebagai senyawa anti oksidan mampu mengikat radikal bebas hidroksil (OH-) dan singlet oksigen (O2-) (Tuminah 2000) yang sangat reaktif dan
3 menyebabkan terjadinya peroksidasi lipid pada membran plasma sel, sehingga memungkinkan digunakan dalam pengenceran semen. Namun demikian, pemakaian glutation dan β-karoten sebagai anti oksidan di dalam pengenceran semen beku masih jarang sehingga memerlukan pengkajian yang lebih mendalam pada semen berbagai jenis hewan. Menurut Suryohudoyo (2000) glutation bersifat hidrofilik dan berperan dalam sitosol, sedangkan β-karoten bersifat lipofilik dan berperan pada membran plasma sel.
Dengan demikian diharapkan kedua senyawa anti oksidan ini dapat secara optimal melindungi sel spermatozoa dari kerusakan akibat pemakaian senyawa oksidan dan senyawa radikal bebas selama proses pembekuan semen.
Permasalahan yang muncul yaitu semakin menurunnya produktivitas kerbau di Aceh karena terjadi penurunan mutu genetik. Hal ini terjadi karena belum dilakukan seleksi pejantan dan belum diaplikasikan bioteknologi reproduksi dalam rangka menjaga, mempertahankan serta meningkatkan mutu genetik kerbau di Aceh. Untuk itu perlu dilakukan seleksi kerbau pejantan yang dapat digunakan sebagai sumber material genetik
Kerbau pejantan unggul dapat dijadikan sebagai donor semen dengan tujuan memperbaiki mutu genetik, melalui pendekatan teknologi reproduksi. Spermatozoa yang dikoleksi dari pejantan unggul dapat dimanfaatkan secara optimal sebagai salah satu alternatif sumber spermatozoa untuk memenuhi kebutuhan dalam penerapan berbagai teknologi reproduksi.
Berdasarkan hal tersebut, maka sudah selayaknya penelitian ke arah pembekuan spermatozoa kerbau dalam rangka memberikan pelayanan IB bagi masyarakat peternak dilaksanakan. Sehingga Perguruan Tinggi memberi kontribusi aktif bagi perkembangan ilmu pengetahuan dan meningkatkan taraf hidup masyarakat.
4 BAB 2. TINJAUAN PUSTAKA
2.1 Krioprotektan
Krioprotektan merupakan suatu zat kimia non elektrolit yang berfungsi mereduksi letal proses kriopreservasi sel baik yang berupa efek larutan maupun pembentukan kristal es ekstraseluler dan intraseluler sehingga dapat menjaga viabilitas sel setelah kriopreservasi. Terdapat dua kelompok krioprotektan dilihat dari sisi fisika/kimia dan membran sel yaitu krioprotektan ekstraseluler dan intraseluler. Krioprotektan intraseluler yaitu krioprotektan yang dapat keluar masuk membran sel dan biasanya memiliki ukuran molekul yang kecil seperti gliserol, dimethylsulfosida (DMSO), etilin glikol (EG) dan 2 propanediol. Krioprotektan ekstraseluler biasanya dengan molekul besar sehingga tidak menembus membran sel seperti fruktosa, sukrosa, protein, lipoprotein, kuning telur, serum darah dan susu (Supriatna dan Pasaribu, 1991).
Dalam proses pembekuan (kriopreservasi) semen, spermatozoa memperoleh perlakuan suhu yang sangat ekstrim rendah. Perlakuan suhu ekstrim yang mencapai – 196oC akan mengakibatkan dampak negatif terhadap spermatozoa. Pada suhu rendah di bawah titik beku akan terjadi perubahan-perubahan yang sangat hebat di dalam sel spermatozoa, serta terbentuknya kristal-kristal es. Kesemua faktor tersebut akan berakibat buruk terhadap sel spermatozoa, khususnya keutuhan membran plasma sel. Keutuhan membran plasma sel spermatozoa menjadi hal yang sangat penting karena membran plasma memiliki fungsi ganda terhadap sel. Selain berfungsi melindungi organel-organel sel dari perusakan mekanik, membran plasma juga berfungsi dalam mengatur lalu lintas zat-zat makanan dan elektrolit-elektrolit keluar masuk sel yang sangat dibutuhkan dalam proses metabolisme. Dengan demikian dapat dikatakan bahwa rusaknya membran plasma sel berarti awal dari proses berakhirnya kehidupan sel itu.
Untuk menjaga integritas membran plasma sel dari kerusakan selama proses produksi semen beku, maka ke dalam pengencer semen harus ditambahkan senyawa yang berfungsi melindungi membran plasma, sehingga dapat mengurangi efek negatif tersebut.
Salah satu senyawa yang sudah dikenal dan telah diterapkan secara luas untuk mengatasi hal tersebut adalah krioprotektan. Selain itu dalam beberapa tahun belakangan ini telah
5 dengan cukup intensif diterapkan pemakaian senyawa antioksidan di dalam pengencer semen. Seperti halnya dengan krioprotektan, pemakaian senyawa antioksidan juga dimaksudkan untuk mengurangi kerusakan spermatozoa selama proses kriopreservasi semen.
Dikenal dua golongan krioprotektan, yakni krioprotektan ekstraseluler dan intraseluler. Krioprotektan ekstraseluler seperti laktosa, maltosa, dan sukrosa tidak dapat memasuki sel, sehingga mereka melindungi sel dengan cara “membungkus” membran plasma sel. Sedangkan krioprotektan intraseluler seperti gliserol, etilen glikol, dan dimethyl sulfoxide (DMSO) dapat memasuki sel, sehingga dapat melindungi sel dari dalam dengan cara menyeimbangkan osmolaritas intra dan ekstrasel serta memodifikasi struktur kristal- kristal menjadi lebih lembut. Penggunaan kedua jenis krioprotektan ini secara bersamaan diharapkan tercipta sinergi yang baik antara keduanya sehingga lebih optimal dalam melindungi sel spermatozoa dari kerusakan selama proses produksi semen beku.
2.2 Antioksidan
Telah dilakukan penelitian pembekuan spermatozoa pada domba garut menggunakan berbagai krioprotektan dan antioksidan untuk mempertahankan kualitas spermatozoa beku (Rizal, 2005). Hasil penelitian tersebut menunjukkan adanya hubungan positif antara kualitas spermatozoa dengan penambahan antioksidan.
Pemakaian laktosa dan gliserol sebagai krioprotektan telah dikenal luas dalam proses kriopreservasi semen berbagai jenis hewan ternak. Namun pada sapi aceh belum diketahui konsentrasi yang optimal dalam mempertahankan kualitas semen beku.
Demikian pula halnya dengan penggunaan antioksidan glutation dan -karoten dalam pengencer semen yang belum lazim digunakan dalam proses kriopreservasi semen.
Glutation dan -karoten sebagai senyawa antioksidan dapat dipahami karena mampu membersihkan radikal bebas hidroksil (OH•) yang sangat reaktif (Tuminah 2000) dan menyebabkan terjadinya peroksidasi lipida pada membran plasma sel, sehingga memungkinkan digunakan di dalam pengencer semen. Namun demikian, pemakaian glutation dan -karoten sebagai antioksidan di dalam pengencer semen beku masih jarang
6 dibandingkan dengan antioksidan lain seperti vitamin C, vitamin E, butylated hydroxytoluene (BHT), dan lain-lain, sehingga memerlukan pengkajian yang lebih mendalam pada semen berbagai jenis hewan. Menurut Suryohudoyo (2000) glutation bersifat hidrofilik dan berperan di dalam sitosol, sedangkan -karoten bersifat lipofilik dan berperan pada membran plasma sel. Dengan demikian diharapkan bahwa dengan kombinasi antara kedua antioksidan ini dapat secara optimal melindungi sel spermatozoa dari kerusakan akibat serangan zat oksidan dan radikal bebas.
Demikian pula halnya dengan upaya kriopreservasi spermatozoa yang diaspirasi dari epididimis perlu dikaji lebih mendalam. Hal ini dimaksudkan sebagai antisipasi terhadap hewan-hewan jantan yang bermasalah dalam melakukan ejakulasi secara normal padahal hewan-hewan ini tergolong hewan langka atau memiliki mutu genetik yang unggul.
Dengan metode ini pelestarian sumberdaya hewan yang mati secara mendadak masih dapat dilakukan, serta dapat juga diterapkan pada hewan-hewan liar dan buas.
Informasi-informasi seperti tersebut di atas belum tersedia dalam jumlah yang memadai pada kerbau Aceh, bahkan belum pernah dilaporkan. Hal inilah yang melandasi diadakannya penelitian ini.
2.3 Peta Jalan Penelitian
Penelitian ini bagian dari tujuan jangka panjang yaitu untuk mendapatkan spermatozoa beku dengan nilai ekonomi tinggi, dapat digunakan sebagai sumber material genetik kerbau jantan unggul, disamping publikasi. Penelitian ini mencakup pekerjaan seleksi kerbau pejantan unggul dan mengkoleksi spermatozoa untuk dibekukan. Pada penelitian ini akan dilakukan analisis kualitas dan viabilitas spermatozoa beku dan uji fertilitas spermatozoa.
7 Belum
- Belum pernah dilakukan - Keberhasilan belum optimal Penelitian pada kerbau Aceh - Menggunakan kerbau lokal Jawa
• Glutation dan β-karoten sudah berhasil untuk membekukan spermatozoa domba garut
Aceh merupakan daerah yang memiliki populasi kerbau terbanyak dan memiliki kualitas yang baik (Hasinah dan Handiwirawan, 2007)
Pemanfaatan kerbau di Aceh belum optimal (daging dan susu) Kebutuhan bahan pangan hewani belum tercukupi
Penambahan Antioksidan telah digunakan dalam pembekuan spermatozoa kerbau lumpur (Dasrul, 2005)
Penambahan Glutation bertingkat Penambahan β- karoten bertingkat
8 BAB 3. TUJUAN DAN MANFAAT
Secara umum hasil penelitian ini bertujuan untuk mendapatkan spermatozoa kerbau dalam bentuk beku yang dapat digunakan untuk inseminasi buatan guna meningkatkan mutu genetik dan populasi kerbau di Aceh. Selanjutnya hasil penelitian ini diharapkan akan bermanfaat bagi pemerintah daerah untuk memenuhi kebutuhan akan protein hewani
Kerbau pejantan unggul dapat dijadikan sebagai donor semen dengan tujuan memperbaiki mutu genetik, melalui pendekatan teknologi reproduksi. Spermatozoa yang dikoleksi dari pejantan unggul dapat dimanfaatkan secara optimal sebagai salah satu alternatif sumber spermatozoa untuk memenuhi kebutuhan dalam penerapan berbagai teknologi reproduksi.
Berdasarkan hal tersebut, maka sudah selayaknya penelitian ke arah pembekuan spermatozoa kerbau dalam rangka memberikan pelayanan IB bagi masyarakat peternak dilaksanakan. Sehingga Perguruan Tinggi memberi kontribusi aktif bagi perkembangan ilmu pengetahuan dan meningkatkan taraf hidup masyarakat.
Adapun keutamaan dari penelitian ini sehingga penting untuk dilakukan antara lain adalah:
1. Mengoptimalkan potensi kerbau dalam aspek meningkatkan mutu genetik dan populasi kerbau dengan cara seleksi pejantan dan membekukan semen (spermatozoa kerbau) sehingga dapat diperoleh stok spermatozoa beku yang unggul dengan cara inseminasi buatan.
2. Hasil penelitian ini diharapkan dapat memberikan manfaat kepada daerah Aceh khususnya petani dan peternak kerbau terhadap pengembangan kerbau sehingga dapat meningkatkan ketahanan pangan di Aceh. Selain itu, manfaat jangka pangjang yang diperoleh dari penelitian ini membuka peluang untuk ekspor.
3. Memberi wawasan terhadap pengembangan IB pada kerbau dengan penyediaan teknik kriopreservasi menggunakan pengencer yang baik.
4. Sebagai salah satu sarana alternatif yang dapat diterapkan dalam upaya meningkatkan populasi dan mutu genetik kerbau.
5. Menghasilkan publikasi ilmiah.
9 BAB 4. METODE PENELITIAN
4.1 Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan di Laboratorium Embriologi Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Syiah Kuala dan BIB Sare., Penelitian ini dimulai bulan Februari 2015 sampai Desember 2016.
4.2 Materi Penelitian Hewan Percobaan
Hewan percobaan yang digunakan adalah empat ekor kerbau pejantan dewasa kelamin asal Simeulu dengan kondisi tubuh dan kesehatan yang baik, berat badan sekitar 400 – 500 kg dan umur sekitar 3 – 5 tahun sebagai sumber semen yang akan diuji kualitasnya. Pejantan dikandangkan secara individu dan diberikan pakan berupa rumput dan leguminosa setiap hari. Untuk menjaga kesehatan, pejantan dimandikan setiap minggu.
4.3 Bahan dan Alat
Tabel 1. Komposisi pengencer dasar
Bahan Jumlah
Tris(hydroxymethyl)aminomethanea (g) Asam sitrat-monohidratb (g)
D(-)Fruktosac (g) Kuning telurd (ml) Penisilin-Ge (IU/ml)
Streptomisin sulfatf (g/ml) Akuabidestilatag ad (ml)
3.32 1.86 1.37 20 1000 1000 100 Keterangan: a = Merck, Germany, cat. K27219882 003
b = Merck, Germany, cat. K22939944 632 c = Merck, Germany, cat. K27917123 038 d = Telur ayam ras
e = Meiji, Japan, cat. APG 0598 J f = Meiji, Japan, cat. SSL 1095 A g = Supracointra, Indonesia.
10 Bahan-bahan penelitian yang digunakan adalah: semen segar kerbau, bahan pengencer dasar (Tabel 1), krioprotektan laktosa-monohidrat (Merck, Germany, cat.
K27650960 033) dan gliserol (Merck, Germany, cat. K28328694 044), antioksidan glutation (Merck, Germany, cat. 336 K20146490) dan -karoten (Merck, Germany, cat.
K22585936 632), formaldehida (Merck, Germany, cat. K25421403 828), NaCl (Merck, Germany, cat. 3.9 K19690004) fisiologis, NaCl 3%, larutan hipoosmotik (Revell dan Mrode 1994), pewarna eosin B (Merck, Germany, cat. 509 K5003834), alkohol, nitrogen cair, KY jelly (Johnson and Johnson, Indonesia), dan lain-lain.
Proses kriopreservasi semen akan menggunakan peralatan sebagai berikut: vagina buatan/elektrik ejakulator, tabung spermatozoa, tabung reaksi, gelas erlenmeyer, gelas piala, gelas ukur, termometer, mikroskop cahaya, gelas objek, gelas penutup, pipet tetes, hemositometer, pH meter, bunsen, timbangan mikro, konteiner N2 cair dan perlengkapannya, straw mini (0.25 ml), rak straw, penangas air, lemari es, styrofoam, dan lain-lain. Sedangkan untuk mengetahui angka fertilitas dilakukan dengan analisis progesteron plasma darah dan ultrasonografi (USG).
4.4 Prosedur Penelitian
Penelitian ini meliputi pembekuan semen hasil ejakulasi dan IB. Penelitian ini terdiri atas tiga tahap percobaan, sedangkan penelitian kedua terdiri atas satu tahap.
Percobaan Tahap Pertama
Percobaan tahap pertama ini dilakukan untuk menguji efektivitas krioprotektan ekstraseluler (laktosa) dan intraseluler (gliserol) terhadap kualitas semen beku.
1. Penampungan Semen
Semen ditampung menggunakan vagina buatan satu kali dalam satu minggu.
Segera setelah ditampung, semen dinilai secara makroskopik dan mikroskopik. Penilaian makroskopik meliputi: volume, warna, konsistensi (kekentalan), derajat keasaman (pH).
Penilaian mikroskopik meliputi: gerakan massa, persentase motilitas, persentase hidup, konsentrasi, persentase abnormalitas, dan integritas membran plasma spermatozoa, yakni persentase tudung akrosom utuh (TAU) dan persentase membran plasma utuh (MPU).
11 2. Pengenceran dan Ekuilibrasi Semen
Semen segar yang memenuhi syarat (motilitas 70%, konsentrasi 2000 juta sel per ml, gerakan massa ++ atau +++, dan abnormalitas <15%) diencerkan sesuai dengan perlakuan yang dicobakan. Perlakuan krioprotektan yang dicobakan adalah sebagai berikut:
• Krioprotektan ekstraseluler berupa laktosa dalam tiga tingkat konsentrasi, yakni: 0 mM (L0) (kontrol), 60 mM (L60), dan 120 mM (L120).
• Krioprotektan intraseluler berupa gliserol dalam tiga tingkat konsentrasi, yakni: 3%
(G3), 5% (G5), dan 7% (G7).
Dengan demikian terdapat sembilan kombinasi perlakuan, yakni: L0G3, L0G5, L0G7, L60G3, L60G5, L60G7, L120G3, L120G5, dan L120G7.
Semen yang telah diencerkan dikemas ke dalam straw mini (0.25 ml) dengan konsentrasi 200 juta sperma motil per straw kemudian diekuilibrasikan di dalam lemari es pada sekitar 5oC selama tiga jam.
3. Kriopreservasi dan Thawing (Pencairan Kembali) Semen
Pembekuan semen dilakukan dengan cara meletakkan straw 10 cm di atas permukaan nitrogen cair (suhu sekitar –130oC) selama 15 menit. Kemudian straw dimasukkan ke dalam nitrogen cair (suhu sekitar –196oC) dan disimpan di dalam konteiner. Setelah disimpan satu minggu, setiap sampel straw masing-masing perlakuan dicairkan kembali untuk dinilai kualitasnya. Semen beku dicairkan kembali dengan cara memasukkan straw ke dalam air hangat bersuhu 37oC selama 30 detik.
Percobaan Tahap Kedua
Percobaan tahap kedua ini dilakukan untuk menguji efektivitas antioksidan glutation dan -karoten terhadap kualitas semen beku. Proses kriopreservasi semen menggunakan prosedur yang sama dengan percobaan tahap pertama. Semen diencerkan dengan komposisi pengencer terbaik dari hasil percobaan tahap pertama.
Perlakuan yang dicobakan dalam percobaan tahap kedua ini adalah sebagai berikut:
12 Pengencer tris terbaik pada percobaan tahap pertama (kontrol).
Penambahan glutation dengan tiga tingkat konsentrasi, yakni: 0.05 g (Glu0.05), 0.10 g (Glu0.10), dan 0.15 g (Glu0.15) per 100 ml pengencer.
Penambahan -karoten dengan tiga tingkat konsentrasi, yakni: 0.00625 g (Kt0.00625), 0.0125 g (Kt0.0125), dan 0.025 g (Kt0.025) per 100 ml pengencer.
Percobaan Tahap Ketiga
1. Uji Fertilitas Semen Beku
Percobaan ini dilakukan untuk menguji tingkat fertilitas semen beku empat perlakuan terbaik hasil percobaan tahap kedua dengan melakukan IB. Pada percobaan ini digunakan dosis IB sebesar 200 juta per straw.
Inseminasi dilakukan 18 – 24 jam setelah awal berahi. Hal ini dilakukan dengan pertimbangan bahwa ovulasi pada kerbau terjadi 26 jam setelah awal berahi, fertilisasi terjadi 2 – 3 jam setelah ovulasi dan waktu minimum yang dibutuhkan spermatozoa fungsional di dalam tuba fallopii sekitar 6 – 8 jam (Hunter 1985).
Diagnosis kebuntingan dilakukan dengan pengukuran kadar hormon progesteron serum setiap induk 16 hari setelah inseminasi (Reichenbach et al. 1996). Pemeriksaan kebuntingan dilakukan kembali 30 hari setelah inseminasi menggunakan ultrasonografi (USG).
4.5 Parameter yang Diamati
Parameter kualitas semen yang diamati adalah:
Persentase motilitas, persentase hidup, persentase TAU, dan persentase MPU spermatozoa masing-masing setelah tahap pengenceran, ekuilibrasi, dan thawing. Konsentrasi malondialdehida (MDA) setiap perlakuan percobaan tahap kedua dianalisis pada tahap setelah thawing.
Fertilitas semen beku (angka kebuntingan).
Persentase motilitas: persentase spermatozoa yang bergerak progresif. Ditentukan secara subjektif pada delapan pandang yang berbeda dengan mikroskop cahaya pembesaran 400
13 kali. Angka yang diberikan berkisar antara 0% hingga 100% dengan skala 5%.
Persentase hidup: persentase spermatozoa yang hidup. Ditentukan dengan menggunakan pewarnaan eosin (Toelihere 1993). Spermatozoa yang hidup ditandai oleh kepala yang berwarna putih, sedangkan yang mati ditandai oleh kepala yang berwarna merah dengan.
Jumlah spermatozoa yang dievaluasi minimal 200.
Persentase TAU: persentase spermatozoa yang memiliki tudung akrosom utuh. Tudung akrosom utuh ditandai oleh ujung kepala spermatozoa yang berwarna hitam tebal apabila semen dipaparkan di dalam larutan NaCl fisiologis-1% formalin (modifikasi metode Saacke dan White 1972). Jumlah spermatozoa yang dievaluasi minimal 200.
Persentase MPU: persentase spermatozoa yang memiliki membran plasma utuh.
Ditentukan dengan menggunakan metode osmotic resistance test (Revell dan Mrode 1994).
Spermatozoa yang memiliki membran plasma utuh ditandai oleh ekor yang melingkar atau menggembung, sedangkan yang rusak ditandai oleh ekor yang lurus apabila semen dipaparkan di dalam larutan hipoosmotik dan diinkubasi pada suhu 37oC selama 60 menit.
Spermatozoa dievaluasi dengan mikroskop pembesaran 400 kali. Jumlah spermatozoa yang dievaluasi minimal 200.
Konsentrasi MDA: dianalisis dengan menggunakan pereaksi asam tiobarbiturat (TBA).
Fertilitas (angka kebuntingan): jumlah betina yang bunting dibagi jumlah betina yang diinseminasi dikali 100%. Ditentukan dengan cara analisis hormon progesteron dari sampel plasma darah betina 16 hari setelah inseminasi. Diagnosis kebuntingan dilakukan kembali pada hari ketiga puluh setelah inseminasi menggunakan USG.
4.6 Luaran Penelitian
Target penelitian adalah berhasil melakukan pembekuan spermatozoa kerbau dalam bentuk straw dan memiliki kualitas yang layak untuk diinseminasikan. Spermatazoa dalam bentuk beku ini dapat disimpan dalam waktu yang lama walaupun pejantan unggulnya sudah mati. Upaya ini diharapkan dapat meningkatkan mutu genetik dan populasi kerbau di Aceh khususnya daerah yang banyak populasi kerbau seperti Daerah Simeulu, Aceh Barat
14 dan lain-lain dalam meningkatkan ketahanan pangan terutama protein hewani dalam bentuk daging dan susu.
4.7 Indikator terukur
Indikator terukur dalam penelitian ini adalah: (1) persentase kebuntingan kerbau betina yang di IB dengan spermatozoa beku kerbau di Aceh meningkat, (2) spermatozoa beku dengan menggunakan berbagai krioprotektan dan penambahan antioksidan lebih baik, (3) persentase sel telur yang dibuahi meningkat.
4.8 Analisis Data
Percobaan tahap pertama dirancang ke dalam rancangan acak lengkap (RAL) pola faktorial 3 x 3. Jumlah penampungan semen sebanyak enam kali sebagai ulangan.
Perbedaan antarperlakuan diuji dengan uji beda nyata terkecil (BNT) (Steel dan Torrie 1993).
Percobaan tahap kedua dirancang ke dalam RAL dengan tujuh perlakuan dan sembilan kali ulangan. Perbedaan antar perlakuan diuji dengan uji BNT (Steel dan Torri 1993). Data percobaan tahap ketiga dianalisis dengan metode chi square (X2) (Steel dan Torrie 1993) dengan model matematika sebagai berikut:
(Ri)(Cj) Eij = G
dimana: Eij = nilai harapan sel (i,j).
Ri = jumlah baris ke-i.
Cj = jumlah lajur ke-j.
G = jumlah umum.
r c (nij – Eij)2 X2 =
i=1 j=1 Eij
dimana: X2 = nilai pengamatan.
nij = nilai pengamatan dalam kelas peubah baris ke-i dan peubah lajur ke-j.
15 Eij = nilai harapan sel (i,j).
r = baris.
c = lajur.
db = (r-1)(c-1).
16 4.9 Fishbone Diagram
Bentuk umum diagram tulang ikan dalam mengindentifikasi masalah dalam penelitian ini adalah sebagai berikut :
Mendapatkan spermatozoa beku yang berkualitas dan meningkatkan keberhasilan kebuntingan kerbau
Pembekuan spermatozoa pada kerbau belum berhasil karena plasma semen mudah rusak.
Penampungan semen untuk seleksi tahap 1.
Pengenceran dan ekuilibrasi semen.
Kriopreservasi dan thawing semen
Penngenceran sperma terbaik dari hasil tahap 1 ditambahkan dengan bahan antioksidan
Uji fertilitas
Vagina buatan/ elektrik ejakulator
- Krioprotektan intraseluler - Krioprotektan
intraseluler
- Penambahan antioksidan glutation
- Penambahan antioksidan β- karoten
- Kualitas dan viabilitas - Uji kebuntingan
Kualitas dan viabilitas sperma
17 BAB 5. HASIL DAN PEMBAHASAN
5.1 Kualitas dan Viabilitas Spermatozoa Kerbau
Berdasarkan hasil penelitian menunjukkan bahwa kualitas dan viabilitas spermatozoa kerbau belum dapat diproses untuk dibekukan karena jumlah yang diperoleh masih sangat sedikit dan kualitasnya masih dibawah 40% (Tabel 5.1). Hal ini menunjukkan kerbau masih harus dilatih dan diberi pakan yang lebih baik. Sebelum kerbau pejantan dinaikkan ke betina pemacek, betina harus disinkronisasi dengan PGF2α. Berbeda dengan sapi aceh yang langsung pejantannya naik bila didekatkan dengan pejantan lainnya. Libido kerbau pejantan masih rendah selain pakan, diduga juga faktor penyesuaian lingkungan dari daerah Siemeulu yang agak berbeda dengan kondisi daerah Saree. Faktor kubangan juga sangat menentukan kesehatan kerbau. Perlu adaptasi yang lebih lama serta memberi makanan yang bersifat suplemen agar libido kerbau meningkat dan kualitas sperma menjadi lebih baik
Tabel 2. Kualitas semen segar kerbau secara makroskopis dan mikroskopis dari spermatozoa ejakulat
Parameter Perlakuan Penampungan Semen
K1 K2 K3 Rata-rata
Volume (ml) 1,8 1,50 1,00 1,4 ±0,49
Warna Putih susu Putih susu Putih susu Putih susu
Konsistensi Kental Kental Kental Kental
pH 7 7 7 7±0
Gerak massa (++) (++) (++) (++)
Motilitas (%) 75 70 78 74,33±4,04
Konsentrasi (106/ ml) 4033 4033 4152 4072±68 Spermatozoa hidup
(%) 80 75 80 78,33±288
Abnormalitas (%) 20 25 21 22±2,64
18
Gambar 1. Proses penampungan spermatozoa kerbau dengan menggunakan betina pemacek
5.2. Morfologi Abnormalitas Spermatozoa
Morfologi abnormalitas primer dan sekunder pada spermatozoa kerbau dapat dilihat pada Gambar 2. Jumlah spermatozoa yang abnormal paling banyak di temukan pada tahap awal penampungan. Hal ini diduga kerbau masih belum terbiasa dan stress dengan teknik penampungan semen sehingga perlu dibiasakan. Setelah dari bulan Februari kerbau berada di BIB Saree dan dilatih untuk pengambilan semen, ternyata baru sekali berhasil naik ke betina pemacek dan kualitasnya masih sangat jelek. Hal ini dikarenakan kerbau yang kami peroleh masih liar sehingga perlu dilatih berkali-kali. Hal ini dapat juga dikarenakan stok spermatozoa matang yang tersedia dalam tubuli seminiferi terbatas. Spermatozoa yang
19 kurang matang sangat mudah rusak. Hal tersebut merupakan salah satu faktor penyebab terjadinya abnormalitas sekunder. Fitriani (2010) mengatakan abnormalitas primer merupakan kelainan fisik spermatozoa yang terjadi pada saat proses pematangan spermatozoa dalam tubuli seminiferi, serta proses perjalanan spermatozoa melalui saluran- saluran organ kelamin jantan.
A B C
E D F
G H I
20 Gambar 2 . Bentuk normal dan abnormalitas spermatozoa A) Bentuk sperma normal, B) Pearshape, C) Macrosephalus, D) Microsephalus, E) Detached head F) Kepala saja, G) Ekor melingkar,H) ekor saja, I) Ekor buntung.
5.3. Efektivitas Berbagai Konsentrasi Laktosa dan Gliserol terhadap Kualitas Semen beku
Motilitas atau daya gerak progresif (bergerak ke depan) menjadi hal yang sangat penting bagi spermatozoa karena ini menunjukkan kemampuan sprmatozoa untuk dapat mencapai tempat fertilisasi sekaligus membuahi oosit. Menurut Subowo (1995) motilitas pada spermatozoa dapat terjadi karena pada bagian lengan sembilan pasang fibril mikro dari sistem fibril mikro 9 + 9 + 2 yang terdapat di ekor spermatozoa mengandung suatu protein besar yang disebut dynein dan memiliki aktivitas sebagai enzim ATP-ase.
Tabel 3. Pengaruh berbagai konsentrasi laktosa dan gliserol terhadap persentase motilitas spermatozoa kerbau
Tahap Perlakuan Perlakuan Gliserol (G) Rataan
Laktosa (L) G3 G5 G7
Setelah L0 76,67±2,36 76,67±2,36 76,67±2,36 76,67±2,36a Pengenceran L90 76,67±2,36 76,67±2,36 76,67±2,36 76,67±2,36a
L120 76,67±2,36 76,67±2,36 76,67±2,36 76,67±2,36a Rataan G 76,67±2,36a 76,67±2,36a 76,67±2,36a
Setelah L0 64,17±4,49 66,67±2,36 65,83±3,43 65.55±3,68a Ekuilibrasi L90 65,00±2,89 68,33±2,36 65,00±2,89 66,11±3,14a L120 65,00±2,89 65,00±2,89 65,00±2,89 65,00±2,89a Rataan G 64,72±3,52a 66,67±2,89a 65,28±3,10a
Setelah L0 32.50±2,50 40.00±2,89 39.17±1,86 35.83±4,49a thawing L90 40.83±4,49 47.50±2,50 41.67±3,73 43.33±4,71b L120 38.33±4,71 40.83±5,33 35.83±3,43 38.33±5,00a Rataan G 37.50±5,59a 42.78±5,06b 39.17±4,17ab
Huruf yang sama dalam kolom atau baris setiap tahap menunjukkan tidak berbeda nyata (P>0,05) L0, L60, L120 = penambahan laktosa sebanyak 0, 60 dan 120 mM
G3, G5, G7 = penambahan gliserol sebanyak 3, 5 dan 7%
21 Hasil penelitian ini menunjukkan bahwa penambahan laktosa sebanyak 60 mM menghasilkan semen beku dengan rata-rata persentase motilitas 43.33% yang lebih tinggi dibandingkan penambahan sebanyak 120 mM 38,05% dan tanpa penambahan laktosa. Hal yang sama juga terlihat pada perlakuan gliserol. Rata-rata persentase motilitas dan spermatozoa hidup setelah thawing perlakuan penambahan 5% gliserol yaitu 42.78% dan 52.55% nyata (P˂0.05) lebih tinggi dibandingkan dengan penambahan 3% gliserol yaitu 37.50% dan 48.78% dan penambahan 7% gliserol yaitu 39.17% dan 48.39%.
Hasil yang diperoleh dari penelitian ini tidak ada perbedaan antar kombinasi perlakuan setelah pengenceran maupun setelah ekuilibrasi. Hal ini berbeda dengan yang dilaporkan Singh et al. (1995) bahwa penambahan laktosa hingga 180 mM nyata meningkatkan persentase motilitas dan spermatozoa hidup semen beku. Namun demikian pengamatan setelah pembekuan belum dapat diamati. Akan diamati setelah sebulan disimpan dalam nitrogen cair,
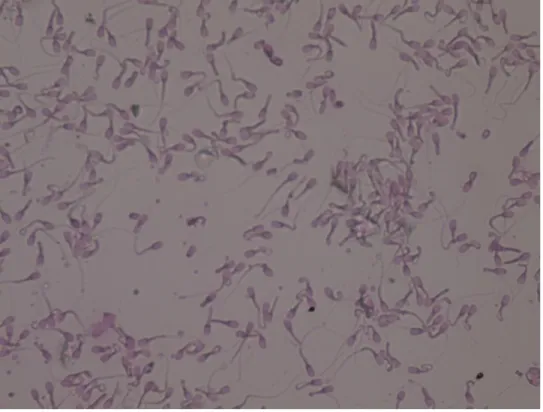
Gambar 3. Spermatozoa kerbau setelah ekuilibrasi. (a) spermatozoa hidup, (b) spermatozoa mati.
22 Pada penelitian ini terlihat penambahan krioprotektan intra seluler danekstra seluler secara bertingkat tidak berbeda antar perlakuan terhadap persentase spermatozoa hidup baik setelah pengenceran maupun setelah ekuilibrasi Namun belum dapat dilaporkan setelah pembekuan. Upaya memperbaiki kualitas semen beku dengan cara menambahkan beberapa jenis gula juga dilaporkan oleh beberapa peneliti. Menurut Aisen et al. (2002) penambahan beberapa jenis glukosa tidak mempengaruhi kualitas spermatozoa pada pengenceran dan ekuilibrasi, namun akan sangat berpengaruh pada proses pembekuan.
Tabel 4. Pengaruh berbagai konsentrasi laktosa dan gliserol terhadap persentase spermatozoa spermatozoa kerbau’
Tahap Perlakuan Perlakuan Gliserol (G) Rataan
Laktosa (L) G3 G5 G7
Setelah L0 84,50±2,36 84,00±2,77 84,83±2,67 84,44±2,63a Pengenceran L90 84,67±2,49 85,67±2,98 85,33±2,47 85,22±2,70a
L120 84,67±2,49 84,17±2,91 83,17±3,29 84,00±2,98a Rataan G 84,61±2,45a 84,94±2,78a 84,44±2,98a
Setelah L0 77,,83±1,57 66,67±2,36 65,83±3,43 65.55±3,68a Ekuilibrasi L90 75,83±2,47 68,33±2,36 65,00±2,89 66,11±3,14a L120 75,83±3,62 65,00±2,89 65,00±2,89 65,00±2,89a Rataan G 76,50±3,00a 66,67±2,89a 65,28±3,10a
Setelah L0 45,,83±5,59 50,50±4,35 47,,67±5,62 48.05±5,82a Thawing L90 53,17±4,22 56,33±2,34 50,83±5,21 53,61±4,78a L120 48.50±6,85 50,33±5,70 46,67±6872 48,50±6,67a Rataan G 48,78±3,00a 52,35±5,3b 48,39±6,20a
Huruf yang sama dalam kolom atau baris setiap tahap menunjukkan tidak berbeda nyata (P>0,05) L0, L60, L120 = penambahan laktosa sebanyak 0, 60 dan 120 mM
G3, G5, G7 = penambahan gliserol sebanyak 3, 5 dan 7%
Pada penelitian ini persentase spermatozoa hidup masih pada range 66 sampai 84%.
Ini mengindikasikan media pengencer yang digunakan mampu mendukung kualitas spermatozoa. Keberadaan gula di dalam media pengencar semen akan membuat membran
23 plasma sel spermatozoa tidak mudah mengalami kerusakan akibat pengaruh buruk adanya perubahan kimia dan fisik yang terjadi selama proses pembekuan karena pengeluaran air yang cepat dari dalam sel. Hal ini menyebabkan membran plasma sel menjadi lebih stabil sebagaimana yang dilaporkan juga pada beberapa jenis sel lain yang telah dibekukan (Strauses et al. 1986, Bakas dan Disalvo, 1991)
Perlakuan gliserol dalam konsentrasi yang tepat juga menghasilkan persentase motilitas dan spermatozoa hidup yang baik pada tahap setelah thawing. Hal ini menunjukkan bahwa gliserol berperan dalam menjaga kualitas spermatozoa pada saat pembekuan dan thawing semen beku. Hal ini dapat dipahami karena pada saat pembekuan , akibat suhu yang sangat ekstrim terjadi pengeluaran molekul air secara besar-besaran dari sitoplasma yang ada pada spermatozoa. Peristiwa ini menyebabkanpeningkatan konsentrasi elektrolot intraseluler dan terbentuknya kristal=kristal es, yang dapat menyebabkan kerusakan dan kematian sel. Keberadaan gliserol dalam media pengencer dapat mengurangi efek negatif tersebut dengan cara masuk ke dalam sel spermatozoa untuk menyeimbangakan osmolaritas intra dan ekstraseluler, dan iitu tergantung pada ketepatan dosis yang diberikan.
5.4. Persentase Tudung Akrosom Utuh dan Membran Plasma Utuh
Membran plasma sel yang utuh merupakan hal yang mutlak harus dimiliki spermatozoa yang baik, karena membran plasma sel memegang peranan yang sangat sentral dalam seluruh proses biokimia yang terjadi di dalam sel. Membran plasma berperan dalam mengatur lalu lintas keluar masuk sel seluruh substrat dan elektrolit yang dibutuhkan dalam proses biokemih di dalam sel.
Hasil penelitian menunjukkan bahwa rata-rata persentase TAU dan MPU semen beku setelah thawing perlakuan penambahan laktosa sebanyak 60 mM
24 Tabel 5. Pengaruh berbagai konsentrasi laktosa dan gliserol terhadap persentase tudung
akrosom utuh (TAU) spermatozoa spermatozoa kerbau’
Tahap Perlakuan Perlakuan Gliserol (G) Rataan
Laktosa (L) G3 G5 G7
Setelah L0 82,50±2,36 82,00±2,77 82,83±2,67 82,44±2,63a Pengenceran L90 82,67±2,49 82,67±2,98 82,33±2,47 82,22±2,70a
L120 81,67±2,49 81,17±2,91 82,17±3,29 81,00±2,98a Rataan G 81,61±2,45a 81,94±2,78a 82,44±2,98a
Setelah L0 71,,83±1,57 73,67±2,36 73,83±3,43 72.55±3,68a Ekuilibrasi L90 73,83±2,47 73,33±2,36 74,00±2,89 73,11±3,14a L120 73,83±3,62 72,00±2,89 72,00±2,89 72,00±2,89a Rataan G 72,50±3,00a 73,67±2,89a 73,28±3,10a
Setelah L0 36,,83±5,59 42,50±4,35 38,,67±5,62 38.05±5,82a Thawing L90 43,17±4,22 49,33±2,34 43,83±5,21 44,61±4,78b L120 39.50±6,85 42,33±5,70 37,67±6872 39,50±6,67a Rataan G 38,78±3,00a 44,35±5,3b 39,39±6,20a
Huruf yang sama dalam kolom atau baris setiap tahap menunjukkan tidak berbeda nyata (P>0,05) L0, L60, L120 = penambahan laktosa sebanyak 0, 60 dan 120 mM
G3, G5, G7 = penambahan gliserol sebanyak 3, 5 dan 7%
BAB 6. RENCANA TAHAPAN BERIKUTNYA
25 1. Pengamatan kualitas spermatozoa beku
Hasil pembekuan spermatozoa dengan kombinasi gliserol dan laktosa bertingkat diamati dengan melakukan thawing dan evaluasi dari spermatozoa beku. Pengamatan kualitas spermatozoa meliputi tingkat motilitas, spermatozoa hidup, tudung akrosom utuh dan membran plasma utuh.
2. Penambahan antioksidan
Hasil terbaik dari kombinasi krioprotektan, selanjutnya ditambahkan anti oksidan glutation dan β-karoten bertingkat yang dicobakan adalah sebagai berikut:
• Pengencer Tris tanpa antioksidan (kontrol)
• Pengencer Tris ditambahkan glutation dengan tiga tingkat konsentrasi, yaitu: 0,05%, (Gl0,05), 0,10% (Gl0,10), dan 0,15% (Gl0,15).
• Pengencer Tris ditambahkan β-karoten dengan tiga tingkat konsentransi, yaitu 0,001%
(Kt0,001), 0,002% (Kt0,002), dan 0,003% (Kt0,003)
• Sehingga terdapat tujuh perlakuan yang dicobakan yaitu kontrok, Gl0,05, Gl0,10, Gl0,15,
Kt0,001, Kt0,002 dan Kt0,003
3. Pembekuan dan Pencairan kembali
Pembekuan semen dilakukan dengan cara meletakkan straw 10 cm di atas permukaan nitrogen cair (suhu sekitar –130oC) selama 15 menit. Kemudian straw dimasukkan ke dalam nitrogen cair (suhu sekitar –196oC) dan disimpan di dalam konteiner. Setelah disimpan satu minggu, setiap sampel straw masing-masing perlakuan dicairkan kembali untuk dinilai kualitasnya.
Semen beku dicairkan kembali dengan cara memasukkan straw ke dalam air hangat bersuhu 37oC.
4. Evaluasi Kualitas Post Thawing
Pengujian ini perlu dilakukan untuk mengetahui kualitas dan viabilitas sperma yang dibekukan. Parameter kualitas dan viabilitas spermatozoa meliputi motilitas, hidup mati, abnormalitas dan hipo osmotik swelling test.
26 5. Aplikasi Inseminasi Buatan menggunakan spermatozoa yang telah berhasil dibekukan
Spermatozoa beku dengan perlakuan terbaik akan digunakan untuk inseminasi buatan guna melihat daya fertilitas spermatozoa beku. Keberhasilan fertilisasi akan dievaluasi menggunakan USG atau tes hormon kebuntingan setelah satu bulan diinseminasi.
27 BAB 7. KESIMPULAN DAN SARAN
7.1. Kesimpulan
Berdasarkan hasil penelitian tahap 1, kombinasi krioprotektan gliserol dan laktosa mampu mempertahankan kualitas spermatozoa setelah pengenceran dan ekuilibrasi sehingga dapat dilanjutkan ke proses pembekuan. Pada media pengencer sebaiknya ditambahkan antioksidan
28 DAFTAR PUSTAKA
Hafez , ESE., Hafez B. 2000. Anatomy of male reproduction. Di dalam: Reproduction in Farm Animals. Ed ke-7. Baltimore: Lippicott William & Wilkins. Hlm 3-12.
Herdis. 1999. Karakteristik semen segar kerbau lumpur (Bubalis bubalis) sebagai plasma nutfah kerbau Indonesia. Sains dan Teknol. Indon. Vol. 1 No.3. BPPT, Jakarta.
Herdis, Purwantara B, Supriatna I, Putu IG. 1999. Integritas spermatozoa kerbau lumpur pada berbagai metode pembekuan semen. Jurnal Ilmu Ternak dan Veteriner Vol. 4 No. 1 Pusat Penelitian dan Pengembangan Peternakan. Balitbang Pertanian.
Departemen Pertanian Bogor.
Hunter RHF. 1985. Experimental studies of sperm transport in sheep, cows, and pigs. Vet Rec 116:188
Raizada BC, Santior A, Pandey MO. 1988. A comparative study of freezing bufallo semen in two dilutors. Proceding of II world Buffalo Congress. New Delhi.
Reichebach HD, Schwartz J, Naderer J, Grupp T, Besenfelder U, Brem G. 1996. Serum progesteron profiles in relation to conception after artificial insemination of oestrous synchronized ewes. Congress Programme of the 13th International Congress on Animal Reproduction. Darling Harbour Convention Centre, Sydney. Vol 2. P.18-80 Revell SG, Mrode RA. 1994. An osmotic resistance test for bovine semen. Anim Reprod
Sci 36: 77-86.
Rizal M. 2005. Fertilitas Spermatozoa Ejakulat dan Epididimis Domba Garut Hasil Kriopreservasi Menggunakan Modifikasi Pengencer Tris dengan Berbagai Krioprotektan dan Antioksidan. Disertasi. Bogor. Sekolah Pascasarjana, Institut Pertanian Bogor.
Saacke RG, White JM. 1972. Semen quality tests and their relationship to fertility. Di dalam: Proceeding 4th Tech Conf on AI and Reprod, NAAB. Hlm 22-27.
Steel RDG, Torrie JH. 1993. Prinsip dan Prosedur Statistika. Jakarta: Gramedia Pustaka Utama
Supriatna I, Pasaribu. 1992. In Vitro Fertilisasi, Transfer Embrio dan Pembekuan Embrio.
Departemen Pendidikan dan Kebudayaan Direktorat Jendral Pendidikan Tinggi Pusat Antar Universitas Bioteknologi Institut Pertanian Bogor.
29 Suryohudoyo P. 2000. Oksidan, antioksidan dan radikal bebas. Suryohudoyo P di dalam:
Kapita Selekta Ilmu Kedokteran Molekuler. Jakarta: CV Sagung seto. Hlm 31-47.
Toelihere MR. 1993. Inseminasi Buatan pada Ternak. Bandung: Angkasa.
Tuminah S. 2000. Radikal bebas dan antioksidan, kaitannya dengan nutrisi dan penyakit kronis. Cermin Dunia Kedokteran 128:49-51.
Wignyosoesastro, N, Salim B. 1982. Peranan Teknologi dalam Peningkatan Hasil Peternakan di Kabupaten Aceh Besar. Universitas Syiah Kuala. Banda Aceh.