1
BAB I PENDAHULUAN
A. Latar Belakang
Padi hitam (Oryza sativa L)merupakan padi yang memiliki kandungan nutrisi yang cukup tinggi seperti serat, zat besi dan antosianin serta asam amino (Pusat Penelitian dan Pengembangan Tanaman Pangan, 2006). Ekstrak methanol beras hitam yang kaya antosianin telah diidentifikasi mengandung cyanidin-3-glucoside dan peonidin-3-cyanidin-3-glucoside dan dilaporkan dapat memperbaiki profil lipid pada tikus yang defisien apolipoprotein E dengan cara menurunkan kadar trigliserida, total kolesterol dan kolesterol non-HDL (Xia et al., 2006). Tingginya manfaat pada padi hitam tidak sebanding dengan ketersediaannya yang rendah dipasaran.Hal ini dikarenakan masa tanam padi hitam yang relatif lebih lama dibandingkan dengan masa tanam padi putih, sehingga petani kurang tertarik untuk membudidayakan.
Salah satu cara untuk memperpendek masa tanam padi hitam adalah dengan rekayasa genetika, yaitu menyisipkan gen pembungaan Hd3a.Pembungaan adalah salah satu fase penting dalam siklus hidup tanaman untuk menghasilkan bunga, buah, dan biji. Pembungaan ini akan dipengaruhi oleh kondisi eksogen (suhu, cahaya, curah hujan, dll) maupun kondisi endogen (hormon, gen, dll) (Imaizumi and Kay, 2006). Padi merupakan tanaman yang banyak dijadikan model untuk mempelajari regulasi waktu pembungaan pada tanaman hari pendek (Yano et al., 2000), sedangkan Arabidopsis thalianabanyak digunakan sebagai model untuk tanaman hari panjang. Terdapat 3 gen kunci pembungaan pada jalur genetik
2 terkait dengan fotoperiode yang telah diisolasi, yaitu: OsGI (O. sativaGIGANTEA), ortholog dari Arabidopsis GI; Hd1 (Heading date 1), ortholog dari Arabidopsis CO (CONSTANS); dan Hd3a (Heading date 3a), ortholog dari ArabidopsisFT (FLOWERING LOCUST). Di bawah kondisi hari panjang. Regulasi ini bersifat positif pada Arabidopsis tetapi bersifat negatif pada padi (Hayama et al., 2003; Izawa, 2003; Tsuji et al., 2008).
Hd3a diidentifikasi melalui Quantitative Trait Loci (QTL), yang menunjukan bahwa induksi pembungaan pada padi dibawah kondisi hari pendek (Yamamoto et al., 1998; Monna et al., 2002).Saat ini Hd3adan RFT1 (Rice Flowring Locus T1) telah diketahui sebagai sinyal pembungaan yang mobile pada padi yang tumbuh dibawah kondisi hari pendek dan hari panjang (Tamaki et al., 2007; Komiya et al., 2009).Penelitian sebelumnya pada padi hitam lokal selama transisi dari fase vegetatif ke fase reproduktif dibawah kondisi alami negara tropis (Susila, 2012), menunjukkan keterlibatan Hd3a dalam transisi pembungaan.Oleh karena itu, perlu dilakukan penelitian mengenai transformasi genetik gen Hd3a pada padi hitam agar dapat berbunga lebih awaluntuk peningkatan produktivitasnya.
Pada penelitian ini dilakukan transformasi secara tidak langsung yaitu menyisipkan konstrak rolC::Hd3a-Agrobacterium tumefaciens pada kalus padi hitam. Penelitian yang dilakukan oleh Tamaki et al. (2007), menunjukan tanaman padi kultivarJaponica yang mengekspresikan Hd3a dibawah kontrol promoter rolC menginisiasi fenotip pembungaan lebih awal. Promoter rolC merupakan promoter spesifik yang dapat mengekspresikan gen pada jaringan pengangkut.
3 Ekspresi Hd3adibawah kontrol promoter rolC diharapkan mampu mempercepat pembungaan pada padi hitam untuk meningkatkan produktivitas padi. Pada penelitian ini digunakan 4 varietas padi hitam yang berbeda terkait dengan tempat asal penanamannya. Hal ini dilakukan untuk mengetahui respon eksplan (bagian tanaman yang digunakan sebagai bahan awal untuk perbanyakan tanaman) terhadap embriogenesis sel. Eksplan padi yang digunakan yaitu bijipadi hitamPakem, biji padi hitamKulon Progo, biji padi hitamIndmira dan biji padi hitam Sleman.Sebelum proses transformasi dilakukan, perlu adanya optimasi medium untuk proses penumbuhan kalus. Medium yang digunakan yaitu medium MS dan N6. Hal ini dilakukan untuk menentukan medium yang tepat dalam kultur kalus padi hitam. Kalus dengan pertumbuhan yang terbaik akan ditransformasi dengan gen Hd3a padaAgrobacterium tumefaciens.
Pada tahapan kultur jaringan yang paling penting adalah menumbuhkan sel kalus dalam sebuah medium. Medium yang sering digunakan untuk kultur jaringan tanaman adalah medium Murashige dan Skoog (MS) dan Medium N6 (Chu medium). Suryowinoto (1996) menyebutkan bahwa medium MS memiliki unsur-unsur dan persenyawaan yang lebih lengkap dibandingkan dengan medium yang lain. Sedangkan medium N6 telah diformulasikan khusus untuk sel, jaringan dan organ tanaman serealia (padi).Medium N6 memiliki kandungan unsur nitrogen yang tinggi yang berperan dalam metabolisme sel. Pada dasarnya dua medium ini baik untuk menumbuhkan sel kalus dalam proses kultur jaringan tanaman akan tetapi perlu adanya seleksi medium terlebih dahulu sebelum
4 melakukan proses transformasi. Proses transformasi dilakukan dengan menyisipkan gen of interest yang berperan dalam proses pembungaan.
B. Perumusan Masalah
Berdasarkan latar belakang yang telah diuraikan, permasalahan yang dapat dirumuskan dalam penelitian ini, adalah sebagai berikut.
1. Apakah terdapat perbedaan respon pertumbuhan kalus padi hitam pada medium MS dan N6?
2. Apakah pertumbuhan kalus kalus padi hitamPakem, padi hitam Kulon Progo, padi hitam Indmira, padi hitam Sleman yang berasal dari empat daerah menggunakan medium pertumbuhan optimal memberikan respon pertumbuhan yang berbeda?
3. Apakah gen Hd3a berhasil ditransformasi sel Agrobacterium tumefaciens ke sel kalus padi hitam?
C. Tujuan Penelitian
Tujuan penelitian ini adalahuntuk:
1. Mengetahui respon pertumbuhan kalus biji padi hitam apabila ditanam di medium MSdan N6.
2. Mempelajaripertumbuhan kalus padi hitamPakem, padi hitam Kulon Progo, padi hitam Indmira, padi hitam Sleman yang berasal dari tempat yang berbeda saat menggunakan medium pertumbuhan optimal.
3. Menganalisis keberhasilan transformasi gen Hd3apada Agrobacterium tumefaciens ke sel kalus padi hitam.
5
D. Manfaat Penelitian
Apabila penelitian ini berhasil, diperoleh padi hitam yang cepat berbunga, makamemiliki masa tanam yang lebih cepat dibandingkan dengan tanaman padi hitam normal.Padi hitam yang cepat berbunga dapat digunakan sebagai kultivar unggul untuk sumber eksplan dalam mikropropagasi tanaman padi.
E. Keaslian Penelitian
Penelitian terkait transformasi gen Hd3a sebelumnya sudah berhasil dilakukan pada tanaman kentang Solanum tuberosum L. oleh Maulani (2015) serta pada tanaman jarak Jatropha curcas oleh Kajikawaetal. (2009). Sedangkan pada penelitian lainnya oleh Yuliani (2014) hanya melihat pola ekspresinya dari gen Hd3apada padi hitam Cempo Ireng. Sehingga yang membedakan keaslian penelitian ini dengan penelitian yang lainnya adalah proses transformasi gen Hd3a kedalam jenis tanaman padi hitam Pakem, padi hitamKulon Progo, padi hitamIndmira, dan padi hitamSleman.
6
BAB II
TINJAUAN PUSTAKA
A. Padi Hitam (Oryza sativaL.)
Oryza sativa atau padi merupakan tanaman pangan yang menjadi kebutuhan pokok utama bagi sebagian besar masyarakat didunia terutama di Asia.Budidaya padi telah berkembang sejak ratusan abad yang lalu dengan cara domestifikasi spesies lokal (Datta and Chaturvedi, 2003). Genus Oryza ini diketahui memiliki 108.000 aksesi padi dari 22 spesies yang terdapat di IRRI (International Rice Research Institute) (Jackson and Lettington, 2003).Masyarakat Zhejiang (Cina) sudah mulai membudidayakan padi sekitar 3000 tahun SM. Tanaman ini mulai menyebar kenegara-negara Asia bagian Timur seperti Jepang, Korea, Filiphina, Indonesia, Malaysia, dan negara-negara yang terletak didaratan India (Silitonga, 2004). Padi merupakan tanaman semusim yang tergolong rumput-rumputan dengan batang berongga dan beruas (Moldenhauer et al., 2013).
1. Klasifikasi Oryza sativa
Oryza sativadapat diklasifikasikan sebagai berikut: Kingdom : Plantae Division : Magnoliophyta Class : Liliopsida Order : Poales Family : Poaceae Genus : Oryza
7 2. Morfologi Padi
Padi memiliki beberapa varian diantaranya padi putih (berbulir putih), padi merah (berbulir merah) dan padi hitam (berbulir hitam).Padihitam varietas lokal banyak dibudidayakan di Pulau Jawa, yakni di Solo, Yogyakarta dan Cibeusi Subang. Di Solo padi hitam dikenal dengan nama ‘Beras Wulung’, di Sleman Yogyakarta dikenal dengan nama ‘Cempo Ireng’ dan di Cibeusi Subang dikenal dengannama ‘Beras Gadog’.
Padi hitam kultivar ‘Cempo Ireng’ merupakan padi lokal didaerah Sleman. Padi ‘Cempo Ireng’ yang ditanam di Daerah Pakem Sleman ini memiliki morfologi yaitu batang beruas ruas, denganlebar daun 1,5 cm, panjang daun sekitar 80 cm, daun berwarna hijau tua, tinggi batang lebih dari 129 cm, dan bulir padi berwarna hitam pekat, dan bentuk bulir agak bulat lonjong dengan sisi ujung oval (Kristiamtini et al., 2012).
Padi hitamtelah dikenal sejak jaman kerajaan kuno jawa.Pada zaman tersebut hanya keluarga raja yang diperbolehkan mengkonsumsi beras hitam ini.Di Cina beras hitam juga telah banyak digunakan sebagai obat karena berkhasiat terhadap kesehatan dan diyakini dapat memberikan umur panjang.Saat ini banyakpenelitian terhadap padi hitam mengenai kandungan gizi yang terdapat didalamnya.Keistimewaan dari beras hitam selain rasanya yang enak, pulen dan wangi juga memiliki kandungan mineral, vitamin dan antosianin yang sangat tinggi bila dibandingkan dengan padi lainnya, sehingga sangat baik untuk kesehatan (Kristamtini, 2004).
8
B. Kalus
Kalus adalah suatu kumpulan sel amorphous yang terbentuk dari sel jaringan yang membelah secara terus menerus (Indrianto, 2003). Sel penyusun kalus adalah sel parenkim yang mempunyai ikatan yang renggang antar sel satu dengan sel yang lain. Kultur kalus bertujuan untuk memperoleh kalus dari eksplan yang diisolasi dan ditumbuhkan dalam lingkungan terkendali. Kalus diharapkan memperbanyak diri (massa selnya) secara terus menerus. Kalus dapat dihasilkan dari kultur organ, dengan diberi zat pengatur tumbuh (ZPT)auksin atau sitokinin didalam medium kultur. Akan tetapi untuk eksplan yang memilik sel kambium dapat membentuk kalus tanpa diberi ZPT.Induksi kalus merupakan tahapan awal pada embriogenesis secara tidak langsung (Indrianto, 2003).
Menurut Suryowinoto (1996), kalus merupakan salah satu wujud dediferensiasi, yaitu reversi sel hidup yang telah terdiferensiasi menjadi tidak terdiferensiasi lagi, atau dengan kata lain, menjadi meristematik kembali.Beberapa kalus bertekstur keras dan kompak, sementara beberapa lainnya sangat mudah remuk menjadi remah-remahan kecil.Pertumbuhan kalus yang rapuh dan mudah remuk disebut kalus friabel (Doods dan Roberts, 1983).
Struktur kalus dari berbagai varietas padi berbeda-beda tergantung pada komposisi medium yang digunakan. Biasanya struktur kalus menggambarkan daya regenerasinya membentuk tunas dan akar. Kalus yang friable biasanya mempunyai kemampuan lebih tinggi untuk membentuk tunas daripada kalus yang bersifat kompak dan berwarna coklat-kehitaman (Gunawan, 1992). Media yang digunakan untuk memacu regenerasi kalus akan sangat menentukan pertumbuhan
9 selnya. Keseimbangan nutrisi dalam media tumbuh sangat mempengaruhi pertumbuhan kalus maupun diferensiasinya membentuk tunas.Morfogenesis eksplan tergantung kepada keseimbangan ZPT auksin dan sitokinin yang digunakan didalam mediumpertumbuhan (Wattimena, 1987).
C. Medium
1. Medium MS
Medium yang sering digunakan untuk sebagian besar spesies tanaman dikotil maupun monokotil adalah medium Murashige dan Skoog (MS) (Dixon, 1985). Suryowinoto (1996) menyebutkan bahwa medium MS memiliki unsur-unsur dan persenyawaan yang lebih lengkap dibandingkan dengan medium yang lain. Medium MS mempunyai keistimewaan yaitu memiliki kandungan mikronutrien yang tinggi. Staba (1988) menambahkan bahwa umumnya mineral-mineral dalam mediumMS dapat mendukung pertumbuhan sel tanaman dalam kulturin vitro.
Komposisi unsur yang terkandung didalam medium MS diketahui sangat dibutuhkan bagi pertumbuhan dan perkembangan sel eksplan atau sel kalus untuk dapat diinduksi menjadi suatu planlet yang diharapkan.Didalam medium MS sendiri terdapat 6 elemen makronutrien, yaitu nitrogen, kalsium, magnesium, kalium, belerang dan fosfor.Unsur mikronutrien yang dibutuhkan terdapat dalam 7 jenis, yaitu tembaga, seng, mangan, boron, molibdat, khor dan besi.Jumlah mikro nutrient ini disesuaikan dengan kebutuhan eksplan.Selain itu, faktor sepertivitamin yang digunakan juga menjadi penentu keberhasilan dalam
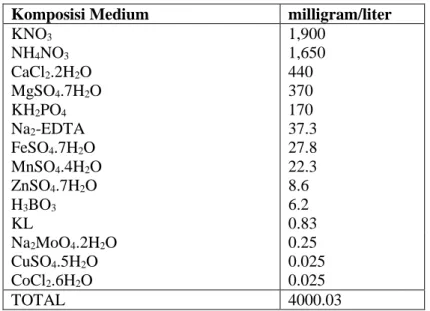
10 perbanyakan secara in vitro (Staba, 1988).Komposisi medium MS disajikan pada tabel 1.
Tabel 1. Komposisi Medium MS.
Komposisi Medium milligram/liter
KNO3 1,900 NH4NO3 1,650 CaCl2.2H2O 440 MgSO4.7H2O 370 KH2PO4 170 Na2-EDTA 37.3 FeSO4.7H2O 27.8 MnSO4.4H2O 22.3 ZnSO4.7H2O 8.6 H3BO3 6.2 KL 0.83 Na2MoO4.2H2O 0.25 CuSO4.5H2O 0.025 CoCl2.6H2O 0.025 TOTAL 4000.03 (Wako-chem, 2016) 2. Medium N6
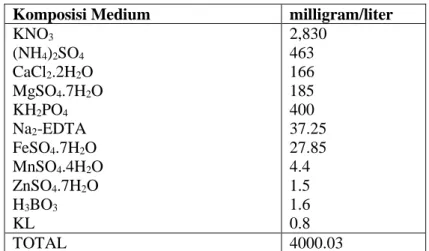
Medium N6 telah diformulasikan khusus untuk sel, jaringan dan organ tanaman serealia khususnya padi. Medium N6 diketahui memiliki unsur nitrogen yang cukup tinggi dibandingkan dengan medium lainnya. Nitrogen merupakan salah satu unsur yang berperan penting dalam memacu morfogenesis secara invitro. Menurut Ammirato (1983) bentuk nitrogen reduksi dan beberapa asam amino seperti glutamin dan casein hidrolisat, sangat penting untuk inisiasi dan perkembangan embrio somatik. Penambahan asam amino dapat merangsang terjadinya komunikasi diantara sel dan jaringan pada organ multiselular (Vesco dan Guerra, 2001). Potasium nitrat berperan sebagai penyedia nitrat.Glisin berperan sebagai penyedia asam amino.Kemasan didalam medium ini tidak
11 mengandung Sukrosa dan Agar (Chu et al., 1978).Komposisi mediumN6 disajikan
pada Tabel 1 sebagai berikut.
Tabel 2. Komposisi Medium N6.
Komposisi Medium milligram/liter
KNO3 2,830 (NH4)2SO4 463 CaCl2.2H2O 166 MgSO4.7H2O 185 KH2PO4 400 Na2-EDTA 37.25 FeSO4.7H2O 27.85 MnSO4.4H2O 4.4 ZnSO4.7H2O 1.5 H3BO3 1.6 KL 0.8 TOTAL 4000.03 (Wako-chem-Chu, 2016)
Medium sangat rentan sekali terhadap kontaminasi. Untuk itu semua proses pembuatan medium harus dilakukan secara aseptis (George & Sherrington, 1984). Medium yang telah dibuat dan telah dimasukkan kedalam botol kultur dapat disterilisasikan menggunakan autoclave pada temperatur 121°C, tekanan 15 psi selama 15 menit. Kemudian medium dapat disimpan dalam temperatur 4 - 20°C (Salle, 1961).
3. Zat Pengatur Tumbuh 2,4-D
Zat pengatur tumbuh merupakan salah satu faktor yang menentukan keberhasilan embriogenesis somatik, seperti auksin dan sitokinin (Gamborg dan Philips, 1995). Auksin merupakan hormon yang sangat berperan dalam berbagai proses perkembangan tumbuhan, seperti pembelahan dan pemanjangan sel, diferensiasi sel dan inisiasi pembentukan akar lateral, pembesaran sel, dominansi
12 apikal, perkembangan pembuluh (jaringan pengangkut), perkembangan aksis embrio, tropisme, serta perkembangan embrio (Friml et al., 2002). Promotor dediferensiasi yang banyak digunakan dalam penelitian kultur in vitro yaitu ZPT golongan auksin (sintetik maupun alami). Auksin yang sering digunakan yaitu 2,4- D, 3,5-T, picloram, dan NAA (Salisbury and Ross, 1995). Penggunaan ZPT auksin dengan konsentrasi rendah 1-10 mg/L pada tanaman jenis monokotil berperan dalam menghambat proses diferensiasi sel sehingga pembentukan organ dapat dihambat dan hanya menghasilkan kalus(Shinoyama et al., 2004). Gambar 1. merupakan rumus kima dari golongan auksin sintetis, yaitu 2,4-D :
Gambar 1. Struktur Kimia 2,4-D (Das et al., 2001)
D. Transformasi Gen Hd3a 1. PromoterrolC
Tumbuhan mempunyai suatu jaringan vaskular yang menghubungkan antara jaringan dengan transport mikronutrein maupun makronutrien sehingga dapat berjalan dengan baik (Mezzit and Lucas, 1996; Golecki et al., 1999; Ishiwatari et al., 1998; Thompson and Schulz, 1999). Terdapat 2 macam jaringan vaskular pada tumbuhan yang berperan penting dalam transport materi diantaranya adalah floem dan xilem. Floem berperan dalam perjalanan materi organik untuk
13 diedarkan keseluruh bagian sel tumbuhan, sedangkan xilem berperan untuk transport air dan hara yang berasal dari dalam tanah menuju ketempat fotosintesis didalan tubuh tumbuhan.Selain itu, xilem juga berfungsi sebagai struktur pendukung dan penguat tubuh tumbuhan (Aloni, 1989; Turgeon, 1996).
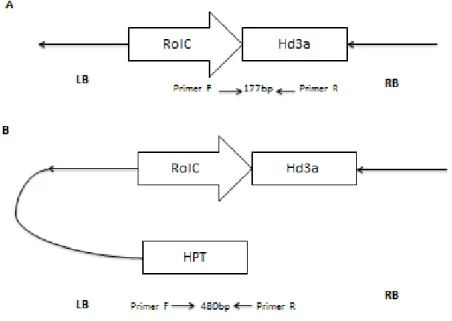
Beberapa gen dari T-DNA yang dieskpresikan secara spesifik pada jaringan tumbuhan tertentu membutuhkan promoter yang juga bersifat spesifik. Salah satu promoter spesifik adalah promoter rolC. Promoter rolCakan terekspresi pada phloem companion cell. rolCdilaporkan mampu menginduksi pembungaan secara cepat pada Arabidopsis (Tamaki et al., 2007). Skema promoter rolC pada T-DNA dapat dilihat pada gambar 2.
(Anggraini, 2012)
Gambar 2. Skema T-DNA yang menunjukan posisi primer dan daerah yang diamplifikasi dengan primer spesifik gen pemicu pembungaan dan antibiotic selectable marker. A. Primer gen Hd3a; B. Primer gen HPT.
14
2. Gen Hd3a
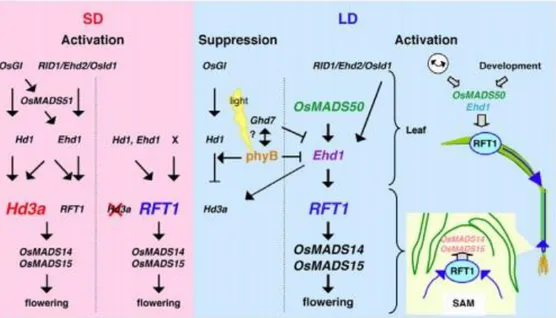
Gen Hd3a adalah salah satu gen yang berhubungan dengan waktu pembungaan. Gen Hd3a yang berasal dari padi telah diisolasi oleh Tamaki et al. (2007) yang menyandi aktivator utama pada proses pembungaan pada padi dalam kondisi hari pendek (Kojima et al., 2002; Tamaki et al., 2007). Selain gen Hd3a, pada Arabidopsis thalianaorthologFlowering Locus T (FT) berperan memacu pembungaan pada tanaman hari panjang (Gambar 3).
Gambar 3. Skema gen penyandi pembungaan pada tanaman hari panjang dan hari pendek (Komiya et al., 2009).
Terdapat 3 gen yang merupakan gen kunci pembungaan pada jalur genetik yang berkaitan dengan fotoperiode telah diisolasi, yaitu :OsGI (O. sativaGIGANTEA), yang merupakan ortholog dari ArabidopsisGI;Hd1 (Heading date 1), yang merupakan otholog dari Arabidopsis CO (CONSTANS); dan Hd3a (heading date 3a), yang merupakan ortholog dari ArabidopsisFT (FLOWERING
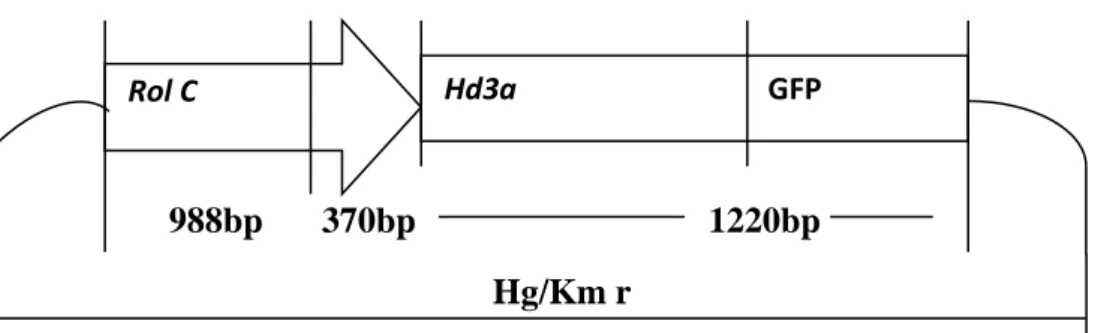
15 LOCUS T). Di bawah kondisi hari panjang, regulasi ini bersifat positif pada Arabidopsis tetapi bersifat negatif pada padi (Hayama et al., 2003; Izawa, 2003; Tsuji et al., 2008).Berdasarkan percobaan, overekspresiHd3adan FT menyebabkan pembungaan lebih awal pada padi dan Arabidopsis thaliana(Kojima et al., 2002).Gambar 4 menunjukan peta vector plasmid P2K1 dengan promoter rolC yang digunakan dalam penelitian ini.
Hind III Kpn I Kpn I Xba I Spe I
988bp 370bp 1220bp
Hg/Km r
P2K1 – Binary Vector 6000bp
Gambar 4.Peta vektor plasmid P2K1-Binary Vector dengan promotor RolC.Vektor plasmid P2K1 – Binary vector mempunyai panjang berkisar 6kb (Tamaki et al., 2007)
E. Agrobacterium tumefaciens sebagai mediator transformasi genetik.
Transformasi genetik merupakan perubahan genetik karena adanya DNA asing yang masuk dan terintegrasi di dalam kromosom sel (hidup) inang. Transformasi genetik pada tumbuhan dilakukan untuk mengintegrasikan gen ke dalam sel tumbuhan untuk menghasilkan tumbuhan baru yang mampu mengekspresikan gen tersebut. Pada awalnya teknik transformasi gen ke dalam tanaman didasari oleh penemuan bakteri tanah Agrobacterium tumefaciens. Bakteri ini merupakan fitopatogen tanah yang menyebabkan penyakit crown gall di dalam jaringan luka pada berbagai macam tanaman dikotil dan mempunyai
16 kemampuan untuk memindahkan DNA ke dalam sel tanaman (Gelvin, 1993; Old dan Primrose, 1989; Rossi et al., 1998; Heldt, 1999).
Strain onkogenik Agrobacterium tumefaiens mengandung plasmid single copy yang berukuran besar (150-250 kb) yang disebut Plasmid Ti (tumor inducing). Sebagian dari DNA plasmid ini yaitu T-DNA (transfer) dipindahkan ke dalam sel tanaman yang terluka dan disisipkan ke dalam genom tumbuhan, dan gen T-DNA yang berasal dari bakteri mampu diekspresikan pada sel tumbuhan inang. Gen yang disisipkan oleh Agrobacterium tumefaciens mengkode sintesis fitohormon auksin dan sitokinin, serta senyawa opin. Akibatnya jaringan yang terinfeksi akan mengalami proliferasi sel yang tidak terkendali dan menghasilkan jaringan tumor. Pada biakan jaringan, tumor ini dapat tumbuh terus menerus meskipun dalam media tidak dilakukan penambahan hormon auksin dan sitokinin, yang lazim digunakan untuk memacu pertumbuhan jaringan tumbuhan secara in vitro (Day dan Lichtenstein, 1992; Heldt, 1999).
Teknik transformasi genetik dengan menggunakanAgrobacterium tumefaciens merupakan teknik transformasi secara tidak langsung yang paling sering digunakan. Teknik ini mempunyai beberapa keunggulan seperti efisiensi transformasi dengan salinan gen tunggal lebih tinggi dan dapat dilakukan dengan peralatan laboratorium yang sederhana dan sisipan gen tunggal berpeluang lebih tinggi dibanding transformasi langsung, sehingga stabilitas ekspresi gen lebih tinggi (Dai et al., 2001; Syafitri, 2012).
Transformasi tidak langsung juga memiliki kekurangan yaitu sekuen yang ditransfer kegenom target bersifat acak, dan terdapat kemungkinan yang ditransfer
17 bukan gen target. Secara alami Agrobacterium tumefacienshanya dapat menginfeksi tanaman dikotil, sehingga pada awalnya transformasi menggunakan Agrobacteriumtumefacienshanya terbatas pada tanaman dikotil.Perkembangan penelitian dasar mengenai mekanisme infeksi Agrobacteriumtumefaciens telah memberikan pemahaman baru sehingga beberapa modifikasi metode transformasi dapat dilakukan untuk tanaman monokotil (Gelvin, 2003).Selain itu, beberapa penelitian mengenai penyisipan gen terhadap tanaman anggrek menggunakan Agrobacterium tumefaciensjuga telah banyak dilakukan.
F. PCR (Polymerase Chain Reaction)
Reaksi berantai polymerase Polymerase Chain Reaction (PCR) adalah suatu metode enzimatis untuk amplifikasi DNA secarain vitro.PCR pertama kali dikembangkan pada tahun 1985 oleh Kary B. Mullis.Amplifikasi DNA pada PCR dapat dicapai bila menggunakan primer oligonukleotida yang disebut amplimers.Primer DNA adalah suatu sekuens oligonukleotida pendek yang berfungsi mengawali sintesis rantai DNA.PCR memungkinkan dilakukannya pelipatgandaan suatu fragmen DNA dan umumnya primer yang digunakan pada PCR terdiri dari 10-30 nukleotida. DNA template (cetakan) yaitu fragmen DNA yang akan dilipatgandakan dan berasal dari sample. DNA polimerase merupakan enzim termostabil Taq dari bakteri termofilik Thermus aquaticus. Deoksiribonukleotida trifosfat (dNTP) menempel pada ujung 3’ primer ketika proses pemanjangan dan ion magnesium menstimulasi aktivasi polymerase(Yusuf, 2010).
18 Menurut Yuwono (2005) ada tiga tahapan penting dalam proses PCR yang selalu terulang dalam 30-40 siklus dan berlangsung dengan cepat:
1. Denaturasi
Di dalam proses PCR, denaturasi awal dilakukan sebelum enzim taq polimerase ditambahkan ke dalam tube PCR 1,5 ml. Denaturasi DNA merupakan proses pembukaan DNA untai ganda menjadi DNA untai tunggal. Ini biasanya berlangsung sekitar 3 menit,
2. Annealing (penempelan primer)
Annealing merupakan tahapan penempelan primer pada DNA target.Kriteria yang umum digunakan untuk merancang primer yang baik adalah bahwa primer sebaiknya berukuran 18 – 25 basa, mengandung 50 – 60% G+C dan untuk kedua primer tersebut sebaiknya sama. Waktu annealing yang biasa digunakan dalam PCR adalah 30 – 45 detik.
3. Pemanjangan Primer (Extention)
Selama tahap ini Taq polymerase memulai aktivitasnya memperpanjang DNA primer dari ujung 5’ ke 3’.Kecepatan polimerisasi nukleotida oleh enzim tersebut pada suhu 72oC diperkirakan 35 – 100 nukleotida/detik, bergantung pada buffer, pH, konsentrasi garam dan molekul DNA target. Biasanya diakhir siklus PCR waktu yang digunakan untuk tahap ini diperpanjang sampai 5 menit sehingga seluruh produk PCR diharapkan terbentuk DNA untai ganda.
Produk PCR dapat diidentifikasi melalui ukurannya dengan menggunakan elektroforesis gel agarosa. Metode ini terdiri atas menginjeksi DNA ke dalam gel agarosa kemudian menggunakan aliran listrik band-band DNA akan berjalan dari
19 kutub negative ke kutub positif. Hasilnya untai DNA kecil pindah dengan cepat menjauhui sumuran.
PCR memiliki keunggulan diantaranyakekhususan, efisiensi dan ketepatan.Kekhususan PCR terletak pada kemampuannya mengamplifikasi sehingga menghasilkan produk melalui sejumlah siklus.Akurasi yang tinggi dikarenakanDNA polymerase mampu menghindari kesalahan pada amplifikasi produk. Selain itu kelebihan lain metode PCR dapat diperoleh pelipatgandaan suatu fragmen DNA (110 bp, 5x10-9 mol) sebesar 200.00 kali setelah dilakukan 20 siklus reaksi selama 220 menit. Reaksi ini dilakukan dengan menggunakan komponen dalam jumlah sangat sedikit, DNA cetakan yang diperlukan hanya sekitar 5 µg oligonukleotida yang diperlukan hanya sekitar 1 mM dari reaksi ini biasa dilakukan dalam volume 50-100 ul (Mahardika, 2005).
20
BAB III
LANDASAN TEORI DAN HIPOTESA
A. Landasan Teori
Saat ini penelitian mengenai padi hitam semakin banyak dilakukan guna meningkatkan produktivitas.Beberapa diantaranya banyak membahas mengenai kandungan gizi dan kemampuan sebagai obat beberapa penyakit.Namun beberapa kendala yang dihadapi saat ini yaitu ketersediaanya dalam memenuhi permintaan pasar yang masih dinilai sedikit.Hal ini dikarenakan masa tanam padi hitam yang lebih lama dari padi putih yaitu memerlukan waktu sekitar 6-7 bulan.
Penelitian sebelumnya telah dilakukan oleh Anggraeni (2012) yang berhasil mentransformasi konstrak rolC::Hd3a-GFP kedalam plasmid Agrobacterium tumefaciens dan diketahui bahwa struktur T-DNA plasmid pembawa florigen Hd3a dibawah kontrol promoter rolC bersifat stabil dan dapat digunakan untuk perakitan tanaman transgenik.
Perakitan tanaman transgenik dilakukan melalui kultur jaringan tumbuhan. Dalam metode kultur jaringan diperlukan adanya medium untuk mendukung pertumbuhan kalus. Menurut Syahid dan Hernani, (2001) Medium MS adalah medium yang biasa digunakan dalam kultur jaringan tumbuhan yang mengandung hormon 2,4-Dicholorophenoxyacetic (2,4-D). Hormon 2,4-D berfungsi sebagai zat pengatur tumbuh (auksin) yang dapat menghambat proses deferensiasi sel pada eksplan tanaman didalam medium kultur. Selain itu, medium lain yang sering digunakan dalam kultur jaringan tumbuhan adalah medium N6 (Chu
21 medium). Medium N6merupakanmedium yang mengandung unsure Nitrogen yang cukup tinggi dan biasa digunakan untuk kultur jaringan tanaman serealia khususnyapadi. Penelitian oleh Tamaki et al. (2007) melaporkan bahwa penggunaan medium N6 menunjukan pertumbuhan kalus terbaik pada padi kultivar japoineca.
Pertumbuhan kalus selain dipengaruhi oleh medium yang digunakan, juga dipengaruhi oleh genotip tanaman atau jenis kultivar. Proses transformasi penyisipan gen Hd3aakanberhasil apabila dilakukan dengan medium pertumbuhan kalus dan metode transformasi yang tepat. Setelah proses transformasi maka perlu adanya deteksi gen untuk mengkonfirmasi bahwa gen Hd3a sudah masuk dalam genom kalus. Proses deteksi gen dapat dilakukan secara molekular.
Dalam penelitian ini, dilakukan optimasi medium yang tepat untuk pertumbuhan kalus padi hitam. Medium yang digunakan adalah medium MS dan medium N6. Oleh karena itu, penelitian ini diharapkan mampu mendapatkan medium yang optimum untuk pertumbuhan kalus padi cempo ireng dan evaluasi terhadap pertumbuhan kalus tiap-tiap eksplan dari kultivar yang berbeda.Keberhasilan proses transformasi dilaporkan apabila gen Hd3atelah tersisipi pada genom kalus padi hitam transforman.
22
B. Hipotesis
Berdasarkan acuan dan pustaka yang telah dipaparkan, maka diajukan hipotesis sebagai berikut:
1. Pertumbuhan kaluspadi hitam yang ditanam di medium N6 memberikan respon pertumbuhan lebih baik dari pada medium MS.
2. Pertumbuhan kalus berbagai macam eksplan padi hitam yang berasal dari tempat yang berbeda saat menggunakan medium pertumbuhan optimal memberikan respon yang berbeda.
3. Gen Hd3adapat dideteksi dalam genom kaluspadi hitam hasil transformasi.
23
BAB IV
METODE PENELITIAN
A. Tempat dan Waktu Penelitian
Penelitian ini dilakukan di Laboratorium Rekayasa Genetika Bioteknologi gedung PAU Sekolah Pascasarjana Universitas Gadjah Mada. Penelitian ini dilakukan dari Mei 2013 - November 2015.Dana penelitian ini sepenuhnya didapatkan dari Dana Hibah Bersaing Pascasarjana Universitas Gadjah Mada dengan Tema Hibah yaitu “Peningkatan Produktivitas Padi Hitam untuk Menunjang Ketahanan Pangan Nasional”.
B. Alat dan Bahan Penelitian 1. Alat
Alat yang digunakan dalam pembuatan medium kultur in vitro tanaman padi hitam dan bakteri terdiri dari alat-alat gelas (petridish, erlenmeyer, gelas ukur, gelas beker, spatula), timbangan analitik (Shimadzu), hote plate (Thermoline), magnetic stirrer, mikropipet (Eppendorf Research), pipet tip,Laminar Air Flow (LAF) (BioHazard-Protection), pipet tetes, microwave (Samsung), pH meter(Metrohm) dan autoclave. Peralatan yang digunakan untuk kulturin vitro tanaman kalus adalah LAF, petridish, pinset, erlenmeyer, spatula, ruang inkubator dengan suhu ruang 25-28°C. Peralatan yang digunakan untuk kultur bakteri adalah tabung reaksi, erlenmeyer, petridish, ose, mikropipet dan pipet tip.
24 Peralatan yang digunakan untuk isolasi DNA, PCR dan elektroforesis terdiri dari mikropipet (eppendorf research) dan pipet tip, mortal dan alu, tube eppendorf 1,5 mL, centrifuge(Beckhman microfuge II), vortex, water bath (GFL 1083), mesin PCR/thermocyler (Applied Biosystem), elektroporesis kit (mupid 2 plus), uv-transilluminator (Vilber Lourmat),freezer -20°C (Sanyo). peralatan yang digunakan untuk pengamatan terdiri dari penggaris, dan kamera (Canon).
2. Bahan
Bahan yang digunakan dalam penelitian ini adalah benih padi hitam berbagai varietas terkait dengan tempat penanamannya yaitu: padi hitam Pakem, padi hitam Kulon Progo, padi hitam Indmira, dan padi hitam Sleman (Gambar 5). Benih masing masing varietas ditransformasikan dengan Agrobacterium tumefacienspembawa plasmid rolC::Hd3a-GFP a.n. Anggraeni Fakultas Biologi UGM (2012).
Bahan yang digunakan untuk medium kultur in vitro terdiri dari bahan kimia komponen medium N6 pack (Wako), MS mix pack (wako), N6 vitamin,
Gambar 5.Morfologi luar biji padi hitam Pakem, padi hitam Kulon Progo, padi hitam, Indmira dan padi hitam Sleman.
25 sukrosa(Sigma), prolin (Sigma), MS vitamin, Km vitamin, hormon 2,4-D, agarosa (sigma), NaCl dan KOH, alumunium foil, parafilm dan aquades. Bahan yang digunakan untuk isolasi kalus padi hitam yaitu larutan bleach 5,25% (Bayclean), ethanol 70%, dan aquades. Bahan yang digunakan untuk skrining tanaman digunakan aquades, asitosiryngon, dan claforan.
Bahan yang digunakan untuk isolasi DNA adalah CTAB 10%, kloroform, isopropanol, ethanol 70 %, ethanol absolute, dan larutan TE. Bahan yang digunakan untuk PCR terdiri dari dNTP mix (takara),taq DNA polymerase(takara), 10x reaction buffer (takara), aquades, dan primer untuk mendeteksiHd3a yaitu Hd3a-F (GCTCACTATCCATCCAGCATG), Hd3a-R (CCTTGCTCAGCTATTTAATTGCATAA), serta primer untuk mendeteksi Hpt yaitu Higromisin-F (GAGCCTGACCTATTGCATCTCC) dan Higromisin-R (GGCCTCCAGAAGAAGATGTTGG). Bahan yang digunakan untuk elektroforesis terdiri dari DNA sampel, loading dye, TBE (Tris base, Boric acid, Na-EDTA) (vivantis), Ethidium bromide (etbr), Agarosa (SIGMA).
C. Cara Kerja
1. Pembuatan Medium a. Medium N6
Pembuatan medium1 Liter,N6 powder sebanyak 1 pack (4 gr) dimasukkan kedalam labu erlenmeyer 1000 mL yang telah berisi 200 mL akuades. Kemudian ditambahkan 1 mL N6 vitamin, 30 gr sukrosa, hormon 2,4-D sebanyak 100 µL, dan prolin 2,88 gr lalu digojog pelan sampai semua bahan homogen.
26 Setelah larutan homogen, ditambahkan akuades sampai volume larutan sebanyak 1 liter.Kemudian larutan medium dibagi menjadi 5 bagian @ 200 mL kedalam erlenmeyer 250 mL. Selanjutnya tiap-tiap larutan medium dilakukan pengukuran pH dengan menggunakan pH meter dengan range pH 5,6-5,8. Tahap terakhir yaitu dilakukan penambahan agarosa (0,8%) yaitu masing-masing erlenmeyer ditambahkan sebanyak 1,6 gr agarosa dan dipanaskan kedalam microwave selama 2 menit untuk melarutkan agar tersebut. Setelah semua bahan homogen medium ditutup rapat dan disterilisasi dengan menggunakan autoclavepada suhu 121°C selama 15 menit.
b. Medium MS
Pembuatan medium MS sebanyak 1 L, pertama-tama MS mix 1 pack (4 gr) dilarutkan kedalam akuades 200 mL. Kemudian ditambahkan sukrosa sebanyak 20 gr, Km vitamin 10 mL dan hormon 2,4-D (0,4 mg/mL) sebanyak 10 mL. Lalu digojog pelan hingga semua bahan homogen.Selanjutnya tambahkan akuades hinga volume larutan 1 liter. Larutan medium dibagi menjadi 5 bagian kedalam erlenmeyer 250 mL @ 200 mL, untuk selanjutnya dilakukan pengukuran pH dengan range pH berkisar 5,6-5,8. Kemudian masing-masing medium ditambahkan agarosa sebanyak 1,6 gr (untuk volume 200 mL) dan dipanaskan kedalam microwave selama 2 menit untuk melarutkan agarosenya. Setelah agar larut, medium ditutup rapat dan disterilisasi selama 15 menit pada tekanan 15 psi dengan menggunakan autoclave.
27
c. Medium MSL
MS powder 1 pack (4 gr) dilarutkan dalam erlenmeyer 1000 mL yang berisi akuades 200 mL. Selanjutnya ditambahkan MS vitamin 1 mL dan sukrosa sebanyak 30 gr lalu digojog hingga semua bahan larut. Kemudian ditambah akuades hingga volume larutan 1 L dan diatur pH larutan sampai kisaran 5,7-5,8. Setelah pH sesuai larutan dibagi menjadi 5 bagian @ 200 mL kedalam erlenmeyer 250 mL.Masing-masing medium disterilisasi menggunakan autoclave selama 15 menit pada tekanan 15 psi.
d. Medium N6CO
N6 powder 1 pack (4 gr) dilarutkan kedalam erlenmeyer 1000 mL yang berisi 200 mL akuades. Kemudian secara bertahap dimasukan Fe EDTA 2mL, MS vitamin 1 mL, sukcrosa 30 gr, dan glukosa 10 gr lalu digojog pelan hingga semua bahan larut. Selanjutnya ditambahkan akuades sampai volume larutan menjadi 1 L. pH larutan diatur dengan kisaran 5,7. Setelah pH sesuai, larutan dibagi menjadi 5 bagian @ 200 mL kedalam erlenmeyer 250 mL. Pada tahapan terakhir ditambahkan agarosa sebanyak 0,6% atau 1,2 gr untuk medium volume 200 mL. Medium lalu dipanaskan selama 5 menit untuk melarutkan media agar. Kemudian masing-masing medium ditutup dengan alumunium foil dan di sterilisasi selama 15 menit pada tekanan 15 psi.
e. Medium Skrining I (MS2D)
MS powder sebanyak 4 gr dilarutkan kedalam akuades sebanyak 200 mL didalam erlenmeyer 1000 mL. Kemudian ditambahkan Km vitamin 10 mL, 2,4-D 100 µL, dan sukrosa sebanyak 20 gr secara bertahap lalu digojog pelan hingga
28 semua bahan larut. Setelah itu, ditambahkan akuades hingga volume larutan 1 L dan diatu pH larutan dengan kisaran 5,7. Pada tahap terakhir ditambahkan agarosa sebanyak 0,9% dan disterilisasi pada autoclave selama 15 menit dengan tekanan 15 psi.
f. Medium Skrining II Regenerasi (Re)
Pada pembuatan mediumRegenerasi(Re)diambil R2 larutan stok makro sebanyak 50 mL, larutan stok mikro sebanyak 1 mL, FeEDTA 2 mL, dan MS vitamin sebanyak 1 mL dimasukan secara bertahap kedalam erlenmeyer 1000 mL yang telah berisi 200 mL akuades lalu digojog pelan. Selanjutnya ditambahkan sukrosa 30 gr, sorbitol 30 gr, dan Hygromysin (50 mg/L) kedalam larutan media lalu digojog pelan hingga semua bahan larut. Setelah semua bahan larut tambahkan akuades hingga volume larutan menjadi 1 L. pH larutan kemudian diatur dengan kisaran 5,8-6 dan ditambahkan agarosa (1%) yaitu sebanyak 10 gr lalu dipanaskan selama 10 menit untuk melarutkan agar. Setelah semua agar larut, bagi media menjadi 4 bagian @250 mL kedalam erlenmeyer 300 mL. Masing-masing erlenmeyer ditutup dengan alumunium foil dan selanjutnya media disterilisasi dengan menggunakan autoclave selama 15 menit pada tekanan 15 psi.
g. Medium LB
Medium LB digunakan untuk isolasi koloni bakteri Agrobacterium tumefaciens.Bahan media LB padatan instan untuk 200 mL dilarutkan kedalam akuades sebanyak 200 mL.Selanjutnya media dipanaskan selama 10 menit untuk melarutkan agar. Kemudian media diautoclave selama 15 menit pada tekanan 15 psi. Setelah proses sterilisasi selesai tambahkan antibiotik kanamisin dan
29 higromisi 50 mg/L sebanyak 200 µL, selanjutnya media dituang pada masing-masing petridish dan ditunggu sampai menjendal.
2. Inisiasi Kalus
Biji padi hitam Pakem, Kulon Progo, Indmira, dan Sleman dicuci dengan akuades steril selama 1 menit. Selanjutnya eksplan dimasukan kedalam larutan Na-Hipoklorit 5,25% dan digojog pelan selama 2 menit, lalu dicuci akuades steril selama 1 menit (pencucian dengan akuades steril dilakukan sebanyak 3 kali). Kemudian eskplan disterilisasi kembali dengan alkohol 70% selama 1 menit dan kembali dicuci akuades steril sebanyak 3 kali dengan lama waktu pencucian 1 menit. Eksplan biji padi dipindahkan kedalam petri steril yang telah dilapisi kertas saring.Kertas saring berfungsi untuk mengeringkan eksplan dari sisa-sisa bahan pensterilan.Selanjutnya eksplan yang telah kering ditanam pada medium N6. Inkubasi eksplan dilakukan didalam ruang inkubator dengan suhu ruang 25°C dengan adanya cahaya.
3. Proses Transformasi Sel Kalus melalui Agrobacterium tumefaciens
Bakteri Agrobacterium tumefaciens ditumbuhkan pada medium LB plate secara tooth pick dan diinkubasi pada kondisi gelap selama 3 hari disuhu ruang.Koloni bakteri yang telah didapatkan selanjutnya disuspensikan pada medium MSL sebanyak 20 mL. Kemudian diinkubasi sampai didapatkan OD medium optimum yaitu kisaran OD600 0,008-0,01. Pengukuran OD medium
menggunakan spektrofotometer. Selanjutnya, kalus yang telah didapatkan dari kultur sebelumnya diinkubasi pada medium MSL cair dengan penambahan
30 asitosiringon sebanyak 20 µL selama 3 menit. Selanjutnya kalus diinkubasi pada medium N6CO selama 3 hari pada suhu 25°C dan kondisi gelap.
4. Skrining I
Sel kalus trasforman yang telah dikokultivasi selama 3 hari dikumpulkan kedalam falcon 50 mL yang berisi 40 mL akuades steril lalu digojog pelan sebagai media pencucian sel kalus transforman. Pada pencucian terakhir dilakukan penambahan klaforan (konsentrasi 100 mg/L).Kemudian tabung digojog pelan lalu kalus transforman ditiriskan pada kertas saring. Kalus transforman yang telah bersih dari inokulum bakteri selanjutnya di tanam pada media MS2D dan
diinkubasi pada suhu ruangan selama 4 minggu kondisi gelap.
5. Skrining II
Setelah didapatkan kalus yang berwana kuning cerah pada proses skrining I, kalus tersebut ditransfer atau disubkultur pada media MS2D yang mengandung
hygromycin 50 gr/L dan kanamisin 50 gr/L. Iinkubasi dibawah pencahayaan pada suhu ruangan selama 2 minggu.
6. Isolasi DNA genom kalus
Kalus transforman padi hitam maupun kalus non transforman diambil sebanyak 200 mg digerus menggunakan mortar dan alu.Kemudian untuk mempermudah penggerusan ditambahkan nitrogen cair. Penggerusan dilakukan hingga halus, kemudian ditambahkan 400 µl CTAB 10% dan diinkubasi selama 10 menit pada suhu 65°C. Kemudian ditambahkan 400µl CIAA lalu disentrifugasi 12000 rpm selama 5 menit. Sebanyak 400 µl supernatan diambil dan dipindahkan ke dalam tube 1,5 mL yang baru. Selanjutnya tambahkan 2-propanol dengan
31 perbandingan (1:1) lalu gojog perlahan dan disentrifugasi kembali 12000 rpm selama 1 menit.Supernatan kemudian dibuang dan pelet ditambahkan larutanhight salt TE 100 µl dan diinkubasi 65 °C selama 10 menit.Setelah diikubasi tambahkan 800 µl Ethanol Absolute inkubasi kedalam -20°C selama 15 menit. Kemudian sample disentrifugasi 12000 rpm selama 10 menit. Pelet dicuci kembali dengan Ethanol 70% inkubasi pada suhu 4 °C selama 5 menit. Selanjutnya sampel di sentrifugasi 12000rpm selama 5 menit.Pelet kemudian dikering anginkan dan setelah kering disuspensikan dengan 30 µl TE. Untuk mengetahui keberadaan DNA genom kalus dapat dilakukan pengecekan dengan menggunakan elektroforesis gel agarosa 1%, dan TBE 1x, voltase 50 volt selama 45 menit.
7. Deteksi keberadaan transgen rolC::Hd3a-GFP pada genom padi hitam
Metode deteksi untuk mengetahui apakah gen sisipan Hd3adan hpt telah berhasil ditransformasi kedalam genom tanaman dilakukan dengan menggunakan analisis PCR. PCR kit yang digunakan untuk analisis genom transforman maupun non transforman yaitu Kit Takara. Komposisi DNA template, dNTP mix, ddH2O, Taq Polymerase dan Taq buffer 10x. Primer yang digunakan yaitu Hd3a (forward) dan Hd3a (reverse) untuk deteksi transgen Hd3a dan primer Higromisisn-F (forward) dan Higromisin-R (reverse) untuk deteksi gen penanda HPT.Komposisi reaksi PCR terlihat pada tabel 2 sebagai berikut:
32 Tabel 3. Komposisi Reaksi PCR
Komponen Volume (µl) DNA template 10x taq Buffer dNTPs Primer Forward Primer Reverse Taq DNA polymerase ddH2O 1 2 2 1 1 0,1 12,9 Total 20
Amplifikasi dilakukan sebanyak 30 siklus dengan pengaturan suhu dan waktu tahapan predenaturasi 96°C selama 2 menit, denaturasi 94°C selama 30 detik, anneling 55°C selama 30 detik, elongasi pada suhu 72°C selama 1 menit, post elongasi pada suhu 72°C selama 2 menit, dan tahap akhir 4°C selama 3 menit. Sama halnya untuk amplifikasi HPT juga menggunakan kondisi yang sama.DNA hasil amplifikasi diambil 5 µl untuk elektroforesis.
Sebanyak 2 gram agarosa dimasukkan ke dalam erlenmeyer dan ditambahkan 100 mL TBE 1x, digojog sampai homogen.Kemudian dipanaskan hingga larutan jernih. Larutan dibiarkan dingin sampai suhu kira-kira 65°C dan ditambahkan 5 µL ethidium bromide lalu digojog pelan hingga homogen. Kemudian dituang ke dalam cetakan gel, pasang sisir untuk membuat sumuran.Sebanyak 5 µL DNA sample ditambah 1 µL Loading dye kemudian dihomogenisasi dan dimasukkan kedalam sumuran. Marker yang digunakan adalah takara (100 bp) sebanyak 3 µL.Elektroda dihubungkan dengan power supply dengan voltage 50 volt selama 45 menit. Visualisasi dilakukan dengan menggunakan sinar UV dengan UV transiluminator.
33
8. Pengamatan Pertumbuhan Kalus.
Pengamatan pertumbuhan kalus dilakukan dengan mengamati seberapa banyak biji padi hitam yang tumbuh pada medium MS dan N6. Penanaman biji dilakukan sebanyak 25 petri yang tiap petrinya ditanam 4 biji padi. Biji padi yang mengalami kontaminasi akan dieliminasi langsung. Hal ini dilakukan agar biji padi hitam lainnya tidak mengalami kontaminasi.
Pengamatan pertumbuhan kalus dilakukan dengan menimbang kalus pada tiap petri setiap minggunya. Penimbangan dilakukan dengan menggunakan timbangan analitik. Hasil penimbangan dicatat didalam tabel.
34
BAB V
HASIL DAN PEMBAHASAN
Hasil penelitian transformasi gen Hd3a kedalam kalus padi hitam diuraikan dengan urutan sebagai berikut : 1) Respon pertumbuhan kalus terhadap medium yang digunakan. 2) Pertumbuhan kalus berbagai sampel padi hitam yaitu padi hitam Pakem, padi hitam Kulon Progo, padi hitam Indmira dan padi hitam Sleman terhadap medium optimal. 3) Pertumbuhan kalus yang berhasil tertansformasi gen Hd3a (transforman) pada medium seleksi serta keberadaan gen Hd3apada kalus transforman.
A. Respon pertumbuhan kalus dari biji padi hitam yang ditanam di medium MS dan N6.
Pada penelitian ini digunakan duamedium yaitu MS dan N6 yang memiliki komposisiseperti tertera pada tabel 3:
Tabel 4. Komposisi Medium MS dan Medium N6
Medium MS (dalam 1 Liter) Medium N6 (dalam 1 Liter)
MS Mix 1 pak Bubuk N6 1 pak
Sukrosa 20 gram Sukrosa 30 gram
KM Vitamin 10ml Proline 2.88 gram
2,4-D (20mg/ml) 100µl N6 Vitamin 1ml
pH 5.8 2,4-D (20mg/ml) 100µl
Agarose8 gram pH 5.8
Agarose 8 gram
(Chu et al., 1978) Penggunaan medium MS dan medium N6 ditujukan untuk mengetahui medium yang memberikan hasil terbaik terhadap pertumbuhan kalus padi hitam. Kedua medium ini merupakan medium siap saji(wako) sehingga diharapkan
35 akurasi komposisi yang digunakan cukup tinggi.Berdasarkan hasil penelitian, pertumbuhan kalus biji padi hitamPakem berbeda pertumbuhannyapada medium yang diujikan.Respon pertumbuhan kalus dapat dilihat padaGambar 6.
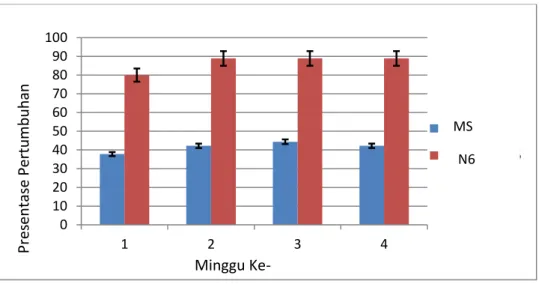
Gambar 6. Persentase pertumbuhan kalus padi hitam Pakem pada Medium MS dan N6.
Gambar 6 menunjukkan bahwa semua kalus padi hitam lebih cocok ditumbuhkan dimedium N6.Secara statistik terlihat bahwa perbedaan medium tanam berpengaruh secara nyata terhadap persentase pertumbuhan kalus (lampiran 1). Menurut Syahid dan Hernani, (2001) medium MSadalah medium yang biasa digunakan dalam kultur jaringan tumbuhan dan mengandung 2,4-Dicholorophenoxyacetic (2,4-D) yang merupakan pengatur tumbuh (auksin) berfungsi sebagai agen penghambat proses dediferensiasi sel pada eksplan. Sedangkan medium N6 adalah medium yang mengandung unsur Nitrogen (N) cukup tinggi sehingga biasa digunakan untuk kultur jaringan tanaman khususnya tanaman serealia(padi).Berdasarkan data yang diperoleh, pertumbuhan kalus pada medium N6 menunjukan persentase lebih tinggi apabila dibandingkan dengan pertumbuhan kalus pada medium MS. Hal ini mungkin dikarenakan berbagai
0 10 20 30 40 50 60 70 80 90 100 1 2 3 4 Medium MS Medium 2N6 Minggu Ke-P res entase P ertu m b u h an MS N6
36 faktor yang mempengaruhi, salah satunya adalah perbedaankomposisibahan didalam masing-masing medium yang digunakan. Oleh karena itu, dalam penelitian ini selanjutnya digunakan medium N6 untuk pembentukan kalus biji padi hitam Pakem, padi hitam Kulon Progo, padi hitam Indmira, danpadi hitam Sleman.
Respon pembentukan kalus pada medium N6 lebih baik daripada medium MS.Hal ini dikarenakanadanya perbedaan jumlah sukrosa yang digunakan dalam penelitian ini. Medium MS menggunakan Sukrosa sebanyak 20gr, sedangkan pada medium N6 menggunakan 30gr.Seperti yang sudah diketahui bahwa fungsi sukrosa pada medium yaitu sebagai sumber karbon. Pada medium N6 memiliki sumber karbon yang lebih besar daripada medium MS. Sumber karbon digunakan sebagai sumber energi bagi eksplan untuk melakukan morfogenesis, dalam hal ini yaitu pertumbuhan kalus. Oleh karena itu, pertumbuhan kalus pada medium N6 lebih baik dari medium MS, dikarenakan sumber karbon pada medium N6 lebih besar daripada medium MS. Hal ini juga diperkuat pada penelitian Gaj (2001) yang menyatakan bahwa gula sebagai komponen utama selain hormon didalam medium kultur, yang berfungsi sebagai sumber energi. Selain itu, Najafi and Javed (2015) menyebutkan didalam penelitiannya bahwa sukrosa lebih baik digunakan dalam medium kultur sebagai penyuplai utama sumber karbon. Selain itu, pada medium N6 digunakan prolin sebagai unsur tambahan. Prolin merupakan asam amino kompleks yang berperan dalam metabolisme sel. Prolin merupakan salah satu penyuplai unsur nitrogen (N) yang sangat dibutuhkan sel (Szabados, 2009).
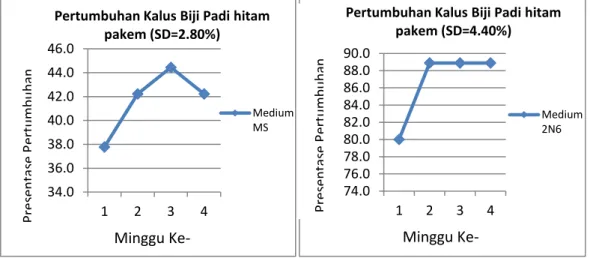
37 Pada medium N6, laju pertumbuhan kalus padi hitam Pakem pada minggu pertama menunjukkan respon pembentukan kalus sebesar 80%, sedangkan pada medium MS hanya sebesar 38 % (Gambar 7). Laju pertumbuhan kalus padamedium N6 pada minggu berikutnyamenunjukkan hasil yang lebih optimalmencapai hampir 90% (Gambar 7).
Gambar 7. Laju Pertumbuhan kalus padi hitamPakem yang menggunakan medium berbeda MS dan N6.
Gambar 7 menunjukan pertumbuhan kalus pada medium MS mengalami penurunan pada minggu ke-3 sampai minggu ke-4.Penurunan pertumbuhan kalus tidak disebabkan oleh tidak meresponnya sel terhadap medium, tetapi disebabkan oleh kontaminasi bakteri. Maka dari itu, sebagaimana hasil yang ditunjukan pada Gambar 6, untuk penelitian tahap selanjutnya penanaman padi hitamPakem, padi hitam Kulon Progo, padi hitam Indmira dan padi hitam Sleman hanya menggunakan medium N6. 34.0 36.0 38.0 40.0 42.0 44.0 46.0 1 2 3 4
Pertumbuhan Kalus Biji Padi hitam pakem (SD=2.80%) Medium MS % Minggu Ke-74.0 76.0 78.0 80.0 82.0 84.0 86.0 88.0 90.0 1 2 3 4
Pertumbuhan Kalus Biji Padi hitam pakem (SD=4.40%) Medium 2N6 Minggu Ke-% Pres en ta se P ertu m b u h an Pres en ta se P ertu m b u h an
38
B. Pertumbuhan kalus dari eksplan padi hitam Pakem, padi hitamKulon Progo,padi hitam Indmiradan padi hitamSleman pada medium N6. 1. Persentase pertumbuhan kalus padi hitam Pakem, Kulon Progo,
Indmira dan Sleman pada Medium N6.
Pertumbuhan kalus merupakan fase awal dalam kultur jaringan tumbuhan untuk mendapatkan masa sel. Tiap eksplan (bagian dari tanaman yang dijadikan sampel untuk dikultur) yang digunakan memiliki respon pertumbuhan yang berbeda-beda dalam suatu medium kultur. Hal ini dikarenakan kemampuan eksplan menyerap nutrisi medium disekitarnya yang bebeda (Indrianto, 2003).Persentase pertumbuhan kalus pada medium N6 dapat terlihat pada Gambar 8.
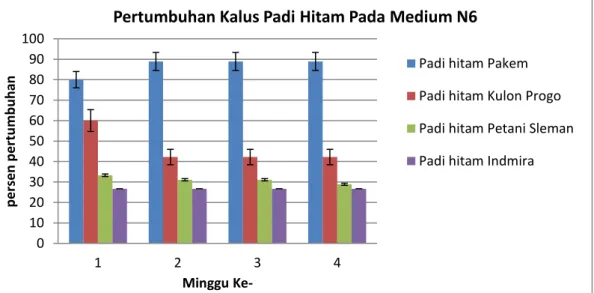
Gambar 8. Pertumbuhan kalus padi hitamberbagai varietasmenggunakan Medium N6
Berdasarkan Gambar 8, dapat diketahui bahwa padi hitam Pakem memiliki persentase pertumbuhan kalus yang lebih tinggi dibandingkan varietas yang lain. Hal ini terlihat dari minggu ke-1 sampai minggu ke-4 pada Gambar 8.Secara statistik hasil dari Gambar 8 tersebut, menyatakan bahwa perbedaan varietas padi
0 10 20 30 40 50 60 70 80 90 100 1 2 3 4 p e rsen p e rtu m b u h an Minggu
Ke-Pertumbuhan Kalus Padi Hitam Pada Medium N6
Padi hitam Pakem Padi hitam Kulon Progo Padi hitam Petani Sleman Padi hitam Indmira
39 hitam berpengaruh terhadap persentase pertumbuhan kalus, sedangkan perbedaan waktu pengukuran tidak ada pengaruh terhadap persentase massa kalus (Lampiran 1). Kalus padi hitam Pakem menunjukkan respon pembentukan kalus secara terus-menerus pada tiap minggunya, sedangkan kalus padi hitam varietas lainnya, dari minggu ke-1 sampai minggu ke-4 mengalami penurunan.Penurunan tersebut disebabkan oleh adanya kontaminasi endogen pada eksplan yang menyebabkan kematian pada kalus secara cepat. Selain itu, perbedaan pertumbuhan pada varietas padi hitam ini dimungkinkan karena adanya perbedaan masa simpan dari biji padi hitam setelah masa panennya. Akibatnya tingkat viabilitas biji padi hitamakan berbeda pula. Sebagaimana menurut Ano (2013) benih padi dengan viabilitas rendah salah satunya di pengaruhi oleh masa simpan yang terlalu lama sehingga akan mengalami pertumbuhan yang tidak maksimal.
Jika ditinjau dari proses sterilisasi biji padi hitam, untuk varietas padi hitam pakem dilakukan sterilisasi menggunakan alkohol 70% selama 1 menit (diulang 3x), dilanjutkan dengan sterilisasi menggunakan bleach selama 3 menit. sedangkan untuk varietas padi hitam Kulon Progo, Indmira dan Sleman, sterilisasi dilakukan lebih lama, yakni dilakukan selama 3 menit untuk alkohol 70% dan 7 menit bleach. Walaupun sudah dilakukan sterilisasi lebih lama, tetap saja kontaminan endogen masih besar. Hal ini yang menjadi penghambat pertumbuhan kalus dari ketiga varietas padi hitam tersebut. Gambar 9 menggambarkan laju pertumbuhan kalus dari keempat varietas padi hitam tersebut.
40 Gambar 9.Laju Pertumbuhan Kalus pada biji empatvarietas Padi Hitam
Berdasarkan Gambar 9 dapat dilihat bahwa laju pertumbuhan kalus padi hitam Sleman, padi hitamKulon Progo, dan padi hitam Indmira tidak mengalami kenaikan.Hal ini dikarenakan ketika ketiga varietas tersebut diinduksi untuk menjadi kalus, kontaminan endogen yang ada di ketiga varietas padi tersebut lebih cepat perkembangannya dibandingkan dengan pertumbuhan kalus, sehingga hasilnya seolah-olah ketiga varietas padi tersebut kurang responsif terhadap medium N6. Akan tetapi kalus yang mampu tumbuh karena tidak terkontaminasi
74.0 76.0 78.0 80.0 82.0 84.0 86.0 88.0 90.0 1 2 3 4
Pertumbuhan Kalus Biji Padi Hitam Pakem (SD=4.40%) Medium 2N6 Minggu % 0.0 10.0 20.0 30.0 40.0 50.0 60.0 70.0 1 2 3 4
Pertumbuhan Kalus Biji Padi Hitam Kulon Progo (SD=8.9%)
Medium 2N6 Minggu % 0.0 5.0 10.0 15.0 20.0 25.0 30.0 1 2 3 4
Pertumbuhan Kalus Biji Padi Hitam Sleman (SD=0.00%) Medium 2N6 Minggu Ke-% 26.0 27.0 28.0 29.0 30.0 31.0 32.0 33.0 34.0 1 2 3 4
Pertumbuhan Kalus Biji Padi Hitam Indimira (SD=1,8)
Medium 2N6
Minggu Ke-%
41 menunjukan laju pertumbuhan yang baik, sehingga didapatkan kalus yang friable. Berbeda pada padi hitam Pakem mengalami kenaikan setelah minggu kedua dan stagnan di minggu keempat, hal ini dimungkinkan ketika padi hitam Pakem diinduksi untuk menjadi kalus, tidak ada kontaminan endogen yang terlihat perkembangannya, sehingga sebagian besar eksplan dapat menjadi kalusyang friable.
2. Pertumbuhan Massa Kaluspadi hitam Pakem, Kulon Progo, Sleman, dan Indmira.
Pertumbuhan kalus tidak hanya dilihat dari persentase laju pertumbuhan kalus saja, akan tetapi pertumbuhan kalus juga dapat diukur melalui massa kalus. Pertumbuhan kalus dengan pengukuran masa kalus dapat dilihat pada Gambar 10.
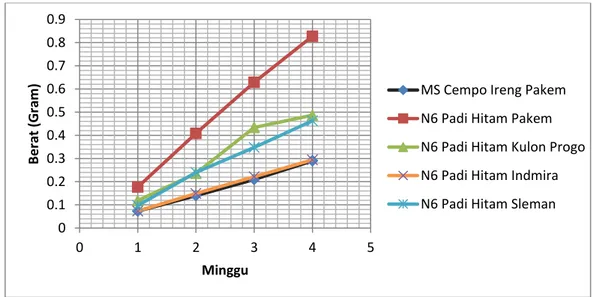
Gambar 10.Pertumbuhan kalus dilihat dari masa kalus yang terbentukpada padi hitam Pakem, Kulon Progo, Indmira, dan Slemansetiap minggu.
Gambar 10menunjukkan massa kalus dari tiap medium selalu mengalami peningkatan massa sel kalus dari minggu ke minggu. Padi hitam Pakem memiliki massa kalus yang paling tinggi kemudian diikuti oleh biji padi padi hitam Kulon
0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 0.8 0.9 0 1 2 3 4 5 B e rat (Gr am ) Minggu
MS Cempo Ireng Pakem N6 Padi Hitam Pakem N6 Padi Hitam Kulon Progo N6 Padi Hitam Indmira N6 Padi Hitam Sleman
42 Progo, padi hitamIndmira, padi hitamSleman pada medium N6. Serta padi hitam Pakem yang ditanam pada medium MS. Hasil tersebut membuktikan bahwa massa kalus dari empat varietas padi hitam tumbuh lebih baik pada medium N6 daripada medium MS. Hal ini dikarenakan Medium N6 mengandung sukrosa dengan kadar lebih tinggi dibandingkan Medium MS yaitu sebesar 30gram/L (Medium N6) dan 20gram/L (Medium MS). Karbohidrat terutama gula, merupakan komponen yang selalu ada dalam media tumbuh. Penggunaan gula jenis sukrosa dalam media tanam diketahui dapat mempengaruhi kecepatan induksi embrio somatik dan pertumbuhan massa kalus (Lazzeri et al., 1988). Menurut Gunawan (1992)kecepatan sel membelah diri dipengaruhi oleh zat pengatur tumbuh dalam konsentrasi tertentu, selain itu juga tergantung pada jenis tumbuhan. Faktor lain seperti jenis media, ketersediaan unsur hara makro/mikro, karbohidrat seperti sukrosa, adanya bahan tambahan seperti air kelapa dan juga faktor fisik seperti cahaya, sterilisasi, suhu, dan pH media.
C. Transformasi Gen Hd3a pada kalus embriogenik padi hitam Pakem, padi hitam Kulon Progo, padi hitam Indmira dan padi hitamSleman dengan metode Agrobacteriumtumefaciens.
Setelah didapatkan kalus dari medium N6, selanjutnya kalus tersebut ditransformasi dengan gen Hd3a dengan bantuan Agrobacterium tumefaciens. Agrobacterium tumefaciens yang digunakan telah memiliki konstrak rolC::Hd3a-GFP.Isolat konstrak rolC::Hd3a-GFPkemudian diperbanyak dengan menumbuhkannya kembali pada medium LB. Berikut ini (Gambar 11) adalah
43 gambarpertumbuhan koloni tunggal bakteri Agrobacterium tumefacien yang membawa plasmid p2K1-binary vector (rolC::Hd3a-GFP) umur 48 jam.
Gambar 11. Pertumbuhan koloni tunggal bakteri Agrobacterium tumefaciens yang membawa plasmid p2K1-binary vector (rolc::Hd3a-GFP) umur 48 jam.
Perbanyakan koloni tunggal ini dilakukan untuk meregenerasi kembali bakteri pembawa gen Hd3a(transforman) sebelum digunakan untuk transformasi. Bakteri Agrobacterium tumefaciens ini ditumbuhkan dalam medium yang mengandung antibiotik higromisin dan kanamisin dengan konsentrasi masing-masing 50 mg/L. Menurut Sudigdoadi (2008) antibiotik bekerja dengan cara menghentikan sintesis protein pada ribosommelalui penghambatan pada tahap translasi dan transkripsi meterial genetik. Penggunaan antibiotik ini bertujuan sebagai agen penyeleksi yang mengindikasikan bahwa bakteri tersebut memiliki gen target yang sesuai. Selanjutnya koloni yang pertumbuhannya cepat akan digunakan dalam proses transformasi gen kedalam sel kalus padi hitam.
Koloni Agrobacteriumtumefaciensyang tumbuh pada medium seleksi diuji dengan koloni PCR untuk mengetahui keberadaan konstrak plasmidHd3a.Hasil koloni PCR menunjukkan bahwa sampai generasi ke-3 bakteri
44 Agrobacteriumtumefaciens masih mengandung konstrak plasmidrolC::Hd3a-GFPyang diinginkan.Berikut hasil analisis colony PCR bakteri Agrobacteriumtumefaciens (Gambar 12).
M 1 2 3 4 5 6
Gambar 12. Hasil analisis PCR koloni Agrobacterium tumefaciens yang membawa konstrak gen
Hd3a dengan panjang pita gen sepanjang 174 bp dan HPT dengan panjang pita gen
sepanjang 455bp. Koloni bakteri ditumbuhkan sampai dengan generasi ketiga.
Proses transformasi dilakukan secara tidak langsung yaitu dengan cara menumbuhkan Agrobacterium tumefaciens pada medium MSL yang sama dengan kalus padi hitam. Proses co-kultivasi kalus dengan bakteri Agrobacterium tumefaciensdilakukan selama 3 hari pada medium N6CO. Hal ini diharapkan
selama waktu tersebut konstrak rolC::Hd3a-GFP akan ditransfer kedalam kalus padi hitam.Seperti yang dikemukakan oleh Yu et. al. (2000),Agrobacterium tumefaciens memiliki Ti plasmid secara alami yang didalamnya terdapa T-DNA sebagai gen penentu pembentukan tumor (crowngall), termasuk gen-gen T-DNA yang menyandi regulator pertumbuhan tanaman.
Komponen genetik yang terlibat dalam mekanisme transfer gen Agrobacteriumtumefaciens yaitu: a) squence T-DNA yang berukuran 200-250 kb yang beintegrasi secara stabil kedalam sel tanaman. b) gen VIR yang berukuran
174 bp
45 35 kb sebagai bagian dari Ti yang terdiri dari 7 lokus: Vir A, Vir B, Vir C, Vir D, Vir E, Vir G, Vir H (produk protein ini berperan dalam pemotongan dan integrasi T-DNA kedalam genom). c) chromosom virulence genes (Chv) terdapat dalam kromosom A. tumefaciens yang berperan dalam interaksi awal sebagai signal untuk mengenali permukaan sel dan penempelan bakteri pada sel tanaman (Kung and Wu, 1993).
Pada proses inisiasi, bakteri Agrobacteriumtumefaciensakan mengenali senyawa fenolik yang berupa Asytosiringone yang ditambahkan kedalam media kultur sebesar 20 µl. Asytosiringone yang diberikan bertujuan agar bakteri menyukai dan dapat menginfeksi kalus, sehingga tanaman akan mengeluarkan senyawa fenol untuk memproduksi VIR (sebagai transmembran resseptor). Selanjutnya gen VIR A akan menginduksi ekspresi gen VIR lainnya yang menyebabkan pemotongan DNA pada sisi L dan R border oleh Vir D1 dan D2, sehingga menjadi satu untai T-DNA tunggal (ssDNA). Vir C membantu sintesis DNA untai tunggal tersebut (strand T). Vir D2 juga memiliki sinyal sasaran nucleus localization signal (NLS) yang terkait pada ujung 5’ T-DNA untuk intergrasi spesifik pada genom tanaman, dilanjutkan dengan proses pengangkutan T-DNA yang melibatkan aktivitas vir E2 yang juga memiliki NLS, Vir E2 akan mengikat ssDNA dan membuat strand Tini mengalir dan berintegrasi kedalam sel tanaman melewati phili, pembentukan saluran phili pada membran sel A. tumefaciens untuk transfer DNA (interbacterial conjugation) dengan dibantu oleh aktivitas gen VIR B1-11, diteruskan dengan aktivitas gen Chv A dan B dari A. tumefaciensyang akan mengikat permukaan sel tanaman. Masuknya strand T ini
46 diatur oleh protein vir D serta produk protein dari vir B yang mengkatalis proses pemindahan dan menginjeksikan DNA kedalam sel (Kung and Wu, 1993). Proses transformasi kalus oleh Agrobacterium tumefaciens terlihat pada Gambar 13.
Gambar 13. Proses inkubasi pada saat inisiasi kalus padi hitam oleh bakteriAgrobacterium
tumefaciens yang membawa gen rolC::Hd3a-GFP pada medium N6CO selama 3
hari.
Pertumbuhan Agrobacterium tumefaciens yang akan diinfeksikan kedalam kalus padi hitam sangat menentukan keberhasilan proses transformasi genetik. Konsentrasi Agrobacteriumtumefaciens di dalam medium MSL dioptimasi sampai OD600 sebesar 0,008-0,01 (pengukuran dengan spektofotometer). Konsentrasi ini
sangat optimal untuk infeksi Agrobacteriumtumefaciens kedalam kalus padi hitam, apabila konsentrasi Agrobacteriumtumefaciens pada medium MSL yang digunakan lebih tinggi dapat mengganggu pertumbuhan sel kalus (overgrowth) sehingga dapat menyebabkan kematian pada kalus (Khurram et. al., 2011)
47 Setelah proses transformasi pada medium N6CO oleh bakteri Agrobacteriumtumefaciens,dilakukan pencucian dengan menggunakan claforan. Claforan digunakan sebagai agen pembunuh terhadap bakteri Agrobacteriumtumefacienspada konsentrasi 500mg/L. Kemudian kalus yang telah bersih ditanam pada medium MS2Ddan medium seleksi dengan
antibiotikhigromisin dan kanamisin.
D. Analisis molekular untuk melihat keberadaan gen Hd3a hasil transformasi didalam genom kalus padi hitam.
Seleksi kalus hasil transformasi dapat dilakukan dengan cara menumbuhkan kalus dalam medium pertumbuhan yang mengandung antibiotik, herbisida, atau fitotoksin, tergantung gen marker yang dikloning pada plasmid dan terintegrasi ke dalam genom tanaman. Pemilihan gen marker ini tergantung pada spesies dan genotip tanaman. Toki (1997) dan Yara et al. (2001) melaporkan bahwa Higromisin 50 mg/l dapat digunakan sebagai agen penyeleksi kalus pada padi. Sel kalus yang dapat tetap hidup pada mediumMS2Dyang mengandung antibiotik
higromisin dan kanamisin sebagai media seleksi dianggap sebagai tanaman kandidat transforman.Sel kalus yang hidup pada media seleksi ini disubkultur dengan medium yang sama seminggu sekali. Gambar 14 menunjukan kalus hasil transformasi pada medium MS2D dengan antibiotik kanamisin dan hygromisin
dengan konsentrasi masing-masing sebanyak 50 mg/l, kalus tersebut berumur 2 minggu setelah proses transformasi gen Hd3a.
48 Gambar 14. Kalus padi hitam hasil transformasi pada medium MS2D dengan antibiotik kanamisin
dan hygromisin 50 mg/l. ket :A. Kalus padi hitam Pakem; B. Kalus padi hitamIndmira; C. Kalus padi hitamKulon Progo; D. Kalus padi hitamSleman. Kalus berumur 2 minggu setelah proses transformasi gen Hd3a. Pada gambar A sudah terlihat adanya pertumbuhan akar pada kalus hasil transformasi (transforman).
Berbeda dengan sel kalus non transforman (wildtype) sebagai kontrol, apabila ditumbuhkan pada medium seleksi dengan penambahan antibiotik yang sama yaitu higromisin dan kanamisin dengan konsentrasi masing-masing 50 mg/L, tampak sel kalus non transforman mengalami pencoklatan (Gambar 15). Kalus terlihat mengalami kematian secara perlahan umur satu minggu pada medium seleksi ini.
A B
49 Gambar 15. Kalus padi hitamnon transforman. Pada medium MS2D dengan antibiotik
higromisin dan kanamisin (masing-masing 50 mg/L). Kalus mengalami pencoklatan dan menuju kematian pada minggu pertama.
Penggunaan antibiotik higromisin dan kanamisin sangat menentukan kandidat sel kalus transforman (Yu et. al., 2001). Berdasarkan hasil yang diperoleh, sel kalus transforman yang tumbuh pada medium seleksi sebagian ada yang mengalami kematian dan sebagaian lagi tetap berwarna putih. Hal ini mengindikasikan bahwa beberapa kalus yang mampu tumbuh dengan baik pada medium seleksi merupakan kalus yang berhasil tertransformasi dengan gen Hd3a oleh bakteri Agrobacterium tumefaciens. Sedangkan kalus yang tidak mampu tumbuh pada medium seleksi mengindikasikan bahwa kalus tersebut tidak berhasil tertransformasi gen Hd3asehingga tidak memilki gen HPT yang dapat meregulasi higromisin didalam medium.Akibatnya kalus yang tidak tertansformasi gen Hd3apada medium seleksi mengalami kematian seperti pada kalus non transforman (wildtype) yang ditumbuhkan pada medium seleksi yang sama (Gambar 15). Antibiotik kanamisin dan higromisin dalam mediumberfungsi menghambat sintesis protein dalam organela terutama kloroplas sehingga terjadi
50 vitrifikasi disusul dengan kematian sel kalus (Slater et al.,2003). Tanaman yang dapat tumbuh (transforman) resisten terhadap kanamisin dan higromisin dikarenakan telah memiliki genHd3ayang berasal dari T-DNA Agrobacteriumtumefaciens.
DNA genom sel kalus yang hidup pada media seleksi (transforman) selanjutnya diisolasi yang kemudian dianalisis T-DNA yang terintegrasi pada DNA genom kalus transforman tersebut. Analisis dilakukan dengan metode PCR menggunakan primer spesifik untuk gen rolC::Hd3a dan gen HPT. Berikut adalah gambar keberadaan gen Hd3a dalam kalus padi transforman disajikan pada gambar 16.
A B C D E
Gambar 16. Elektroforegram DNA hasil amplifikasi DNA genom transforman padi hitam. Ket: A. Kalus padi hitam non transforman; B. Kalus padi hitam Pakem; C. Kalus padi hitamKulon Progo; D. kalus padi hitamIndmira; dan E. Kalus padi hitamSleman; M: marka gen; NT: kalus nontransforman; T: hasil amplifikasi genom kalus transgenik dengan primer Hd3a (174 bp); H: hasil amplifikasi genom kalus transgenik dengan primer HPT (455 bp).
M NT H T1 H1 T 2 H2 T3 H3 T4 H4
174 bp 455 bp