BAB II
LANDASAN TEORI
A. Tinjauan Pustaka
1. Lupus Erimatosus Sistemik a. Definisi
Lupus Eritematosus Sistemik (SLE) adalah penyakit autoimun yang kompleks ditandai oleh adanya autoantibodi terhadap inti sel dan melibatkan banyak sistem organ dalam tubuh (Suarjana, 2014).
b. Epidemiologi
Angka kejadian SLE bervariasi antar negara, etnis, jenis kelamin, dan perubahan dari waktu ke waktu. Di Amerika Serikat prevalensi SLE diperkirakan sekitar 13 per 100.000, sehingga sekitar 159.000 dari 300 juta orang di Amerika Serikat yang terkena SLE. Angka kejadian SLE di Eropa Utara adalah sekitar 40 per 100.000 orang (Bhattacharya et al., 2011). Belum terdapat data epidemiologi SLE yang mencakup semua wilayah Indonesia (Perhimpunan Rematologi Indonesia, 2011).
c. Imunopatogenesis
Berkembangnya SLE terjadi dalam serangkaian langkah (Bertias, 2012). Ada periode panjang kecenderungan untuk autoimunitas, yang dipengaruhi oleh genetik, jenis kelamin, dan paparan lingkungan, dan kemudian terjadi pengembangan autoantibodi, yang biasanya mendahului gejala klinis oleh bulan ke tahun (gambar 1). Sebagian individu dengan autoantibodi menunjukkan klinis SLE, sering dimulai dengan keterlibatan sejumlah kecil sistem organ atau nilai laboratorium abnormal, dan kemudian berkembang menjadi kelainan klinis dan laboratorium yang cukup jelas. Akhirnya, setelah bertahun-tahun, sebagian besar individu dengan pengalaman klinis flare intermiten SLE dan terjadi perbaikan (biasanya tidak remisi lengkap), dan terjadi kompilasi kerusakan organ dan adanya penyakit penyerta yang berkaitan dengan predisposisi genetik, peradangan kronis, aktivasi jalur yang merusak organ (seperti tubulus ginjal), dan/atau menyebabkan fibrosis, untuk terapi, dan penuaan (Bevra, 2013).
Gambar 1. Perjalanan Klinis Lupus Erithematosus Sistemik (Bertias et al., 2012)
Interaksi sel B dan T pada SLE memainkan peran utama dalam produksi IgG dan komplemen–dalam usahanya memperbaiki antibodi autoreaktif. Hiperaktivitas sel T dan/atau sel B menyebabkan jumlah yang lebih tinggi dari autoantibodi dan sitokin proinflamasi, dan hipoaktivitas menyebabkan autoreaktivitas yang memungkinkan autoreaktif sel B dan T untuk menghindari apoptosis. Ada defek yang memungkinkan kelangsungan hidup subset sel-B autoreaktif pada SLE. Proses toleransi (apoptosis, anergi, BCR editing) yang tumpul, yang memungkinkan kelangsungan hidup dan pematangan sel B autoreaktif. Setelah sel B yang normal keluar sumsum tulang, terjadi serangkaian pemeriksaan yang biasanya menyingkirkan sel autoreaktif. Adanya defek di beberapa pos pemeriksaan tersebut pada SLE, termasuk awal maturasi sel B dan transisi B menjadi sel B matur, masuk ke pusat germinal (GCS), dan B naive untuk mengaktifkan mautrasi sel B. Normalnya, di GCS, sel B nonautoreactive bermigrasi ke daerah zona T, di mana mereka berhubungan dengan CD4 + T sel helper, yang menyebabkan aktif dan termemori, dengan switching Ig dan memproduksi sel plasma. Proses ini menghasilkan pelindung respon antibodi (Bevra, 2013).
Terdapat blokade dalam SLE untuk mencegah sel-sel autoreaktif B bergeser ke zona sel T. Sehingga pada GCS ada defek toleransi yang memungkinkan bantuan sel-T untuk produksi autoantibodi yang berpotensi membahayakan. Sel B normal dan SLE juga dapat menghasilkan autoantibodi dengan switching kelas dan maturasi independen terhadap sel T, melalui aktivasi TLRs sel-B. Dalam SLE proses ini dapat ditingkatkan, mungkin oleh autoantigens. Paparan lingkungan pada sel B untuk autoantigen mungkin dipengaruhi oleh varian genetik SLE yang mempromosikan aktivasi imunitas innate dan produksi IFN tinggi oleh sel imun innate (Bevra, 2013)
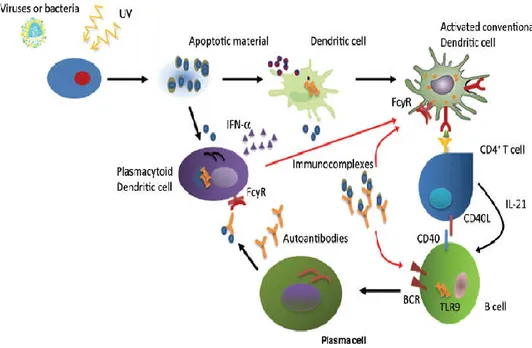
Gambar 2. Pathogenesis Lupus Eritematosis Sistemik (Bertias, 2012)
Gambar 2 pada SLE semua jalur menyebabkan asam nukleat endogen yang dimediasi produksi α interferon (IFNα). Peningkatan produksi autoantigen selama apoptosis (terkait UV dan/atau spontan), menurunnya bersihan, deregulasi penanganan dan presentasi, semuanya penting untuk inisiasi respon autoimun. Nukleosom mengandung ligan endogen berbahaya yang dapat mengikat reseptor molekul patogen terkait yang merusak apoptosis yang menyebabkan aktivasi DC dan Sel B dan produksi IFN dan autoaantibodi. Reseptor permukaan sel seperti BCR dan FcRIIa memfasilitasi endositosis asam nukleat yang mengandung bahan atau kompleks imun dan mengikat reseptor endosomal dari innate imunitas seperti TLRs. Pada tahap awal penyakit, ketika autoantibodi dan kompleks imun mungkin belum terbentuk, antimikroba peptida yang dilepaskan oleh jaringan yang rusak seperti LL37 dan perangkap neutrofil ekstraseluler, mungkin mengikat asam nukleat dan menghambat degradasi dan dengan demikian memfasilitasi endositosis dan stimulasi TLR-09/07 di plasmasitoid sel dendrik (DC). Meningkatnya jumlah dari asam nukleat endogen terkait apoptosis merangsang produksi IFN dan menyebabkan autoimunitas dengan merusak toleransi melalui aktivasi dan promosi pematangan konvensional (myeloid) DC. Sel dendrik matur menyebabkan toleransi ketika DC matur yang telah aktif menyebabkan autoreaktivitas. Produksi autoantibodi oleh sel B dalam lupus didorong oleh ketersediaan antigen endogen dan sebagian besar tergantung pada bantuan sel T, yang dimediasi oleh interaksi sel
permukaan (CD40L/CD40) dan sitokin (IL-21). Kromatin yang mengandung kompleks imun merangsang sel B karena gabungan silang BCR/ TLRDC, reseptor sel BCR, B, FCR, Fc reseptor, UV, TLR (Bertias, 2012).
2. Interleukin 6
Interleukin 6 (IL-6) adalah sitokin pleiotropik dengan cakupan aktivitas biologis yang cukup luas. Dapat bertindak dalam endokrin, mode autokrin dan parakrin pada sel target yang beragam. Sumber utama dari IL-6 adalah monosit; fibroblas dan sel endotel, tetapi sel T, sel B, keratinosit, sel mesangial, dan beberapa sel tumor juga memproduksi IL-6. Sintesis diinduksi oleh IL-1, IL-2, tumor necrosis factor (TNF-α), dan interferon (IFN) dan dihambat oleh IL-4, IL-10 dan IL-13. Salah satu fungsi biologis yang paling penting dari IL-6 adalah kemampuannya untuk merangsang tahap final maturasi limfosit B. Di bawah pengaruh IL-6, limfosit B berdiferensiasi menjadi sel plasma matur dan mensekresikan imunoglobulin (Ig). Selain itu, IL-6 menginduksi pertumbuhan sel T sitotoksik dan diferensiasi sel T melalui augmentasi ekspresi reseptor IL-2 dan produksi IL-2. Ini juga merupakan inducer poten dari makrofag terminal dan diferensiasi osteoklas. Interleukin 6 juga berhubungan dengan IL-1 dan TNF, termasuk induksi demam dan produksi protein fase akut seperti serum amyloid A, CRP, alpha 1 antitrypsin, fibrinogen, dan haptoglobulin. Berbeda dengan efek proinflamasi, IL-6 menengahi beberapa efek anti-inflamasi yang unik. Sedangkan baik IL-1 maupun TNF-α menginduksi sintesis satu sama lain, serta IL-6 mengakhiri upregulatory kaskade inflamasi dan menghambat sintesis IL-1 dan TNF-α. Hal ini juga penting bahwa, sebagai faktor pertumbuhan sel, IL-6 dapat menginduksi proliferasi keratinosit epidermal dan sel mesangial dan memiliki peran aktif dalam mesangial glomerulonefritis proliferatif (Tackey et al, 2004).
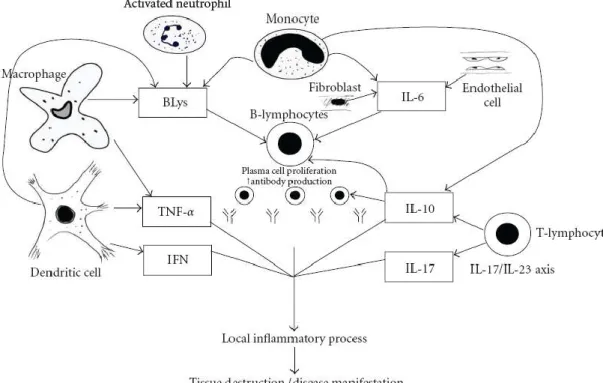
Gambar 3. Peran sitokin dalam patogenesis lupus (Yap dan Lai, 2010)
Stimulasi oleh IL-6 menyebabkan sel-sel progenitor uncommitted untuk mengekspresikan faktor transkripsi yang menghambat limfopoiesis dan mempromosikan myelopoiesis pada SLE (gambar 3). Mekanisme lain bagaimana IL-6 dapat mempengaruhi kelangsungan hidup sel B adalah melalui recombination activation gen (Rag) yang sangat penting untuk penyusunan kembali imunoglobulin gen V(D)J. Interleukin 6 mengekspresikan Rags dan karenanya memfasilitasi penyelamatan sel B autoreaktif dari apoptosis. Peran IL-6 juga terdapat dalam generasi autoantibodi dan pengembangan berbagai manifestasi klinis pada hewan coba. Pada pasien lupus, ditekankan kadar IL-6 berkorelasi dengan aktivitas penyakit dan kadar anti dsDNA. Sel lymphoblastoid terisolasi dari subyek lupus menunjukkan kadar 6 yang tinggi dan IL-6 antagonisme mengakibatkan pengurangan anti ds DNA in vitro (Yap dan Lai, 2010). Peran dominan IL-6 pada patogenesis SLE adalah untuk mempercepat produksi autoantibodi dengan mempromosikan proliferasi sel B autoreaktif. Telah diteliti dalam percobaan ex vivo bahwa sel B dari pasien lupus bisa meningkatkan kadar imunoglobulin dan blokade IL-6 secara signifikan menghapus sintesis spontan immunoglobulin, yang dipulihkan dengan pemberian IL-6 eksogen, sehingga menunjukkan peran penting dari IL-6 dalam produksi autoantibodi. Di antara berbagai subtipe Limfosit B, sel B densitas rendah bertanggung jawab untuk produksi sebagian besar autoantibodi, dan IL- 6 dapat
memfasilitasi sel-sel kepadatan B rendah pada pasien lupus aktif untuk membedakan langsung ke Ig-sel sekresi. Pada tingkat gen, produksi IL-6 yang menyimpang oleh sel B SLE diregulasi regulator positif recombination activating gen (RAG2), yaitu p27 (Kip1), menyebabkan SLE B sel menjadi rentan terhadap penyusunan ulang gen imunoglobulin sekunder dan produksi autoantibodi (Su et al, 2012).
3. Mikroalbuminuria
Mikroalbuminuria merupakan petanda dini (marker) terjadinya disfungsi endotel secara umum meliputi pembuluh darah renal, kardial, maupun serebral. Adanya mikroalbuminuria yang secara mudah dapat diteksi lewat urin, dapat menjadi marker disfungsi endotel pembuluh darah di seluruh tubuh. Dengan mengetahui mikroalbuminuria, kita menjadi lebih dini mengetahui disfungsi endotel tersebut sehingga prognosisnya lebih baik karena disfungsi endotel tersebut masih reversibel (Weir, 2007; Loscalzo, 2009).
Mikroalbuminuria sesuai dengan hukum homeostasis akan direabsorbsi oleh sel-sel tubulus proksimal. Mikroalbuminuria yang terus menerus akan menyebabkan sel-sel-sel-sel tubulus proksimal bekerja keras mereabsorbsi protein tersebut akibatnya sel-sel tubulus proksimal mengalami stresor dan akan mengeluarkan sitokin pro-inflamasi (TNF-α, IL-1β, IL-6 dan TGF-β1). Sitokin-sitokin tersebut akan merusak ginjal baik melalui mekanisme fibrosis, apoptosis, onkosis, maupun nekrosis (Robbins dan Cotran, 2005).
Tabel 1. Klasifikasi Ekskresi Albumin Urin (Weir, 2007).
Mikroalbumi nuria 24 jam (mg/24 jam) Mikroalbumi nuria overnight (mg/24 jam) Spot Urine Albumin Albumin/Creatinine Ratio Gender mg/mmol mg/g Normal <15 <10 <10 M <1.25 <10
F <1.75 <15 High Normal 15 to <30 10 to <20 10 to <20 M 1.25 to <2.5 10 to <20 F 1.75 to <3.5 15 to <30 Micro-albuminuria 30 to <300 20 to <200 20 to <200 M 2.5 to <25 20 to <200 F 3.5 to <35 30 to <300 Macro-albuminuria >300 >200 >200 M >25 >200 F >35 >300 4. Nefritis lupus
Nefritis lupus terjadi ketika antibodi (antinuclear antibody) dan komplemen terbentuk di ginjal yang menyebabkan terjadinya proses peradangan. Hal tersebut biasanya mengakibatkan terjadinya sindrom nefrotik (eksresi protein yang besar) dan dapat berprogresi dengan cepat menjadi gagal ginjal. Produk nitrogen sisa terlepas kedalam aliran darah. Lupus Eritematosus Sistemik menyerang berbagai struktur internal dari ginjal, meliputi nefritis interstitial dan glomerulonefritis menbranosa. Nefritis lupus mengenai 2 dari 10 ribu orang. Pada anak dengan SLE, sekitar setengahnya akan mengakibatkan terjadinya progresifitas menjadi gagal ginjal. Lupus Eritematosus Sistemik paling sering terjadi pada wanita usia 20-40 tahun (Lee et al., 2010).
Gambar 4 menerangkan mekanisme terjadinya nefritis lupus, dari kanan atas: awal terjadinya nefritis melibatkan produksi autoantibodi terhadap self antigen diikuti oleh pembentukan kompleks imun (IC) di glomeruli. Deposisi IC menyebabkan aktivasi komplemen dan aktivasi sel ginjal intrinsik (sel mesangial (MC) dan sel endotel (EC), baik yang mengarah ke kemokin lokal dan sitokin inflamasi. Ekspresi kemokin mengarah ke influx sel inflamasi seperti limfosit dan makrofag. Gambar sebelah kiri: influx sel imun menyebabkan inflamasi interstitial serta glomeruli dan serta aktivasi EC. Aktivasi sel ginjal (MC dan podocytes) dan infiltrasi sel imun (makrofag dan sel dendritik (DC) menghasilkan nitrogen reaktif [(nitrat oksida (NO)] dan spesies oksigen reaktif (ROS). Ekspresi gabungan sitokin dan ROS menghasilkan inflamasi ginjal dan fibrosis, yang mengakibatkan kerusakan jaringan kumulatif baik di tingkat glomerular (kanan atas) dan tingkat tubular (kiri). Kanan bawah: interaksi Limfosit dan fungsi seperti ekspresi sitokin dan produksi antibodi berkontribusi terhadap inflamasi dan kerusakan dalam tubulus dan glomeruli (Nowling dan Gilkeson, 2011).
Gambar 4. Mekanisme terjadinya nefritis lupus. (Nowling dan Gilkeson, 2011) Terjadinya nefritis melibatkan produksi autoantibodi terhadap self antigen diikuti oleh pembentukan kompleks imun (IC) di glomeruli BCR, reseptor sel B; FCR, reseptor Fc; monosit Chemoattractant Protein-1 (MCP-1); STAT, sinyal transduser dan aktivator transkripsi; TCR, reseptor sel-T.
Menurut lnternationol Society of Nephrotogy/Renal Pathology Society, gambaran histologis pada lupus nefritis dibagi menjadi 6 kelas sebagai berikut :
1.
5. Hewan Coba Model Lupus
Tetramethylpentadecane (TMPD) atau sering dikenal dengan nama pristan merupakan zat yang berperan untuk menginduksi SLE pada hewan. Produksi
autoantibodi karena TMPD ini melalui jalur signallinf dari IFN 1. Sumber utama dari IFN 1 adalah monosit imatur yang mengekspresikan ly6C pada permukaannya yang diproduksi melalui jalur TLR 7 dan Myd88. Jaringan limfoid ektopik juga memproduksi autoantibodi lupus sebagai respon terhadap TMPD (Reeves et al., 2009).
Pristan (TMPD) adalah alkalin isoprenoid yang ditemukan dalam jumlah kecil di beberapa tanaman. Pristan berasal dari metabolisme phytol, suatu ester klorofil. Pristan banyak terdapat pada alga dan plankton yang dapat merubah phytol menjadi pristan. Selain itu minyak mentah yang didapatkan dari proses penyulingan yang mengandung rantai cabang parafin, naphtene, dengan 15 atau lebih karbon dengan titik uap antara 300-600ºC dapat menghasilkan pristan (Reeves et al, 2009).
Penelitian untuk membuat mencit model lupus, dapat menggunakan injeksi tunggal 0,5 ml pristan intraperitoneal (Chowdhary et al., 2007). Injeksi TMPD intraperitoneal pada mencit Balb/C akan menyebabkan respon inflamasi lokal (lipogranuloma), dan atritis (Satoh et al., 1994).
Injeksi pristan akan menginduksi terjadinya aktivasi NFβ yang berada pada makrofag intraperitoneal untuk memproduksi sitokin proinflamasi. Sitokin IL-6 akan menginduksi endotelin, endotelin akan mengaktifkan NADPH dan terbentuklah ROS. Selain itu, TNF-α juga akan mengaktifkan NADPH untuk membentuk ROS.
Mekanisme aksi adjuvant minyak hidrokarbon murni masih belum sepenuhnya dapat dijelaskan. Hal penting yang mungkin berkontribusi terhadap patogenesis adalah induksi sitokin inflamasi oleh minyak hidrokarbon. Injeksi intraperitoneal minyak hidrokarbon dilaporkan menginduksi ekspresi sitokin proinflamasi IL-12, IL-6, dan TNF. Selanjutnya, pristan dan heksadekana memicu pelepasan sitokin inflamasi 1α dan IL-1β oleh mekanisme inflammasome-independent dan dependent. Peningkatan kadar serum IL-1α, IL-1β juga dijelaskan dalam darah perifer tikus setelah stimulasi dengan pristan. IL-1 dan inflammasome yang penting dalam penyakit autoimun biasanya dipicu oleh minyak hidrokarbon (Boeltz et al., 2013).
Penelitian terbaru menunjukkan bahwa bortezumib inflammasome inhibitor mencegah lupus nefritis pada mencit model lupus. Selanjutnya, mencit yang kekurangan caspase 1, enzim pusat dari inflammasome, dilindungi terhadap pembentukan autoantibodi dan glomerulonefritis pada pristan-induced lupus (Satoh et al., 2000).
Mekanisme selanjutnya mungkin induksi kematian sel dan akumulasi sel-sel mati. Pristan memiliki efek sitotoksik tergantung dosis dan jenis sel dan dilaporkan
menginduksi kematian sel in vitro dan in vivo. Pada tikus, pristan menginduksi apoptosis melalui jalur mitokondria. Selain itu, Fas tampaknya terlibat, karena injeksi pristan meregulasi ekspresi Fas dan L dalam sel peritoneal dan baris sel, dan Fas atau Fas-L tikus kekurangan dilindungi dari PIFas-L. Pristan juga menginduksi kematian sel dengan cara yang berbeda pada tikus dan sel manusia. Injeksi pristan ke tikus memicu apoptosis pada pengeringan kelenjar getah bening inguinal dan meningkatkan jumlah sirkulasi sel apoptosis dan nekrosis. Ada juga bukti pristan yang akan tergabung dalam membran sel dan karena itu dapat memiliki pengaruh yang merugikan pada membran integritas (Boeltz et al., 2013).
Pristan pada kadar lebih rendah, demikian pula hexadane, menginduksi pembentukan perangkap neutrofil ekstraseluler (NETs) pada neutrofil polimorfonuklear dari darah manusia, tikus, dan mencit. Hal Ini merupakan temuan penting, karena NETs telah terlibat dalam patogenesis lupus Peptida antimikroba (AMP) seperti cathelicidins berhubungan dengan NETs dan mampu mengikat asam nukleat, melindungi dari degradasi oleh nucleases, dan meningkatkan serapan ke TLR yang mengandung endosomes yang mungkin berkontribusi pada patogenesis SLE (Garcia et al., 2011) dan arthritis (Hoffman et al., 2013).
Selain itu, pasien SLE sering memperlihatkan tanda pengaruh neutrofil, dan neutrofil dapat berkontribusi untuk SLE dan juga untuk arthritis melalui berbagai mekanisme, misalnya, produksi mediator inflamasi, pelepasan proteinase yang menyebabkan kerusakan pembuluh darah dan cedera jaringan, dan produksi dari AMP yang meningkatkan imunogenisitas dari kompleks imun ( Boeltz et al., 2013).
Gambar 5. Mekanisme pristan menginduksi lupus pada mencit. (Boeltz et al., 2013)
Mekanisme injeksi pristan menginduksi lupus pada mencit dijelaskan pada gambar 5, dimana penyerapan autoantigen yang dihasilkan oleh kematian sel yang berkelanjutan dalam pengaturan lingkungan inflamasi dan kekurangan clearance pada lokasi paparan minyak hidrokarbon (pristan) dapat menyebabkan meningkatnya dan menyimpangnya presentasi autoantigen. Signalling dari TLRs dan induksi IFN tipe I tampaknya sangat penting Faktor lain yang disebabkan oleh pristan adalah HMGB1 alarmin. HMGB1, yang dirilis selama kematian sel dan/atau dari sel-sel kekebalan yang diaktifkan setelah paparan pristan, dapat berkontribusi untuk induksi autoantibodi anti nuklear dan munculnya gambaran lupus. Lingkaran yang ditetapkan oleh proses ini akhirnya menghasilkan rusaknya toleransi dan berkembangnya manifestasi lupus atau penyakit rematik autoimun (Boeltz et al., 2013).
6. Sel Punca a. Definisi
Sel Punca adalah sel tubuh manusia dengan kemampuan istimewa memperbaharui atau meregenerasi dirinya sendiri (self regenerate/self renewal) dan mampu berdiferensiasi menjadi sel lain (Permenkes, 2012). Sel punca atau dikenal stem cell mempunyai 2 sifat, yaitu kemampuan untuk berdiferensiasi menjadi sel lain (differentiate). Dalam hal ini stem cell mampu berkembang menjadi berbagai jenis sel
mature, misalnya sel saraf, sel otot jantung, sel otot rangka, sel pankreas, dan lain-lain. Dan kemampuan untuk memperbaharui atau meregenerasi dirinya sendiri (self-regenerate/self-renew). Dalam hal ini sel punca dapat membuat salinan sel yang persis sama dengan dirinya melalui pembelahan sel (Watt dan Ryan, 2010).
b. Jenis-jenis sel punca
Berdasarkan sumbernya sel punca dibagi menjadi 2 yaitu (Saputra, 2008): i. Sel punca embrional
ii. Sel punca dewasa
Berdasarkan klasifikasinya sel punca dibedakan menjadi 4 (Hakim et al, 2008): i. Totipoten
ii. Pluripoten iii. Multipoten iv. Unipoten
a. Sumber
Sel punca bisa didapat dari berbagai sumber (Reznick et al., 2008), yaitu: Transplantasi sel punca dari sumsum tulang, jaringan adipose, darah tali pusat, cairan ketuban, induced pluripotent, gigi, zigot, fetus.
b. Klasifikasi sel punca
Berdasarkan tipe sel yang dihasilkan, sel punca dapat dikelompokan menjadi:
i. Sel punca hematopoetik
Sel punca hematopoetik dalam perkembangannya dapat menghasilkan sel pembentuk darah. Sel tipe hematopoetik merupakan tipe sel punca yang sejak lama telah digunakan dalam terapi keganasan darah (leukemia). Strategi terapi ini memungkinkan dilakukannya kemoterapi dosis tinggi yang dapat mengeliminasi sel abnormal (ablasi) pada penderita keganasan. Populasi sel yang tereliminasi oleh kemoterapi akan digantikan oleh sel punca hematopoetik yang ditransplantasikan (Hakim et al., 2008).
Sel punca hematopoetik memiliki molekul yang khas pada permukaan selnya, yaitu molekul glikoprotein CD34. Molekul penanda ini dapat digunakan sebagai sarana untuk menghitung jumlah sel punca hematopoetik yang berhasil diisolasi dari berbagai sumber di atas. Bahkan dalam penggunaannya dalam terapi keganasan, telah ditentukan jumlah CD34 yang direkomendasikan oleh ASBMT (American Society for Blood and Marrow Transplantation) dan ISCT (International Society for Cellular Therapy) engraftment dari sel yang ditransplantasikan diperlukan setidaknya 5 x 106 CD34+ cells/kg berat badan.
CD34+ (CD34 renumeration) menjadi mutlak diperlukan untuk transplantasi jenis ini (Hakim et al., 2008).
ii. Sel Punca Mesenkimal
Sel punca mesenkimal (MSC) adalah sel progenitor multipoten dengan potensi multilineage untuk berdiferensiasi menjadi jenis sel asal mesoderm, seperti adiposit, osteosit, dan kondrosit. Dikembangkan kriteria minimal untuk mendefinisikan secara universal MSC manusia. Kriteria meliputi plastisitas, mekspresikan antigen permukaan spesifik (CD73+ CD90+ CD105+ CD34- CD45- CD11b- CD14- CD19- CD79a- HLA-DR-) serta potensial diferensial multipoten dalam kondisi diferensiasi vitro yang standar (Kim dan Cho, 2013). Tidak seperti sel induk hematopoietik, imunogenisitas MSC tanpa MHC-II dan menstimulasi ekspresi molekul. MSC berada di sumsum tulang, otot rangka, jaringan adiposa, jaringan ikat, tali pusar darah, dan produk plasenta (Yan et al., 2013).
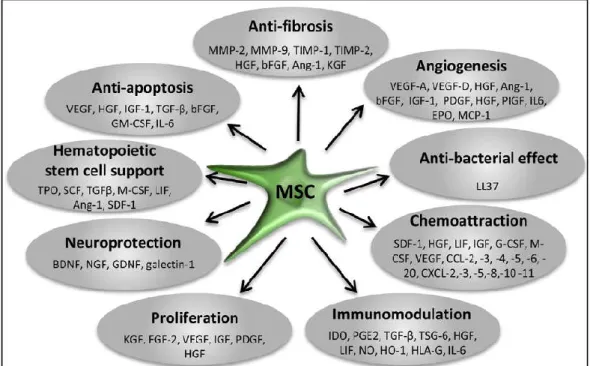
Gambar 6. Peran faktor parakrin yang disekresikan MSC (Maumus et al, 2013)
Keunggulan sel punca mesenkimal dibandingkan dengan sel punca lainnya sel punca mesenkimal bersifat hipoimmunogenik karena mengekspresikan secara rendah major histocompatibility (MHC) kelas I dan tidak mengekspresikan MHC kelas II atau co-stimulasi molekul (CD40, CD40L, CD80 atau CD86) (Flavio dan Figueroa, 2011). Karena efek pada sel imunokompeten tidak dibatasi MHC, penggunaan sel punca mesenkimal alogenik secara luas digunakan tanpa perlu mencocokkannya dengan Host Leukocyte Antigen (HLAs).
Faktor larutan utama yang disekresi oleh sel punca mesenkimal : a. Insulin-Like Growth Factor 1 (lGF-1)
b. Hepatocyte Grcwth Factor (HGF)
c. Vascular Endhotelial Growth Factor (VEGF) d. Stromal Derived Factor I (SDF-1)
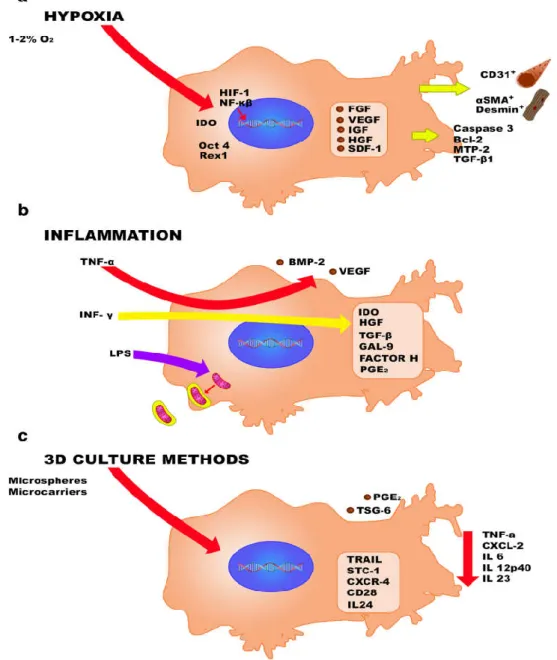
Kultur sel punca mesenkimal dilakukan dengan stimulasi tertentu (gambar 6), misalnya hipoksia. Hipoksia mengaktifkan HIF dan NF-kappa β; meningkatkan ekspresi beberapa faktor pertumbuhan, juga menginduksi kegiatan IDO dan meningkatkan stemness (Okt-4 dan Rex-1). Demikian pula, hipoksia pra-AC MSC, mendukung aktivasi caspase 3, Bcl-2, MTP-2, TGF- β1 pada sel target meningkatkan resistensi apoptosis; meningkatkan kapasitas regeneratif dari otot dan sel-sel endotel. b) inflamasi yang disebabkan oleh INF-γ meningkatkan ekspresi molekul anti-inflamasi dan regeneratif
dan, melalui TNF-α meningkatkan produksi VEGF dan BMP-2 yang mendukung pembentukan pembuluh darah baru dan osteoblas. Sel punca mesenkimal yang terkena LPS mampu merangkum mitokondria dan memberikan mereka untuk sel-sel lain. c) metode kultur 3D seperti microcarriers atau spheroids menginduksi produksi TSG-6 dan meningkatkan sekresi PGE2. Selain itu, itu juga mendukung sekresi molekul antiapoptotik dan antikanker. Selanjutnya, MSC diperoleh dari konfigurasi 3D, menghambat ekspresi molekul terkait inflamasi dan kanker pada sel target (Madrical et al., 2014).
Gambar 7. Peran hipoksia, inflamasi, dan kultur 3D pada MSC (Madrigal et al., 2014)
8. Penelitian Yang Relevan
Sel mesenkimal yang berasal dari tali pusat (UC-MSC) juga menunjukkan efek terapeutik yang signifikan pada hewan percobaan model lupus. Untuk mengetahui efektivitas UC-MSC pada manusia, Wu et al. (2010) meneliti 16 pasien SLE refrakter yang menerima transplantasi UC-MSC. Hasil dari penelitian ini menunjukkan bahwa UC-MSCs sukses dalam mengurangi keparahan penyakit SLE dengan meningkatnya skor aktivitas penyakit. Pasien juga memiliki perbaikan yang signifikan titer serum ANA dan anti-dsDNA, meningkatnya serum albumin, dan meningkatnya C3. Selain perbaikan klinis penyakit, pasien mengalami peningkatan Tregs perifer bersama dengan pemulihan keseimbangan sitokin Th1/Th2 (Collin dan Gilkesson, 2013).
Terapi sel punca mesenkimal dari uji klinis terapi sel punca mesenkimal pada manusia adalah terapi sel punca mesenkimal pada SLE berat yang refrakter memberikan hasil yang cukup menggembirakan (Sun et al., 2010; Liang et al., 2010). Telah dilaporkan pula bahwa terapi sel punca mesenkimal berhasil mengurangi gangguan ginjal pada SLE, walaupun penelitian ini menggunakan metode yang belum terkontrol baik (Lee et al., 2010). Hasil-hasil tersebut menunjukkan bahwa perlu penelitian lebih lanjut tentang sel punca mesenkimal baik tentang mekanisme aksi dan pengembangan protokol klinik yang aman (Singer dan Caplan, 2011).
Sun (2009) memberi terapi 4 pasien dengan SLE dan lupus nefritis yang tidak respon dengan siklofosfamid dan prednison oral (≥ 20 mg/day) .The Disease Activity Index (SLEDAI) meningkat secara bermakna pada bulan ke 1, 6, dan ke 12, dan juga protein urin. Sel limfosit CD4+ Foxp3 (T regulatory) meningkat pada bulan ke 3, dan dosis terapi diturunkan. Tidak ada komplikasi dalam 12-18 bulan. Hasil penelitian ini mendorong penelitian lagi dengan sampel lebih besar yaitu 15 pasien SLE refrakter termasuk 4 kasus yang dilaporkan terdahulu. Pada penelitian ini sepertiga pasien sebelumnya gagal terapi dengan mycophenolatemophetil (1-2 gr/day x 3 bulan) (Liang et al., 2010).
Manifestasi klinis selain ginjal meliputi artritis, penyakit kulit berat, serositis, dan hematologi daran sitopenia yang tidak responsif. Pasien mendapatkan infus sel punca mesenkimal alogenik dari sumsum tulang 3-5 anggota keluarga sehat tanpa pencocokan HLA. Manifestasi klinis dan serologis meningkat secara dramatis. Follow up pasien selama 17.2 (3-36) bulan tanpa adanya efek buruk atau kematian. Proteinuria 24 jam menurun secara drastis adalam waktu 1 minggu setelah terapi sel punca mesenkimal, anti dsDNA menurun dalam 1 dan 3 bulan setelah terapi. Treg dimana pada SLE aktif
menurun baik kuantitatif atau kualitatif (La Cava et al., 2008) kembali normal dalam waktu 1 minggu dengan menghitung persentase sel limfosit CD4+ Foxp3+ pada darah tepi.
Penelitian kedua dari Nanjing China dengan menggunaan sel punca mesenkimal dari darah tali pusat pada 15 pasien lupus berat (Sun et al., 2010). Lima pasien dari 15 kasus ginjal dengan gambaran histologis proliferatif nefritis dan 11 pasien mendapatkan infus siklofosfamid. Tali pusat untuk kultur sel punca mesenkimal berasal dari kelahiran normal, dikultur dalam serum bovine 10%. Follow up pasien hanya 8,25 bulan akan tetapi terjadi peningkatan yang bermakna pada skor SLEDAI, albumin serum, proteinuria urin 24 jam, creatinin, complement, dan antibodi anti dsDNA. Penurunan IL-4 dengan peningkatan yang tidak bermakna pada IFN γ menunjukkan perbaikan dari keseimbangan Th2 (Chang et al., 2011) penelitian penelitian tersebut menunjukkan bahwa sel punca mesenkimal harus dipelajari lebih lanjut sebagai terapi lupus.
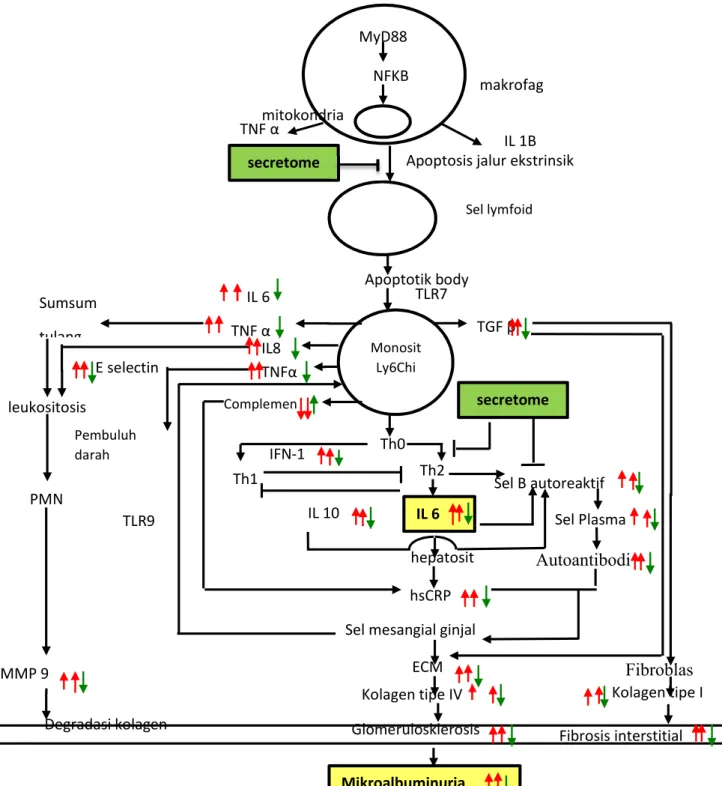
B. Kerangka Pikir
TLR9 pristan
Gambar 8. Kerangka Pikir Penelitian
Keterangan :
MyD88
NFKB
Apoptosis jalur ekstrinsik
Sel lymfoid makrofag Monosit Ly6Chi IL 1B TNF α Apoptotik body TLR7 IL 6 hepatosit Th1 Th0 Th2 IFN-1 IL 10 hsCRP Sel B autoreaktif Sel Plasma Autoantibodi
Sel mesangial ginjal
Kolagen tipe IV Mikroalbuminuria TLR9 mitokondria Complemen IL8 8 Kolagen tipe I MMP 9
Degradasi kolagen Glomerulosklerosis
Fibrosis interstitial Sumsum tulang leukositosis IL 6 TNF α TNFα PMN E selectin Pembuluh darah Fibroblas TGF β secretome ECM secretome
1. : menghambat 5. : menurunkan 2. : mengaktivasi 6. : variabel tergantug
3. : meningkatkan
4. : variabel bebas
Penjelasan (Narasi) Kerangka Konseptual:
Pristan (2,6,10,14-Tetramethylpentadecane) adalah alkana isoprenoid yang awalnya diisolasi dari minyak hati ikan hiu, kini sintesis pristan diproduksi untuk menggantikannya dalam penelitian. Pristan digunakan untuk menginduksi plasmasitoma pada mencit model multiple myeloma, nefritis lupus, ataupun penyakit-penyakit autoimun (Reeves et al., 2009), dan rheumatoid arthritis (Hoffmann et al., 2010). Untuk membuat mencit model lupus, bisa digunakan dengan injeksi tunggal 0,5 ml pristan intraperitoneal (Chowdhary et al., 2007).
Mekanisme utama pristan dalam menginduksi autoimunitas adalah dengan adanya produksi interferon 1, yaitu berupa IFN α dan IFN β. IFN 1 akan berikatan dengan reseptornya IFNAR dan menyebabkan aktifasi respon imun innate dan adaptif (Reeves et al., 2009). Adanya inflamasi pada peritoneum akan menyebabkan pengeluaran dari monosit imatur Ly6C dari sumsum tulang. Monosit imatur Ly6C inilah yang berperan memproduksi IFN 1 melalui berbagai mekanisme yang komplek. Monosit ini akan berubah menjadi makrofag di jaringan. Adanya sisa apoptosis dari sel akan dikenali oleh TLR7, suatu sensor untuk unmethylated CpG DNA yang dapat mengenali asam nukleat (Reeves et al., 2009). Rangsangan endosomal TLR 7 selanjutnya akan merangsang molekul adaptor MyD88 (Kawai dan Akira, 2007). Langkah selanjutnya melibatkan kinase IRF (interferon regulatory factor) 7. Sinyal dari IRF 7 ini akan menyebabkan transkripsi gen IFN 1 dan terjadi produksi IFN 1 yaitu IFN α dan IFN β (Reeves et al., 2009).
Interferon α akan mengaktifkan dari sel T autoreaktif, sel dendritik imatur, dan sel T CD8 sitotoksik. Selanjutnya akan mengaktifkan dari sel limfosit B autoreaktif, terjadi proliferasi dari sel B dan sel plasma. Terjadi peningkatan produksi IG G, yaitu anti ds DNA. Adanya auto antigen, antibodi ds DNA bersama dengan sistem komplemen dan beberapa faktor lainnya akan menimbulkan kompleks imun (Banchereau dan Pasqual, 2006).
Injeksi pristan intraperitoneal juga akan menyebabkan tersekresinya autoantibodi, selanjutnya akan terbentuk kompleks antigen-autoantibodi. Kompleks antigen-autoantibodi yang berada di sirkulasi akhirnya akan terdisposisi pada sel target, termasuk sel mesangial, podosit, sel tubulus dan sel endotel di glomerulus. Kompleks ini akan menyebabkan terjadinya
glomerulosklerosis dan fibrosis interstisial pada ginjal, selanjutnya menyebabkan kerusakan pada ginjal dan terjadilah mikroalbuminuria. Disamping itu, terjadinya disfungsi endotel pada pembuluh darah, juga akan terjadi disfungsi endotel kapiler glomerulus yang akan mengurangi negatifitas sehingga terjadi mikroalbuminuria.
TGF 1 mempunyai reseptor pada sel target, yaitu sel mesangial, dan sel mesangial yang dirangsang TGF 1 ini akan menghasilkan pembentukan Ekstra Celluler Matrix (ECM), misalnya kolagen, laminin, fibronektin, elastin, proteoglikan dan lainnya. Dalam hal ini yang paling berperan adalah kolagen tipe iv yang mengakibatkan glomerulosklerosis (Purwanto, 2010).
Peran dominan IL-6 pada patogenesis SLE adalah untuk mempercepat produksi autoantibodi dengan mempromosikan proliferasi sel B autoreaktif. (Yap dan Lei, 2010), dimana kadar abnormalnya ditemukan pada tikus model lupus maupun pada serum dan jaringan lokal pada pasien lupus. Kadar IL-6 meningkat secara signifikan dan berkorelasi dengan aktivitas penyakit dan kadar anti dsDNA (Su et al, 2012).
Reaksi inflamasi akibat bahan-bahan kimiawi (pristan) dan fragmentasi sel ataupun molekul damage-associated molecular pattern (DAMP) akibat proses apoptosis dapat menimbulkan aktivasi makrofag, selanjutnya NfB menjadi lebih aktif sehingga akan mengekspresikan sitokin-sitokin pro-inflamasi antara lain TNF-, IL-1 maupun IL-6. TNF- bersifat proteolitik, akan merusak glikoprotein sehingga muatan negatip permukaan podosit menjadi berkurang. Keadaan ini akan menyebabkan daya tolak-menolak antara podosit dan albumin berkurang, akhirnya albumin mudah menembus membran filtrasi dan akan terjadi mikroalbuminuria (Purwanto, 2010).
Media sekresi sel punca mesenkimal mempunyai efek imunomodulasi. Pada prekondisi hipoksia akan menyebabkan sekresi dari VEGF, HGF 1, IGF -1, SDF-1. (Madrigal et al, 2014) VEGF akan meningkatkan angiogenesis dan mencegah apoptosis endotel (Oyama, 1998) sehingga akan mengurangi derajat vaskulitis. HGF berperan dalam menurunkan aktifitas autoreaktif sel limfosit B (Kuroiwa et al., 2006), sehingga produksi antibodi akan menurun. Selain itu HGF juga akan menurunkan apoptosis endotel (Nakagami et al., 2004) sehingga akan menurunkan vaskulitis. IGF 1 berperan dalam menurunkan apoptosis endotel (Singer dan Caplan, 2011) dan meningkatkan toleransi dari sel APC (Fernandez et al, 2004). Sedangkan SDF akan meningkatkan apoptosis sel T autoreaktif dan menurunkan sel B autoreaktif (Biajoux et al., 2012). Sehingga dengan pemberian media sekresi sel punca mesenkimal ini
akan terjadi perbaikan dari kerusakan organ sasaran, yaitu dan perbaikan dari lupus nefritis yang ditandai dari menurunnya ekspresi IL-6 dan menurunnya kadar mikroalbuminuria.
C. Hipotesis Penelitian
1. Ada pengaruh pemberian secretome sel punca mesenkimal terhadap ekspresi IL-6 pada mencit model lupus dengan induksi pristan.
2. Ada pengaruh pemberian secretome sel punca mesenkimal terhadap kadar mikroalbuminuria pada mencit model lupus dengan induksi pristan.