OPTIMALISASI PENANDAAN Gd-DOTA-PAMAM
SEBAGAI AGEN PENGONTRAS
MAGNETIC RESONANCE IMAGING (MRI)
SKRIPSI
PUTRI LUSIANA
PROGRAM STUDI KIMIA
FAKULTAS SAINS DAN TEKNOLOGI
UNIVERSITAS ISLAM NEGERI SYARIF HIDAYATULLAH
JAKARTA
OPTIMALISASI PENANDAAN Gd-DOTA-PAMAM
SEBAGAI AGEN PENGONTRAS
MAGNETIC RESONANCE IMAGING (MRI)
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains Program Studi Kimia
Fakultas Sains dan Teknologi
Universitas Islam Negeri Syarif Hidayatullah Jakarta
Oleh: PUTRI LUSIANA
11150960000043
PROGRAM STUDI KIMIA
FAKULTAS SAINS DAN TEKNOLOGI
UNIVERSITAS ISLAM NEGERI SYARIF HIDAYATULLAH
JAKARTA
OPTIMALISASI PENANDAAN Gd-DOTA-PAMAM SEBAGAI AGEN PENGONTRAS
MAGNETIC RESONANCE IMAGING (MRI)
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains Program Studi Kimia
Fakultas Sains dan Teknologi
Universitas Islam Negeri Syarif Hidayatullah Jakarta Oleh:
PUTRI LUSIANA 11150960000043
Menyetujui, Pembimbing I
Nanda Saridewi, M.Si NIP. 19841021 200912 2 004
Pembimbing II
Titis Sekar Humani, M.Si NIP. 19821207 200801 2 011
Mengetahui,
Ketua Program Studi Kimia
Dr. La Ode Sumarlin, M.Si NIP. 19750918 200801 1 007
PENGESAHAN UJIAN SKRIPSI
Skripsi yang berjudul Optimalisasi Penandaan Gd-DOTA-PAMAM sebagai Agen Pengontras Magnetic Resonance Imaging (MRI) telah diuji dan dinyatakan LULUS pada Sidang Munaqosah Fakultas Sains dan Teknologi Universitas Islam Negeri Syarif Hidayatullah Jakarta pada 21 Juli 2020. Skripsi ini telah diterima sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains Program Studi Kimia.
Menyetujui,
Penguji I Penguji II
Dr. Sri Yadial Chalid, M.Si Dr. Siti Nurbayti, M.Si NIP. 19680313 200312 2 001 NIP. 19740721 200212 2 002
Pembimbing I Pembimbing II
Nanda Saridewi, M.Si Titis Sekar Humani, M.Si
NIP. 19841021 200912 2 004 NIP. 19821207 200801 2 011 Mengetahui,
Dekan Fakultas Sains dan Teknologi Ketua Program Studi Kimia
Prof. Dr. Lily Surayya Eka Putri, M.Env.Stud Dr. La Ode Sumarlin, M.Si NIP. 19690404 200501 2 005 NIP.19750918 200801 1 007
PERNYATAAN
DENGAN INI SAYA MENYATAKAN BAHWA SKRIPSI INI ADALAH HASIL KARYA SAYA SENDIRI DAN BELUM PERNAH DIAJUKAN SEBAGAI SKRIPSI ATAU KARYA ILMIAH PADA PERGURUAN TINGGI ATAU LEMBAGA MANAPUN.
Jakarta, 21 Juli 2020
Putri Lusiana NIM. 11150960000043
ABSTRAK
PUTRI LUSIANA. Optimalisasi Penandaan Gd-DOTA-PAMAM sebagai Agen Pengontras Magnetic Resonance Imaging (MRI). Dibimbing oleh NANDA SARIDEWI dan TITIS SEKAR HUMANI.
Agen pengontras digunakan untuk memperjelas gambaran dari organ yang sulit dibedakan melalui teknik pencitraan Magnetic Resonance Imaging (MRI). Agen pengontras yang umum digunakan adalah Gadolinium (III) 1,4,7,10-Tetraazacyclododecane-1,4,7,10-Tetraacetate Acid (Gd-DOTA) atau DOTAREM. Penelitian ini bertujuan untuk optimalisasi penandaan agen pengontras Gd-DOTA-PAMAM beserta karakterisasinya. Sintesis konjugat DOTA-Gd-DOTA-PAMAM G3 dilakukan dengan mengkonjugasikan ester-NHS-DOTA dengan PAMAM G3 dengan perbandingan mol DOTA:PAMAM = 96:1. Hasil sintesis konjugat DOTA PAMAM G3 dimurnikan menggunakan kolom PD-10 dan dilakukan karakterisasi dengan uji kolorimetri menggunakan dye protein Commasie Brilliant Blue G-25 dan terjadi perubahan warna dari coklat menjadi biru. Konjugat DOTA-PAMAM G3 kemudian dilakukan penandaan dengan 153Gd dan diukur persentase panandaan menggunakan Instant Thin Layer Chromatography-Silica Gel (ITLC-SG) sebagai fase diam, dan larutan salin sebagai fase gerak. Penandaan dilakukan dengan memvariasikan waktu inkubasi yaitu 1,2,3,4 dan 5 jam dengan pH 5,5 dan suhu 95 °C. Dari pengukuran persentase penandaan menggunakan TLC scanner, didapatkan persentase penandaan tertinggi sebesar 58±19,3%, yaitu pada suhu penandaan 95 °C dan waktu inkubasi 5 jam.
ABSTRACT
PUTRI LUSIANA. Optimization Labelling of Gd-DOTA-PAMAM as a Contrast Agent Magnetic Resonance Imaging (MRI). Supervised by NANDA SARIDEWI and TITIS SEKAR HUMANI.
Contrast agents are used to clarify images of organs that are difficult to distinguish through magnetic resonance imaging (MRI) imaging techniques. The contrast agent commonly used is Gadolinium (III) 1,4,7,10-Tetraazacyclododecane-1,4,7,10-Tetraacetate Acid (Gd-DOTA) or DOTAREM. This study aims to optimize the marking of Gd-DOTA-PAMAM contrast agents and their characteristics. Synthesis of the DOTA-PAMAM G3 conjugate was carried out by conjugating ester-NHS-DOTA with PAMAM G3 with a mole ratio of ester-NHS-DOTA: PAMAM = 96: 1. The synthesis of the DOTA PAMAM G3 conjugate was purified using a PD-10 column and characterization was done by colorimetric testing using dye protein Commassie Brilliant Blue G-25 and a change in color from brown to blue. The DOTA-PAMAM G3 conjugate was then labelled with 153Gd and measured percentages of measurements using Instant Thin Layer Chromatography-Silica Gel (ITLC-SG) as the stationary phase, and saline solution as the mobile phase. The labelling is done by varying the incubation time of 1,2,3,4 and 5 hours with a pH of 5.5 and a temperature of 95 ° C. From the measurement of the percentage of markings using a TLC scanner, the highest percentage of labelling was 58 ± 19.3%, which was at a temperature of 95 ° C and an incubation time of 5 hours.
viii
KATA PENGANTAR
Assalamu’alaikum Warahmatullah Wabarakatuh
Puji dan syukur penulis haturkan ke hadirat Allah SWT, atas segala nikmat-Nya sehingga penulis mampu menyelesaikan skripsi. Shalawat serta salam semoga selalu dilimpahkan kepada junjungan kita Nabi Muhammad SAW. Skripsi ini berjudul Optimalisasi Penandaan Gd-DOTA-PAMAM sebagai Agen Pengontras Magnetic Resonance Imaging (MRI). Ucapan terima kasih penulis sampaikan kepada semua pihak yang telah membantu dan mendukung sehingga skripsi ini dapat diselesaikan.
1. Nanda Sari Dewi, M.Si selaku pembimbing I yang telah memberikan ilmu pengetahuan, bimbingan, nasihat serta arahan dalam penulisan skripsi ini. 2. Titis Sekar Humani, M.Si, selaku pembimbing II yang telah senantiasa
meluangkan waktunya untuk berdiskusi dan memberikan bimbingan dalam menyelesaikan penelitian.
3. Dr. Sri Yadial Chalid, M.Si dan Dr. Siti Nurbayti, M.Si selaku penguji I dan II yang telah memberi kritik dan saran yang bermanfaat kepada penulis dari tahap awal sampai tahap akhir penyusunan.
4. Dr. La Ode Sumarlin, M.Si selaku Ketua Program Studi Kimia Fakultas Sains dan Teknologi UIN Syarif Hidayatullah Jakarta.
5. Prof. Dr. Lily Surayya Eka Putri, M.Env.Stud selaku Dekan Fakultas Sains dan Teknologi Universitas Islam Negeri Syarif Hidayatullah Jakarta.
6. Bapak dan Ibu dosen Program Studi Kimia Fakultas Sains dan Teknologi UIN Syarif Hidayatullah Jakarta.
ix
7. Pusat Teknologi Radioisotop dan Radiofarmaka, BATAN Serpong yang telah menyediakan bahan dan fasilitas untuk penelitian ini.
8. Orang tua yang selalu memberikan doa, dukungan materi maupun moril selama berlangsungnya penulisan skripsi.
9. Teman-teman kimia 2015 yang telah berjuang bersama selama 4 tahun. Penulis menyadari sepenuhnya bahwa skripsi ini masih terdapat kekurangan. Semoga skripsi ini dapat bermanfaat khususnya bagi penulis dan para pembaca pada umumnya.
Jakarta, 21 Juli 2020
x DAFTAR ISI
Halaman
KATA PENGANTAR ... viii
DAFTAR ISI ... x
DAFTAR TABEL ... xii
DAFTAR GAMBAR ... xiii
DAFTAR LAMPIRAN ... xiv
BAB IPENDAHULUAN ... 1 1.1 Latar Belakang ... 1 1.2 Rumusan Masalah ... 4 1.3 Hipotesis ... 4 1.4 Tujuan Penelitian ... 4 1.5 Manfaat Penelitian ... 5
BAB IITINJAUAN PUSTAKA ... 6
2.1 Magnetic Resonance Imaging (MRI) ... 6
2.2 Agen Pengontras ... 7
2.3 Gadolinium ... 9
2.4 Ester-NHS-DOTA ... 11
2.5 Gadolinium-based Contrast Agents (GdCA) ... 14
2.6 Dendrimer Poliamidoamin (PAMAM) ... 16
2.7 Kolom Desalting PD-10 ... 20
2.8 Kromatografi Lapis Tipis (KLT) ... 21
2.9 Fourier Transfrom Infra-Red (FTIR) ... 24
BAB IIIMETODE PENELITIAN ... 26
3.1 Waktu dan Tempat ... 26
3.2 Alat dan Bahan ... 26
3.2.1 Alat ... 26
3.2.2 Bahan ... 26
xi
3.4.1 Konjugasi DOTA-PAMAM G3 ... 28
3.4.2 Uji Kemurnian Konjugat DOTA-PAMAM G3 ... 28
3.4.2.1 Preparasi Kolom PD-10 ... 28
3.4.2.2 Pemurnian DOTA-PAMAM G3 dengan Kolom PD-10 ... 28
3.4.3 Karakterisasi Konjugat DOTA-PAMAM G3 ... 29
3.4.4 Penandaan DOTA-PAMAM G3 dengan 153Gd. ... 29
BAB IVHASIL DAN PEMBAHASAN... 30
4.1 Sintesis Konjugat DOTA PAMAM ... 30
4.2 Pemurnian Konjugat DOTA PAMAM... 32
4.3 Karakteristik DOTA-PAMAM G3 Menggunakan FTIR ... 34
4.4 Penandaan DOTA-PAMAM dengan 153Gd ... 36
4.4.1 Optimalisasi penandaan DOTA-PAMAM dengan 153Gd ... 36
4.4.2 Persentase penandaan 153Gd-DOTA-PAMAM ... 37
BAB VPENUTUP ... 41
5.1 Simpulan ... 41
5.2 Saran ... 41
DAFTAR PUSTAKA ... 42
xii
DAFTAR TABEL
Halaman
Tabel 1. Radiocontrast Agents ...8
Tabel 2. Karakteristik gadolinium ...9
Tabel 3. Isotop alami gadolinium dan produk aktivasi (n, γ) ...10
Tabel 4. Agen pengontras berbasis gadolinium ...15
Tabel 5. Karakteristik fisika dendrimer PAMAM G3 ...18
Tabel 6. Karakteristik kolom PD-10 ...20
Tabel 7. Panjang gelombang dan gugus fungsi senyawa hasil uji FTIR ...35
xiii
DAFTAR GAMBAR
Halaman
Gambar 1. Sistem MRI ...6
Gambar 2. DOTA ...11
Gambar 3. Ester-NHS-DOTA ...12
Gambar 4. Skema reaksi NHS ester untuk konjugasi kimia ke amina primer ...13
Gambar 5. Gadolinium digunakan pada pemindaian MRI ...14
Gambar 6. Gd-DOTA ...15
Gambar 7. Struktur dendrimer ...16
Gambar 8. Struktur percabangan dendrimer generasi 0-4 ...17
Gambar 9. Dendrimer PAMAM generasi 3 ...19
Gambar 10. Pelat ITLC sebelum dan sesudah pengembangan ...22
Gambar 11. Proses analisis sampel ...24
Gambar 12. Diagram alur penelitian ...27
Gambar 13. Konjugasi DOTA-PAMAM G3 ...31
Gambar 14. Hasil uji kolorimetri dari pemurnian fraksi DOTA-PAMAM G3...32
Gambar 15. Reaksi kolorimetri dengan CBB G-250 ...33
Gambar 16. Spektrum FTIR 153Gd-DOTA-PAMAM G3 ...34
Gambar 17. Penandaan DOTA-PAMAM dengan 153Gd ...36
Gambar 18. Radiokromatogram kontrol; GdCl3 dan Gd-EDTA. ...38
Gambar 19. Radiokromatogram hasil penandaan 5 jam. ...39
xiv
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Perhitungan Bufer Fosfat 0,1 M pH 7,2 100 mL ...49
Lampiran 2. Perhitungan Bufer Fosfat 0,05 M pH 7,2 + EDTA 5 mM 1 L ...50
Lampiran 3. Perhitungan Bufer Fosfat 0,01 M pH 7,4 1 L ...51
Lampiran 4. Perhitungan BSA 5% (w/v) 20 mL...52
Lampiran 5. Perhitungan buffer amonium astetat pH 5,5 1M 500 mL...52
Lampiran 6. Perhitungan EDTA 0,05M 10 mL ...52
Lampiran 7. Perbandingan mol DOTA-PAMAM G3 ...52
Lampiran 8. Penandaan konjugat DOTA-PAMAM dengan GdCl3... 52
Lampiran 9. Radiokromatogram 1 jam ...53
Lampiran 10. Radiokromatogram 2 jam ...54
Lampiran 11. Radiokromatogram 3 jam ...55
1 BAB I PENDAHULUAN
1.1 Latar Belakang
Magnetic Resonance Imaging (MRI) telah menjadi salah satu teknik yang dapat digunakan dalam diagnosis medis untuk melihat organ dan struktur di dalam tubuh untuk mendiagnosis berbagai kondisi, dari ligamen yang sobek hingga tumor. Penggunaan MRI dalam bidang medis biasanya menggunakan senyawa untuk meningkatkan kontras visual yang disebut agen pengontras (Bushong & Clarke, 2013). Agen pengontras digunakan untuk meningkatkan kontras visual antara jaringan tubuh normal dan tidak normal. Agen ini juga dapat menunjukkan kerusakan organ-organ terutama pada jaringan lunak sistem saraf pusat, hati, sistem pencernaan, sistem limfatik, payudara, sistem kardiovaskular dan paru (Thomsen, 2006).
Agen pengontras yang sering digunakan pada MRI adalah Gadolinium (Gd). Gd bersifat paramagnetik yang merupakan syarat utama sebagai agen pengontras (Seiler et al., 1994). Agen pengontras yang paling luas digunakan dalam teknik pencitraan molekul modern adalah Gadolinium diethylenetriaminepentaacetic acid (Gd-DTPA) dan Gadolinium (III) 1,4,7,10-Tetraazacyclododecane-1,4,7,10-Tetraacetate Acid (Gd-DOTA) (Reimer et al., 2010).
Ion-ion Gadolinium memiliki toksisitas yang sangat tinggi. Toksisitas gadolinium harus diminimalisasi dengan cara pembuatan kompleksnya dengan ligan seperti DOTA dan DTPA (Laurent et al., 2017). Kompleks Gd-DOTA memiliki stabilitas kimia yang tinggi dan toksisitas yang rendah dibandingkan Gd-DTPA (Laurent et al., 2017). Senyawa kompleks gadolinium dengan ligan
2 DOTA/DTPA dapat digabungkan dengan dendrimer (Svenson & Tomalia, 2005). Penggabungan kompleks gadolinium dengan dendrimer dapat menghasilkan agen pengontras yang spesifik pada tubuh manusia (Brechbiel et al., 2005).
Dendrimer merupakan polimer bercabang yang berstruktur unik tiga dimensi, memiliki gugus-gugus fungsi yang dapat dimodifikasi pada permukaannya dan dapat membawa bahan aktif secara selektif langsung ke sasaran dan tidak menyebar ke organ atau jaringan lain yang tidak diinginkan (Tomalia et al., 2012). Dendrimer Poliamidoamin Generasi 3 (PAMAM G3) dapat mengikat agen pengkelat dalam jumlah yang banyak, juga bisa dikonjugasikan dengan molekul antibodi (Kobayashi, 2000).
Allah SWT berfirman dalam Al-Qur’an Surat Al-Hadiid ayat 25.
َموُقَي ِل َنا َزيِمْلا َو َباَتِكْلا ُمُهَع َم اَن ْلَزْنَأ َو ِتاَنِ يَبْلاِب اَنَلُسُر اَنْلَس ْرَأ ْدَقَل
َمَلْعَيِل َو ِساَّنلِل ُعِفاَنَم َو ٌديِدَش ٌسْأ َب ِهيِف َديِدَحْلا اَنْل َزْنَأ َو ۖ ِطْسِقْلاِب ُساَّنلا
ٌزي ِزَع ٌّيِوَق َ َّاللَّ َّنِإ ۚ ِبْيَغْلاِب ُهَلُس ُر َو ُهُرُصْنَي ْنَم ُ َّاللَّ
Artinya: Sesungguhnya Kami telah mengutus rasul-rasul Kami dengan membawa bukti-bukti yang nyata dan telah Kami turunkan bersama mereka al-Kitab dan neraca (keadilan) supaya manusia dapat melaksanakan keadilan. Dan Kami ciptakan/turunkan besi yang padanya terdapat kekuatan yang hebat dan berbagai manfaat bagi manusia (supaya mereka mempergunakan besi itu), dan supaya Allah mengetahui siapa yang menolong (agama)-Nya dan rasul-rasul-Nya padahal Allah
tidak dilihatnya. Sesungguhnya Allah Mahakuat lagi Maha Perkasa.". [Surat
Al-Hadiid ayat 25]
Dalam ayat itu, Al-Quran secara jelas mengungkapkan tentang penciptaan besi, kekuatan besi dan manfaat besi bagi manusia. Seiring dengan perkembangan waktu, pengetahuan manusia bertambah. Ilmuwan seperti Profesor Armstrong dari NASA atau Mohamed Asadi berpandangan bahwa "memang besi diturunkan dari langit". Sains memberikan informasi kepada kita bahwa besi termasuk logam berat tidak dapat dihasilkan oleh bumi sendiri. Besi ini menunjukkan keistimewaannya
3 dengan berbagai cara, di antaranya adalah besi diturunkan dari langit melalui meteorit pada awal terbentuknya bumi, miliaran tahun yang lalu. Besi diketahui mempunyai kekuatan yang dahsyat: inti besi dan nikel membentuk perisai medan magnet bumi dengan energi yang luar biasa untuk menahan solar flares dan badai magnetik angkasa. Besi memiliki medan magnet yang tinggi, begitu juga dengan penelitian ini menggunakan logam Gadolinium yang memiliki medan magnet tinggi (paramagnetik) yang menjadi syarat utama sebagai agen pengontras dalam MRI.
Penelitian sebelumnya telah menunjukkan bahwa kombinasi Gd-DOTA dengan dendrimer PAMAM (Poliamidoamin) lebih menguntungkan seperti kemudahan karakterisasi, stabilitas dan kelarutan (Nwe et al., 2011). Rahmania et al., 2015 telah menemukan bahwa sintesis radiogadolinium(III)-DOTA-PAMAM G3-trastuzumab menghasilkan persentase penandaan tertinggi pada suhu 37 ⁰C dengan lamanya waktu inkubasi 3 jam sebesar 50,8% dengan menggunakan rasio molar ester NHS DOTA ke PAMAM G3 adalah 96:1 atau tiga kali lipat dari jumlah amina primer dalam PAMAM G3 untuk mendapatkan konjugat DOTA PAMAM G3 yang optimal.
Sintesis (177Lu-DOTA)
n-PAMAM-[nimotuzumab-F(ab’)2] oleh Humani et al., (2017) didapatkan persentase penandaan sebesar 69.59±1.66% dengan kondisi optimal pada suhu 37 ⁰C, pH 3,5 dan 6 jam. Ghai (2015) bahwa efisiensi penandaan [68Ga] DOTA–PAMAM terbaik pada 96,0% dengan waktu inkubasi 30 menit sambil menjaga suhu reaksi konstan antara 90-100 °C.
Penelitian ini dilakukan untuk mencari kondisi optimal penandaan 153 Gd-DOTA-PAMAM G3 dengan memvariasikan waktu inkubasi yaitu 1, 2, 3, 4 dan 5 jam dengan suhu 95 ⁰C pada pH 5,5 dengan perbandingan mol
ester-NHS-4 DOTA:PAMAM G3 yaitu 96:1. Konjugasi DOTA-PAMAM G3 menggunakan bufer fosfat pH 7,2, kemudian dimurnikan dengan menggunakan kolom PD-10. Karakterisasi hasil sintesis konjugat DOTA-PAMAM G3 menggunakan FTIR untuk mengonfirmasi adanya senyawa DOTA-PAMAM G3 yang telah terikat 153Gd.
Konjugat DOTA-PAMAM G3 kemudian ditandai dengan radionuklida 153GdCl
3 menggunakan Instant Thin Layer Chromatography – Silica Gel (ITLC-SG) sebagai fase diam dan larutan salin sebagai fase gerak. Persentase penandaan diukur menggunakan TLC scanner.
1.2 Rumusan Masalah
1. Berapa pH, suhu dan waktu inkubasi yang diperlukan untuk mendapatkan hasil penandaan yang optimal?
2. Berapa persentase penandaan 153Gd-DOTA-PAMAM G3 yang optimal?
1.3 Hipotesis
1. Penandaan 153Gd-DOTA-PAMAM G3 yang optimal pada suhu 90-100 ⁰C dan pH 5,5 pada waktu inkubasi lebih dari 3 jam.
2. Persentase penandaan 153Gd-DOTA-PAMAM G3 yang optimal didapatkan sebesar >50%.
1.4 Tujuan Penelitian
1. Menentukan pH, suhu dan waktu inkubasi yang diperlukan untuk penandaan 153Gd-DOTA-PAMAM G3 yang optimal.
5 2. Menentukan persentase penandaan Gd-DOTA-PAMAM G3 sebagai agen
pengontras MRI.
1.5 Manfaat Penelitian
Hasil penelitian ini dapat dijadikan sumber data ilmiah dan memberikan manfaat mengenai 153Gd-DOTA-PAMAM G3 kepada masyarakat, industri radiofarmasi dan pemerintah terkait sebagai agen pengontras pada MRI untuk diagnostik penyakit.
6 BAB II
TINJAUAN PUSTAKA
2.1 Magnetic Resonance Imaging (MRI)
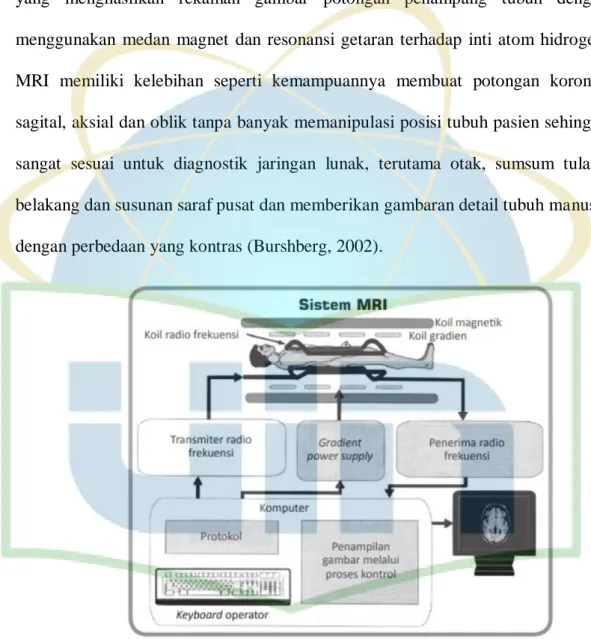
MRI adalah suatu alat kedokteran di bidang pemeriksaan radiologi diagnostik yang menghasilkan rekaman gambar potongan penampang tubuh dengan menggunakan medan magnet dan resonansi getaran terhadap inti atom hidrogen. MRI memiliki kelebihan seperti kemampuannya membuat potongan koronal, sagital, aksial dan oblik tanpa banyak memanipulasi posisi tubuh pasien sehingga sangat sesuai untuk diagnostik jaringan lunak, terutama otak, sumsum tulang belakang dan susunan saraf pusat dan memberikan gambaran detail tubuh manusia dengan perbedaan yang kontras (Burshberg, 2002).
Gambar 1. Sistem MRI (Chakeres & Schmallbrock, 1992).
Gambar 1 menunjukkan sistem MRI menggunakan medan magnet yang kuat, gelombang radio, dan komputer untuk menghasilkan gambar terperinci dari struktur
7 internal tubuh yang lebih jelas, lebih terperinci dan akurat mengkarakterisasi penyakit daripada metode pencitraan lainnya. MRI bersifat noninvasif dan tidak menggunakan radiasi pengion (Radiologyinfo, 2020).
Mekanisme deteksi MRI disebabkan oleh perbedaan kepadatan proton, waktu relaksasi T1 atau T2, dan tingkat difusi air yang berbeda dari proton air, sehingga memberikan kontras anatomi. Gambar dengan resolusi tinggi dapat dihasilkan oleh sinyal dari proton air saja tanpa radiasi pengion (Burshberg, 2002).
2.2 Agen Pengontras
Agen pengontras adalah senyawa yang diberikan pada prosedur MRI untuk meningkatkan dan memperjelas kontras suatu gambaran atau citra dari organ terutama pada jaringan lunak sistem saraf pusat, hati, sistem pencernaan, sistem limfatik, payudara, sistem kardiovaskular dan paru (Bushong & Clarke, 2013).
Agen pengontras pada umumnya ditetapkan berdasarkan sifat magnetik (Briley-sæbø et al., 2004). Material magnetik yang aman digunakan untuk agen pengontras yaitu umumnya pada kompleks-kompleks ion paramagnetik gadolinium(III) dan besi(III), karena memiliki momen magnetik dan relaksifitas proton yang tinggi (Yurt & Kazanci, 2008). Senyawa agen pengontras bekerja dengan mengubah sifat magnetik dari inti hidrogen terdekat (Burshberg, 2002).
MRI berfungsi melalui prinsip yang berbeda dan karenanya menggunakan agen kontras yang berbeda. Agen pengontras harus digunakan sesuai sifat dasar dari organ atau jaringan yang ingin dicitrakan (Mitsumori et al., 2014). Beberapa jenis agen kontras digunakan dalam pencitraan medis dan mereka dapat secara kasar
8 diklasifikasikan berdasarkan modalitas pencitraan yang digunakan seperti yang terlihat pada Tabel 1.
Tabel 1. Radiocontrast Agents Iodinated Contrast Agents (ICAs) Gadolinium-based Contrast Agents (GBCAs) Iron Oxide-based Contrast Agents (SPIONs) Echocardiography Conrast Media Agents Cystografin® Eovist® Ferumoxytol® Optison® Cystografin
Dilute® Magnevist® Feridex IV® Definity®
MD-76R® Multihance® Endorem® Lumason®
Cholografin
Meglumine® Omniscan® Resovist®
Conray® OptiMARK® Sinerem® (AMI-227) Oxilan® ProHance® Ferumoxsil®
Visipaque® Gadavist® Ferucarbotran® Omnipaque® Dotarem® (SHU-555A) Isovoe® Feruglose NC100150 Isovue® Banges® Scanlux® Sumber: D’souza, 2018.
Agen pengontras bukan pewarna yang secara permanen menghitamkan organ internal. Agen pengontras adalah zat yang sementara mengubah cara sinar-x atau alat pencitraan lainnya berinteraksi dengan tubuh. Ketika dimasukkan ke dalam tubuh sebelum pemeriksaan pencitraan, agen pengontras membuat struktur atau jaringan tertentu dalam tubuh tampak berbeda pada gambar daripada jika tidak ada agen pengontras yang diberikan. Agen pengontras membantu membedakan area tubuh tertentu dari jaringan di sekitarnya dengan meningkatkan visibilitas organ tertentu, pembuluh darah atau jaringan, agen pengontras membantu dokter mendiagnosis kondisi medis (Radiologyinfo, 2020).
Agen pengontras yang dimasukkan ke dalam tubuh pasien dapat dilakukan dengan dua cara, yaitu melalui intravena dengan memasukkan ke dalam pembuluh darah atau secara oral. Agen pengontras yang telah masuk ke dalam tubuh
9 kemudian akan terdistribusi secara biologis menuju target jaringan dan akan diekskresikan melalui ginjal dan hati (Aime & Caravan, 2009).
2.3 Gadolinium
Gadolinium merupakan anggota pertengahan dari deret lantanida yang bersifat stabil dalam ion bervalensi +3, dengan adanya 7 elektron tidak berpasangan di kulit f sehingga Gd3+ memiliki momen magnet yang cukup besar (Cotton et al., 2007). Gadolinium juga merupakan salah satu unsur paramagnetik yang menjadi syarat utama sebagai agen pengontras dan mempunyai kemampuan menyerap neutron yang sangat tinggi (4,9x104 barns) (Gunawan, 2006).
Tabel 2. Karakteristik gadolinium
Nomor atom 64
Berat atom 152,92
Titik lebur 1585 K (1312 °C, 2394 °F)
Titik didih 3273 K (3000 °C, 5432 °F)
Isotop 153Gd
Konfigurasi electron [Xe]4f75d16s2
Sifat magnetic Feromagnetik-paramagnetik
Waktu paruh 241,6 hari
Momen Magnetik 0,38 µ
Sumber: IAEA 2003, Greenwood 2012, Lide, 2004.
Gadolinium adalah unsur kimia dengan simbol Gd dan nomor atom 64. Gadolinium adalah logam tanah jarang berwarna putih keperakan, sedikit ulet dan lunak. Logam Gd bereaksi dengan oksigen untuk membentuk lapisan hitam pada suhu tinggi dan larut dalam asam tetapi susah larut dalam air. Gd memiliki titik leleh 1.312 °C (2.394 °F) dan titik didih sekitar 3.000 °C (5.400 °F) seperti ditunjukkan pada Tabel 2. Kelimpahan gadolinium di permukaan bumi diperkirakan sekitar 4,5 hingga 6,4 bagian per juta. Beberapa mineral yang terdapat
10 di dalamnya adalah monasit, bastnasit, samarskit, gadolinit, dan xenotime (Lide, 2004).
Kegunaan utama senyawa gadolinium termasuk tempat untuk fosfor sebagai lampu neon, mengintensifkan layar X, dan scintillators untuk tomografi sinar-X, dan sebagai agen kontras pada MRI (dalam bentuk kelat yang larut dalam air). Kegunaan lain gadolinium ialah dalam perisai dan batang kendali reaktor nuklir (karena penampang penyerapan nuklirnya sangat tinggi) dan sebagai komponen yttrium gadolinium garnet, yang digunakan dalam komunikasi (Ryzhikov, 2005).
Gadolinium-153 atau 153Gd merupakan radioisotop EC (Electron Capture) 100% dan pemancar sinar gamma yang mempunyai energi 0,0697 MeV, 0,0974 MeV dan 0,103 MeV dengan intensitas masing-masing sebesar 2,4%, 30% dan 21%. Waktu paruh 153Gd cukup panjang yaitu t
1/2 = 241,6 hari.
Tabel 3. Isotop alami gadolinium dan produk aktivasi (n, γ) Isotope %Abundance Thermal
neutron cross section (barn) Activation product Half-life 152Gd 0,20 10 153Gd 241,6 d 154Gd 2,15 80 Stable - 155Gd 14,73 61000 Stable - 156Gd 20,47 2 Stable - 157Gd 15,68 254000 Stable - 158Gd 24,87 2,3 159Gd 18,6 h 160Gd 21,90 1,5 161Gd 3,7 m 161Tb 6,91 d Sumber: Lehenberger 2011, Weast 1987
Radioisotop 153Gd dapat dibuat melalui reaksi aktivasi neutron dari sasaran 152Gd dengan reaksi 152Gd(n,ɣ)153Gd. Reaksi ini memiliki tampang lintang reaksi (cr) 1100 barn, dan kelimpahan isotop 152Gd di alam sebesar 0,2%. Isotop lain yang ada didalam gadolinium alam berupa 154Gd, 155Gd, 156Gd, 157Gd, 158Gd dan 160Gd seperti yang ditunjukkan pada Tabel 3 (IAEA, 2003).
11 153Gd diproduksi oleh iradiasi neutron termal dari 152Gd atau 151Eu yang diperkaya (dalam europium oksida alami). Iradiasi 151Eu dengan neutron menghasilkan 152Eu, beberapa di antaranya mengalami peluruhan β hingga 152Gd, yang kemudian dapat menyerap neutron untuk menghasilkan 153Gd (Enger, 2013).
2.4 Ester-NHS-DOTA
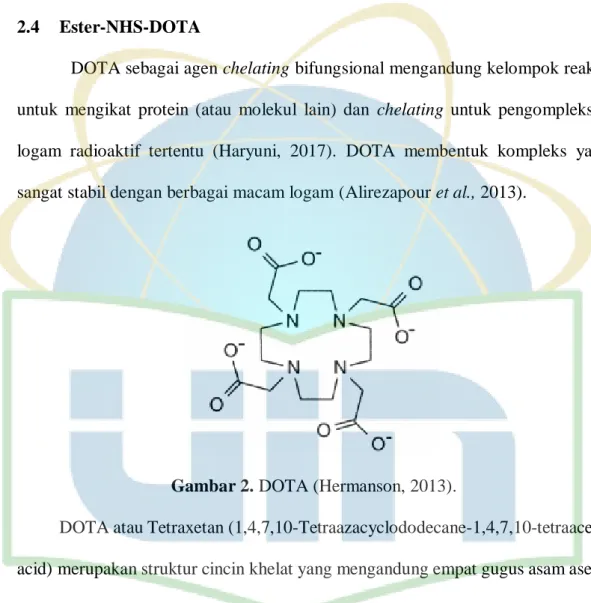
DOTA sebagai agen chelating bifungsional mengandung kelompok reaktif untuk mengikat protein (atau molekul lain) dan chelating untuk pengompleksan logam radioaktif tertentu (Haryuni, 2017). DOTA membentuk kompleks yang sangat stabil dengan berbagai macam logam (Alirezapour et al., 2013).
Gambar 2. DOTA (Hermanson, 2013).
DOTA atau Tetraxetan (1,4,7,10-Tetraazacyclododecane-1,4,7,10-tetraacetic acid) merupakan struktur cincin khelat yang mengandung empat gugus asam asetat karboksilat dari empat nitrogen pada struktur siklik 12 atomnya seperti ditunjukkan pada Gambar 2 (Hermanson, 2013). Kompleks Gd3+ dan DOTA digunakan sebagai agen kontras MRI berbasis gadolinium dengan nama asam gadoterik (Alirezapour et al., 2013
12 DOTA dapat terkonjugasi ke antibodi monoklonal dengan menempelkan salah satu dari empat gugus karboksil sebagai amida. DOTA juga dapat dikaitkan dengan molekul yang memiliki afinitas untuk berbagai struktur. Senyawa yang dihasilkan digunakan dengan sejumlah radioisotop dalam terapi dan diagnosis kanker (Alirezapour et al., 2013).
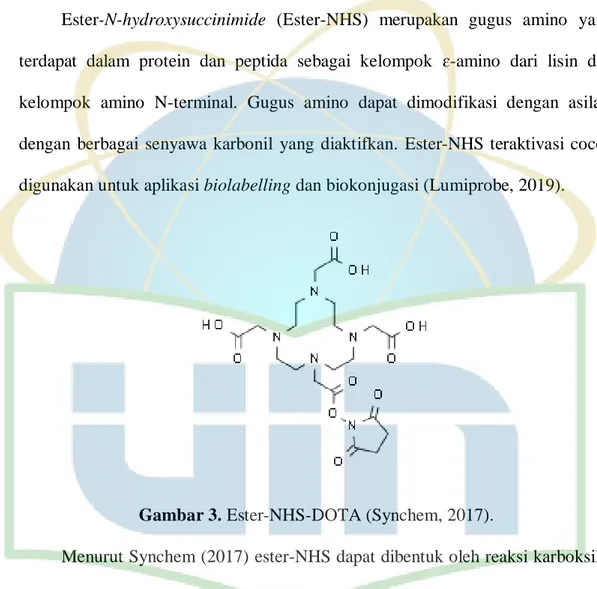
Ester-N-hydroxysuccinimide (Ester-NHS) merupakan gugus amino yang terdapat dalam protein dan peptida sebagai kelompok ɛ-amino dari lisin dan kelompok amino N-terminal. Gugus amino dapat dimodifikasi dengan asilasi dengan berbagai senyawa karbonil yang diaktifkan. Ester-NHS teraktivasi cocok digunakan untuk aplikasi biolabelling dan biokonjugasi (Lumiprobe, 2019).
Gambar 3. Ester-NHS-DOTA (Synchem, 2017).
Menurut Synchem (2017) ester-NHS dapat dibentuk oleh reaksi karboksilat dengan NHS dengan adanya karbodiimida seperti yang ditunjukkan pada Gambar 3. Turunan ester-NHS yang stabil didapatkan dengan reaksi aktivasi yang dilakukan dalam kondisi non-air menggunakan karbodiimida atau agen kondensasi yang tidak larut dalam air, seperti DCC (Hermanson, 2008). Biokonjugasi superior ligan bifungsional DOTA
N-succinimidyl-1,4,7,10-tetraazacyclododecane-1,4,7,10-13 tetraacetic acid (NHS-DOTA) digunakan sebagai ligan bifungsional (Chappell et al., 2003).
Gambar 4. Skema reaksi NHS ester untuk konjugasi kimia ke amina primer. (Thermofisher, 2020)
Pengikat silang yang diaktifkan ester NHS dan senyawa pelabelan bereaksi dengan amina primer dalam kondisi fisiologis hingga sedikit basa (pH 7,2 hingga 9) untuk menghasilkan ikatan amida yang stabil. Reaksi ini melepaskan N-hydroxysuccinimide (NHS). R mewakili reagen pelabelan atau salah satu ujung pengikat silang yang memiliki gugus reaktif NHS ester; P mewakili protein atau molekul lain yang mengandung kelompok fungsional target seperti yang ditunjukkan pada Gambar 4 (Thermofisher, 2020).
Hidrolisis ester NHS bersaing dengan reaksi amina primer. Laju hidrolisis meningkat dengan pH bufer dan berkontribusi terhadap ikatan silang yang kurang efisien dalam larutan protein yang kurang pekat. Waktu paruh hidrolisis untuk senyawa NHS-ester adalah 4 sampai 5 jam pada pH 7. Waktu paruh ini berkurang hingga 10 menit pada pH 8,6 dan 4 °C. Tingkat hidrolisis NHS-ester dalam larutan berair yang bebas dari amina primer dapat diukur pada 260 hingga 280 nm, karena produk sampingan NHS menyerap dalam kisaran tersebut (Thermofisher, 2020).
Reaksi ikatan silang NHS-ester paling umum dilakukan dalam fosfat, karbonat-bikarbonat, HEPES atau buffer borat pada pH 7,2 hingga 8,5 selama 0,5 hingga 4 jam pada suhu kamar atau 4 °C. Banyak bentuk reagen ester-NHS yang
14 tidak tersulfonasi tidak larut dalam air dan harus dilarutkan dalam pelarut organik yang larut dalam air, seperti DMSO dan DMF, sebelum dapat ditambahkan ke campuran reaksi berair (Thermofisher, 2020).
2.5 Gadolinium-based Contrast Agents (GdCA)
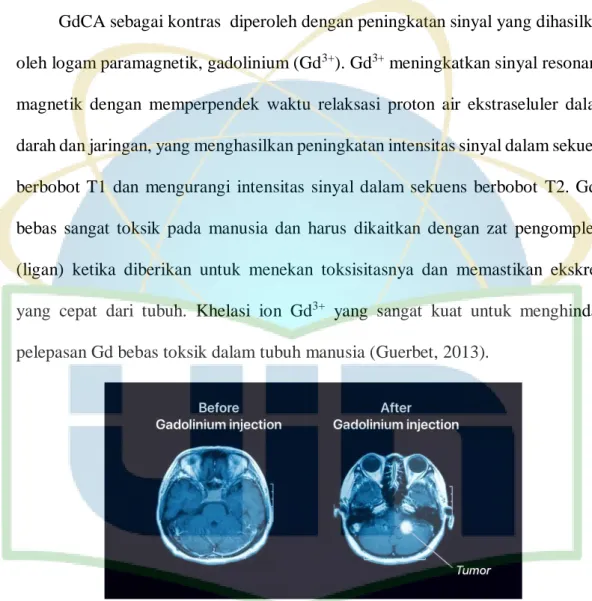
GdCA sebagai kontras diperoleh dengan peningkatan sinyal yang dihasilkan oleh logam paramagnetik, gadolinium (Gd3+). Gd3+ meningkatkan sinyal resonansi magnetik dengan memperpendek waktu relaksasi proton air ekstraseluler dalam darah dan jaringan, yang menghasilkan peningkatan intensitas sinyal dalam sekuens berbobot T1 dan mengurangi intensitas sinyal dalam sekuens berbobot T2. Gd3+ bebas sangat toksik pada manusia dan harus dikaitkan dengan zat pengompleks (ligan) ketika diberikan untuk menekan toksisitasnya dan memastikan ekskresi yang cepat dari tubuh. Khelasi ion Gd3+ yang sangat kuat untuk menghindari pelepasan Gd bebas toksik dalam tubuh manusia (Guerbet, 2013).
Gambar 5. Gadolinium digunakan pada pemindaian MRI (Inside Radiology, 2020).
GdCA digunakan untuk meningkatkan kontras struktur atau cairan dalam tubuh dalam pencitraan medis seperti ditunjukkan pada Gambar 5. Khelasi ion-ion kimia yang dicampur dengan gadolinium akan mengelilingi logam beracun dan mencegahnya membahayakan tubuh dan menjaga kemampuannya untuk
15 meningkatkan kontras pada jaringan tubuh (Drugwatch, 2020). Pasien dengan fungsi ginjal normal, sebagian besar media kontras gadolinium yang disuntikkan (lebih dari 90%) dikeluarkan dalam urin dalam waktu 24 jam (Inside Radiology, 2020).
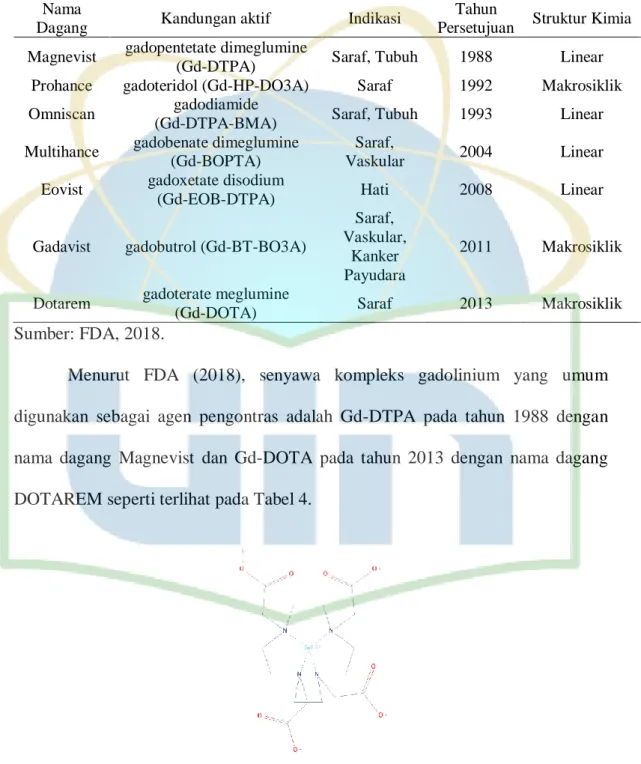
Tabel 4. Agen pengontras berbasis gadolinium Nama
Dagang Kandungan aktif Indikasi
Tahun
Persetujuan Struktur Kimia Magnevist gadopentetate dimeglumine
(Gd-DTPA) Saraf, Tubuh 1988 Linear Prohance gadoteridol (Gd-HP-DO3A) Saraf 1992 Makrosiklik Omniscan gadodiamide
(Gd-DTPA-BMA) Saraf, Tubuh 1993 Linear Multihance gadobenate dimeglumine
(Gd-BOPTA)
Saraf,
Vaskular 2004 Linear Eovist gadoxetate disodium
(Gd-EOB-DTPA) Hati 2008 Linear
Gadavist gadobutrol (Gd-BT-BO3A)
Saraf, Vaskular,
Kanker Payudara
2011 Makrosiklik
Dotarem gadoterate meglumine
(Gd-DOTA) Saraf 2013 Makrosiklik
Sumber: FDA, 2018.
Menurut FDA (2018), senyawa kompleks gadolinium yang umum digunakan sebagai agen pengontras adalah Gd-DTPA pada tahun 1988 dengan nama dagang Magnevist dan Gd-DOTA pada tahun 2013 dengan nama dagang DOTAREM seperti terlihat pada Tabel 4.
16 Gd-DOTA atau DOTAREM terdiri dari asam organik DOTA sebagai agen chelating dan gadolinium (Gd3+) yang digunakan dalam bentuk garam meglumine (Gadoterate meglumine) seperti terlihat pada Gambar 6. Gd-DOTA adalah agen kontras berbasis gadolinium yang diindikasikan untuk penggunaan intravena dengan MRI di otak (intrakranial), tulang belakang dan jaringan terkait pada pasien dewasa dan anak-anak (termasuk neonatus panjang) untuk mendeteksi dan memvisualisasikan area dengan gangguan sawar darah otak dan / atau vaskularisasi abnormal (Guerbet, 2013).
2.6 Dendrimer Poliamidoamin (PAMAM)
Dendrimer merupakan polimer dengan rantai bercabang berulang berbentuk sferis dengan diameter berkisar antara 1 hingga 100 nm. Dendrimer bersifat monodisperse, homogen dan memiliki makromolekul berukuran nano yang memiliki permukaan besar fungsional seperti banyak cabang pohon (Abbasi et al., 2016).
Gambar 7. Struktur dendrimer (Nanjwade et al., 2009).
Menurut Nanjwade et al. (2009), dendrimer terdiri dari tiga komponen yaitu gugus inti, rantai cabang dan gugus fungsi terminal seperti terlihat pada Gambar 7.
17 Gugus inti terletak di pusat dendrimer dan cabang dendrimer yang menyusun struktur intradendrimer terikat pada gugus inti.
Gambar 8. Struktur percabangan dendrimer generasi 0-4 (Bharali et al.,2009). Dendrimer terdapat dalam bentuk generasi rendah ke tinggi yaitu monomer yang terikat pada gugus inti (G0) disebut generasi I (G1), cabang yang terikat pada G1 dendrimer disebut generasi II (G2), cabang yang terikat pada G2 dendrimer disebut generasi III (G3) dan seterusnya, seperti terlihat pada Gambar 8 (Bharali et al.,2009). Ukuran dendrimer menentukan mekanismenya melewati membran sel. Dendrimer generasi 1 dan generasi 2 melewati sel melalui mekanisme transport paraselular, sedangkan dendrimer generasi 3-5 menembus membran sel melalui mekanisme transport transelular (endositosis) (Caminade et al., 2011).
Dendrimer dapat diaplikasikan sebagai pembawa yang efektif pada sistem penghantaran obat, karena dendrimer yang dirancang dengan tepat dapat menghasilkan kelarutan, dan kapabilitas biologis yang baik. Dendrimer dalam sistem penghantaran obat juga dapat digunakan sebagai agen penyalut untuk melindungi atau mendistribusikan obat ke sel spesifik atau sebagai alat pelepasan untuk agen biologis aktif (Nanjwade, 2009).
Dendrimer harus bersifat nontoksik, non-imunogenik (jika digunakan untuk vaksinasi), mampu menebus membran biologis (biopermeabel), mampu berada di sirkulasi sistem biologis selama waktu dan yang diinginkan, dan mampu menuju
18 sel target spesifik agar dapat digunakan dalam sistem penghantaran obat (Fatimah, 2012).
Kemampuan dendrimer sebagai penghantar obat didasarkan pada kemampuannya untuk meningkatkan kelarutan, permeabilitas molekul obat, dan membantu formulasi obat controlled release (Markatou et al., 2007). Dendrimer dapat meningkatkan permeabilitas dan efek retensi yang dapat menjadikannya sebagai penghantar obat tertarget pada target sel kanker (Garg et al., 2011).
Dendrimer PAMAM merupakan dendrimer yang pertama kali berhasil di sintesis, di karakterisasi dan tersedia secara komersial. Kemiripan ukuran, kemiripan sifat elektrik dan karakteristik biomimetik menyebabkan jenis dendrimer ini disebut sebagai artificial protein (Svenson & Tomalia, 2005). Dendrimer PAMAM sebagai sistem pembawa obat karena toksisitas dan polidispersitasnya yang relatif rendah, kelarutannya yang baik dalam air, kemampuannya berpenetrasi ke dalam sel yang lebih baik, dan imunogenisitasnya yang rendah dibandingkan dendrimer lain (Jain et al., 2010; Menjoge et al., 2010).
Tabel 5. Karakteristik Fisika Dendrimer PAMAM
Generasi Jumlah Gugus Terminal Bobot Molekul
(g/mol) Diameter (nm) 0 4 517 1,5 1 8 1430 2,2 2 16 3256 2,9 3 32 6909 3,6 4 64 14215 4,6 5 128 28826 5,4 6 256 58048 6,7 7 512 116493 8,1 8 1024 233383 9,7 9 2048 467162 11,4 10 4096 934720 13,5
19 Menurut Nanjwade et al. (2009), dendrimer "tumbuh" dari inti pusat dalam proses manufaktur berulang, dengan setiap langkah berikutnya mewakili "generasi" dendrimer baru. Peningkatan generasi (berat molekul) menghasilkan diameter molekul yang lebih besar, dua kali jumlah situs permukaan reaktif, dan sekitar dua kali lipat berat molekul generasi sebelumnya seperti pada Tabel 5.
Gambar 9. Dendrimer PAMAM generasi 3 (Jain et al., 2010).
Dendrimer PAMAM generasi 3 memiliki jumlah gugus terminal sebanyak 32, bobot molekul sebesar 6909 g/mol dan diameter 3,6 nm seperti ditunjukkan pada Gambar 9 (Nanjwade et al, 2009). Jumlah gugus fungsional pada permukaan dendrimer meningkat secara eksponensial sebanding dengan fungsi generasi, yang berimplikasi pada stuktur geometris dan bergantung pada jumlah struktur perifer dendrimer (Crooks et al., 2001).
20 2.7 Kolom Desalting PD-10
Kolom Desalting PD-10 mengandung Media Sephadex G-25 seperti pada Tabel 6, yang menjadikan pemisahan yang cepat dari zat dengan berat molekul tinggi dari zat dengan berat molekul rendah. Teknik kromatografi adalah filtrasi gel dan molekul dipisahkan berdasarkan perbedaan ukuran (Healtchare, 2007). Kolom PD-10 adalah anggota platform Trap, yang dibutuhkan untuk persiapan skala kecil yang fleksibel sebelum teknik analitik seperti elektroforesis gel, kromatografi cair, dan LC-MS (Healthcare, 2009).
Tabel 6. Karakteristik Kolom PD-10
Matrix Sephadex G-25 Medium
Particle size range 85 to 260 μm
Packled bed dimensions 1,45 x 5.0 cm (8.3 mL)
Maximum sample volume 2.5 mL
Volume of eluted sample gravity 3.5 mL Volume of eluted sample spin 2.5 mL
Desalting Capacity >90%
Exlusion limit Mr 5000
Chemical Stability All commonly used buffers
Working pH range 2-13
Storage temperature +4 to +30o C
Storage solution 0/15% Kathon CG/ICP Biocide
Sumber: Hagel, 1998.
Kolom Desalting PD-10 digunakan untuk desalting, pertukaran bufer dan pembersihan sampel (GE Healtchare, 2007). Desalting dan pertukaran bufer adalah dua contoh pemisahan kelompok. Perbedaan ukuran besar antara protein dan zat terlarut molekul rendah memungkinkan untuk memilih media filtrasi gel yang akan mengecualikan protein dari jaringan berpori sambil memungkinkan permeasi penuh zat terlarut berbobot molekul rendah (Hagel, 1998).
1. Molekul yang lebih besar dari pori-pori terbesar dalam matriks Sephadex dikeluarkan dari matriks dan dielusi terlebih dahulu, dalam atau setelah
21 volume kosong. Volume kosong adalah volume kolom di luar matriks Sephadex.
2. Molekul yang lebih kecil dari pori-pori terbesar dalam matriks Sephadex akan menembus pori-pori dengan berbagai tingkat. Mereka memiliki volume kolom yang dapat diakses lebih besar daripada molekul besar dan karena itu mereka mengelusi molekul besar sebelum satu volume kolom total bufer telah melewati kolom (Healtchare, 2007).
Pemisahan kelompok dapat dibuat menggunakan dua protokol yang berbeda, protokol gravitasi dan protokol putaran. Protokol gravitasi yaitu cairan melewati kolom dengan gaya gravitasi, ada pemulihan sedikit lebih tinggi dan menggunakan kapasitas desalting Protokol gravitasi dibandingkan dengan saat menggunakan protokol spin dan sampel yang digunakan terdilusi. Protokol putaran yaitu gaya gravitasi tambahan ditambahkan dengan memutar kolom dalam centrifuge untuk beberapa langkah protokol dan tidak ada dilusi sampel (Healtchare, 2007).
2.8 Kromatografi Lapis Tipis (KLT)
KLT merupakan teknik pemisahan campuran dengan menggunakan suatu plat fase diam yang akan secara seragam tersebar di atas permukaan plat tersebut yang kemudian fase gerak akan bergerak sepanjang fase diam karena pengaruh gaya kapiler pada pengembangan (Gandjar & Rohman, 2007).Fase diam biasanya terdiri dari bubuk adsorben, silika (SiO2) atau alumina (Al2O3) yang dibagi halus, digunakan dalam bentuk lapisan tipis (sekitar 0,25 mm) (Kumar, 2013).
Instant Thin Layer Chromatography-Silica Gel (ITLC-SG) adalah adsorben yang digunakan untuk penandaan (Decristoforo et al., 2007). Metode ITLC-SG
22 digunakan untuk analisis yang cepat dan akurat dari penandaan dan radiofarmaka. Plat ITLC terbuat dari lembaran fiberglass yang diimpregnasi dengan adsorben, biasanya gel silika yang merupakan salah satu fase diam yang paling sering digunakan (Millar et al., 2009). Silika gel merupakan yang paling banyak digunakan, karena dapat dipakai untuk KLT adsorbsi maupun partisi (Kumar, 2013). Pelat ITLC memiliki nilai ekonomi tinggi, karena bahan fleksibel dapat dipotong untuk ukuran apa pun (Decristoforo et al., 2007).
Gambar 10. Plat ITLC sebelum dan sesudah pengembangan (Decristoforo et al.,2007).
Pemisahan tergantung pada afinitias relative senyawa terhadap stasioner dan fase gerak. Senyawa-senyawa dibawah pengaruh fase gerak akan bergerak diatas permukaan fase diam. Senyawa dengan afinitas yang lebih tinggi terhadap fase stasioner berjalan lambat sementara yang lain bergerak lebih cepat. Setelah pemisahan terjadi, komponen divisualisasikan sebagai bitnik-bintik pada tingkat yang berbeda diatas plat seperti yang ditunjukkan pada Gambar 10 (Decristoforo et al. ,2007).
23 Jarak antara jalannya pelarut bersifat relatif, oleh karena itu diperlukan suatu perhitungan tertentu untuk memastikan spot yang terbentuk memiliki jarak yang sama walaupun ukuran jarak plat nya berbeda. Nilai perhitungan tersebut adalah nilai Rf, nilai ini digunakan sebagai nilai perbandingan relatif antar sampel. Nilai Rf juga menyatakan derajat retensi suatu komponen dalam fase diam sehingga nilai Rf sering juga disebut faktor retensi. Nilai Rf dapat dihitung dengan rumus berikut:
𝑅𝑓 = 𝐽𝑎𝑟𝑎𝑘 𝑦𝑎𝑛𝑔 𝑑𝑖𝑡𝑒𝑚𝑝𝑢ℎ 𝑠𝑢𝑏𝑠𝑡𝑎𝑛𝑠𝑖 𝐽𝑎𝑟𝑎𝑘 𝑦𝑎𝑛𝑔 𝑑𝑖𝑡𝑒𝑚𝑝𝑢ℎ 𝑜𝑙𝑒ℎ 𝑝𝑒𝑙𝑎𝑟𝑢𝑡
Semakin besar nilai Rf dari sampel maka semakin besar pula jarak bergeraknya senyawa tersebut pada plat kromatografi lapis tipis. Saat membandingkan dua sampel yang berbeda di bawah kondisi kromatografi yang sama, nilai Rf akan besar bila senyawa tersebut kurang polar dan berinteraksi dengan adsorbent polar dari plat kromatografi lapis tipis (Skoog, 2013).
Nilai Rf dapat dijadikan bukti dalam mengidentifikasikan senyawa, bila identifikasi nilai Rf memiliki nilai yang sama maka senyawa tersebut dapat dikatakan memiliki karakteristik yang sama atau mirip. Sedangkan, bila nilai Rfnya berbeda, senyawa tersebut dapat dikatakan merupakan senyawa yang berbeda (Skoog, 2013).
Pemisahan pada kromatografi lapis tipis yang optimal hanya dapat diperoleh jika menotolkan sampel dengan ukuran bercak sekecil mungkin dan sesempit mungkin. Untuk memperoleh reprodusibilitas, volume sampel yang ditotolkan paling sedikit 0,5 µL. jika volume sampel yang akan ditotolkan >2,0 µL maka penotolan harus dilakukan secara bertahap dengan dilakukan pengeringan antar totolan (Depkes, 2000).
24 2.9 Fourier Transfrom Infra-Red (FTIR)
FTIR adalah teknik yang digunakan untuk mendapatkan spektrum inframerah dari absorbansi, emisi, fotokonduktivitas dari sampel padat, cair dan gas. Karakterisasi dengan menggunakan FTIR bertujuan untuk mengetahui jenis-jenis vibrasi antar atom. FTIR juga digunakan untuk menganalisa senyawa organik dan anorganik serta analisa kualitatif dan analisa kuantitatif dengan melihat kekuatan absorbsi senyawa pada panjang gelombang tertentu (Sastrohamidjojo, 1992).
Gambar 11. Proses analisis sampel (Thermofisher, 2011).
FTIR berupa sumber energi yang melewati celah ke sampel, celah tersebut berfungsi mengontrol jumlah energi yang diserap oleh sampel. Sumber energi sebagian diserap oleh sampel dan yang lainnya ditransmisikan melalui permukaan sampel sehingga sinar inframerah lolos ke detektor dan sinyal yang terukur kemudian dikirim ke komputer. Menurut Sastrohamidjojo (1992), FTIR terdiri dari lima bagian utama, yaitu seperti ditunjukkan pada Gambar 11.
1. Sumber sinar, terbuat dari filament nernst atau globar yang dipanaskan menggunakan listrik hingga temperatur 1000-1800 °C. Pemijar globar
25 merupakan batangan silikon karbida yang dipanasi hingga 1200 °C dan merupakan sumber radiasi yang sangat stabil . Pijar Nernst merupakan bidang cekung dari sirkonium dan yutrium oksida yang dipanasi hingga sekitar 1500 °C dengan arus listrik serta kurang stabil dibandingkan dengan pemijar globar dan memerlukan pendingin air.
2. Pencerminan, sistem utama FTIR adalah interferometer yang berfungsi sebagai kombinasi peralatan atau pengatur seluruh frekuensi inframerah yang dihasilkan oleh sumber cahaya. Interferometer terdiri dari 3 komponen yaitu lensa statik, lensa dinamis, dan beamsplitter.
3. Daerah cuplikan, dimana berkas acuan dan cuplikan masuk ke dalam daerah cuplikan dan masing-masing menembus sel acuan dan cuplikan secara bersesuaian.Detektor, berfungsi untuk mendeteksi sinar infra merah atau energi pancaran yang lewat akibat panas yang dihasilkan.
4. Detektor yang sering digunakan adalah termokopel, sel golay dan balometer. Ketiga detektor bekerja berdasarkan efek pemanasan yang ditimbulkan oleh sinar IR.
5. Elektronik, detektor inframerah menghasilkan tegangan yang merespon interferogram yang masuk melalui sampel, tegangan ini akan membentuk analog sebelum spektrofotometer dapat mengirim interferogram ke sistem data, maka sinyal harus dikonversikan dari bentuk analog ke bentuk digital.
26 BAB III
METODE PENELITIAN
3.1 Waktu dan Tempat
Penelitian dilakukan pada Maret 2019 sampai dengan bulan Maret 2020 di Pusat Teknologi Radioisotop dan Radiofarmaka, Gedung 11-BATAN, Puspiptek, Serpong, Kota Tangerang Selatan.
3.2 Alat dan Bahan 3.2.1 Alat
Alat yang digunakan dalam penelitian ini adalah kolom desalting PD-10 Sephadex G25 merk Healthcare, Instant Thin Layer Chromatography-Silica Gel (ITLC-SG) strips merk Gelman Science, FTIR, dose calibrator merk ATOM LAB-300 BOIDEX, thermomixer merk Eppendorf, radiochromatography scanner merk TLC 204, water purification system, pipet mikro merk Eppendorf, neraca analitik merk Deriver Precision Balance TAPI-4101, vortex mixers merk VWR®, oven dan pengaduk magnetik merk yellow line MAG HS 10 dan peralatan gelas.
3.2.2 Bahan
Bahan yang digunakan adalah 153Gd yang disiapkan dengan iradiasi Gd di Reaktor Serba Guna G.A. Siwabessy BATAN Serpong, dendrimer PAMAM G3 (Sigma-Aldrich), ester-NHS-DOTA (Macrocylics), EDTA (merck), HCl (merck), protein dye (Bio-Rad), bovine serum albumin (BSA) (merck), NaOH (merck), KH2PO4.H2O (merck), K2HPO4.2H2O (merck), ammonium asetat (merck) dan kertas indikator pH (merck).
27 3.3 Diagram Alir Penelitian
Konjugasi NHS-DOTA dan PAMAM G3 (rasio molar 96:1)
pH campuran disesuaikan menjadi 7,2, dengan penambahan NaOH atau HCl dan diinkubasi selama
24 jam pada suhu 4 °C
Konjugat DOTA-PAMAM
Dimurnikan dengan kolom PD-10 Dikarakterisasi dengan FTIR
karakterisasi FTIR untuk DOTA-PAMAM
Dilakukan penandaan 153Gd pada DOTA-PAMAM G3 dan analisis persen penandaan dengan TLC scanner Bioscan dengan variasi waktu inkubasi 1,2,3,4 dan 5
jam dengan suhu 95 °C dan pH 5,5 &
Dilakukan pengukuran persentase penandaan 153
Gd-DOTA-PAMAM G3 dengan Instant
Thin Layer Chromatography-Silica Gel
(ITLC-SG) sebagai fase diam, dan salin sebagai fase gerak
153
Gd-DOTA-PAMAM
28 3.4 Prosedur Kerja
3.4.1 Konjugasi DOTA-PAMAM G3 (Humani, 2017)
Ester-NHS-DOTA ditimbang sebanyak 73,104 mg kemudian dilarutkan dalam 4 mL bufer fosfat 0,1 M pH 7,2 (Lampiran 1). Kemudian ditambahkan 34,545 µL PAMAM G3. Larutan diatur pH sampai 7,2 menggunakan NaOH 0,1 dan 1 M atau HCl 0,1 dan 1 M kemudian dicek pH dengan kertas indikator pH. Larutan diinkubasi selama 24 jam pada suhu 4 °C.
3.4.2 Uji Kemurnian Konjugat DOTA-PAMAM G3 3.4.2.1 Preparasi Kolom PD-10 (Humani, 2017)
Kolom PD-10 dicuci menggunakan bufer fosfat 0,01 M pH 7,4 (Lampiran 3) sebanyak 4 x 8 mL. Bovine Serum Albumin (BSA) 5% (w/
v) 500 µL (Lampiran
4) ditambahkan ke dalam kolom sebagai blocking kolom dan menghasilkan tetesan berwarna kuning. Kolom PD-10 dicuci dengan bufer fosfat 4 x volume sampel (4 x 500 µL) dan kemudian dicuci kembali dengan ±60 mL bufer fosfat.
3.4.2.2 Pemurnian DOTA-PAMAM G3 dengan Kolom PD-10 (Ritawidya et al, 2014)
Konjugat DOTA-PAMAM G3 dengan perbandingan 96:1 dimasukkan ke dalam kolom. Bufer fosfat 0,05 M pH 7,2 yang mengandung EDTA 5 mM (Lampiran 2) sebanyak 1 mL dimasukkan ke dalam kolom. Didiamkan sebentar sampai larutan memenuhi kolom. Kolom dibuka dan ditampung larutan per 250 µL sebanyak 60 fraksi (jika larutan di kolom sudah habis, ditambahkan lagi 1 mL bufer fosfat). Fraksi campuran tersebut di uji menggunakan protein dye. Fraksi berwarna biru, menandakan adanya DOTA-PAMAM G3 dan fraksi berwarna coklat
29 menandakan adanya DOTA bebas. Fraksi-fraksi yang menunjukkan adanya PAMAM G3 digabung menjadi satu di dalam vial.
3.4.3 Karakterisasi Konjugat DOTA-PAMAM G3 (Yenni, 2018) Karakterisasi konjugat DOTA-PAMAM G3 dilakukan dengan FTIR.
3.4.4 Penandaan DOTA-PAMAM dengan 153Gd (Ghai, 2015;Humani, 2017) Larutan hasil iradiasi 153Gd diambil sebanyak 878,7 µL dan ditambahkan bufer amonium asetat 1 M pH 5,5 (Lampiran 5) sebanyak 87,87 µL. Campuran ditambahkan DOTA-PAMAM G3 sebanyak 1 mL, kemudian pH dikondisikan dengan menggunakan NaOH atau HCl sampai pH 5,5. pH kurang dari 5,5 harus ditambahkan bufer amonium asetat lagi sejumlah larutan 153Gd. Larutan diinkubasi selama 5 jam pada suhu 95 °C dengan kecepatan 400 rpm.
Sampel dicuplik setiap 1 jam sebanyak 50 µL dan ditambahkan larutan EDTA 0,05 M (Lampiran 6) sejumlah mol Gd, kemudian diinkubasi selama 5 menit. Persentase penandaan 153Gd pada DOTA-PAMAM G3 ditentukan menggunakan strip ITLC-SG (1 cm x 10 cm) sebagai fase diam dan larutan salin sebagai fase gerak. Persentase penandaan diperoleh dengan menggunakan TLC scanner Bioscan.
30 BAB IV
HASIL DAN PEMBAHASAN
4.1 Konjugat DOTA PAMAM
Sintesis konjugat DOTA PAMAM dilakukan dengan mencampurkan ester-NHS-DOTA dengan dendrimer PAMAM G3 dalam bufer fosfat pH 7,2 sehingga terjadi kompleksasi. Kompleksasi tergantung pada jenis buffer dan nilai pH. Ligan DOTA mampu berikatan dengan melalui reaksi konjugasi dengan dendrimer PAMAM G3. Penyiapan DOTA-PAMAM G3 dilakukan pada pH 7,2 selain agar kelarutan DOTA tetap tinggi juga agar atom hidrogen di gugus amin primer mengalami deprotonasi. PAMAM ditambahkan bufer fosfat akan menghasilkan selektivitas yang tinggi pada pH 7,2 yang menyebabkan pembentukan protein PAMAM kompleks.
Rasio molar pengikat silang dengan molekul target, tingkat modifikasi dan konjugasi yang disesuaikan dapat dikontrol untuk menciptakan produk yang optimal. Rasio molar ester NHS DOTA terhadap PAMAM G3 yang digunakan adalah 96:1 atau 3x lipat dari jumlah amina primer di PAMAM G3 untuk mengoptimalkan jumlah DOTA yang berikatan dengan PAMAM. Reaksi ligan ester DOTA NHS dengan dendrimer PAMAM G3 yang mengandung 32 gugus amina primer menghasilkan konjugat DOTA-PAMAM G3 melalui ikatan amida yang stabil.
31 Gambar 13. Konjugasi DOTA-PAMAM G3 (Rahmania, 2014). Larutan yang mengandung ester NHS akan bereaksi dengan nukleofil dengan melepaskan NHS leaving group untuk membentuk produk asilasi seperti ditunjukkan pada Gambar 13 menunjukkan bahwa pengikat silang yang diaktifkan oleh ester NHS dan senyawa pelabelan bereaksi dengan amina primer dalam kondisi yang agak basa untuk menghasilkan ikatan amida yang stabil. Reaksi ini melepaskan NHS, yang dapat dihilangkan dengan mudah dengan dialisis atau desalting.
Senyawa NHS tidak berpengaruh pada reaksi kimia, tetapi cenderung meningkatkan kelarutan air dari pengikat silang yang mengandung mereka. Selain itu, kelompok yang dibebankan mencegah pengikat silang NHS dari menembus membran sel untuk digunakan untuk metode pengikatan silang permukaan sel (Thermofisher, 2018).
32 Fungsi larutan bufer untuk meningkatkan laju hidrolisis ester aktif. Reaksi dengan amina primer dan sekunder, masing-masing menciptakan hubungan amida yang stabil, yang tidak mudah terurai sehingga dalam molekul protein, reagen ikatan silang ester NHS berpasangan dengan amina di terminal N (Hermanson, 2008).
4.2 Kemurnian Konjugat DOTA PAMAM
Konjugat DOTA-PAMAM G3 dimurnikan dengan kolom PD-10 dengan bufer fosfat 0.05 M pH 7.2 yang mengandung 5mM EDTA sebagai eluen yang dikondisikan terlebih dahulu dengan Bovine Serum Albumin (BSA) yaitu suatu protein netral yang digunakan sebagai blocking agent untuk mengatasi ikatan elektrostatik di dalam kolom. Fraksi yang telah dielusi kemudian di uji kolorimetri dengan dye protein Commasie Brilliant Blue (CBB) G-250.
Gambar 14. Hasil uji kolorimetri dari pemurnian fraksi DOTA-PAMAM Uji kolorimetri akan menghasilkan fraksi DOTA-PAMAM G3 berwarna biru dan fraksi yang tidak mengandung DOTA-PAMAM G3 akan menunjukkan warna
33 coklat. Uji kolorimetri menghasilkan fraksi 11-41 berwarna biru dan menunjukkan terdapat DOTA-PAMAM G3 dan jika tidak ada protein yang terikat maka warna larutan akan warna coklat seperti ditunjukkan pada Gambar 14. Fraksi tersebut disatukan untuk uji dilakukan tahap selanjutnya.
Gambar 15. Reaksi kolorimetri dengan CBB G-250
Uji kolorimetri dengan menggunakan pewarna CBB G-250 untuk kuantifikasi protein, dan bekerja dengan mengikat protein melalui atraksi Van der Waals dan melalui interaksi ionik antara kelompok asam sulfonat pewarna dan kelompok amina protein positif seperti ditunjukkan Gambar 15. CBB G-250 mengalami perubahan warna di mana pewarna berubah dari cokelat muda di bawah pH 2 menjadi biru tua pada pH 7 (Olson, 2007).
Jumlah ligan pewarna CBB G-250 yang terikat pada setiap molekul protein sebanding dengan jumlah muatan positif yang ditemukan pada protein. Asam amino bebas, peptida dan protein dengan berat molekul rendah tidak menghasilkan warna dengan pereaksi pewarna CBB (Olson, 2007). CBB bereaksi terutama dengan asam amino arginin dan asam amino aromatik (Ahmed, 2004).
34 4.3 Karakteristik DOTA-PAMAM G3 Menggunakan FTIR
Karakterisasi dengan FTIR bertujuan untuk mengidentifikasi DOTA PAMAM G3 yang terdapat serapan khas gugus fungsi amina pada dendrimer PAMAM G3 yang terikat dengan ligan DOTA.
Gambar 16. Spektrum FTIR DOTA-PAMAM G3
Spektrum FTIR DOTA-PAMAM ditunjukkan pada Gambar 16 terdapat vibrasi stretching –OH pada 2925,61 cm-1. Vibrasi stretching C-H dari –CH2- pada senyawa alifatik pada puncak serapan 2858,56 cm-1. Vibrasi N-H amida sekunder muncul pada bilangan gelombang 1567,61 cm-1. Puncak serapan terdapat pada 1077,73 cm-1 merupakan daerah serapan C-N stretch dari C-NH2 yang khas pada senyawa amina primer alifatik. Selain itu, terdapat juga serapan pada 545,95 cm-1 pada senyawa C=O out of plane bed di amida secara umum, dan bilangan gelombang 464,53 cm-1 yang merupakan serapan khas –C-C=O pada amida secara umum.
35 Menurut Yenni (2018) bahwa spektrum FTIR DOTA-PAMAM G3 terdapat pada bilangan gelombang 3315,97 cm-1 menunjukkan ikatan O-H dari asam karboksilat, 2830,13 cm-1 vibrasi gugus fungsi C-H ikatan alifatik, 1639, 83 cm-1 vibrasi stretching gugus fungsi C=O, 1581,78 cm-1 vibrasi bending gugus fungsi N-H (amida), 1075,98 cm-1 menunjukkan adanya vibrasi gugus fungsi C-NH
2. Serapan khas yang menandakan terdapat DOTA-PAMAM G3 terdapat pada penyerapan dengan bilangan gelombang 1075,98 cm-1 untuk ikatan C-N.
Hasil uji FTIR senyawa Gd-DOTA pada bilangan gelombang 1036,62 cm-1 terdapat vibrasi gugus fungsi C-N, 1086,81 cm-1 vibrasi gugus fungsi C=O, 1603,34 cm-1 vibrasi gugus fungsi N-H dan 3433,59 cm-1 ikatan O-H (Mohseni, 2020). Serapan khas terdapat pada bilangan gelombang 1036,62 untuk ikaran C-N (amida). Tabel 7. Panjang gelombang dan gugus fungsi senyawa hasil uji FTIR
Bilangan gelombang (cm-1) Jenis vibrasi
2925,61 O-H 2858,59 C-H alifatik 1567,61 N-H (amida 2o) 1077,73 C-N 545,95 C=O 464,53 C-C=O
Tabel 7 menunjukkan serapan khas pada 1077,73 cm-1 dimana menunjukkan vibrasi C-N stretch dari C-NH2 terkaitnya DOTA dengan PAMAM G3. Serapan khas juga terdapat pada Yenni (2018) dimana penyerapan pada bilangan gelombang 1075,98 cm-1 untuk ikatan C-N dan Mohseni (2020) pada bilangan gelombang 1036,62 untuk ikaran C-N (amida). Dari hasil uji FTIR tersebut menunjukkan bahwa DOTA berhasil terikat dengan dendrimer PAMAM G3.
36 4.4 Penandaan DOTA-PAMAM dengan 153Gd
Penandaan dilakukan untuk mengetahui persentase penandaan dari 153 Gd-DOTA-PAMAM dengan menggunakan ITLC-SG dan diukur menggunakan TLC scanner yang akan menghasilkan radiokromatogram. Penandaan menggunakan senyawa radioaktif gadolinium karena memiliki sensitivitas dan selektivitas yang tinggi.
4.4.1 Optimalisasi penandaan DOTA-PAMAM dengan 153Gd
Penandaan dilakukan dengan memvariasikan waktu inkubasi yaitu 1, 2, 3, 4 dan 5 jam, pada suhu 95 °C dan pH 5,5. Kestabilan kompleks dipengaruhi oleh pH sehingga penandaan harus dilakukan pada kondisi pH dimana bentuk kompleksnya stabil. Laju pembentukan kompleks meningkat dengan pH, tetapi di atas pH 6 ion lantanida mulai membentuk kompleks hidrokso yang tidak larut. pH optimal untuk penandaan adalah antara pH 5 dan 6. pH tidak memiliki pengaruh yang signifikan terhadap kompleksasi (selama pH dikontrol) bahkan ketika konsentrasinya tinggi.
37 Penandaan dilakukan bertujuan untuk mengikat 153Gd ke DOTA PAMAM dengan menambahkan senyawa radioaktif 153GdCl3 ke DOTA PAMAM G3 untuk membentuk 153Gd-DOTA-PAMAM G3 seperti yang ditunjukkan pada Gambar 17. Tabel 8. Persentase penandaan DOTA-PAMAM G3 dengan 153Gd
Suhu pH Waktu (jam) Persentase Penandaan (%) Simplo Duplo Triplo
95 °C 5,5 1 7,41 11,58 3,44 2 4,97 2,07 4,59 3 2,59 2,43 5,92 4 4,69 1,45 4,33 5 36,38 73,61 64
Penandaan DOTA-PAMAM dengan 153Gd dilakukan secara triplo. Tabel 8 menunjukkan bahwa didapatkan hasil tertinggi pada waktu inkubasi selama 5 jam yaitu sebesar 58±19,3%. Berdasarkan penelitian sebelumnya, Rahmania et al., (2014) menemukan pada sintesis radiogadolinium(III)-DOTA-PAMAM G3-trastuzumab yang menghasilkan persentase penandaan pada suhu 37 ⁰C dengan waktu inkubasi 5 jam sebesar 53,3%. Penelitian tersebut membuktikan penelitian ini bahwa penggunaan suhu 95 °C akan mendapatkan persentase penandaan yang lebih tinggi. Semakin tinggi suhu akan mempercepat pengikatan tetapi waktu inkubasi yang lebih lama tidak secara signifikan meningkatkan hasil kompleksasi (Ghai, 2015).
4.4.2 Penandaan 153Gd-DOTA-PAMAM G3
Penandaan kompleks 153Gd-DOTA-PAMAM G3 dilakukan dengan menggunakan sistem kromatografi lapis tipis dengan ITLC-SG. ITLC-SG digunakan sebagai fase diam dan larutan salin sebagai fase gerak. Gel silika digunakan sebagai fase diam, senyawa yang lebih polar memiliki interaksi yang
38 lebih kuat dengan kertas atau gel silika sementara senyawa yang kurang polar bergerak di sepanjang plat dan menghasilkan nilai Rf yang lebih tinggi
Gambar 18. Radiokromatogram kontrol; A) GdCl3 dan B) Gd-EDTA Penentuan Rf dan persentase penandaan dilakukan dengan alat TLC scanner. Gambar 18 menunjukkan radiokromatogram GdCl3 dan Gd-EDTA dapat terlihat pada strip ITLC-SG yang dikembangkan dengan larutan salin berada pada Rf=1.
Sumbu X dan Y pada radiokromatogram menunjukkan bahwa sumbu X adalah position atau panjang kertas (mm) dan sumbu Y adalah radioaktivitas (C/mm). Panjang kertas ITLC-SG yang digunakan adalah 120 mm atau 12 cm. Aktivitas atau intensitas radiasi diukur dalam hitungan per detik (cps) yang menyatakan jumlah per unit yang terdaftar dalam instrumen pemantauan radiasi (Radiation, 2019).
39 Gambar 19. Radiokromatogram hasil penandaan 153Gd-DOTA-PAMAM G3
dengan lama waktu inkubasi 5 jam (triplo)
Penentuan Rf komplek secara bersamaan juga dielusi larutan 153Gd, sehingga akan dapat dilihat perbedaan Rf komplek dan 153Gd bebas. Gambar 19 menunjukkan dua puncak yaitu 153Gd bebas pada Rf=1 dalam campuran reaksi yang mengandung produk utama dari 153Gd-DOTA-PAMAM G3 pada Rf=0. Akhir reaksi, EDTA ditambahkan secara berlebihan untuk mengikat 153Gd bebas yang tidak terikat pada 153Gd-DOTA-PAMAM G3.
40 Gambar 20. Kurva persentase penandaan dengan variasi waktu inkubasi
Gambar 20 menunjukkan perubahan persentase penandaan dengan memvariaskan waktu inkubasi. Persentase penandaan 153Gd-DOTA-PAMAM G3 yang optimal didapatkan pada waktu inkubasi selama 5 jam sebesar 58±19,3%. Persentase penandaan yang rendah terjadi karena masih banyaknya pengotor atau 153Gd pada senyawa 153Gd-DOTA-PAMAM G3 seperti terlihat pada hasil radiokromatogram dari ITLC-SG.
Pengotor dapat timbul dari penandaan yang tidak lengkap, kerusakan produk dari waktu ke waktu yang disebabkan oleh ketidakstabilan, dan terkena bahan asing selama sintesis (Ghahramani, 2015). Pengotor berupa gadolinium bebas dapat bersifat sangat toksik. Pengotor lain dapat menurunkan kualitas gambar, meningkatkan dosis radiasi yang diserap, atau melokalisasi di area selain yang dimaksudkan, pada akhirnya memberikan informasi yang tidak lengkap atau salah (Oliveira, 2014). 0 10 20 30 40 50 60 70 1 2 3 4 5 % P en an da an Waktu (Jam)
41 BAB V
PENUTUP
5.1 Simpulan
1. Persentase penandaan optimal didapatkan pada pH 5,5, suhu inkubasi 95 ⁰C dan waktu inkubasi 5 jam.
2. Persentase penandaan 153Gd-DOTA-PAMAM G3 yang didapatkan adalah sebesar 58±19,3%.
5.2 Saran
Perlunya penambahan variasi waktu inkubasi diatas 5 jam untuk mendapatkan hasil penandaan yang lebih optimal.
42 DAFTAR PUSTAKA
[FDA] Food and Drug Association. 2018. Gadolinium Based - Contrast Agent. [diunduh pada 20 Feb 2019]. Tersedia pada: http:www.fda.gov/Drugs/
DrugSafety/PostmarketDrugSafetyInformationforPatientandProviders/ucm1 42882.htm.
[IAEA] International Atomic Energi Agency. 2003. Manual Reactor Produced Radioisotop (IAEA TECDOC 1340). Austria: Vienna.
[IAEA] International Atomic Energi Agency. 2018. Quality Control in the Production of Radipharmaceuticals. (IAEA-TECDOC-1856). Austria: Vienna.
Abbasi E, Milani M, Aval SF, Kouhi M, Akbarzadeh A, Nasrabadi HT, Samiei M. 2016. Silver Nanoparticles: Synthesis Methods, Bioapplications and Properties. Critical Reviews in Microbiology. 42:173–180.
Ahmed H. 2004. Principles and reactions of protein extraction, purification, and characterization. CRC press.
Aime S, Caravan P. 2009. Biodistribution on Gadolinium-Based Contrast Agents, Including Gadolinium Deposition. NIH Public Access. 30(6):1259–1267. Alirezapour B, Jalilian AR, Bolourinovin F, Moradkhani S. 2013. Production and
Quality Control of [67Ga]-DOTA-Trastuzumab for Radioimmunoscintigraphy. Iranian Journal of Pharmaceutical Research. 12(2):355–366.
Bharali DJ, Kalil M, Gurbuz M, Simone, TM, Mousa SA. 2009. Nanoparticles and Cancer Therapy : A Concise Review with Emphasis on Dendrimers. International Journal of Nanomedicine. 4:1–8.
Brechbiel, MW, Star RA, Kobayashi H. 2005. Methods for Functional Kidney Imaging Using Small Dendrimer Contrast Agents. United States of America: US Departement of Health and Human Services.
Briley-sæbø K, Hustvedt S, Haldorsen A, Bjørnerud A. 2004. Long-term Imaging Effects in Rat Liver After a Single Injection of an Iron Oxide Nanoparticle Based MR Contrast Agent. Journal of Magnetic Resonance Imaging. 20:622– 631.
Burshberg J. 2002. The Essential Physics of Medical Imaging. California: Lippincot Williams & Wilkins.
Bushong SC & Clarke G. 2013. Magnetic Resonance Imaging-E-Book: Physical and Biological Principles. Elsevier Health Sciences.