UJI EFISIENSI DAN EFEKTIVITAS
VAKSIN HydroVac® UNTUK
PENANGGULANGAN INFEKSI Aeromonas hydrophila
PADA IKAN LELE DUMBO (Clarias gariepinus)
SKRIPSI
BERTO MULIA WIBAWA NPM O10.050004
UNIVERSITAS PADJADJARAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
JURUSAN MANAJEMEN SUMBERDAYA PERAIRAN
JATINANGOR
2010
UJI EFISIENSI DAN EFEKTIVITAS
VAKSIN HydroVac® UNTUK
PENANGGULANGAN INFEKSI Aeromonas hydrophila
PADA IKAN LELE DUMBO (Clarias gariepinus)
SKRIPSI
Diajukan untuk Menempuh Ujian Sarjana Perikanan pada Fakultas Perikanan dan Ilmu Kelautan
BERTO MULIA WIBAWA NPM O10.050004
UNIVERSITAS PADJADJARAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
JURUSAN MANAJEMEN SUMBERDAYA PERAIRAN
JATINANGOR
2010
ABSTRACT
Berto Mulia Wibawa (Supervised by : Rosidah and Otong Suhara Djunaedi). 2010. The Efficiency and Effectiveness Test of HydroVac® Vaccine to Prevent Aeromonas hydrophila Infection in Catfish (Clarias gariepinus)
This research was conducted from July 5th to August 24th 2009 at Research Institute for Freshwater Aquaculture Sempur Bogor with the pre-research from January 4th to May 28th 2009. The objective of this experiment was to know the efficiency and effectiveness HydroVac® vaccine in order to prevent Aeromonas
hydrophila infection in catfish (Clarias gariepinus). The method of this research
was experimental method using Completely Randomized Design with 4 treatments and 4 replication, with the treatment : A (catfish without HydroVac® Vaccine immersion), B (catfish immersed by HydroVac® Vaccine 1st immersion), C (catfish immersed by HydroVac® Vaccine 3rd immersion), and D (catfish immersed by HydroVac® Vaccine 5th immersion). Observed parameters were survival rate, antibody titer, differential leucocyte count, phagocytic index, and water quality.
The result of experiment showed that HydroVac® Vaccine was effective and efficient to prevent Aeromonas hydrophila infection until 3rd immersion giving the survival rate percentage of 96,25%. Furthermore, application of the HydroVac® Vaccine could increase lymphocyte to provide the substance of fish immunity and maintain the phagositic cells to countering a new antigens when
Aeromonas hydrophila infection occurs.
KATA PENGANTAR
Segala puji syukur kehadirat Allah SWT, karena atas rahmat dan kemudahan-Nya penulis dapat menyelesaikan skripsi yang berjudul ”Uji Efisiensi dan Efektivitas Vaksin HydroVac® untuk Penanggulangan Infeksi Aeromonas
hydrophila pada Ikan Lele Dumbo (Clarias gariepinus)”.
Banyak pihak yang telah membantu penulis dalam proses penelitian dan penulisan usulan penelitian ini. Penulis mengucapkan terima kasih yang sebesar-besarnya kepada :
1. Dr. Ayi Yustiati, Ir., MS. sebagai Dekan Fakultas Perikanan dan Ilmu Kelautan, Universitas Padjadjaran.
2. Rosidah, Dra., M.Si sebagai ketua pembimbing yang telah memberikan saran dan arahan kepada penulis.
3. Prof. Dr. H. Otong Suhara Djunaedi, Ir., MS. sebagai anggota komisi pembimbing dan dosen wali yang telah memberikan saran dan arahan kepada penulis.
4. Roffi Grandiosa, S.Pi., M.Sc. sebagai dosen penelaah yang telah memberikan saran dan arahan kepada penulis.
5. Yeni Mulyani, S.Si., M.Si. sebagai asisten ahli yang telah memberikan saran dan arahan kepada penulis.
6. Dr. H. Amin Setiawan, Ir., MS. sebagai Kepala Laboratorium Akuakultur yang telah memberikan saran dan arahan kepada penulis.
7. Dr. H. Eddy Afrianto, Ir., M.Si sebagai Ketua Program Studi Perikanan Fakultas Perikanan dan Ilmu Kelautan, Universitas Padjadjaran.
8. Dr. Tri Heru Prihadi, sebagai Kepala Balai Riset Perikanan Budidaya Air Tawar Bogor.
9. Desy Sugiani, S.Pi., M.Si. sebagai pembimbing lapangan yang telah memberikan saran dan arahan pada penulis.
10. Drh. Uni Purwaningsih dan H. Taukhid, Ir., M.Sc yang telah memberikan saran dan arahan kepada penulis.
11. Pak Bambang, Pak Mihdar, Pak Wahyu, Pak Edi; atas bantuan dan dukungannya sehingga penelitian ini dapat berjalan dengan lancar.
12. Kedua orang tua dan adik yang tanpa henti selalu melimpahkan doa, kasih sayang, dorongan semangat, dan pengorbanannya kepada penulis.
13. Teman-teman FPIK 2005, Fahmi, Luqman, Yasin, Auliya dan teman-teman FPIK lainnya atas bantuannya, dukungan semangat, dan kebersamaannya.
Semoga amal kebaikan yang telah diberikan mendapat balasan yang setimpal dari Allah SWT. Akhir kata, penulis berharap skripsi ini dapat memberikan manfaat bagi kita semua.
Jatinangor, Februari 2010
DAFTAR ISI Bab Halaman KATA PENGANTAR ... i DAFTAR ISI ... ii DAFTAR GAMBAR ... v DAFTAR TABEL... vi
DAFTAR LAMPIRAN ... vii
I PENDAHULUAN 1.1 Latar Belakang ... 1 1.2 Identifikasi Masalah ... 3 1.3 Tujuan Penelitian ... 3 1.4 Kegunaan Penelitian ... 3 1.5 Kerangka Pemikiran ... 3 1.6 Hipotesis ... 5 II TINJAUAN PUSTAKA 2.1 Biologi Ikan Lele Dumbo (Clarias gariepinus) ... 6
2.2 Bakteri Aeromonas hydrophila ... 7
2.3 Sistem Kekebalan Tubuh Ikan ... 10
2.4 Vaksinasi Pada Ikan ... 11
2.5 Vaksin HydroVac® ... 13
2.6 Darah Ikan ... 17
2.7 Diferensial Leukosit ... 17
III. METODE PENELITIAN 3.1 Tempat dan Waktu Penelitian ... 22
3.2 Alat dan Bahan ... 22
3.2.1 Alat-Alat Penelitian ... 22 3.2.2 Bahan-Bahan Penelitian ... 24 3.3 Metode Penelitian ... 25 3.4 Prosedur Penelitian ... 26 3.4.1 Penelitian Pendahuluan ... 26 3.4.2 Penelitian Utama ... 26
3.5 Parameter yang Diamati ... 28
3.5.1 Tingkat Kelangsungan Hidup Ikan Uji... 28
3.5.2 Titer Antibodi ... 29
3.5.4 Indeks Fagositosis ... 30
3.5.5 Kualitas Air ... 32
3.6 Analisis Data Hasil Penelitian ... 32
IV HASIL DAN PEMBAHASAN 4.1 Tingkat Kelangsungan Hidup Ikan Uji ... 33
4.1.1 Masa Induksi Vaksin Ikan Uji ... 33
4.1.2 Masa Uji Tantang Ikan Uji ... 35
4.2 Gejala Klinis Ikan Lele Dumbo Selama Uji Tantang ... 39
4.3 Pengamatan Titer Antibodi ... 42
4.4 Pengamatan Diferensial Leukosit ... 43
4.5 Pengamatan Indeks Fagositosis ... 47
4.6 Kualitas Air Media ... 49
V KESIMPULAN DAN SARAN 5.1 Kesimpulan ... 50
5.2 Saran ... 50
DAFTAR PUSTAKA ... 51
DAFTAR GAMBAR
Nomor Judul Halaman
1. Kerangka Pemikiran Penelitian ... 5
2. Lele Dumbo ... 6
3. Tubuh Lele Dumbo Yang Terinfeksi Aeromonas hydrophila ... 7
4. Hubungan Antara Respon Imun Produksi dan Sel-Sel Memori Terhadap Vaksinasi Primer dan Sekunder ... 12
5. Vaksin HydroVac® Produksi BRPBAT Bogor ... 13
6. Sel Darah Putih Limfosit ... 18
7. Sel Darah Putih Monosit ... 19
8. Sel Darah Putih Neutrofil ... 20
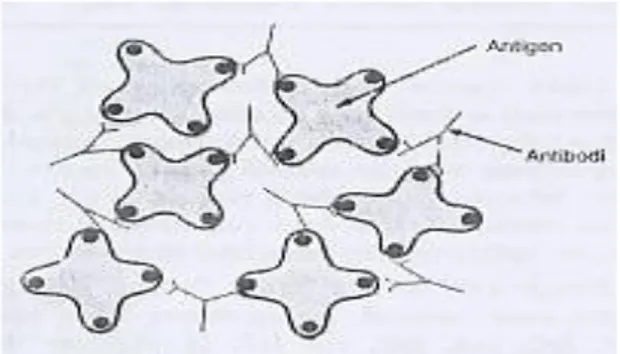
9. Molekul Antigen Terikat Satu Sama Lain oleh Antibodi Bivalen ... 20
10. Grafik Tingkat Kelangsungan Hidup Ikan Uji pada Masa Uji Tantang ... 38
11. Gejala Klinis Ikan Lele Dumbo Terserang Aeromonas hydrophila Saat Uji Tantang ... 40
12. Reaksi Aglutinasi Pada Uji Titer Antibodi ... 43
13. Gambar Sel Darah Ikan Lele Dumbo ... 44
14. Fagositosis Antigen oleh Sel Fagosit Fungsional (Penelanan Antigen) ... 47
DAFTAR TABEL
Nomor Judul Halaman
1. Mortalitas dan Tingkat Kelangsungan Hidup (KH) Ikan Uji
pada Minggu ke-1 dan ke-2 Masa Induksi Vaksin ... 33 2. Mortalitas dan Tingkat Kelangsungan Hidup (KH) Ikan Uji
pada Minggu ke-3 Masa Induksi Vaksin ... 34 3. Mortalitas dan Rata-Rata Tingkat Kelangsungan Hidup (KH)
Ikan Uji selama Dua Minggu Masa Uji Tantang ... 35 4. Rata-Rata Tingkat Kelangsungan Hidup Ikan Uji setelah Uji
Tantang dan Signifikansi Perlakuan Pemberian Vaksin ... 37 5. Gejala Klinis dan Respon Makan Harian Ikan Lele Dumbo
Selama Uji Tantang ... 41 6. Presentase Diferensial Leukosit (Limfosit, Monosit, dan
Neutrofil) Ikan Uji pada Masa Aklimatisasi, Induksi Vaksin,
dan Uji Tantang ... 45 7. Rata-Rata Nilai Fagositosis Sel Fagosit Fungsional Darah
Ikan Uji ... 48 8. Kisaran Kualitas Air Media Pemeliharaan dan Hasil
DAFTAR LAMPIRAN
Nomor Judul Halaman
1. Hasil Pengukuran Uji Titer Antibodi Ikan Lele Dumbo
(Clarias gariepinus pada Penelitian Pendahuluan ... 56 2. Hasil Pengukuran Uji Titer Antibodi Ikan Lele Dumbo
(Clarias gariepinus pada Penelitian Utama ... 58 3. Analisa Sidik Ragam (Uji F) dan Uji Duncan 5% dari Nilai
Mortalitas dan Tingkat Kelangsungan Hidup Ikan Uji Setelah
Diuji Tantang ... 61 4. Tabel Suhu Harian Lingkungan Pemeliharaan pada Masa Uji
Tantang ... 67 5. Tata Letak Akuarium Perlakuan ... 68 6. Prosedur Pembuatan Larutan Phosphate Buffer Saline (PBS)
di Balai Riset Perikanan Budidaya Air Tawar (BRPBAT),
Bogor. ... 69 7. Pembuatan Larutan Bakteri Staphylococcus aureus
Kepadatan 1010 cfu/ml dengan Spektrofotometer di Balai
Riset Perikanan Budidaya Air Tawar (BRPBAT), Bogor ... 70 8. Pembuatan Larutan Bakteri Aeromonas hydrophila
Kepadatan 108 cfu/ml dengan Spektrofotometer di Balai Riset
Perikanan Budidaya Air Tawar (BRPBAT), Bogor ... 71 9. Prosedur Penghitungan Nilai Kualitas Air di Balai Riset
Perikanan Budidaya Air Tawar (BRPBAT), Bogor ... 72 10. Komposisi Pakan ... 73
BAB I PENDAHULUAN
1.1 Latar Belakang Penelitian
Ikan lele dumbo (Clarias gariepinus) merupakan salah satu jenis ikan air tawar yang banyak dibudidayakan di Indonesia karena memiliki beberapa keunggulan, antara lain mudah dibudidayakan dan pertumbuhannya lebih cepat dibandingkan lele lokal (Clarias batrachus), namun dalam pembudidayaannya tidak terlepas dari berbagai hambatan diantaranya serangan penyakit yang disebabkan Bakteri Aeromonas hydrophila.
Bakteri Aeromonas hydrophila merupakan penyebab penyakit bercak merah atau disebut juga Motile Aeromonas Septicemia (MAS) yang sering menyerang ikan air tawar dan menginfeksi semua umur. MAS merupakan penyakit bakterial yang bersifat akut, menginfeksi semua umur dan semua jenis ikan air tawar, dapat mengakibatkan kematian hingga 100%, dan sering menimbulkan kerugian yang sangat signifikan (Kamiso dan Triyanto 1993). Komisi Kesehatan Ikan dan Lingkungan Nasional pada 2006 telah menetapkan jenis penyakit ini sebagai salah satu penyakit ikan utama di Indonesia.
Berbagai cara telah berhasil dilakukan untuk mengendalikan infeksi Bakteri Aeromonas hydrophila pada ikan baik secara kuratif (pengobatan) maupun preventif (pencegahan). Penggunaan antibiotik dan bahan kimia dapat digunakan untuk menanggulangi bakteri Aeromonas hydrophila, tetapi penggunaan antibiotik jika digunakan secara terus menerus akan menyebabkan resistensi bakteri-bakteri patogen terhadap antibiotik yang digunakan. Penggunaan bahan kimia juga memiliki dampak yang kurang baik karena dapat mencemari lingkungan (Supriyadi dan Rukyani 1990).
Penggunaan vaksin merupakan salah satu alternatif untuk mengendalikan infeksi Aeromonas hydrophila karena vaksinasi dapat meningkatkan kekebalan tubuh ikan terhadap serangan penyakit baik kekebalan spesifik maupun kekebalan non spesifik yang pada akhirnya dapat meningkatkan kelangsungan hidup ikan.
Vaksinasi dirasakan sangat efisien karena dengan cara ini dapat diperoleh kekebalan hanya dengan sekali atau dua kali pemberian vaksin sampai ikan dapat dipanen. Keuntungan lain dari vaksinasi adalah tidak adanya efek samping pada ikan berbeda halnya dengan penggunaan antibiotik yang mana dapat berdampak negatif pada ikan (Supriyadi dan Rukyani 1990).
Vaksinasi dapat dilakukan melalui penyuntikan, perendaman, penyemprotan, dan melalui pakan. Dari keempat cara tersebut perendaman dinilai lebih praktis, karena dapat digunakan untuk memvaksin ikan dalam jumlah besar (Ward 1982). Selain itu melalui perendaman tingkat stres yang dialami ikan lebih kecil dibandingkan dengan cara penyuntikan atau penyemprotan sehingga metode perendaman sudah umum dilakukan oleh para pembudidaya ikan di Indonesia (Supriyadi dan Rukyani 1990).
Salah satu produk vaksin yang dapat menanggulangi bakteri Aeromonas
hydrophila pada ikan adalah HydroVac® yang diproduksi oleh Balai Riset
Perikanan Budidaya Air Tawar Bogor. Berdasarkan hasil uji coba secara laboratoris maupun lapangan, aplikasi Vaksin HydroVac® terbukti efektif dalam pencegahan MAS pada ikan air tawar di Indonesia. Aplikasi Vaksin Hydrovac® dapat menekan tingkat kematian ikan akibat penyakit MAS sebesar 30-40%. Jika tanpa aplikasi vaksin, tingkat kematian yang diakibatkan MAS dapat mencapai 60-70% (Taukhid 2008).
Ketersediaan Vaksin HydroVac® jumlahnya terbatas dan hanya dapat dibeli di Balai Riset Perikanan Budidaya Air Tawar Bogor, sehingga para pembudidaya ikan dalam penggunaannya harus seefisien mungkin. Salah satu caranya adalah dengan menggunakan vaksin tersebut melalui perendaman secara berkali-kali, namun sampai saat ini belum diketahui sampai rendaman keberapa kali vaksin tersebut dapat digunakan dan masih efektif untuk meningkatkan kekebalan tubuh ikan terhadap infeksi MAS. Maka dari itu perlu dilakukan penelitian untuk mengetahui Efisiensi dan Efektivitas Vaksin HydroVac® dalam Penanggulangan Infeksi Aeromonas hydrophila pada Ikan Lele Dumbo.
1.2 Identifikasi Masalah
Sejauhmana efisiensi dan efektivitas penggunaan Vaksin HydroVac® melalui perendaman untuk penanggulangan infeksi bakteri Aeromonas hydrophila pada ikan lele dumbo (Clarias gariepinus), yang masih dapat meningkatkan kelangsungan hidup ikan.
1.3 Tujuan Penelitian
Penelitian ini bertujuan untuk menganalisis pada perendaman yang ke berapa Vaksin HydroVac® masih efektif untuk menanggulangi infeksi bakteri
Aeromonas hydrophila pada ikan lele dumbo, namun masih dapat meningkatkan
kelangsungan hidup ikan lele dumbo tersebut.
1.4 Kegunaan Penelitian
Penelitian ini diharapkan dapat memberikan informasi khususnya bagi para pembudidaya ikan lele dumbo mengenai penggunaan Vaksin HydroVac® terutama pada perendaman ke berapa yang masih efektif untuk menanggulangi infeksi Aeromonas hydrophila pada ikan lele dumbo, dan masih dapat meningkatkan kelangsungan hidup ikan lele dumbo dan pendapatan pembudidaya ikan lele dumbo tersebut.
1.5 Kerangka Pemikiran
Pada umumnya, munculnya penyakit pada ikan disebabkan oleh hasil interaksi yang tidak seimbang antara tiga komponen dalam ekosistem perairan yaitu inang (ikan) yang lemah, patogen yang ganas, serta kualitas lingkungan yang memburuk. Tanpa memperhatikan keseimbangan terhadap ketiga komponen tersebut, maka upaya pengendalian sangat sulit dicapai karena secara faktual ikan selalu hidup bersama dengan patogen yang setiap saat berpotensi menyebabkan penyakit (Snieszko 1973 dalam Taukhid 2004).
Vaksin adalah suatu antigen yang biasanya berasal dari suatu jasad patogen yang telah dilemahkan atau dimatikan, dengan tujuan untuk meningkatkan daya tahan (kekebalan) ikan atau menimbulkan kekebalan aktif terhadap suatu penyakit tertentu. Adapun yang disebut vaksinasi adalah suatu upaya pemberian vaksin ke dalam tubuh hewan (ikan) agar memiliki ketahanan terhadap serangan penyakit (Kordi 2004). Mekanisme kerja vaksin adalah mempengaruhi respon imun (kebal) yaitu sel-sel memori yang bersifat melindungi dan telah terbentuk pada waktu sebelumnya (Ellis 1988). Setelah dilakukan vaksinasi biasanya akan timbul suatu antibodi yang dapat melawan suatu penyakit. Antibodi akan terbentuk apabila sel penghasil antibodi yaitu sel limfosit (sel-B) telah berfungsi dengan baik. Antibodi yang spesifik akan terbentuk jika ada rangsangan antigen spesifik (penginfeksi) yang masuk ke dalam tubuh ikan yang berfungsi merangsang makrofag untuk memfagosit (memakan) patogen tersebut (Tizard 1988).
Penelitian mengenai vaksinasi melalui perendaman pada ikan untuk mengatasi penyakit bakterial telah dilakukan oleh Taufik dkk (1992). Penelitian tersebut dilakukan dengan melakukan perendaman vaksin Aeromonas hydrophila terhadap benih ikan gurame. Hasil penelitian menunjukkan bahwa kelangsungan hidup ikan setelah diuji tantang menghasilkan kelangsungan hidup tertinggi sebesar 75,11%. Dari hasil penelitian tersebut terbukti bahwa pemberian vaksin dapat menekan tingkat kematian ikan akibat infeksi Aeromonas hydrophila.
Berdasarkan hasil penelitian yang dilakukan oleh Rosiyanti (1991) menunjukkan bahwa data hasil penelitian uji titer antibodi ikan lele dumbo yang divaksin melalui perendaman dengan vaksin yang telah disimpan dalam es dan tanpa es dengan lama penyimpanan berbeda pada pengenceran 1:32 tingkat kelangsungan hidup ikan adalah sebesar 93,03% setelah diuji tantang dengan bakteri Aeromonas hydrophila dengan kepadatan 107.
Berdasarkan hasil penelitian pendahuluan yang telah dilakukan, penggunaan Vaksin HydroVac® sebanyak lima kali perendaman memberikan nilai titer antibodi yang berbeda untuk setiap kali perendaman, setiap perendaman
dilakukan selama 30 menit, dimana terjadi penurunan kualitas vaksin pada jumlah perendaman yang semakin banyak yang diakibatkan konsentrasi vaksin yang diserap oleh ikan pada setiap perendaman. Nilai titer antibodi pada perendaman ke-1 menunjukkan nilai paling tinggi yaitu 1:64, perendaman ke-2 dan ke-3 dengan nilai 1:32, perendaman ke-4 dan ke-5 dengan nilai 1:16, sedangkan perlakuan tanpa perendaman vaksin yaitu 1:8 (Lampiran 1). Pada perendaman ke-3 didapatkan nilai titer antibodi 1:ke-32, diduga pada perendaman ke-ke-3 tersebut dapat memberikan nilai kelangsungan hidup ikan yang tinggi setelah dilakukan diuji tantang.
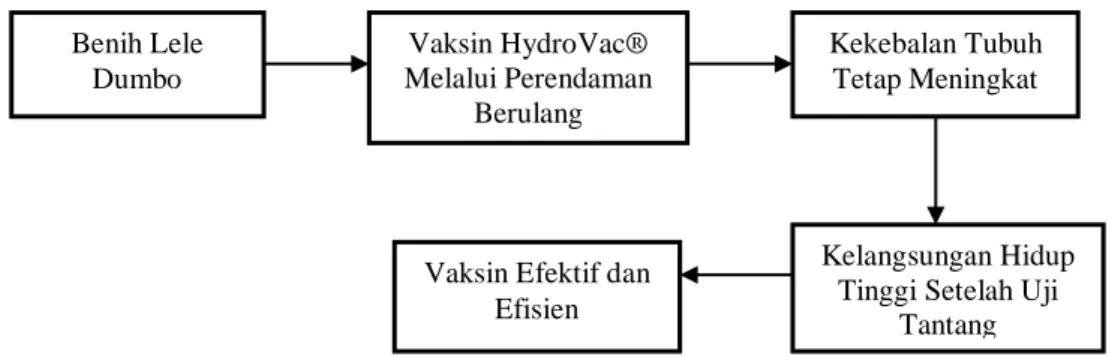
Gambar 1. Kerangka Pemikiran Penelitian
1.6 Hipotesis
Vaksin HydroVac® masih efektif dan efisien digunakan hingga perendaman yang ke-3 untuk menanggulangi infeksi Aeromonas hydrophila pada ikan lele dumbo.
Benih Lele Dumbo Vaksin HydroVac® Melalui Perendaman Berulang Kekebalan Tubuh Tetap Meningkat Kelangsungan Hidup Tinggi Setelah Uji
Tantang Vaksin Efektif dan
BAB II
TINJAUAN PUSTAKA
2.1 Biologi Ikan Lele Dumbo (Clarias gariepinus)
Menurut Saanin (1984) klasifikasi ikan lele dumbo adalah sebagai berikut: Kingdom : Animalia
Filum : Vertebrata Kelas : Pisces Sub kelas : Teleostei
Ordo : Ostariophysoidei Famili : Claridae
Genus : Clarias
Species : Clarias gariepinus
Gambar 2. Lele Dumbo Sumber : Soetomo (1989)
Ikan lele dumbo tersebar di rawa-rawa, danau, dan sungai di daerah tropis dan subtropis di benua Asia dan Afrika (Suyanto 1987). Ikan lele ini tumbuh cepat dan mencapai ukuran besar dalam waktu relatif pendek. Dalam waktu tiga bulan, ikan lele dumbo dapat mencapai bobot 150-200 gram per ekor dengan panjang 15-20 cm. Tubuh lele dumbo bersifat memanjang, kepala pipih dengan bentuk setengah lingkaran atau segitiga, kulit berlendir dan tidak bersisik. Kepala, punggung (dorsal) dan bagian sisi (lateral) berwarna agak gelap, bila menderita stress maka terjadi perubahan warna seperti mozaik hitam putih (Soetomo 1989).
Ikan lele dumbo mempunyai sirip tunggal pada punggung (dorsal), bagian ekor (caudal), dan bagian anal (dubur) serta sirip berpasangan yang terdapat di bagian dada dan bagian perut. Sirip dada mempunyai duri yang sangat keras dan
runcing yang disebut patil, yang berfungsi sebagai senjata dan alat pergerakan, dan tidak mengandung racun (Suyanto 1987).
Ikan lele ini memakan berbagai makanan dari zooplankton renik sampai ikan kecil dan menghisap organisme benthos dari dasar perairan. Ikan jenis catfish ini juga menyukai makanan berprotein yang membusuk, sehingga dapat digolongkan sebagai hewan pemakan bangkai (Suyanto 1987).
Alat pernafasan pada lele dumbo terdiri atas lima pasang insang, dimana pada setiap pasang terdapat tapis insang (gill rakers). Pada bagian atas insang terdapat organ pernafasan tambahan yang disebut arborescent yang merupakan lipatan kulit tipis yang menyerupai spon. Adanya organ tersebut memungkinkan lele dumbo hidup dengan kadar oksigen rendah yaitu 2 ppm (Teugels 1982).
Suhu optimal untuk pemeliharaan lele dumbo adalah 25-30°C, sedangkan untuk pertumbuhan larva diperlukan kisaran suhu antara 26-30°C. Nilai pH yang baik untuk budidaya lele dumbo antara 6,5-9 dan kandungan amonia dalain air tidak lebih dari 0,1 ppm (Soetomo 1989).
2.2 Bakteri Aeromonas hydrophila
Motile Aeromonas Septicemia (MAS) atau penyakit bercak merah
disebabkan oleh infeksi bakteri Aeromonas hydrophila. MAS merupakan penyakit bakterial yang bersifat akut, menginfeksi semua umur & semua jenis ikan air tawar, dapat mengakibatkan kematian hingga 100%, dan sering menimbulkan kerugian yang sangat signifikan (Kamiso dan Triyanto 1993).
Klasifikasi Aeromonas hydrophila menurut Kabata (1985) dalam Winarsih (1996) adalah sebagai berikut :
Filum : Protophyta Kelas : Schizomycetes Ordo : Pseudomonadales Famili : Vibrionaceae Genus : Aeromonas
Species : Aeromonas hydrophila
Bakteri Aeromonas hydrophila merupakan bakteri gram negatif yang berbentuk batang dengan ukuran 0,9-1,0 µm x 1,0-3,5 µm. Ciri-ciri lainnya adalah bakteri ini bergerak (motil) dengan flagel polar tunggal, berbentuk bulat dengan tepi rata, cembung dan koloninya berwarna kuning keputih-putihan (krem), dengan diameternya 2-3 mm (Austin dan Austin 1987). Bakteri ini termasuk patogen oportunistik yang hampir selalu berada di air (Agustina 1992). Patogen adalah mikroorganisme yang dapat menyebabkan penyakit yang spesifik, kebanyakan patogen bersifat fakultatif yaitu organisme yang hanya menimbulkan penyakit dalam kondisi tertentu saja (Dana dan Angka 1990).
Infeksi MAS ditandai dengan adanya luka di permukaan tubuh, lokal haemoragi terutama pada insang, borok (tukak), abses, exopthalmia dan perut gembung (Austin dan Austin 1987). Menurut Brenden dan Huizinga (1986) dalam Angka (1990), bakteri Aeromonas hydrophila menghasilkan Extra Cellular
Product (ECP) yang berupa enterotoxin dan hemolysis yang dapat menyebabkan
kerusakan sistemik sampai sistem hematopoietik dan hati yang akhirnya menyebabkan kematian. Amlacher (1961) dan Otte (1963) dalam Winarsih (1996) menyatakan bahwa tipe penyerangan bakteri dapat diklasifikasikan menjadi empat, yaitu :
1. Akut.
Ikan-ikan yang mengalami septicemia akan mati cepat dengan tanda-tanda penyakit belum terlalu terlihat (penularan hingga timbul gejala penyakit antara 1 atau 2 hari).
2. Sub akut.
Gejala yang timbul adalah dropsi, bisul-bisul, abses, dan pendarahan pada pangkal sirip (mortalitas dapat terjadi dalam beberapa hari)
3. Kronis.
Ditandai dengan adanya ulser dengan furunkel, dan bisul-bisul bernanah (abses) yang berlanjut lama (dalam periode waktu yang relatif lama (bulan/tahun)).
4. Laten.
Ikan tidak memperlihatkan gejala penyakit secara nyata, tetapi di dalam darah dan jaringan tubuhnya terdapat bakteri penyebab penyakit itu. Hal ini disebabkan karena ikan yang terserang penyakit ini memiliki kekebalan tubuh untuk melawan bakteri.
Menurut Soetomo (1989), sumber penularan bakteri Aeromonas
hydrophila adalah ikan, organisme lain, air, dan lumpur yang mengandung bakteri
ini. Aeromonas hydrophila dapat hidup di air dan lumpur, terutama yang kotor dan banyak bahan organiknya. Selain itu, beberapa faktor yang mendorong timbulnya penyakit oleh bakteri ini dan memperburuk kondisi ikan yang sakit adalah :
1. Kepadatan ikan.
2. Suhu yang terlalu tinggi atau terlalu rendah.
3. Penanganan yang kurang baik sehingga menimbulkan luka atau hilangnya sisik.
4. Luka oleh parasit eksternal.
5. Rendahnya oksigen terlarut dalam air sehingga menyebabkan penyakit secara bersama-sama dengan bakteri Aeromonas yang lain misalnya Aeromonas
salmoncida.
Gejala yang menyertai adanya bakteri Aeromonas hydrophila antara lain ulser yang berbentuk bulat atau tidak teratur dan berwarna merah keabu-abuan, inflamasi dan erosi di dalam rongga dan disekitar mulut seperti penyakit mulut merah (red mouth disease). Tanda lain adalah haemoragi pada sirip dan
eksopthalmia (pop eye) yaitu mata membengkak dan menonjol (Sarwono et al. 1993 dalam Winarsih 1996). Selain itu ciri-ciri lainnya adalah pendarahan pada tubuh, sisik terkuak, borok, nekrose, busung, dan juga ikan lemas sering di permukaan atau dasar kolam (Dana dan Angka 1990).
Ikan yang terserang bakteri Aeromonas hydrophila biasanya akan memperlihatkan gejala berupa : warna tubuh berubah menjadi gelap, kulitnya menjadi kasar dan timbul pendarahan yang selanjutnya akan menjadi borok, kemampuan berenangnya menurun dan sering mengap-mengap di permukaan air karena insangnya rusak sehingga sulit bernafas, dan sering terjadi pendarahan pada organ bagian dalam seperti hati (Soetomo 1989)
2.3 Sistem Kekebalan Tubuh Ikan
Ikan memiliki sistem pertahanan tubuh untuk melawan berbagai macam penyakit. Dalam tubuhnya, terdapat dua sistem pertahanan yaitu sistem pertahanan non spesifik dan spesifik. Sistem pertahanan non spesifik berfungsi untuk segala patogen yang menyerang dan bersifat permanen (selalu ada). Sistem pertahanan spesifik terdiri atas dua faktor yaitu antibodi dan seluler, dimana yang paling berperan adalah antibodi. Sistem pertahanan spesifik berfungsi melawan penyakit yang memerlukan rangsangan terlebih dahulu (Ellis 1988). Pada awal kehidupannya, sistem pertahanan ikan yang mula-mula berfungsi adalah sistem pertahanan non spesifik, sedangkan pertahanan spesifik (antibodi dan seluler) pada ikan baru berkembang dan dapat berfungsi dengan baik sekitar umur beberapa minggu setelah telur menetas (Ellis 1988)
Antibodi merupakan suatu senyawa protein yang terbentuk sebagai respon pertahanan terhadap masuknya bahan atau benda asing ke dalam tubuh, yang dapat bereaksi dengan antigen khusus (Tizard 1988). Menurut Anderson (1974), antigen adalah suatu partikel atau benda asing yang merangsang tubuh untuk memproduksi antibodi spesifik. Antibodi akan terbentuk apabila sel penghasil antibodi yaitu sel limfosit (sel-B) telah berfungsi dengan baik. Proses terbentuknya antibodi yang spesifik menurut Tizard (1988) adalah karena adanya
rangsangan antigen penginfeksi yang masuk ke dalam tubuh ikan kemudian difagositir (dimakan) oleh makrofag. Makrogfag adalah populasi sel yang masing-masing memiliki sebuah nukleus bundar, yang berfungsi memusnahkan antigen dengan cara fagositik. Makrofag akan mengirimkan sinyal kepada limfosit-B sehingga memberikan respon, yaitu dengan membesar dan berproliferasi ( proses perbanyakan secara cepat melalui pembelahan sel atau tunas secara terus menerus), yang memproduksi antibodi spesifik yaitu suatu senyawa yang dikenal sebagai imunoglobin sesuai dengan antigen yang member rangsangan (Anderson 1974).
2.4 Vaksinasi pada Ikan
Vaksin adalah suatu antigen yang biasanya berasal dari suatu jasad patogen yang telah dilemahkan atau dimatikan, dengan tujuan untuk meningkatkan daya tahan (kekebalan) ikan atau menimbulkan kekebalan aktif terhadap suatu penyakit tertentu. Adapun yang disebut vaksinasi adalah suatu upaya pemberian vaksin ke dalam tubuh hewan (ikan) agar memiliki ketahanan terhadap serangan penyakit (Kordi 2004).
Teknik pemberian vaksin bisa dilakukan dengan berbagai macam cara yaitu melalui penyuntikan (injeksi), pakan, perendaman, dan penyemprotan dengan tekanan tinggi. Metode pemberian vaksin yang paling efektif adalah dengan cara menyuntikan pada bagian intraperitoneal (rongga perut). Vaksinasi melalui suntikan biasanya diberikan sebanyak 0,1 ml pada ikan dengan ukuran bobot tubuh lebih dari 15 gram. Ukuran ikan kurang dari 10 gram, metode perendaman atau penyemprotan lebih efektif digunakan. Hal ini dilakukan untuk meminimasi stress pada ikan. Metode pemberian vaksin melalui makanan (pakan) yang dilakukan seminggu sekali atau dalam waktu lama (Ellis 1988).
Secara umum terdapat 2 tipe vaksin yaitu vaksin mati (inaktif) dan vaksin hidup (aktif). Vaksin mati diberikan dari patogen yang dinonaktifkan (dimatikan) atau diekstrak sedangkan vaksin hidup berupa organisme patogen yang dilemahkan tanpa atau dengan mengurangi virulensinya (Ellis 1988). Virulensi
adalah derajat patogenisitas dari suatu mikroorganisme. Pada umumnya, virus dimatikan dengan melarutkannya dalam formalin (Tonguthai et al 1999).
Faktor yang mempengaruhi vaksinasi pada ikan antara lain suhu, umur, dan bobot ikan. Suhu lingkungan yang rendah menyebabkan produksi antibodi lambat. Umur dan bobot ikan juga perlu diperhatikan karena organ tubuh ikan yang berfungsi merespon kekebalan adalah setelah umur 2 minggu. Ikan yang berumur kurang dari 2 minggu dan bobot tubuh kurang dari 1 gram belum mampu merespon vaksin secara efektif dan efisien (Kordi 2004).
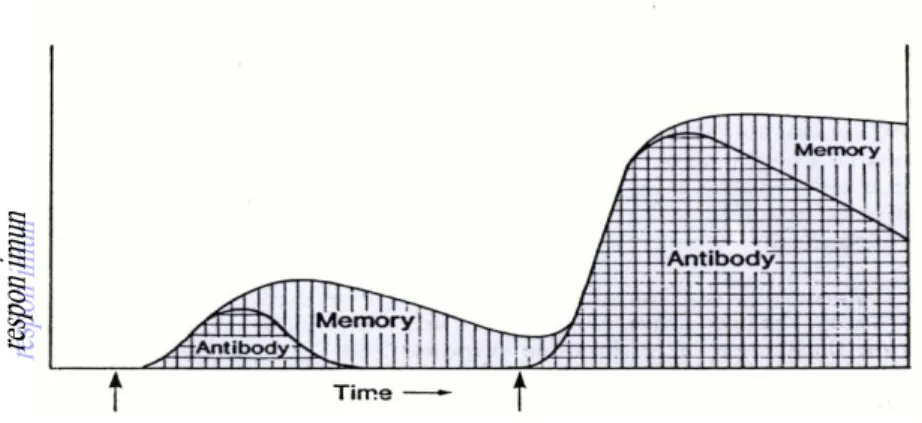
Mekanisme kerja vaksin adalah mempengaruhi respon imun (kebal) yaitu sel-sel memori yang bersifat melindungi dan telah terbentuk pada waktu sebelumnya (Ellis 1988). Adanya infeksi alami sebagai suatu pendorong produksi imun akan mempengaruhi memori sel (Gambar 3). Respon kekebalan setelah infeksi sekunder akan jauh lebih cepat dan lebih hebat (Fujaya 2004).
Gambar 4. Hubungan Antara Respon Imun Produksi Antibodi dan Sel-Sel Memori terhadap Vaksinasi Primer dan Vaksinasi Sekunder
(Sumber : Eliss 1988)
2.5 Vaksin HydroVac®
Vaksin HydroVac® adalah vaksin anti-Aeromonas hydrophila yang diproduksi oleh Balai Riset Perikanan Budidaya Air Tawar, Sempur, Bogor.
Vaksinasi Primer Infeksi Alami atau vaksinasi sekunder
Vaksin ini diciptakan sebagai salah satu produk biologi bagi upaya peningkatan produksi perikanan budidaya air tawar nasional. Berdasarkan hasil kajian laboratoris dan lapang, aplikasi vaksin HydroVac® dapat menekan tingkat kematian ikan akibat penyakit MAS sebesar 30-40% dibandingkan dengan tanpa aplikasi vaksin yang mencapai 60-70% (Taukhid 2008).
Gambar 5. Vaksin HydroVac® Produksi BRPBAT Bogor
Di dalam tubuh ikan terdapat imunoglobulin-like yang memiliki kemampuan untuk menginduksi kekebalan yang dapat dirangsang baik secara buatan maupun secara alamiah. Dari bukti tersebut, maka BRPBAT melakukan kajian imunologis terhadap seluruh koleksi isolat bakteri Aeromonas hydrophila dan diuji potensi imunogeniknya serta virulensinya secara in vitro dan in vivo untuk mendapatkan kandidat antigen yang memiliki potensi dapat bereaksi silang (cross-reactivity). Dari pengujian tersebut, terpilih bakteri Aeromonas hydrophila dengan kode isolat AH-26 sebagai kandidat yang paling potensial sebagai sumber antigen untuk dikembangkan sebagai vaksin (Taukhid 2008).
Vaksin diproduksi pada media komersial Tryptic Soy Agar (TSA) steril yang dituangkan pada cawan petri berdiameter 10 cm dengan ketebalan 2 mm. Inokulasi biakan bakteri dilakukan dengan menggunakan Jarum Ose yang bentuknya telah dimodifikasi sehingga bakteri akan tumbuh di seluruh permukaan cawan petri dengan ketebalan koloni yang merata (Taukhid 2008).
Inkubasi biakan dilakukan selama 24 jam dalam inkubator pada suhu 27 1oC. Pemanenan dilakukan dengan teknik sistem kering, sehingga seluruh biakan bakteri dapat dipanen secara sempurna. Bakteri dari setiap cawan petri dilarutkan dalam 10 ml saline 0,85% steril, dan melalui perbandingkan tersebut diperoleh konsentrasi bakterin sebesar 1013 cfu/ml. Proses inaktivasi antigen dilakukan melalui pemanasan (heat killed) pada suhu 90oC selama 2 jam dalam water bath, kemudian larutan bakal vaksin disimpan dalam lemari pendingin (suhu 4ºC) selama 24 jam. Untuk mendapatkan sediaan akhir vaksin, dilakukan pemecahan sel-sel antigen melalui proses sonikasi pada suhu dingin selama 4 x 15 detik yang dilakukan bersamaan dengan penambahan unsur preservatif yaitu phenol pada konsentrasi 0,3% (w/v). Produk akhir vaksin dikemas dalam botol volume 100 ml yang siap untuk digunakan (Taukhid 2008).
Salah satu diantara beberapa keunggulan yang dimiliki oleh vaksin ini adalah kemampuannya untuk menginduksi respon kebal spesifik yang dapat bereaksi silang (cross reactivity) terhadap beberapa strain bakteri Aeromonas
hydrophila patogen yang terdapat di beberapa wilayah pengembangan budidaya
ikan air tawar. Keunggulan ini memberi harapan bahwa produk vaksin ini dapat digunakan oleh seluruh pembudidaya ikan di seluruh wilayah sentra produksi ikan air tawar (Taukhid 2008).
Vaksin HydroVac® telah terbukti memiliki potensi untuk menginduksi respon kebal spesifik pada beberapa jenis ikan budidaya dari berbagai ukuran (mulai dari ikan yang berumur lebih dari 3 minggu sejak saat menetas). Proses induksi kekebalan umumnya mulai dapat terdeteksi setelah 2-3 minggu dari saat pemberian vaksin (Taukhid 2008).
Menurut Taukhid (2008), keberhasilan program vaksinasi tidak hanya ditentukan oleh keampuhan dari vaksin yang digunakan, tetapi juga sangat ditentukan oleh bagaimana dan kapan sebaiknya vaksin itu diberikan. Oleh karena itu, ada beberapa persyaratan yang sebaiknya diperhatikan sebelum melakukan vaksinasi terhadap ikan.
1. Sebaiknya ikan telah berumur 3 minggu atau lebih, karena pada umur kurang dari 3 minggu, organ-organ yang berperan dalam sistem pembentukan antibodi belum sempurna. Organ-organ yang terlibat dalam sistem kekebalan tubuh ikan meliputi “reticulo endothelial” (ginjal bagian depan, thymus, limfa, dan hati), limfosit, plasmosit dan fraksi serum protein tertentu.
2. Status kesehatan ikan harus dalam kondisi optimal, ikan yang sedang sakit misalnya karena terinfeksi patogen parasitik sebaiknya jangan divaksinasi terlebih dahulu sebelum parasit tersebut diberantas.
3. Suhu air relatif hangat (diatas 26 oC). Berdsarkan pengalaman, vaksinasi dan pemeliharaan ikan pada suhu air ≥ 28 o
C, respon antibodi yang terbentuk akan lebih cepat dibandingkan dengan suhu air yang lebih rendah.
4. Air yang digunakan untuk melakukan vaksinasi dan pemeliharaan ikan harus bebas dari unsur polutan. Air yang mengandung unsur polutan akan menghambat proses pembentukan antibodi (immunosuppressif) dalam tubuh ikan.
Pemberian Vaksin HydroVac® menurut Taukhid (2008) dapat dilakukan melalui beberapa cara, yaitu:
1. Perendaman dalam larutan vaksin selama 15-30 menit. Teknik ini sangat ideal untuk ikan-ikan benih dalam jumlah cukup banyak. Dosis vaksin yang digunakan adalah 100 ml vaksin untuk 1.000 liter air atau 1 ml vaksin untuk setiap 10 liter air. Selama proses vaksinasi sebaiknya dilengkapi dengan aerasi, dan kepadatan ikan tidak terlalu tinggi. Pengamatan tingkah laku ikan selama proses vaksinasi dilakukan secara cermat, apabila terlihat ikan yang mengalami masalah, sebaiknya segera dipindahkan ke air yang lebih segar. Melalui perendaman, vaksin masuk ke dalam tubuh ikan melalui kulit (sistem peredaran darah terbuka) atau insang (kapiler pembuluh darah dalam filamen insang) untuk selanjutnya masuk ke dalam darah.
2. Melalui pakan ikan (pellet). Teknik ini lebih sesuai untuk ikan-ikan yang sudah dipelihara dalam kolam pemeliharaan ataupun sebagai upaya vaksinasi ulang (booster). Dosis vaksin yang digunakan untuk teknik ini adalah 3-5 ml/kg bobot tubuh ikan, dan pemberian vaksin melalui pakan sebaiknya dilakukan selama 5-7 hari berturut-turut. Teknik mencampur vaksin dengan pakan ikan yang umum dilakukan adalah vaksin tersebut diencerkan beberapa kali dengan air bersih, kemudian dimasukkan ke dalam alat semprot. Semprotkan larutan vaksin tersebut ke pakan secara merata (jangan terlalu basah), dikeringkan dengan cara diangin-anginkan dan selanjutnya langsung diberikan kepada ikan. Akan lebih baik lagi apabila vaksin yang telah disemprotkan ke pakan diselaputi putih telur terlebih dahulu, dikeringkan dan kemudian baru diberikan kepada ikan. Sebaiknya pencampuran vaksin dilakukan tidak terlalu lama dari jadwal pemberian pakan.
3. Penyuntikan. Dilakukan terutama untuk ikan-ikan yang berukuran relatif besar dan berharga, misalnya induk ikan. Keuntungan pemberian vaksin melalui penyuntikan adalah 100% vaksin dapat masuk ke dalam tubuh ikan. Dosis vaksin yang diberikan melalui teknik ini adalah 0,2 ml/kg bobot tubuh ikan. Ada dua cara penyuntikan yang biasa dilakukan, yaitu dimasukkan ke rongga perut atau disebut intra peritional (IP) dan dimasukkan ke otot/daging atau disebut intra muscular (IM). Penyuntikan secara IP biasanya dilakukan di bagian perut, diantara kedua sirip perut atau sedikit di depan anus, dengan sudut kemiringan jarum suntik (needle) kira-kira 30o. Penyuntikan secara IM biasanya dilakukan di bagian punggung, pada ikan yang bersisik biasanya dilakukan di sela-sela sisik ke 3-5 dari kepala, dengan sudut kemiringan jarum suntik kira-kira 30-40o. Penyuntikan secara IP secara teoritis akan memberikan hasil yang lebih baik karena vaksin akan terdistribusi lebih cepat, namun cara ini memerlukan sedikit ketrampilan khusus terutama pada saat menusukkan jarum ke rongga perut. Apabila jarum yang masuk terlalu dalam dan sudut kemiringannya tidak
tepat, maka ada kemungkinan vaksin akan masuk ke usus atau gonad, dan dapat menusuk organ-organ internal lainnya. Sedangkan penyuntikan secara IM, meskipun distribusi vaksin relatif lebih lambat, namun pelaksanaannya lebih mudah dan aman. Satu hal yang perlu diperhatikan, di dalam cairan vaksin yang telah dimasukkan ke dalam alat suntik adalah tidak boleh ada gelembung udara, karena hal ini akan berakibat fatal yaitu mematikan ikan (Taukhid 2008).
2.6 Darah Ikan
Darah ikan tersusun atas cairan plasma dan sel-sel darah, yang terdiri dari sel darah merah (eritrosit), sel darah putih (leukosit), dan keping darah (trombosit). Volume darah dalam tubuh ikan teleostei sekitar 5% dari berat tubuh (Anderson 1974). Darah merupakan bagian terpenting dalam sistem sirkulasi yang mengedarkan media ke seluruh tubuh organisme (Chinabut et al. 1991).
2.7 Diferensial Leukosit
Sel darah putih (leukosit) pada tubuh organisme berfungsi membersihkan tubuh dari benda asing dan sebagai sistem pertahanan tubuh ikan yang bereaksi terhadap gangguan dari luar (Moyle and Cech 1988). Leukosit pada ikan berbentuk lonjong sampai bulat dan tidak berwarna. Sel darah putih dalam ikan jumlahnya berkisar antara 20.000-150.000 sel/mm3 (Lagler et al 1977).
Chinabut et al (1991) mengelompokan leukosit menjadi agranulosit dan granulosit yang didasarkan pada ada atau tidaknya butir-butir (granule) dalam sitoplasma. Agranulosit terdiri atas limfosit, trombosit, dan monosit sedangkan granulosit terdiri atas neutrofil, eosinofil, dan basofil. Sel-sel trombosit jumlahnya
paling banyak dan hampir setengah dari seluruh jumlah sel-sel leukosit (Lagler et al 1977).
Leukosit merupakan kesatuan sel darah putih yang bekerja secara bersama-sama melalui dua cara untuk mencegah penyakit. Dua cara tersebut adalah dengan merusak partikel asing (antigen) melalui proses fagositosit dan dengan membentuk antibodi atau limfosit yang dapat menghancurkan atau
membuat antigen tidak aktif (Guyton and Hall 1996 dalam Setiawan 1997). Bentuk dari sel darah putih yang berperan dalam merespon kekebalan terhadap antigen (partikel asing) dalam darah yaitu limfosit, monosit, dan neutrofil. Trombosit hanya berperan dalam proses pembekuan darah jika terjadi luka dan bukan pada proses fagositosis. Bentuk leukosit basofil dan eosinofil tidak ditemukan dalam ikan catfish maupun ikan mas (Chinabut et al 1991).
a. Limfosit
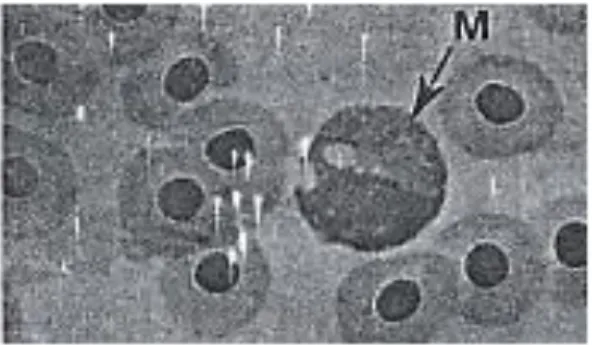
Limfosit berbentuk oval, biasanya lebih kecil daripada trombosit (Lagler et al 1977). Menurut Chinabut et al (1991), inti sel limfosit hampir memenuhi ruangan sel, berwarna gelap dengan sedikit tersisa sitoplasma, dan tidak bergranula yang mengelilingi inti (Gambar 6). Diameter limfosit berkisar antara 4,5-12 µm (Moyle and Cech 1988).
Gambar 6. Sel darah Putih Limfosit (Sumber : Chinabut et al 1991)
Limfosit dalam darah dibagi menjadi dua golongan populasi yaitu populasi limfosit “B” yang diduga berasal dari ginjal dan populasi limfosit “T” diduga berasal dari kelenjar thimus (Guyton and Hall 1996 dalam Setiawan 1997). Limfosit “B” berperan dalam pembentukan antibodi dan sel-sel memori, sedangkan limfosit “T” berperan mengatur kekebalan melalui pembentukan limfosit yang peka terhadap patogen dan merangsang produksi limfosit “B” (Guyton and Hall 1996 dalam Setiawan 1997, Fujaya 2004). Moyle and Cech (1988) menegaskan bahwa limfosit merupakan pemeran utama dalam mekanisme
imun spesifik dengan memproduksi antibodi. Antibodi dibentuk dari suatu proses yang terjadi dalam limfosit sebagai reaksi dari kehadiran antigen.
Antibodi biasanya memiliki suatu reaksi yang menyebabkan antigen (partikel asing) melekat pada molekul antibodi, juga dapat mengaktifkan suatu molekul non-antibodi yang disebut komplemen. Molekul antibodi dan komplemen bersama-sama dapat menimbulkan lisis dari sel-sel bakteri. Kekurangan limfosit dapat menurunkan konsentrasi antibodi dan menyebabkan meningkatnya serangan penyakit (Fujaya 2004).
b. Monosit
Menurut Chinabut et al (1991), monosit berbentuk tidak beraturan dan sering dikarakteristikan dengan keberadaan pseudopod, dan sitoplasma berwarna biru-hijau (Gambar 7). Ukuran monosit lebih luas dibandingkan neutrofil atau limfosit yaitu 10-14 µm (Watson et al 1963 dalam Chinabut et al 1991).
Gambar 7. Sel darah Putih Monosit (Sumber : Chinabut et al 1991)
Proporsi monosit jumlahnya paling sedikit bila dibandingkan dengan populasi sel lain dalam leukosit namun berperan penting dalam memfagosit mikroorganisme patogen (Moyle dan Cech 1988). Menurut Fujaya (2004), monosit lebih kuat dibanding neutrofil dalam memfagositosit bakteri, bahkan dapat memfagositosit partikel yang lebih besar. Monosit matang disebut makrofag dan mampu memfagosit 100 bakteri.
c. Neutrofil
Neutrofil berbentuk bundar dengan ukuran diameter 9-13 µm. Neutrofil mengandung banyak sitoplasma yang bergranula (Gambar 8). Sitoplasma berwarna ungu pucat atau biru, sementara inti berwarna biru gelap (Chinabut et al 1991).
Gambar 8. Sel darah Putih Neutrofil (Sumber : Chinabut et al 1991)
Neutrofil memiliki kemampuan memfagosit memakan dan menghancurkan partikel asing seperti halnya peran monosit (Ellis 1976 dalam Chinabut et al 1991). Menurut Fujaya (2004), fagositasi yang dilakukan oleh neutrofil dilakukan dengan mendekati ke segala arah sekitar partikel dengan pseudopodianya, selanjutnya pseudopodia satu sama lain saling bersatu pada tempat yang berlawanan sehingga menciptakan ruangan tertutup bagi partikel yang difagositosit tersebut (Gambar 9). Satu neutrofil dapat memfagositosit 5-20 bakteri sebelum neutrofil tersebut menjadi tidak aktif atau mati.
Gambar 9. Molekul Antigen Terikat Satu Sama Lain oleh Antibodi Bivalen (Sumber : Guyton and Hall 1996 dalam Martiani 2008)
Pada contoh kasus menurut Lagler et al. (1977), serangan penyakit bakterial pseudomonas terhadap ikan mas mempengaruhi proporsi jumlah sel-sel leukosit. Limfosit dalam darah ikan mas jumlahnya menurun dari 92,0% menjadi 49,4%, monosit menurun dari 5,7% menjadi 3,8%, sedangkan jumlah neutrofil menjadi meningkat dari 2,3% menjadi 12,6%. Infeksi tersebut menyebabkan aktivitas fagositosis oleh sel darah putih tidak stabil bahkan menunjukkan ketidakmampuan dalam memfagositosis bakteri tersebut.
BAB III
METODE PENELITIAN
3.1 Tempat dan Waktu Penelitian
Penelitian ini telah dilakukan di Laboratorium Basah dan Laboratorium Patologi Balai Riset Perikanan Budidaya Air Tawar (BPRBAT), Bogor. Balai tersebut terletak di Jl. Sempur No. 1 Bogor Telp (0251) 8313200. Pelaksanaan penelitiannya di Laboratorium Basah untuk pemeliharaan ikan dan Laboratorium Patologi untuk pengujian penyakit ikan.
Penelitian pendahuluan telah dilaksanakan pada tanggal 4 Januari sampai dengan 28 Mei 2009, sedangkan penelitian utama dilaksanakan pada tanggal 5 Juli sampai dengan 24 Agustus 2009.
3.2 Alat dan Bahan
3.2.1 Alat-Alat Penelitian
Alat-alat penelitian yang digunakan terdiri atas : 1. Alat-alat selama masa pemeliharaan ikan
a. Akuarium dengan ukuran (60x40x35) cm3 sebanyak 16 buah sebagai wadah ikan uji yang telah disterilisasi dengan rendaman KMnO4 sebanyak
5 ppmselama 24 jam
b. Bak fiber volume 300 liter dengan tutupnya sebanyak 5 buah untuk wadah aklimatisasi ikan uji. Semua bak fiber tersebut telah disterilisasi dengan rendaman KMnO4 sebanyak5 ppm selama satu hari
c. Blower sebanyak 1 buah, selang aerasi dan batu aerasi sebanyak 28 buah untuk memasok oksigen pada setiap akuarium dan bak fiber.
d. Termometer minimum-maksimum merk Brilian dengan ketelitian 1oC sebanyak 5 buah untuk mengukur suhu air dan suhu udara pada bak fiber ikan uji (MAS negatif)
f. Timbangan analitik merk Adam Equipment QT-5000 dengan berat maksimal 5000 gram dan ketelitian 1 gram untuk menimbang bobot ikan dan berat pakan
g. Selang plastik sebanyak 4 buah untuk penyiphonan dan mengganti air h. Serok kain kasa sebanyak 8 buah untuk mengambil ikan uji
i. Wadah plastik sebagai tempat pakan 2. Alat-alat untuk Uji Titer Antibodi
a. Jarum suntik dengan merek Terumo Disposable Syringe ketelitian 1 ml untuk mengambil darah ikan dan bakteri
b. Mesin spektrofotometer untuk menghitung kepadatan bakteri c. Cawan petri untuk menanam bakteri
d. Tabung Eppendorf 2,0 ml sebagai alat untuk menyimpan darah e. Mikroplate untuk pengamatan titer antibodi
f. Mikropipet 5-50 µl dan tipsnya untuk menghomogenkan serum pada
mikroplate
g. Mikropipet 50-200 µl dan tipsnya untuk menghomogenkan serum pada
mikroplate
h. Vortex dengan merek Gilson untuk menghomogenkan sampel
i. Mini sentrifuge dengan merek Mini Spin Eppendorf untuk memisahkan serum dari darah
j. Refrigerator untuk penyimpanan serum 3. Alat-alat untuk Uji Diferensiasi Leukosit
a. Alat suntik ukuran 1 ml merk Terumo Disposable Syringe ketelitian 0,1 ml untuk mengambil darah ikan
b. Staining jar sebagai wadah bahan fiksasi dan pewarnaan c. Slide glass sebagai alat untuk membuat preparat ulas darah
d. Mikroskop Photo merk Olympus BX51 dengan pembesaran 10-200x untuk mengamati dan dokumentasi leukosit
e. Hand counter untuk menghitung jumlah leukosit yang akan diamati dalam preparat ulas darah
4. Alat-alat untuk Uji Indeks Fagositosis
a. Mikroplate volume 3 ml dengan merk Vacuntainer®
b. Tabung Erlenmeyer 500 ml dan 1 L untuk wadah pembuatan media
c. Gelas ukur 500 ml dan 1 L merk Pyrex Iwaki Glass untuk mengukur aquades
d. Cawan petri untuk media inkubasi bakteri
e. Jarum suntik dengan merk Terumo Disposable Syringe ketelitian 1 ml untuk pengambilan darah dan pengambilan Aeromonas hydrophila
f. Jarum ose untuk pengambilan dan penginokulasian bakteri
g. Mikroskop foto merk Olympus BX 51 dengan pembesaran 10-200x untuk mengamati preparat
5. Alat-alat untuk pengamatan kualitas air
a. Termometer air raksa dengan skala 0-100oC untuk mengukur suhu air b. pH meter untuk mengukur derajat keasaman
c. Camerer Water Sampler sebagai wadah sampel air untuk diuji kandungan ammonia
d. Spektrofotometer untuk menghitung kadar ammonia
3.2.2 Bahan Bahan Penelitian
Bahan-bahan yang digunakan dalam penelitian ini antara lain : 1. Ikan uji
Ikan uji yang digunakan dalam penelitian ini adalah ikan lele dumbo sebanyak 800 ekor yang berasal dari kelompok perikanan Parung, Bogor, Jawa Barat. Ukuran bobot tubuh ikan lele dumbo berkisar antara 10-12 gram. 2. Bahan-bahan selama masa pemeliharaan ikan
a. Pelet ikan apung merek T782-K
b. KMNO4 100% yang digunakan untuk sterilisasi alat pemeliharaan
3. Bahan-bahan untuk uji titer antibodi a. Mikroplate sebanyak 2 buah
c. Bakteri Aeromonas hydrophila yang telah dilarutkan dalam salin 0,85% dengan kepadatan 108cfu
d. Serum murni sebanyak 100 µl e. Salin 0,85% sebanyak 100 ml
4. Bahan-bahan untuk membuat preparat ulas darah a. Methanol untuk proses fiksasi
b. Gymnesa 100% untuk pewarnaan c. Akuades untuk mencuci preparat 5. Bahan untuk Indeks Fagositosis
a. Tri triplex II sebagai cairan anti koagulan b. Triptic Soya Agar sebagai bahan tanam bakteri
c. Phosphat Buffer Saline (PBS) 0,85% sebagai cairan fisiologis bakteri d. Media selektif Aeromonas hydrophila
6. Bahan untuk vaksinasi
a. Vaksin HydroVac® sebanyak 5 botol
3.3 Metode Penelitian
Penelitian ini dilakukan dengan menggunakan metode rancangan acak lengkap (RAL). Jumlah perlakuan pada penelitian ini sebanyak empat perlakuan dan masing-masing perlakuan diulang empat kali. Setiap wadah perlakuan diisi benih lele dumbo sebanyak 20 ekor. Adapun perlakuan tersebut yaitu :
Perlakuan A : Benih lele dumbo tidak diberi Vaksin HydroVac®
Perlakuan B : Benih lele dumbo direndam oleh Vaksin HydroVac® rendaman ke-1
Perlakuan C : Benih lele dumbo direndam oleh Vaksin HydroVac® rendaman ke-3
Perlakuan D : Benih lele dumbo direndam oleh Vaksin HydroVac® rendaman ke-5
3.4 Prosedur Penelitian
3.4.1 Penelitian Pendahuluan
Penelitian pendahuluan bertujuan untuk menentukan sampai ulangan rendaman keberapa Vaksin HydroVac® masih dapat digunakan untuk penanggulangan infeksi Aeromonas hydrophila pada benih lele dumbo. Penelitian pendahuluan menggunakan benih lele berukuran 5-7 cm dengan bobot 4-6 g. Penelitian ini dilakukan dengan 5 perlakuan dan 1 kontrol dengan lama perendaman setiap perlakuan selama 30 menit. Setiap akuarium diisi masing-masing dengan 25 ekor benih, diberi pakan 3 kali sehari secara ad libitum pada pukul 09.00, 13.00, dan 17.00, serta dilakukan penyiphonan 2 hari sekali pada pagi hari. Pengamatan titer antibodi dilakukan 1 minggu sekali setiap minggu sebelum dan sesudah vaksinasi. Pengamatan titer antibodi bertujuan untuk mengetahui peningkatan kekebalan tubuh ikan setelah pemberian vaksin.
3.4.2 Penelitian Utama
Langkah-langkah pada penelitian utama meliputi persiapan penelitian, pemeliharaan ikan, pemberian vaksin, uji tantang, dan pengamatan.
A. Persiapan Penelitian
Persiapan penelitian mencakup : 1. Sterilisasi Wadah Penelitian
Wadah penelitian dan alat-alat yang digunakan saat proses pemeliharaan serta pengamatan, terlebih dahulu dibersihkan dan direndam dalam larutan Kalium Permanganat (KMnO4) 100% selama 24 jam kemudian
dikeringkan.
2. Persiapan Bahan dan Media
Persiapan ikan uji dilakukan dengan mengambil ikan sebanyak 800 ekor dari Kelompok Perikanan Parung Bogor. Persiapan media dilakukan dengan pengisian air pada wadah akuarium sebanyak 60 L dan bak fiber sebanyak 300 L.
3. Aklimatisasi Ikan
Sebelum diberi perlakuan pemberian Vaksin HydroVac®, kelompok ikan lele dumbo dimasukkan ke dalam bak fiber yang berukuran 300 L sebanyak 5 buah yang masing-masing berisi 200 ekor ikan lele dumbo. Ikan diaklimatisasi selama satu minggu. Selama proses aklimatisasi, kelompok ikan uji diberi pakan tenggelam komersial dengan frekuensi pemberian tiga kali per hari sebanyak 3% dari rata-rata bobot. Penyiponan dilakukan setiap dua hari sekali pada pagi hari.
B. Pemberian Vaksin HydroVac®
Ikan diberi Vaksin HydroVac® dengan cara perendaman selama 30 menit setelah masa aklimatisasi dengan dosis sebanyak 1 ml vaksin pada 10 L air. Setelah diberikan vaksin, ikan lele dumbo dipelihara kembali pada bak fiber selama 2 minggu kemudian dipindahkan ke dalam akuarium masing-masing sebanyak 20 ekor untuk dipelihara selama 1 minggu sebelum masa uji tantang.
C. Pemeliharaan Ikan
Setelah ikan direndam dengan vaksin, dilakukan pemeliharaan ikan selama tiga minggu. Ikan dipelihara dan diberi pakan secara ad libitum. Pakan yang digunakan adalah pelet ikan apung komersial yang diberikan dengan frekuensi tiga kali per hari yaitu pada pukul 08.00, 12.00, dan 16.00. Penyiponan dilakukan tiga hari sekali pada pagi hari.
D. Postulat Koch
Tujuan dilakukannya Postulat Koch adalah untuk mengetahui reaksi virulensi stok bakteri Aeromonas hydrophila yang telah mengalami kultur ulang dalam media Tryptic Soy Agar (TSA), untuk mengembangkan daya patogenitasnya perlu dilakukan reinfeksi bakteri ke ikan lele dumbo melalui penyuntikan dengan masa inkubasi ±24 jam. Amati gejala klinis dan
kematiannya selama 2 hari, apabila ikan yang diinfeksi menunjukkan gejala ikan yang terserang Aeromonas hydrophila maka ambil isolat bakterinya dari luka, darah, dan ginjal untuk diidentifikasi dan dikultur ulang. Postulat Koch ini penting karena strain Aeromonas hydrophila ada yang patogen dan non patogen (Taufik dan Wong 1990).
E. Uji Tantang
Pada minggu ke-3 setelah pemberian vaksin, dilakukan uji tantang dengan cara menginfeksikan ikan lele dengan bakteri Aeromonas hydrophila kepadatan 108cfu yang telah ditingkatkan virulensinya pada ikan uji. Infeksi bakteri dilakukan dengan metode penyuntikan sebanyak 0,2 ml pada bagian punggung ikan. Pada masa uji tantang, ikan uji tetap diberi pakan dan dilakukan penyiphonan. Uji tantang dilakukan selama 2 minggu bersamaan dengan pengamatan kelangsungan hidup ikan.
3.5 Parameter yang Diamati
3.5.1 Tingkat Kelangsungan Hidup Ikan Uji
Tingkat kelangsungan hidup (KH) diamati pada masa uji tantang. Pengamatan parameter tersebut dilakukan setiap hari. Perhitungan parameter tingkat kelangsungan hidup menurut Effendie (1997) adalah :
100% Nt KH No Keterangan :
KH = Tingkat kelangsungan hidup ikan (%)
Nt = Jumlah ikan lele dumbo yang hidup pada akhir pengamatan No = Jumlah ikan lele dumbo pada awal pengamatan
3.5.2 Titer Antibodi
Pengamatan titer antibodi dilakukan sebanyak empat kali, satu minggu sebelum vaksinasi, tiga minggu setelah vaksinasi, dan setiap minggu pada masa uji tantang. Pengamatan tersebut dilakukan untuk mengamati antibodi yang terdapat pada darah ikan sebelum dan setelah vaksinasi. Pengamatan dilakukan terhadap sampel ikan sebanyak tiga ekor yang diambil dari tiap wadah perlakuan.
Cara pengambilan dan penghitungan titer antibodi adalah :
- Darah diambil menggunakan jarum suntik ketelitian 1 ml, kemudian dimasukkan ke dalam tabung eppendorf.
- Darah disentrifuge, supernatannya diambil berupa serum. - Uji aglutinasi dilakukan dalam mikroplate :
Larutan salin dimasukkan ke dalam masing-masing sumur sebanyak 50 µl, kemudian masukkan 100 µl serum ke dalam sumur pertama. Diaduk menjadi homogen, lalu pindahkan ke tabung kedua sebanyak 50 µl dan seterusnya hingga terjadi serial pengenceran sampai sumur ke-12. Serial pengenceran berupa deret ukur 1, 2, 4, 8, 16, 32, dan seterusnya. Bakteri sebanyak 50 µl dengan kepadatan 108 sel/ml diinokulasikan kedalam masing-masing sumur sampai sumur ke-12. Inkubasi sampai terjadi aglutinasi berupa gumpalan-gumpalan berupa partikel kecil pada dasar sumur dari mikroplate.
Metode penghitungan yang digunakan adalah Metode Titrasi (Kebalikan Pengenceran). Metode titrasi adalah prosedur pengujian untuk menemukan adanya antibodi khusus yang disusun dalam seri pengenceran bertingkat dari semua yang diuji. Perbandingan terbalik pengenceran tertinggi yang memberikan reaksi positif dikenal sebagai titer dan merupakan ukuran jumlah antibodi dalam serum tadi (Tizard 1988).
3.5.3 Diferensial Leukosit
Pengamatan diferensial leukosit dilakukan sebanyak empat kali yaitu pada satu minggu sebelum vaksinasi, tiga minggu setelah vaksinasi, dan setiap minggu
pada masa uji tantang. Pengamatan ini dilakukan untuk mengetahui perubahan jumlah total leukosit sehingga dapat mengetahui respon kekebalan tubuh ikan pasca vaksinasi dan uji tantang. Pengamatan dilakukan terhadap sampel ikan sebanyak enam belas ekor yang diambil dari setiap perlakuan dan setiap ulangan.
Diferensial leukosit dihitung untuk mengetahui respon kekebalan tubuh setelah pasca vaksinasi dan pasca uji tantang. Sel-sel darah putih yang dihitung pada penelitian ini adalah sel-sel darah limfosit, monosit, dan neutrofil. Dari 100 sel darah putih tersebut, dihitung berapa jumlah sel limfosit, monosit, dan neutrofil. Secara matematika, perhitungan diferensial leukosit menurut Kent and Thunet (1987) sebagai berikut :
Presentase Limfosit = 100 L x 100% Presentase Monosit = 100 M x 100% Presentase Neutrofil = 100 N x 100% Keterangan :
L = Jumlah Sel Darah Putih Limfosit M = Jumlah Sel Darah Putih Monosit N = Jumlah Sel Darah Putih Neutrofil L + M + N = 100 sel
L% + M% + N% = 100%
3.5.4 Indeks Fagositosis
Pengamatan Indeks Fagositosis dilakukan sebanyak empat kali yaitu satu minggu sebelum vaksinasi, tiga minggu setelah vaksinasi, dan setiap minggu pada masa uji tantang. Pengamatan pada masa aklimatisasi untuk mengetahui kemampuan sel-sel fagosit dalam melakukan mekanisme fagositosis sebelum diberi perlakuan Vaksin HydroVac®, dan pengamatan pada akhir perlakuan untuk mengetahui kemampuan leukosit dalam melakukan mekanisme fagositosis.
Aktivitas fagositik dilakukan berdasarkan persen (%) sel darah putih yang memfagosit dengan sel darah putih yang tidak memfagosit. Perhitungannya secara matematika menurut Anderson dan Siwicki (1993) dalam Martiani (2008) adalah :
Indeks Fagositosis = 100%
100
Sel Darah Putih Yang Memfagosit x
Prosedur pembuatan preparat Indeks Fagosit : 1. Larutan salin 0,85% disiapkan
2. Sampel darah diambil sebanyak 0,1 ml
3. 0,1 ml bakteri Staphilococcus aureus dengan pengenceran 1 x 107 yang telah ditambahkan larutan salin ditempatkan pada tabung mikrotiter
4. Bakteri dicampurkan dengan sampel darah, kemudian diinkubasi selama satu jam pada suhu ruangan
5. Darah sebanyak 0,05 ml diteteskan pada gelas objek (1)
6. Gelas objek (2) diletakkan dengan sudut 45º diatas gelas objek (1), kemudian gelas objek (2) digeser mengulas ke arah belakang dan ke depan hingga darah menyebar dan membentuk lapisan darah yang tipis
7. Gelas objek (1) yang telah diulas darah diangin-anginkan sampai kering 8. Setelah kering, gelas objek (1) yang telah diulas darah tersebut difiksasi
dengan methanol selama 5 menit
9. Gelas objek (1) yang telah diulas darah diwarnai dengan larutan gymsa 100% selama 30 menit
10. Gelas objek (1) yang telah diulas darah dicuci dengan air dan dikeringkan 11. Hasilnya diamati dengan mikroskop dan sel fagositnya dihitung
3.5.5 Kualitas Air
Parameter kualitas air yang diamati selama penelitian antara lain suhu, derajat keasaman dan ammonia. Pengamatan parameter tersebut dilakukan satu minggu sekali mulai dari masa aklimatisasi sampai masa uji tantang. Pada saat masa uji tantang, suhu diamati setiap hari.
3.6 Analisis Data Hasil Penelitian
Tingkat kelangsungan hidup (KH) ikan uji setelah diuji tantang dianalisis dengan analisis sidik ragam menggunakan uji F, apabila terdapat perbedaan antara perlakuan dianalisis dengan uji Duncan dengan taraf kepercayaan 5 %. Adapun hasil penghitungan titer antibodi, diferensial leukosit, indeks fagositosis, dan kualitas air dianalisis secara deskriptif. Metode perhitungan sidik ragam menurut Gasperz (1991) adalah :
Xij = i + j + ij Keterangan :
Xij = Hasil pengamatan pada perlakuan ke-i ulangan ke-j
i = Rata-rata umum
j = Pengaruh perlakuan ke-i
BAB IV
HASIL DAN PEMBAHASAN
4.1 Tingkat Kelangsungan Hidup Ikan Uji 4.1.1 Masa Induksi Vaksin Ikan Uji
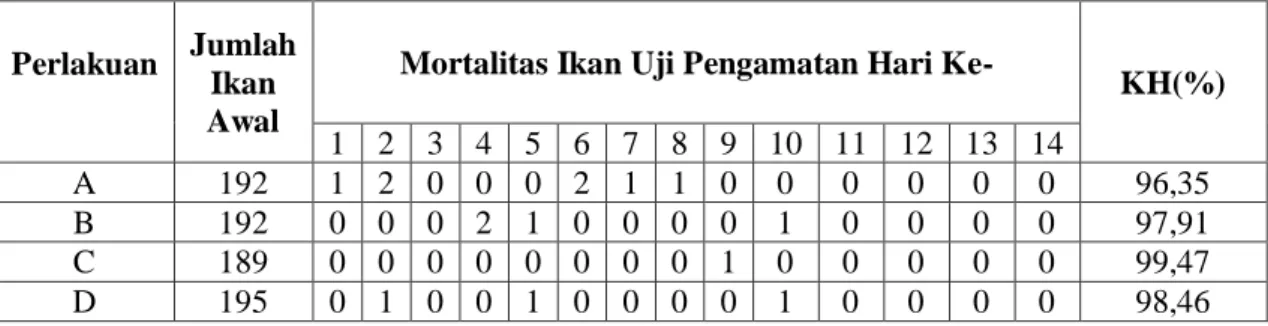
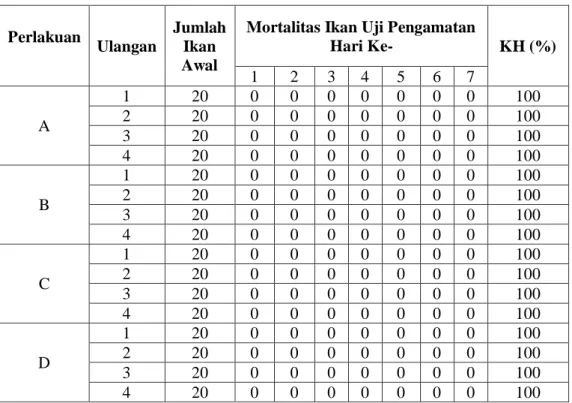
Hasil pengamatan terhadap mortalitas dan tingkat kelangsungan hidup ikan uji selama tiga minggu masa induksi vaksin, menunjukkan tingkat kelangsungan hidup yang tinggi. Sampai dengan minggu ke-2 masa induksi vaksin ikan uji dipelihara dalam bak fiber, tingkat kelangsungan hidup yang diperoleh adalah perlakuan A (benih lele dumbo tidak diberi Vaksin HydroVac®) 96,35%, perlakuan B (benih lele dumbo direndam oleh Vaksin HydroVac® rendaman ke-1) 97,91%, perlakuan C (benih lele dumbo direndam oleh Vaksin HydroVac® rendaman ke-3) 99,47%, dan perlakuan D (benih lele dumbo direndam oleh Vaksin HydroVac® rendaman ke-5) 98,46% (Tabel 1). Tingkat kelangsungan hidup pada minggu ke-3 masa induksi vaksin setelah dipindahkan ke akuarium pada seluruh perlakuan adalah sebesar 100% (Tabel 2). Tingginya kelangsungan hidup pada seluruh pelakuan vaksinasi (B, C, dan D) menunjukkan bahwa Vaksin HydroVac® aman, tidak berbahaya bagi kesehatan ikan, serta tidak menimbulkan penyakit. Hal ini sesuai dengan pernyataan Sjamsudin (1977) bahwa salah satu persyaratan vaksin yang baik adalah aman terhadap resipien, yaitu tidak toksik, tidak menganggu kesehatan ikan, dan tidak menimbulkan efek samping pasca vaksinasi.
Tabel 1. Mortalitas dan Tingkat Kelangsungan Hidup (KH) Ikan Uji pada Minggu ke-1 dan ke-2 Masa Induksi Vaksin
Perlakuan Jumlah Ikan Awal
Mortalitas Ikan Uji Pengamatan Hari Ke-
KH(%) 1 2 3 4 5 6 7 8 9 10 11 12 13 14 A 192 1 2 0 0 0 2 1 1 0 0 0 0 0 0 96,35 B 192 0 0 0 2 1 0 0 0 0 1 0 0 0 0 97,91 C 189 0 0 0 0 0 0 0 0 1 0 0 0 0 0 99,47 D 195 0 1 0 0 1 0 0 0 0 1 0 0 0 0 98,46
Keterangan :
A = Benih lele dumbo tidak diberi Vaksin HydroVac®
B = Benih lele dumbo direndam oleh Vaksin HydroVac® rendaman ke-1 C = Benih lele dumbo direndam oleh Vaksin HydroVac® rendaman ke-3 D = Benih lele dumbo direndam oleh Vaksin HydroVac® rendaman ke-5 KH = Kelangsungan hidup
Tabel 2. Mortalitas dan Tingkat Kelangsungan Hidup (KH) Ikan Uji pada Minggu ke-3 Masa Induksi Vaksin
Perlakuan
Ulangan
Jumlah Ikan Awal
Mortalitas Ikan Uji Pengamatan
Hari Ke- KH (%) 1 2 3 4 5 6 7 A 1 20 0 0 0 0 0 0 0 100 2 20 0 0 0 0 0 0 0 100 3 20 0 0 0 0 0 0 0 100 4 20 0 0 0 0 0 0 0 100 B 1 20 0 0 0 0 0 0 0 100 2 20 0 0 0 0 0 0 0 100 3 20 0 0 0 0 0 0 0 100 4 20 0 0 0 0 0 0 0 100 C 1 20 0 0 0 0 0 0 0 100 2 20 0 0 0 0 0 0 0 100 3 20 0 0 0 0 0 0 0 100 4 20 0 0 0 0 0 0 0 100 D 1 20 0 0 0 0 0 0 0 100 2 20 0 0 0 0 0 0 0 100 3 20 0 0 0 0 0 0 0 100 4 20 0 0 0 0 0 0 0 100 Keterangan :
A = Benih lele dumbo tidak diberi Vaksin HydroVac®
B = Benih lele dumbo direndam oleh Vaksin HydroVac® rendaman ke-1 C = Benih lele dumbo direndam oleh Vaksin HydroVac® rendaman ke-3 D = Benih lele dumbo direndam oleh Vaksin HydroVac® rendaman ke-5 KH = Kelangsungan hidup
4.1.2 Masa Uji Tantang Ikan Uji
Sebelum masa uji tantang, terlebih dahulu dilakukan percobaan penginfeksian bakteri Aeromonas hydrophila dengan cara perendaman dan penyuntikan masing-masing dengan kepadatan bakteri 108 cfu pada ikan tanpa perlakuan vaksinasi, percobaan ini adalah untuk membandingkan gejala klinis ikan yang direndam dan disuntik oleh Aeromonas hydrophila. Hasil percobaan menunjukkan bahwa cara perendaman memang menunjukkan gejala klinis terserang Aeromonas hydrophila dengan munculnya bintik-bintik merah pada bagian tubuh ikan, namun setelah satu minggu bintik-bintik merah tersebut kemudian hilang dan ikan sembuh padahal ikan tersebut adalah perlakuan tanpa vaksinasi, sedangkan cara penyuntikan lebih efektif memunculkan borok-borok pada bagian tubuh ikan lele dumbo dan mengakibatkan kematian dalam selang waktu 3 sampai dengan 7 hari. Dari percobaan tersebut maka metode uji tantang yang dipilih adalah metode penyuntikan karena lebih dapat menimbulkan efek gejala klinis ikan terserang Aeromonas hydrophila daripada metode perendaman.
Mekanisme masuknya bakteri Aeromonas hydrophila ketika uji tantang adalah melalui otot ikan karena penyuntikan dilakukan secara intra muscular (penyuntikan pada otot ikan). Gejala klinis ikan yang terinfeksi Aeromonas
hydrophila biasanya diawali dengan timbulnya bintik-bintik merah yang
kemudian berubah menjadi borok-borok pada seluruh tubuh ikan, bahkan tidak jarang bagian daging pada ikan lele dumbo juga terkelupas akibat infeksi bakteri tersebut.
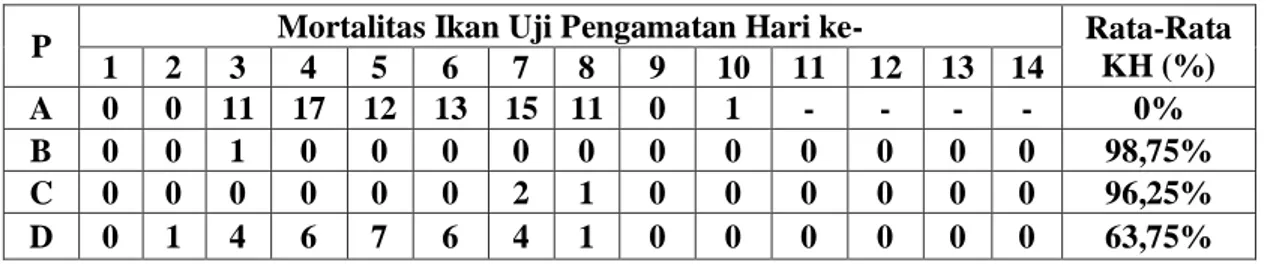
Hasil uji tantang terhadap ikan uji yang telah diberi vaksin diketahui dengan mengamati mortalitas dan rata-rata tingkat kelangsungan hidup ikan uji setelah diinfeksi dengan bakteri Aeromonas hydrophila. Dari hasil pengamatan terhadap mortalitas dan rata-rata tingkat kelangsungan hidup ikan uji setelah diuji tantang selama dua minggu menunjukkan bahwa setiap perlakuan memperlihatkan mortalitas dan rata-rata tingkat kelangsungan hidup yang berbeda (Tabel 3).