Studi Ekspresi CREM (C-AMP Responsive Element Modulator) Testis dan Motilitas Spermatozoa pada Tikus Jantan (Rattus norvegicus) Pasca
Paparan Laserpunktur
Study Of Testis CREM (C-AMP Responsive Element Modulator) Expression And Spermatozoa Motility In Male Rats (Rattus norvegicus)
Laserpuncture Post-Exposure l
Mar’atus Sakinah, Aulanni’am,dan Pungky Slamet W.K.
Program Studi Pendidikan Dokter Hewan, Program Kedokteran Hewan, Universitas Brawijaya
ABSTRAK
Laserpunktur merupakan suatu teknik stimulasi pada titik akupunktur dengan menggunakan sinar laser sebagai alat yang mempunyai efek stimulator. Laser berkekuatan rendah yang digunakan untuk laserpunktur (5 mW sampai 30 mW) terbukti dapat meningkatkan aktifitas jaringan seperti peningkatan hormon dan enzim jaringan. Laserpunktur memiliki manfaat salah satunya digunakan untuk meningkatkan fertilitas. Tujuan penelitian ini adalah untuk mengetahui paparan laserpunktur dapat meningkatkan fertilitas dengan melihat peningkatan ekspresi CREM (cAMP-Responsive Elemen Modulator) testis dan motilitas spermatozoa. Tikus yang digunakan dalam penelitian ini adalah tikus Rattus nurvegicus yang dibagi menjadi dua kelompok yaitu kelompok A sebagai kontrol negatif dan kelompok B sebagai kontrol positif diberi paparan laserpunktur pada 6 titik akupunktur dexter dan sinister yang terbagi 2 titik BL 22 atau
sanjiaoshu, 2 titik BL 23 atau shenshu dan 2 titik GV 4 atau mingmeng dengan dosis paparan 15 detik/titik. Penentuan ekspresi CREM diamati dengan metode imunohistokimia dan pengamatan motilitas spermatozoa dilakukan menggunakan mikroskop Olympus BX51 menggunakan metode Hag & Toelihere (2000). Hasil penelitian menunjukkan adanya perbedaan yang signifikan (P<0,05) antar perlakuan terhadap peningkatan ekspresi CREM. Nilai ekspresi CREM kelompok A dan B berturut-turut adalah 0,8 ± 0,1% dan 2,5 ± 0,2%. Induksi laserpunktur pada titik reproduksi tikus jantan (Rattus norvegicus)) meningkatkan meningkatkan 68% ekspresi CREM (cAMP-Responsive Elemen Modulator ) dan motilitas spermatozoa.
ABSTRACT
Laserpunktur is a stimulation technique on the acupuncture points using laser as a stimulating tool. Low powered lasers used for laserpuncture (5 mW to 30 mW) have proven to improve network activity such as increased tissue hormones and enzymes. Laserpuncture have the benefits which one of them is used to increase fertility. The purpose of this study was to determine that the exposure of laserpuncture can improve fertility measured by the increase in the expression of CREM (cAMP-responsive Element Modulator) testes and sperm motility. Rats used in this study were Rattus nurvegicus which are divided into two groups: group A as a negative control and group B as a positive control were given laserpuncture exposure acupuncture points on 6 dexter and sinister which consisted of 2 BL 22 point or sanjiaoshu, 2 BL 23 points or Shenshu and 2 GV 4 point or mingmeng with exposure dose as much as 15 sec/point. Determination of CREM expression was observed by immunohistochemical technigue and observation of sperm motility was performed using a Olympus BX51 microscope based on Hag & Toelihere method (2000). The results showed a significant difference (P <0.05) between the treatment of the increased expression of CREM. CREM expression value in group A and B were 0.8 ± 0.1% and 2.5 ± 0.2% respectively. Induction laserpunktur at the point of reproductions of male rats (Rattus norvegicus) increases expression of CREM (cAMP-responsive Element Modulator) by 68% and increase the motility of spermatozoa.
Key words:Laserpuncture, CREM, Spermatozoa Motility. 1. PENDAHULUAN
Anjing ras merupakan hewan
kesayangan yang banyak memiliki
keunggulan misalnya sebagai anjing penjaga dan anjing kontes (Natasaputra, 2005). Keunggulan dan sifat yang dimiliki anjing ras ini menyebabkan permintaan masyarakat meningkat meningkat dan para breeder
anjing berupaya untuk memenuhi
permintaan tersebut dengan kualitas genetik unggul yang menjadi harapan kelompok penggemar anjing. Saat ini para breeder
kesulitan untuk mendapat pejantan unggul, sehingga perlu dilakukan optimalisasi pengolahan semen namun untuk menggertak birahi pada anjing ternyata belum banyak dilakukan terutama menggunakan teknologi laserpunktur.
Terapi akupunktur merupakan metode terapi dari China yang menggunakan jarum untuk mengobati berbagai macam penyakit.
Penggunaan jarum dalam metode
akupunktur memiliki kekurangan yaitu merasakan sakit pada saat di terapi. Teknologi LASER (Light Amplification by
Stimulated Emission of Radiation) untuk
memberikan rangsangan pada titik
akupuntur (laserpunktur) mulai banyak dikembangkan (Adikara, 2001). Sinar laser dijadikan alternatif untuk stimulasi dalam akupunktur karena cahaya gelombang pendek dihasilkan oleh suatu proses stimulasi radiasi melalui sistem semi-konduktor dan karakteristik dari sinar laser menyebabkan timbulnya daya stimulasi terhadap sel-sel pada titik akupunktur menjadi kuat (Herdis, 2005).
Laserpunktur merupakan teknik
stimulasi pada titik akupunktur dengan menggunakan laser sebagai alat yang mempunyai efek stimulator. Aplikasi laserpunktur untuk sinkronisasi estrus telah dilaporkan pada sapi (Susan, 2001) dan
kerbau (Guntoro dan Yasa, 2002).
Teknologi laserpunktur pada titik-titik reproduksi terbukti dapat meningkatkan libido pejantan domba Garut, gertak birahi pada kerbau (Herdis, 2010; Guntoro dkk , 2002). Selain itu teknologi laserpunktur
diyakini dapat meningkatkan proses
Proses spermatogenesis erat
hubungannya dengan ekspesi CREM
(cAMP-Responsive Elemen Modulator).
CREM berperan penting dalam
perkembangan dan maturasi spermatid. Mekanisme CREM dalam perkembangan spermatid yaitu CREM berikatan dengan cAMP respon elements (CREs). Ikatan tersebut akan memodulasi transkiripsi cAMP responsive genes dan meregulasi gen pada spermatid (Aulanni’am, 2011). Ekspresi CREM secara tidak langsung mempengaruhi kualitas spermatozoa yaitu
salah satunya terhadap motilitas
spermatozoa (Aoki et al., 2006)
Paparan laserpunktur pada penelitian ini menggunakan hewan model tikus (
Rattus norvegicus) jantan sebagai pengkajian awal teknologi laserpunktur yang nantinya akan diterapkan pada anjing ras jantan. Pemilihan tikus juga didasarkan pada usia dewasa kelamin yang lebih cepat dan perkawinan yang tidak tergantung musim sehingga lebih efisien (Kusumawati, 2004). Berdasarkan latar belakang tersebut, penelitian ini bertujuan mempelajari ekspresi CREM (cAMP responsive elemnt modulator) dan motilitas spermatozoa.
2. BAHAN DAN METODE
Penelitian ini dilaksanakan selama bulan Juni-Desember 2013 di Laboratorium Biokimia dan Laboratorium Fisiologi Hewan Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Brawijaya, Malang serta Laboratorium Patologi Rumah Sakit Dr. Soetomo, Surabaya.
Hewan dan Bahan Uji
Hewan coba yang digunakan adalah tikus (Rattus norvegicus) jantan Strain
Wistar umur 12-13 minggu dengan berat badan 150 gram dengan 28 ekor tikus yang diperoleh dari Unit Pengembangan Hewan
Percobaan (UPHP) Universitas Gajah Mada Yogyakarta. Penggunaan hewan coba dalam penelitian ini telah mendapatkan sertifikat laik etik oleh Komisi Etik Penelitian Universitas Brawijaya No. 170-KEP-UB. Jenis laser yang digunakan untuk alat laserpunktur adalah jenis soft laser Helium-Neon (He-Ne) dengan spesifikasi memiliki daya 5 mW dan panjang gelombang 632,8 nm serta memiliki luas luaran sianar 0,2 cm2.
Induksi Laserpunktur
Penelitian ini bersifat eksperimental laboratorik dengan menggunkan uji t independent ( tidak berpasangan). Perlakuan terdiri dari 2 kelompok yaitu : kelompok kontol dan kelompok perlakuan yang di
induksi laserpunktur pada 6 titik
akunpunktur yaitu, terbagi dalam 2 titik akupunktur BL 22 atau sanjiaoshu (antara
processus transversus vertebralis lumbalis
2-3) dexter dan sinester, 2 titik akupunktur BL 23 atau shenshu (antara processus transversus vertebralis lumbalis 3-4) dexter
dan sinester, 2 titik akupunktur GV 4 atau
mingmeng (dorsal persendian processus tranversus vertebralis lumbalis 4-5) dexter
dan sinester. Jumlah sampel atau ulangan masing-masing perlakuan 14 ekor tikus.
Parameter yang diamati
Parameter yang diamati ini adalah ekspresi CREM (c-AMP responsive element modulator) dan motilitas spermatozoa pada tikus jantan (rattus nurvegicus) pasca paparan leserpuntur. Pengukuran ekspresi
CREM (c-AMP responsive element
modulator) menggunakan metode
pewaranan Imunohistokimia dan motilitas spermatozoa menggunkan Metode penilain motilitas spermatozoa dilakukan dengan metode Hag & Toelihere (1997).
Analisa data
Analisa data dilakukan menggunakan
softwere SPSS rev.16,0. Uji ekspresi CREM (c-AMP responsive element modulator) menggunakan Uji T independent dan uji motilitas spermatozoa menggunakan uji
Mann Whitney.
3. HASIL DAN PEMBAHASAN 3.1 Hasil Penelitin CREM
Hasil pengamatan immunohistokimia
terhadap ekspresi CREM
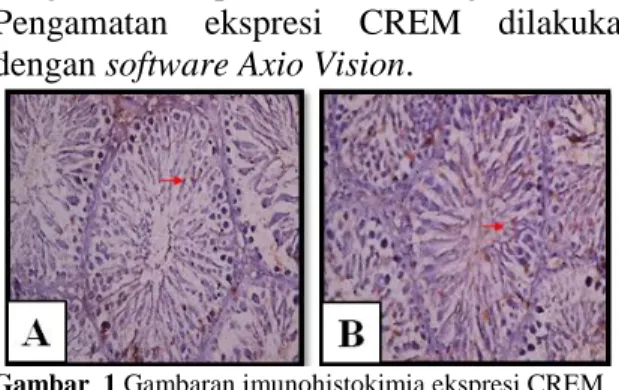
(cAMP-Responsive Elemen Modulator) pada testis tikus (Rattus norvegikus) jantan hasil paparan laserpunktur ditunjukkan dengan peningkatan luas area yang warna coklat seperti yang terlihat pada Gambar 1. Pada kelompok (B) yang diberi perlakuan paparan laserpunktur mengalami peningkatan luas area yang lebih tinggi apabila dibandingkan dengan kelompok kontrol negative (A). Pengamatan ekspresi CREM dilakukan dengan software Axio Vision.
Gambar 1 Gambaran imunohistokimia ekspresi CREM pada testis Tikus (Rattus norvegicus) Jantan.
Keterangan : pembesaran 400x, tanda panah menunjukkan ekspresi CREM
Gambar 1 (A) menunjukkan
gambaran imunohstokimia ekspresi CREM testis dalam keadaan normal, dimana pada kondisi normal ekspesi CREM juga terdapat pada testis. Pada gambar 1 (B) menunjukkan peningkatan luas area ekspersi CREM . Peningkatan luas area ekspresi CREM
diyakini karena adanya paparan laserpunktur yang menimbulkan daya stimulasi yang spontan dan cepat melalui jalur saraf.
Table 1 Jumlah Presentase Rata-rata Luas Area Ekspresi CREM
Kelompok Tikus Jumlah Rata-rata Ekspresi CREM (%) ± SD A (Tikus Kontrol) 0,8 ± 0,1 B (Tikus Induksi Laserpunktur) 2,5 ± 0,2
Tabel 1 menunjukkan bahwa pada kelompok B yang memiliki rata-rata luas area sebesar 0,8±0,1 % menunjukkan peningkatan rata-rata luas area ekspresi
CREM apabila dibandingkan dengan
kelompok kontrol negatif yang memiliki rata-rata luas area sebesar 2,5±0,2 %. Hasil analisis lanjutan dengan uji T tidak berpasangan (Independent sample T test), menunjukan bahwa pada kelompok B peningkatan sebesar 68% ekspresi CREM yang signifikan (P<0,05) apabila dibandingkan dengan kelompok A.
Paparan sinar laser yang diberikan pada enam titik akupunktur BL 22 atau
sanjiaoshu, BL 23 atau shenshu, GV 4 atau
mingmeng menimbulkan energi gelombang elektromagnetik dari sinar laser yang menembus jaringan kulit dan mengenai ujung saraf perifer akan diterima oleh sel signaling serta berikatan dengan reseptor pada membran sel membentuk komplek ligand-reseptor (Palaniapan, 2010).
Reseptor yang teraktivasi akan mengaktifkan Protein G sub unit α sebagai penghantar signal melintasi membran plasma dari luar sel ke dalam sel (Cummings et al., 2006). Protein G sub unit α kemudian akan mengalami fosforilasi untuk mengaktifkan Enzim Fosfolipase C (PLC) di membran plasma, sehingga Enzim Fosfolipase C selanjutnya menghidrolisa
Fosfatidil Inositol Bisfosfat (PIP2) menjadi Inositol Trifosfat (IP3) dan Diasil Griserol
(DAG). Keduanya berperan dalam
transduksi signal sebagai second messenger. Selanjutnya, IP3 akan berikatan dengan
reseptor spesifik pada Retikulum
Endoplasmik (RE) yang terkait dengan kanal Ca2+ memicu pelepasan Ca2+ dari RE ke sitosol sehingga meningkatkan kadar Ca2+ intraseluler. Aktivasi reseptor melalui jalur fosfolipase, diperoleh beberapa second messenger, yaitu DAG, IP3 dan Ca2+. DAG bersama-sama dengan Ca2+ mengaktivasi protein kinase C (PKC). PKC berperan dalam sintesis gen-gen tertentu. Ca2+ intraseluler akan mengaktivasi calcineurin. Calcineurin bersama dengan PKC berperan
dalam signaling dalam pelepasan
neurotransmiter. Jalur aktivitas seluler akibat induksi laserpunktur seperti tersebut ini dikenal sebagai jalur metabotropic (Kusuma, 2013).
Paparan laserpunktur pada titik reproduksi dapat melalui jalur ionotropik, paparan sinar laser laserpunktur mengenai titik reproduksi akan merubah gelombang elektromagnetik menjadi sinyal listrik. Sinyal listrik menyebabkan depolarisasi membran sel syaraf. Membran sel syaraf kemudian merespon dengan terbukanya saluran ion. Ca2+ ektraseluler akan masuk melalui calcium sensing receptor (CaSR) atau melalui voltage-gated Ca2+ channels ( VGCC). Masuknya Ca2+ ektraseluler ini kemudian bertemu dengan gelembung-gelembung sinaptik dan membran terbuka untuk melepaskan neurotransmiter ke celah sinaptik dengan cara eksositosis selanjutnya ditangkap oleh reseptor postsinap, yang kemudian berperan dalam signaling yaitu melanjutkan sinyal listrik dari presinap menuju postsinap sampai akhirnya menuju otak (Kusuma, 2013). Di otak kemudian menimbulkan reaksi berantai seperti merangasang calcineurin dan PKC untuk
mengaktifkan enzym Glutamic acid
decarboxylase (GAD). Aktifnya GAD ini akan merangsang neuron GABAergic untuk mensintesis GABA (Kusuma, 2013). GABA kemudian langsung menyampaikan pesan melalui adanya kontak neuron GABAergik dan neuron GnRH yang memungkinkan terjadinya pelepasan GnRH di hipotalamus. Sehingga produk dari neuron GABAergik berupa GABA memiliki efek stimulasi pada
pelepasan hormon gonadotropin dari
hipofisa (Kah et al., 1992; Sloley et al., 1992; Trudeau et al., 1993a,b ; Trudeau et al, 2000; Popesku et al., 2008).
GnRH yang di sekresikan akan menstimulasi pituitari anterior untuk meningkatkan sekresi hormon gonadotropin, berupa Luteinizing Hormone (LH) dan
Folicle Stimulating Hormone (FSH). LH
yang dihasilkan akan menstimulasi
peningkatan jumlah sel leydig pada testis
dan berikatan Luteinizing Hormone
Receptor (LH-R) untuk mengaktifkan cyclic adenosine monophosphate (cAMP) sehingga
menstimulus produksi testosteron
(Rathgeber, 2007). FSH yang disekresikan oleh pituitari anterior akan meningkatkan jumlah sel sertoli pada testis. FSH dengan
Folicle Stimulating Hormone-Receptor
(FSH-R) yang berperan sebagai proliferasi dan perkembangan sel sertoli (Darnell, et
al., 2000). FSH dan FSH-R akan
menyebabkan aktifasi pathway cAMP-PKA sehingga menstimulasi regulasi ekspresi
CREM (cAMP-Responsif Elemen
Modulator).
CREM merupakan kunci regulator
molekular terhadap seluruh stadium
spermatogenesis (Don dan Stelzer, 2002) dan meregulasi ekspresi sejumlah gen post-meiosis penting, seperti protein transisi dan protamin (Sassone-Corsi, 1998). CREM merupakan faktor transkripsi yang berperan
penting pada spermatogenesis dan
berinteraksi secara nyata didalam spermatid dan sel sertoli.
Jumlah sel sertoli yang meningkat akan mempengaruhi peningkatan produksi ABP sebagai sumber nutrisi dalam proses spermatogenesis. Androgen Binding Protein
(ABP) sebagai sumber nutrisi dalam proses maturasi sel diproduksi oleh sel sertoli. ABP dalam jumlah yang melimpah digunakan
dalam proses spermatogenesis untuk
meningkatkan jumlah sel spermatozoa yang dihasilkan pada kondisi mature yang tampak dari peningkatan motilitas. Faktor
transkripsi CREM berperan terhadap
motilitas dan viabilitas spermatozoa. Peningkatan motilitas spermatozoa akan menyebabkan spermatozoa mampu bergerak dalam saluran reproduksi betina untuk
mencapai sel telur sehingga dapat
membuahi.
3.2Hasil Penelitin motilitas spermatozoa
Motilitas merupakan suatu kemampuan spermatozoa untuk bergerak secara progresif dan dapat dijadikan acuan dalam penilaian kualitas semen. Motilitas spermatozoa ini
berasal dari gerakan mendorong
spermatozoa pada bagian ekor yang
menyerupai gerakan cambuk. Hasil
pengamatan motilitas spermatozo tikus
tanpa perlakuan dan pasca paparan
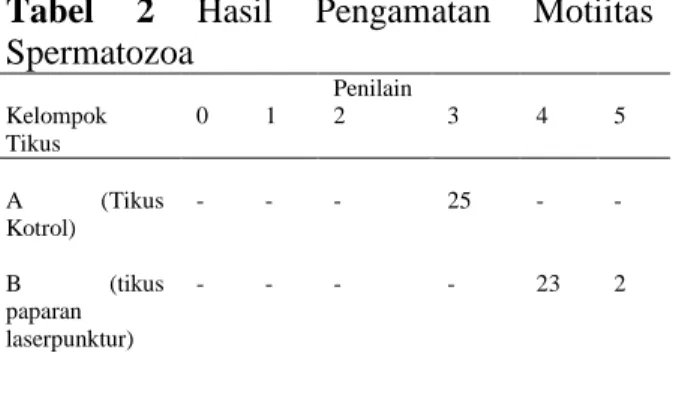
laserpunktur dapat dilihat pada Tabel 2.
Tabel 2 Hasil Pengamatan Motiitas Spermatozoa Penilain Kelompok Tikus 0 1 2 3 4 5 A (Tikus Kotrol) - - - 25 - - B (tikus paparan laserpunktur) - - - - 23 2
Hasil pengamatan menggunakan
mikroskop cahaya membuktikan bahwa paparan laserpunktur dengan energi 0,375
joule/titik mampu meningkatkan motilitas spermatozoa pada tikus. Penilain motilitas
spermatozoa yang dilakukan dalam
penelitian ini menggunakan metode Hag & Toelihere (1997). Hasil analisa lanjutan dengan uji Mann Whitney menunjukkan bahwa kelompok B terdapat peningkatan motilitas spermatozoa yang signifikan (P<0,05) dibandingkan kelompok A.
Pergerakan spermatozoa
membutuhkan sejumlah energi ATP yang digunakan untuk menggerakan ekor. ATP yang diperlukan berasal dari protein-protein yang dihasilkan oleh ABP. Androgen Binding Protein (ABP) sebagai sumber nutrisi dalam proses maturasi sel diproduksi oleh sel sertoli (Greenspan et al., 1994).
Jumlah sel sertoli yang meningkat
pasca paparan laserpunktur akan
mempengaruhi peningkatan produksi ABP sebagai sumber nutrisi dalam proses spermatogenesis. ABP dalam jumlah yang
melimpah digunakan dalam proses
spermatogenesis untuk meningkatkan
jumlah sel spermatozoa yang dihasilkan pada kondisi mature.
Sel mengeluarkan energi
metabotropik dalam bentuk ATP dihidrolisis menjadi adenosine difosfat (ADP) dan fosfat organik.
ATP + H2O ADP + Pi + H+
Sebagaian besar ATP dibentuk pada oksidasi dengan cara fosforilasi oksidasi mitokondria. Fosforilasi oksidatif adalah suatu proses ATP yang tejadi dalam
mitokondria, ATP yang disentesis
dibebaskan ke dalam matriks mitokondria. Mitokondria pada spermatozoa terletak pada bagian tengah spermatozoa. Mitokondria yang tersusun heliks bertanggung jawab
menyediakan energi bagi motilitas
spermatozoa (Hirata et al., 2002). Energi yang dihasilkan ini digunakan sel untuk homeostatis, regulasi, pembelahan, motilitas
dan kematian (Wallace, 1999; St. John et al.,
2005; May Panloup et al., 2006). Gangguan pada fungsi respirasi mitokondria dapat menyebabkan menurunnya motilitas dan fertilitas (spiropoulus et al., 2002). Motilitas spermatozoa merupakan salah satu indikator fertilitas hewan jantan.
4. KESIMPULAN
Induksi laserpunktur pada titik reproduksi tikus jantan (Rattus norvegicus)) dapat meningkatkan meningkatkan 68% ekspresi CREM (cAMP-Responsive Elemen Modulator ) dan motilitas spermatozoa dibandingkan dengan kelompok kontrol.
UCAPAN TERIMAKASIH
Peneliti mengucapkan terima kasih kepada Dr. Ir. Pungky Slamet WK., Msi yang telah memberi ijin menggunakan alat laserpunktur.
DAFTAR PUSTAKA
Adikara, Rts. 2001. Teknologi Laserpunktur Pada Ternak. Pusat Penelitian
Bioenergi Lembaga Penelitian
Universitas Airlangga. Surabaya.
Adikara, Rts. 1994. Aplikasi Teknologi Akupunktur Untuk Bioteknologi Peternakan Dalam Usaha Peningkatan Pertubuhan Ternak Sapi Potong Meridian Indonesia Jurnal Of Acupuncture. I: 15-23.
Ana L. M., Liliane F. I. S., Batista A O, G Claudia, C Fabiana M., José G Franco Ricardo L. R. B and R. Juliana, 2010.
Motile sperm organelle morphology examination (MSOME): intervariation study of normal sperm and sperm with large nuclear vacuoles. Reprod. Biol. Endocrinol: 8;56.
Aoki VW, DT Carrel dan L Liu. 2005. Identification And Evaluation Of A Novel Sperma Protamin Abnormality in a Population Of Infertle Male. Human Reproduction, 20(5): 1298-1306.
Armitage, D. 2004. Rattus Norvegicus. Animal Diversity Web. University Of Michigan Of Zoology.
Aulanni’am. 2011. Inhibin B: Struktur Dan Karakter Biokimiawi Sebagai Kandidat Kontrasepsi Pria. Pusat Penerbitan Dan Percetakan Unair. Surabaya.
A.Peri dan M. Serio, 2000. The CREM System in human spermatogenesis.
Journal of endocrinological investigation, 23: 578-583.
Bearden, H. J, J. W. Fuquay, and S. T.
Willard. 2004. Applied Animal
Reproduction. 6th ed. New Jersey: Prentice Hall. Upper Saddle, New Jersey.
Beeser, G.M., and G.F. Cahill. 2002.
Endocrinology Second Edition. WB Saunders Company. US.
Behr, R., and G Weinbauer, F. (2001) Camp Responsive Element Modulator (Crem): An Essential Facto.
Blendy, J. A., Kaestner, K. H., Weinbauer, G. F., Nieschlag, E., and Schutz, G. 1996. Severe Impairment Of Spermatogenesis In Mice Lacking The Crem Gene. Nature (London) 380, 162– 165.
Bourgeron, T. 2000. Mitochondrial function and male fertility. Results Probl. Cell Differ. 28: 187-210.
Carrell DT and L. Li, 2001. Altered Protamin 2 Expression Is Ncommon In Donors Of Known Fertility, But Common Omong Men With Poor Fertilizing Capacity, And May Reflect Other Abnormalities Of Spermiognesis.
J. Androl, 22: 604-610.
Carolina, V. M. 2005. Rat Dissection Guide. Biologycal Supply Company. Prague.
Corsi-Sassone, P., S. Foulkes., Lalli, E., and Molina, C. A. N., 1993 Inducibility And Negative Autoregulation Of Crem: An Alternative Promoter Directs The Expression.
Cummings, T.M., and S. Lindley. 2006.
Essentials of Western Veterinary Accupuncture. Blackwell Publishing Ltd. Oxford.
Cui, Y., Z. Chen, and J. Sha. 2006. Effects of reproductive hormones on spermatogenesis. ZhongHua Nan Ke Xui. 10(5):465-467.
Elzanaty, S., J. Richthoff, J. Malm, and A. Giwercman. 2002. The impact of epididymal and accessory sex gland function on sperm motility. Human Reproduction. 17(11):2904-2911.
Delmas V, Van der Hoorn F, B.B. Mellstrom, Jegou and P. Sassone-corsi. 1993. Indiktion of CREM Activator Proteins in Spermatid: Down-Stream Tagets and implication for Haploid
germ Call Differentation. Mol
Endocrinol, 7: 1502-1514
Darnell, J., and D. Baltimore. 2000.
Moleculer Cell Biology Fourth Edition.
Am Books. Sci.
Donald’s, Mc. 2003. Veterinary
Endocrinology and Reproduction Fifth Edition. Lowa State Press. Lowa.
GF Weinbauer, K Steger, I Kleiner, M
Bergmann dan R Berh. 2004.
Expression of Aktifator of CREM in the Testis (ACT) During Normal and Impaired Spermatogenesis: Corelation with CREM expression. Molecular human reproduction, 10(2): 129-135.
Grasspan, F.S., and J.D. Baxter. 2000.
Endokrinologi Dasar dan Klinik. Penerbit Buku Kedokteran EGC.
Jakarta.
Guntoro, S., dan N. Suyasa. 2000.
Superovulasi Dengan Teknik Laserpunktur Pada Kambing Peranakan Etawa. Instalasi Penelitian Dan Pengkajian Teknologi Pertanian Bali. Denpasar.
Guntoro. 2002. Aplikasi Teknologi
Laserpunktur Untuk Gertak Birahi Pada Kerbau. Instalasi Penelitian Dan Pengkajian Teknologi Pertanian Bali. Denpasar.
Hardjat No. T. 2001. Dasar- Dasar Laserpunktur. Seminar Persatuan Akupunturis Seluruh Indonesia (Paksi) 9-10 Juni 2001. Jakarta.
Hardijanto T, T.Sardjito, T. Hernawati , S. Susilowati dan T.W.Suprayogi. 2010.
Ilmu Inseminasi Buatan. Airlangga University Press. Surabaya.
Hartono. 1988. Histologi Veteriner Jilid II, Organologi. Laboratorium Histologi, Bagian Anatomi, Fakultas Kedokteran Hewan Institut Pertanian Bogor: Bogor.
Herdis, M. Surachman, dan I. Kusuma. 2001. Inseminasi Buatan Teknologi Tepat Guna Solusi Dalam Meningkatkan Populasi Ternak Akibat Krisis Ekonomo. Prosiding. Teknologi Untuk Negeri 2001. Jakarta, 19-20 Maret 2001. Badan Pngkajian Dan Penerapan Teknologi.7-11.
Herdis. 2005. Optimalisasi Insemenasi Buatan Melalui Aplikasi Teknologi Laserpunktur Pada Domba Garut (Ovis Aries). Institut Pertanian Bogor. Bogor.
Kusuma, P.S.W. 2000. Pengaruh
Penembakan Soft Laser He-Ne Terhadap Siklus Reproduksi Ikan Nila
[Thesis]. Program Pascasarjana
Universitas Airlangga.
Herdis. 2010. Aplikasi Teknologi
Laserpunktur dalam Meningkatkan Libido Pejantan Domba Garut (Ovis aries). Pusat Teknologi Produksi Pertanian. Jakarta.
Holstein AF, M. Davidoff and Schulze W. 2003. Understanding spermatogenesis is a prerequisite for treatment. Reprod Biol Endocrinol 1:107.
Klide, A.M., and H. KungShiu. 1977.
Veterinary Accupuncture. University of Pennsylvania Press. Pennsylvania.
Kusuma, P.S.W. 2000. Pengaruh
Penembakan Soft Laser He-Ne Terhadap Siklus Reproduksi Ikan Nila
[Thesis]. Program Pascasarjana
Universitas Airlangga.
Kusumawati, D. 2004. Bersahabat Dengan Hewan Coba. Universitas Gajah Mada Press. Yogyakarta.
Lin J., W. W. Chan, L. and S. Wu. 2001.
Acupuncture For Reproduction In
Cattle. Di Dalam: Schoaen A. M. Veterinary Acupunctureancient Art To Modernt Medicine. Ed Ke-2. St Louis: Mosby Hlm 565-573.
P. Sassone-Corsi, Monaco. L, F. Nantel, N. S. Foulkes, D. Masquilier, Lemeur, M., Henriksen, K. Dierich, and A. Parvinen, M. 1996. Spermiogenesis Deficiency And Germ-Cell Apoptosis In Crem-Mutant Mice. Nature (London) 380, 159–162.
May Panloup P, Chretien MF, Savagner F, Vasseur C, Jean M, Malthiery Y. and Reynier P. 2003. Increased sperm mitochondrial DNA content in male infertility. Hum Reprod 18(3):550-556.
Meachem, S.J. and E. Nieschlag. 2001.
Inhibin B in Male Reproduction : Patho-physiology and Clinical Relevance. Journal Endocrinology, 145 : 561-571.
Miligan, G. 1994. Signal transduction. A practical Approach. New York. Edited by Rickwood D. Oxford University Press : 167-179.
Natasaputra I. 2005. Golden Retriever. Penebar Swadaya, Jakarta.
Palaniapan, R. 2010. Biological Signal Analysis. Ventus Publishing. London.
Prihatno, S.A. 2004. Infertilitas dan Sterilitas. Fakultas Kedokteran Hewan Universitas Gadjah Mada, Yogyakarta.
Rathgeber, R. 2007. Equine Acupuncture.
The Blood-Horse Inc. Usa.
Spiropoulos J., Turnbull DM., and PF. Chinnery. 2002. Can mitochondrial
DNA mutations cause sperm dysfunction. Hum Reprod 8(8):719-721 St. John JC, RP. Jokhi and CLR. Barratt.
2005. The impact of mitochondrial genetics on male infertility. Int. J. Androl 28:65-73.
Susan G. 2001. Veterinary Acupuncture, Ancient Art To Modern Medicine Second Edition. St Louis. Mosby. 53-78.
Susan G . 2001. Global Acupuncture Reseach : Previously Ultrnslated Studies. Di Dalam: Schoen A.M. Veterinary Acupuncture, Ancient Art To Modern Medicine. Edke-2. St Louis. 53-57.
Toelihere, M.R. 1997. Fisiologi Reproduksi pada Ternak. Penerbit Angkasa. Bandung.
Walker, W., and Cheng. 2005. FSH and Testosteron Signaling in Sertoli Cell.
Reproduction, 130: 15-28.
Yasa, R. 2003. Penggunaan Laserpunktur Untuk Singkronisasi Estrus Pada Fase Lutealpada Kambing Peranakan Etawa (Pe) Thesis. Yogyakarta. Program Pascasarjana. Univrsitas Gajah Mada.
Yusuf, M. 2012. Ilmu Reproduksi Ternak. Lembaga Kajian dan Pengembangan Pendidikan Universitas Hasanudin. Makasar.