i
LAPORAN RESMI
PRAKTIKUM DASAR TEKNIK KIMIA II
Materi :
SPEKTROFOTOMETRI ANORGANIK
Oleh :
A. HANIF IZZATA ARKO NIM : 21030112140034 B. PUTI SETYO PURWOKO NIM : 21030112130149 C. RIZKIA RISANG KHAIRUNNISA NIM : 21030112140041
LABORATORIUM DASAR TEKNIK KIMIA II TEKNIK KIMIA FAKULTAS TEKNIK
UNIVERSITAS DIPONEGORO SEMARANG
Laboratorium Dasar Teknik Kimia II ii
LEMBAR PENGESAHAN
Laporan resmi Praktikum Dasar Teknik Kimia II dengan materi spektrofotometri anorganik yang disusun oleh :
Kelompok : I/Senin Siang
Anggota : 1. Hanif Izzata Arko 21030112140034 2. Puti Setyo Purwoko 21030112130149 3. Rizkia Risang Khairunnisa 21030112140041 Telah disahkan pada
Hari : Tanggal :
Semarang, 2013
Asisten
Laboratorium Dasar Teknik Kimia II iii
KATA PENGANTAR
Puji syukur penulis panjatkan kehadirat Allah SWT atas segala limpahan rahmat, karunia, dan hidayah-Nya sehingga penulis dapat menyelesaikan Laporan Resmi Praktikum Dasar Teknik Kimia II dengan materi Spektrofotometri Anorganik.
Dalam laporan ini penulis meyakini sepenuhnya bahwa tidaklah mungkin menyelesaikan makalah ini tanpa doa, bantuan, dan dukungan baik secara langsung maupun tidak langsung. Pada kesempatan ini penulis ingin memberikan rasa terima kasih kepada :
1. Ir. C. Sri Budiyati, MT selaku Dosen Praktikum Dasar Teknik Kimia II
2. Asisten Laboratorium Dasar Teknik Kimia II Universitas Diponegoro
3. Kedua orang tua atas doa, kesabaran, limpahan kasih sayang, dan dukungan yang telah diberikan
4. Teman-teman Teknik Kimia Universitas Diponegoro angkatan 2012 Penulis meyakini bahwa laporan ini jauh dari kesempurnaan. Mohon maaf apabila terdapat kekurangan ataupun kesalahan. Penulis mengharapkan kritik dan saran yang membangun dari semua pihak berkaitan dengan laporan ini. Akhir kata, semoga laporan ini dapat bermanfaat bagi semua pihak dan dapat berguna sebagai bahan penambah ilmu pengetahuan.
Semarang, Juni 2013
Laboratorium Dasar Teknik Kimia II iv
DAFTAR ISI
KATA PENGANTAR ... iii
DAFTAR ISI ... iv
DAFTAR TABEL ... vi
DAFTAR GAMBAR ... vii
INTISARI ... viii
SUMMARY ... x
BAB I PENDAHULUAN I.1. Latar Belakang ... 1
I.2. Rumusan Masalah ... 1
I.3. Tujuan Percobaan ... 1
BAB II TINJAUAN PUSTAKA II.1. Pengertian ... 2
II.2. Peralatan untuk Spektrofotometri... 2
II.3. Hukum Lambert-Beer ... 2
II.4. Hukum Least-Square ... 3
BAB III METODOLOGI PERCOBAAN III.1. Bahan dan Alat yang Digunakan ... 5
III.2. Gambar Alat ... 5
III.3. Variabel Percobaan ... 6
III.4. Cara Kerja ... 6
BAB IV HASIL PERCOBAAN DAN PEMBAHASAN IV.1. Hasil Percobaan ... 8
Laboratorium Dasar Teknik Kimia II v BAB V PENUTUP V.1. Kesimpulan ... 14 V.2. Penutup ... 14 DAFTAR PUSTAKA ... 15 LAMPIRAN
A. DATA HASIL PERCOBAAN ... A-1 B. LEMBAR PERHITUNGAN ... B-1 C. LEMBAR PERHITUNGAN REAGEN ... B-5 D. LEMBAR KUANTITAS REAGEN ... C-1 E. LAMPIRAN REFERENSI
Laboratorium Dasar Teknik Kimia II vi
DAFTAR TABEL
Tabel IV.1.1 Pembuatan Kurva Standar ... 8 Tabel IV.1.2 Pengukuran Kadar Sampel ... 8 Tabel IV.1.3 Perbandingan Kadar Teoritis dengan Kadar Praktis ... 8
Laboratorium Dasar Teknik Kimia II vii
DAFTAR GAMBAR
Gambar 2.2 Kurva A vs c menurut hukum Lambert-Beer ... 4
Gambar III.2.1 Spektrofotometer ... 5
Gambar III.2.2 Kuvet ... 5
Gambar III.2.3 Labu Takar ... 5
Gambar III.2.4 Kertas pH (Indikator Universal) ... 5
Gambar III.2.5 Beaker Glass ... 5
Gambar III.2.6 Gelas Ukur ... 5
Gambar III.2.7 Pipet Tetes ... 5
Gambar IV.2.1 Kurva Standar pada λ = 450 nm ... 9
Gambar IV.2.1 Kurva Standar pada λ = 480 nm ... 9
Gambar IV.2.1 Kurva Standar pada λ = 510 nm ... 9
Gambar IV.2.5 Grafik Kadar Teoritis vs Kadar Praktis λ=450nm ... 9
Gambar IV.2.5 Grafik Kadar Teoritis vs Kadar Praktis λ=480nm ... 10
Laboratorium Dasar Teknik Kimia II viii
INTISARI
Salah satu metode untuk menentukan konsentrasi suatu zat pada analisis kimia secara kuantitatif yaitu spektrofotometri yang didasarkan pada pengukuran transmitansi atau absorbansilarutan terhadap cahaya pada panjang gelombang tertentu dengan menggunakan instrumen spektrofotometer.
Bahan yang digunakan pada percobaan adalah larutan induk CuSO4.5H2O, HCl pekat, BaCl2.2H2O, dan aquadest. Sedangkan alat yang digunakan adalah spektrofotometer Optima SP-300, kuvet, labu takar, gelas ukur, kertas pH, beaker glass, dan pipet. Langkah kerja pertama yang dilakukan adalah mengkalibrasi alat dengan panjang gelombang awal (320 nm) dan transmitan = 0, kemudian memasukkan panjang gelombang yang akan digunakan pada analisis dan tempatkan pelarut murni lalu atur transmitans- 100%. Langkah selanjutnya adalah pembuatan kurva standar dengan mengukur transmitansi dari larutan induk CuSO4.5H2O pada beberapa volume yang sudah diencerkan dengan aquadest, diasamkan dengan HCl, dan ditambahkan BaCl2.2H2O dengan menggunakan panjang gelombang 450 nm, 480 nm, dan 510 nm. Langkah terakhir, pengukuran larutan sampel yang diberikan dengan mengencerkan sampel dengan aquadest, mengasamkan dengan HCl pekat, menambahkan BaCl2.2H2O, dan menghitung transmitansinya pada panjang gelombang yang ditentukan kemudian menghitung konsentrasinya.
Berdasarkan hasil percobaan, diperoleh panjang gelombang optimum 480 nm yang diperoleh dari regresi yang paling mendekati 1 dan %error paling kecil. Kadar yang diperoleh dengan panjang gelombang 450 nm : 480 nm : 510 nm berturut-turut adalah 147,09 ppm ; 175,39 ppm ; 225,15 ppm pada sampel I dengan kadar asli 180 ppm. Pada sampel II diperoleh kadar 114,38 ppm ; 111,314 ppm ; 127,815 ppm dengan kadar asli 120 ppm. Untuk sampel III diperoleh kadar 65,94 ppm ; 48,92 ppm ; 50,18 ppm dengan kadar asli 60 ppm. Kadar yang diperoleh lebih besar karena kurang bersihnya kuvet sedangkan beberapa kadar yang lebih kecil diperoleh karena adanya galat pada instrument dan efek kelelahan detektor. PH=1 digunakan untuk menekan pengonan pada larutan. Saran,
Laboratorium Dasar Teknik Kimia II ix
bersihkan kuvet sebelum digunakan, teliti dalam mengukur volume larutan,kalibrasi alat sebelum digunakan, teliti dalam mengukur pH, dan lakukan percobaan dengan hati-hati sesuai prosedur.
Laboratorium Dasar Teknik Kimia II x
SUMMARY
One of the method to determine the concentration of a substance in chemical analysis in quantitative measurement is spectrophotometry which is based on the measurement of solution transmittance or absorbance toward the radiance in an specific wavelength by using spectrophotometry instrument.
Materials that is used in this experiment are primary solution CuSO4.5H2O, concentrated HCl, BaCl2.2H2O, and aquadest. Whereas the equipments needed are Optima SP-300 Spectrophotometer, cuvette, volumetric flask, graduated cylinder, pH indicator, beaker glass, and pipette. The first step of the experiment is to calibrate the equipment with the initial wavelength (320 nm) and transmittance = 0. Then, insert the wavelength that will be used in analysis and place the aquadest and then set transmittance into 100%. The next step is making the standard curve by measuring the transmittance of primary solution CuSO4.5H2O in various volume which has been diluted, added with HCl, and added with BaCl2.5H2O, by using various wavelength determined (450 nm, 480 nm, and 510 nm). The last step to do is to measure the sample solution which is given by diluting it with aquadest, adding HCl and BaCl2.5H2O on it, and measuring the transmittance in wavelengths that has been determined before. Then, find the concentration of the sample.
From the experimental result, the optimum wavelength obtained is 480 nm which is found from the regression value that is closest to 1 and from the smallest error percentage. The concentration obtained in 450 nm, 480 nm, and 510 nm wavelength sequentially are 147,09 ppm ; 175,39 ppm ; 225,15 ppm for the first sample with 180 ppm for the real concentration. In the second sample, the concentration obtained are 114,38 ppm ; 111,31 ppm ; 127,82 ppm with 120 ppm for the real concentration. And for the third sample, they are 65,94 ppm ; 48,92 ppm ; 50,18 ppm with 60 ppm for the real concentration. Some of the concentration obtained are higher due to the unclean cuvette whereas some of the concentration obtained are lower because of the instrument error and detector extenuation effect. pH = 1 is used to suppress ionization in solution. The
Laboratorium Dasar Teknik Kimia II xi
suggestions for this experiment, clean the cuvette before using it, be precise while measuring volume of the solution, calibrate the equipment before using it, be precise in pH measurement, and do the experiment carefully.
Laboratorium Dasar Teknik Kimia II 1
BAB I PENDAHULUAN I.1. Latar Belakang
Proses analisa suatu bahan kimia saat ini diharapkan didapat hasil analisa yang akurat secara kuantitatif dan proses analisadengan instrumental yang lebih bias menjamin keakuratan hasilnya. Salah satu analisa kuantitatif yang menggunakan instrument adalah spektrofotometri, di mana analisa ini dilakukan berdasarkantransmitansi atau absorbansi larutan terhadap cahaya pada panjang gelombang tertentu.
I.2. Rumusan Masalah
1. Bagaimana menganalisa ion SO42- dalam larutan dengan menggunakan alat spektrofotometer?
2. Berapa konsentrasi ion SO42- dalam larutan dengan menggunakan alat spektrofotometer?
I.3. Tujuan Percobaan
Menentukan ion SO42- dalam larutan secara turbidimetri dengan memakai alat spektrofotometer.
Laboratorium Dasar Teknik Kimia II 2
BAB II
TINJAUAN PUSTAKA
II.1. Pengertian
Spektrofotometri adalah cara analisa kuantitatif berdasarkan transmitansi atau absorban larutan terhadap cahaya pada panjang gelombang tertentu dengan menggunakan instrument Spektrofotometer. II.2. Peralatan untuk Spektrofotometri
1. Suatu sumber energy cahaya yang berkesinambungan dalam spektrum di mana instrument beroperasi.
2. Suatu monokromator, yakni suatu piranti untuk menciptakan pita sempit panjang gelombang dari spektrum lebar yang dipancarkan oleh sumber cahaya.
3. Suatu wadah untuk sampel.
4. Suatu detektor, yang berupa transduser yang mengubah energi cahaya menjadi suatu isyarat listrik.
5. Suatu pengganda (amplifier) dan rangkaian yang berkaitan agar isyarat listrik memadai untuk dibaca.
6. Suatu sistem baca pada mana diperagakan besarnya listrik. II.3. Hukum Lambert-Beer
Lambert merumuskan hubungan antara absorbansi dan panjang gelombang yang ditempuh larutan :
log P0/P = K1’.b ….. (1)
Sumber Monokromator Sampel Detektor
Pengganda Piranti Bagian Optis B ag ian lis trik
Laboratorium Dasar Teknik Kimia II
3 di mana : P0/P = absorbansi
: P = tenaga radiasi yang keluar medium : P0 = tenaga radiasi yang masuk medium : b = tebal kuvet
Menurut Beer, absorbansi dipengaruhi oleh konsentrasi sehingga : log P0/P = K2’.c ….. (2)
Bila K1’ = f(c) dan K2’ = f(b), maka substitusi dari persamaan (1) dan (2) :
log P0/P = f(c).b log P0/P = f(b).c
f(b).c = f(c).b
f(b)/c = f(c)/c Maka log P0/P = f(c).b = f(b).c = k.c.b Jika konsentrasi larutan dalam mol/liter maka harus ditulis ε d mana ε = absorptivitas molar,
log P0/P = ε.b.c
Jika konsentrasi dalam gram/liter maka k harus ditulis a di mana a = absortivitas,
log P0/P = a.b.c
Jika absorbs Log P0/P = transmitansi (T) A = log P0/P = log 1/T = - log T
%T = P0/P x 100%
II.4. Hukum Least-Square
Metode Least-Square dipilih untuk pendekatan sektrofotometer menurut hokum Beer yang merupakan dasar absorbs.
A = a.b.c di mana : a = absortivitas b = tebal kuvet
Laboratorium Dasar Teknik Kimia II
4 Bila A dialirkan untuk c terhadap cuplikan yang tebalnya b cm akan menghasilkan daerah di mana hokum Beer berlaku suatu garis lurus dengan lereng ab.
Gambar 2.2 Kurva A vs c menurut hukum Lambert-Beer
Tetapi secara instrumental didapat grafik yang kurang memenuhi hubungan linier antara absorbansi dan konsentrasi pada penentuan absorbansi larutan sehingga memenuhi hukum kurva A vs c dipakai metode Least-square.
y = mx + c di mana : y = absorbansi
m = bilangan tetap (konstanta)
x = kadar larutan seri
sedangkan :
𝑚 =𝑛∑𝑥𝑦 − ∑𝑥∑𝑦 𝑛∑𝑥2 − (∑𝑥)2 𝑐 =∑𝑥2∑𝑦 − ∑𝑥∑𝑥𝑦𝑛∑𝑥2−(∑𝑥)2
Laboratorium Dasar Teknik Kimia II 5
BAB III
METODOLOGI PERCOBAAN
III.1. Bahan dan Alat Yang Digunakan III.1.1. Bahan yang digunakan
1. Larutan induk CusO4.5H2O (4 ml, 5 ml, 6 ml, 7 ml)
2. HCl pekat secukupnya
3. BaCl2.2H2O @200 mgr
4. Aquadest secukupnya
III.1.2. Alat yang digunakan
1. Spektrofotometer Optima SP-300 2. Kuvet dan tempat kuvet
3. Labu takar 50 ml 4. Gelas ukur 5. Kertas pH (indikator universal) 6. Beaker glass 7. Pipet Tetes III.2. Gambar Alat Utama
1.) 2.) 3.)
Laboratorium Dasar Teknik Kimia II
6 Keterangan :
1. Spektrofotometer : untuk mengukur absorbansi atau transmitansi suatu larutan
2. Kuvet : Sebagai media tempat sampel yang akan diukur absorbansi/transmitansinya
3. Labu takar : untuk mencampur larutan agar homogen 4. Indikator universal : untuk menguku pH larutan
5. Beaker glass : untuk mencampur larutan 6. Gelas ukur : untuk mengukur volume larutan
7. Pipet tetes : untuk mengambil larutan dalam skala tetes
III.3. Variabel Proses
1. CuSO4.5H2O (4 ml, 6 ml, 5 ml, 7 ml) 2. BaCl2.2H2O @ 200 mgr
III.4. Cara Kerja 1. Kalibrasi Alat
a. Menghubungkan Optima SP-300 dengan sumber listrik.
b. Menghidupkan Optima SP-300 dengan tombol ON/OFF di belakang mesin dan memanaskan 5-10 menit.
c. Atur metode pembacaan transmitansi.
d. Atur metode pembacaan absorban tak berhingga (transmitan = 0). e. Menentukan panjang gelombang (λ pada 450 nm, 480 nm, dan 510
nm).
f. Memasukkan pelarut murni aquadest ke dalam kuvet dan menempatkannya.
g. Mengukur skala absorbansi = 0 (transmitan = 100%). h. Optima SP-300 siap dipakai.
2. Pembuatan Kurva Standar
a. Mengambil 4 ml, 6 ml, 5 ml, dan 7 ml larutan induk CuSO4.5H2O lalau masukkan dalam labu takar 50 ml.
Laboratorium Dasar Teknik Kimia II
7 b. Encerkan dengan aquadest sampai tanda batas.
c. Mengambil 10 ml dari masing-masing labu takar, lalu masukkan ke dalam labu takar 50 ml.
d. Encerkan dengan aquadest sampai mendekati tanda batas.
e. Mengasamkan dengan HCl sampai pH = 1. Uji pH dengan menggunakan universal indikator kemudian tambahkan 200 mgr BaCl2.2H2O.
f. Encerkan dengan aquadest sampai tanda batas. g. Larutan dipindah ke dalam kuvet.
h. Mengukur transmitansinya pada λ = 450 nm, 480 nm, dan 510 nm. i. Membuat kurva standar A = log 1/T terhadap konsentrasi.
3. Pengukuran Larutan Sampel
a. Ambil 10 ml larutan sampel dengan pipet, masukkan ke dalam labu takar 50 ml, encerkan sampai mendekati tanda batas.
b. Asamkan dengan HCl pekat sampai pH = 1. Uji pH dengan indikator universal. Kemudian tambahkan 200 mgr BaCl2.2H2O ke dalam larutan.
c. Encerkan dengan aquadest sampai tanda batas, kocok hingga terbentuk endapan BaSO4.
d. Mengukur transmitansinya pada λ = 450 nm, 480 nm, dan 510 nm. e. Menghitung konsentrasinya.
Laboratorium Dasar Teknik Kimia II 8
BAB IV
HASIL PERCOBAAN DAN PEMBAHASAN
IV.1. Hasil Percobaan
IV.1.1. Tabel Pembuatan Kurva Standar
Volume 450 nm 480 nm 510 nm T A T A T A 4 ml 37,4 0,4273 38,6 0,4134 43,5 0,3615 5 ml 34,1 0,4673 35,0 0,4559 41,7 0,3799 6 ml 31,8 0,4976 32,1 0,4935 41,2 0,3851 7 ml 21,0 0,6678 25,1 0,6003 31,4 0,5031
IV.1.2. Tabel Pengukuran Kadar Sampel
Sampel 450 nm 480 nm 510 nm
T A T A T A
1 9,6 1,0458 9,2 1,0362 10,5 0,9788
2 14,7 0,8377 19,3 0,7167 23,5 0,6289 3 30,4 0,5171 39,3 0,4056 44,6 0,3507
IV.1.3. Tabel Perbandingan Kadar Teoritis dengan Kadar Praktis
Sampel
Konsentrasi Praktis Konsentrasi Teoritis (ppm) 450 nm (ppm) 480 nm (ppm) 510 nm (ppm) 1 147,0898 175,396 225,4626 180 2 114, 38 111,314 127,815 120 3 65,938 48,92 50,18 60
Laboratorium Dasar Teknik Kimia II
9 IV.2. Pembahasan
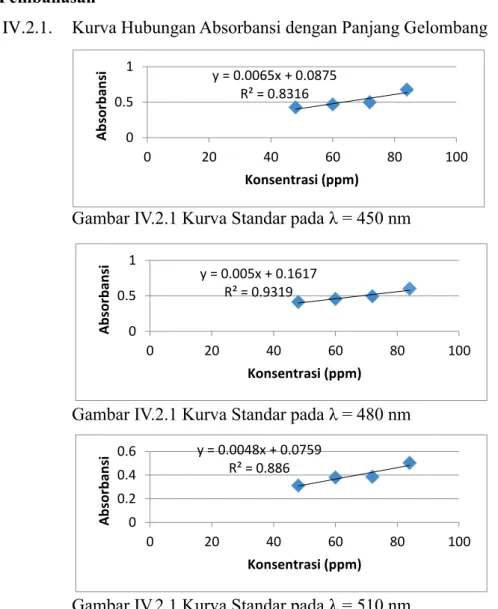
IV.2.1. Kurva Hubungan Absorbansi dengan Panjang Gelombang
Gambar IV.2.1 Kurva Standar pada λ = 450 nm
Gambar IV.2.1 Kurva Standar pada λ = 480 nm
Gambar IV.2.1 Kurva Standar pada λ = 510 nm
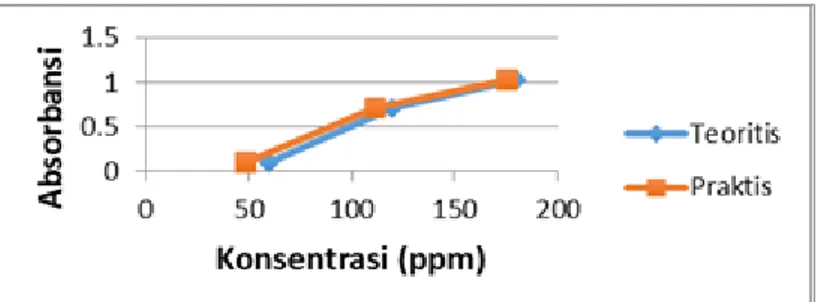
IV.2.2. Kurva Perbandingan Kadar Teoritis vs Praktis
Gambar IV.2.5 Grafik Kadar Teoritis vs Kadar Praktis λ=450nm
y = 0.0065x + 0.0875 R² = 0.8316 0 0.5 1 0 20 40 60 80 100 A b sor b an si Konsentrasi (ppm) y = 0.005x + 0.1617 R² = 0.9319 0 0.5 1 0 20 40 60 80 100 A b sor b an si Konsentrasi (ppm) y = 0.0048x + 0.0759 R² = 0.886 0 0.2 0.4 0.6 0 20 40 60 80 100 A b sor b an si Konsentrasi (ppm) 0 0.5 1 1.5 0 50 100 150 200 A b so rb an si Konsentrasi (ppm) Teoritis Praktis
Laboratorium Dasar Teknik Kimia II
10 Gambar IV.2.5 Grafik Kadar Teoritis vs Kadar Praktis λ=480nm
Gambar IV.2.5 Grafik Kadar Teoritis vs Kadar Praktis λ=510nm
IV.2.3. Panjang Gelombang Optimum
Pada percobaan, kami menggunakan panjang gelombang 450 nm, 480 nm, dan 510 nm. Berdasarkan hasil percobaan diperoleh data regresi yang berbeda-beda. Nilai regresi yang mendekati 1 (satu) diperoleh dari percobaan dengan panjang gelombang 480 nm. Pada pengukuran kadar sampel pada saat menggunakan panjang gelombang 480 nm diperoleh % error yang kecil. Pengukuran pada panjang gelombang optimum diperoleh keuntungan seperti perubahan konsentrasi larutan akan memberikan absorbansi yang besar, sehingga dapat memperkecil kesalahan. Selain itu, pada λ optimum akan diperoleh bentuk kurva kalibrasi yang linier sesuai dengan hukum Lambert-Beer. Jadi pada panjang gelombang 435 nm – 480 nm merupakan spectrum warna biru dan panjang gelombang optimum untuk pengukuran kadar SO42- adalah 480 nm. 0 0.5 1 1.5 0 50 100 150 200 A b so rb an si Konsentrasi (ppm) Teoritis Praktis 0 0.5 1 1.5 0 50 100 150 200 A b so rb an si Konsentrasi (ppm) Teoritis Praktis
Laboratorium Dasar Teknik Kimia II
11 (Underwood, 384)
(Silberberg, 1049) (Spektrofotometri, 32)
IV.2.4. Kadar yang Diperoleh lebih Besar
Pada percobaan, diperoleh kadar dari tiap sampel dari beberapa panjang gelombang yang digunakan. Beberapa kadar yang diperoleh lebih besar dari kadar aslinya. Hal ini disebabkan karena kurang bersihnya permukaan kuvet sehingga pada saatsinar dilewatkan ke sampel, cahaya tidak hanya diserap oleh sampel melainkan juga diserap oleh kotoran yang terdapat pada permukaan kuvet. Hal ini menyebabkan cahaya yang diteruskan sedikit sehingga transmitansi yang diperoleh juga kecil. Transmitansi berbanding terbalik dengan absorbansi sehingga absorbansi yang diperoleh besar. Absorbansi yang didapat lebih besar daripada yang seharusnya menyebabkan kadar yang diperoleh juga lebih besar. Oleh karena itu, pada percobaan terdapat beberapa kadar yang lebih besar daripada kadar aslinya. Selain itu,penyimpangan konsentrasi yang diperoleh juga dapat disebabkan oleh ketidakseimbangan ion-ion pada larutan yang diteliti. Kesetimbangan yang melibatkan ion-ion sering peka terhadap elektrolit yang ditambahkan, dan kegagalan mengendalikan kuat ion dapat menimbulkan masalah dalam spektrofotometri. Dalam hal ini contoh penyimpangan yang ditimbulkan adalah lebih besarnya nilai absorbansi yang diperoleh yang berpengaruh pada lebih besarnya nilai konsentrasi sampel dari yang seharusnya.
(http://myopera.com/....) (Underwood, 396)
Laboratorium Dasar Teknik Kimia II
12 IV.2.5. Kadar yang Diperoleh Lebih Kecil
Pada percobaan, beberapa kadar yang diperoleh dari beberapa panjang gelombang lebih kecil daripada kadar aslinya. Hal ini disebabkan karena adanya galat pada instrumen. Pada instrumen tidak terdapat cahaya yang benar-benar monokromatis. Hukum Bouger-Beer menyatakan bahwa radiasi yang diperlukan adalah radiasi monokromatik. Bila melewati suatu lapisan akan menyerap fraksi yang sama. Namun nilai ε bergantung pada panjang gelombang, sehingga nilai absorbansi yang terukur mencerminkan distribusi panjang gelombang yang tidak benar-benar monokromatis. Distribusi panjang gelombang yang kurang maksimal ini menyebabkan hasil yang diperoleh juga kurang maksimal sehingga dapat menyebabkan beberapa kadar yang diteliti memiliki nilai yang lebih kecil daripada yang seharusnya.
Hal lain yang dapat mempengaruhi perolehan kadar yang diteliti adalah efek kelelahan detektor. Dalam sebuah detektor, respon yang linear terhadap daya radiasi, waktu respon yang cepat, dan kestabilan tinggi diperlukan untuk memperoleh hasil yang maksimal dari sampel yang diteliti. Penggunaan spektrofotometer dalam jangka waktu yang lama dapat menyebabkan detektor dalam alat tersebut lelah. Hal ini akan mengurangi kinerja dari detektor tersebut. Efek kelelahan detektor ini dapat menimbulkan pembacaan nilai hasil absorbansi yang diteliti lebih kecil. Oleh karena itu, pada percobaan terdapat beberapa kadar dari sampel yang diperoleh lebih kecil dari kadar asli.
Laboratorium Dasar Teknik Kimia II
13 (Underwood, 396, 402)
IV.2.6. Penggunaan pH = 1
Pada percobaan, pH larutan dijadikan pH = 1. Hal ini dilakukan untuk menekan pengionan pada larutan. Pada pengukuran absorban pada sederetan larutan asam lemah, HB, derajat disosiasi (fraksi yang terionkan) bervariasi menurut banyaknya HB yang dimasukkan ke dalam tiap larutan jika volume akhirnya sama. Pada situasi ini mungkin untukmenjumpai penyimpangan hokum Beer baik positif maupun negative, bergantung pada nilai ε dari kedua spesies itu. HB dan B- pada panjang gelombang yang digunakan. Karena fraksi bahan yang hadir sebagai B- berkurang dengan bertambahnya konsentrasi analitis HB akan terlihat penyimpangan negative dari hokum Beer jika ε B- > ε HB. Sebaliknya jika ε HB > ε B-, akan dihasilkan penyimpangan positif. Sistem itu haruslah memenuhi hukum Beer pada panjang gelombang di mana ε HB = ε B-. Penyimpangan dari hukum Beer ini dapat dihindari dengan menyesuaikan pH larutan ke suatu nilai yang sangat rendah, dengan menambahkan asam kuat untuk menekan pengionan HB.
Laboratorium Dasar Teknik Kimia II 14
BAB V PENUTUP
V.1. Kesimpulan
1. Panjang gelombang optimum adalah 480 nm. Hal ini dikarenakan pada panjang gelobang tersebut diperoleh regresi mendekati 1 dan % error yang paling kecil.
2. Beberapa kadar dari sampel yang diperoleh lebih besar daripada kadar asli. Hal ini disebabkan karena kurang bersihnya kuvet dan ketidakseimbangan ion-ion pada larutan yang diteliti.
3. Beberapa kadar dari sampel yang diperoleh lebih kecil dari kadar aslinya. Hal ini disebabkan karena pada instrument tidak ada cahaya yang benar-benar monokromatis dan karenaefek kelelahan detektor. 4. Pada percobaan digunakan pH = 1 untuk menekan pengionan pada
larutan.
V.2. Saran
1. Bersihkan kuvet sebelum digunakan 2. Teliti dalam mengukur volume larutan 3. Kalibrasi alat sebelum digunakan 4. Teliti dalam mengukur pH
Laboratorium Dasar Teknik Kimia II 15
DAFTAR PUSTAKA
Anonim,2010,Spektrofotometri,http//:harisanto.files.wordpress.com/2010/01/ Spektrofotometri.pdf, diakses tanggal 4 Mei 2013 pukul 16.00 WIB Anonim,2012,Spektrofotometri (Kimia-XII),http://myopera.com/ekawidyakartika/
1109/2012/01/25/Spektrofotometri_kelas_xii, diakses tanggal 4 Mei 2013 pukul 16.00 WIB
Anonim,2011,Spektrofotometri Ultraviolet,http://waris-triyono.blogspot.com/ 2011/12/Spektrofotometri_ultraviolet_visibleuv.html, diakses tanggal 4 Mei 2013 pukul 16.20 WIB
H.I. Flasschka,EDTA Titrations.Pergamen Press,Inc.New York.1959
I.M. Kolthoff and V.A. Stenger.Volumetric Analysis.2nd ed. John Willey and Sons, Inc.New York.1957
M. Miller.Separations Methods in Chemical Analysis.John Willey and Sons, Inc. New York.1957
Perry, John H.Chemical Engineers Handbook, 5th ed.International Standart Edition.Mc Graw Hill Book, Inc.New York.Kogakusha Company, Inc.Tokyo.1960
Silberberg, Martin S.Chemistry: The Molecular Nature of Matter and Change, 5th ed.Mc Graw Hill Book Company, Inc.new York.2009
Underwood, A.I. and Day R.A.Analisa Kimia Kuantitatif. Edisis ke-4,
diterjemahkan oleh Drs. R. Soendoro, Ny Widaningsih W, Ba., Dra Ny Sri Rahadjeng S. Penerbit Erlangga.Jakarta.1981
Vogel A.I.Buku Teks Anorganik Kualitatif Makro dan Semi Mikro. Diterjemahkan oleh Ir. Sutiono dan Dr. A. Hadyono Pudjatmadja.Jakarta:Penerbit P.T. Kalman Media Pustaka
W. Huber.Titration in Nonaqueous Solutions.Academic Press, inc.New York.1967 W. Wagner and C.J Hull.Inorganic Titrimetric Analysis.Marce Dekker, inc.New
York.1971
Widarsih, R. wiwi, Rahman Arief, dan Siti Rohayati.Spektrofotometri Kelas XII.Kementrian Perindustrian.Pusdiklat Industri.Bogor.2010
Laboratorium Dasar Teknik Kimia II
A-1
DATA HASIL PERCOBAAN
LABORATORIUM DASAR TEKNIK KIMIA II
JURUSAN TEKNIK KIMIA FAKULTAS TEKNIK
UNIVERSITAS DIPONEGORO
MATERI
:
Spektrofotometri AnorganikI.
VARIABEL
CuSo4.5H2O BaCl2.2H2O 4 ml @200 mgr 6 ml 5 ml 7 mlII.
BAHAN DAN ALAT
Bahan yang digunakan
1. Larutan induk CuSO4.5H2O 2. HCl pekat
3. BaCL2.2H2O 4. Aquadest
Alat yang digunakan
1. Spektrofotometer Optima SP-300
2. Kuvet dan tempat kuvet 3. Labu takar 50 ml 4. Gelas ukur 5. Kertas pH 6. Beaker glass 7. Pipet tetes
III. CARA KERJA
1. Kalibrasi Alat
a. Menghubungkan Optima SP-300 dengan sumber listrik.
b. Menghidupkan Optima SP-300 dengan tombol ON/OFF di belakang mesin dan memanaskan 5-10 menit.
c. Atur metode pembacaan transmitansi.
d. Atur metode pembacaan absorban tak berhingga (transmitan = 0). e. Menentukan panjang gelombang (λ pada 450 nm, 480 nm, dan 510
nm).
f. Memasukkan pelarut murni aquadest ke dalam kuvet dan menempatkannya.
Laboratorium Dasar Teknik Kimia II
A-2 g. Mengukur skala absorbansi = 0 (transmitan = 100%).
h. Optima SP-300 siap dipakai. 2. Pembuatan Kurva Standar
a. Mengambil 4 ml, 6 ml, 5 ml, dan 7 ml larutan induk CuSO4.5H2O lalau masukkan dalam labu takar 50 ml.
b. Encerkan dengan aquadest sampai tanda batas.
c. Mengambil 10 ml dari masing-masing labu takar, lalu masukkan ke dalam labu takar 50 ml.
d. Encerkan dengan aquadest sampai mendekati tanda batas.
e. Mengasamkan dengan HCl sampai pH = 1. Uji pH dengan menggunakan universal indikator kemudian tambahkan 200 mgr BaCl2.2H2O.
f. Encerkan dengan aquadest sampai tanda batas. g. Larutan dipindah ke dalam kuvet.
h. Mengukur transmitansinya pada λ = 450 nm, 480 nm, dan 510 nm. i. Membuat kurva standar A = log 1/T terhadap konsentrasi.
3. Pengukuran Larutan Sampel
a. Ambil 10 ml larutan sampel dengan pipet, masukkan ke dalam labu takar 50 ml, encerkan sampai mendekati tanda batas.
b. Asamkan dengan HCl pekat sampai pH = 1. Uji pH dengan indikator universal. Kemudian tambahkan 200 mgr BaCl2.2H2O ke dalam larutan.
c. Encerkan dengan aquadest sampai tanda batas, kocok hingga terbentuk endapan BaSO4.
d. Mengukur transmitansinya pada λ = 450 nm, 480 nm, dan 510 nm. e. Menghitung konsentrasinya.
Laboratorium Dasar Teknik Kimia II
A-3
IV.
HASIL PERCOBAAN
V 450 nm 480 nm 510 nm T A T A T A 5 ml 34,1 0,4673 35,0 0,4559 41,7 0,3799 7 ml 21,0 0,6778 25,1 0,6003 31,4 0,5031 6 ml 31,8 0,4976 32,1 0,4935 41,2 0,3851 4 ml 37,4 0,4273 38,6 0,4134 43,5 0,3615 S 450 nm 480 nm 510 nm T A T A T A 1 9,6 1,0458 9,2 1,0362 10,5 0,9788 2 14,7 0,8327 19,3 0,7167 23,5 0,6289 3 30,4 0,5171 39,3 0,4056 44,6 0,3507 a. Panjang Gelombang 450 nm 𝑚 =𝑛. ∑𝑋𝑌 − ∑𝑋. ∑𝑌 𝑛. ∑𝑋2 − (∑𝑋)2 𝑚 =4(141,3108) − (264)(2,07) 4(18.144) − (264)2 𝑚 =565,2432 − 546,48 72.576 − 69.696 𝑚 =18,7632 2880 𝑚 = 6,515 𝑥 10−3 𝑣 =∑𝑋2. ∑Y − ∑𝑋. ∑X𝑌 𝑛. ∑𝑋2− (∑𝑋)2 v =18.144(2,07) − 264(141,3108) 2880 𝑐 =37.558,08 − 37.306,0512 2880 𝑐 = 0,08751 y = 6,515. 10−3𝑋 + 0,08751 b. Panjang Gelombang 480 nm No. X (ppm) Y X2 XY 1. 48 0,4273 2304 20,5104 2. 60 0,4673 3600 28,038 3. 72 0,4978 5184 35, 8222 4. 84 0,6778 7056 56,9352 ∑ 264 2,07 18.144 141,3108 No. X (ppm) Y X2 XY 1. 48 0,4134 2304 19,8432 2. 60 0,4559 3600 27,354
Laboratorium Dasar Teknik Kimia II A-4 𝑚 =𝑛. ∑𝑋𝑌 − ∑𝑋. ∑𝑌 𝑛. ∑𝑋2 − (∑𝑋)2 𝑚 =4(133,1544) − (264)(1,96) 4(18.144) − (264)2 𝑚 =532,6176 − 518,2584 72.576 − 69.696 𝑚 =14,3592 2880 𝑚 = 4,9858 𝑥 10−3 𝑐 =∑𝑋2. ∑Y − ∑𝑋. ∑X𝑌 𝑛. ∑𝑋2− (∑𝑋)2 c =18.144(1,96) − 264(133,1544) 2880 𝑐 =35.614,4564 − 35.157,7616 2880 𝑐 = 0,16171 y = 4,9858. 10−3𝑋 + 0,16171 c. Panjang Gelombang 510 nm 𝑚 =𝑛. ∑𝑋𝑌 − ∑𝑋. ∑𝑌 𝑛. ∑𝑋2 − (∑𝑋)2 𝑚 =4(110,1336) − (264)(1,63) 4(18.144) − (264)2 𝑚 =440,5344 − 430,2144 72.576 − 69.696 𝑚 =10,32 2880 𝑚 = 3,5833 𝑥 10−3 𝑐 =∑𝑋 2. ∑Y − ∑𝑋. ∑X𝑌 𝑛. ∑𝑋2− (∑𝑋)2 c =18.144(1,63) − 264(110,1336) 2880 𝑐 =29.567,4624 − 29.075,2704 2880 𝑐 = 0,1709 y = 3,5833. 10−3𝑋 + 0,1709 3. 72 0,4935 5184 35,532 4. 84 0,6003 7056 50,452 ∑ 264 1,9631 18.144 133,1544 d. No. X (ppm) Y X2 XY 1. 48 0,3615 2304 17,352 2. 60 0,3799 3600 22,194 3. 72 0,3851 5184 27,7272 4. 84 0,5031 7056 42,2684 ∑ 264 1,6296 18.144 110,1336
Laboratorium Dasar Teknik Kimia II A-5 450 nm y = 6,515.10-3 + 0,08751 I X = 147,0898 ppm II X = 114, 38066 ppm III X = 65,9386 ppm 480 nm y = 4,9858X.10-3 + 0,16171 I X = 175,396125 ppm II X = 111,3141 ppm III X => 48,9169 ppm 510 nm y = 3,5833X10-3 + 0,1709 I X = 225,4626 ppm II X = 127,8151 ppm III X = 50,1772 ppm
PRAKTIKAN
……….
MENGETAHUI
ASISTEN
...
Laboratorium Dasar Teknik Kimia II B-1 LEMBAR PERHITUNGAN 1. Persamaan Least-Square e. Panjang Gelombang 450 nm 𝑚 =𝑛. ∑𝑋𝑌 − ∑𝑋. ∑𝑌 𝑛. ∑𝑋2 − (∑𝑋)2 𝑚 =4(141,3108) − (264)(2,07) 4(18.144) − (264)2 𝑚 =565,2432 − 546,48 72.576 − 69.696 𝑚 =18,7632 2880 𝑚 = 6,515 𝑥 10−3 𝑣 =∑𝑋2. ∑Y − ∑𝑋. ∑X𝑌 𝑛. ∑𝑋2− (∑𝑋)2 v =18.144(2,07) − 264(141,3108) 2880 𝑐 =37.558,08 − 37.306,0512 2880 𝑐 = 0,08751 y = 6,515. 10−3𝑋 + 0,08751 f. Panjang Gelombang 480 nm 𝑚 =𝑛. ∑𝑋𝑌 − ∑𝑋. ∑𝑌 𝑛. ∑𝑋2 − (∑𝑋)2 𝑚 =4(133,1544) − (264)(1,96) 4(18.144) − (264)2 𝑚 =532,6176 − 518,2584 72.576 − 69.696 𝑐 =∑𝑋 2. ∑Y − ∑𝑋. ∑X𝑌 𝑛. ∑𝑋2− (∑𝑋)2 No. X (ppm) Y X2 XY 1. 48 0,4273 2304 20,5104 2. 60 0,4673 3600 28,038 3. 72 0,4978 5184 35, 8222 4. 84 0,6778 7056 56,9352 ∑ 264 2,07 18.144 141,3108 g. No. X (ppm) Y X2 XY 1. 48 0,4134 2304 19,8432 2. 60 0,4559 3600 27,354 3. 72 0,4935 5184 35,532 4. 84 0,6003 7056 50,452 ∑ 264 1,9631 18.144 133,1544
Laboratorium Dasar Teknik Kimia II B-2 c =18.144(1,96) − 264(133,1544) 2880 𝑐 =35.614,4564 − 35.157,7616 2880 𝑚 =14,3592 2880 𝑚 = 4,9858 𝑥 10−3 𝑐 = 0,16171 y = 4,9858. 10−3𝑋 + 0,16171 h. Panjang Gelombang 510 nm 𝑚 =𝑛. ∑𝑋𝑌 − ∑𝑋. ∑𝑌 𝑛. ∑𝑋2 − (∑𝑋)2 𝑚 =4(110,1336) − (264)(1,63) 4(18.144) − (264)2 𝑚 =440,5344 − 430,2144 72.576 − 69.696 𝑚 =10,32 2880 𝑚 = 3,5833 𝑥 10−3 𝑐 =∑𝑋2. ∑Y − ∑𝑋. ∑X𝑌 𝑛. ∑𝑋2− (∑𝑋)2 c =18.144(1,63) − 264(110,1336) 2880 𝑐 =29.567,4624 − 29.075,2704 2880 𝑐 = 0,1709 y = 3,5833. 10−3𝑋 + 0,1709 i. No. X (ppm) Y X2 XY 1. 48 0,3615 2304 17,352 2. 60 0,3799 3600 22,194 3. 72 0,3851 5184 27,7272 4. 84 0,5031 7056 42,2684 ∑ 264 1,6296 18.144 110,1336
Laboratorium Dasar Teknik Kimia II
B-3 2. Penentuan Konsentrasi Sampel
a. Panjang Gelombang 450 nm y = 6,515. 10−3𝑋 + 0,1709 Sampel 1 1,0458 = 6,515. 10−3𝑋 + 0,08751 𝑋 = 1,0458 − 0,08751 6,515. 10−3 X = 147, 0898 ppm Kadar asli = 180 ppm % 𝑒𝑟𝑟𝑜𝑟 = 180−147,0898 180 x100% % error = 18,2834 % Sampel 2 0.8327 = 6,515. 10−3𝑋 + 0,08751 𝑋 = 0,8327 − 0,08751 6,515. 10−3 X = 114,38066 ppm Kadar asli = 120 ppm % 𝑒𝑟𝑟𝑜𝑟 = 120−114,3806 120 x100% % error = 3,12 % Sampel 3 0,5171 = 6,515. 10−3𝑋 + 0,08751 𝑋 = 0,5171 − 0,08751 6,515. 10−3 X = 65,9386 ppm Kadar asli = 60 ppm % 𝑒𝑟𝑟𝑜𝑟 =60−65,938660 x100% % error = 3,3 % b. Panjang Gelombang 480 nm y = 4,9858. 10−3𝑋 + 0,16171 Sampel 1 1,0362 = 4,9858. 10−3𝑋 + 0,16171 𝑋 =1,0362 − 0,16171 4,9858. 10−3 X = 175,396125 ppm Kadar asli = 180 ppm % 𝑒𝑟𝑟𝑜𝑟 =180−175,3961180 x100% % error = 2,56 % Sampel 2
Laboratorium Dasar Teknik Kimia II B-4 0.7167 = 4.9858. 10−3𝑋 + 0,16171 𝑋 =0,8327 − 0,16171 4,9858. 10−3 X = 111,3141 ppm Kadar asli = 120 ppm % 𝑒𝑟𝑟𝑜𝑟 =120−111,3141120 x100% % error = 4,83 % Sampel 3 0,656 = 4.9858. 10−3𝑋 + 0,16171 𝑋 =0,656 − 0,16171 4,98858. 10−3 X = 48,9169 ppm Kadar asli = 60 ppm % 𝑒𝑟𝑟𝑜𝑟 =60−48,916960 x100% % error = 6,10 % c. Panjang Gelombang 510 nm y = 3,5833. 10−3𝑋 + 0,1709 Sampel 1 0,9788 = 3,5833. 10−3𝑋 + 0,08751 𝑋 =0,9788 − 0,1709 3,5833. 10−3 X = 225, 4626 ppm Kadar asli = 180 ppm % 𝑒𝑟𝑟𝑜𝑟 =225,4626−180,180 x100% % error = 25,26 % Sampel 2 0,6789 = 3,5833. 10−3𝑋 + 0,08751 𝑋 =0,6789 − 0,1709 3,5833. 10−3 X = 127,8151 ppm Kadar asli = 120 ppm % 𝑒𝑟𝑟𝑜𝑟 =127,8151−120120 x100% % error = 4,34 % Sampel 3 0,17091 = 3,5833. 10−3𝑋 + 0,1709 𝑋 =0,17091 − 0,1709 3,5833. 10−3 X = 48,9169 ppm Kadar asli = 60 ppm % 𝑒𝑟𝑟𝑜𝑟 =60−48,916960 x100% % error = 5,46 %
Laboratorium Dasar Teknik Kimia II
B-5 LEMBAR PERHITUNGAN REAGEN
CuSO4 (3000 ppm) 50 ml 1.) 4 ml 2.) 6 ml 3.) 5 ml 4.) 7 ml 𝐶1 𝑉1 = 𝐶2 𝑉2 1. 4 ml 4 𝑚𝑙𝐶1 = 3000 𝑝𝑝𝑚50 𝑚𝑙 𝐶1= 240 ppm 𝐶 = 240 ppm × 1050 = 48 ppm 2. 6 ml 6 𝑚𝑙𝐶1 = 3000 𝑝𝑝𝑚50 𝑚𝑙 𝐶1= 360 ppm 𝐶 = 360 ppm × 1050 = 72 ppm 3. 5 ml 5 𝑚𝑙𝐶1 = 3000 𝑝𝑝𝑚50 𝑚𝑙 𝐶1= 300 ppm 𝐶 = 300 ppm × 1050 = 60 ppm 4. 7 ml 7 𝑚𝑙𝐶1 = 3000 𝑝𝑝𝑚50 𝑚𝑙 𝐶1= 420 ppm 𝐶 = 420 ppm × 1050 = 84 ppm
Laboratorium Dasar Teknik Kimia II
C-1
LEMBAR KUANTITAS REAGEN
LABORATORIUM DASAR TEKNIK KIMIA II
JURUSAN TEKNIK KIMIA FAKULTAS TEKNIK
UNIVERSITAS DIPONEGORO
PRAKTIKUM KE : 4
MATERI : Spektrofotometri Anorganik HARI/TANGGAL : Selasa, 9 April 2013
KELOMPOK : 1/Senin Siang
NAMA : 1. Hanif Izzata Arko
2. Puti Setyo Purwoko 3. Rizkia Risang Khairunnisa 4.
ASISTEN
: Gita Permana Putra
KUANTITAS REAGEN
NO
JENIS REAGEN
KUANTITAS
1.
CuSO
4.5H
2O
(4, 6, 5, 7)
2.
BaCl
2.2H
2O
@ 200 mg
3.
HCl pekat
secukupnya
TUGAS TAMBAHAN :
CATATAN :
λ = 450 , 480 , 510 SEMARANG, 9 APRIL 2013 ASISTEN NIM.http://harisdianto.files.wordpress.com/2010/01/spektofotometri1.pdf
VII.PEMBAHASAN
Pengukuran zat dengan spektofotometri selalu melibatkan analat blanko dan standar. Blanko adalah larutan yang mempunyai perlakuan yang sama dengan analat tetapi tidak mengandung komponen analat. Tujuan pembuatan larutan blanko ini adalah untuk mengetahui besarnya serapan oleh zat yang bukan analat. Larutan analat adalah larutan yang dianalisis. Larutan standar adalah larutan yang mendapat perlakuan yang sama dengan analat dan mengandung kkomponen analat dengan konsentrasi yang sudah diketahui.
Adapun kesalahan yang mungkin terjadi disebabkan oleh beberapa faktor di bawah, yaitu :
Pengenceran yang kurang sempurna. Sensitifitas alat.
Kuvet yang kurang bersih.
Adanya serapan oleh pelarut. Hal ini dapat diatasi dengan penggunaan blangko, yaitu larutan yang berisi selain komponen yang akan dianalisis termasuk zat pembentuk warna.
Serapan oleh kuvet. Kuvet yang ada biasanya dari bahan gelas atau kuarsa, namun kuvet dari kuarsa memiliki kualitas yang lebih baik.
Kesalahan fotometrik normal pada pengukuran dengan absorbansi sangat rendah atau sangat tinggi, hal ini dapat diatur dengan pengaturan konsentrasi, sesuai dengan kisaran sensitivitas dari alat yang digunakan (melalui pengenceran atau pemekatan).
Kuvet yang kotor atau tergores.
Sidik jari yang dapat menyerap radiasi ultra violet.
Adanya gelembung udara atau gas dalam lintasan radiasi panjang gelombang yang dihasilkan sudah tidak cocok dengan yang tertera pada instrument.
Kurang ketelitian dalam pembacaan hasil penimbangan Perbedaan situasi pada saat pengukuran
Perbedaan yang terdapat pada obyek yang diukur.
http://my.opera.com/...
6.1. Penyimpangan Hukum Bouger-Beer Penyimpangan Kimia
Penyimpangan ini terjadi pada pengukuran absorbans pada sederetan asam lemah, HB. Derajat disosiasi HB (fraksi yang terionkan) bervariasi menurut banyaknya HB yang dimasukkan dalam tiap larutan jika volume akhirnya sama. Fraksi yang hadir sebagai B- akan berkurang dengan bertambahnya konsentrasi HB, maka akan terjadi penyimpangan negatif yaitu εB- > εHB, dan sebaliknya jika εHB > εB -akan terjadi penyimpangan positif, sementara sistem harus memenuhi hukum beer pada panjang gelombang dimana εHB = εB- (isobetik).
Penyimpangan ini dapat dihindari dengan melakukan pengukuran pada panjang gelombang isobetik, penyesuaian pH larutan ke nilai yang rendah, penambahan asam kuat untuk menekan pengionan HB dan dengan penambahan alkali kuat secukupnya untuk mengubah bahan menjadi B-.
Penyimpangan instrumen
Hukum Bouger-Beer menyatakan bahwa radiasi yang diperlukan adalah radiasi monokromatik, bila melewati suatu lapisan akan menyerap fraksi yang sama. Namun nila ε bergantung pada panjang gelombang, sehingga nilai absorbans yang terukur mencerminkan distribusi panjang gelombang yang tidak benar-benar monokromatik. Penyimpangan juga dapat terjadi pada instrumen yang digunakan seperti efek kelelahan detektor, ketidaklinieran penguat (sinyal), piranti baca dan ketidakstabilan sumber energi radiasi. Untuk mengatasi hal ini yaitu dengan menggunkan spektrofotometer yang lebih modern.
DIPERIKSA KETERANGAN TANDA TANGAN