ABSTRAK
Penelitian ini bertujuan mengetahui pengaruh ekstrak etilasetat dan ekstrak metanol andaliman terhadap kerusakan dinding sel bakteri Bacillus cereus,
Staphylococcus aureus dan Salmonella Typhimurium dengan metode BATH
(Bacterial Adhesion to Hydrocarbons) menggunakan hidrokarbon n-oktana. Hasil pengamatan menunjukkan bahwa ekstrak etilasetat memiliki daya penghambatan pertumbuhan lebih tinggi daripada ekstrak metanol andaliman. Daya penghambatan ekstrak etilasetat terhadap protoplast B. cereus sebesar 19.62 mm dan terhadap protoplast S. aureus 16.15 mm. Ekstrak etilasetat dan ekstrak metanol mampu meningkatkan hidrofobisitas bakteri B. cereus masing- masing sebesar 73.01-79.58 dan 58.92-65.96%, sedangkan terhadap S. aureus sebesar 62.35-71.95 dan 62.20-66.15%, serta S. Typhimurium sebesar 44.75-53.28 dan 41.44-50.02%. Bakteri B. cereus dan S. aureus termasuk dalam golongan bakteri hidrofobik kuat sedangkan S. Typhimurium digolongkan bakteri hidrofobik moderat.
PENDAHULUAN
Struktur dinding sel bakteri Gram positif berbeda dengan dinding sel Gram negatif. Bakteri Gram positif mengandung 90% peptidoglikan serta lapisan tipis asam teikoat dan asam teikuronat yang bermua tan negatif. Pada bakteri Gram negatif, terdapat lapisan di luar dinding sel yang mengandung 5-10% peptidoglikan, selebihnya terdiri dari protein, lipopolisakarida dan lipoprotein. Lapisan ini merupakan dua lapis lipid (bilayer lipid), yang disebut lapisan lipopolisakarida (LPS). Lapisan ini tidak tersusun hanya oleh fosfolipid saja, seperti yang terdapat pada membran sitoplasma, tetapi juga mengandung polisakarida dan protein (Madigan et al. 2003).
Dinding sel mengandung suatu zat yang secara kimiawi merupakan suatu polimer kompleks mukopeptida (murein, peptidoglikan) yang terdiri atas polisakarida dan suatu polipeptida dengan banyak ikatan silang. Polisakarida tersebut biasanya mengandung gula amino N-asetilglukosamin dan asam asetilmuramat. Pada gula amino itu terikat rantai-rantai peptida pendek. Kekuatan dinding sel ditambah lagi dengan ikatan silang pada rantai- rantai peptida (melalui ikatan pentaglisin) sebagai akibat reaksi transpeptidase yang dilakukan beberapa
enzim. Lapisan peptidoglikan lebih tebal (40 lapisan) pada dinding sel bakteri Gram positif daripada dinding sel Gram negatif (1-5 lapisan) (Lewis et al. 2004).
Dalam upaya untuk mencapai sasaran, senyawa antibakteri dapat menembus LPS dari dinding sel tersebut. Molekul- molekul yang bersifat hidrofilik akan lebih mudah melewati LPS dibandingkan dengan yang hidrofobik. Pada bakteri gram positif, tidak ada lapisan LPS, jadi fungsi penghalangnya tidak ada sehingga molekul senyawa antibakteri yang bersifat hidrofilik maupun yang hidrofobik dapat melewatinya (Best 1999). Bakteri Gram negatif mempunyai sisi hidrofilik yaitu karboksil, asam amino dan hidroksil (Gorman 1991).
Beberapa senyawa antibakteri dapat merusak integritas membran luar dengan cara merusak ikatan antara kation divalent Ca++ dan Mg++ dengan LPS. Asam-asam organik seperti etilen diamin tetraacetic acid (EDTA), asam sitrat, asam malat, asam tartarat, asam laktat (Gao et al. 1999; Stratford 2000) dan asam klorida (Alakomi et al. 2000) dapat menghambat pertumbuhan bakteri Gram nega tif dengan mengkelat kation divalent Ca++ dan Mg++. Terlepasnya kation-kation tersebut dari membran luar akan memudahkan masuknya senyawa antibakteri ke dalam sel (Stratford 2000). Mekanisme kerja antibakteri dari komponen fenolik diantaranya dapat bereaksi dengan komponen fosfolipid dari membran sel (P. aeruginosa) sehingga menyebabkan peningkatan status permeabilitas sel membran atau dapat menyebabkan perubahan dalam komponen asam lemak dan kandungan fosfolipid, sehingga dapat menyebabkan kekacauan pada sistem membran sel (Nychas 1995).
Penelitian ini bertujuan untuk mengetahui pengaruh polaritas ekstrak andaliman terhadap kerusakan dinding sel khususnya terhadap sifat hidrofobisitas
B. cereus, S. aureus dan S. Typhimurium dan protoplast sel B. cereus, S. aureus.
METODOLOGI
Bahan dan Alat
Bahan yang digunakan adalah buah andaliman varietas simanuk, yang berasal dari Medan dan diperoleh dari Pusat Pasar Senen Jakarta. Kultur bakteri yang digunakan untuk pengujian terdiri dari 3 jenis bakteri, yaitu: Bacillus cereus
FNCC 134, Staphylococcus aureus FNCC 057 dan Salmonella Typhimurium FNCC 034 yang diperoleh dari koleksi kultur Pusat Antar Universitas Pangan dan Gizi Universitas Gadjah Mada (UGM) Yogyakarta.
Pengujian Aktivitas Antibakteri Ekstrak Andaliman terhadap Protoplast (Nuraida et al. 1999)
Sebanyak satu ose kultur B. cereus dan S. aureus disuspensikan dengan enzim lisozim sebanyak 50 µg/ml. Selanjutnya diinkubasi selama 30 menit dan dipanen dengan sentrifugasi pada 6000 rpm selama 15 menit (Nuraida et al. 1999). Pengujian aktivitas antibakteri menggunakan metode sumur dengan konsentrasi ekstrak 2% (Harrigan 1998).
Pengujian Hidrofobisitas Bakteri (Jones et al. (1991)
Sebanyak 4.8 ml suspensi bakteri uji yang mengandung 106 cfu/ml disentrifus dengan kecepatan 1900 g selama 15 menit. Supernatan kultur dibuang dan pelet bakteri ditambah 4.8 ml N B yang mengandung ekstrak andaliman dengan konsentrasi 2, 4 dan 6% (w/w). Kontrol disiapkan dengan penambahan 1.07 ml bufer fosfat dan 3.73 ml media NB. Selanjutnya suspensi diinkubasi pada 370C selama 30 menit dan disentrifus 1900 rpm selama 15 menit. Pelet yang terbentuk dicuci dengan PBS (Phosphat Buffer Saline) kemudian diresuspensikan dalam PBS menjadi 4.8 ml.
Selanjutnya 4.8 ml suspensi ditambahkan hidrokarbon n-oktana dengan volume 0.3, 0.6, 0.9, 1.2 dan 1.5 ml, kemudian divortex selama satu menit dan disetimbangkan pada suhu kamar selama 15 menit, sehingga terjadi pemisahan. Fase air diambil secara perlahan- lahan menggunakan pipet pasteur, kemudian absorbansi diukur pada ? 600 nm.
HASIL DAN PEMBAHASAN
Pengaruh Ekstrak Andaliman terhadap Protoplast
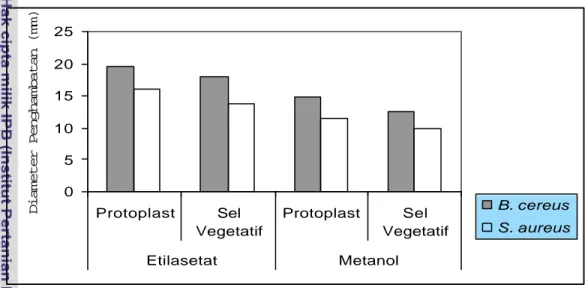
Hasil pengujian aktivitas antibakteri ekstrak etilasetat dan ekstrak metanol andaliman terhadap protoplast dan sel vegetatif disajikan pada Gambar 7.1
(Lampiran 34 dan 35). Pada Gambar 7.1 dapat dilihat bahwa protoplast B. cereus dan S. aureus lebih peka dibandingkan sel vegetatifnya. B. cereus lebih peka terhadap ekstrak etilasetat dengan diameter penghambatan sebesar 19.62 mm dibandingkan S. aureus sebesar 16.15 mm. Sedangkan ekstrak metanol mempunyai diameter penghambatan lebih rendah dibandingkan dengan ekstrak etilasetat andaliman yaitu sebesar 14.85 mm dan 11.55 mm.
0 5 10 15 20 25 Protoplast Sel Vegetatif Protoplast Sel Vegetatif Etilasetat Metanol
Diameter Penghambatan (mm) B. cereus
S. aureus
Gambar 7.1 Pengaruh Ekstrak Etilasetat dan Metanol terhadap Protoplast dan Sel Vegetatif Bakteri B. cereus dan S. aureus.
Protoplast adalah bagian sel bakteri yang hanya terdiri dari membran sel sitoplasma dan materi sel intraselulernya (Williams dan Gladhill 1991). Adanya penurunan resistensi protoplast disebabkan karena dinding sel bakteri telah terhid rolisis oleh enzim lisozim yang ditambahkan pada saat preparasi protoplast. Lisozim berfungsi untuk memecah ikatan asetilglukosamin dan asam N-asetilmuramat pada peptidoglikan dinding sel bakteri (Jawetz et al. 1996). Dengan terhidrolisisnya dinding sel bakteri ekstrak etilasetat dan ekstrak metanol lebih mudah berpenetrasi masuk ke dalam sel.
Diduga mekanisme penghambatan bakteri oleh ekstrak etilasetat dan ekstrak metanol adalah dengan cara bereaksi terhadap membran sel atau komponen-komponen dalam sitoplasma sel. Mekanisme kerja penghambatan ekstrak yang bereaksi dengan membran sel diantaranya telah dilaporkan oleh Nishina et al. (1991) dan Kim et al. (1995). Senyawa fenol, seperti yang telah
dilaporkan pada penelitian sebelumnya dapat bereaksi dengan membran sel bakteri, mengganggu proses transpor, pada konsentrasi tinggi dapat menyebabkan koagulasi komponen sitoplasma sel, dan mengganggu sistem proton motive force yang berperan dalam produksi energi pada sel. Diduga senyawa aktif yang terdapat pada ekstrak etilasetat dan ekstrak metanol andaliman seperti fenol hidrokuinon mempunyai mekanisme yang sama dengan senyawa fenol (Kim et al. 1995).
Kemampuan senyawa fenol hidrokuinon sebagai senyawa antibakteri karena adanya gugus hidroksil (OH), gugus keton (CO), dan gugus metoksi (OCH3) (Nishina et al. 1991; Bisignano et al. 2000), sedangkan tanin sebagai senyawa antibakteri karena mempunyai gugus hidroksil (Sakanaka et al. 1989) yang dapat bebas melewati dinding sel atau porin dan masuk ke dalam sel.
Nuraida et al. (1999) melaporkan bahwa aktivitas antibakteri ekstrak polar picung dengan konsentrasi 60% dapat meyebabkan peningkatan sensitivitas protoplast B. cereus dan S. aureus dibandingkan dengan sel utuhnya. Dalam penelitian ini menggunakan ekstrak dengan konsentrasi 30% mampu menghambat prtoplast sebesar 19.62 mm, sedangkan ekstrak picung dengan konsentrasi 60% diameter penghambatannya terhadap protoplast sebesar 12.60 mm. Aktivitas antibakteri komponen minyak atsiri (karvakrol, sitral, dan geraniol) dapat mengakibatkan terganggunya lapisan fosfolipid dari membran sel yang akan meningkatkan permeabilitas membran sel, sehingga unsur-unsur pokok penyusun sel bocor keluar sel (Kim et al. 1995). Nishina et al. (1999) menunjukkan bahwa kinerja inaktivasi dari komponen anetol biji jintan manis dapat mengakibatkan rusaknya struktur membran plasma bakteri dan asam nukleat DNA dalam sel aktif.
Kerusakan pada dinding sel (misalnya oleh lisozim) atau terhambatnya sintesis dinding sel mengakibatkan lisis pada sel. Pada lingkungan hipertonik (sukrosa 20%) kerusakan dinding sel mengakibatkan terbentuknya protoplast (bakteri Gram positif) atau sferoplast (bakteri Gram negatif). Bila protoplast ditempatkan dalam lingkungan dengan kondisi normal, maka protoplast dapat menyerap cairan secara cepat, membengkak dan pecah (Jawetz et al. 1996).
Pengaruh Ekstrak Andaliman terhadap Hidrofobisitas Bakteri
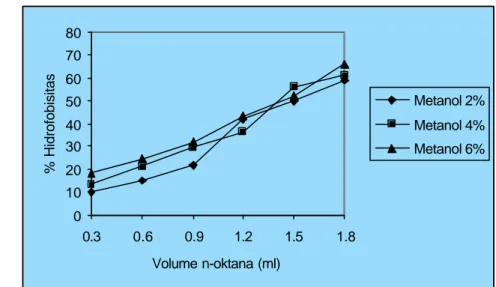
Penentuan hidrofobisitas bakteri dilakukan dengan modifikasi BATH (Bacterial Adherence to Hidrocarbons) pada hidrokarbon n-oktana dengan metode Jones et al. (1991) dan Lee dan Yli (1996). Hasil pengukuran karbon n-oktana dapat dilihat pada Gambar 7.2 – 7.7 dan Lampiran 51-68. Ketiga bakteri uji (B. cereus, S. aureus dan S. Typhimurium) menunjukkan sifat hidrofobis itas yang meningkat dengan diberi ekstrak etilasetat maupun ekstrak metanol.
Ekstrak etilasetat dan ekstrak metanol andaliman dengan konsentrasi 2, 4, dan 6% meningkatkan sifat hidrofobisitas B. cereus masing- masing dengan kisaran 73.01-79.58% (Gambar 7.2) dan 58.92-65.96% (Gambar 7.3). Hidrofobisitas B. cereus tertinggi diperoleh pada konsentrasi ekstrak etilasetat dan ekstrak metanol masing- masing 6%. Semakin tinggi konsentrasi ekstrak andaliman maka hidrofobisitas sel B. cereus juga semakin tinggi.
Gambar 7.2 Pengaruh Konsentrasi Ekstrak Etilasetat Andaliman dan Volume n-Oktana terhadap Hidrofobisitas B. cereus
Pola peningkatan hidrofobisitas B. cereus oleh konsentrasi ekstrak etilasetat dan ekstrak metanol relatif sama seiring dengan semakin meningkatnya volume hidrokarbon n-oktana yang ditambahkan (Gambar 7.3). Semakin banyak konsentrasi ekstrak dan volume n-oktana yang terikat dengan gugus alkil penyusun dinding sel B. cereus maka hidrofobisitas bakteri semakin meningkat. Gugus metil n-oktana mampu berikatan dengan gugus fosfat dari dinding sel bakteri (Marin et al. 1997), dimana semakin tinggi jumlah n-oktana yang
0 10 20 30 40 50 60 70 80 0.3 0.6 0.9 1.2 1.5 1.8 Volume n-oktana (ml) % Hidrofobisitas Etilasetat 2% Etilasetat 4% Etilasetat 6%
ditambahkan akan semakin banyak yang berikatan dengan gugus fosfat dari dinding sel bakteri.
Gambar 7.3 Pengaruh Konsentrasi Ekstrak Metanol Andaliman dan Volume n-Oktana terhadap Hidrofobisitas B. cereus
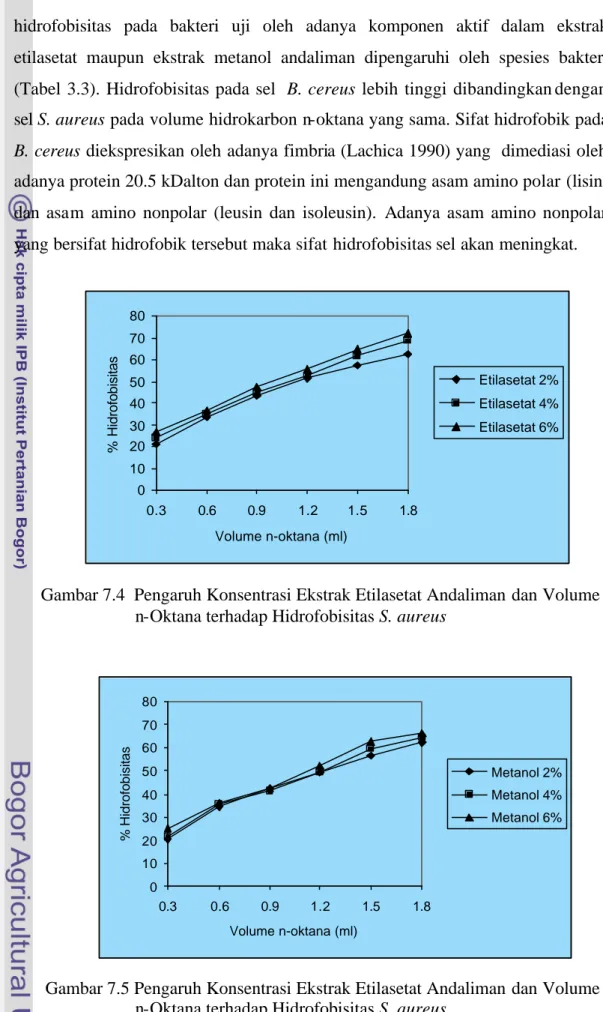
Pengaruh ekstrak etilasetat andaliman memberikan pengaruh yang berbeda nyata (p<0.01) terhadap hidrofobisitas S. aureus (Gambar 7.4), sedangkan ekstrak metanol tidak berpengaruh nyata (p>0.01) terhadap hidrofobisitas S. aureus (Gambar 7.5). Ekstrak etilasetat dan ekstrak metanol andaliman dengan konsentrasi 2, 4, dan 6% (w/w) memberikan nilai hidrofobisitas kuat terhadap
S. aureus masing- masing dengan kisaran 62.35-71.95% sedangkan ekstrak
metanol nilai hidrofobisitasnya lebih rendah yaitu berkisar 62.20-66.15%. Semakin tinggi konsentrasi ekstrak etilasetat maupun ekstrak metanol akan semakin tinggi komponen aktif yang terdapat pada ekstrak untuk berinteraksi dengan dinding sel bakteri sehingga komponen hidrofobik yang tidak berikatan dengan komponen aktif akan berinteraksi dengan n-oktana. Semakin tinggi interaksi komponen ekstrak etilasetat maupun metanol akan menunjukkan peningkatan hidrofobisitas S. aureus, hal ini akan menyebabkan terjadinya kerusakan dinding sel. Semakin tinggi hidrofobisitas maka kerusakan dinding sel juga akan semakin tinggi.
Hidrofobisitas S. aureus tertinggi diperoleh pada konsentrasi ekstrak etilasetat dan ekstrak metanol masing- masing 6% (w/w). Peningkatan
0 10 20 30 40 50 60 70 80 0.3 0.6 0.9 1.2 1.5 1.8 Volume n-oktana (ml) % Hidrofobisitas Metanol 2% Metanol 4% Metanol 6%
hidrofobisitas pada bakteri uji oleh adanya komponen aktif dalam ekstrak etilasetat maupun ekstrak metanol andaliman dipengaruhi oleh spesies bakteri (Tabel 3.3). Hidrofobisitas pada sel B. cereus lebih tinggi dibandingkan dengan sel S. aureus pada volume hidrokarbon n-oktana yang sama. Sifat hidrofobik pada
B. cereus diekspresikan oleh adanya fimbria (Lachica 1990) yang dimediasi oleh
adanya protein 20.5 kDalton dan protein ini mengandung asam amino polar (lisin) dan asam amino nonpolar (leusin dan isoleusin). Adanya asam amino nonpolar yang bersifat hidrofobik tersebut maka sifat hidrofobisitas sel akan meningkat.
Gambar 7.4 Pengaruh Konsentrasi Ekstrak Etilasetat Andaliman dan Volume n-Oktana terhadap Hidrofobisitas S. aureus
Gambar 7.5 Pengaruh Konsentrasi Ekstrak Etilasetat Andaliman dan Volume n-Oktana terhadap Hidrofobisitas S. aureus
0 10 20 30 40 50 60 70 80 0.3 0.6 0.9 1.2 1.5 1.8 Volume n-oktana (ml) % Hidrofobisitas Etilasetat 2% Etilasetat 4% Etilasetat 6% 0 10 20 30 40 50 60 70 80 0.3 0.6 0.9 1.2 1.5 1.8 Volume n-oktana (ml) % Hidrofobisitas Metanol 2% Metanol 4% Metanol 6%
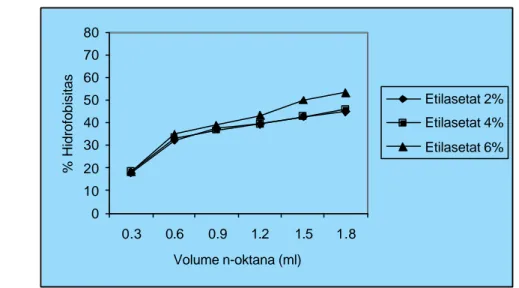
Ekstrak etilasetat andaliman memberikan pengaruh berbeda nyata (p<0.01) terhadap hidrofobisitas S. Typhimurium (Gambar 7.6), sedangkan ekstrak metanol menunjukkan pengaruh yang tidak berbeda nyata (p>0.01) terhadap hidrofobisitas
S. Typhimurium (Gambar 7.7).
Gambar 7.6 Pengaruh Konsentrasi Ekstrak Etilasetat Andaliman dan Volume n-Oktana terhadap Hidrofobisitas S. Typhimurium
Gambar 7.7 Pengaruh Konsentrasi Ekstrak Etilasetat Andaliman dan Volume n-Oktana terhadap Hidrofobisitas S. Typhimurium
Ekstrak etilasetat dan ekstrak metanol andaliman pada konsentrasi 2, 4, dan 6% (w/w) memberikan nilai hidrofobisitas moderat terhadap S. Typhimurium dengan kisaran 44.75-53.28% dan 41.44-50.02% lebih rendah dibandingkan
0 10 20 30 40 50 60 70 80 0.3 0.6 0.9 1.2 1.5 1.8 Volume n-oktana (ml) % Hidrofobisitas Etilasetat 2% Etilasetat 4% Etilasetat 6% 0 10 20 30 40 50 60 70 80 0.3 0.6 0.9 1.2 1.5 1.8 Volume n-oktana (ml) % Hidrofobisitas Metanol 2% Metanol 4% Metanol 6%
B. cereus dan S. aureus. Menurut Santos et al. (1990) kriteria hidrofobisitas
bakteri dengan metode BATH (Bacterial Adherence to Hydrocarbons) dikelompokkan hidrofobisitas kuat (>50%), moderat (0-50%) dan negatif
(<20%). Pengaruh ekstrak etilasetat pada konsentrasi 2 dan 4% terhadap
S. Typhimurium dapat termasuk dalam hidrofobisitas moderat, sedangkan
konsentrasi 6% termasuk dalam hidrofobisitas kuat (53.28%). Hidrofobisitas
S. Typhimurium tertinggi diperoleh pada konsentrasi ekstrak etilasetat dan ekstrak
metanol masing- masing pada konsentrasi 6%. Ekstrak metanol hingga konsentrasi
6% tidak mempengaruhi nilai hidrofobisitas S. Typhimurium. Hidrofobisitas
S. Typhimurium lebih rendah dibandingkan dengan B. cereus dan S. aureus.
Rendahnya hidrofobisitas S. Typhimurium (bakteri Gram negatif) dapat dijelaskan dalam hubungannya dengan komponen dinding sel seperti fosfolipid, lipopolisakarida dan komponen luar sel seperti fimbria dan kapsul. Komponen ini mempunyai fungsi penempelan pada sel inang dengan membentuk interaksi hidrofobik (Finlay dan Falkow 1997). Menurut Nikaido (1996) fosfolipid pada
S. Typhimurium banyak mengandung fosfatidiletanolamin yang mengandung
asam amino polar dan LPS dengan komponen polisakarida yang relatif lebih tinggi. Keragaman komponen penyusun dinding sel, komponen membran terluar dan komponen yang memberikan fungsi (fimbria dan kapsul) terhadap sifat hidrofobik bakteri menyebabkan setiap spesies dan galur bakteri mengekspresikan hidrofobisitas yang berbeda.
Jones et al. (1991) melaporkan bahwa penambahan taurolidin 2.0% meningkatkan hidrofobisitas sebesar 5.13% pada E. coli dan 15.16% pada
Staphylococcus saprophyticus, sedangkan klorheksidin asetat dengan konsentrasi
0.075% dapat menurunkan hidrofobisitas sebesar 24.69% pada E. coli dan sebaliknya meningkatkan hidrofobisitas sebesar 36.72% pada S. saprophyticus.
Menurut Rosenberg dan Sar (1990), perubahan hidrofobisitas pada bakteri yang diakibatkan oleh komponen bioaktif (sama seperti yang terdapat dalam ekstrak andaliman) seperti alkaloid, glikosida, flavonoid dan steroid. Hal ini dapat dijelaskan sebagai berikut: (1) terjadinya peningkatan hidrofobisitas pada sel
B. cereus dan S. aureus dan S. Typhimurium, kemungkinan disebabkan oleh
menonjol adalah LPS yang meningkatkan hidrofobisitas bakteri. Menurut Sunairi
et al. (1997) perubahan kapsul bakteri yang simetris karena adanya perlakuan
antibakteri menjadikan bakteri lebih bersifat hidrofobik. Kemungkinan ini karena komponen aktif dalam ekstrak etilasetat bersifat sebagai surfaktan dan berinteraksi dengan senyawa lipoprotein dan memberikan efek peningkatan hidrofobik. (2) Penurunan hidrofobisitas pada S. Typhimurium kemungkinan disebabkan oleh senyawa komponen aktif pada ekstrak metanol seperti fenolik hidrokuinon berinteraksi dengan fimbria dan mengakibatkan penggumpalan protein subunit 20.5 kDalton, sehingga protein ini kehilangan struktur hidrofobiknya dan mengakibatkan hidrofobisitas bakteri menurun.
Peningkatan hidrofobisitas akibat perlakuan ekstrak etilasetat lebih besar daripada ekstrak metanol. Hal ini menunjukkan bahwa perubahan dinding sel oleh ekstrak etilasetat lebih berpotensi meningkatkan hidrofobisitas dibandingkan dengan ekstrak metanol. Komponen protein dan karbohidrat yang terdapat dalam ekstrak uji dapat mengikat sisi hidrofilik dari bakteri. Menurut Duncan-Hewitt (1990) interaksi yang terjadi seperti halnya penambahan 1% SDS yang meningkatkan hidrofobisitas pada sel B. cereus, disebabkan karena SDS dapat mengikat pada sisi hidrofobik. Peningkatan hidrofobisitas juga dapat disebabkan karena penambahan enzim lisozim yang dapat menghilangkan peptidoglikan.
Perubahan hidrofobisitas bakteri B. cereus, S. aureus dan S. Typhimurium menunjukkan perubahan struktur permukaan dinding sel bakteri. Pada komponen permukaan bakteri juga terdapat protein yang mengkoordinasi produksi protein ekstraseluler termasuk toksin, maka adanya perubahan hidrofobisitas pada bakteri juga menghambat faktor virulensi yang lain. Selain itu perubahan hidrofobisitas yang meningkat maupun menurun kemungkinan dapat menghambat virulensi khususnya terhadap pelekatan bakteri pada sel inang (Jones et al. 1991).
SIMPULAN
Ekstrak etilasetat andaliman memiliki penghambatan paling tinggi dibandingkan ekstrak metanol baik terhadap sel maupun terhadap protoplast sel
etilasetat dengan diameter penghambatan sebesar 19.62 mm, pada S. aureus sebesar 16.15 mm, sedangkan penghambatan oleh ekstrak metanol andaliman lebih rendah yaitu masing- masing sebesar 14.85 dan 11.55 mm. Protoplast dan sel vegetatif S. aureus lebih tahan terhadap ekstrak metanol andaliman.
Hidrofobisitas bakteri lebih tinggi pada B. cereus, S. aureus dan
S. Typhimurium menunjukkan adanya perubahan struktur permukaan sel bakteri.
Ekstrak etilasetat dan ekstrak metanol andaliman pada konsentrasi 2, 4, dan 6% (w/w) mempengaruhi hidrofobisitas. Bakteri S. Typhimurium lebih tahan terhadap hidrofobisitas baik oleh ekstrak etilasetat maupun ekstrak metanol. Hal ini disebabkan S. Typhimurium memiliki membran luar yang dapat menurunkan hidrofobisitas. Hidrofobisitas B. cereus tertinggi diperoleh pada konsentrasi ekstrak etilasetat dan ekstrak metanol masing- masing 6%. Semakin tinggi konsentrasi ekstrak andaliman yang ditambahkan pada B. cereus, S. aureus dan
S. Typhimurium maka nilai hidrofobisitas juga semakin tinggi.
DAFTAR PUSTAKA
Alakomi HL, Skytta E, Saarela M, Mattila-Sandholm T. 2000. Lactic acid permeabilizes gram-negative bacteria by disrupting the outer membrane.
Appl Environ Microbiol 66:2001-2005.
Best GK. 1999. Antibacterial Chemotheraphy.
http://pharminto.com/publ/msb/newdrgs.html. [18 Agu 1999]
Bisignano G, Sanogo R, Marino A, Aquino R, D’Angelo V, Germano MP, De Pasquale R dan Pizza C. 2000. Antimicrobial activityof Mitracarpus
scaber extract and isolated constituents. Letter Appl Microb 30: 105-108.
Duncan-Hewitt WD. 1990. Natural of the Hydrophobic effect. Di dalam: Doyle RJ, dan Rosenberg M, editor. Microbial Cell Surface Hydrophobicity. American Society for Microbiology. Washington DC.
Finlay BB dan Falkow S. 1997. Common themes in microbial pathogenicity revisited. Microbiology and Molecular Biology Reviews. hlm:136-169.
Gorman SP, 1991. Microbial adherence and biofilm production. Di dalam Denyer SP, dan Hugo WB. Mechanism of Action of Chemical Biocides Their
Harrigan WF. 1998. Laboratory Methods in Food Microbiology. 3rd edition. San Diego.
Hugo WB dan Russel AD. 1987. Pharmaceutical microbiology. Di dalam: Denyer SP dan Hugo WB. (eds). Mechanism of Action of Chemical Biocides. Blackwell Scientific Publicat., Oxford.
Jawetz E, Melnick J dan Adelberg E. 1996. Medical Microbiology. Appleton & Lange. San Fransisco.
Jones D, Gorman S, Mccafferty DF dan Woolfson AD. 1991. The effects of three non-antibiotic, antimicrobial agents on the surface hydrophobicity of certain microorganism evaluated by difference methods. J Appl Bacteriol 71: 218-227.
Kim JM, Marshal MR, Cornell JA, Boston JF dan Wei CI. 1995. Antibacterial activity of carcacrol, citral and geraniols againts Salmonella typhimurium in culture medium and fish cubes. J Food Sci 60 (6): 1365-1368.
Lachica RV. 1990. Significance of hydrophobicity in the adhesiveness of pathogenic Gram negative bacteria. Di dalam Doyle RJ dan Rosenberg M, editor. Microbiol Cell Surface Hydrophobicity. American Society for microbiology. Washingyon DC.
Lee KK, Yli KC. 1996. A Comparison of three methods for assaying hydrophobicity of pathogenic Vibrio.J Letters In Appl Microbiol 13:343-346
Lewis K, Salyers AA, Taber HW, Wax RG. 2004. Bacterial Resistance to
Antimicrobials. Marcel Dekker, Inc.
Madigan MT, Martinko JM, Parker J. 2003. Brock Biology of Microorganisms. Tenth Edition. Southern Illinois University Carbondale.
Marin ML, Benito Y, Pin C, Fernandez MF, Garcia ML, Selgas MD, Cases C. 1997. Lactic acid bacteria: hydrophobicity and strength of attachment to meat surfaces. Letters in Appl Microbiol 24:14-18.
Nikaido H. 1996. Outer membrane. Di dalam: Neidhardt FC. (Ed). Escherichi coli and Salmonella. ASM Press. Washington D.C.
Nishina AK, KinaichiH, Uchibori T, Seino H dan Osawa T. 1991. 2,6-dimethoxy-p-benzequinone as an antimicrobial substance in the bark of Phyllostachys
heterocyclavar. Pubscens a species of thick-stemmed bamboo. J Agric Food Chem 39:266-269.
Nuraida L, Andarwulan N dan Kristikasari E. 1999. Aktivitas antimikroba biji picung (Pangium edule Reinw.) segar dan terfermentasi terhadap bakteri patogen dan perusak makanan. J Ilmu dan Tek Pangan 4 (2): 18-26.
Nychas GJE.1995. Natural antimicrobials from plants. Di Dalam: Gould GW. (Eds). New Methods of Food Preservation. Blackie Academic and Profesional. London.
Rosenberg, E and N. Sar. 1990. Changes in bacterial surface hydrofobicity during morphogenesis and differentiation. Di dalam: Doyle RJ dan Rosenberg M, editor. Microbial Cell Surface Hydrophobicity. American Societyof for Microbiology. Washington. DC.
Sakanaka S, Kim M, Taniguchi M, Yamamoto T. 1989. Antibacterial substances in Japanese green tea extract against Streptococcus mutan, a cariogenic bacterium. Agric Biol Chem 53(9):2307-2311.
Stratford M. 2000. Traditional preservatives-organic acids. Di dalam: Robinson RK, Batt CA, Patel PD, editor. Encyclopedia of Food Microbiology. Volume 1. London: Academic Press.
Sunairi M, Iwabuchi N, Yoshizawa Y, Murooka H,. Murosaki H and Nakajima M. 1997. Cell-surface hydrofobicity and scum formation of Rhodococcus
rhodochrous strain with different colonial morphologies. J Appl Microbiol
82:204-210
William P dan Gledhill L. 1991. Fractionation of bacterial cell and isolation of membranes and macromolecules. Di dalam: Denyer SP, Hugo WB, editor.
Mechanism of Action of Chemical Biocides. Oxford: Blackwell Scientific