BAB II
TINJAUAN PUSTAKA
2.1. Bakteri Asam Laktat (BAL)
Bakteri asam laktat merupakan bakteri Gram positif, tidak berspora, berbentuk batang maupun kokus, bersifat fakultatif anaerobik (Fardiaz, 1992), memproduksi asam laktat sebagai hasil akhir fermentasi glukosa, pada umumnya katalase negatif (Leistner, 2000). Beberapa spesies BAL ditemukan juga tergolong katalase positif seperti : Bacillus coagulans dan Sporolactobacillus (Vecchi and Drago, 2006). BAL secara umum dibagi menjadi dua kelompok, homofermentatif dan heterofermentatif. Kelompok homofermentatif hanya menghasilkan asam laktat selama proses fermentasi gula sedangkan heterofermentatif dapat membentuk sejumlah karbondioksida, etil alkohol, asam asetat, dan gliserol bersamaan dengan sejumlah besar asam laktat. Sifat yang terpenting dari BAL adalah kemampuannya dalam memfermentasi gula manjadi asam laktat.
BAL mampu menghasilkan zat antimikroba yang dapat menghambat pertumbuhan dan aktivitas mikroba (Salminem et al. 2004). Asam organik dalam bahan pangan dapat berfungsi sebagai asidulan atau pengawet, sementara garam atau ester dapat menjadi antimikroba yang efektif pada pH yang mendekati netral. Hasil utama metabolit BAL berupa asam laktat dapat menyebabkan perubahan pH secara signifikan. Terbentuknya asam laktat dan asam organik oleh BAL dapat menyebabkan penurunan pH dan mengakibatkan mikroba yang tidak tahan terhadap kondisi pH yang relatif rendah akan terhambat (Fardiaz, 1992). Aktivitas asam-asam lipofilik seperti asam laktat dan asetat dalam bentuk tidak terdisosiasi dapat menembus sel mikroba dan pada pH intraseluler yang lebih tinggi, berdisosiasi menghasilkan ion-ion hidrogen dan mengganggu fungsi metabolik esensial seperti translokasi substrat dan fosforilasi oksidatif dengan demikian mereduksi pH intraseluler (Cabo et al. 2000).
Beberapa genus bakteri dapat menghasilkan peptida yang bersifat antimikroba yang kemudian lebih dikenal dengan nama bakteriosin. Bakteriosin sering diartikan sebagai protein dengan efek antagonistik sebagai bakterisidal atau bakteriostatik terhadap pertumbuhan bakteri. Berbagai genus bakteri Gram positif dan Gram negatif telah dilaporkan menghasilkan bakteriosin diantaranya genus Lactobacillus, Micrococcus, Staphylococcus, Streptococcus, Pseudomonas, dan Carnobakterium (Suarsana, 2003).
L. plantarum adalah bakteri asam laktat dari famili Lactobacilliceae dan genus Lactobacillus. Bakteri ini bersifat Gram positif, non motil, dan berukuran 0,6-0,8 μm x 1,2-6,0 μm (Holt et al. 2000). L. plantarum mampu menghasilkan asam laktat dan penghasil hidrogen peroksida tertinggi dibandingkan bakteri asam laktat lainnya selain itu juga menghasilkan bakteriosin yang merupakan senyawa protein yang bersifat bakterisidal dan dapat menyebabkan kematian sel dengan cepat walaupun pada konsentrasi rendah (Permanasari, 2004). Bakteriosin yang dihasilkan L. plantarum diketahui mampu menghambat pertumbuhan S. aureus (Branen, 1993) dan S. agalactiae (Lubas et al. 2012).
BAL memiliki peranan penting pada organisme akuakultur. Verschuere et al. (2000) melaporkan bahwa BAL dapat digunakan sebagai agensia pengendalian biologis terhadap mikroba patogen atau parasit pada organisme akuakultur diantaranya pada ikan, telur ikan dan Crustacea karena dapat bersifat antimikroba dan tidak berbahaya bagi organisme akuakultur. Parker (1994) melaporkan hasil penelitiannya, bahwa BAL dapat digunakan sebagai agen biologis dalam menghambat pertumbuhan bakteri patogen pada larva ikan. L. plantarum merupakan salah satu spesies BAL yang dijadikan pengganti antibiotik pada hewan akuakultur dalam mencegah timbulnya penyakit dan pengontrol kualitas air (Fuller, 1989). Kemampuan BAL dalam menghambat pertumbuhan bakteri pathogen S. agalactiae telah banyak dilaporkan, beberapa spesies BAL tersebut diantaranya Pediococcus pentosaceus (Harijani, 2010), L. aciodophilus, L. brevis, L. fermentum, dan Weissella confuse (Serna et al. 2011).
2.2. Streptococcus agalactiae
S. agalactiae merupakan Grup B Streptococcus (GBS), bakteri Gram positif, berbentuk kokus, tidak dapat tumbuh pada suhu dibawah 10 0C, fermentasi oksidatif positif dan uji katalase negatif (Abuseliana et al, 2011 ; Evans et al, 2006 ; Hardi et al. 2011). Hal ini didukung dari pengujian oleh Evans et al. (2002), bahwa S. agalactiae termasuk bakteri Gram positif, oksidase negatif, uji katalase negatif, isolat menunjukkan hasil positif pada reaksi leucine aminopeptidase, arginin deaminase dan trehalose.
Sheehan et al. (2009) mengelompokan S. agalactiae dalam dua tipe yaitu tipe 1 (β-hemolitik) dan tipe 2 (non-hemolitik). Tipe 1 mampu melisis eritrosit dengan sempurna yang ditunjukkan dengan adanya zona bening pada media agar darah. Sedangkan tipe 2 tidak mampu melisis eritrosit sehingga tidak terbentuk zona bening pada media agar darah. Tipe 2 dikatakan lebih virulen dibanding tipe 1 dilihat dari jumlah kematian yang lebih cepat dan banyak. Bakteri tipe 2 menyebabkan kematian pada ikan nila setelah 6-24 jam sedangkan tipe 1 baru menyebabkan kematian setelah 48 jam pasca injeksi (Hardi et al. 2011).
Penyerangan S. agalactiae dipengaruhi oleh faktor suhu pada lingkungan (Sepahi et al, 2013). Selanjutnya Sepahi et al, (2013) melaporkan ada hubungan yang jelas antara suhu dan mortalitas pada Oncorhynchus mykiss dengan Streptococcus agalactiae. Pada suhu 12 ºC, ikan tidak menunjukkan penyakit klinis Streptococcosis sedangkan pada suhu 18 ºC, kematian mulai tumbuh pesat bahkan dari hari pertama suntikan bakteri. Pada suhu 40 0C lebih meningkatkan patogenesitas S. agalactiae dibandingkan pada suhu 30 0C, hal ini terkait dengan ukuran zona hemolisis yang terbentuk (Mereghetti et al. 2008). Selanjutnya hasil penelitian di China menunjukkan patogenesitas dari S. agalactiae akan semakin meningkat pada bulan Juli-Oktober disebabkan peningkatan suhu yang terjadi sehingga kerentanan ikan nila terhadap S. agalactiae semakin meningkat (Wang et al. 2013).
S. agalactiae bersifat patogen dan dilaporkan telah menginfeksi manusia, hewan darat dan hewan laut (Abuseliana et al. 2011). S. agalactiae umumnya menyerang manusia pada saluran vagina hingga menyebabkan mandul. Penyakit lainnya akibat serangan S. agalactiae yaitu meningitis (Delanoy et al. 2013), infeksi saluran kemih, arthritis, infeksi saluran pernafasan (Chaiwarith et al. 2011). Infeksi pada hewan darat contohnya mastitis pada sapi (Sorensen et al. 2010). Wabah streptococcocis karena S. agalactiae telah menyerang dan menyebabkan kematian pada ikan mullet di teluk Kuwait (Jaffar et al. 2008), lumba-lumba (Tursiops truncatus) (Pasnik et al. 2009). S. agalactiae juga merupakan patogen utama dalam ikan budidaya, khususnya nila (Giordano et al. 2010, Abuseliana et al. 2010, Abuseliana et al. 2011). Serangan yang ditimbulkan S. agalactiae telah mengakibatkan meningitis otak pada ikan nila sehingga ikan kehilangan keseimbangan dan terjadi kelainan pola renang (Abuseliana et al. 2011).
Streptococcosis dapat disebabkan strain S. agalactiae yang sama pada manusia dan ikan. S. agalactiae ST 283 ditemukan menjadi penyebab meningitis pada manusia di Asia Tenggara, sementara strain yang sama juga di ditemukan menyerang ikan nila (Delanoy et al. 2013). S. agalactiae yang menyerang ikan dapat bersifaf zoonotic (menular) pada manusia dan begitu sebaliknya. Penularan dapat terjadi melalui limbah yang berasal dari saluran urogenital dari manusia yang terserang penyakit ini (Delanoy et al. 2013). Infeksi streptokokus terjadi setelah mengkonsumsi bahan yang mengandung organisme streptokokus, melalui feses ikan yang mengandung S. agalactiae dan kemudian terakumulasi di lingkungan air dan masuk melalui oral pada ikan (Pasnik et al. 2009). Sedangkan Garcia et al. (2008), melaporkan hal yang berbeda pada hewan ternak. S. agalactiae yang berasal dari ternak sapi tidak menular pada ikan nila dan lele sehingga tidak dapat menginfeksi. Hal ini dikarenakan ketidakmampuan S. agalactiae bertahan dalam tubuh ikan nila dan lele.
S. agalactiae yang diisolasi dari ikan nila yang terinfeksi secara alami mampu mereproduksi penyakit pada juvenil ikan nila dan menyebabkan kematian sebanyak 55% dalam waktu 10 hari (Abuseliana et al. 2011). Giordano et al. (2010), melaporkan terjadi kematian mencapai 90% pada ikan yang diinjeksi S. agalactiae pada bagian intraperitoneal dengan dosis 1,5 x 108CFU/ikan dan 67,5% pada ikan yang diinjeksi S. agalactiae pada bagian intraperitoneal dengan dosis 1,5 x 106 CFU/ikan.
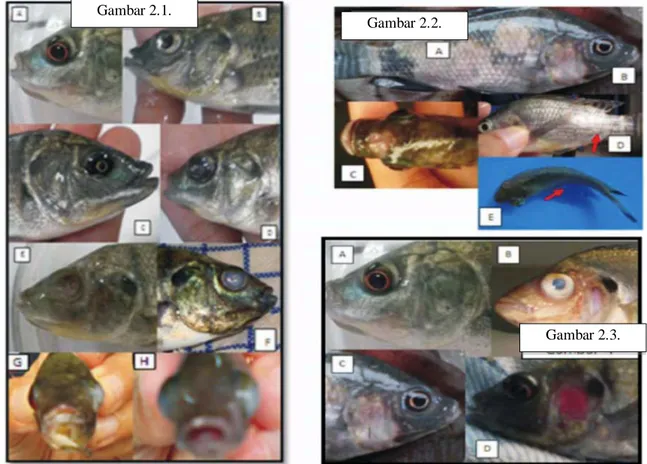
Gambar 2.1 Perubahan yang terjadi pada organ mata ikan nila; A. normal; B. mata
mengkerut, C. pupil mata mengecil; D.opacity (kekeruhan mata); E. mata lisis dan F. purulens (mata putih). G. lateral eksotalmia, H.
bilateral eksotalmia.
Gambar 2.2 Perubahan pada permukaan tubuh A. warna tubuh pucat; B. bibir pucat
dan memutih; C. ulcer pada bagian kepala; D. abses pada bagian tubuh; E. tubuh membentuk huruf “C”.
Gambar 2.3 Perubahan pada operkulum A. normal; B & C clear operculum, D. clear
operculum disertai pendarahan.
Gambar 2.1.
Gambar 2.2.
Gejala awal yang di timbulkan dari streptococcosis pada ikan nila yaitu kelesuan, kehilangan nafsu makan (Abuseliana et al. 2011 ; Giordano et al. 2010 ; Pasnik et al. 2009). Perubahan pada aktivitas makan ikan nila pasca diinjeksi dengan S. agalactiae mulai tampak pada 24 jam awal. Ikan mulai lambat merespon pakan yang diberikan dan jumlah pakan yang dimakan juga berkurang (Hardi et al. 2011). Gejala eksternal yang ditimbulkan yaitu pengelompokan di bagian bawah akuarium dan berenang abnormal, beberapa ikan menunjukka n penonjolan bola mata (Gambar 2.1), perut buncit, bentuk tubuh seperti huruf “C” (Gambar 2.2), erosi ekor, dan perdarahan di rahang bawah (Gambar 2.3) (Abuseliana et al. 2011 ; Hernandez et al. 2009 ; Wang et al. 2013). Gejala lainnya berupa warna feses yang semakin buram memutih dan berlendir dari hari ke hari (Pasnik et al. 2009). Sedangkan gejala internal diantaranya perbesaran hati, kandung empedu dan limpa serta perubahan warna organ pucat. S. agalactiae yang menyerang usus biasanya mengandung lendir berwarna kuning (Wang et al. 2013). Gejala serupa secara alami dan eksperimen juga dilaporkan dari berbagai Negara diantaranya Brazil (Salvador et al. 2005).
Menurut Hardi et al. (2008), bagian yang bersifat virulen pada S. agalactiae adalah toksisitas produk ekstraseluler. Pengujian toksisitas produk ekstraseluler S. agalactiae tipe β-hemolitik dan non-hemolitik menghasilkan simpulan bahwa produk ekstraselular merupakan salah satu faktor virulensi S. agalactiae, karena gejala yang muncul pada ikan nila saat diinjeksi dengan produk ekstraseluler sama dengan gejala yang ditemukan pada ikan nila yang diinjeksi dengan sel utuh S. agalactiae. Penginjeksian dengan produk ekstraseluler menyebabkan kerusakan sel lebih cepat dibandingkan dengan penginjeksian sel utuh S. agalactiae hal ini dikarenakan produk ekstraseluler langsung beredar keseluruh tubuh dan mempengaruhi kerja dan metabolisme sel lebih cepat dibandingkan dengan bakteri sel utuh yang harus berkembang berada dalam sel yang rusak untuk memproduksi dan mengeluarkan eksotoksinnya.
2.3. Biofilm
Biofilm merupakan kumpulan sel mikroorganisme yang menempel pada permukaan padat dalam lingkungan yang berair dan bersifat irreversible (Kokare et al. 2009). Penempelan biofilm dapat terjadi pada permukaan biotik dan nonbiotik. Ketebalan biofilm berkisar 5-50 µm. Peningkatan ketebalan koloni bakteri dalam membentuk biofilm dapat mencapai 100-200 µm. Biofilm tersusun dari sel-sel mikroorganisme dan eksopolisakarida (EPS) (Olson, 2002). Mikroorganisme dalam biofilm hidup dalam matriks yang diproduksi oleh mikroorganisme itu sendiri dari bahan EPS yang membentuk lingkungan bagi mikroorganisme tersebut (Flemming and Wingender, 2008). EPS yang terkandung dalam biofilm seperti DNA ekstraseluler (eDNA), polisakarida ekstraseluler, serat amiloid, dan protein biofilm saling terkait. Komponen matrik ini menjadi target baik untuk berkombinasi dengan enzim putatif seperti DNases, protease, dan penurunan enzim ekstraseluler polisakarida untuk mencegah pembentukan biofilm atau merangsang penyebaran biofilm yang sudah terbentuk (Abee et al. 2011).
Biofilm tidak hanya berupa kumpulan sel yang menempel pada permukaan, namun secara struktural dan dinamis berupa sistem biologi yang komplek. Hal ini adalah bentuk perlindungan dari kondisi lingkungan yang tidak mendukung pertumbuhan sel. Selanjutnya, sel ini akan menyebar ke kepermukaan yang baru disekitarnya (Stoodley et al. 2006). Sel biofilm ini dilindungi dari bahan kimia antibakteri (termasuk alam antibiotik), bakteriofag lingkungan, sehingga biofilm sulit dihancurkan (Donlan, 2002).
Faktor pembentukan dan penyebaran biofilm diantaranya sistem quorum sensing dan molekul seperti autoinducer 2 (AI-2) (Abee et al. 2011). Faktor lainnya yaitu motilitas, bakteri yang bersifat motil telah diindikasikan menjadi faktor penting selama pembentukan biofilm atau penempelan sel ke permukaan. Motilitas penting untuk pembentukan biofilm statis tetapi tidak untuk pembentukan biofilm di bawah aliran (Abee et al. 2011). Menurut Marshal dalam
permukaan dalam pembentukan biofilm meliputi; ketersediaan nutrisi, suhu, pH, aliran material.
Menurut Stoodley et al. (2002), empat alasan penyebab terbentuknya biofilm yaitu (1) biofilm adalah alat pertahanan diri mikroba, biofilm menolak kekuatan fisik yang bisa menyapu sel terikat, (2) pembentukan biofilm memungkinkan sel untuk tetap di zona yang menguntungkan, (3) Biofilm memungkinkan sel-sel bakteri hidup dalam hubungan erat satu sama lain, (4) memfasilitasi komunikasi antar sel dan meningkatkan peluang untuk bertahan hidup. Menurut Aparna and Yadav (2008), pembentukan biofilm tersusun dari beberapa tahapan. Tahap pertama, terbentuknya biofilm dimulai dengan perlekatan sel mikroba planktonik pada permukaan substrat. Meskipun mikroba mempunyai kemampuan adhesi yang sama pada semua jenis substrat, namun sifat permukaan yang kasar lebih disenangi, dan lebih cepat terbentuk pada material hidrofobik seperti teflon dan plastik dibandingkan pada gelas dan logam. Setelah itu, koloni akan mengikatkan diri lebih kuat pada permukaan dengan menggunakan pili. Selama tahap ini, sel bakteri mengalami pertumbuhan logaritmik.
Tahap kedua, bakteri mengalami multiflikasi sambil mengeluarkan sinyal kimia untuk berkomunikasi secara internal. Substansi EPS mulai dihasilkan berdasarkan mekanisme genetik. EPS kemudian akan mentrap nutrien dan bakteri planktonik. Agregat sel terbentuk sementara motilitas sel menjadi semakin menurun sejalan dengan semakin progresifnya lapisan agregat (Aparna and Yadav, 2008). Tahap ketiga. Selama tahap maturasi, biofilm terus tumbuh sejalan dengan pertumbuhan koloni. Semakin lama biofilm semakin berkembang dengan pertambahan ukuran dan perubahan bentuk.Pada tahap ini, ketebalan biofilm lebih dari 10 µm (Aparna and Yadav, 2008).
Tahap keempat, ketebalan lapisan biofilm pada tahap ini mencapai lebih dari 100 mm (Aparna and Yadav, 2008) dan dapat mencapai 300-400 mm seperti
yang dibentuk oleh algal mats. Pada tahap dispersi, sel-sel dalam koloni akan terlepas sendiri atau bersama sebagian komponen matriks. Tahap kelima, biofilm akan memasuki tahap ini beberapa hari setelah tahap keempat. Pada tahap ini terjadi disperse sel sehingga memungkinkan beberapa bakteri meninggalkan biofilm untuk berkembang kembali menjadi sel planktonik.
Sel biofilm yang telah terbentuk lebih tahan beribu-ribu kali dibandingkan dengan sel planktonik terhadap bahan-bahan antimikroba, maupun kondisi fisik yang ekstrim seperti panas (Oh and Marshal, 1995). Bakteri patogen yang membentuk biofilm memerlukan usaha pengontrolan yang lebih keras dibanding keadaan planktonik. Pengendalian mikroorganisme patogen yang membentuk biofilm pada permukaan stainless steel telah dilakukan dengan peningkatan suhu dan konsentrasi klorin (Silitonga, 2013). Semakin tinggi suhu dan konsentrasi klorin yang diberikan semakin efektif dalam mengendalikan sel biofilm pada permukaan ketiga bakteri patogen oportunistik Escherichia coli, Staphylococcus sp, dan Salmonella. Pengujian menunjukkan konsentrasi klorin yang paling efektif untuk membunuh sel biofilm adalah 225 ppm selama 2 menit dan suhu yang paling efektif yaitu 100 0C selama 5 menit. Adanya perlakuan fisik dan kimia yaitu panas dan klorin juga mampu mengendalikan biofilm A. hydrophila pada permukaan stainless steel (Bal’a et al. 1999). Biofilm mampu menempel pada permukaan stainless steel pada alat pengolahan makanan laut (Jamilah et al. 2004). Pengendalian mikroorganisme yang membentuk biofilm pada alat-alat pengolahan makanan serta proses dalam pengolahan makanan telah dilakukan dengan menggunakan metode kontrol fisika dan kimia seperti perlakuan panas dan sanitasi kimia. Metode kontrol ini mampu mengendalikan dan menonaktifkan mikroorganisme pada permukaan peralatan dalam pengolahan makanan (Hood and Zottola, 1995).