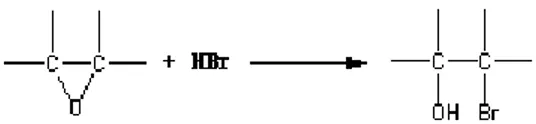KINETIKA DAN OPTIMALISASI REAKSI EPOKSIDASI
METIL ESTER JARAK PAGAR
DENGAN KATALIS AMBERLITE IR-120
JOKO SUHARTO
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
2007
ABSTRAK
JOKO SUHARTO. Kinetika dan Optimalisasi Reaksi Epoksidasi Metil Ester Jarak Pagar Dengan Katalis Amberlite IR-120. Dibimbing oleh PURWANTININGSIH SUGITA dan AHMAD SJAHRIZA.
Dalam pembuatan plastik lazim ditambahkan pemlastis. Pemlastis yang umum digunakan adalah kelompok berbahan dasar minyak bumi (golongan ftalat). Pemlastis ini dalam kurun waktu tertentu dapat bermigrasi dari plastik sehingga membahayakan kesehatan manusia dan tidak ramah lingkungan.
Minyak biji jarak pagar mengandung sekitar 40−60%. Minyak jarak pagar ini berpotensi untuk dikembangkan sebagai bahan dasar pemlastis, selain dimanfaatkan sebagai biodiesel. Kemampuan memlastiskan ini didapat dengan mengepoksidasi metil ester jarak pagar (MEJP) dengan asam perkarboksilat berkataliskan resin asam penukar ion, yaitu Amberlite IR-120. Penelitian ini terdiri atas tiga tahap, yaitu (1) analisis MEJP, (2) optimalisasi dan sintesis MEJP epoksida, dan (3) studi kinetika reaksi epoksidasi yang meliputi penentuan orde reaksi, tetapan laju reaksi (k), dan energi aktivasi (Ea).
Kondisi optimum reaksi epoksidasi MEJP menggunakan Modde 5.0 diperoleh pada suhu 70 oC, dengan waktu reaksi 12 jam dan konsentrasi Amberlite 3%. Nilai bilangan oksirana optimum hasil percobaan sebesar 3.38% sedangkan dengan Modde 5.0 sebesar 3.61%. Studi kinetika reaksi epoksidasi MEJP pada suhu 50, 60, dan 70 oC menunjukkan kinetika orde pertama, dengan nilai k berturut-turut 6.24 × 10-2, 10.17 × 10-2, dan 16.74 × 10-2 jam-1, serta E
a sebesar 45.43 kJ mol-1.
ABSTRACT
JOKO SUHARTO. Kinetics and Optimization of Epoxidation Reaction of Jatropha curcas L. Methyl Ester with Amberlite IR-120 Catalyst. Supervised by PURWANTININGSIH SUGITA and AHMAD SJAHRIZA.
In plastic manufacture, plasticizer is usually added. The commonly used plasticizer was oil-based group (phtalate group). This plasticizer after a periode of time may migrate from the plastic so that it may harm human health and is not environmentally sound.
The seed of Jatropha curcas L. oil contains about 40−60% of oil. This oil is potential to be developed as a raw material for platicizer, as well as for biodiesel. This plasticizing ability is obtained by epoxidizing jatropha methyl ester (MEJP) with percarboxylic acid catalyzed by ion exchange acid resin, Amberlite IR-120.This research consisted of three phases; (1) analysis of MEJP, (2) optimization and synthesis of MEJP epoxide, and (3) kinetic study of the epoxidation reaction including determination of reaction order, reaction rate constants (k), and activation energy (Ea).
Optimum condition of the MEJP epoxidation reaction was obtained at 70 oC, in 12 hours, and 3% concentration of Amberlite IR-120. The optimum oxirane number from this research was 3.38% whereas the value obtained using Modde 5.0 was 3.61%. Kinetic study of MEJP epoxidation reactions at 50, 60, and 70 oC, showed the first order kinetics, with k values of 6.24 × 10-2, 10.17 × 10-2, and 16.74 × 10-2hour-1, respectively, and E
a of 45.43 kJ mol-1.
KINETIKA DAN OPTIMALISASI REAKSI EPOKSIDASI
METIL ESTER JARAK PAGAR
DENGAN KATALIS AMBERLITE IR-120
JOKO SUHARTO
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
2007
Judul : Kinetika dan Optimalisasi Reaksi Epoksidasi Metil Ester Jarak Pagar dengan Katalis Amberlite IR-120
Nama : Joko Suharto NIM : G44202041
Disetujui:
Pembimbing I, Pembimbing II,
Dr. Purwantiningsih Sugita, MS
NIP 131 779 513 Drs. Ahmad Sjahriza NIP 131 842 413
Disetujui:
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam Institut Pertanian Bogor
Prof. Dr. Ir. Yonny Koesmaryono, MS NIP 131 473 999
PRAKATA
Puji syukur kepada Allah SWT atas segala rahmat dan hidayah-Nya sehingga Penulis dapat menyelesaikan karya ilmiah ini. Tema penelitian yang dipilih dalam penelitian ini adalah kinetika dan optimalisasi reaksi epoksidasi minyak nabati dengan judul Kinetika dan Optimalisasi Reaksi Epoksidasi Metil Ester Jarak Pagar dengan Katalis Amberlite IR-120. Dana penelitian ini diperoleh dari Program Hibah Kompetisi A2 Departemen Kimia, Institut Pertanian Bogor.
Dalam penelitian ini penulis banyak mendapatkan bantuan dan bimbingan dari berbagai pihak. Oleh karena itu, penulis mengucapkan terima kasih kepada Dr. Purwantiningsih Sugita, MS dan Drs. Ahmad Sjahriza selaku pembimbing yang telah memberikan bimbingan dan arahan selama penelitian dan penulisan karya ilmiah ini. Penghargaan penulis sampaikan kepada Kak Budi Arifin, SSi, Ibu Yeni, Bapak Sabur, dan staf Laboratorium Kimia Organik IPB atas bantuannya, dan kepada rekan tim epoksida atas saran-sarannya, serta kepada orang tua tercinta atas dukungan moril dan materil selama ini.
Semoga karya ilmiah ini bermanfaat.
Bogor, Juni 2007 Joko Suharto
RIWAYAT HIDUP
Penulis dilahirkan di Sukoharjo pada tanggal 3 Maret 1984 dari ayah Mardjuki dan ibu Suharti. Penulis merupakan putra ketiga dari tiga bersaudara.
Tahun 2002 penulis lulus SMA Al Islam 1 Surakarta dan pada tahun yang sama masuk IPB melalui jalur Undangan Seleksi Masuk IPB (USMI). Penulis memilih Program Studi Kimia, Departemen Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, IPB.
Selama mengikuti perkuliahan, penulis pernah menjadi asisten praktikum Kimia Organik Layanan tahun ajaran 2006/2007, Kimia Bahan Alam tahun ajaran 2006/2007, dan Kimia Pangan tahun ajaran 2006/2007. Pada tahun 2004 penulis melaksanakan praktik lapangan di PT Pindo Deli Pulp and Paper Mills, Karawang.
DAFTAR ISI
Halaman
DAFTAR TABEL ... ii
DAFTAR GAMBAR ... iii
DAFTAR LAMPIRAN ... iv
PENDAHULUAN ... 1
TINJAUAN PUSTAKA Jarak Pagar (Jatropha curcas L.) ... 1
Pemlastis ... 2
Epoksidasi ... 2
Kinetika Reaksi Epoksidasi ... 3
BAHAN DAN METODE Bahan dan Alat ... 4
Metode Penelitian ... 4
HASIL DAN PEMBAHASAN Analisis Metil Ester Jarak Pagar (MEJP) ... 5
Optimalisasi Reaksi Epoksidasi MEJP ... 5
Kinetika Reaksi Epoksidasi MEJP ... 9
SIMPULAN DAN SARAN ... 11
DAFTAR PUSTAKA ... 11
DAFTAR TABEL
Halaman
1 Kandungan asam lemak pada minyak jarak pagar ... 2
2 Ciri mutu MEJP ... 5
3 Senyawa metil ester pada MEJP ... 5
4 Ciri mutu MEJPE ... 5
5 Kondisi optimum reaksi epoksidasi menggunakan Modde 5.0 ... 9
6 Nilai koefisien determinasi (R2) untuk penentuan orde reaksi ... 10
7 Tetapan laju reaksi epoksidasi MEJP ... 10
DAFTAR GAMBAR
Halaman 1 Bunga dan biji jarak pagar (Jatropha curcas L) ... 22 Struktur trigliserida minyak jarak pagar ... 2
3 Reaksi pengikatan iodin ... 3
4 Reaksi pembukaan cincin oksirana oleh HBr ... 3
5 Perangkat radas sintesis epoksidasi MEJP ... 4
6 Reaksi pembukaan cincin oksirana yang disebabkan oleh sisa pereaksi dan produk samping yang terbentuk ... 6
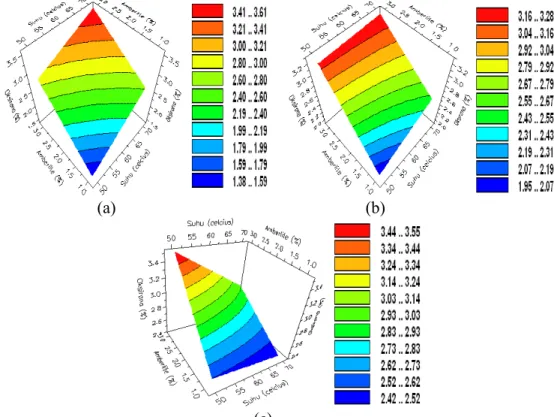
7 Pengaruh suhu dan konsentrasi Amberlite IR-120 pada waktu (a) 12 jam, (b) 24 jam, (c) 36 jam terhadap bilangan oksirana ... 6
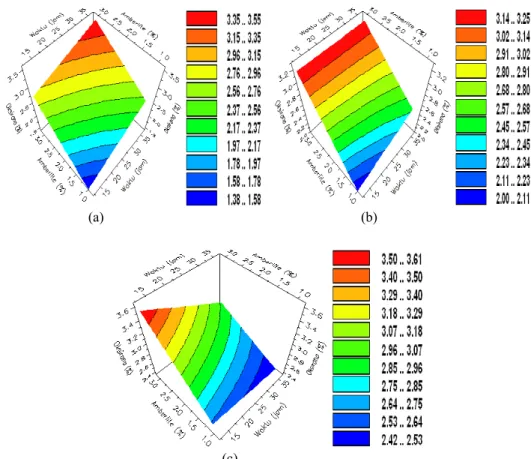
8 Pengaruh waktu dan konsentrasi Amberlite IR-120 pada suhu (a) 50 oC, (b) 60 oC, dan (c) 70 oC terhadap bilangan oksirana ... 7
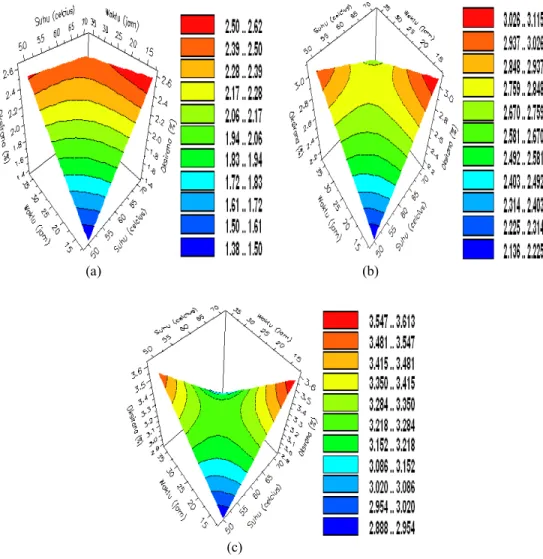
9 Pengaruh suhu dan waktu pada konsentrasi Amberlite IR-120 (a) 1%, (b) 2%, dan (c) 3% terhadap bilangan oksirana ... 8
10 Summary of fit optimalisasi reaksi epoksidasi ... 9
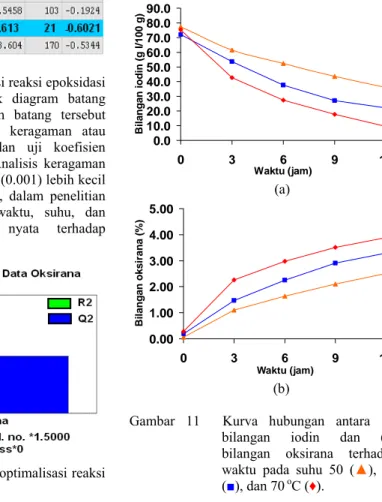
11 Kurva hubungan antara (a) bilangan iodin dan (b) bilangan oksirana terhadap waktu pada suhu 50 (▲), 60(■), dan 70 oC (♦) . ... 9
12 Kurva regresi hubungan antara ln Io/I terhadap waktu pada suhu 50 oC, 60 oC, dan 70 oC untuk penentuan tetapan laju reaksi (k) ... 10
13 Kurva regresi hubungan antara 1/T dengan ln k untuk penentuan energi aktivasi (Ea) ... 11
DAFTAR LAMPIRAN
Halaman 1 Prosedur analisis bilangan oksirana, bilangan iodin,
dan bilangan peroksida ... 14
2 Prosedur síntesis dan optimalisasi reaksi epoksidasi MEJP ... 16
3 Prosedur kinetika reaksi epoksidasi MEJPE ... 17
4 Hasil analisis kandungan senyawa dalam MEJP dengan GC-MS ... 18
5 Analisis gugus fungsi MEJP dan MEJPE dengan FTIR ... 20
6 Spektrum FTIR MEJP ... 21
7 Spektrum FTIR MEJPE ... 22
8 Data optimalisasi sintesis MEJPE ... 23
9 Hasil uji Anova untuk bilangan oksirana ... 24
10 Hasil uji koefisien kuadratik untuk bilangan oksirana ... 24
11 Data untuk penentuan orde reaksi epoksidasi MEJP pada suhu 50, 60, dan 70 oC ... 25
12
Kurva regresi penentuan orde reaksi epoksidasi MEJP
pada suhu 50 (
▲
), 60
(
■
), dan 70
oC (
♦
) ... 25
13 Data penentuan tetapan laju reaksi (k) epoksidasi MEJP
pada suhu 50, 60, dan 70
oC... 26
PENDAHULUAN
Plastik dibuat dari dua jenis komponen. Komponen utamanya adalah polimer atau resin dan komponen kedua adalah zat aditif, yang berguna untuk memberikan sifat unggul seperti warna, ketahanan terhadap pembakaran, kekuatan, dan fleksibilitas. Zat aditif dalam skala luas telah memberikan berbagai macam sifat plastik yang beredar sekarang ini. Salah satu zat aditif yang lazim ditambahkan ke dalam plastik adalah pemlastis (Cavanaugh 1995).
Senyawa turunan ftalat adalah salah satu pemlastis yang umum yang ditambahkan ke dalam produk poli(vinil klorida) (PVC) untuk memberikan kelenturan dan sifat tahan lama. Jenis ftalat yang biasanya digunakan ialah dibutil ftalat (DBP), dimetoksietil ftalat (DMEP), di-(2-etilheksil) ftalat (DEHP), dioktil ftalat (DOP), dan diisononil ftalat (DINP) yang kesemuanya berbahan dasar minyak bumi (Shea 2003). Pemlastis jenis ftalat dapat berpindah ke permukaan plastik, kemudian menguap atau lepas ke lingkungan sehingga dalam waktu lama plastik menjadi rapuh. Pelepasan ftalat menyebabkan melimpahnya polutan tersebut di lingkungan. Menurut EPA’s Toxic Release Inventory,
senyawa ftalat tergolong toksik. Bahkan mulai tahun 2006, Uni Eropa telah mengeluarkan larangan penggunaan pemlastis jenis ester ftalat (Tullo 2005).
Alternatif pengganti pemlastis jenis ftalat adalah pemlastis berbahan dasar minyak nabati. Pemlatis berbahan dasar minyak nabati yang telah dikembangkan di antaranya adalah minyak bunga matahari, minyak beras (rice oil), menhaden oil, asam oleat, dan minyak
kedelai (Chou & Lee 1997, Supriyadi 1992, dan Hazimah et al. 2000). Dibandingkan
dengan pemlastis berbahan baku minyak bumi (petrokimia), pemlastis jenis ini memiliki keunggulan karena mudah terurai dan terbarukan. Pemlastis berbahan baku ester asam lemak dari minyak nabati pernah diteliti oleh Wibowo et al. (2003), yaitu metil ester
dari minyak kelapa sawit. Pemlastis berbahan dasar minyak nabati yang telah menguasai pasar dunia (43%) adalah minyak kedelai epoksida (ESO).
Pemlastis berbahan dasar minyak nabati ataupun dalam bentuk metil esternya dapat dibuat melalui reaksi epoksidasi. Reaksi ini dapat dilakukan dengan menggunakan perasam organik secara in situ, sebagai hasil reaksi asam
karboksilat dengan hidrogen peroksida, yang berfungsi sebagai donor atom oksigen pada ikatan rangkap dalam minyak atau metil ester (Campanella & Baltanas 2005).
Indonesia memiliki banyak sumber daya nabati, di antaranya kelapa sawit, kemiri, saga, kapuk, karet, dan jarak pagar. Penggunaan minyak nabati di Indonesia sekarang ini sudah mulai berkembang, tidak hanya sebatas sebagai minyak untuk industri kosmetik ataupun pangan, tetapi juga sudah dijadikan bahan bakar (biodiesel), untuk mengurangi penggunaan bensin. Namun, penggunaan minyak nabati di Indonesia sebagai pemlastis belum berkembang, padahal di Eropa dan Jepang penggunaan pemlastis ini sudah memasuki tahap aplikasi, yaitu sebagai pengganti ftalat, yang banyak digunakan untuk pembuatan alat-alat medis.
Jarak pagar merupakan tanaman yang sekarang ini banyak diteliti. Shah et al. (2003)
melaporkan bahwa kandungan minyak biji jarak pagar tinggi, sekitar 40─60% (b/b). Minyak jarak pagar memiliki sifat fisik dan kimia yang mirip dengan minyak kedelai. Oleh karena itu, pada penelitian ini akan dikembangkan potensi minyak jarak pagar dalam bentuk metil esternya sebagai bahan dasar pemlastis, selain pemanfaatannya sebagai biodiesel.
Tujuan penelitian ini adalah mempelajari kondisi optimum reaksi epoksidasi metil ester jarak pagar dengan menggunakan tiga peubah yang diragamkan, yaitu waktu, suhu, dan konsentrasi katalis Amberlite IR-120. Parameter yang diamati meliputi bilangan iodin dan bilangan oksirana. Data penelitian ini juga akan digunakan untuk mempelajari kinetika reaksi yang meliputi orde reaksi, tetapan laju reaksi (k), dan energi aktivasi (Ea).
TINJAUAN PUSTAKA
Jarak Pagar (Jatropha curcas L.)Tanaman jarak pagar termasuk famili Euphorbiceae, satu famili dengan karet dan ubi kayu. Klasifikasi tanaman jarak pagar adalah sebagai berikut: divisi Spermatofita, subdivisi Angiospermae, kelas Dicotyledonae, ordo Euphorbiales, famili Euphorbiceae, genus Jatropha, dan spesies Jatropha curcas L. Biji
jarak pagar mengandung minyak dengan rendemen sekitar 35─45% dan beracun. Gambar 1 memperlihatkan bunga dan biji jarak pagar (Hambali et al. 2006).
Gambar 1 Bunga dan biji jarak pagar (Jatropha curcas L.).
Minyak dari biji jarak pagar dapat digunakan sebagai biopestisida dan pengganti minyak pelumas pada mesin diesel. Selain itu juga dapat digunakan sebagai bahan baku pembuatan sabun dan sebagai alternatif bahan bakar, yaitu biodiesel (Wiesenhütter 2003).
Melihat potensi minyak jarak pagar, pemerintah telah mencanangkan pengembangan minyak jarak sebagai sumber energi terbarukan sampai tahun 2010 dengan melakukan pembudidayaan tanaman jarak pagar secara besar-besaran di Indonesia. Hal ini berkaitan dengan potensi tanaman jarak pagar sebagai bahan bakar alternatif untuk menghemat cadangan minyak bumi yang semakin menipis. Jarak pagar dapat dibuat biodiesel melalui reaksi esterifikasi dan transesterifikasi (Hambali et al. 2006).
Gubitz et al. (1998) dalam Manurung
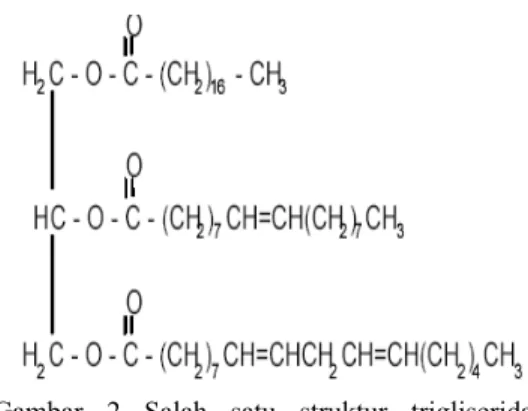
(2005) melaporkan bahwa kandungan asam lemak dalam minyak jarak pagar berupa asam miristat, palmitat, stearat, arakidonat, behenat, palmitoleat, oleat, linoleat, dan linolenat (Tabel 1). Menurut Manurung (2005), minyak jarak pagar mengandung trigliserida dengan rantai asam lemak linear dengan atau tanpa ikatan ganda. Salah satu contoh struktur trigliserida dalam minyak jarak pagar ditampilkan pada Gambar 2.
Tabel 1 Kandungan asam lemak pada minyak jarak pagar
Asam lemak Komposisi (%)
Miristat 0-0.1 Palmitat 14.1-15.3 Stearat 3.7-9.8 Arakidonat 0-0.3 Behenat 0-0.2 Palmitoleat 0-1.3 Oleat 34.3-45.8 Linoleat 29.0-44.2 Linolenat 0-0.3
Sumber: Gubitz et al. 1998 dalam Manurung
2005.
Gambar 2 Salah satu struktur trigliserida minyak jarak pagar.
Pemlastis
Pemlastis merupakan salah satu zat aditif yang lazim digunakan pada plastik untuk meningkatkan kelunakan dan kelenturannya. Senyawa ini memberikan kelenturan dan daya tahan yang diinginkan pada polimer plastik yang bersifat keras seperti PVC. Prinsip kerja pemlastis ialah mengisi ruang antarrantai polimer dan menurunkan suhu transisi kaca (Tg) sehingga dapat mengubah sifat plastik dari
keras, getas, dan rapuh menjadi lembut, lentur dan tahan lama.
Hal utama yang harus dipertimbangkan dalam pemilihan pemlastis adalah kompatibilitas (Ahmad et al. 1987). Kompatibilitas berkaitan dengan kemampuan pemlastis untuk berikatan dengan polimer, dan dapat diperbaiki dengan meningkatkan kandungan epoksida dalam suatu senyawa. Mutu bahan baku dapat memengaruhi rendemen epoksida yang diperoleh dan sifat senyawa epoksi yang digunakan sebagai pemlastis (Kirk & Othmer 1965).
Oleokimia yang difungsionalisasi dengan gugus epoksi dapat digunakan sebagai pemlastis dan penstabil dalam material plastik, khususnya untuk PVC dan kopolimernya. Pemlastis menjaga supaya plastik dan karet tetap lembut, serta memberikan stabilitas terhadap cahaya dan panas yang baik.
Epoksidasi
Epoksida atau oksirana merupakan eter siklik yang beranggotakan tiga buah atom. Keregangan cincin dalam molekul membuatnya lebih reaktif dibandingkan dengan eter lainnya. Reaksi epoksida penting dalam sintesis organik, karena epoksida yang terbentuk merupakan zat antara yang dapat diubah menjadi beraneka ragam produk (Solomons 1980). Epoksidasi dengan menggunakan hidrogen peroksida dan sejumlah
katalis bersifat tidak toksik, sehingga berpotensi untuk dikembangkan ke skala industri (Lane & Burges 2002).
Pada dasarnya ada empat teknologi untuk menghasilkan epoksida dari alkena, yaitu (1) epoksidasi dengan asam perkarboksilat, (2) epoksidasi dengan peroksida organik dan anorganik, (3) epoksidasi dengan halohidrin, dan (4) epoksidasi dengan molekul oksigen (Rios 2003). Metode pertama dan kedua lebih bersih dan efisien. Sementara pada metode ketiga, penggunaan halohidrin sangat berbahaya terhadap lingkungan dan membutuhkan perlakuan khusus. Akhirnya pada metode keempat, molekul oksigen memiliki selektivitas dan aktivitas yang bergantung pada katalis yang mengandung unsur dari golongan IV−VIB menghasilkan selektivitas yang tinggi, tetapi prosesnya lama, sedangkan untuk katalis yang mengandung unsur dari golongan I, VII, dan VIIIB, proses epoksidasi berlangsung dengan cepat, tetapi dengan selektivitas yang rendah (Rios 2003).
Keberhasilan reaksi epoksidasi dievaluasi melalui penentuan bilangan iodin dan bilangan oksirana. Bilangan iodin merupakan ukuran ketidakjenuhan atau banyaknya ikatan rangkap pada asam lemak. Ikatan rangkap tersebut akan bereaksi dengan iodin, maka asam lemak yang sangat jenuh akan mengikat lebih banyak iodin. Reaksi adisi iodin ini dapat dilihat pada Gambar 3.
Gambar 3 Reaksi pengikatan iodin.
Sementra itu, bilangan oksirana didefinisikan sebagai banyaknya HBr yang dibutuhkan untuk membuka cincin oksirana. Pada penentuan bilangan oksirana, cincin oksirana akan bereaksi dengan HBr sehingga membuka dan kandungan oksigen oksirana dapat dihitung. Reaksi pembukaan cincin oksirana dapat dilihat pada Gambar 4.
Gambar 4 Reaksi pembukaan cincin oksirana oleh HBr.
Kinetika Reaksi Epoksidasi
Kinetika reaksi pada dasarnya membahas tentang laju perubahan konsentrasi pereaksi atau hasil reaksi pada suatu periode waktu
dalam suatu reaksi kimia. Laju reaksi berbanding lurus dengan konsentrasi pereaksi dipangkatkan suatu bilangan tertentu. Persamaan laju reaksi dapat dituliskan secara umum sebagai berikut:
Laju reaksi =
[
]
...
...(
1
)
d
]
[
d
xA
k
t
A
=
Dengan mengukur konsentrasi pereaksi pada berbagai waktu, orde reaksi x dapat ditentukan.
Selanjutnya dari kurva regresi yang cocok untuk orde tersebut, tetapan laju reaksi k dapat
diperoleh persamaan garis lurus (Petrucci 1992).
Energi aktivasi merupakan energi yang harus dimiliki oleh molekul reaktan agar dapat bereaksi, atau energi yang harus disimpan dalam spesies antara, yaitu kompleks teraktifkan, yang terbentuk selama tumbukan molekul. Energi aktivasi dapat diperoleh dari logaritma natural persamaan Arrhenius (persamaan 2) dengan mengalurkan 1/T (K-1)
sebagai sumbu x dan ln k sebagai sumbu y.
⎟
⎠
⎞
⎜
⎝
⎛ −
=
RT
E
A
k
exp
a)
2
.(
...
...
1
ln
ln
⎟
⎠
⎞
⎜
⎝
⎛
−
=
T
R
E
A
k
adengan k adalah tetapan laju reaksi, A adalah faktor frekuensi tumbukan, E adalah energi
aktivasi, R adalah tetapan gas ideal (8.314 J
mol-1 K-1), dan
T adalah suhu (Kelvin).
Kinetika reaksi epoksidasi minyak nabati telah cukup banyak dipelajari, baik dengan katalis heterogen maupun homogen (Rios 2003). Penelitian yang telah dilakukan di antaranya adalah kinetika epoksidasi minyak kedelai (Petrović 2001 & Rangrajan et al.
1995), minyak sawit (Gan et al. 1995), dan
minyak mahua (Goud et al. 2000).
Goud et al. (2000) telah mempelajari
kinetika epoksidasi minyak mahua (mahua oil)
dengan asam peroksiasetat, yang dibuat secara
in situ dari hidrogen peroksida cair dan asam
asetat, dengan resin asam penukar ion positif sebagai katalis. Energi aktivasi yang diperoleh sebesar 12.0 kkal/mol (Goud et al. 2006).
Sementara itu, epoksidasi in situ minyak
kedelai dalam pelarut toluena dengan asam peroksiasetat dan asam peroksiformat menggunakan katalis Amberlite IR-120, didapat memiliki orde reaksi pertama, dengan energi aktivasi berturut-turut 54.7 dan 35.9 kJ mol-1 (Petrović
BAHAN DAN METODE
Bahan dan AlatBahan-bahan yang digunakan dalam penelitian ini adalah metil ester jarak pagar (MEJP) (Puspiptek, Serpong), katalis Amberlite IR-120 dari Rhom & Haas
(Philadelphia, USA), HCl 1 N, asam asetat glasial, toluena, H2O2 35%, NaHCO3, HCl 0.5
N, kloroform, larutan bromin, kristal iodin, akuades, kristal Na2S2O3.5H2O, larutan HBr,
kristal ultraviolet, larutan asam asetat-kloroform (3:2) kristal KI, dan indikator amilum 1%.
Alat-alat yang digunakan adalah seperangkat radas epoksidasi (Gambar 5), alat titrasi sistem tertutup, lempeng pemanas, neraca analitik, komputer dengan perangkat lunak Modde 5, alat-alat kaca yang lazim
dipakai di laboratorium, spektrofotometer infra merah transformasi Fourier (FTIR) Shimadzu 8400 di Departemen Kimia Universitas Pendidikan Indonesia dan kromatografi gas-spektrometer massa (GC-MS) Shimadzu AOC-20i autoinjector di Departemen Kimia
Universitas Islam Negeri Syarif Hidayatullah dengan kondisi alat sebagai berikut:
Kolom : MPS
Panjang kolom : 30 meter
Detektor : Electron Impact (EI) Gas pembawa : He
Laju alir : 1.5 ml/menit
Gambar 5 Perangkat radas sintesis epoksidasi MEJP.
Metode Penelitian
Penelitian ini terdiri atas tiga tahap, yaitu (1) analisis metil ester jarak pagar (MEJP) yang meliputi bilangan iodin, oksirana, dan peroksida, serta analisis komposisi MEJP menggunakan GC-MS (Chou & Lee 1997, Gan
et al. 1992, Rangrajan et al. 1995, Rios 2003),
(2) optimalisasi dan sintesis reaksi epoksidasi MEJP (Rios 2003), serta analisis MEJP dan
MEJPE menggunakan FTIR (Parreira et al.
2002), dan (3) kinetika reaksi epoksidasi yang meliputi penentuan orde reaksi, tetapan laju reaksi (k), dan energi aktivasi (Ea) (Petrović et
al. 2001).
Analisis Metil Ester Jarak Pagar (MEJP)
Prosedur analisis bilangan iodin, oksirana, dan peroksida dapat dilihat pada Lampiran 1.
Sintesis dan Optimalisasi Reaksi Epoksidasi MEJP
Prosedur sintesis dan optimalisasi epoksidasi MEJP adalah sebagai berikut. Larutan pertama yang merupakan campuran 10 g metil ester jarak pagar (MEJP) dengan 0.8 ml asam asetat glasial, 2.9 ml toluena, dan katalis Amberlite IR-120 yang dimasukkan ke dalam labu leher tiga, kemudian larutan kedua, yaitu 5.78 g H2O2 35%, dimasukkan ke dalam corong
pisah. Pengaduk magnet dimasukkan ke dalam labu leher tiga dan termometer dipasang, kemudian larutan kedua ditambahkan tetes demi tetes ke dalam labu leher tiga. Jalannya reaksi diatur pada suhu 50, 60, dan 70 oC
selama 12, 24, dan 36 jam, dengan konsentrasi Amberlite IR-120 sebanyak 1, 2, dan 3% (b/b) terhadap bobot minyak yang diragamkan. Secara keseluruhan semuanya berjumlah 27 varian sintesis.
Larutan hasil sintesis kemudian dinetralkan dengan larutan NaHCO3, dimasukkan ke dalam
corong pisah, dan didiamkan sebentar sampai MEJPE memisah. Lapisan air dibuang sedangkan lapisan MEJPE dicuci berulang kali dengan akuades, ditimbang, dan dianalisis bilangan iodin dan bilangan oksirananya. Gugus fungsi MEJPE juga dianalisis dengan FTIR (Chou & Lee 1997, Gan et al. 1992,
Rangrajan et al. 1995, Rios 2003). Bagan alir
sintesis dan optimalisasi reaksi epoksidasi MEJP dapat dilihat di Lampiran 2. Data bilangan oksirana yang didapat kemudian diolah dengan perangkat lunak Modde 5.0
untuk menentukan kondisi optimum dari reaksi epoksidasi.
Kinetika Reaksi Epoksidasi MEJP
Kinetika reaksi epoksidasi dipelajari pada kondisi optimum yang didapat, tetapi dengan menggunakan reaktan 10 kali lebih banyak, yang dicuplik setiap 3 jam (Lampiran 3). Alikuot dinetralkan, dicuci kemudian dianalisis bilangan iodin dan bilangan oksirananya. Nilai bilangan iodin dan oksirana yang dihasilkan diolah untuk mendapatkan parameter kinetika,
yaitu orde reaksi, tetapan laju reaksi (k) dan
energi aktivasinya.
Orde reaksi dicari dengan memasukkan data bilangan iodin pada suhu 50, 60, dan 70 oC
untuk dialurkan pada kurva hubungan antara waktu dan bilangan iodin (orde ke-0), ln bilangan iodin (orde ke-1), dan 1/bilangan iodin (orde ke-2). Orde reaksi ditentukan berdasarkan tingkat kesesuaian dengan data percobaan (curve fitting method), yaitu
koefisien determinasi (R2) yang terbesar.
Tetapan laju reaksi diperoleh dari kemiringan atau gradien garis lurus hubungan antara waktu dengan bilangan iodin pada orde reaksi yang telah ditentukan, sedangkan energi aktivasi ditetntukan berdasarkan kemiringan kurva hubungan antara 1/T (sumbu x) terhadap ln k
(sumbu y).
HASIL DAN PEMBAHASAN
Analisis Metil Ester Jarak Pagar (MEJP)Karakteristik mutu MEJP yang dianalisis meliputi bilangan oksirana, bilangan iodin, dan bilangan peroksida. Hasilnya dapat dilihat pada Tabel 2
Tabel 2 Nilai mutu MEJP
Parameter MEJP Bilangan iodin (g I/100 g) 97.2574
Bilangan oksirana (%) 0.04
Bilangan peroksida (ek/1000 g) 14.0825 Senyawa yang terkandung dalam MEJP dianalisis dengan GC-MS. Data kromatogram dan spektrum MEJP dapat dilihat pada Lampiran 4 dan ringkasan hasil analisis tersebut dapat dilihat pada Tabel 3.
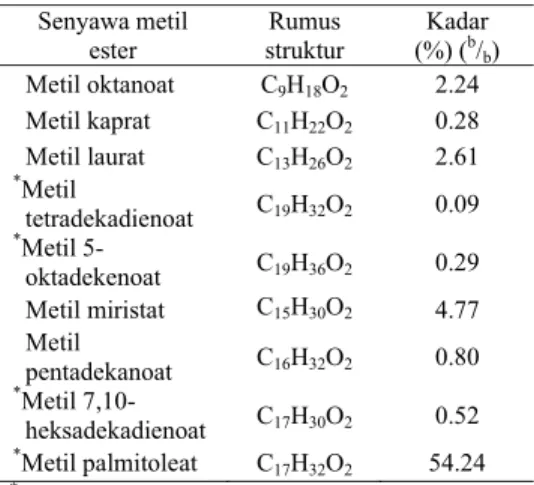
Tabel 3 Senyawa metil ester pada MEJP
Senyawa metil ester Rumus struktur Kadar (%) (b/ b) Metil oktanoat C9H18O2 2.24 Metil kaprat C11H22O2 0.28 Metil laurat C13H26O2 2.61 *Metil tetradekadienoat C19H32O2 0.09 *Metil 5-oktadekenoat C19H36O2 0.29 Metil miristat C15H30O2 4.77 Metil pentadekanoat C16H32O2 0.80 *Metil 7,10-heksadekadienoat C17H30O2 0.52 *Metil palmitoleat C 17H32O2 54.24 (*) : metil ester takjenuh.
berdasarkan analisis GC-MS diperoleh bahwa kira-kira 55.14% asam lemak penyusun minyak jarak pagar adalah asam lemak tak jenuh. Asam lemak tak jenuh ini didominasi oleh metil palmitoleat, yaitu sebanyak 54.24%. Keberadaan asam lemak tak jenuh ini didukung oleh bilangan iodin MEJP sebesar 97.2574 g I2/100 g (Tabel 2).
Optimalisasi Reaksi Epoksidasi MEJP
Epoksidasi MEJP yang dibahas di sini ialah sintesis pada waktu 12 jam, suhu 70 oC,
dan konsentrasi Amberlite IR-120 sebesar 3%. Kondisi reaksi ini dipilih secara acak. Karakteristik mutu MEJPE pada kondisi reaksi tersebut dapat dilihat pada Tabel 4.
Tabel 4 Nilai mutu MEJPE
Parameter (12 jam, 70 MEJPE oC, 3%)
Bilangan iodin (g I/100 g) 17.46 Bilangan oksirana (%) 3.38 Bilangan peroksida (ek/1000 g) 21.85 Dibandingkan dengan Tabel 3, dan Tabel 4 menunjukkan penurunan bilangan iodin MEJPE sebesar 5−6 kali dari kondisi awal. Sebaliknya bilangan oksirana meningkat 84 kali dari kondisi awal. Hal ini membuktikan telah terjadinya reaksi oksidasi, salah satunya ialah pembentukan cincin oksirana. Akan tetapi bilangan oksirana yang terbentuk tergolong rendah bila dibandingkan dengan nilai hasil epoksidasi minyak kedelai yang mencapai 6.9% (Petrović etal. 2001).
Rendahnya bilangan oksirana MEJPE ini diduga karena tidak semua ikatan rangkap MEJP terkonversi menjadi epoksida. Hal ini juga didukung oleh analisis FTIR. Pada MEJP dan MEJPE (Lampiran 5), yang menunjukkan bahwa baik spektrum MEJP maupun MEJPE memiliki serapan untuk gugus C-O, C=C, dan C=O. Serapan gugus C-O MEJP diperoleh yaitu pada bilangan gelombang 879.5, 914.2, dan 1245.9 cm-1, gugus C=C pada bilangan
gelombang 1600.8 cm-1 dan 1654.8 cm-1, serta
gugus C=O pada bilangan gelombang 1743.5 cm-1. Sementara pada MEJPE serapan gugus
C-O, C=C, dan C=O berturut-turut diperoleh pada bilangan gelombang 879.5 dan 1245.9 cm-1;
1604.7 dan 1627.8 cm-1; dan 739.7 cm-1.
Spektrum inframerah MEJP dan MEJPE ditampilkan pada Lampiran 6 dan 7.
Rendahnya bilangan oksirana dapat dipula disebabkan penggunaan H2O2 yang berlebih.
Kelebihan H2O2 diduga membuka cincin
oksirana dari MEJPE. Selain itu, pembukaan cincin juga diduga karena katalis Amberlite IR-120 yang digunakan merupakan resin asam penukar kation. Dugaan reaksi pembukaan cincin oksirana menurut Petrović et al. (2001)
ditampilkan pada Gambar 6. CH3COOH H2O H2O2 H+ R1 C H C H R2 OH OCOCH3 R1 C H C H R2 OH OH R1 C C H2 R2 O R1 C H C H R2 OH OOH R1 C H C H R2 O
Gambar 6 Reaksi pembukaan cincin oksirana yang disebabkan oleh sisa pereaksi dan produk samping yang terbentuk.
Optimalisasi reaksi epoksidasi merupakan ragam dari peubah kondisi reaksi untuk menentukan kondisi optimum dari pengaruh
waktu, suhu, dan konsentrasi Amberlite IR-120.
Pengaruh suhu dan konsentrasi Amberlite IR-120 pada waktu reaksi 12 jam (Gambar 7a), 24 jam (Gambar 7b), dan 36 jam (Gambar 7c) memperlihatkan bahwa dengan semakin tinggi suhu (sampai 70 oC) dan semakin besar
konsentrasi Amberlite IR-120 (sampai 3%), nilai bilangan oksirana meningkat. Namun, peningkatan bilangan oksirana pada waktu 12 dan 24 jam, jauh lebih besar daripada reaksi 36 jam. Kenaikan bilangan oksirana pada waktu reaksi 12 dan 24 jam ditunjukkan oleh perubahan daerah warna dari biru ke merah, meskipun keduanya memiliki kisaran nilai bilangan oksirana yang berbeda. Pada waktu reaksi 12 jam, bilangan oksirana berkisar 1.38−1.59% sampai 3.41−3.61%, sedangkan pada waktu reaksi 24 jam, kisarannya 1.95−2.07% sampai 3.16−3.28%.
Pengaruh suhu dan konsentrasi Amberlite IR-120 pada waktu reaksi 36 jam (Gambar 7c) memperlihatkan kenaikan bilangan oksirana paling rendah dibandingkan pada waktu reaksi 12 dan 24 jam. Kenaikan tersebut ditunjukkan oleh perubahan daerah warna dari biru ke hijau muda, dengan kisaran bilangan oksirana sebesar 2.42−2.52% sampai 2.93−3.03%.
(a) (b)
(c)
Gambar 7 Pengaruh suhu dan konsentrasi Amberlite IR-120 pada waktu: (a) 12 jam, (b) 24 jam, dan (c) 36 jam terhadap bilangan oksirana.
Berdasarkan pola yang sama dari ketiga kurva pada Gambar 7 diduga bahwa semakin lama epoksidasi (sampai 36 jam), semakin banyak pula asam asetat yang terbentuk sebagai produk samping dari reaksi antara MEJP dan asam peroksiasetat. Hal ini meningkatkan pembukaan cincin oksirana sehingga bilangan oksirana yang terukur semakin kecil.
Pengaruh waktu dan konsentrasi Amberlite IR-120 pada suhu 50 oC (Gambar 8a), 60 oC
(Gambar 8b), dan 70 oC (Gambar 8c)
memperlihatkan bahwa dengan semakin lama waktu reaksi (sampai 36 jam) dan semakin besar konsentrasi Amberlite IR-120 (sampai 3%), nilai bilangan oksirana meningkat. Namun, peningkatan bilangan oksirana pada suhu 50 dan 60 oC lebih tinggi dibandingkan
dengan suhu 70 oC. Kenaikan bilangan
oksirana pada suhu 50 dan 60 oC ditunjukkan
oleh perubahan daerah warna dari biru ke merah, yaitu berturut-turut adalah 1.38−1.58% sampai 3.35−3.55% dan 2.00−2.11% sampai 3.14−3.25%. Sementara pada suhu 70 oC
(Gambar 8c) kenaikan bilangan oksirananya
paling rendah, yang ditunjukkan oleh perubahan daerah warna dari biru ke hijau, dengan kisaran bilangan oksirana 2.53−2.64% sampai 2.85−2.96%.
Pola yang sama di antara ketiga kurva pada Gambar 8 menunjukkan bahwa semakin tinggi suhu (sampai 70 oC), oksidasi ikatan
rangkap MEJP tak jenuh oleh asam peroksiasetat berlangsung semakin cepat. Akan tetapi, peningkatan pembentukan cincin oksirana pada suhu 50 oC kira-kira dua kali
lebih besar daripada suhu 60 oC dan 70 oC.
Pengaruh suhu dan waktu pada konsentrasi Amberlite IR-120 1%, 2%, dan 3% ditunjukkan pada Gambar 9. Konsentrasi katalis 1% (Gambar 9a) memperlihatkan bahwa dengan semakin tinggi suhu (sampai 70
oC) dan semakin lama waktu reaksi (sampai 36
jam), nilai bilangan oksirana meningkat. Peningkatan ini ditunjukkan oleh perubahan daerah warna dari biru ke jingga, dengan kisaran nilai bilangan oksirana 1.38−1.50% sampai 2.39−2.50%.
(a) (b)
(c)
Gambar 8 Pengaruh waktu dan konsentrasi Amberlite IR-120 pada suhu 50 oC (a), 60 oC (b),
Pola yang hampir sama diperoleh pada konsentrasi katalis 2% (Gambar 9b); semakin tinggi suhu (sampai 70 oC) dan semakin lama
waktu reaksi (sampai 36 jam), nilai bilangan oksirana meningkat sampai suhu kurang lebih 64 oC dalam waktu reaksi sekitar 30 jam
dengan kisaran nilai bilangan oksirana 2.76−2.85% (daerah warna kuning kehijauan). Nilai ini menurun ketika reaksi berlanjut sampai suhu 70 oC dalam waktu reaksi sekitar
36 jam dengan kisaran nilai bilangan oksirana 2.67−2.76% (daerah warna hijau muda). Pada konsentrasi katalis 3% (Gambar 9c) bilangan oksirana juga naik sampai suhu sekitar 60 oC
dalam waktu reaksi kira-kira 25 jam, dengan bilangan oksirana 3.22−3.28%, dan kemudian
turun kembali pada suhu 70 oC dalam waktu
reaksi 36 jam, dengan bilangan oksirana 2.95−3.02%. Ketiga kurva pada Gambar 9 memiliki pola yang serupa, yaitu dengan bertambahnya konsentrasi Amberlite IR-120, bilangan oksirana akan naik pada awalnya (daerah warna biru) sampai di kondisi reaksi tertentu, tetapi ketika reaksi dilanjutkan bilangan oksirana mulai menurun. Hal ini diduga disebabkan oleh adanya ion H+ yang
dilepaskan oleh katalis, yang di satu sisi mempercepat reaksi epoksidasi, namun di sisi lain, ketika semakin banyak ion H+ yang
dilepaskan, terjadi pembukaan cincin oksirana, yang menurunkan nilai bilangan oksirana.
(a) (b)
(c)
Gambar 9 Pengaruh suhu dan waktu pada konsentrasi Amberlite IR-120 1% (a), 2% (b), dan 3% (c) terhadap bilangan oksirana.
Optimalisasi menggunakan Modde 5.0
menghasilkan kondisi reaksi optimum pada waktu 12 jam, suhu 70 oC dengan katalis
Amberlite IR-120 3% (0.3 g). Nilai optimum bilangan oksirana yang diperoleh dari hasil pengolahan data dengan metode respons permukaan (response surface method) sebesar
3.613% (Tabel 5). Nilai tersebut mendekati nilai optimum yang didapat dari hasil percobaan, yaitu 3.38%.. Nilai optimum tersebut lebih tinggi daripada hasil epoksidasi dengan katalis zeolit (Diana 2007), yaitu 1.33%, dan bentonit (Wahid 2007), yaitu 1.36%. Data optimalisasi reaksi epoksidasi tersaji di Lampiran 8.
Tabel 5 Kondisi optimum reaksi epoksidasi menggunakan Modde 5. 0
Keseluruhan optimalisasi reaksi epoksidasi diringkaskan dalam bentuk diagram batang pada Gambar 10. Diagram batang tersebut mengandung informasi uji keragaman atau ANOVA (Lampiran 9) dan uji koefisien kuadratik (Lampiran 10). Analisis keragaman menunjukkan bahwa nilai P (0.001) lebih kecil
daripada taraf α (5%). Jadi, dalam penelitian ini semua peubah baik waktu, suhu, dan konsentrasi berpengaruh nyata terhadap bilangan oksirana.
Gambar 10 Summary of fit optimalisasi reaksi epoksidasi.
Sementara dari analisis koefisien kuadratik, diperoleh bahwa model persamaan matematika untuk optimasi ialah;
Bilangan oksirana = 2.740540 + 0.115400x + 0.157172y + 0.506617z - 0.332267xy - 0.118933xz - 0.127108yz
Dengan x = waktu, y = suhu, z = konsentrasi
Amberlite IR-120. Nilai R2 dan Q2-nya
berturut-turut adalah 0.662 dan 0.482. Linearitas optimalisasi tergolong rendah (66,2%). Rendahnya linearitas ini disebabkan oleh ketidakseragaman sintesis yang dilakukan, terutama faktor suhu yang digunakan.
Kinetika Reaksi Epoksidasi MEJP
Kinetika reaksi epoksidasi dapat ditentukan dengan melihat penurunan jumlah ikatan rangkap MEJP yang diinterpretasikan dalam bentuk penurunan bilangan iodin. Dalam hal ini diasumsikan bahwa seluruh ikatan rangkap MEJP terkonversi menjadi gugus epoksida. Kurva penurunan bilangan iodin dan kenaikan bilangan oksirana dapat dilihat pada Gambar 11.
0.0 10.0 20.0 30.0 40.0 50.0 60.0 70.0 80.0 90.0 0 3 6 9 12 Waktu (jam) B il a ng an iodi n (g I/ 100 g)
(a) 0.00 1.00 2.00 3.00 4.00 5.00 0 3 6 9 12 Waktu (jam) B il a ngan oksi ra n a (% )
(b)
Gambar 11 Kurva hubungan antara (a) bilangan iodin dan (b) bilangan oksirana terhadap waktu pada suhu 50 (▲), 60 (■), dan 70 oC (♦).
Penentuan kinetika reaksi epoksidasi secara in situ melibatkan dua reaksi utama,
yaitu pembentukan asam peroksiasetat dan pembentukan epoksida. Persamaan reaksinya sebagai berikut: AA + H2O2 k1 k2 PAA + H2O ...(1) MEJPE + AA...(2) PAA + MEJP k3
dengan AA adalah asam asetat, PAA adalah asam peroksi asetat. k1, k2, dan k3 adalah tetapan kecepatan reaksi.
Data dan kurva penentuan orde reaksi epoksidasi diberikan pada Lampiran 11 dan 12 dan hasilnya diringkaskan pada Tabel 6. Terlihat bahwa nilai koefisien determinasi (R2)
terbesar diperoleh pada orde pertama. Nilainya berturut-turut 0.9975, 0.9931, 0.9959, pada suhu 50, 60, dan 70 oC.
Tabel 6 Nilai koefisien determinasi (R2) untuk
penentuan orde reaksi Suhu
(oC) Orde Persamaan garis R2 50 0 y = -3.3527x + 74.301 0.9772 1 y = -0.0624x + 4.3319 0.9975 2 y = 0.0012x + 0.0125 0.9893 60 0 y = -4.2219x + 67.806 0.9541 1 y = -0.1017x + 4.2659 0.9931 2 y = 0.0027x + 0.012 0.9862 70 0 y = -5.216x + 65.812 0.9131 1 y = -0.1674x + 4.3068 0.9959 2 y = 0.0072x + 0.0035 0.8900
Persamaan yang digunakan untuk penentuan tetapan laju reaksi pada orde pertama ialah sebagai berikut:
)
3
....(
...
...
I
d
/
dI
t
=
k
−
dengan I ialah bilangan iodin. Integrasi persamaan (3) menghasilkan persamaan (4):
)
4
...(
...
...
)
I
/
I
ln(
0=
kt
Dari persamaan (4), dengan membuat kurva regresi hubungan ln(I0/I) terhadap waktu t,
nilai k dapat diperoleh sebagai kemiringan
kurva. Data selengkapnya diberikan pada
Lampiran 13. Kurva yang diperoleh pada suhu 50, 60, dan 70 oC ditampilkan pada Gambar 12. y = 0.1674x + 0.0131 R2 = 0.9959 y = 0.1017x + 0.0129 R2 = 0.9931 y = 0.0624x + 0.0162 R2 = 0.9975 0.0 0.5 1.0 1.5 2.0 2.5 0 3 6 9 12 Waktu (jam) ln (I o /I )
Gambar 12 Kurva regresi hubungan ln (I0/I)
terhadap waktu pada suhu 50 (▲), 60(■), dan 70 oC (♦) untuk
penentuan nilai tetapann laju reaksi (k).
Data nilai k yang diperoleh (Tabel 7)
menunjukkan bahwa perbedaan suhu reaksi 10
oC telah secara signifikan meningkatkan nilai k. Kenaikan suhu memperbesar fraksi molekul
MEJP dan asam peroksiasetat yang teraktifkan, atau memiliki energi kinetik melebihi energi aktivasi reaksi epoksidasi. Karena itu, reaksi berlangsung lebih cepat. Data pada Tabel 7 digunakan untuk menentukan energi aktivasi
(Ea) dengan menggunakan persamaan
Arrhenius (persamaan 2).
Tabel 7 Tetapan laju reaksi epoksidasi MEJP Suhu
reaksi (oC)
Tetapan laju reaksi (k)
(jam-1) R2
50 6.24 × 10-2 0.9975
60 10.17 × 10-2 0.9931
70 16.74 × 10-2 0.9959
Energi aktivasi yang diperoleh ialah sebesar 45.43 kJ mol-1. Nilai ini lebih rendah
daripada energi aktivasi epoksidasi minyak kedelai yang dilakukan oleh Petrovic et al
(2001), yaitu 54.7 kJ mol-1, tetapi lebih tinggi
daripada nilai energi aktivasi epoksidasi minyak kelapa sawit yang dilakukan oleh Wibowo et al. (2003), yaitu 37.47 kJ mol-1.
Kurva regresi hubungan ln k terhadap 1/T
untuk penentuan Ea ditampilkan pada Gambar
y = -5464.3x + 14.137 R2 = 0.9995 -3.0 -2.5 -2.0 -1.5 -1.0 -0.5 0.0 0.0029 0.0030 0.0030 0.0031 0.0031 0.0032 1/T (1/K) ln k
Gambar 13 Kurva regresi hubungan ln k
terhadap 1/T untuk penentuan Ea.
SIMPULAN DAN SARAN
SimpulanKondisi optimum reaksi epoksidasi MEJP yang diperoleh dengan menggunakan Modde 5.0 ialah suhu 70 oC, waktu reaksi 12 jam, dan
konsentrasi Amberlite IR-120 3%. Nilai bilangan oksirana optimum hasil percobaan sebesar 3.38% sedangkan dengan Modde 5.0
mencapai 3.61%.
Studi kinetika reaksi epoksidasi MEJP pada suhu 50, 60, dan 70 oC menghasilkan
kinetika orde pertama dengan tetapan laju reaksi (k) berturut-turut sebesar 6.24 × 10-2,
10.17 × 10-2, dan 16.74 × 10-2 jam-1. Dari
ketiga data tersebut, diperoleh energi aktivasi (Ea) sebesar 45.43 kJ mol-1.
Saran
Diperlukan percobaan pendahuluan yang berkaitan dengan ketahanan MEJP terhadap lama penyimpanan agar karakteristik mutu MEJP tidak mengalami perubahan. Selain itu, dalam penentuan kinetika reaksi epoksidasi suhu dan pengambilan cuplikan harus diatur supaya tidak mengubah kompoisisi reaktan.
DAFTAR PUSTAKA
Ahmad S et al. 1987. Potential application of epoxidized palm oil in plastic and rubber industries. Di dalam: Palm Oil Conferences. Conferences II: Technology;
tempat tidak diketahui,29 Jun−1 Jul 1987. Campanella A, Baltanas MA. 2005.
Degradation of the oxirane ring of epoxidazed vegetable oils in liquid-liquid systems: II. Reactivity with solvated acetic
and peracetic acids, Latin Am App Res
35:211−216.
Cavanaugh T. 1995. Plastics additives’95.
Chemical Marketing Reporter p. SR. 10.
[terhubung berkala]. http://www.carbo-hydrateeconomy.org/library/admin/uploade dfiles/BiochemicalPlasticizers.html [24 Apr 2006].
Chou TC, Lee V. 1997. Epoxidation of oleic acid in the present of benzaldehyde using cobalt(II) tetraphenylporphyrin as catalyst.
Industrial & Eng Chem Res 36:1485−1490.
Diana W. 2007. Optimalisasi reaksi epoksidasi metil ester jarak pagar dengan katalis zeolit sebagai pemlastis alternatif [skripsi]. Bogor: Fakultas Matematika dan Ilmu pengetahuan Alam, Institut Pertanian Bogor.
Gan LH, Ooi KS, Gan LM, Goh SH. 1995.
Effects of epoxidation on thermal oxidative stabilities of fatty acid esters derived from palm olein. J Am Oil Chem Soc
72:439-442.
Goud VV, Patwardhan AV, Pradhan NC. 2005. Studies on the epoxidation of mahua oil (Madhumica indica) by hydrogen
peroxide. Bior Tech. 12:1365-1371.
Gubitz GM, Mittelbatch M, Trabi M. 1999. Exploitation of the tropical oil seed plant
Jatropha curcas L. BiorTech. 67: 73−82.
Hambali E et al. 2006. Jarak Pagar Tanaman Penghasil Biodiesel. Jakarta: Penebar Swadaya.
Hazimah AH, Salimah A, Ahmad I. 2000. Epoxidation palm oil creates exciting avenues for palm-based industrilisation.
Forum Information Service.
Kirk RE, Othmer DF. 1982. Encyclopedia of Chemical Technology. Ed ke-3. New York:
J Wiley.
Lane BS, Burgess K. 2002. Metal-catalyzed epoxidation of alkenes with hydrogen peroxide. J Am Chem Soc. Vol.
103:2457-2474.
Manurung R. 2005. Straight Jatropha oil: promissing green fuel. Jatr Oil 46:25.
[terhubung berkala].http://www.chem. ac.ad/jatropha/marung.pdf [23 Mar 2005]. Parreira et al. 2002. Quantitative determination
near-infrared spectroscopy and multivariate calibration. App Spectros 56:1607−16145.
Petrović ZS, Zlatanić A, Lava CC, Sinadinović-Fišer S. 2001. Epoxidation of soybean oil in toluene with peroxoacetic and peroxoformic acids - Kinetics and side reactions. Kansas: Pittsburg State University, Kansas Polymer Research Center.
Petrucci RH. 1992. Kimia Dasar, Prinsip dan Terapan Modern. Achmadi SA,
penerjemah. Jakarta: Erlangga.
Rangrajan B, Havey A, Grulke EA, Culnan PD. 1995. Kinetic parameter of a two-phase model for in-situ epoxidation of
soybean oil. J Am Oil Chem Soc
72:1161-1169.
Rios LA. 2003. Heterogeneously catalyzed reactions with vegetable oils: Epoxidation and nucleophilic epoxide ring-opening with alcohol [disertasi]. Aachen: The Institute of Chemical Technology and Heterogeneous Catalysis. University RWTH.
Shah S, Shanna S, Gupta MN. 2003. Biodiesel preparation by lipase-catalyzed transesterification of Jatropha oil. Energy & Fuels 18:154-159
Shriner RL et al. 2004. The Systematic
Identification of Organic Compounds. New York: J Wiley.
Solomons TWG. 1980. Organic Chemistry. Ed
ke-2. New York: J Wiley.
Supriyadi S. 1992. Proses in-situ epoksidasi
minyak sawit. Menara Perkebunan 23:
115-123.
Tullo HA. 2005. Cutting out phatalates. polyvinyl chloride applications haven’t been flexible enough to accept alternatives to phatalate esters. Chem & Eng News. 83:
29-31.
Wiesenhütter J. 2003. Use of the Physic Nut (Jatropha curcas L.) to Combat
Desertification and Reduce Poverty. Deutsche: Deutsche Gesellschaft für Technische Zusammenarbeit (GTZ).
Wachid AA. 2007. Optimalisasi reaksi epoksidasi metil ester jarak pagar dengan katalis bentonit [skripsi]. Bogor: Fakultas Matematika dan Ilmu pengetahuan Alam, Institut Pertanian Bogor.
Wibowo TY, Sofian A, Purwanto W. 2003. Kinetika reaksi epoksidasi metil ester minyak kelapa sawit dengan katalis Amberlite. Sains dan Teknologi Indonesia
Lampiran 1 Prosedur analisis bilangan oksirana, bilangan iodin, dan bilangan
peroksida
Bilangan Oksirana
Sampel sebanyak (0.3-0.5) gram (± 0.0001 gram) ditimbang, lalu dimasukkan ke dalam labu erlenmeyer 50 mL, kemudian dilarutkan dalam 10 mL asam asetat glasial. Setelah itu ditambahkan indikator kristal ungu sebanyak 5 tetes (maksimum 0.1 mL), lalu dititrasi dengan larutan HBr 0.1 N sampai berwarna hijau kebiruan selama 30 detik.
Bilangan Oksirana %(b/b) =
(g)
oh
bobot cont
N
V
×
×
1.60
dengan: BO = Bilangan Oksirana V = Volume HBr (mL) N = Normalitas HBr Bilangan IodSampel ditimbang sebanyak ±0.5 gram, kemudian dimasukkan ke dalam labu erlenmeyer 250 mL bertutup asah. CCl4 sebanyak 10 mL ditambahkan dengan menggunakan gelas ukur untuk melarutkan lemak, kemudian sebanyak 25 mL larutan Hanus ditambahkan ke dalamnya, setelah itu larutan disimpan selama 1 jam dalam ruang gelap. Setelah 1 jam, larutan tersebut ditambahkan 10 mL KI 10% dan erlenmeyer segera ditutup. Dikocok sebentar, kemudian dititrasi menggunakan larutan Na2S2O3 0.1 N sampai larutan berwarna kuning muda, lalu ditambahkan amilum 1% sebagai indikator. Titrasi dihentikan pada saat larutan berubah warna dari warna biru menjadi tidak berwarna. Bilangan iod dinyatakan sebagai gram iod yang diserap per 100 gram.
Pembuatan larutan Hanus. Sebanyak 13.2 gram iodium murni dilarutkan dalam 1 liter asam asetat glasial sambil dipanaskan sehingga iodium melarut sempurna (lakukan dengan hati-hati di ruang asam). Larutan yang terjadi dibiarkan sampai dingin, dan setelah itu ditambahkan 3 ml brom sehingga larutan berwarna kelabu tua. Larutan disimpan dalam botol berwarna gelap dan ditutup rapat. Bilangan iod dihitung sebagai berikut:
Bilangan iod %(b/b) =
M
V
V
T
(
)
12.69
×
×
3−
4 dengan:T = Normalitas larutan standar Na2S2O3 0.1 N
V3 = Volume larutan Na2S2O3 0.1 N yang diperlukan untuk mentitrasi larutan blanko (mL).
V4 = Volume larutan Na2S2O3 0.1 N yang diperlukan untuk mentitrasi larutan contoh (mL).
M = Bobot contoh (g)
Bilangan Peroksida
Ditimbang ±5.00 gram minyak jarak pagar ke dalam erlenmeyer 250 ml bertutup asah dan ditambahkan 30 ml larutan asam asetat-kloroform (3:2), Larutan digoyang sampai bahan terlarut semua, dan ditambahkan 0.5 ml larutan KI jenuh. Didiamkan selama satu menit dan kadangkala dogoyang, kemudian ditambahkan 30 ml akuades. Dititrasi dengan Na2S2O3 0.1 N sebanyak dua tetes sampai warna kuning hampir hilang. Ditambahkan 0,5 ml larutan pati 1%. Titrasi dilanjutkan sampai warna biru mulai hilang. Bilangan peroksida dinyatakan dalam ekuivalen dari peroksida dalam setiap 1000 gram contoh. Bilangan peroksida dihitung sebagai berikut;
Bilangan Peroksida %(b/b) =
)
(
1000
3 2 2 3 2g
contoh
bobot
x
O
S
Na
N
x
SO
Na
ml
Lampiran 2 Prosedur sintesis dan optimalisasi epoksidasi MEJP
NaHCO3
jenuh Netralisasi Butiran amberlite jangan sampai masuk ke corong pisah
Ditimbang -uji bilangan iod -uji bilangan oksirana -Optimalisasi data dengan Modde 5.0
Lampiran 3 Prosedur kinetika epoksidasi MEJP
Direaksikan pada suhu : 50 oC 60 oC 70 oC NaHCO3jenuh
Netralisasi Butiran amberlitejangan sampai masuk ke pipet volumetrik
Pencucian berulang kali pakai akuades Diambil cuplikan sebanyak 10 ml/3 jam
Menggunakan
bahan 10x dari
tahapan sintesis
-uji bil iodine -uji bil oksirana -Penetuan orde -Penetuan k -Penetuan Ea
57.8 g
H
2O
235%
Pun cak
Kromatografi Gas Spektroskopi Massa
Waktu retensi (menit) Kromatogram Waktu retensi (menit) Puncak massa Puncak dasar Identifikasi
Luas daerah % Tinggi % Kemiripan
(%) Rumus molekul Bobot molekul Struktur 3 14.229 7053545 1.32 12008951 2.24 14.233 70 74.05 98 C9H18O2 158 O O metil oktanoat 4 18.776 358172 2.24 358172 0.07 18.775 43 55.10 93 C10H18O 154 O trans-2-dekenal 5 19.831 4402378 0.82 1435369 0.64 19.833 62 81.10 96 C10H16O 152 O (2Z, 4Z)-2,4-dekadienal 7 21.171 1485237 0.28 563748 0.24 21.175 54 74.05 97 C11H22O2 186 O O metil kaprat 9 25.617 1451757 0.27 384144 0.17 25.617 47 55.10 97 C12H26O 186 HO n-dodekanol 10 27.489 13995385 2.61 5256118 2.35 27.492 100 74.05 98 C13H26O2 214 O O metil laurat 14 32.051 502905 0.09 177631 0.08 32.050 70 67.10 84 C19H32O2 292 O O metil tetradekadienoat 15 32.353 1535776 0.29 558936 0.25 32.350 88 74.05 89 C19H36O2 296 O O metil 5-oktadekenoat
Pun cak
Kromatografi Gas Spektroskopi Massa
Waktu retensi (menit) Kromatogram Waktu retensi (menit) Puncak massa Puncak dasar Identifikasi
Luas daerah % Tinggi % Kemiripan
(%) Rumus molekul Bobot molekul Struktur 16 33.173 25586746 4.77 9157587 4.10 33.175 126 74.05 97 C15H30O2 242 O O metil miristat 19 35.796 4267440 0.8 1444646 0.65 35.792 98 74.05 97 C16H32O2 256 O O metil pentadekanoat 20 37.328 2765496 0.52 745111 0.33 37.325 98 67.10 93 C17H30O2 266 O O metil 7,10-heksadekadienoat 21 37.592 10903212 2.03 2539715 1.14 37.592 132 55.10 95 C17H32O2 268 O O metil 9-heksadekenoat 22 37.744 280037474 52.21 37084674 16.60 37.742 187 55.10 96 C17H32O2 268 O O metil 9-heksadekenoat
Lampiran 5 Analisis gugus fungsi MEJP dan MEJPE dengan FTIR
MEJP MEJPE Gugus fungsi υ (cm -1) (Shriner, 2004) υ (cm-1) % T υ (cm-1) %Tuluran C-O epoksida
750- 840 914.2 96.1 879.5 60.0 810-950 1245.9 30.0 1245,9 30.0 1220-1260 1600.8 96.0 1604.7 85.0 C=C Sp2 1600-1700 1654.8 85.3 1627.8 82.2 1743.5 8.0 1739.7 16.0 C=O karbonil 1540-1820 2854.5 8.1 2854.5 8.1 uluran C-H 2840-3000 2923.9 5.2 2927.7 0.2 3008.7 28.9 - -
Lampiran 8 Data optimalisasi sintesis MEJPE
No Kondisi reaksi Bobot MEJP (g) MEJP MEJPE BobotMEJPE (g) MEJPE (%) Rendemen Waktu
(Jam)
Suhu
(oC) IR-120 (g) Amberlite Bilangan iodin (g I/100 g)
Bilangan oksirana (%) Bilangan iodin (g I/100 g) Bilangan oksirana (%) 1 12 50 1 10.00 97.2059 0.04 57.4143 1.31 9.6431 92.4 2 24 50 1 10.00 97.3713 0.04 44.7556 1.77 10.593 101.5 3 36 50 1 10.00 96.1468 0.04 50.6684 2.42 10.9114 104.56 4 12 60 1 10.00 97.2059 0.04 65.1533 1.83 9.6343 92.32 5 24 60 1 10.00 97.3713 0.04 44.4594 2.68 10.6216 101.78 6 36 60 1 10.00 96.1468 0.04 49.2343 2.71 9.1432 87.61 7 12 70 1 10.01 97.2059 0.04 36.2468 2.34 8.5695 82.11 8 24 70 1 10.01 97.3713 0.04 14.0526 2.73 9.1432 87.61 9 36 70 1 10.00 96.1468 0.04 55.2474 2.41 9.6406 92.38 10 12 50 2 10.00 97.2059 0.04 54.0182 2.15 11.1974 107.29 11 24 50 2 10.00 97.2574 0.04 46.9906 2.66 10.7524 103.03 12 36 50 2 10.00 96.1468 0.04 40.4591 2.81 10.8092 103.58 13 12 60 2 10.01 97.2059 0.04 20.9741 2.93 10.0765 96.56 14 24 60 2 10.01 97.3713 0.04 30.9646 3.38 11.0357 105.75 15 36 60 2 10.00 96.1468 0.04 17.3941 2.52 10.0426 96.23 16 12 70 2 10.00 97.3713 0.04 11.3848 3.05 10.2208 97.94 17 24 70 2 10.00 97.2574 0.04 14.6693 2.78 8.5989 82.39 18 36 70 2 10.00 96.1468 0.04 23.3958 2.19 10.2009 97.75 19 12 50 3 10.00 97.2574 0.04 43.7031 2.69 10.4925 100.54 20 24 50 3 10.00 97.2574 0.04 35.017 3.24 10.9798 105.21 21 36 50 3 10.00 96.1468 0.04 29.3492 3.37 10.6346 101.9 22 12 60 3 10.01 97.2574 0.04 52.1175 2.59 10.3284 98.97 23 24 60 3 10.00 97.2574 0.04 10.1601 4.39 10.5049 100.66 24 36 60 3 10.00 96.1468 0.04 28.2431 3.29 10.3214 98.9 25 12 70 3 10.01 97.2574 0.04 17.4559 3.38 10.2663 98.37 26 24 70 3 10.00 97.2574 0.04 7.2651 3.74 8.9442 85.71 27 36 70 3 10.00 96.1468 0.04 12.7049 2.63 10.5971 101.54
Lampiran 9 Hasil uji Anova untuk bilangan oksirana
oksirana DF SS MS F P SD (variance) Total 27 213.344 7.90162 Constant 1 202.786 202.786 Total Corrected 26 10.558 0.406075 0.63724 Regression 6 6.99274 1.16546 6.53795 0.001 1.07956 Residual 20 3.56521 0.17826 0.422209 Lack of Fit -- -- -- -- -- -- (Model Error) Pure Error -- -- -- -- (Replicate Error) N = 27 Q2 = 0.482 Cond. No = 1.5000 DF = 20 R2 = 0.662 Y-miss = 0 R2 Adj. = 0.561 R Adj. = 0.442Lampiran 10 Hasil uji koefisien kuadratik untuk bilangan oksirana
Oksirana coeff. SC Std. Err. P Conf. int(±)
Constant 2.740540 0.0812542 4.20942e-019 0.169494 waktu 0.115400 0.0995156 0.259861 0.207856 suhu 0.157172 0.0995156 0.129937 0.207586 amberlite 0.506617 0.0995156 5.58e-005 0.207586 waktu*suhu -0.332267 0.1218810 0.0130106 0.25424 waktu*amberlite -0.118933 0.1218810 0.340813 0.25424 suhu*amberlite -0.127108 0.1218810 0.309444 0.25424 N = 27 Q2 = 0.482 Cond. No = 1.5000 DF = 20 R2 = 0.662 Y-miss = 0 R2 Adj. = 0.561 RSD = 0.4222 Conf. lev. = 0.95