BAB II
TINJAUAN PUSTAKA
2.1. Air
2.1.1. Pengertian Air
Menurut Achmad (2004), air merupakan senyawa kimia yang terdiri dari atom
H dan O. Sebuah molekul air terdiri dari satu atom O yang berikatan kovalen dengan
dua atom H. Molekul air yang satu dengan molekul air lainnya bergabung dengan
satu ikatan hidrogen antara atom H dengan atom O. Adanya ikatan hidrogen inilah
yang menyebabkan air mempunyai sifat-sifat yang khas seperti terlihat pada tabel
berikut :
Tabel 2.1. Sifat-sifat Penting dari Air
Sifat Efek dan kegunaan
Pelarut yang sangat baik.
Konstanta dielektrik paling tinggi di antara cairan murni lainnya.
Tegangan permukaan lebih tinggi daripada cairan lainnya.
Transparan terhadap cahaya tampak dan sinar yang mempunyai panjang gelombang lebih besar dari ultraviolet.
Bobot jenis tertinggi dalam bentuk cairan (fasa cair) pada 4 ºC
Panas penguapan lebih tinggi daripada yang lainnya.
Kapasitas kalor lebih tinggi dibandingkan dengan cairan lain kecuali ammonia. Panas laten dan peleburan lebih tinggi daripada cairan lain kecuali ammonia.
Transport zat-zat makanan dan bahan buangan yang dihasilkan proses biologi. Kelarutan dan ionisasi dari senyawa ini tinggi dalam larutannya.
Faktor pengendali dalam fisiologi;
membentuk fenomena tetes dan permukaan. Tidak berwarna, mengakibatkan cahaya yang dibutuhkan untuk fotosintesis mencapai kedalaman tertentu.
Air beku (es) mengapung, sirkulasi vertikal menghambat stratifikasi badan air.
Menentukan transfer panas dan molekul air antara atmosfer dan badan air.
Stabilitas dari temperature organisme dan wilayah geografis.
Temperatur stabil pada titik beku.
2.2. Siklus Hidrologi
Siklus hidrologis merupakan suatu fenomena alam. Dengan adanya siklus ini
maka keberadaan air di bumi akan tetap terjaga. Di alam, air mempunyai fungsi
terpenting dalam kehidupan manusia. Manusia memanfatkan air untuk memenuhi
kebutuhan sehari-hari seperti mencuci, mandi, memasak dan membersihkan
kotoran-kotoran yang ada di lingkungan. Air di alam ini bersirkulasi atau mengalami siklus
hidrologi (Chandra, 2006).
Menurut Chandra (2006), secara umum pergerakan air di alam terdiri dari
berbagai peristiwa, seperti:
1. Penguapan air (evaporasi)
2. Pembentukan awan (kondensasi)
3. Peristiwa jatuhnya air ke bumi/hujan (presipitasi)
4. Aliran air pada permukaan bumi dan di dalam tanah
Secara jelas, siklus hidrologis ini dapat dijelaskan sebagai berikut:
Pada mulanya, air yang terdapat di bumi baik berasal dari air permukaan, air yang ada
di dalam tumbuhan serta hewan dan manusia akan menguap dengan adanya panas
yang berasal dari sinar matahari. Selanjutnya uap ini akan tertahan di atmosfer dan
membentuk awan. Dalam kondisi tertentu, uap ini selanjutnya akan mendingin dan
berubah bentuk menjadi tetesan-tetesan air dan akhirnya jatuh ke bumi sebagai hujan.
Air hujan tersebut ada yang masuk langsung ke permukaan tanah, namun ada pula
yang meresap di dalam tanah dan menjadi air tanah serta ada sebagian yang diserap
oleh tumbuhan. Selanjutnya tumbuhan, air permukaan, manusia serta hewan akan
akhirnya terbentuk kembali air yang dapat digunakan dalam kehidupan di muka bumi
ini. Siklus inilah yang disebut sebagai siklus hidrologi (Mulia, 2005).
Gambar 2.1. Siklus Hidrologi 2.3. Sumber-sumber Air
Menurut Pandia, dkk (1995), sumber-sumber air yang ada di alam terdiri dari:
2.3.1. Air laut
Air laut mempunyai rasa asin karena mengandung garam NaCl. Kadar garam
NaCl dalam air laut adalah lebih kurang 3%. Dengan keadaan ini maka air laut tidak
memenuhi syarat untuk kebutuhan domestik maupun industri (Pandia, dkk, 1995).
2.3.2. Air atmosfir, air meteorologik atau air hujan
Air atmosfir mempunyai sifat sadah karena mengandung ion bikarbonat
sehingga boros dalam pemakaian sabun. Air yang sadah ini juga dapat menyebabkan
kerusakan (karat) pada alat-alat rumah tangga. Hal ini disebakan kation-kation
ataupun anion-anion dalam air sadah tersebut bereaksi dengan sabun membentuk
3.3.3. Air permukaan
Air permukaan merupakan air yang sebagian besar berasal dari air hujan yang
jatuh ke bumi. Air permukaan ini seperti air danau, sungai, rawa, telaga, waduk dan
terjun. Air permukaan ini dapat mengandung pengotor-pengotor yang bisa terjadi
akibat dari aliran air hujan yang menuju permukaan tanah bercampur dengan
lumpur, sampah dan lainnya (Pandia, dkk, 1995).
Air permukaan dapat dibedakan atas :
a. Air sungai
Air sungai mempunyai derajat pengotoran yang cukup tinggi. Debit yang
tersedia untuk memenuhi kebutuhan domestik pada umumnya dapat mencukupi
(Pandia, dkk, 1995).
b. Air rawa dan danau
Kebanyakan air rawa dan danau mempunyai warna, yang disebabkan oleh
adanya zat-zat organis yang telah membusuk, misalnya asam humat yang larut dalam
air.
Dengan adanya pembusukan maka kadar zat organis dalam air rawa akan
tinggi, dan umumnya kadar Fe dan Mn akan tinggi pula. Pada permukaan air rawa
juga tumbuh algae, karena adanya sinar matahari dan O2 sehingga Fe dan Mn
mengendap. Karena itu, untuk pengambilan air sebaiknya dilakukan pada kedalaman
tertentu di tengah-tengah agar endapan-endapan Fe dan Mn tidak terbawa, demikian
3.3.4. Air tanah
Menurut Chandra (2006), air tanah merupakan sebagian air hujan yang
mencapai permukaan bumi dan menyerap ke dalam lapisan tanah dan menjadi air
tanah. Sebelum mencapai lapisan tempat air tanah, air hujan akan menembus
beberapa lapisan tanah dan meyebabkan terjadinya kesadahan pada air. Kesadahan
pada air menyebabkan air mengandung zat-zat mineral seperti kalsium, magnesium,
dan logam berat seperti Fe dan Mn. Akibatnya, apabila kita menggunakan air sadah
untuk mencuci, sabun yang kita gunakan tidak akan berbusa dan bila diendapkan
akan terbentuk endapan semacam kerak.
Air tanah merupakan air yang berada di permukaan tanah. Menurut Darmono
(2001), air tanah dapat terkontaminasi dari beberapa sumber pencemar, baik lokal
maupun regional. Dua sumber utama kontaminasi air tanah ialah terjadinya
kebocoran bahan kimia organik dari penyimpanan bahan kimia dalam bunker yang
disimpan dalam tanah, dan penampungan limbah industri yang ditampung dalam
suatu kolam besar yang terletak di atas atau di dekat sumber air tanah.
Berdasarkan lokasinya, air tanah dapat dibedakan atas air tanah dangkal, air
tanah dalam dan mata air.
a. Air tanah dangkal
Terjadi karena daya peresapan air pada permukaan tanah. Akibatnya lumpur
akan tertahan, demikian pula dengan sebagian bakteri. Air tanah yang jernih dapat
mengandung lebih banyak zat kimia (garam-garam yang terlarut), karena melalui
lapisan tanah yang mempunyai unsur-unsur kimia tertentu yang berfungsi sebagai
bagian air yang dekat dengan permukaan tanah. Setelah menemukan lapisan rapat air,
air yang terkumpul merupakan air tanah dangkal. Air tanah ini dapat dimanfaatkan
untuk kebutuhan domestik melalui sumur-sumur dangkal (Sanropie, dkk, 1984).
Air tanah dangkal dapat diperoleh pada kedalaman sekitar 15 meter. Kualitas
air tanah dangkal sebagai sumur-sumur air minum cukup baik, tetapi kuantitasnya
kurang dan tergantung kepada musim (Sanropie, dkk, 1984).
Air tanah secara normal akan bebas dari kekeruhan dan organisme pathogen.
Apabila air yang berasal dari aquifer (air tanah dangkal) yang mengandung zat
organik, kandungan oksigen akan terurai dan kandungan karbon dioksida akan
menjadi tinggi, air akan menjadi korosif. Pada kandungan zat organik dalam aquifer
tinggi, kandungan oksigen akan habis terurai. Air yang tidak mengandung oksigen
(anaerobik) akan melarutkan besi, mangan dan logam berat dalam air tanah
(Sanropie, dkk, 1984).
b. Air tanah dalam
Terdapat setelah lapisan rapat air yang pertama. Untuk pengambilan sampel
air tanah dalam memerlukan bor dan memasukkan pipa hingga kedalaman 100-300
meter.
Jika tekanan air tanah ini besar, maka air dapat menyembur keluar dan dalam
keadaan ini sumur yang terbentuk disebut sumur artesis. Jika air tidak dapat keluar
dengan sendirinya, maka digunakan pompa untuk membantu pengeluaran air tanah
dalam.
Kualitas air tanah dalam pada umumnya lebih baik dari air tanah dangkal,
tanah yang dilalui. Jika melalui tanah kapur, maka air akan menjadi sadah karena
mengandung Ca(HCO3)2 dan Mg(HCO3)2. Jika melalui batuan granit, maka air akan
lunak dan agresif karena mengandung gas CO2 dan Mn (HCO3)2 (Sanropie, dkk,
1984).
Air yang bersifat sadah tidak ekonomis dalam penggunaannya karena :
1) terlalu boros dalam pemakaian sabun. Hal ini disebabkan air yang
mengandung ion Ca2+ bereaksi dengan senyawa sodium stearat
C17H35COONa dalam sabun membentuk endapan kalsium stearat
C17H35(COO2)Ca yang menyebabkan tidak terbentuknya busa sabun. Setelah
ion Ca2+ habis, baru busa akan terbentuk.
2) mengganggu pada ketel-ketel air karena terjadi reaksi :
Ca(HCO3)2 CaCO3 + H2O + CO2
Dengan terbentuknya kerak CaCO3 sebagai batu ketel, maka akan
mengganggu perpindahan panas sehingga sering terjadi ledakan pada
ketel-ketel air atau sumbatan pada pipa-pipa (Sanropien, dkk, 1984). Kuantitas air
tanah dalam umumnya mencukupi dan sedikit dipengaruhi oleh perubahan
musim.
c. Mata air
Mata air adalah air tanah yang keluar dengan sendirinya ke permukaan tanah.
Mata air yang berasal dari tanah dalam hampir tidak berpengaruh oleh musim dan
kualitasnya sama dengan air tanah dalam.
Berdasarkan cara munculnya ke permukaan tanah, mata air dibedakan atas:
2) air yang keluar ke permukaan pada suatu dataran atau air artesis
(Sanropie, dkk, 1984).
Menurut Darmono (2001), banyak logam berat baik yang bersifat toksik
maupun esensial terlarut dalam air dan mencemari air tawar maupun air laut. Sumber
pencemaran ini banyak berasal dari pertambangan, peleburan logam, dan jenis
industri lainnya, dan dapat juga berasal dari lahan pertanian yang menggunakan
pupuk atau antihama yang mengandung logam.
Air tanah sering terkontaminasi oleh logam-logam diantaranya besi (Fe) dan
mangan (Mn). Keberadaan logam ini biasanya ditandai dengan warna air yang
berubah menjadi kuning-coklat setelah beberapa saat kontak dengan udara. Menurut
Sobirin (2010), kontaminasi air tanah oleh besi (Fe) dan mangan (Mn) adalah akibat
adanya kontak antara air dengan batu dan mineral, dan kadang-kadang akibat kontak
dengan bahan buatan manusia seperti pipa besi dan baja. Biasanya air tanahlah yang
memerlukan pengolahan untuk menghilangkan besi (Fe) dan mangan (Mn). Selain
itu, beberapa hal yang berandil besar dalam menimbulkan kontaminasi air tanah oleh
besi (Fe) dan mangan (Mn) adalah pembuangan limbah industri atau tambang.
3.4. Sumur
Menurut Chandra (2006), sumur merupakan sumber utama persediaan air
bersih bagi penduduk yang tinggal di daerah pedesaan maupun di perkotaan
Indonesia. Secara teknis sumur dapat dibagi menjadi 2 jenis:
1. Sumur dangkal ( shallow well)
Sumur semacam ini memiliki sumber air yang berasal dari resapan air hujan di
terdapat di Indonesia dan mudah sekali terkontaminasi air kotor yang berasal dari
kegiatan mandi-cuci-kakus (MCK) sehingga persyaratan sanitasi yang ada perlu
sekali diperhatikan.
2. Sumur dalam (deep well)
Sumur ini memiliki sumber air yang berasal dari proses purifikasi alami air hujan
oleh pelapisan kulit bumi menjadi air tanah. Sumber airnya tidak terkontaminasi
dan memenuhi persyaratan sanitasi.
Menurut Azwar (1979), sumur dangkal yang dipandang memenuhi syarat
kesehatan ialah:
a. Dinding sumur 3 meter bagian atas harus dibuat dari tembok yang tidak tembus
air, agar perembesan air permukaan yang telah tercemar tidak terjadi. Kedalaman
3 meter diambil karena bakteri pada umumnya tidak dapat hidup lagi pada
kedalaman tersebut.
b. Kira-kira 1½ meter berikutnya ke bawah, dinding ini dibuat dari tembok yang
tidak disemen, tujuannya lebih banyak untuk mencegah runtuhnya tanah.
c. Dasar tanah diberi batu kerikil agar tidak keruh.
d. Di atas tanah dibuat dinding tembok kira-kira 1 meter, agar air sekitarnya tidak
masuk ke dalam sumur, serta juga untuk keselamatan pemakai.
e. Tanah di sekitar tembok sumur atas disemen dan tanahnya dibuat miring dengan
tepinya dibuat saluran. Lebar semen di sekeliling sumur kira-kira 1½ meter, agar
air permukaan tidak masuk.
f. Sumur diberi atap dan ember yang dipakai jangan diletakkan di bawah, tetapi
g. Sebaiknya air sumur diambil dengan pompa.
Air sumur ini bersumber dari air tanah, untuk kontaminasi air sumur dapat
terjadi seperti penjelasan pada air tanah. Dimana kontaminasi yang sering terjadi
adalah tingginya kandungan logam besi (Fe) dan mangan (Mn) pada sumur tersebut.
Kedua logam yaitu besi (Fe) dan mangan (Mn) dapat dijelaskan sebagai berikut:
a. Besi (Fe)
1. Pengertian Besi
Menurut Alaerts (1987), Besi adalah salah satu elemen kimiawi yang dapat
ditemui pada hampir setiap tempat di bumi, pada semua lapisan geologis dan semua
badan air. Pada umumnya, besi yang ada di dalam air dapat bersifat :
a. Terlarut sebagai Fe2+ (fero) atau Fe3+ (feri);
b. Tersuspensi sebagai butir koloidal (diameter < 1 µm) atau lebih besar, seperti
Fe2O3, FeO, FeOOH, Fe(OH)3 dan sebagainya;
c. Tergabung dengan zat organis atau zat padat yang inorganis (seperti tanah
liat).
Pada air permukaan jarang ditemui kadar Fe lebih besar dari 1 mg/l, tetapi di
dalam air tanah kadar Fe dapat jauh lebih tinggi. Konsentrasi Fe yang tinggi ini dapat
dirasakan dan dapat menodai kain dan perkakas dapur.
Pada air yang tidak mengandung oksigen O2, seperti seringkali air tanah, besi
berada sebagai Fe2+ yang cukup dapat terlarut, sedangkan pada air sungai yang
mengalir dan terjadi aerasi, Fe2+ teroksidasi menjadi Fe3+; Fe3+ ini sulit larut pada pH
6 sampai 8 (kelarutan hanya di bawah beberapa µg/l), bahkan dapat menjadi
bisa mengendap. Demikian dalam air sungai, besi berada sebagai Fe2+, Fe3+ terlarut
dan Fe3+ dalam bentuk senyawa organis berupa koloidal (Alaerts, 1987).
2. Kandungan Besi (Fe) dalam Air
Menurut Achmad (2004), besi adalah satu dari lebih unsur-unsur penting
dalam air permukaan dan air tanah. Perairan yang mengandung besi sangat tidak
diinginkan untuk keperluan rumah tangga, karena dapat menyebabkan bekas karat
pada pakaian, porselin dan alat-alat lainnya serta menimbulkan rasa yang tidak enak
pada air minum pada konsentrasi diatas kurang lebih 0,31 mg/l.
Menurut Yuliana (2009), besi dalam air berbentuk ion bervalensi dua (Fe2+)
dan bervalensi tiga (Fe3+). Dalam bentuk ikatan dapat berupa Fe2O3, Fe(OH)2,
Fe(OH)3 atau FeSO4 tergantung dari unsur lain yang mengikatnya. Dinyatakan pula
bahwa besi dalam air adalah bersumber dari dalam tanah sendiri di samping dapat
pula berasal dari sumber lain, diantaranya dari larutnya pipa besi, reservoir air dari
besi atau endapan-endapan buangan industri.
Hal-Hal yang memengaruhi kelarutan besi dalam air, yaitu:
a. Kedalaman
Air hujan yang turun jatuh ke tanah dan mengalami infiltrasi masuk ke dalam
tanah yang mengandung FeO akan bereaksi dengan H2O dan CO2 dalam tanah
dan membentuk Fe(HCO3)2. Dimana semakin dalam air yang meresap ke dalam
tanah semakin tinggi juga kelarutan besi karbonat dalam air tersebut.
b. Derajat Keasaman ( pH )
pH air akan terpengaruh terhadap kadar besi dalam air. Apabila pH air rendah
logam lainnya dalam air, pH yang rendah kurang dari 7 dapat melarutkan logam.
Dalam keadaan pH rendah, besi yang ada dalam air berbentuk ferro dan ferri,
dimana bentuk ferri akan mengendap dan tidak larut dalam air serta tidak dapat
dilihat dengan mata sehingga mengakibatkan air menjadi berwarna, berbau dan
berasa.
c. Suhu
Temperatur yang tinggi menyebabkan menurunnya kadar O2 dalam air. Kenaikan
temperatur air juga dapat menguraikan derajat kelarutan mineral sehingga
kelarutan Fe pada air tinggi.
d. Bakteri besi
Bakteri besi (Crenothrix, Lepothrix, Galleanella, Sinderocapsa dan
Sphoerothylus) adalah bakteri yang dapat mengambil unsur besi dari sekeliling
lingkungan hidupnya sehingga mengakibatkan turunnya kandungan besi dalam
air. Dalam aktifitasnya bakteri besi memerlukan oksigen dan besi. Hasil aktifitas
bakteri besi tersebut menghasilkan presipitat (oksida besi) yang akan
menyebabkan warna pada pakaian dan bangunan. Bakteri besi merupakan bakteri
yang hidup dalam keadaan anaerob dan banyak terdapat dalam air yang
mengandung mineral. Pertumbuhan bakteri akan menjadi lebih sempurna apabila
air banyak mengandung CO2 dengan kadar yang cukup tinggi.
e. Karbondioksida ( CO2 ) Agresif
Karbondioksida (CO2) merupakan salah satu gas yang terdapat dalam air.
Berdasarkan bentuk dari gas Karbondioksida (CO2) di dalam air, CO2 dibedakan
dan CO2 agresif. Dari ketiga bentuk Karbondioksida (CO2) yang terdapat dalam
air, CO2 agresif-lah yang paling berbahaya karena kadar CO2 agresif lebih tinggi
dan dapat menyebabkan terjadinya korosi sehingga berakibat kerusakan pada
logam-logam dan beton. Menurut Powell CO2 bebas yang asam akan merusak
logam apabila CO2 tersebut bereaksi dengan air. Reaksi ini dikenal sebagai teori
asam, dengan reaksi sebagai berikut:
2 Fe + H2CO3 FeCO3 + 2 H+
2 FeCO3 + 5 H2O +1/2 O2 2 Fe(OH)2 + 2 H2CO3
Dalam reaksi di atas dapat dilihat bahwa asam karbonat tersebut secara
terus-menerus akan merusak logam, selain membentuk FeCO3 sebagai hasil reaksi
antara Fe dan H2CO3, selanjutnya FeCO3 bereaksi dengan air dan gas oksigen
(O2) menghasilkan zat 2FeOH dan 2H2CO3 dimana H2CO3 tersebut akan
menyerang logam kembali sehingga proses perusakan logam akan berjalan secara
terus-menerus mengakibatkan kerusakan yang semakin lama semakin besar pada
logam tersebut.
3. Dampak Besi (Fe) dalam kehidupan
Menurut Yuliana (2009), apabila kosentrasi besi terlarut dalam air melebihi
1,0 mg/l akan menyebabkan berbagai masalah, diantaranya :
a) Gangguan Teknis
Endapan Fe(OH) bersifat korosif terhadap pipa dan akan mengendap pada saluran
pipa, sehingga mengakibatkan efek-efek yang dapat merugikan seperti mengotori
b) Gangguan Fisik
Gangguan fisik yang ditimbulkan oleh adanya besi terlarut dalam air adalah
timbulnya warna, bau, rasa. Air akan terasa tidak enak bila konsentrasi besi
terlarutnya > 1,0 mg/l.
c) Gangguan Kesehatan
Senyawa besi dalam jumlah kecil di dalam tubuh manusia berfungsi sebagai
pembentuk sel-sel darah merah, dimana tubuh memerlukan 7-35 mg/hari yang
sebagian diperoleh dari air. Tetapi zat Fe yang melebihi dosis yang diperlukan
oleh tubuh dapat menimbulkan masalah kesehatan. Hal ini dikarenakan tubuh
manusia tidak dapat mensekresi Fe, sehingga bagi mereka yang sering mendapat
tranfusi darah warna kulitnya menjadi hitam karena akumulasi Fe. Air minum
yang mengandung besi cenderung menimbulkan rasa mual apabila dikonsumsi.
Selain itu dalam dosis besar dapat merusak dinding usus. Kematian sering kali
disebabkan oleh rusaknya dinding usus ini. Kadar Fe yang lebih dari 1 mg/l akan
menyebabkan terjadinya iritasi pada mata dan kulit. Apabila kelarutan besi dalam
air melebihi 10 mg/l akan menyebabkan air berbau seperti telur busuk.
b. Mangan (Mn)
1. Pengertian Mangan (Mn)
Mangan merupakan unsur logam yang termasuk golongan VII, dengan berat
atom 54,93, titik lebur 12470C, dan titik didihnya 20320C. Menurut Slamet (2002),
mangan (Mn) adalah metal kelabu-kemerahan. Di dalam penyediaan air, seperti
2. Kandungan Mangan (Mn) dalam Air
Menurut Achmad (2004), toksisitas mangan (Mn) relatif sudah tampak pada
konsentrasi rendah. Dengan demikian tingkat kandungan Mn yang diizinkan dalam
air yang digunakan untuk keperluan domestik sangat rendah, yaitu di bawah 0,05
mg/l. Dalam kondisi aerob mangan dalam perairan terdapat dalam bentuk MnO2 dan
pada dasar perairan tereduksi menjadi Mn2+ atau dalam air yang kekurangan oksigen
(DO rendah). Oleh karena itu pemakaian air yang berasal dari dasar suatu sumber air,
sering ditemukan mangan dalam konsentrasi tinggi.
3. Dampak Mangan (Mn) terhadap Kesehatan
Di dalam tubuh manusia, mangan dalam jumlah yang kecil tidak
menimbulkan gangguan kesehatan, tetapi dalam jumlah yang besar dapat tertimbun di
dalam hati dan ginjal. Ada berbagai pendapat tentang gangguan kesehatan akibat
keracunan mangan, tetapi umumnya dalam keadaan kronis menimbulkan gangguan
pada sistem saraf dan menampakkan gejala seperti penyakit Parkinson. Berdasarkan
percobaan yang dilakukan terhadap kelinci, keracunan mangan menimbulkan
gangguan pada pertumbuhan tulang.
Menurut Sri dalam Fajar (2008), menyatakan bahwa pengaruh kesehatan yang
ditimbulkan mangan dapat terserap tubuh melalui beberapa jalur. Jalur tersebut
seperti melalui udara, debu mangan dapat terhirup masuk ke tubuh lewat saluran
pernapasan. Selain itu mangan juga dapat terserap melalui air tanah, serta makanan
dan air minum. Efek mangan ditentukan lamanya dan tingginya kadar mangan yang
diserap tubuh dan bersifat meracuni tubuh dan membahayakan kesehatan. Orang
dapat mengalami kondisi yang dikenal dengan istilah manganisme. Gejala
manganisme dapat muncul perlahan selama berbulan atau bertahun-tahun dengan
intensitas berlainan. Bisa muncul sekaligus atau sendiri-sendiri dan umumnya gejala
masih terus berlanjut hingga bertahun-tahun, namun tidak semua penderita
mengalami gejala yang sama.
Air tanah sangat sering digunakan untuk memenuhi kebutuhan akan air. Baik
kuantitas maupun kualitas sangat diperhatikan. Untuk kuantitas, air sebaiknya
tersedia dalam jumlah yang cukup untuk memenuhi kebutuhan manusia. Menurut
Sunjaya dalam Wulan (1999), menyatakan bahwa ditinjau dari segi kuantitasnya
kebutuhan air untuk rumah tangga adalah:
1) Kebutuhan air untuk minum dan mengolah makanan 5 liter / orang perhari
2) Kebutuhan air untuk higien yaitu untuk mandi dan membersihkan dirinya
25-30 liter / orang perhari
1) Kebutuhan air untuk mencuci pakaian dan peralatan 25-30 liter / orang perhari
2) Kebutuhan air untuk menunjang pengoperasian dan pemeliharaan fasilitas sanitasi
atau pembuangan kotoran 4-6 liter / orang perhari.
Menurut Suparmin (2000), kualitas air tanah dipengaruhi oleh beberapa
faktor, yaitu:
1. Iklim, meliputi curah hujan dan temperatur. Perubahan temperatur
berpengaruh terhadap kelarutan gas. Semakin rendah temperatur maka gas
yang tertinggal sebagai larutan semakin banyak. Curah hujan yang jatuh ke
permukaan tanah akan melarutkan unsur-unsur kimia antara lain oksigen,
2. Litologi yaitu jenis tanah dan batuan dimana air akan melarutkan unsur-unsur
padat dalam batuan tersebut.
3. Waktu yaitu semakin lama air tanah itu tinggal di suatu tempat akan semakin
banyak unsur terlarut.
4. Aktivitas manusia yaitu kepadatan penduduk berpengaruh negatif terhadap
air tanah apabila kegiatannya tidak memperhatikan lingkungan seperti
membuang sampah sembarangan dan kotoran manusia (Suparmin, 2000).
2.5. Kualitas Air
Peraturan Pemerintah No. 20 tahun 1990 mengelompokkan kualitas air
menjadi beberapa golongan menurut peruntukannya. Adapun penggolongan air
menurut peruntukannya adalah sebagai berikut:
1. Golongan A, yaitu air yang dapat digunakan sebagai air minum secara langsung,
tanpa pengolahan terlebih dahulu.
2. Golongan B, yaitu air yang dapat digunakan sebagai air baku air minum
3. Golongan C, yaitu air yang dapat digunakan untuk keperluan perikanan dan
peternakan
4. Golongan D, yaitu air yang dapat digunakan untuk keperluan pertanian, usaha di
perkotaan, industri, dan pembangkit listrik tenaga air (Effendi, 2003).
Peraturan tentang kualitas air yang lain adalah Permenkes RI Nomor 416
tahun 1990 tentang syarat-syarat dan pengawasan kualitas air bersih dan Permenkes
RI Nomor 492 tentang persyaratan kualitas air minum. Standard kualitas air bersih
dapat diartikan sebagai ketentuan-ketentuan berdasarkan Permenkes RI No.
yang menunjukkan persyaratan–persyaratan yang harus dipenuhi agar air tersebut
tidak menimbulkan gangguan kesehatan, penyakit, gangguan teknis, serta gangguan
dalam segi estetika. Peraturan ini dibuat dengan maksud bahwa air yang memenuhi
syarat kesehatan mempunyai peranan penting dalam rangka pemeliharaan,
perlindungan serta mempertinggi derajat kesehatan masyarakat. Dengan peraturan ini
telah diperoleh landasan hukum dan landasan teknis dalam hal pengawasan kualitas
air bersih.
2.6. Persyaratan Kualitas Air
Persyaratan kualitas air wajib dipenuhi dalam penggunaan air untuk
kebutuhan hidup manusia. Air yang baik dan aman bagi kesehatan adalah apabila
memenuhi syarat fisika, kimia, mikrobiologi dan radioaktif.
2.6.1. Persyaratan Fisik
Menurut Kusnaedi (2010), persyaratan fisik air yaitu:
1. Tidak berwarna
Air yang berwarna berarti air tersebut telah mengandung bahan-bahan
berbahaya yang dapat mengganggu kesehatan jika dikonsumsi.
2. Temperaturnya normal
Air yang baik harus memiliki temperatur sama dengan temperatur udara
(20-260 C). Menurut Permenkes RI No 416 tahun 1990, temperatur air yang baik
adalah suhu udara ± 30C.
3. Rasanya tawar
Air yang terasa asam, manis, pahit, atau asin menunjukkan bahwa kualitas air
4. Tidak berbau
Air yang baik adalah air yang apabila dicium tidak menimbulkan bau baik
dicium pada jarak dekat maupun jauh.
5. Jernih atau tidak keruh
Air yang keruh disebabkan oleh adanya koloid-koloid dari bahan tanah liat
yang terkandung di dalam air tersebut. Semakin banyak kandungan koloid
maka air tersebut akan semakin keruh. Menurut Permenkes RI Nomor 416
tahun 1990, kekeruhan yang diperbolehkan di dalam air bersih adalah 25
NTU.
6. Tidak mengandung zat padatan
Air minum yang baik tidak diperbolehkan mengandung padatan, meskipun air
tersebut jernih namun jika mengandung padatan yang terapung maka air
tersebut tidak baik digunakan sebagai air minum. Total zat padatan terlarut
(TDS) yang diperbolehkan di dalam air minum adalah 500 mg/l menurut
Permenkes RI Nomor 492 tahun 2010.
2.6.2. Persyaratan Kimia
Menurut Slamet (2000), air yang baik adalah air yang tidak tercemar secara
berlebihan oleh zat-zat kimia yang berbahaya bagi kesehatan antara lain Air Raksa
(Hg), Aluminium (Al), Arsen (As), Barium (Ba), Besi (Fe), Flourida (F), Kalsium
(Ca), Derajat keasaman (pH) dan zat-zat kimia lainnya. Air yang digunakan untuk
memenuhi kebutuhan sehari-hari sebaiknya tidak mengandung zat-zat kimia tersebut
dalam konsentrasi yang melebihi seperti yang tercantum dalam PerMenKes RI
gangguan kesehatan jika tetap digunakan. Contohnya Besi (Fe), keberadaannya di
dalam tubuh memang diperlukan namun dalam konsentrasi yang rendah. Jika di
dalam air bersih, konsentrasi Besi (Fe) yang diperbolehkan ada yaitu hanya dalam
konsentrasi 1,0 mg/lt saja dan untuk air minum yaitu 0,3 mg/l.
Menurut Permenkes RI Nomor 416 tahun 1990, untuk syarat kimia air yaitu
kandungan besi (Fe) dan mangan (Mn) yang masih diperbolehkan ada dalam air
bersih adalah Fe (01,0 mg/l) dan Mn (0,5 mg/l).
2.6.3. Persyaratan Mikrobiologi
Syarat biologi yang harus dipenuhi di dalam air yang digunakan untuk
kebutuhan domestik adalah tidak boleh mengandung mikroorganisme yang berbahaya
bagi kesehatan. Mikroorganisme tersebut seperti bakteri total coliform. Menurut
Permenkes RI No. 416 Tahun 1990, total coliform yang diperbolehkan dalam air
perpipaan adalah 10 per 100 ml air sedangkan untuk non perpipaan adalah 50 per 100
ml air.
2.6.4. Persyaratan Radioaktif
Adanya zat radioaktif di lingkungan tentu saja sangat membahayakan. Hal ini
disebabkan zat radioaktif ini bersifat sangat reaktif karena mengandung radiasi yang
tinggi. Di dalam air, zat radioaktif ini biasanya ada akibat bahan radioaktif dibuang
langsung ke lingkungan air. Zat radioaktif dapat menimbulkan kerusakan pada sel
yang terpapar dan kerusakan ini berupa kematian serta perubahan komposisi genetik.
Perubahan genetik dapat menimbulkan penyakit seperti kanker dan mutasi (Mulia,
2.7. Air Bersih
Air Bersih yang baik yaitu harus memenuhi syarat kesehatan seperti
dijelaskan di atas.
2.7.1. Pengertian Air Bersih
Menurut Peraturan Menteri Kesehatan RI Nomor 416 Tahun 1990, air bersih
adalah air yang digunakan untuk keperluan sehari-hari yang kualitasnya memenuhi
syarat kesehatan dan dapat diminum apabila telah dimasak.
2.8. Teknologi Penurunan Kandungan Besi (Fe) dan Mangan (Mn) dalam Air Menurut Said, N.S dan Wahjono, H.D (1999), beberapa cara yang dapat
dilakukan untuk menurunkan kadar besi (Fe) dan mangan (Mn) dalam air adalah:
1. Oksidasi
Cara oksidasi ini dapat dilakukan dengan tiga cara, yaitu
a. Oksidasi dengan udara (aerasi)
Fe dan Mn dapat dihilangkan dari dalam air dengan melakukan oksidasi
yaitu Fe menjadi Fe(OH)3 dan Mn menjadi Mn2O3 yang tidak larut dalam
air, kemudian diikuti dengan pengendapan dan penyaringan. Proses oksidasi
dilakukan dengan menggunakan udara biasa disebut aerasi yaitu dengan
cara memasukkan udara dalam air.
b. Oksidasi dengan khlorine (khlorinasi)
Khlorine, Cl2 dan ion hipoklorit (OCl-) adalah bahan oksidator yang kuat,
sehingga meskipun pada pH rendah dan oksigen terlarut sedikit dapat
mengoksidasi dengan cepat. Untuk melakukan khlorinasi, khlorin dilarutkan
melalui orifice flowmeter atau dosimeter yang disebut khlorinator.
Pemakaian kaporit atau kalsium hipokhlorit untuk mengoksidasi atau
menghilangkan besi dan mangan relatif sangat mudah karena kaporit berupa
serbuk atau tablet yang mudah larut dalam air.
c. Oksidasi dengan kalium permanganat
Dalam proses oksidasi Fe dan Mn dengan kalium permanganat, kebutuhan
akan kalium permanganat cukup sedikit. Selanjutnya dalam proses akan
terbentuk mangan dioksida yang berlebihan. Mangan dioksida ini berfungsi
sebagai oksidator yang dapat mengoksidasi Fe dan Mn dalam air tersebut.
2. Pertukaran ion
Penurunan besi dan mangan dengan cara pertukaran ion yaitu dengan cara
mengalirkan air baku yang mengandung Fe dan Mn melalui suatu media
pertukaran ion. Sehingga Fe dan Mn akan bereaksi dengan media penukar
ionnya. Sebagai media penukar ion yang sering dipakai zeolit alami yang
merupakan senyawa hydrous silikat aluminium dengan kalsium dan natrium.
Selain bahan penukar ion alami ada juga penukar ion tiruan (resin sintetis)
yang mempunyai sifat-sifat yang lebih khusus. Ditinjau dari siklus penukar
ionnya, ada dua tipe yaitu: penukar ion dengan siklus Na yang regenerasinya
dengan memakai larutan NaCl, dan penukar ion dengan siklus H yang
regenerasinya dengan menggunakan larutan HCl.
3. Filtrasi kontak
Ada dua cara yang banyak dipakai, yaitu:
Air baku yang mengandung Fe dan Mn dialirkan ke suatu filter yang
medianya mengandung MnO2.nH2O. Selama mengalir melalui media
tersebut Fe dan Mn yang terdapat dalam air baku akan teroksidasi menjadi
bentuk Fe(OH)3 dan Mn2O3 oksigen terlarut dalam air, dengan oksigen
sebagai oksidator.
b. Dengan mangan zeolit
Air baku yang mengandung Fe dan Mn dialirkan melalui suatu filter bed
yang media filternya terdiri dari mangan-zeolit (K2Z.MnO.Mn2O7).
Mangan zeolit berfungsi sebagai katalis dan pada waktu yang bersamaan
besi dan mangan yang ada dalam air teroksidasi menjadi bentuk
ferri-oksida dan mangandiferri-oksida yang tak larut dalam air.
4. Soda lime
Proses ini merupakan gabungan antara proses pemberian zat alkali untuk
menaikkan pH dengan proses aerasi. Dengan menaikkan pH air baku sampai
harga tertentu maka reaksi oksidasi besi dan mangan dengan cara aerasi dapat
berjalan lebih cepat. Zat alkali yang sering dipakai yaitu (CaO) atau larutan
kapur [Ca(OH)2] dan soda api [Na(OH)] atau campuran antara keduanya.
Cara penambahan zat alkali yakni sebelum proses aerasi. Untuk oksidasi besi,
sangat efektif pada pH 8-9, sedang untuk oksidasi mangan baru efektif pada
pH >10. Oleh karena pH air baku menjadi tinggi, maka setelah Fe dan Mn nya
5. Bakteri besi
Pada saringan pasir lambat, pada saat operasi dengan kecepatan 10-30
meter/hari, setelah operasi berjalan 7-10 hari, maka pada permukaan atau
dalam media filternya akan tumbuh dan berkembang biak bakteri besi yang
dapat mengoksidasi besi atau mangan yang ada dalam air. Bakteri besi
mendapatkan energi aktivasi yang dihasilkan oleh reaksi oksida besi ataupun
oksida mangan, untuk proses perkembangbiakannya. Dengan didapatkannya
energi tersebut maka jumlah sel bakteri juga akan bertambah. Dengan
bertambahnya jumlah sel bakteri besi tersebut, maka kemampuan
mengoksidasi-nyapun menjadi bertambah pula. Sedangkan besi yang telah
teroksidasi akan tersaring/tertinggal dalam filter. Yang termasuk dalam grup
Bakteri besi yang banyak dijumpai yaitu: Crenothrix yang dapat
menghilangkan besi maupun Mangan.
6. Filtrasi dua tahap
Cara ini sebetulnya untuk menghilangkan / meniadakan proses koagulasi
dan sedimentasi yaitu dengan cara melakukan penyaringan 2 (dua) tahap
dengan saringan pasir cepat. Setelah proses aerasi, maka senyawa besi dalam
bentuk Fe(OH)3 larut dalam air dialirkan ke dalam saringan pasir cepat secara
bertahap. Cara ini dapat menghemat biaya operasi untuk koagulasi dan
pengendapan tetapi beban saringan pertama akan cukup besar.
7. Koagulasi
Proses penurunan kadar besi dan mangan dengan cara koagulasi dapat
a. Koagulasi dengan penambahan bahan koagulan
Besi dan mangan banyak terdapat dalam air tanah dan umumnya berada
dalam bentuk senyawa valensi 2 atau dalam bentuk ion Fe2+ dan Mn2+.
Lain halnya jika besi dan mangan tersebut berada dalam air dalam bentuk
senyawa organik dan koloid, misalnya bersenyawa dengan zat warna
organik atau asam humus (humic acid), maka keadaan yang demikian
susah dihilangkan baik dengan cara aerasi, penambahan khlorine maupun
dengan penambahan kalium permanganat. Adanya partikel-partikel halus
Fe(OH)3.nH2O air juga sukar mengendap dan menyebabkan air menjadi
keruh. Untuk menghilangkan zat besi dan mangan seperti pada kasus
tersebut, perlu dilakukan koagulasi dengan membubuhkan bahan
koagulan, misalnya aluminium sulfat, Al2(SO4).nH2O dalam air yang
mengandung koloid. Dengan pembubuhan koagulan tersebut, koloid
dalam air menjadi bergabung dan membentuk gumpalan (flock) kemudian
mengendap. Setelah koloid senyawa besi dan mangan mengendap,
kemudian air disaring dengan saringan pasir cepat atau saringan pasir
lambat.
b. Koagulasi dengan cara elektrolitik
Ke dalam air baku dimasukkan elektroda dari lempengan logam
aluminium (Al) yang dialiri dengan listrik arus searah. Dengan adanya
arus listrik tersebut, maka elektroda logam Al tersebut sedikit demi sedikit
akan larut ke dalam air membentuk ion Al3+, yang oleh reaksi hidrolisa air
Dengan terbentuknya Al(OH)3.nH2O dan besi organik serta
partikel-pertikel koloid lain yang bermuatan negatif akan tertarik oleh ion Al3+
sehingga menggumpal menjadi partikel yang besar, mengendap dan dapat
dipisahkan. Cara ini sangat efektif, tetapi makin besar skalanya maka
kebutuhan listriknya makin besar pula.
8. Cara lain
Khususnya untuk menghilangkan besi yang ada dalam air ada cara lain
yang dapat digunakan yaitu dengan Oksidasi Kontak (Contact Oxydation). Air
baku dialirkan melalui saringan pasir atau media lainnya yang permukaannya
terlapisi oleh zat oksiferrihidroksida (FeOOH). Pada saat melalui media
tersebut Fe2+ dengan waktu yang sangat singkat akan teroksidasi menjadi Fe3+
dengan zatoksigen yang terlarut (DO) sebagai oksidator.
Tetapi jika kandugnan oksigen yang terlarut dalam air baku kecil
misalnya air tanah, maka air bakunya harus dikontakkan dengan udara dengan
cara kontak biasa atau menggunakan peralatan tertentu untuk suplai oksigen.
Mekanisme reaksi penghilangan besi dengan oksidasi kontak adalah
merupakan reaksi auto-katalitik dengan oksiferrihidroksida (FeOOH) sebagai
katalis, yang banyak terdapat pada bijih limonite. Jika dibandingkan dengan
cara-cara yang lain, penghilangan besi dengan cara ini mempunyai
karakteristik yang sangat berbeda. Cara oksidasi kontak ini mempunyai
keuntungan:
1. Tanpa proses koagulasi dan pengendapan.
3. Waktu pakai media filter (penyaringan) / katalis lama.
4. Tanpa proses regenerasi.
2.9. Koagulasi dan Flokulasi 2.9.1. Koagulasi
Koagulasi merupakan proses destabilisasi muatan partikel koloid, suspended
solid halus dengan penambahan koagulan disertai dengan pengadukan cepat untuk
mendispersikan bahan kimia secara merata. Pada dasarnya koloid terbagi dua, yakni
koloid hidrofilik yang bersifat mudah larut dalam air (soluble) dan koloid hidrofobik
yang bersifat sukar larut dalam air (insoluble). Bila koagulan ditambahkan ke dalam
air, reaksi yang terjadi antara lain adalah:
a. Pengurangan zeta potensial (potensial elektrostatis) hingga suatu titik di mana
gaya van der walls dan agitasi yang diberikan menyebabkan partikel yang tidak
stabil bergabung serta membentuk flok;
b. Agregasi partikel melalui rangkaian inter partikulat antara grup-grup reaktif pada
koloid;
c. Penangkapan partikel koloid negatif oleh flok-flok hidroksida yang mengendap.
Faktor-faktor yang memengaruhi proses koagulasi antara lain:
1. Kualitas air meliputi gas-gas terlarut, warna, kekeruhan, rasa, bau, dan kesadahan;
2. Jumlah dan karakteristik koloid;
3. Derajat keasaman air (pH);
4. Pengadukan cepat, dan kecepatan paddle;
5. Temperatur air
7. Karakteristik ion-ion dalam air (Mignolo, 2012).
Koagulasi dapat dilakukan dengan empat cara, yaitu:
a. Cara elektroforesis
Dalam cara ini, koloid diberi arus listrik sehingga partikel bergerak ke elektroda
yang berlawanan muatannya. Akibatnya partikel menjadi netral dan akhirnya
menggumpal dan mengendap di sekitar elektroda itu.
b. Cara pemanasan
Suatu koloid jika dipanaskan akan terkoagulasi karena energi partikel menjadi
lebih besar, dan tabrakan sesamanya dapat membentuk ikatan dan akhirnya
menggumpal.
c. Penambahan elektrolit
Koloid yang dapat menyerap ion akan terkoagulasi bila ditambah larutan
elektrolit, karena menjadi tidak stabil, contohnya koloid Fe(OH)3 bila ditambah
ion negatif seperti PO4 3- . Koloid Fe(OH)3 distabilkan oleh ion Fe3+ dengan cara
teradsorpsi di permukaannya. Bila ditambah PO4 3- , mengakibatkan Fe3+ di
permukaan itu lepas karena membentuk FePO4. Akibatnya koloid menjadi tidak
stabil dan terkoagulasi.
d. Mencampur dua macam koloid
Bila dua macam koloid yang berlawanan muatannya dicampur akan menimbulkan
koagulasi karena ada daya tarik listrik antara keduanya. Contohnya koloid
Jenis-jenis koagulan yang sudah umum dan sudah dikenal yang digunakan
pada pengolahan air adalah sebagai berikut:
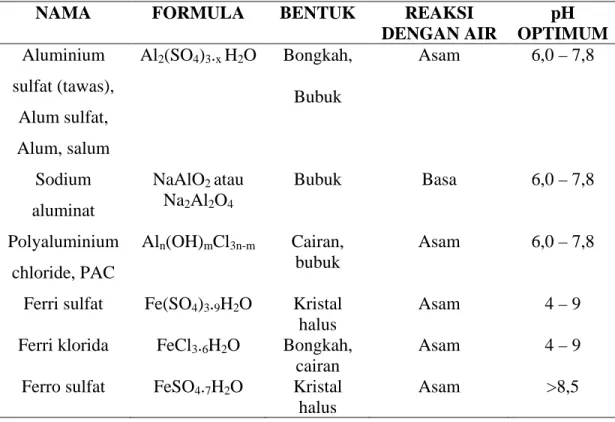
Tabel 2.2. Jenis Koagulan
NAMA FORMULA BENTUK REAKSI
DENGAN AIR pH OPTIMUM Aluminium sulfat (tawas), Alum sulfat, Alum, salum
Al2(SO4)3.x H2O Bongkah,
Bubuk Asam 6,0 – 7,8 Sodium aluminat NaAlO2 atau Na2Al2O4 Bubuk Basa 6,0 – 7,8 Polyaluminium chloride, PAC Aln(OH)mCl3n-m Cairan, bubuk Asam 6,0 – 7,8
Ferri sulfat Fe(SO4)3.9H2O Kristal halus
Asam 4 – 9
Ferri klorida FeCl3.6H2O Bongkah, cairan
Asam 4 – 9
Ferro sulfat FeSO4.7H2O Kristal halus
Asam >8,5
Sumber: Parajaja 2008
2.9.2. Flokulasi
Proses flokulasi dalam pengolahan air bertujuan untuk mempercepat proses
penggabungan flok-flok yang telah dibibitkan pada proses koagulasi. Partikel-partikel
yang telah distabilkan selanjutnya saling bertumbukan serta melakukan proses
tarik-menarik dan membentuk flok yang ukurannya makin lama makin besar serta mudah
mengendap. Pengadukan lambat (agitasi) pada proses flokulasi dapat dilakukan
dengan metoda yang sama dengan pengadukan cepat pada proses koagulasi
2.10. Biji Kelor
Kelor (Moringa oleifera) merupakan salah satu tanaman perdu yang banyak
ditemui di Indonesia. Menurut sejarahnya, tanaman kelor (Moringa oleifera), berasal
dari kawasan sekitar Himalaya dan India, kemudian menyebar ke kawasan di
sekitarnya sampai ke Benua Afrika dan Asia-Barat. Tanaman ini berbunga sepanjang
tahun berwarna putih, buah bersisi segitiga dengan panjang sekitar 30 cm, tumbuh
subur mulai dari dataran rendah sampai ketinggian 700 m di atas permukaan laut. Di
Indonesia, masyarakat lebih memanfaatkan tanaman ini sebagai pembatas lahan
ataupun pagar rumah. Tentang manfaat daun, biji, bunga, akar, kulit batang dan getah
masih kurang diketahui oleh masyarakat. Hanya sebagian saja yang telah
memanfaatkan tanaman kelor ini seperti daun, bunga dan buah sebagai bahan
makanan. Namun ada pula masyarakat yang memanfaatkan tanaman ini dalam
hubungannya dengan kebudayaan mereka.
Sejak awal tahun 1980-an oleh Jurusan Teknik Lingkungan ITB, biji kelor
digunakan untuk penjernihan air permukaan (air kolam, air sungai, air danau sampai
ke air sungai) sebagai pengendap (koagulans) dengan hasil yang memuaskan. Oleh
karena rangkaian penelitian terhadap manfaat tanaman kelor mulai dari daun, kulit
batang, buah sampai bijinya, sejak awal tahun 1980-an telah dimulai. Untuk biji
kelor, kini telah popular digunakan sebagai koagulan untuk mengolah air (Pasaribu,
2011).
2.10.1. Biji Kelor sebagai Koagulan
Penggunaan biji kelor sebagai koagulan untuk mengolah air telah banyak
oleh Francis K. A dan Amos B. Penelitian yang dilakukan yaitu mengetahui
efektivitas biji Moringa oleifera sebagai koagulan untuk pemurnian air dan hasilnya
adalah biji Moringa oleifera mampu memurnikan air tersebut pada dosis 10 g/l. Pada
konsentrasi tersebut sifat koagulan dari biji Moringa oleifera sangat tepat dalam
memurnikan air (Amagloh F. K dan Amos B, 2009).
Biji kelor dapat dimanfaatkan sebagai koagulan disebabkan biji kelor ini
mengandung zat aktif berupa 4α-4r-rhamnosyloxy-benzyl-isothiocyanate yang berfungsi sebagai protein kationik yang mampu mengadsorpsi dan menetralisir
partikel-partikel lumpur serta air logam dalam air limbah atau air keruh. Zat aktif ini
dapat membantu menurunkan gaya tolak-menolak antara partikel koloid dalam air,
sehingga dapat digunakan sebagai bahan koagulan dalam proses pengolahan air. Biji
kelor sebagai koagulan dapat digunakan dengan dua cara yaitu: biji kering dengan
kulitnya dan biji kering tanpa kulitnya. Dapat dimanfaatkan dalam bentuk serbuk
ataupun pasta (Ndabigengesere et al dalam Rambe, 2009).
Untuk mendapatkan biji kelor yang dapat dimanfaatkan sebagai koagulan
salah satunya dalam bentuk pasta dengan cara sebagai berikut:
1. Langkah pertama adalah memilih biji kelor yang telah matang (berwarna
kecoklatan)
2. Selanjutnya biji yang telah dipilih dihaluskan hingga berbentuk serbuk
3. Serbuk yang dihasilkan tersebut dicampur dengan air hingga berbentuk pasta
Jika dalam penggunaannya nanti, pasta ini dapat diencerkan terlebih dahulu
untuk mendapatkan biji kelor 1% berarti dibutuhkan 1 gram serbuk biji kelor dengan
perbandingan aquadest sebesar 100 ml (1 gram serbuk biji kelor: 100 ml aquadest).
2.11. Kerangka Konsep
Penambahan koagulan Biji kelor per 500 ml air sumur gali dengan konsentrasi : - 20 mg - 40 mg - 60 mg - 80 mg Kadar Besi (Fe) dan Mangan (Mn) dalam Air Sumur Gali
Kadar Besi (Fe) dan Mangan (Mn) setelah perlakuan Sesuai Baku Mutu (Permenkes RI No. 416 tahun 1990) Tidak Sesuai Baku Mutu (Permenkes RI No. 416 tahun 1990) - Cara pengadukan - Waktu pengadukan - Waktu pengendapan
2.12. Hipotesis Penelitian Hipotesis sementara :
Ho1 : Ada perbedaan kadar besi (Fe) pada air sumur gali sebelum dan sesudah
penambahan berbagai kadar koagulan biji kelor.
Ho2 : Ada perbedaan kadar mangan (Mn) pada air sumur gali sebelum dan sesudah
penambahan berbagai kadar koagulan biji kelor.
Ha1 : Tidak ada perbedaan kadar besi (Fe) pada air sumur gali sebelum dan sesudah
penambahan berbagai kadar koagulan biji kelor.
Ha2 : Tidak ada perbedaan kadar mangan (Mn) pada air sumur gali sebelum dan