EFEK HEPATOPROTEKTIF KOMBINASI INFUSA DAUN TEH (Camellia sinensis (L.)O.K.) DAN SARI BUAH APEL (Pyrus malus L.)
TERHADAP MENCIT JANTAN TERINDUKSI PARASETAMOL
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Ilmu Farmasi
Oleh :
Fransisca Yeni Subagyo
NIM : 03 8114 133
FAKULTAS FARMASI UNIVERSITAS SANATA DHARMA
YOGYAKARTA 2008
Janganlah mencoba untuk menjadi orang sukses
tetapi jadilah orang yang bernilai.
(Albert Einstein)
Lakukan sekarang apa yang menjadi
keinginanmu esok hari
(Robert Kiyosaki)
Kupersembahkan buat :
Bapak, Mba Santi, Ardi dan
keluarga besar serta semua orang
yang ada dalam hidupku.
Terima kasih telah
membuat
hidupku begitu bermakna.
God Bless You All
PRAKATA
Puji syukur kepada Tuhan Yang Maha Esa atas berkat rahmat dan
anugerahNya, sehingga penulis bisa menyelesaikan skripsi yang berjudul “Efek
Hepatoprotektif Kombinasi Infusa Daun Teh (Camellia Sinensis (L.)O.K.) dan
Sari Buah Apel (Pyrus Malus L.) terhadap Mencit Jantan Terinduksi
Parasetamol”. Keberhasilan skripsi ini tidak lepas dari dukungan berbagai pihak
yang sangat membantu penulis dalam menyusun skripsi. Oleh karena itu penulis
ingin mengucapkan terima kasih kepada :
1. Rita Suhadi, M.Si, Apt. selaku Dekan Fakultas Farmasi Universitas Sanata
Dharma.
2. Christine Patramurti, M.Si., Apt. selaku Kepala Jurusan Fakultas Farmasi
Universitas Sanata Dharma atas segala arahan dan dukungannya selama ini.
3. Drs. Mulyono, Apt. selaku dosen pembimbing yang telah banyak meluangkan
waktu, tenaga, dan atas segala masukan serta sarannya dalam penyusunan
skripsi ini.
4. Yosef Wijoyo, M.Si., Apt. selaku dosen penguji atas segala arahan, kritik,
saran, dan waktunya.
5. dr. Luciana Kuswibawati, M. Kes., selaku dosen penguji atas segala arahan,
kritik, saran, dan waktunya.
6. Ign. Y. Kristio Budiasmoro, M.Si., selaku dosen pembimbing akademik atas
segala arahan, dukungan, saran, dan kritiknya.
7. Mas Heru, Mas Parjiman, Mas Kayat, Mas Andri, dan segenap laboran
Fakultas Farmasi USD yang telah membantu jalannya penelitian hingga dapat
terselesaikan dengan baik.
8. Lidia Dwi Susanti, kakakku, atas doa, perhatian, kesabaran, dukungan, dan
pengertiannya selama penulis menjalani kehidupan kuliah dan melakukan
penelitian ini.
9. Ardi Susatya, terima kasih atas sayang, perhatian, kesabaran, doa, waktu,
tenaga, dukungan, dan kebersamaan selama kuliah dan penelitian.
10.Bapak, Mama, Mba Piah, Mba Tuti, saudara-saudaraku : Aristho, Aya, Ole,
Alvin, dan Alda di Kutoarjo terima kasih atas doa, perhatian, semangat, dan
dukungan selama ini.
11.Ratna dan Ken, Feli dan Danang, Eka dan Yoyon, Wenny dan Mas Tio, Otic,
Ayu, dan Mba Maria terima kasih atas perhatian, bantuan, dukungan,
kebersamaan, dan persahabatan yang indah selama ini.
12.Teman-teman seperjuangan selama penelitian di laboratorium : Nia, Agnes,
Indu, Punto, Fani, Essy, Olive, Evelyn, dan Mas Supri terima kasih atas saran,
kritik, dukungan, semangat, dan bantuan selama ini.
13.Fitri, Tyas, Nunuk, Ankga, Rini, dan Anny atas dukungan, persahabatan dan
kebersamaannya selama ini.
14.Erga, Erma, Ari, Surya, Ranti, Diah, Willy, Shindi, Yudha, Aan, dan semua
mahasiswa Farmasi Angkatan 2003 terima kasih atas dukungan, kebersamaan,
bantuan, dan perhatian, serta kenangan indahnya.
15.Tante Yani, Om Lauren, dan Edo di Malang tarima kasih atas bantuan dan
dukungan selama penulis berada di Malang.
16.Bu Ning, Pak Sunu, dan temen-temen P3W di Perpustakaan Paingan : Eko,
Tami, Diaz, Melan, Melati, Ari, dan semuanya terima kasih atas perhatian,
dukungan, dan kerjasamanya selama ini.
17.Mas Bona, Mas Onong, Mas Tian, Yudhi, Ledu, Ratna, Mas Aan, Laora,
Lucky, dan semua teman-teman di Victory Studio Disc terima kasih atas
kerjasama, kebersamaan, pengalaman hidup, dan hiburannya selama ini.
18.Teman-teman kos lama : Mba Tista, Mba Vivie dan Mas Indra, Chika, Mba
Ema, Acid, Mba Inke, Juleha, Aniez, Novi, Mba Ling, Mba Nia, dan Mba
Ning atas kebersamaan dan dukungannya selama ini.
19.Semua pihak yang telah banyak membantu penyusunan skripsi ini.
Atas segala bantuan dan dukungan yang telah diberikan selama ini, penulis
menyampaikan rasa terima kasih dan hormat, serta mohon kritik dan saran yang
membangun demi kemajuan penulis.
Penulis
INTISARI
Teh hijau banyak diminati masyarakat saat ini. Tanaman ini diketahui mengandung polifenol sebagai antioksidan yang sangat bermanfaat bagi kesehatan. Minuman teh hijau terdiri dari berbagai rasa misalnya rasa buah apel. Apel mengandung polifenol yaitu flavonoid. Baik teh hijau dan buah apel memiliki sifat antioksidan karena kandungan polifenolnya sehingga kombinasi keduanya dapat dihubungkan dengan efek perlindungannya terhadap hati. Penelitian ini menggunakan infusa daun teh hijau yang dikombinasi dengan sari buah apel dan dipejankan pada mencit jantan terinduksi parasetamol. Tujuan dilakukan penelitian ini adalah untuk mengetahui perbandingan kombinasi infusa daun teh hijau dan sari buah apel yang paling efektif dalam memberikan efek hepatoprotektif.
Penelitian ini merupakan penelitian ekperimental murni dengan rancangan acak lengkap pola satu arah dengan subjek uji mencit jantan galur Swiss. Sebanyak 50 ekor subjek uji dibagi secara acak ke dalam 10 kelompok, yaitu : kelompok 1 sebagai kontrol positif, kelompok 2 sebagai kontrol negatif, kelompok 3 dipejani suspensi PVP, kelompok 4 sebagai kontrol infusa daun teh hijau, kelompok 5 sebagai kontrol sari buah apel, dan kelompok 6 – 10 diberi kombinasi infusa daun teh hijau dan sari buah apel satu kali sehari selama 6 hari dengan perbandingan volume 4:1; 3:1; 2:1; 1:1; dan 0,5:1 dan pada hari ke-7 dipejani parasetamol dosis 0,2438 g/kg BB. Setelah 24 jam subjek uji diambil darahnya untuk diperiksa aktivitas ALT/GPT serumnya, hatinya ditimbang, dan dibuat preparat untuk diamati histopatologinya.
Data aktivitas ALT serum, berat hati, dan kerusakan hati dianalisis dengan uji Kolmogorov – Smirnov, Levene Test, dan dilanjutkan dengan uji Kruskal – Wallis dan uji Mann – Whitney dengan taraf kepercayaan 95 %. Hasil penelitian menunjukkan kombinasi infusa daun teh hijau dan sari buah apel dengan perbandingan 2:1 paling efektif dengan persen efek hepatoprotektif 85,32 % dan berat hati relatif 1,2381 ± 0,0378 g.
Kata kunci : efek hepatoprotektif, teh hijau, apel
ABSTRACT
Green tea is well known today. Green tea known contain of polyphenolics compound as antioxidant, its very useful. Green tea’s beverage has various flavors such as apple’s essence. Apple fruit contains polyphenolic compound is flavonoid. It is act as antioxidant too. So these combination can be related with hepatoprotective effect. This research used green tea’s infuse combined with apple’s essence on male mice induced by acetaminophen. The aim of the research is to know which one of the compare of the combination of green tea’s infuse and apple’s essence has the most effective hepatoprotective effect.
This research was a pure experimental study following the one way complete random design with Swiss’s mice as animal subject. A number of fifty male mice were divided into ten groups, each consisted of five : first group as positive control was given acetaminophen doses 0,2438 g/kg BW, second group as negative control was given aqua, third group was given PVP, fourth group was given green tea’s infuse, fifth group was given apple’s essence, and sixth to ten group represent the treatment group, successively given the combination on green tea’s infuse and apple’s essence with the comparison 4:1; 3:1; 2:1; 1:1; and 0,5:1 orally once a day during six days, on seventh, given acetaminophen doses 0,2438 g/kg BW. After 24 hours, blood of each mice in all group was sampled at the eyes sinus orbital and determined its ALT/GPT serum activity level, their liver were measured and made to histopathology then given the score of pursuant to its damage degree.
ALT/GPT serum activity level, liver weight, and histopathology data was analyzed with Kolmogorov – Smirnov test and Levene Test, then continued with Kruskal – Wallis and Mann – Whitney test with confidence level 95 %. Result of the research showed that combination of green tea’s infuse and apple’s essence in comparison 2:1 is the most effective with hepatoprotective effect’s percentages equal to 85,32 % and the relative weight of liver equal to 1,2381 ± 0,0378 g.
Keywords : hepatoprotective effect, green tea, apple
DAFTAR ISI
Halaman
HALAMAN JUDUL ... i
HALAMAN PERSETUJUAN PEMBIMBING ... ii
HALAMAN PENGESAHAN ... iii
HALAMAN PERSEMBAHAN ... iv
PERNYATAAN KEASLIAN KARYA... v
PRAKATA ... vi
INTISARI ... ix
ABSTRACT... x
DAFTAR ISI ... xi
DAFTAR TABEL ... xv
DAFTAR GAMBAR... xvi
DAFTAR LAMPIRAN... xviii BAB I. PENDAHULUAN ...
A. Latar Belakang ...
B. Permasalahan... C. Keaslian Penelitian... D. Manfaat Penelitian...
1. Manfaat Teoritis...
2. Manfaat Praktis... E. Tujuan Penelitian...
1. Tujuan umum……….…….… BAB II. PENELAAHAN PUSTAKA ...
A. Anatomi dan Fisiologi Hati...
B. Patofisiologi Hati ... ... C. Tes Fungsi Hati ...
D. Agen Antihepatotoksin ………..
E. Parasetamol ………
F. Tanaman Teh ………
1. Klasifikasi………..…….
2. Morfologi……….………..
3. Teh hijau ...……….……….
4. Kandungan kimia…..………...
5. Khasiat dan kegunaan ...
G. Tanaman Apel...………...………
1. Klasifikasi………...………..
2. Morfologi…………... 3. Kandungan kimia. …... 4. Manfaat dan kegunaan... H. Flavonoid...
I. Tanin ………...
J. Landasan Teori ……….……...
K. Hipotesis ………….………...
BAB III. METODOLOGI PENELITIAN
A. Jenis dan Rancangan Penelitian……….….……….
B. Definisi Operasional………..
C. Variabel Penelitian………...……
1. Variabel bebas………...…
2. Variabel tergantung………....…
3. Variabel pengacau terkendali………..….…
4. Variabel pengacau tak terkendali………...… D. Subjek dan Bahan Penelitian………...
E. Alat Penelitian ………...
F. Tata Cara Penelitian………...
1. Determinasi tanaman………...…
2. Pembuatan infusa daun teh hijau……... 3. Pembuatan sari buah apel………...…. 4. Pembuatan kombinasi infusa daun teh hijau dan sari buah
5. Pembuatan suspensi PVP ... 6. Pembuatan suspensi parasetamol 1% dalam PVP...…... 7. Pembuatan serum ...
8. Penetapan aktivitas ALT/GPT serum ... 9. Pembuatan preparat histopatologi hati ... 10.Pemeriksaan histopatologi hati ... 11.Uji pendahuluan ...
7.1 Penentuan dosis hepatotoksik parasetamol ... 7.2 Penetapan waktu kehepatotoksikan parasetamol 7.3 Penetapan masa praperlakuan kombinasi infusa daun
teh hijau dan sari buah apel ... 12.Pengelompokkan dan perlakuan hewan uji …………..…….
G. Analisis Data………...………. BAB IV. HASIL DAN PEMBAHASAN...
A. Determinasi Tanaman... 1. Determinasi tanaman teh (Camellia sinensis (L.)O.K.) .... 2. Determinasi tanaman apel (Pyrus malus L.) …...…… B. Uji Pendahuluan ………...…
1. Penentuan dosis hepatotoksik parasetamol………...……. 2. Penentuan waktu kehepatotoksikan parasetamol …...… 3. Penetapan masa praperlakuan kombinasi infusa daun teh
hijau dan sari buah apel ... C. Perlakuan ………... ...
1. Kontrol negatif air suling ……. ... 2. Kontrol positif parasetamol dosis 0,2438 g/kg BB... 3. Kontrol PVP ………... 4. Kontrol infusa daun teh hijau ………... 5. Kontrol sari buah apel …... 6. Efek hepatoprotektif kombinasi infusa daun teh hijau dan
A. Kesimpulan... B. Saran...
69 69 DAFTAR PUSTAKA ...
LAMPIRAN ...
70 74 BIOGRAFI PENULIS ... 122
DAFTAR TABEL
Halaman
Tabel I. Kandungan kimia pada teh hijau, teh hitam, dan teh
oolong dalam keadaan kering (mg/100 g) ... 21 Tabel II. Aktivitas ALT serum dan histopatologi sel hati mencit
setelah pemberian parasetamol dosis 0,2250; 0,2313;
0,2375; 0,2438; 0,2500 g/kg BB dan kontrol (n=5) ... 44 Tabel III Berat hati mencit setelah pemberian parasetamol dosis
0,2250; 0,2313; 0,2375; 0,2438; 0,2500 g/kg BB dan
kontrol (n=5)... 46 Tabel IV. Aktivitas ALT serum setelah pemberian parasetamol dosis
0,2438 g/kg BB pada selang waktu 24 dan 48 jam (n=5)... 48 Tabel V. Aktivitas ALT serum dan histopatologi hati mencit
kelompok masa praperlakuan 2, 4, 6, 8, dan 10 hari yang
dipejani parasetamol dosis 0,2438 g/kg BB (n=5)... 50 Tabel VI. Berat hati mencit kelompok masa praperlakuan 2, 4, 6, 8,
dan 10 hari yang dipejani parasetamol dosis 0,2438 g/kg
BB (n=5)... 51 Tabel VII. Rata-rata aktivitas ALT serum, tingkat kerusakan hati, dan
persen efek hepatoprotektif kelompok perlakuan (n=5)... 52 Tabel VIII. Rata-rata berat hati mencit relatif kelompok perlakuan
(n=5)... 54 Tabel IX. Persen perbedaan rata-rata aktivitas ALT serum kelompok
6, 7, 8, 9, dan 10 dibandingkan kelompok 5 ... 63 Tabel X. Hasil percobaan penentuan dosis hepatotoksik parasetamol 80 Tabel XI. Hasil percobaan penentuan waktu hepatotoksik
parasetamol ……… 85
Tabel XII. Hasil percobaan penentuan masa perlakuan kombinasi
infusa daun teh hijau dan sari buah apel ... 87 Tabel XIII. Hasil percobaan kelompok perlakuan ……… 92
DAFTAR GAMBAR
Halaman
Gambar 1. Struktur mikroskopik lobulus hati ... 8
Gambar 2. Tipe nekrosis ... 10
Gambar 3. Struktur parasetamol ... 16
Gambar 4. Jalur metabolisme parasetamol ... 18
Gambar 5. Struktur umum flavonoid ... 25
Gambar 6. Struktur senyawa katekin, epikatekin, flavon, dan flavonol 26 Gambar 7. Struktur senyawa teaflavin pada teh ... 27
Gambar 8. Struktur tanin terkondensasi ... 28
Gambar 9. Diagram batang aktivitas ALT serum setelah pemberian parasetamol dosis 0,2250; 0,2313; 0,2375; 0,2438; 0,2500 g/kg BB dan kontrol (n=5) ... 45 Gambar 10. Diagram batang aktivitas ALT serum kelompok masa praperlakuan 2, 4, 6, 8, dan 10 hari yang dipejani parasetamol dosis 0,2438 g/kg BB (n=5)... 51 Gambar 11. Fotomikroskopi hati mencit setelah pemberian air suling (perbesaran 40 x 10) ... 53
Gambar 12. Fotomikroskopi hati mencit setelah pemberian parasetamol dosis 0,2438 g/kg BB (perbesaran 40 x 10) ... 55
Gambar 13. Fotomikroskopi hati mencit setelah pemberian PVP (perbesaran 40 x 10) ... 56
Gambar 14. Fotomikroskopi hati mencit setelah pemberian infusa daun teh hijau (perbesaran 40 x 10) ... 57
Gambar 15. Fotomikroskopi hati mencit setelah pemberian sari buah apel (perbesaran 40 x 10) ... 58
Gambar 16. Fotomikroskopi hati mencit setelah pemberian kombinasi infusa daun teh hijau dan sari buah apel perbandingan 4 : 1 (perbesaran 40 x 10) ... 61 Gambar 17. Fotomikroskopi hati mencit setelah pemberian kombinasi
infusa daun teh hijau dan sari buah apel perbandingan 3 : 1
(perbesaran 20 x 10) ... 62 Gambar 18. Fotomikroskopi hati mencit setelah pemberian kombinasi
infusa daun teh hijau dan sari buah apel perbandingan 2 : 1
(perbesaran 40 x 10) ... 63 Gambar 19. Fotomikroskopi hati mencit setelah pemberian kombinasi
infusa daun teh hijau dan sari buah apel perbandingan 1 : 1
(perbesaran 20 x 10) ... 64 Gambar 20. Fotomikroskopi hati mencit setelah pemberian kombinasi
infusa daun teh hijau dan sari buah apel perbandingan 0,5:1
(perbesaran 20 x 10) ... 65
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Surat pengesahan determinasi tanaman teh (Camellia
sinensis (L.)O.K.) ... 74 Lampiran 2. Foto tanaman teh (Camellia sinensis (L.)O.K.)... 75 Lampiran 3. Foto daun teh hijau kering dan infusa daun teh hijau ... 76 Lampiran 4. Surat pengesahan determinasi tanaman apel (Pyrus
malus L.) ... 77 Lampiran 5. Foto tanaman apel ... 78 Lampiran 6. Foto buah apel dan sari buah apel ... 79 Lampiran 7. Hasil percobaan penentuan dosis hepatotoksik
parasetamol ... 80 Lampiran 8. Analisis statistik aktivitas ALT serum : penentuan dosis
hepatotoksik parasetamol ... 81 Lampiran 9. Analisis statistik berat hati mencit : penentuan dosis
hepatotoksik parasetamol ... 83 Lampiran 10. Hasil percobaan penentuan waktu hepatotoksik
parasetamol ... 85 Lampiran 11. Analisis statistik aktivitas ALT serum : penentuan waktu
hepatotoksik parasetamol ... 86 Lampiran 12. Hasil percobaan penentuan masa praperlakuan
kombinasi infusa daun teh hijau dan sari buah apel ... 87 Lampiran 13. Analisis statistik aktivitas ALT serum : penentuan masa
praperlakuan kombinasi infusa daun teh hijau dan sari
buah apel ... 88 Lampiran 14. Analisis statistik berat hati mencit : penentuan masa
praperlakuan kombinasi infusa daun teh hijau dan sari
buah apel ... 90 Lampiran 15. Hasil percobaan kelompok perlakuan ... 92 Lampiran 16. Analisis statistik aktivitas ALT serum kelompok
xix
perlakuan ... 93 Lampiran 17. Rangkuman uji Mann-Whitney aktivitas ALT serum
kelompok perlakuan ... 113 Lampiran 18. Analisis statistik berat hati mencit kelompok perlakuan 114 Lampiran 19. Skoring histopatologi hati mencit kelompok perlakuan 119 Lampiran 20. Perhitungan angka perlindungan hasil skoring
histopatologi hati mencit kelompok perlakuan ... 120 Lampiran 21. Rangkuman uji Mann-Whitney skoring histopatologi
BAB I PENDAHULUAN
A. Latar Belakang
Teh merupakan salah satu jenis tanaman yang memiliki banyak manfaat
bagi manusia. Manfaat teh di antaranya dapat mencegah kanker, meningkatkan
sistem imun, mengurangi obesitas, antiaterosklerosis (Anonim, 2003a),
antibakteri, antioksidan, antikaries, peluruh air seni, mencegah osteoporosis, dan
menjaga kesehatan jantung. Teh dibedakan menjadi 3 (tiga) jenis berdasarkan
proses pengolahannya yaitu teh tanpa fermentasi (teh hijau), teh semifermentasi
(teh oolong), dan teh fermentasi (teh hitam) (Syah, 2006).
Teh hijau merupakan jenis teh yang sangat diminati oleh masyarakat di
Indonesia saat ini. Banyak produk yang mengandung teh hijau beredar di pasaran,
salah satu produk yang paling banyak dikonsumsi yaitu produk minuman, baik
dalam bentuk siap seduh maupun kemasan. Teh hijau mengandung senyawa
polifenol yang bersifat sebagai antioksidan. Aktivitas antioksidan senyawa
polifenol pada teh hijau sangat kuat mencapai 25 – 100 kali aktivitas antioksidan
vitamin C dan E (Anonim, 2003a).
Produk minuman kemasan teh hijau memiliki aneka rasa misalnya rasa
buah apel. Buah apel diketahui juga mengandung senyawa polifenol (Dalimartha,
2000). Penelitian ini menggunakan infusa daun teh hijau yang dikombinasi
dengan sari buah apel. Baik teh hijau dan apel memiliki sifat antioksidan karena
kandungan polifenolnya sehingga kombinasi keduanya dapat dihubungkan dengan
efek perlindungannya terhadap hati.
Senyawa polifenol yang banyak terkandung dalam teh hijau adalah katekin
dan tanin. Ada 4 (empat) jenis senyawa katekin pada teh hijau yaitu katekin,
epikatekin (EC), epigalokatekin (EGC), dan epigalokatekin galat (EGCG).
Epigalokatekin galat (EGCG) merupakan komponen yang paling kuat aktivitas
antioksidannya (Anonim, 2003a). Tanin merupakan polimer flavonoid, penyebab
rasa sepat pada teh. Tanin dibagi menjadi 2 (dua) jenis yaitu tanin yang dapat
dihidrolisis (hydrolyzable tannin) dan tanin terkondensasi (nonhydrolyzable atau
condensed tannin). Tanin dapat mengendapkan protein dan menyebabkan protein
tersebut resisten pada enzim proteolitik. Jika diaplikasikan pada jaringan hidup,
tanin bersifat astringen sehingga menjadi dasar terapi dengan tanin, misalnya pada
saluran gastrointestinal dan abrasi kulit (Tyler, Brady, dan Robbers, 1988). Jadi,
tanin selain bersifat antioksidan juga bersifat astringen.
Penyakit hati dapat disebabkan oleh obat, bahan kimia, alkohol, toksin,
atau infeksi virus (Crowley, 2001). Salah satu pengobatan penyakit hati dapat
dilakukan dengan meningkatkan perlindungan hati (Donatus, 1992). Penelitian
yang pernah dilakukan untuk mengetahui efek hepatoprotektif teh dan apel antara
lain : penelitian Yuningsih (2003), pemberian infusa teh dosis 10 g/kg BB pada
tikus jantan terinduksi parasetamol memberikan efek hepatoprotektif sebesar
89,36 %, namun tidak dijelaskan jenis teh yang digunakan. Penelitian Setianto
(2004) menunjukkan persen efek hepatoprotektif sari buah apel dosis 33,33 ml/kg
BB sebesar 92,90 %, dosis sari apel hasil penelitian tersebut digunakan dalam
penelitian ini. Penelitian ini menggunakan parasetamol sebagai senyawa model
sebelumnya. Parasetamol merupakan obat antipiretika dan analgetika yang sering
digunakan dalam pengobatan.
Penelitian yang dilakukan ini berbeda dengan penelitian sebelumnya
karena menggunakan infusa daun teh hijau dan sari buah apel dengan berbagai
perbandingan. Tujuannya untuk mengetahui apakah kombinasi kedua bahan ini
memberikan efek hepatoprotektif, perbandingan yang paling efektif, dan
mengetahui pengaruh penambahan infusa daun teh hijau terhadap efek
hepatoprotektif sari buah apel pada mencit jantan terinduksi parasetamol.
B. Permasalahan
Berdasarkan latar belakang di atas, dapat dirumuskan permasalahan
sebagai berikut ini :
1. Apakah kombinasi infusa daun teh hijau dan sari buah apel memberikan
efek hepatoprotektif pada mencit jantan terinduksi parasetamol?
2. Berapa perbandingan kombinasi infusa daun teh hijau dan sari buah apel
yang memberikan efek hepatoprotektif paling efektif ?
3. Bagaimana efek pemberian infusa daun teh hijau terhadap efek
hepatoprotektif sari buah apel ?
C. Keaslian Penelitian
Hasil penelitian mengenai efek hepatoprotektif teh dan apel yang pernah
1. Infusa teh dosis 10 g/kg BB yang dipejankan pada tikus jantan terinduksi
parasetamol memberikan efek hepatoprotektif sebesar 89,96 %
(Yuningsih, 2003) namun tidak dijelaskan jenis teh yang digunakan.
2. Sari buah apel dosis 33,33 ml/kg BB memberikan efek hepatoprotektif
sebesar 92,90 % pada mencit jantan terinduksi parasetamol (Setianto,
2004).
3. Jus buah apel dosis 25,0 g/kg BB memberikan efek hepatoprotektif sebesar
83,31 % pada mencit jantan terinduksi parasetamol (Ladoangin, 2004).
4. Kombinasi jus wortel dan buah apel perbandingan 1:2 memberikan efek
hepatoprotektif 70,12 % pada mencit jantan terinduksi parasetamol
(Widyaningrum, 2004).
5. Kombinasi sari wortel dan buah apel perbandingan 1:3 memberikan efek
hepatoprotektif 93,49 % pada mencit jantan terinduksi parasetamol (Ayu,
2004).
6. Level serum antioksidan serum non enzimatik di hati berkurang pada
intoksikasi etanol karena teh hijau melindungi membran fosfolipid akibat
meningkatnya peroksidasi (Skrzydlewska, Ostrowska, Stankiewicz, dan
Farbiszewski, 2002).
7. Penggunaan infusa daun teh hijau menurunkan produk peroksidasi lipid
(Skrzydlewska, Ostrowska, dan Michalak, 2002).
Penelitian yang dilakukan penulis berbeda dengan penelitian sebelumnya.
Penelitian ini belum pernah dilakukan sebelumnya serta tidak memuat bagian
D. Manfaat Penelitian
1. Manfaat teoritis
Penelitian ini diharapkan dapat bermanfaat dalam pengembangan ilmu
kefarmasian dan pengetahuan mengenai teh hijau dan buah apel di Indonesia.
2. Manfaat praktis
Penelitian ini diharapkan dapat memberikan informasi akurat pada
masyarakat mengenai kegunaan teh hijau dan buah apel dan dijadikan acuan
terapi alternatif pada pencegahan penyakit hati.
E. Tujuan Penelitian
1. Tujuan Umum
1. Mengetahui efek hepatoprotektif kombinasi infusa daun teh hijau dan
sari buah apel pada mencit jantan terinduksi parasetamol.
2. Mengetahui perbandingan kombinasi infusa daun teh hijau dan sari
buah apel yang memberikan efek hepatoprotektif paling efektif.
3. Mengetahui pengaruh pemberian infusa daun teh hijau terhadap efek
hepatoprotektif sari buah apel.
2. Tujuan Khusus
Penulis memperoleh pengalaman dan pengetahuan dalam
BAB II
PENELAAHAN PUSTAKA
A. Anatomi dan Fisiologi Hati
Hati merupakan kelenjar terbesar dalam tubuh, rata-rata sekitar 1500 g
atau 2,5 % berat badan pada orang dewasa normal. Hati memiliki dua lobus
utama, kanan dan kiri. Permukaan hati diliputi oleh peritoneum viseralis kecuali
daerah kecil pada permukaan posterior yang melekat langsung pada diafragma. Di
bawah peritoneum terdapat jaringan penyambung padat yang disebut kapsula
Glisson yang menutupi seluruh organ, kapsula ini pada hilus atau porta hepatis
pada permukaan inferior, melanjutkan ke dalam massa hati dan membentuk
rangka untuk cabang-cabang vena porta, arteria hepatika, dan saluran empedu
(Price dan Wilson, 1995).
Hati memiliki dua lobus utama yaitu lobus kanan dan lobus kiri. Setiap
lobus hati terdiri dari struktur-struktur yang disebut lobulus yaitu unit mikroskopis
dan fungsional organ. Setiap lobulus merupakan badan heksagonal yang terdiri
atas lempeng-lempeng sel hati berbentuk kubus yang tersusun radial mengelilingi
vena sentralis. Di antara lempengan sel hati terdapat kapiler-kapiler yang disebut
sinusoid. Sinusoid merupakan cabang vena porta dan arteria hepatika, bedanya
dengan kapiler lain sinusoid dibatasi oleh sel fagositik atau sel Kupffer (Price dan
Wilson, 1995).
Selain cabang-cabang vena porta dan hepatika yang melingkari bagian
perifer lobulus hati terdapat pula saluran empedu. Saluran empedu interlobular
membentuk kapiler empedu yang sangat kecil yang dinamakan kanalikuli,
berjalan di tengah-tengah lempengan sel hati. Empedu yang dibentuk dalam sel
hati diekskresi ke dalam kanalikuli yang bersatu membentuk saluran empedu yang
makin lama makin besar yang disebut duktus koledokus (Price dan Wilson, 1995).
Hati memiliki dua sumber suplai darah yaitu dari saluran cerna dan limpa
melalui vena porta dan dari aorta melalui arteria hepatika. Sekitar sepertiga darah
yang masuk berasal dari arteria hepatika dan dua pertiganya berasal dari vena
porta. Volume total darah yang melewati hati setiap menit adalah 1500 ml dan
dialirkan melalui vena hepatika kanan dan kiri dan bermuara pada vena kava
inferior (Price dan Wilson, 1995).
Vena porta bersifat unik karena terletak di antara dua daerah kapiler, yaitu
hati dan saluran cerna. Vena porta di hati bercabang-cabang menempel melingkari
lobulus hati dan saling berhubungan dengan vena interlobularis yang berjalan di
antara lobulus-lobulus hati. Vena-vena ini membentuk sinusoid yang berjalan di
antara lempengan hepatosit dan bermuara dalam vena sentralis. Vena sentralis
dari beberapa lobulus bersatu membentuk vena sublobularis yang kemudian
bersatu membentuk vena hepatika (Price dan Wilson, 1995).
Hati sangat penting dalam mempertahankan hidup dan berperan pada
setiap fungsi metabolik tubuh. Hati memiliki kapasitas cadangan yang besar,
hanya dengan 10 – 20 % jaringan yang berfungsi hati mampu mempertahankan
kehidupan. Hati mempunyai kemampuan regenerasi yang mengagumkan.
Pengangkatan sebagian hati, baik karena sel sudah mati atau sakit, akan diganti
Gambar 1. Struktur mikroskopik lobulus hati (Vandenberghe, 1996)
Hati merupakan organ yang kompleks dengan fungsi metabolik,
detoksikasi, sekresi, dan ekskresi (Vandenberghe, 1996), misalnya : metabolisme
karbohidrat, protein, dan lemak yang dicerna melalui sirkulasi portal, sintesis
berbagai substansi termasuk protein plasma dan protein yang penting dalam
pembekuan darah, penyimpanan vitamin B12 dan mineral lain, serta detoksikasi
dan sekresi berbagai substansi (Crowley, 2001). Fungsi detoksikasi sangat penting
dilakukan oleh enzim-enzim hati melalui oksidasi, reduksi, hidrolisis, atau
konjugasi zat-zat yang berbahaya dan mengubahnya menjadi zat yang secara
fisiologis tidak berbahaya (Price dan Wilson, 1995).
Berdasarkan uraian di atas gangguan fungsi hati dapat mengakibatkan
B. Patofisiologi Hati
Penyakit hati dapat disebabkan oleh agen hepatotoksik atau hepatotoksin.
Hepatotoksin menurut Zimmerman (1978) dapat dibagi menjadi hepatotoksin
intrinsik atau sejati atau teramalkan dan hepatotoksik tak teramalkan atau
idiosinkratik. Hepatotoksin intrinsik adalah hepatotoksin yang pada dasarnya : 1)
memiliki sifat toksik pada hati sehingga dapat menyebabkan penyakit hati pada
setiap individu yang terpapar, 2) derajat kerusakan hati yang disebabkan
tergantung pada dosis, 3) kerusakan hati yang muncul pada manusia sama dengan
kerusakan hati jika dipaparkan pada hewan percobaan, dan 4) interval antara
waktu pemejanan dan kerusakan hati yang timbul cenderung pendek atau
konsisten.
Hepatotoksin idiosinkratik adalah hepatotoksin yang : 1) tidak
menyebabkan lesi pada hewan percobaan, 2) kerusakan hati pada manusia tidak
tergantung dosis, 3) interval antara pemejanan dosis pertama dan kerusakan hati
yang timbul lebih bervariasi dan biasanya lebih panjang daripada hepatotoksin
intrinsik. Hepatotoksin ini terutama 4) menyebabkan kerusakan hati pada individu
yang hipersensitif atau individu yang memiliki ketidaknormalan metabolik
(Zimmerman, 1978).
Hepatotoksin intrinsik dibedakan menjadi 2 (dua) macam berdasarkan
mekanismenya, yaitu hepatotoksin langsung dan tidak langsung. Hepatotoksin
langsung adalah zat atau produk metabolismenya yang secara langsung merusak
membran plasma dan retikulum endoplasma, diikuti dengan kerusakan lisosom
mengganggu metabolisme sel, contohnya : CCl4, CHCl3, dan asam tanat.
Hepatotoksin tak langsung bekerja dengan mengganggu jalur metabolisme khas
atau proses yang penting dalam menjaga integritas sel hati (sitotoksik), misalnya :
parasetamol, tetrasiklin dan etanol atau mengganggu proses sekresi empedu
(kolestatik), misalnya rifamisin (Zimmerman, 1978).
Kerusakan sitotoksik dapat dibedakan menjadi 2 (dua) jenis, yaitu nekrosis
dan steatosis. Nekrosis disebabkan oleh kerusakan membran sel atau organel yang
menyebabkan sel kehilangan integritasnya. Nekrosis dibedakan berdasarkan
lokasinya yaitu nekrosis fokal (menyebar pada sel parenkim hati), nekrosis zonal
(pada zona sentrilobular, midzonal, atau periportal), dan nekrosis masif (pada
semua lobulus hati). Lokasi nekrosis zonal bergantung pada tempat sistem enzim
yang mengaktifkan molekul menjadi metabolit toksik dan lokasi sistem enzim
pendetoksikasi (Zimmerman, 1978).
Steatosis disebabkan oleh akumulasi trigliserid atau fraksi lemak lain
dalam sel hati atau gangguan fungsi hati yang dapat meningkatkan kadar
trigliserid misalnya meningkatnya sintesis asam lemak, berkurangnya oksidasi
asam lemak, atau menurunnya produksi lipoprotein. Ada 2 (dua) tipe steatosis,
yaitu steatosis mikrovesikular, ditandai oleh penimbunan sedikit lemak pada sel
hati namun tidak sampai mendesak inti sel, dan steatosis makrovesikular, ditandai
oleh penimbunan lemak dalam jumlah besar pada sel hati, mengisi hampir seluruh
sel sehingga mendesak inti sel ke perifer (Zimmerman, 1978). Kerusakan
kolestatik berkaitan dengan sekresi empedu (Vandenberghe, 1996).
C. Tes Fungsi Hati
Tes fungsi hati dapat dilakukan dengan berbagai cara, yaitu : tes enzim
serum, tes sekresi empedu (bilirubin terkonjugasi dan tak terkonjugasi), tes
metabolisme protein (albumin dan globulin serum, masa protrombin, amonia
darah), tes metabolisme karbohidrat (amilase serum dan kemih), tes metabolisme
lemak (lipase dan kolesterol serum), dan tes imunologik (tes diagnosis untuk virus
hepatitis) (Price dan Wilson, 1995).
Pada hewan percobaan dapat dilakukan dengan membandingkan
parameter biokimia fungsional dan klinis dengan perubahan morfologi. Data
anatomi dan patologi termasuk berat badan dan pemeriksaan makroskopik dan
mikroskopik organ yang bersangkutan. Pada studi toksisitas, pemeriksaan
enzim mikrosomal, berat hati, dan volume hepatoselular akan meningkat
(Vandenberghe, 1996).
Tes enzim serum yang sering digunakan pada tes fungsi hati, yaitu AP
(alkali fosfatase), γ-GT (gamma-glutamil transferase), AST (GOT) (aspartat
amino transferase/glutamic oxaloasetic transaminase), ALT (GPT) (alanin amino
transferase/glutamic pyruvate transaminase) (Vandenberghe, 1996), LDH (laktat
dehidrogenase) (Price dan Wilson, 1995), NTD (nukleotidase), dan CHE
(kolinesterase) (Sherwin dan Sobenes, 1996 cit.,Widijanti, 2004).
Tes diagnostik yang biasa dilakukan untuk mengetahui gangguan fungsi
hati yaitu uji enzim AST (GOT) dan ALT (GPT) serum. Kedua enzim ini
merupakan enzim-enzim intraselular yang berada di jantung, hati, jaringan otot,
dan terlepas dari jaringan yang rusak (Price dan Wilson, 1995).
Aspartat aminotranferase/glutamat oksaloasetat transaminase (AST/GOT)
merupakan enzim pada mitokondria dan sitosol yang lebih banyak terdapat di
jantung dibanding hati, otot, otak, dan ginjal. Aspartat aminotranferase akan
meningkat jika terjadi nekrosis hepatoselular dan infark miokardial. Alanin
aminotransferase merupakan enzim sitosolik yang lebih spesifik untuk organ hati
pada peradangan akut dibandingkan AST (GOT). Peningkatan level transaminase
akibat nekrosis hepatoselular akan menyebabkan lepasnya enzim ke aliran darah
akibat perubahan permeabilitas membran. Nekrosis hepatoselular dapat
disebabkan oleh hepatotoksin, penyakit (infeksi dan diabetes melitus), tumor hati,
Wilkinson (1976) menguraikan bahwa AST (GOT) mengkatalisis reaksi
sebagai berikut :
AST
sedangkan ALT/GPT mengkatalisis reaksi :
ALT
Pada penelitian ini digunakan tes enzim serum ALT/GPT dengan metode
spektrometri, prinsip reaksinya adalah :
ALT
Aktivitas ALT/GPT ditentukan dari laju oksidasi NADH menjadi NAD+
(Bergmeyer dan Bernt, 1974). Penelitian ini menggunakan pereaksi siap pakai,
ALAT (GPT) FS* Kit (DiaSys, Germany) dengan 2 (dua) reagen, yaitu R1 =
Nilai normal ALT (GPT) serum adalah 1 – 35 U/L dan AST (GOT) serum
5 – 40 U/L (Friedman, 2002). AST sangat sensitif untuk mendeteksi onset
hepatotoksisitas dan ketidaknormalan AST menunjukkan disfungsi hati.
Peningkatan AST terjadi 8 – 12 jam setelah pemejanan (Bizovi dan Smilkstein,
2002).
D. Agen Antihepatotoksin
Agen antihepatotoksin dapat memberikan perlindungan pada
hepatotoksisitas oleh berbagai sebab meliputi : (1) pencegahan aktivasi metabolik
dengan menghambat sistem enzim sitokrom P-450, (2) interaksi dengan ikatan
reseptor, (3) membantu mekanisme pertahanan sel dengan menyediakan
kosubstrat atau prekursornya, antioksidan, atau radical scavenger, dan (4)
stabilisasi membran selular dan subselular (Siegers, 1988).
Berbagai zat kimia dapat bersifat sebagai inhibitor reaksi oksidasi
mikrosomal, misalnya metirapon dan simetidin, dapat digunakan pada toksisitas
parasetamol. Glutation, kosubstrat pada reaksi GSH-peroksidase dan
GSH-S-transferase, menurun akibat toksisitas parasetamol dan bromobenzen,
mengindikasikan pentingnya GSH endogen pada detoksikasi intermediat reaktif.
Penelitian dengan pemberian intravena atau oral dosis tinggi GSH tereduksi pada
mencit mengurangi kematian dan kerusakan hati akibat parasetamol (Siegers,
1988).
Prekursor utama untuk sintesis GSH yaitu sistein. Pemberian sistein secara
oral tidak efektif untuk meningkatkan konsentrasi GSH karena cepat
dan sebagai substrat reaksi konjugasi langsung. Prekursor ini digunakan sebagai
antidot toksisitas parasetamol (Siegers, 1988).
Senyawa alam dan antioksidan sintetik mampu mempengaruhi proses
yang menyebabkan hepatotoksisitas, misalnya peroksidasi lipid. Antioksidan
lipofilik, α-tokoferol (vitamin E), dan hidrofilik, asam askorbat (vitamin C).
Antioksidan sintetik misalnya BHA dan BHT. Antioksidan dari tanaman yaitu
flavonoid, misalnya katekin dan silimarin yang dapat menekan respon
hepatotoksik parasetamol, CCl4, dan bromobenzen. Mekanisme hepatoproteksi
lain misalnya pengubahan ikatan reseptor dengan memodifikasi fluiditas membran
(flavonoid), penghambatan biosintesis protein, dan sitoproteksi oleh prostaglandin
(Siegers, 1988) atau memicu aktivitas enzim detoksikasi hati misalnya glutation
(Naim, 2003).
E. Parasetamol
Parasetamol merupakan derivat para amino fenol (Wilmana, 2002) yang
berbentuk serbuk hablur, putih, tidak berbau, berasa pahit (Anonim, 1995a), larut
dalam air panas dan alkohol. Parasetamol baik disimpan pada suhu 15 - 30ºC,
bekerja sebagai analgesik dan antipiretik, dengan menghambat sintesis dan
pelepasan prostaglandin, namun aktivitas antiinflamasinya lemah. Pada manusia
parasetamol diabsorpsi cepat dan sempurna melalui saluran cerna. Adanya
makanan dapat menunda absorpsinya. Konsentrasi tertinggi dalam plasma dicapai
25 % parasetamol dalam darah terikat pada protein plasma. (Anonim, 2005). Di
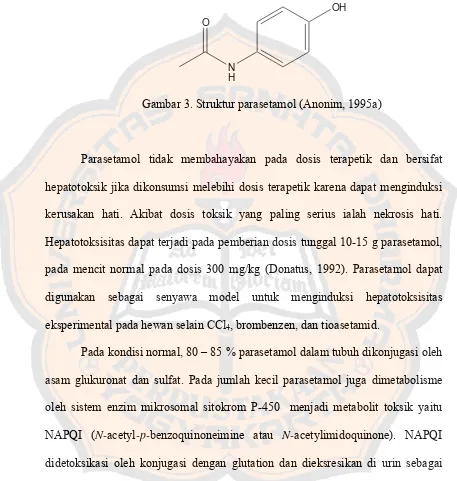
bawah adalah gambar struktur parasetamol :
O
N H
OH
Gambar 3. Struktur parasetamol (Anonim, 1995a)
Parasetamol tidak membahayakan pada dosis terapetik dan bersifat
hepatotoksik jika dikonsumsi melebihi dosis terapetik karena dapat menginduksi
kerusakan hati. Akibat dosis toksik yang paling serius ialah nekrosis hati.
Hepatotoksisitas dapat terjadi pada pemberian dosis tunggal 10-15 g parasetamol,
pada mencit normal pada dosis 300 mg/kg (Donatus, 1992). Parasetamol dapat
digunakan sebagai senyawa model untuk menginduksi hepatotoksisitas
eksperimental pada hewan selain CCl4, brombenzen, dan tioasetamid.
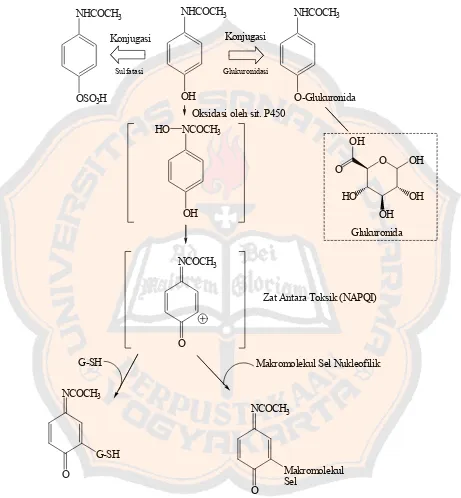
Pada kondisi normal, 80 – 85 % parasetamol dalam tubuh dikonjugasi oleh
asam glukuronat dan sulfat. Pada jumlah kecil parasetamol juga dimetabolisme
oleh sistem enzim mikrosomal sitokrom P-450 menjadi metabolit toksik yaitu
NAPQI (N-acetyl-p-benzoquinoneimine atau N-acetylimidoquinone). NAPQI
didetoksikasi oleh konjugasi dengan glutation dan dieksresikan di urin sebagai
asam merkapturat (Anonim, 2005).
Jika jumlah metabolit aktif yang terbentuk berlebihan sedangkan glutation
tidak mencukupi, misalnya pada kasus overdosis parasetamol, NAPQI akan
sentrilobular (Vandenberghe, 1996) atau sentrizonal (Zimmerman, 1978).
Metabolisme obat secara oksidatif terjadi pada zona III hepatik (sentrilobular) dan
pada zona inilah dijumpai kerusakan hati akibat toksisitas parasetamol (Bizovi
dan Smilkstein, 2002).
Oksidasi enzim akibat induksi NAPQI mengubah fungsi normal sel
melawan spesies oksigen reaktif endogen, menyebabkan oksidasi protein. Arilasi
protein sel merupakan penyebab toksisitas dengan adanya ikatan kovalen.
Dishomeostasis kalsium intraselular dan peroksidasi lipid juga menyebabkan
kematian sel (Bizovi dan Smilkstein, 2002).
Peningkatan level kalsium mengaktivasi fosfolipase A yang dapat merusak
membran fosfolipid menyebabkan membran kehilangan integritas yang
irreversibel (Siegers, 1988). Kematian sel juga dapat disebabkan karena
fragmentasi DNA dan kerusakan mitokondrial (Bizovi dan Smilkstein, 2002).
Nekrosis hati dapat diketahui dengan adanya peningkatan level enzim
serum, hiperbilirubinemia, dan level plasma faktor koagulasi yang tidak normal
(Zimmerman, 1978). Nilai ALT/GPT dan AST/GOT serum sangat tinggi dan
bervariasi mencapai 10000 U/L (Anonim, 2005).
Jalur metabolisme parasetamol dapat ditunjukkan pada gambar di bawah
NHCOCH3
G-SH Makromolekul Sel Nukleofilik
Zat Antara Toksik (NAPQI) Konjugasi
Konjugasi
Oksidasi oleh sit. P450
OH
F. Tanaman Teh Klasifikasi
Divisi : Spermatophyta
Sub divisi : Angiospermae
Kelas : Dicotyledonae
Bangsa : Guttiferales
Suku : Theaceae
Marga : Camellia
Jenis : Camellia sinensis (L.)O.K.
Morfologi
Pohon kecil karena sering dipangkas tampak seperti perdu. Bila tidak
dipangkas, akan tumbuh kecil ramping setinggi 5-10 m dan bentuk tajuk seperti
kerucut. Batang tegak, berkayu, bercabang-cabang, ujung ranting dan daun muda
berambut halus. Daun tunggal, bertangkai pendek, letak berseling, helai daun
kaku seperti kulit tipis, bentuk elips memanjang, ujung dan pangkal runcing, tepi
bergerigi halus, pertulangan menyirip, panjang 6-18 cm, lebar 2-6 cm, warna
hijau, permukaan mengkilap. Bunga di ketiak daun, tunggal atau beberapa bunga
bergabung menjadi satu, berkelamin dua, garis tengah 3-4 cm, warna putih cerah
dengan kepala sari berwarna kuning, harum. Buah kotak, berdinding tebal, pecah
menurut ruang, masih muda hijau, setelah tua coklat kehitaman. Biji keras, 1-3.
Pucuk dan daun muda yang digunakan untuk pembuatan teh. Perbanyakan dengan
Teh Hijau
Teh dikelompokkan menjadi 3 (tiga) jenis berdasarkan pengolahan pasca
panennya yaitu teh hijau, teh oolong, dan teh hitam. Baik teh hijau, teh hitam,
maupun teh oolong berasal dari tanaman yang sama. Pengolahan yang berbeda
menyebabkan kandungan kimia dan karakteristik teh yang dihasilkan pun
berbeda.
Teh hijau dibuat dengan menginaktivasi enzim polifenol oksidase yang
terdapat pada daun teh segar. Metode ini dapat dilakukan melalui pemanasan
maupun penguapan. Hal ini menyebabkan kandungan senyawa polifenol yang
terdapat pada teh hijau lebih tinggi dibandingkan teh hitam dan teh oolong
terutama kandungan katekinnya. Teh hijau mengandung 16-30 % senyawa katekin
namun hal ini masih dipengaruhi oleh cuaca, varietas, jenis tanah, dan tingkat
kematangan daun (Syah, 2006). Oleh karena itu, teh hijau memiliki sifat
antioksidan yang lebih baik daripada teh hitam maupun teh oolong.
Perbedaan pengolahan ini juga mempengaruhi kandungan kimia
masing-masing teh. Teh hijau, teh hitam, dan teh oolong mengandung senyawa polifenol
yang khas, dimana senyawa ini terdapat pada salah satu teh namun tidak dijumpai
pada kedua jenis teh yang lain (Anonim, 2003a).
Kandungan kimia
Dalimartha (2000) menguraikan daun teh mengandung kafein, teobromin,
teofilin, tanin, xantin, adenin, minyak atsiri, naringenin, kuersetin, dan fluoride.
polifenol 25 %, protein 20 %, karbohidrat 4 %, kafein 2,5 – 4,5 %, serat 27 %, dan
pektin 6 %.
Perbandingan kandungan kimia ketiga jenis teh menurut USDA Database
for the Flavonoid Content of Dried Teas (Anonim, 2003a) dapat dilihat pada tabel
di bawah ini :
Tabel I. Kandungan kimia pada teh hijau, teh hitam, dan teh oolong dalam keadaan kering (mg/100 g)
Kandungan Teh Hijau Teh Hitam Teh Oolong
(+)- Katekin sampai 100,00 35,00 – 480,00 5,00 – 70,00
(+)-Galokatekin - 56,00 – 278,00 -
(-)-Epikatekin 190,00 -2000,00 60,00 -1095,00 120,00 – 450,00
(-)-Epigalokatekin 100,00 – 5440,00 29,00 – 3817,50 180,00 – 1640,00
(-)-Epikatekin-3-Teaflavin-3’-galat sampai 0,99 15,00 – 413,00 -
Teaflavin-3-galat sampai 2,74 7,50 – 496,00 -
Tearubigin sampai 527,63 3914,32 – 10506,2 -
Apigenin sampai 0,50 - -
Luteolin sampai 0,50 - -
Kampferol 77,61 – 331,00 24,80 – 231,00 1,50
Mirisetin 52,00 – 159,00 21,00 – 74,35 0,32
Khasiat dan kegunaan
Teh hijau berkhasiat sebagai antioksidan, antikanker, antibakteri,
antiaterosklerosis, menjaga kesehatan jantung, meningkatkan kekebalan tubuh,
menurunkan kolesterol, mencegah osteoporosis dan karies pada gigi, melancarkan
keluarnya air seni, menurunkan berat badan (Syah, 2006), meningkatkan aktivitas
enzim antioksidan sehingga dapat melindungi hati (Naim, 2003).
Selain itu daun teh juga dapat mengatasi sakit kepala, diare, menyuburkan
dan menghitamkan rambut, dan mengatasi infeksi saluran cerna. Keracunan kafein
kronis terjadi bila minum 5 cangkir teh tiap hari yang setara dengan 600 mg
kafein, menunjukkan tanda dan gejala seperti gangguan pencernaan makanan
(dispepsia), rasa lemah, gelisah, tremor, sulit tidur, tidak nafsu makan, sakit
kepala, pusing (vertigo), bingung, berdebar, sesak napas, dan sukar BAB
(Dalimartha, 2000).
G. Tanaman Apel Klasifikasi
Divisi : Spermatophyta
Sub divisi : Angiospermae
Kelas : Dicotyledonae
Bangsa : Rosales
Suku : Rosaceae
Marga : Pyrus
Morfologi
Syamsuhidayat dan Hutapea (1991) menguraikan morfologi Pyrus malus
L. berupa tanaman perdu, tinggi 3-5 m, batang berkayu, bulat, bercabang, putih
kehijauan. Daun tunggal, bulat telur, ujung dan pangkal runcing, tepi bergerigi,
berbulu, berseling, di ujung cabang, panjang 3-15 cm, lebar 2-6 cm, pertulangan
menyirip, hijau. Bunga majemuk, bentuk malai, di ujung cabang, kelopak hijau,
berbulu, berbagi lima, benang sari banyak, putih, kepala sari kuning kecoklatan,
putik satu, putih kekuningan, putih. Buah buni, bulat, ujung dan pangkal berlekuk,
hijau keunguan. Biji kecil, pipih, coklat kehitaman. Akar tunggang, putih
kecoklatan.
Kandungan Kimia
Buah dan daun apel mengandung saponin dan flavonoid (Syamsuhidayat
dan Hutapea, 1991). Menurut USDA Database for the Flavonoid Content of
Selected Food (Anonim, 2003a) apel segar (bersama kulitnya) mengandung
katekin, EC, EGC, EGCG, GC, apigenin, luteolin, kaemferol, mirisetin, dan
kuersetin. Buah apel juga mengandung pektin, berbagai garam mineral yang
penting bagi tubuh, seperti : kalsium, fosfor, besi, yodium, natrium, kalium,
magnesium, khlor, belerang, kuprum, mangan dan zinc, serta berbagai jenis
vitamin misalnya : vitamin C, vitamin B1, dan vitamin A (Said, 2002).
Manfaat dan Kegunaan
Buah apel dapat dimanfaatkan untuk menurunkan tekanan darah pada
penderita tekanan darah tinggi. Caranya dengan mengukus ± 50 g buah apel segar
Untuk menjaga kesehatan pencernaan, fungsi hati, dan ginjal setiap hari makan 2
buah apel bersama kulitnya. Untuk menurunkan demam, buat jus dari 1 buah apel
dan diminum sebelum berubah warna (Said, 2002).
Buah apel juga digunakan untuk mengurangi mual, gangguan pencernaan saat
hamil dan diare (Anonim, 2003b). Kandungan flavonoid pada buah apel
berkhasiat sebagai antioksidan alami (Anonim, 2003a). Hartono (2002)
menguraikan bahwa kandungan pektin dalam apel dapat mengobati penyakit maag
atau lambung. Fungsi lain adalah memperlambat resorpsi dan menyerap lemak
serat gula setelah konsumsi karbohidrat atau lemak sehingga menurunkan
kolesterol dan gula darah. Buah apel juga berkhasiat sebagai obat tidur bagi
penderita insomnia dan melancarkan air kencing karena kandungan kalium dan
magnesium.
H. Flavonoid
Senyawa fenol adalah senyawa yang memiliki cincin aromatik yang
mengandung gugus hidroksil. Senyawa ini mudah larut dalam air karena dapat
berikatan dengan gula sebagai glikosida, terdapat pada vakuola sel (Robinson,
1995).
Polifenol pada teh hijau merupakan komponen antioksidan poten yang
lebih kuat daripada vitamin C dan E. Polifenol utama pada teh hijau adalah
flavonoid. Flavonoid dapat dibedakan menjadi 5 sub kelas yaitu flavonol, flavon,
flavanon, flavan-3-ol, dan antosianidin. Flavonoid yang terdapat pada teh hijau
(apigenin dan luteolin), dan flavonol (kaemferol, mirisetin, dan kuersetin)
(Anonim, 2003a).
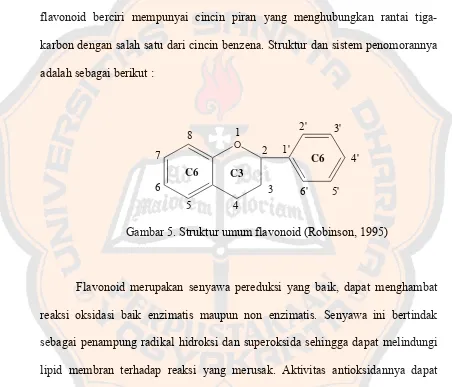
Golongan flavonoid dapat digambarkan sebagai deretan senyawa C6-C3
-C6, artinya kerangka karbonnya terdiri atas dua gugus C6 (cincin benzena
tersubstitusi) disambungkan oleh rantai alifatik tiga-karbon. Golongan terbesar
flavonoid berciri mempunyai cincin piran yang menghubungkan rantai
tiga-karbon dengan salah satu dari cincin benzena. Struktur dan sistem penomorannya
adalah sebagai berikut :
Gambar 5. Struktur umum flavonoid (Robinson, 1995)
Flavonoid merupakan senyawa pereduksi yang baik, dapat menghambat
reaksi oksidasi baik enzimatis maupun non enzimatis. Senyawa ini bertindak
sebagai penampung radikal hidroksi dan superoksida sehingga dapat melindungi
lipid membran terhadap reaksi yang merusak. Aktivitas antioksidannya dapat
HO
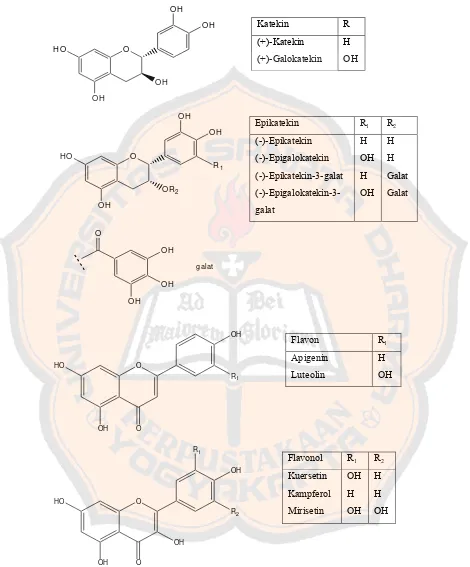
Gambar 6. Struktur senyawa katekin, epikatekin, flavon, dan flavonol
O
Gambar 7. Struktur senyawa teaflavin pada teh (Anonim, 2003a)
I. Tanin
Tanin merupakan polimer flavonoid, memberikan reaksi umum senyawa
fenol, tidak mengkristal, dan memiliki sifat-sifat khusus seperti presipitasi
alkaloid, gelatin, protein, dan polisakarida (Hagerman, 2002). Tanin tersebar luas
dalam tumbuhan berpembuluh baik pada daun, buah, kulit batang, maupun
batang. Di dalam tumbuhan letak tanin terpisah dari protein dan enzim sitoplasma.
Tanin digolongkan menjadi 2 (dua) jenis yaitu : tanin terkondensasi (condensed
tannin), terdapat pada gimnospermae dan angiospermae, serta tanin yang dapat
dihidrolisis (hydrolizable tannin), penyebarannya terbatas pada tumbuhan
berkeping dua (Harborne, 1987).
Tanin terkondensasi berasal dari kondensasi dua atau lebih flavan-3-ol,
seperti katekin, membentuk dimer. Polimerisasi lebih lanjut menghasilkan polimer
dari hubungan 4,6 dan 4,8. Tanin kondensasi juga dapat berasal dari
flavan-3,4-diol (leukoantosianidin) yaitu monomer antosianidin, namun tanin jenis ini tidak
dapat berinteraksi dengan protein membentuk kompleks yang dapat mengendap
(Hagerman, 2002). Bobot molekul pada rentang 3000 – 12000. Polimer tidak larut
dalam air atau etil asetat, tetapi dapat diekstraksi dengan aseton. Jika diberikan
agen hidrolitik, tanin ini akan berpolimerisasi, menjadi tidak larut, dan
menghasilkan produk berwarna merah yang disebut flobafen. Tanin kondensasi
menyebabkan rasa sepat pada makanan dan teh (Robinson, 1995).
Gambar 8. Struktur tanin terkondensasi (Hagerman, 2002)
Tanin yang dapat dihidrolisis merupakan derivat asam galat yang
teresterifikasi menjadi inti poliol dan gugus galoil, dan akan diesterifikasi lebih
kelas, yang paling sederhana adalah depsida galoil glukosa. Pada senyawa ini, inti
yang berupa glukosa dikelilingi oleh lima gugus ester galoil atau lebih, misalnya
galotanin. Pada jenis kedua, inti molekul berupa senyawa dimer asam galat, yaitu
asam heksahidroksidifenat, yang berikatan dengan glukosa, misalnya elagitanin
(Hagerman, 2002).
Tanin dapat bersifat sebagai pengkhelat ion logam, agen presipitasi
protein, dan antioksidan (Hagerman, 2002). Tanin dapat mengendapkan protein
sehingga resisten terhadap enzim proteolitik. Jika diberikan pada jaringan hidup,
aksi ini disebut astringen dan membentuk dasar aplikasi terapetik tanin. Tanin
yang dimanfaatkan sebagai obat yaitu asam tanat dan turunannya, asam
asetiltanat, digunakan sebagai astringen pada saluran gastrointestinal dan abrasi
pada kulit.
Asam tanat dapat larut dalam air, alkohol, aseton dan tidak larut dalam
eter, kloroform dan benzen. Pada penanganan luka bakar, protein jaringan yang
terpapar diendapkan oleh tanin dan membentuk antiseptik ringan dengan
membentuk lapisan pelindung bagi regenerasi jaringan baru dibawahnya. Sifat
tanin ini dimanfaatkan di laboratorium sebagai reagen untuk deteksi gelatin,
protein, dan alkaloid. Pada penanganan keracunan alkaloid, larutan tanin sangat
efektif dalam menginaktivasi alkaloid dengan pembentukan tanat yang tak larut
(Siegers, 1988).
J. Landasan Teori
Penyakit hati dapat disebabkan oleh hepatotoksin, misalnya parasetamol.
digunakan sebagai senyawa model untuk menginduksi kerusakan hati. Metabolit
aktifnya yaitu NAPQI dapat mengarilkan makromolekul yang dapat mengganggu
integritas sel hati. Kerusakan hati yang terjadi adalah nekrosis sentrilobular. Salah
satu cara penapisan awal kerusakan sel hati akut dapat dilakukan dengan
pengukuran aktivitas ALT/GPT serum.
Teh hijau dan apel mengandung senyawa flavonoid yang bersifat
antioksidan dan mampu meningkatkan aktivitas enzim detoksikasi hati.
Kemampuan ini menjelaskan penggunaannya sebagai alternatif minuman
kesehatan dan terapi gangguan fungsi hati secara tradisional.
Penelitian Yuningsih (2003) menunjukkan pemberian infusa teh dosis 10
g/kg BB pada tikus jantan terinduksi parasetamol memberikan efek
hepatoprotektif sebesar 89,36 %, namun tidak dijelaskan jenis teh yang
digunakan. Jika diasumsikan kandungan tiap jenis teh adalah sama maka dari
penelitian ini dapat diketahui efek hepatoprotektif teh hijau dibandingkan hasil
penelitian tersebut. Apakah akan memberikan efek yang sama atau lebih baik
mengingat kandungan senyawa katekinnya jauh lebih tinggi daripada kedua jenis
teh lain.
Penelitian Setianto (2004) menunjukkan persen efek hepatoprotektif sari
buah apel dosis 33,33 ml/kg BB sebesar 92,90 %, dosis sari apel hasil penelitian
tersebut digunakan dalam penelitian ini untuk mengetahui apakah dengan adanya
penambahan teh hijau akan mempengaruhi efek hepatoprotektif sari buah apel
terhadap mencit jantan terinduksi parasetamol. Hal ini dikarenakan selain
protein dan melapisi dinding mukosa usus sehingga dapat mempengaruhi absorpsi
senyawa flavonoid lain.
K. Hipotesis
Penambahan infusa daun teh hijau akan mengurangi efek hepatoprotektif
sari buah apel dan pada perbandingan volume tertentu akan memberikan efek
BAB III
METODOLOGI PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian ini merupakan penelitian eksperimental murni dengan
rancangan acak lengkap pola searah.
B. Definisi Operasional
1. Infus daun teh hijau adalah hasil rebusan daun teh hijau dengan air dalam
panci yang dipanaskan selama 15 menit pada suhu 90°C, sambil sesekali
diaduk, kemudian diserkai dalam keadaan panas menggunakan kain flanel
putih.
2. Sari buah apel adalah hasil penyarian buah apel bersama kulitnya yang
diperoleh dengan menghancurkan buah apel menggunakan blender dan
disari menggunakan kain flanel putih.
3. Efek hepatoprotektif kombinasi infus daun teh hijau dan sari buah apel
adalah kemampuan kombinasi infus daun teh hijau dan sari buah apel
untuk melindungi sel hati dari kerusakan yang disebabkan oleh
parasetamol.
C. Variabel Penelitian
1. Variabel utama
a. variabel bebas : perbandingan volume kombinasi infus daun teh
hijau dan sari buah apel dalam ml.
b. variabel tergantung : tingkat kerusakan sel hati mencit yang
terinduksi parasetamol, dilihat dari aktivitas ALT/GPT serum dan
histopatologi hati mencit.
2. Variabel pengacau terkendali
a. subjek uji : mencit, jantan, galur Swiss, umur 2,0 - 3,0 bulan, berat
badan 20-30 g.
b. bahan uji : buah apel yang diperoleh dari perkebunan apel Batu,
Malang, Jawa Timur dan daun teh hijau kering dari perkebunan teh
PT Pagilaran, Samigaluh, Kulon Progo, Yogyakarta.
3. Variabel pengacau tak terkendali
keadaan patologis hewan uji
D. Subjek dan Bahan Penelitian
1. Subjek penelitian
Mencit, jantan, galur Swiss, berat badan 20 - 30 g, umur 2,0 – 3,0
bulan diperoleh dari Laboratorium Farmakologi – Toksikologi, Fakultas
2. Bahan penelitian
a. Bahan uji : buah apel yang sehat, tidak busuk, kulit berwarna hijau
kemerahan, keras, bebas dari kerut-kerut, dan bintik-bintik lembek,
diperoleh dari perkebunan apel Batu, Malang, Jawa Timur dan
daun teh hijau kering dari perkebunan teh PT Pagilaran,
Samigaluh, Kulon Progo, Yogyakarta.
b. Bahan hepatotoksin yang digunakan adalah parasetamol murni,
berwarna putih, tidak berbau, berasa pahit, diperoleh dari PT
Konimex, Solo.
c. Bahan pelarut parasetamol adalah serbuk PVP, berwarna putih,
terdispersi dalam air, diperoleh dari Laboratorium Farmakokinetika
– Biofarmasetika, Fakultas Farmasi, Universitas Sanata Dharma,
Yogyakarta.
d. Bahan pelarut adalah air suling yang diperoleh dari Laboratorium
Farmakologi – Toksikologi, Fakultas Farmasi, Universitas Sanata
Dharma, Yogyakarta.
e. Penetapan aktivitas ALT/GPT serum digunakan pereaksi siap pakai
ALAT (GPT) FS* Kit (DiaSys, Germany) diperoleh dari CV. Alfa
Kimia, Yogyakarta.
f. Pembuatan preparat histologi hati digunakan formalin 10 %, xilol,
alkohol, lilin cetak, zat warna hematoksilin, dan eosin (E. Merck,
E. Alat Penelitian
Alat-alat yang digunakan dalam penelitian ini adalah spuit injeksi oral,
alat-alat bedah, mikropipet, efendorf, Microlab (E. Merck, Germany), alat-alat
gelas (Pyrex), timbangan elektrik (Mattler Teledo, Switzerland),
Mikrosentrifugasi (Denver Instrument, USA), kamera digital, blender Phillip,
kain flanel putih, dan kompor listrik.
F. Tata Cara Penelitian
1. Determinasi tanaman teh dan apel
Determinasi tanaman teh dan apel dilakukan untuk memastikan
kebenaran tanaman teh dan apel yang digunakan.
2. Pembuatan infus daun teh hijau
Infus teh dibuat dengan cara memanaskan serbuk daun teh hijau
sebanyak 10 g dalam 100 ml air selama 15 menit pada suhu 90°C
kemudian diserkai dalam keadaan panas menggunakan kain flanel putih.
3. Pembuatan sari buah apel
Sari buah apel diperoleh dengan menimbang 100 g buah apel,
setelah dicuci bersih dengan air mengalir, dan dipotong kecil-kecil
bersama kulitnya, kemudian dihancurkan menggunakan blender selama 5
menit. Biji buah apel tidak diikutsertakan. Buah apel yang sudah hancur
disari menggunakan kain flanel putih kemudian cairan yang diperoleh
4. Pembuatan kombinasi infus daun teh hijau dan sari buah apel
Kombinasi infus daun teh hijau dan sari buah apel dibuat dengan
perbandingan 4:1, 3:1, 2:1, 1:1, dan 0,5:1.
5. Pembuatan suspensi PVP
Suspensi PVP dibuat dengan cara menimbang seksama sejumlah g
PVP dan didispersikan dalam air panas sampai konsentrasi yang
diinginkan.
6. Pembuatan suspensi parasetamol dalam PVP
Suspensi parasetamol dalam PVP dibuat dengan cara melarutkan
sejumlah g parasetamol yang telah ditimbang seksama ke dalam suspensi
PVP sesuai konsentrasi yang diinginkan.
7. Pembuatan serum
Darah mencit ditampung dalam efendorf melalui dinding efendorf,
diamkan sampai menjendal selama 15 menit, kemudian sentrifugasi
dengan kecepatan 3500 rpm selama 10 menit dan diambil supernatannya.
8. Penetapan aktivitas ALT/GPT serum
Alat yang digunakan untuk mengukur aktivitas ALT/GPT serum
adalah Microlab (E. Merck, Germany). Aktivitas ALT/GPT serum dibaca
menggunakan pereaksi siap pakai ALAT (GPT) FS* Kit (DiaSys,
Germany) pada panjang gelombang 340 nm, suhu 37°C, dan faktor koreksi
1745. Aktivitas GPT-ALT/GPT serum dinyatakan dalam U/L (Bergmayer
9. Pembuatan preparat histolopatogi hati
Hati mencit yang diperoleh dipotong-potong dengan mikrotom
setebal 3 mm kemudian difiksasi. Preparat dimasukkan ke dalam larutan
etanol secara bertingkat berturut-turut : etanol 80 % selama 2 jam, etanol
95 % selama 2 jam, etanol 95 % selama 1 jam, masing-masing 1 kali
dilanjutkan etanol absolut selama 1 jam dilakukan dua kali. Preparat
kemudian dimasukkan ke dalam xilol selama 1 jam dilakukan 3 kali.
Preparat lalu dipindahkan ke dalam parafin cair selama 2 jam di dalam
blok preparat dan dicetak. Setelah dicetak preparat dipotong setebal 5
mikron.
Ambil preparat untuk diwarnai dengan prosedur pewarnaan Harris
Hematoksilin-eosin. Preparat dimasukkan berturut-turut ke dalam larutan
xilol selama 5 menit dilakukan 3 kali, laruran etanol absolut selama 5
menit 2 kali, aquades 1 menit, Harris Hematoksilin selama 20 menit,
aquades 1 menit, asam alkohol 2-3 celupan, aquades 1 menit dan 15 menit,
eosin 2 menit, etanol 96 % dan etanol absolut selama 3 menit
masing-masing 2 kali, dan xilol selma 5 menit dilakukan 2 kali. Preparat
dikeringkan pada suhu kamar kemudian ditutup dengan balsem Canada
serta objek gelas.
10.Pemeriksaan histopatologi sel hati
Preparat hati yang telah dibuat kemudian diperiksa histopatologi
pemeriksaan histopatologi dan fotomikroskopi merupakan hasil kualitatif
dan dinilai dengan skoring derajat kerusakan sel hati dengan kriteria :
0 = normal atau tidak terdapat kerusakan pada sel hati
1 = infiltrasi sel radang (+)
2 = infiltrasi sel radang (+) dan nekrosis (+)
3 = infiltrasi sel radang (++) dan nekrosis (++)
4 = infiltrasi sel radang (+++) dan nekrosis (+++)
5 = nekrosis (++++)
11.Uji pendahuluan
a. Penetapan dosis hepatotoksik parasetamol
Dosis hepatotoksik parasetamol ditetapkan berdasarkan
hasil penelitian Donatus (1992) mengenai kehepatotoksikan
parasetamol yaitu 0,300 g/kg BB namun pada rentang 0,200 –
0,250 g/kg BB sudah menunjukkan kehepatotoksikan. Dalam
penelitian ini digunakan 5 peringkat dosis yaitu 0,2250; 0,2314;
0,2375; 0,2438 dan 0,2500 g/kg BB. Orientasi dosis
kehepatotoksikan parasetamol dilakukan dengan membagi 25 ekor
mencit ke dalam 5 kelompok dan berturut-turut dipejani
parasetamol dosis 0,2250; 0,2314; 0,2375; 0,2438 dan 0,2500 g/kg
BB secara per oral. Dua puluh empat jam kemudian mencit-mencit
tersebut diambil darahnya melalui sinus orbitalis mata untuk dibuat
serum guna pengukuran aktivitas ALT/GPT. Mencit-mencit
preparat histologi. Dosis hepatotoksik parasetamol yang nantinya
dipakai dalam penelitian adalah dosis dimana diperoleh aktivitas
ALT/GPT serum paling tinggi.
Sebagai pembanding untuk mengetahui adanya kenaikan
aktivitas ALT/GPT serum dilakukan pengukuran aktivitas enzim
pada 5 ekor mencit tanpa perlakuan apapun.
b. Penetapan waktu kehepatotoksikan parasetamol
Penetapan waktu kehepatotoksikan parasetamol dilakukan
dengan melihat kenaikan aktivitas ALT/GPT serum pada jam
ke-24 dan 48 setelah pemejanan parasetamol dosis hepatotoksik.
Waktu dimana terjadi kenaikan aktivitas ALT/GPT serum
maksimal digunakan sebagai waktu untuk pengambilan darah.
c. Penetapan masa praperlakuan kombinasi infus daun teh hijau dan
sari buah apel
Penetapan masa praperlakuan kombinasi infus daun teh
hijau dan sari buah apel dilakukan pada 25 ekor mencit yang dibagi
dalam 5 kelompok, masing-masing 5 ekor, kemudian dipejani
kombinasi infus teh hijau dan sari buah apel dengan perbandingan
tertinggi yaitu 4:1. Kelompok 1, 2, 3, 4, dan 5 dipejani kombinasi
tersebut selama berturut-turut 2, 4, 6, 8, dan 10 hari. Pada akhir
masa perlakuan mencit-mencit tersebut dipejani parasetamol dosis
hepatotoksik secara per oral. Dua puluh empat jam kemudian
mata dan diukur aktivitas ALT/GPT serumnya. Mencit-mencit
tersebut kemudian dikorbankan dan diambil hatinya untuk dibuat
preparat histologi.
12.Pengelompokkan dan perlakuan hewan uji
Sejumlah 50 ekor mencit dibagi secara acak ke dalam 10 kelompok
masing-masing 5 ekor. Kelompok 1 dipejani parasetamol dosis
hepatotoksik sebagai kontrol positif, kelompok 2 dipejani air suling
sebagai kontrol negatif, kelompok 3 dipejani suspensi PVP, kelompok 4
dipejani infus daun teh hijau, kelompok 5 dipejani sari buah apel,
kelompok 6, 7, 8, 9, dan 10 dipejani kombinasi infus daun teh hijau dan
sari buah apel secara berturut-turut dengan perbandingan 4:1, 3:1, 2:1, 1:1,
dan 0,5:1.
G. Analisis Data
Data aktivitas ALT/GPT serum diuji dengan uji Kolmogorov –
Smirnov untuk mengetahui distribusi data dan dilanjutkan dengan uji Levene
untuk mengetahui homogenitas variansinya. Jika didapat nilai p > 0,05
dilanjutkan dengan ANOVA satu arah dengan taraf kepercayaan 95 % dan uji
LSD untuk mengetahui perbedaan masing-masing kelompok. Jika nilai p <
0,05 maka analisis ANOVA satu arah tidak dapat dilakukan sehingga analisis
data aktivitas ALT/GPT serum dilakukan dengan uji Kruskal – Wallis dan
dilanjutkan dengan uji Mann – Whitney dengan taraf kepercayaan 95 % untuk
BAB IV
HASIL DAN PEMBAHASAN
Penelitian ini dilakukan untuk mengetahui efek hepatoprotektif pemberian
kombinasi infusa daun teh hijau dan sari buah apel terhadap mencit jantan
terinduksi parasetamol. Metode yang digunakan adalah tes enzim serum,
pengukuran berat hati mencit, dan pengamatan mikroskopik histopatologi hati.
Tes enzim serum dilakukan dengan pengukuran aktivitas ALT/GPT serum
(U/L) secara spektrometrik, pengukuran berat hati mencit setelah perlakuan (g),
dan pengamatan secara mikroskopik dilakukan pada preparat hati. Efek
hepatoprotektif kombinasi infusa daun teh hijau dan sari buah apel dapat dilihat
dari penurunan aktivitas ALT/GPT serum kelompok kombinasi infusa daun teh
hijau dan sari buah apel jika dibandingkan dengan kontrol positif yaitu pemberian
parasetamol dosis hepatotoksik dan menurunnya tingkat kerusakan hati.
1. Determinasi Tanaman
Determinasi tanaman dilakukan untuk mengetahui dan memastikan
kebenaran tanaman yang digunakan pada penelitian ini. Hal ini dilakukan
dengan mengamati ciri-ciri morfologis yang terdapat pada tanaman dan
disesuaikan dengan ciri-ciri yang terdapat pada buku acuan. Buku acuan yang
digunakan adalah Flora of Java oleh Backer dan van den Brink (1965).