IDENTIFIKASI SENYAWA KIMIA AKTIF FRAKSI
DAUN ASHITABA (Angelica keiskei koidzumi) DALAM
PENGHAMBATAN AKTIVITAS α-GLUKOSIDASE
SECARA IN-VITRO
Disusun sebagai salah satu syarat menyelesaikan Program Studi Strata II pada Jurusan Magister Ilmu Farmasi Sekolah Pascasarjana
Oleh
Yuli Fitriana NIM. V 100140007
PROGRAM STUDI MAGISTER ILMU FARMASI
SEKOLAH PASCASARJANA
UNIVERSITAS MUHAMMADIYAH SURAKARTA
2017
i
HALAMAN PERSETUAN
IDENTIFIKASI SENYAWA KIMIA AKTIF FRAKSI
DAUN ASHITABA (Angelica keiskei koidzumi) DALAM
PENGHAMBATAN AKTIVITAS α-GLUKOSIDASE
SECARA IN-VITRO
PUBLIKASI ILMIAH
Oleh
Yuli Fitriana V.100140007
Telah diperiksa dan disetujui oleh :
Dosen pembimbing I
iii
PERNYATAAN
Dengan ini saya menyatakan bahwa dalam naskah publikasi ini tidak terdapat karya yang pernah diajukan untuk memperoleh gelar disuatu perguruan tinggi dan sepanjang pengetahuan saya juga tidak terdapat karya atau pendapat yang pernah ditulis atau diterbitkan orang lain, kecuali secara tertulis diacu dalam naskah dan disebutkan dalam daftar pustaka.
Apabila kelak terbukti ada ketidak benaran dalam pernyataan saya diatas maka saya pertanggungjawabkan sepenuhnya.
Sukoharjo 9 november 2017
Penulis
Yuli Fitriana V.100140007
1
IDENTIFIKASI SENYAWA KIMIA AKTIF FRAKSI
DAUN ASHITABA (Angelica keiskei koidzumi) DALAM
PENGHAMBATAN AKTIVITAS α-GLUKOSIDASE
SECARA IN-VITRO
ABSTRAKSI
Diabetes mellitus (DM) adalah suatu gangguan metabolisme yang ditandai dengan hiperglikemia. Salah satu kerja obat yang digunakan untuk mengobati penyakit diabetes melitus adalah dengan menghambat kerja enzim α-glukosidase. Daun Ashitaba (Angelica keiske koidzumi) merupakan salah satu tanaman yang berpotensi sebagai obat antidiabetes. Tujuan penelitian ini adalah untuk mengetahui golongan senyawa kimia aktif yang mempunyai aktivitas penghambatan enzim α-glukosidase yang diuji secara in-vitro terhadap ekstrak, fraksi dan isolat. Data diperoleh dengan cara mengukur IC50 ekstrak, fraksi dan isolat terhadap penghambatan aktivitas α-glukosidase dan diidentifikasi senyawa golongan yang terkandung dalam isolat hasil isolasi, metode yang digunakan untuk pengukuran aktvitas enzim α-glukosidase adalah Spectrofotometric dan disolasi dengan metode kromatografi radial dan hasil isolasi dianalisis dengan NMR. Hasil penelitian menyimpulkan bahwa ekstrak, fraksi dan isolat hasil isolasi memiliki aktivitas terhadap penghambatan enzim α-glukosidase dengan masing-masing nilai IC50 untuk ekstrak, fraksi, dan isolat adalah 28,63; 18,45; dan 42,75 µg/mL. Pengujian kinetika terhadap fraksi aktif menunjukkan tipe penghambatannya adalah campuran (Mixed Inhibitor). Golongan senyawa yang diduga memiliki aktivitas penghambatan enzim α-glukosidase adalah flavonoid, alkaloid dan terpenoid. Senyawa kimia aktif dapat dideteksi dengan berbagai macam pereaksi yaitu dengan pereaksi sitoborat, dragendrof dan anisaldehid.
Kata Kunci : Kromatografi radial, Angelica keiske koidzumi, α-Glukosidase, Diabetes Melitus (DM)
ABSTRACT
Diabetes mellitus (DM) is a metabolic disorders characterized by hiperglikemia. One work of drugs used to treat of diabetes mellitus is to hinder a working enzyme α–glukosidase. Leaves Ashitaba (Angelica keiske koidzumi) is one of the plants potentially as antidiabetic. The purpose of this research is to know the active chemical compound that have the activity of an enzyme inhibitoryα-glukosidase tested in in-vitro against extract, and isolates fraction. Data is collected by means of measuring IC50 extract, a fraction and isolates against inhibition activity α-glukosidase and identified the compound contained in isolates result of isolation, methods used to measurement activity enzymeα-glukosidase is spektrofotometric in isolation with the chromatography radial and results isolation dianalis with NMR. The study concluded that the extract, fractions and isolated isolates have activity against α-glucosidase enzyme inhibition with IC50 values to extract, fractions, and isolates was 28.63, 18:45 and 42.75 mg / mL respectively.Testing kinetics of the active fraction showed the type
2
of inhibition is a mixture (Mixed Inhibitor). Classes of compounds that allegedly discount inhibitory activity of α-glucosidase enzyme is flavonoids, alkaloids and terpenoids. The active chemical compounds can be detected with various reagents are reagents sitoborat, dragendrof and anisaldehid.
Keywords:Chromatography radial, Angelica Keiske Koidzumi, α-Glukosidase, Diabetes mellitus (DM)
1. PENDAHULUAN
Ashitaba merupakan tanaman yang bermanfaat untuk panjang umur yang dulu-dulu dicari oleh kaisar pertama china dari dinasti Chin (Adinata,et al., 2012). Di Indonesia tanaman ini tumbuh banyak tumbuh salah satunya di desa sembalun kecamatan Sembalun kabupaten Lombok Timur Nusa Tenggara Barat. Sembalun adalah desa yang berada dikaki Gunung Rinjani Lombok yang memiliki ketinggian 1200 mdpl.
Diabetes melitus (DM) merupakan gangguan metabolisme yang ditandai dengan hiperglikemia dan abnormalits metabolisme karbohidrat, lemak dan protein yang disebabkan oleh penurunan sensitivitas insulin atau keduanya (Dipiro, et al, 2005). Dari data International Diabetes Federation (IDF) tahun 2014 bahwa prevalensi penderita diabetes di indonesia mencapai angka 9116 miliar dengan kelompok umur 20-79 tahun (Internasional Diabetes Federation,2014).
Penghambat α-glukosidase (acarbose) merupakan salah satu gologan obat antidiabetes oral yang secara kompetitif menghambat kerja maltase, isomaltase, sukrase dan glukoamilase sehingga dapat menunda penguraian sukrosa dan karbohidrat kompleks diusus halus. Efek utama yang timbul akibat aksi ini ialah dapat mengurangi peningkatan kadar glukosa darah postprandial (Dipiro, et al, 2005).
Pada penelitian terdahulu telah terbukti bahwa ekstrak etanol dari daun Ashitaba (Angelica keiskei koidzumi) memiliki aktifitas sebagai antidiabetes, menurut peneliti (Enoki T, et all) bahwa senyawa 4-HD (Chalcones dari 4 - Hydroxyderricin) dalam Ashitaba menunjukkan efek pencegahan pada perkembangan diabetes pada tikus. Penelitian lain yang dilakukan oleh (Luo.L, et all) bahwa Ashitaba menunjukkan aktifitas inhibisi α-glukosidase yang sangat baik.
3
Penelitian ini bertujuan untuk mengetahui golongan senyawa kimia aktif yang mempunyai aktivitas penghambatan enzim α-Glukosidase yang diuji secara in-vitro terhadap ekstrak, fraksi dan isolat. Data diperoleh dengan cara mengukur IC50 ekstrak, fraksi dan isolat terhadap penghambatan aktivitas α-Glukosidase dan diidentifikasi senyawa golongan yang terkadung dalam hasil isolat.
2. METODE PENELITIAN
Pembuatan ekstrak. Ditimbang 965.83 gram simplisia daun Ashitaba (Angelica keiskei koidzumi) yang telah disortasi kering direndam dalam pelarut etanol 96%, sesekali dilakukan pengadukan dibiarkan selama 3x24 jam lalu saring dan remaserasi 3x dengan etanol 96%, masing-masing esktrak cair dari hasil maserasi dan remaserasi di evaporasi menggunakan rotaryevaporator hingga didapatkan ekstrak kental.
Fraksinasi corong pisah. Ditimbang 20 gram ekstrak kental dan larutkan dalam aquadest 100 mL pada suhu 50ºC diaduk, diambil endapan dan dipartisi dalam corong pisah menggunakan heksan sebanyak 3 kali dengan volume 50, 25, 25 mL. Dipisahkan antara lapisan etanol-air dan heksan. Partisi kembali dengan menggunakan kloroform sebanyak 2 kali dengan volume masing-masing 25 mL dan digojog. Dipisahkan lapisan etanol-air dan lapisan kloroform. Dipartisi kembali menggunakan etil asetat sebanyak 2 kali dengan volume masing-masing 25 mL. Dpisahkan lapisan etanol-air dengan lapisan etil asetat. Dibiarkan masing-masing fraksi menguap pada suhu kamar dan dihitung rendemen masing-masing fraksi.
2.1 Fraksinasi dengan Kromatografi Vakum Cair (KCV).
Ditimbang 20.108 gram ekstrak kental daun Ashitaba, 40.216 gram silika Gel 60 dan 175 gram silica Gel GF254. Dilarutkan 20.108 gram ekstrak kental dalam etanol sampai homogen, kemudian tambahkan kedalam 40,216 gram silika Gel 60 sampai terbentuk campuran yang homogen. Pasang seperangkat alat Kromatografi Cair Vakum (KCV) hubungkan dengan vacum pada bagian tengah kolom, masukkan silica gel GF.254 sambil diratakan dengan cara ditekan sampai mapat dengan bantuan
4
vacum, jenuhkan dengan heksan, kemudian dimasukkan sampel yang
sudah dicampurkan dengan silika Gel.60 diatas silika Gel GF.254 yang telah dijenuhkan, kemudian diatas sampel diletakkan kertas saring sesuai ukuran kolom yang digunakan untuk mengelusi. Dielusi dengan pelarut yang kepolarannya meningkat sesuai hasil optimasi. Pelarut yang digunakan untuk elusi adalah heksan-kloroform (6: 4; 5: 5), kemudian dilanjutkan dengan fase gerak heksan–etil asetat (9,5:0,5); serta (9 : 1) ; (8 : 2), bilas dengan etanol 2 kali elusi dengan volume, tampung hasil elusi dalam botol kaca dan ditampung sesuai dengan flouresensi warna pada sinar tampak, lalu diuapkan dengan bantuan rotary evaporator sampai terbetuk fraksi kering, gabungkan fraksi yang memiliki profil Rf yang sama.
2.2 Pengujian aktivitas penghambatan enzim α-glukosidase terhadap ekstrak dan fraksi (Tabel 1.)
Tabel 1. Sistem reaksi inhibisi α-glukosidase oleh ekstrak dan Fraksi
Larutan Blanko C S0 S1
Ekstrak/fraksi/acarbose (µL) - - 1 1
DMSO (µL) 1 1 - -
Buffer (µL) 49 49 49 49
Substrat 25 25 25 25
Inkubasi 37°C selama 5 menit
Buffer 25 - 25 -
Enzim - 25 - 25
Inkubasi 37°C selama 15 menit
Na2CO3 (µL) 100 100 100 100
Keterangan :
Blanko = Sistem reaksi tanpa adanya ekstrak/fraksi/Acarbose dan enzim
C = Campuran tanpa ekstrak/fraksi/Acarbose
S0 = Campuran tanpa enzim namun dengan ekstrak/fraksi/Acarbose S1 = Campuran dengan enzim dan ekstrak/fraksi/Acarbose
2.3 Pengujian kinetika penghambatan enzim oleh fraksi aktif. (Tabel 2.)
Tabel 2. Uji kinetika penghambatan enzim
S0 S1
Fraksi (μL) - 1
DMSO (μL) 1 -
Buffer (μL) 49 49
Substrat(μL) 25 25
Inkubasi 37°C selama 5 menit
Enzim (μL) 25 25
Inkubasi 37°C selama 15 menit
5
Keterangan :
S0 = Campuran tanpa ekstrak/fraksi/isolat S1 = Campuran dengan ekstrak/fraksi/isolate
(Alfarabhi,2010).
Isolasi menggunakan Kromatografi Radial (Kromatotron).
Disiapkan lempeng kromatotron dengan cara melarutkan 45 gram silica Gel PF60 1.07749.1000 merck dalam aquadest 95 mL pada suhu 10ºC dalam wadah kaca kemudian gojog kuat sampai homogen, tuangkan diatas lempeng kromatotron dan biarkan mengering pada suhu kamar. Setelah kering lempeng diaktifkan dengan cara dipanaskan pada oven pada suhu 105ºC selama 10 menit. Disiapkan lempeng dengan ukuran jari-jari yaitu 7 cm dengan ketebalan lempeng 1 mm (Horisson, 2012). kondisikan dengan dialiri heksan p.a dengan volume 100-50 mL, biarkan heksan mengalir dari rubber tubing pada bagian bawah kromatotron. Biarkan sedikit menguap, masukkan sampel pada (solvent inlet) dengan bantuan pipet tetes dengan kecepatan searah jarum jam dan biarkan sampel terabsorbsi dahulu. Dielusi dengan pelarut yang sesuai hasil dari optimasi fase gerak untuk KCV, kemudian hasil tampungan dipisahkan berdasarkan flouresensi warna yang terbentuk dengan pengamatan lampu UV 254 nm dan 366 nm. Hasil tampungan dielusi kembali dengan KLT dengan panjang 4 cm untuk melihat jumlah bercak.
Analisis NMR. Sebanyak 5 mg isolat dilarutkan ke dalam pelarut CD3OD dan ditambahkan TMS, kemudian dianalisis menggunakan NMR 400MHz dan 500 MHz. Ditunggu sampai analisis selesai, analisis terhadap peak yang didapat.
Uji identifikasi senyawa. Sebanyak 5 mg isolat dilarutkan dalam 500µL etanol 95%, kemuduan ditotolkan pada KLT silica gel GF254 yang telah diaktifkan. KLT dimasukkan dalam Chamber yang telah dijenuhkan dan dielusi. Kemudian keringkan KLT pada oven dengan suhu 110ºC selama 5 menit (Wagner, 1996). Hasil elusi disemprot dengan pereaksi dragendroff, anisaldehid, FeCl3 dan sitoborat, kemudian diamati reaksi warna yang terjadi pada UV 254 nm, 366 nm dan sinar tampak.
6
Analisis data
1) Perhitungan % penghambatan (IC50) : Menggunakan regresi linier antara konsentrasi ekstrak, fraksi daun Ashitaba (Angelica keiskei koidzumi) terhadap (%) penghambatan enzimα-glukosidase.
2) Identifikasi isolat menggunakan teknik kromatografi :
Diidentifikasi kandungan fraksi menggunakan KLT fase normal, identifikasi dilihat berdasarkan warna dan nilai Rf yang didapat, dilakukan identifikasi spot yang didapat dengan pengelusian minimal 3 fase gerak yang berbeda polaritasnya.
3) Indentifikasi isolat menggunakan spektroskopi NMR
Dilakukan identifikasi terhadap peak yang didapat pada spektra H-NMR dan C-NMR dengan menganalisis lingkungan kimia, pola pemisahan (Spiliting) yang terbentuk, rasio integrasi, konstanta kopling, kemudian dibandingkan dengan referensi.
3. Hasil dan PEMBAHASAN
Ekstraksi dan fraksinasi daun Ashitaba penyarian serbuk daun Ashitaba (Angelica keiskei koidzumi) dilakukan dengan menggunakan metode maserasi. Metode maserasi merupakan metode yang paling sederhana dengan merendam serbuk simplisia dalam pelarut (Gunawan, 2004 ; Depkes RI, 2000). Esktrak kental yang diperoleh berwarna hijau kehitaman yang berbau lemah dengan nilai rendemen total dari 1 x maserasi dan 2x remaserasi yang diperoleh sebesar 29,63% (286,17 gram). Proses fraksinasi pertama menggunakan metode partisi (cair-cair) dimana proses fraksinasi bertujuan agar hasil yang diperoleh dari ekstrak lebih sederhana. Fraksinasi selanjutnya menggunakan metode Kromatografi vacum cair (KCV), metode ini yang biasa digunakan untuk tahap faksinasi awal dari suatu ekstrak non polar ataupun semi polar (Raymond, 2006). Metode ini umumnya digunakan untuk fraksinasi sampel dalam jumlah besar (10-50 gram). Hasil fraksinasi dengan nilai rendemen yang didapat yaitu (Tabel.3) :
7
Tabel 3. Hasil pengeringan 5 fraksi hasil KCV
Keterangan 1 2 3 4 5 Bobot fraksi ( Gram) 0.7357 Gram 1.2993 Gram 2.2896 Gram 5.6014 Gram 2.445 Gram Nilai Rf 0.3 0.94 0.66 0.3 0.36
Pengujian aktivitas penghambatan enzim α-Glukosidase secara in-vitro dilakukan menggunakan metode spektrofotometrik. Dimana adanya
enzim α-Glukosidase dapat meghidrolisis substrat p-nitrofenol-α- D-Glukopiranosida (p-NPG) yang dapat menghasilkan produk p-nitrofenol
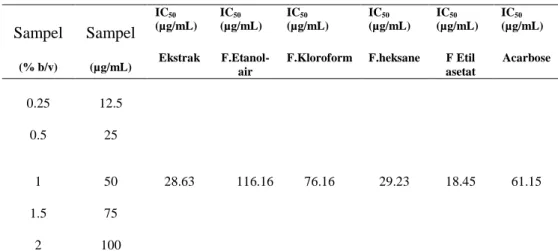
dan D-glukosa. Reaksi antara enzim dan substrat akan membentuk senyawa p-nitrofenol berwarna kuning. Perlunya menentukan kurva baku p-nitrofenol adalah untuk menghitung konsentrasi produk (p-nitrofenol) yang terbentuk untuk menganalisis persen penghambatan dan kinetika penghambatan enzim α-Glukosidase. Dari hasil nilai IC50 yang diperoleh fraksi etil asetat yaitu 18.45 µg/mL menunjukkan kemampuan memiliki potensi sangat aktif terhadap penghambatan aktivitas α-Glukosidase. Jika dibandingkan acarbose pada penelitian ini diperoleh IC50 = 61.152 µg/mL, maka pada fraksi etil asetat daun Ashitaba (Angelica keiskei koidzumi) memiliki aktivitas penghambatan α-Glukosidase lebih tinggi dengan nilai IC50 =18.45 µg/mL (Tabel.4)
Tabel 4. Hasil Uji penghambatan enzim α-Glukosidase oleh ekstrak dan fraksi daun Ashitaba (Angelica keiskei koidzumi) dan Acarbose (IC50)
Sampel (% b/v) Sampel (µg/mL) IC50 (µg/mL) Ekstrak IC50 (µg/mL) F.Etanol-air IC50 (µg/mL) F.Kloroform IC50 (µg/mL) F.heksane IC50 (µg/mL) F Etil asetat IC50 (µg/mL) Acarbose 0.25 12.5 0.5 25 1 50 28.63 116.16 76.16 29.23 18.45 61.15 1.5 75 2 100
Penetuan uji kinetika penghambatan enzim dilakukan untukmelihat mekanisme fraksi etil asetat dalam penghambatan enzim dandalam hal ini kenapa yang digunakan dalam uji kinetika adalah fraksi etil asetat karena dalam uji penghambatan aktivitas enzim α-Glukosidase oleh fraksi etil
8
asetat menunjukkan fraksi etil asetat yang paling kuat dengan melihat nilai IC50yaitu 18.45 µg/mL. Uji kinetika dilakukan dengan membuat beberapa seri konsentrasi substrat p-nitrofenol-α-D-glukopiranosida (p-NPG), meliputi konsentrasi 0,625; 1,25; 2,5; 5; 10 mM dengan inhibisi maupun tanpa inhibisi. Hasil regresi linier ditunjukkan pada (Gambar 1.) pada reaksi enzim substrat dengan inhibitor diperoleh persamaan y= 0,0051x +0,0017 dan reaksi enzim-substrat tanpa inhibitor diperoleh y= 0,0014x + 0,0009. Dari persamaan regresi linier tersebut digunakan untuk menentukan Km dan Vmax. Berikut pada (tabel 5.) merupakan hasil nilai Km dan Vmax.
Tabel 5.Nilai dari Km dan Vmax fraksi etil asetat daun Ashitaba (Angelica keiskei koidzumi)
Sistem reaksi Km (b/a) Vmax(1/a)
Tanpa Inhibitor 1.55 1111
Dengan Inhibitor(AP) 3 588.235
Gambar 1. Hasil Plot Lineweaver-Burk pada konsentrasi 0,5% fraksi etil asetat
Berdasarkan hasil uji kinetika dengan melihat nilai Kmax dan Vmax (Tabel.5) dan grafik hasil plot Lineweaver-Burk (Gambar.1) menunjukkan bahwa mekanisme kinetika penghambatan campuran (mixed type inhibition), hal ini bisa disebabkan karenafraksi semipolar masih mengandung banyak senyawa yang memiliki berbagai mekanisme penghambatan enzim yang berbeda satu dengan yang lainnya. Kriteria penghambatan tipe campuran (mixed type inhibition) dapat dilihat dari
y = 0,0014x + 0,0009 R² = 0,9178 TANPA INHIBISI y = 0,0051x + 0,0017 R² = 0,9972 INHIBISI -0,002 0 0,002 0,004 0,006 0,008 0,01 0,012 -0,5 0 0,5 1 1,5 2 A xi s Ti tle Axis Title
Chart Title
Series29
nilai KAP>K dan VAP< V yang merupakan jenis kinetika campuran tipe I (IIIines.,2008).
Dalam melakukan tahap isolasi suatu senyawa menggunakan teknik kromatografi, perlu terlebih dahulu dilakukan optimasi terhadap fase gerak agar diperoleh pemisahan yang baik, optmasi terlebih dahulu harus dilakukan karena dalam hal ini fase gerak sangat menentukan dan mempengaruhi keberhasilan suatu analisis. Optimasi fase gerak terhadap fraksi mendapatkan hasil pemisahan yang baik dengan menggunakan fraksi yang memiliki nilaiRf 0.3 – 0.36. Tahap isolasi menggunakan fase gerak (heksan : kloroform 5 : 5 v/v) dan tidak menghasilkan isolat yang murni karena masih terdapat banyak bercak kemudian dilanjutkan Isolasi kedua masih menggunakan fraksi semi polar dengan fase gerak yaitu heksan : etil asetat dengan rasio sistem gradient ( 7 : 3 ) → 8 : 2 → 9 : 1 v/v ) menghasilkan 11 fraksi namun masih terdapat tailing dan bercak yang banyak dengan rata-rata nilai Rf 0.6 – 0.64, dalam isolasi kedua ini peneliti kembali menggabungkan hasil isolat dari fraksi yang sudah diisolasi dengan kromtatron dengan menggabungkan fraksi 2.4 − 2.5 − 2.6 − 2.7 dan 2.8 untuk di isolasi kembali dengan harapan senyawa yang tertarik lebih sederhana, dengan bobot setelah dikeringkan sebesar 94.56 mg,
Dari isolasi kedua menghasilkan 6 fraksi dengan terdapatnya 2 bercak yang memiliki nilai Rf 0.42 dan 0.56 pada fraksi 2.1 – 2.2 – 2.3 – 2.4 (berflouresensi biru) Rf 0.46–0.56 dan pada fraksi 2.5 (berflouresensi biru ) dan fraksi 2.6 tidak terdeteksi bercak. Hasil dari fraksi 2.1–2.3–2.4 digabungkan kembali untuk diisolasi kembali dengan perolehan berat fraksi kering sebesar 39.825 mg. Diperoleh 6 fraksi dimana pada fraksi 4.2 terdapat 1 bercak (Gambar.2) dengan nilai Rf 0.64 berflouresensi biru terang dengan berat fraksi kering 8.5 mg.
10
Gambar 2. Hasil analisis isolasi keempat (penggabungan fraksi3.1 3.2 3.4 3.5 3.6) fraksi semi polar menggunakan kromtotron dengan fase diam silika gel 60 F254 dengan panjang elusi 5 cm dan fase gerak heksan – etil
asetat ( 9 : 1 v/v) yang dilihat dengan sinar UV 366nm.
Penelitian oleh (Sembiring B,B et al., 2011) bahwa dalam Ashitaba (Angelica keiskei koidzumi) terutama daun terkandung senyawa golongan alkaloid, saponin, tanin, fenolik, flavonoid, triterpenoid dan glikosida. Identifikasi golongan senyawa yang dilakukan menggunakan hasil isolasi dimana hasil menunjukkan bahwa dengan menggunakan fase gerak heksan-etil asetat memberikan hasil yang baik dilihat dari optimasi isolat hasil kromatografi radial. Pemisahan yang baik dengan diperoleh satu bercak berflouresensi biru. Identifikasi dengan teknik ini dilakukan dengan cara isolat yang didapat dielusi pada lempeng silika gel GF254 sebagai fase diam dan heksan : etil asetat 9 : 1 v/v sebagai fase gerak. Kemudian plat hasil elusi disemprot dengan dragendroff, anisaldehid, FeCl3 dan sitoborat untuk melihat golongan senyawa (Tabel.6).
Tabel 6. Hasil analisis isolat dengan pereaksi dengan pereaksi dragendroff, anisaldehid, FeCl3, sitoborat
Isolat Fraksi 4.2 Warna sebelum
disemprot pereaksi (UV 366 nm) Warna setelah disemprot pereaksi (UV 366 nm) dan sinar tamak Golongan senyawa
Pereaksi dragendroff Berflouresensi biru stabilo
Berflouresensi Coklat lemah
(+)Alkaloid Pereaksi Anisaldehid Berflouresensi biru
stabilo
Berflouresensi Orange kemerahan
(+) Terpenoid
Pereaksi FeCL3 Berflouresensi biru
stabilo
Tidak berflouresensi (-) Polifenol
Pereaksi Sitoborat Berwarna biru
stabilo
Berwarna kuning lemah
(+) Flavonoid
11
Berdasarkan hasil pengamatan dengan menggunkan sinar tampak, UV 254 nm dan 366 nm memperlihatkan bahwa dalam isolat fraksi 4.2 menunjukkan adanya senyawa golongan flavonoid, terpenoid dan alkaloid.
Fraksi 4.2 pada 13C-NMR berflouresensi 400 MHz dengan pelarut CD3OD terdeteksi beberapa peak dengan intensitas yang sangat rendah dan data tersebut tidak dapat diinterpretasikan (Gambar 3.).dalam hal ini pelarut sangat mempegaruhi akan kemunculan suatu spektra. Hal Ini bisa disebabkan karena pada prosesnya analit tidak terlarut sempurna. DMSO (dimetil sulfoksida) merupakan salah satu pilihan pelarut yang bisa digunakan apabila analit tidak dapat melarut pada pelarut lain (Saifuddin, 2014).
Gambar 3. Hasil analisis 13C-NMR fraksi 1.8 dengan CD3OD menggunakan instrumen berfrekuensi 400 MHz
.
Gambar 4. Hasil analisis 13H-NMR fraksi 1.8 dengan CD3OD menggunakan instrumen berfrekuensi 400 MHz
12
Dari hasil analisis terhadap fraksi 4.2 terdeteksi ada 12 lingkungan kimia dengan pola-pola spinnya dan terprediksi 5.3 ppm (q) ; 4.6 ppm (s) ; 2.8 ppm (t) ; 2.4 ppm (m); 2.1 ppm (m) ; 1.9 ppm (m) ; 1.6 ppm (m) ; 1.4 ppm (q) ; 1.2 ppm (d) ; 1.1 ppm (t) ; 1.0 ppm (m) ; 0.92 ppm (m). Hasil analisis menggunakan 1H-NMR dan 13 C-NMR beRfrekuensi 500 MHz tidak dapat diinterpretasikan karena isolat 4.2 belum murni. Spektra yang dihasilkan memiliki intensitas yang rendah. Bisa saja dalam hal ini menunjukkan bahwa pelarut dapat mempengaruhi kemunculan spektra walaupun dalam proses analisa, analit terlarut dalam pelarut CD3OD. Berdasarkan hasil penelitian pada tahap isolasi dengan mengunakan metode kromatografi radial dan dianalisa dengan menggunakan NMR
dianggap belum memiliki hasil yang diinginkan, oleh karena itu dalam
penelitian ini seharusnya penulis melakukan beberapa metode tambahan analisis, seperti ketika mendapatkan satu bercak seharusnya dilanjutkan ke tahap uji titik leleh yang merupakan suatu metode untuk mengetahui kemurnian suatu analit (wilbraham, 1992).
Uji penghambatan enzim α-Glukosidase oleh fraksi daun Ashitaba (Angelica keiskei koidzumi) diperoleh nilai IC50 isolat sebesar 42.65 µg/mL. Suatu ekstrak atau isolat dikatakan sangat aktif jika memiliki nilai penghambatan (IC50) sebesar IC50 25 µg/mL, aktif IC50 jika 25< µg/mL IC50 ≤ 50 µg/mL, kurang aktif jika 50 < IC50 ≤100, dan tidak aktif jika nilai IC50> 100 µg/mL (Widiyarti et,al 2012). Dari hasil nilai IC50 yang diperoleh dari isolat hasil isolasi menunjukkan kemampuan bahwa daun ashitaba (Angelica keiskei koidzumi) memiliki potensi aktif terhadap penghambatan aktivitas α-Glukosidase. Dalam hal ini mengapa hasil penghambatan oleh isolat fraksi 4.2 lebih rendah diandingkan dengan fraksi etil asetat, hal ini bisa diakibatkan terjadinya ekstrapolasi hasil isolat pada fraksi 4.2 dan kemampuan senyawa yang tertarik dalam isolasi memiliki daya hambat yang rendah terhadap enzim α-Glukosidase.
13
4. PENUTUP 4.1 Kesimpulan
1) Ekstrak etanol 96% daun Ashitaba (Angelica keiskei koidzumi) berpotensi dalam penghambatan enzim α-Glukosidase dengan nilai IC50 28.63 µg/mL
2) Fraksi etil asetat (Semipolar) daun Ashitaba (Angelica keiskei koidzumi) berpotensi dalam penghambatan enzim α-Glukosidase dengan rata-rata nilai IC50 18.45 µg/mL dengan mekanisme penghambatan tipe campuran ( Mixed type I Inhibition).
3) Fraksi 3.2 belum menghasilkan senyawa penanda karena masih berupa senyawa campuran dan belum diinterpretasikan. Namun dalam hasil uji identifikasi senyawa bahwa fraksi 4.2 mengandung senyawa golongan flavonoid, alkaloid dan terpenoid.
4.2 Saran
1) Perlu dilakukan penelitian lanjutan tentang karakterisasi senyawa pada ekstrak daun Ashitaba yang berpotensi memiliki aktivitas penghambatan α-Glukosidase.
2) Perlu dilakukan isolasi terhadap semua fraksi untuk memperoleh chemical marker dari daun ashitaba dan diuji aktivitas biologinya.
DAFTAR PUSTAKA
Adinata, M.O., Sudira,I.W., Berata,I.K., 2012, Efek Ekstrak Daun Ashitaba (Angelica keiskei) Terhadap Gambaran Histopatologi Ginjal Mencit (Mus musculus) Jantan, Buletin Veteriner Udayana, Vol 4 No 2 :55-62.
Alfarabi M., 2010, Kajian Antidiabetogenik Ekstrak Daun Sirih Merah ( Piper crocatum ) in vitro, Tesis
Alwan, A.A.S. (1994). Management of diabetes melitus : Standars of care and clinical practice guidlines. Alexandria, Egypt : WHO.
Baba K, Taniguchi M, Shibano M, Minami H, 2009. “The Components and Line Breeding of Angelica keiskei koidzumi”, Bunseki Kagaku, , December,Vol.58 No.12.
Corwin,J,E. (2001). Buku saku Patofisiologi Dari Handbook of phatophysiology oleh Brahm U. Pendit.Jakarta : EGC, 542-548. Dipiro, Joseph T., Robert L. Talbert., Gary C. Yee., Gary R. Matzke.,
Barbara G. Wells & L.Michael Posey. (2005). Pharmacotheraphy a pathophysiologic approach. New York : McGraw-Hill Companies, Inc, 1333-1352.
14
Dirjen BPOM. 1995. Farmakope Indonesia Ed ke-4. Jakarta: Departemen Kesehatan Republik Indonesia, hal. 7-8.
Ditjen BPOM. 2000. Parameter Standar Umum Ekstrak Tumbuhan Obat. Jakarta: Departemen Kesehatan RI, hal. 82-84.
Enoki T, Ohnogi H, Nagamine K, Kudo Y, Sugiyama K, Tanabe M, Kobayashi E, Sagawa H, Kato I., “Antidiabetic activities of Chalcones isolated from a Japanese Herb, Angelica keiskei.”, Journal of Agriculture, Food and Chemistry, Biotechnology Research Laboratories, Takara Bio Inc, 2007.
Illanes A., 2008, Enzyme biocatalysis: Principles and applications,
Internasional Diabetes Federation Diabetes atlas.(2006). The Global burden.2 agustus 2011.
Luo.L, Ruihan wang, Xian ojun wong, zhong jun Ma, Ning Li.,2012. Coumpound from angelica keiske with NQO1 induction, DPPH scavenging and α-glukosidase inhibitory activities. Food chemistry, volume 131,issue 3, pages 992-998.
Mun’im A., Katrin, Azizahwati, Andriani A., Mahmudah K.F. and Mashita M., 2013, Screening of α- Glucosidase Inhibitory Activity of Some Indonesian Medicinal Plants, International J. Med. Arom. Plants, 3 (2), 144–150.
Oboh G, et al (2014). In Vitro Studies on antioxsidant property and inhibition of -Amylase, -Glucosidase, and Angiotensin I-Converting Enzyme by Polyphenol-Rich Extracts from Cocoa (Theobroma cacao) Bean. Phatology Research Internasional,Federal University of Technology,PMB 704, Akure 340252, Nigeria
Raymond C., (2006), kimia dasar ketiga jilid 1, penerbit airlangga.Jakarta.
Sembiring, B,B.,Manoi,F.,2011. Identifikasi Mutu Tanaman
Ashitaba,.Buletin littro, Vol 22 No.2 : 177-185.
Sugiwati S., Setiasih S. and Afifah E., 2009, Antihyperglycemic Activity of The Mahkota Dewa (Phaleria macroarpa (Scheff.) Boerl.) Leaf Extracts as an Alpha-Glucosidase Inhibitor, Makara, Kesehatan, 13 (2), 74–78.
Saifudin, A., 2014, Senyawa Alam Metabolit Sekunder: Teori, Konsep, dan
TeknikPemurnian, Yogyakarta
Widowati L., Dzulkarnain B. and Sa’roni, 1997, Tanaman obat untuk Diabetes Mellitus, Cermin Dunia Kedokteran, Vol. 116. April 1997. Wilbraham, 1992, Pengantar Kimia Organik 1, Bandung, ITB-Press.