U IVERSITAS I DO ESIA
LAPORA PRAKTEK KERJA PROFESI APOTEKER
DI PT. ZE ITH PHARMACEUTICALS
JL. TAMBAK AJI 1
SEMARA G JAWA TE GAH
PERIODE 4 FEBRUARI – 28 MARET 2013
LAPORA PRAKTEK KERJA PROFESI APOTEKER
APRILYA TRI SUSA TI, S.Farm.
1206312851
A GKATA LXXVI
FAKULTAS FARMASI
PROGRAM PROFESI APOTEKER
DEPOK
U IVERSITAS I DO ESIA
LAPORA PRAKTEK KERJA PROFESI APOTEKER
DI PT. ZE ITH PHARMACEUTICALS
JL. TAMBAK AJI 1
SEMARA G JAWA TE GAH
PERIODE 4 FEBRUARI – 28 MARET 2013
LAPORA PRAKTEK KERJA PROFESI APOTEKER
Diajukan sebagai salah satu syarat untuk memperoleh gelar Apoteker
APRILYA TRI SUSA TI, S.Farm.
1206312851
A GKATA LXXVI
FAKULTAS FARMASI
PROGRAM PROFESI APOTEKER
DEPOK
Puji dan syukur saya ucapkan kepada Allah SWT karena atas berkat dan rahmat-Nya, saya dapat menyelesaikan Laporan Praktek Kerja Profesi Apoteker (PKPA) di PT. Zenith Pharmaceuticals, untuk memenuhi salah satu persyaratan guna menyelesaikan pendidikan Program Profesi Apoteker Fakultas Farmasi Universitas Indonesia. Dalam penulisan laporan ini, penulis tidak terlepas dari bimbingan, arahan, bantuan serta dukungan dari berbagai pihak. Untuk itu pada kesempatan ini penulis ingin menyampaikan terima kasih yang sebesar-besarnya kepada :
1. Bapak Andre Widjajanto, B.Buss, MBA., selaku Direktur PT. Zenith Pharmaceuticals.
2. Bapak Drs. Agus Sidharta, Apt., selaku Plan Manager dan Manajer PPIC (Production Plan and Inventory Control) PT. Zenith Pharmaceuticals, atas kesempatan yang telah diberikan kepada kami untuk melaksanakan PKPA dan sekaligus sebagai pembimbing Praktek Kerja Profesi Apoteker di PT. Zenith Pharmaceuticals yang telah banyak memberikan bimbingan dan masukan selama pelaksanaan PKPA dan penyusunan.
3. Bapak Kristoforus K., S.Si., Apt., selaku Formulation Development Manager, sekaligus sebagai pembimbing Praktek Kerja Profesi Apoteker di PT. Zenith Pharmaceuticals yang telah banyak memberikan bimbingan dan masukan selama pelaksanaan PKPA dan penyusunan.
4. Bapak Yohanes G. Reyaan, S.Farm, Apt., selaku Manajer Produksi sekaligus sebagai pembimbing Praktek Kerja Profesi Apoteker di PT. Zenith Pharmaceuticals yang telah banyak memberikan bimbingan dan masukan selama pelaksanaan PKPA dan penyusunan.
5. Ibu Dewi Triwartini, M.Sc, Apt., selaku Manajer QA (Quality Assurance) sekaligus sebagai pembimbing Praktek Kerja Profesi Apoteker di PT. Zenith Pharmaceuticals yang telah banyak memberikan bimbingan dan masukan selama pelaksanaan PKPA dan penyusunan.
7. Dr. Harmita, Apt., selaku pembimbing dan ketua Program Apoteker Fakultas Farmasi Universitas Indonesia yang telah memberikan bimbingan dan pengarahan selama PKPA.
8. Prof. Yahdiana Harahap, M.S, Apt., selaku dekan Fakultas Farmasi Universitas Indonesia.
9. Seluruh staf dan karyawan PT. Zenith Pharmaceuticals, yang telah banyak memberikan bantuan dan bimbingan selama pelaksanaan PKPA.
10.Teman-teman PKPA periode Februari-Maret 2013 di PT. Zenith
Pharmaceuticals Semarang yang berasal dari Universitas Indonesia (UI), Universitas Islam Indonesia (UII) Yogyakarta, dan Universitas Setia Budi (USB) atas kerja sama yang baik selama PKPA berlangsung hingga terselesaikannya laporan PKPA di PT. Zenith Pharmaceuticals Semarang. 11.Orang tua yang selalu memberikan doa, serta dukungan moral dan finansial
kepada penulis.
12.Rekan-rekan mahasiswa Apoteker angkatan 76 yang telah berjuang bersama dalam menyelesaikan studi di Program Profesi Apoteker di Universitas Indonesia.
13.Segenap pihak yang tidak dapat disebutkan satu persatu, atas dukungan dan bantuannya.
Penulis menyadari bahwa laporan ini masih jauh dari sempurna. Oleh karena itu, penulis mengharapkan saran dan kritik yang membangun dari pihak yang membaca. Akhir kata, penulis berharap semoga pengetahuan dan pengalaman yang diperoleh selama menjalani PKPA yang dituangkan dalam laporan ini dapat memberikan manfaat bagi semua pihak yang memerlukan.
Semarang, Maret 2013
Sebagai sivitas akademik Universitas Indonesia, saya yang bertanda tangan di
bawah ini:
Nama
: Aprilya Tri Susanti
NPM
: 1206312851
Program Studi
: Apoteker
Fakultas
: Farmasi
Jenis karya
: Karya Akhir
demi pengembangan ilmu pengetahuan, menyetujui untuk memberikan kepada
Universitas Indonesia Hak Bebas Royalti Noneksklusif (
Non-exclusive Royalty Free Right) atas karya ilmiah saya yang berjudul :
Laporan Praktek Kerja Profesi Apoteker di PT. Zenith Pharmaceuticals Indonesia
Jl. Tambak Aji 1 Semarang Jawa Tengah Periode 4 Februari
–
28 Maret 2013
beserta perangkat yang ada (jika diperlukan). Dengan Hak Bebas Royalti
Noneksklusif
ini
Universitas
Indonesia
berhak
menyimpan,
mengalihmedia/format-kan, mengelola dalam bentuk pangkalan data (database),
merawat, dan memublikasikan tugas akhir saya selama tetap mencantumkan
nama saya sebagai penulis/pencipta dan sebagai pemilik Hak Cipta.
Demikian pernyataan ini saya buat dengan sebenarnya.
Dibuat di : Depok
Pada tanggal : 5 Juli 2013
Yang menyatakan
HALAMAN JUDUL ... ii
HALAMAN PENGESAHAN ... iii
KATA PENGANTAR ... iv
DAFTAR ISI ... vi
DAFTAR TABEL ... viii
DAFTAR GAMBAR ... ix
1. PE DAHULUA ... 1
1.1. Latar Belakang ... 1
1.2. Tujuan ... 2
2. TI JAUA UMUM ... 3
2.1. Gambaran Umum Industri Farmasi ... 3
2.2. Cara Pembuatan Obat Yang Baik ... 3
3. TI JAUA KHUSUS ... 16
3.1. Gambaran Umum PT. Zenith Pharmaceuticals ... 16
3.2. Departemen PT. Zenith Pharmaceuticals ... 21
4. PEMBAHASA ... 52
4.1. Manajemen Mutu.... ... 53
4.2. Personalia... ... 54
4.3. Bangunan dan Fasilitas... ... 55
4.4. Peralatan ... 57
4.5. Sanitasi dan Higiene... ... 58
4.6. Produksi ... 60
4.7. Pengawasan Mutu ... 61
4.8. Inspeksi Diri dan Audit Mutu... ... 62
4.9. Pengawasan Mutu ... 63
4.10Dokumentasi ... 64
4.11Pembuatan dan Analisis Berdasarkan Kontrak ... 65
4.12Validasi dan Kualifikasi ... 65
5. KESIMPULA DA SARA ... 67
5.1Kesimpulan.... ... 67
5.2Saran.... ... 67
Gambar 3.1. Struktur Organisasi PT. Zenith Pharmaceuticals. ... 20 Gambar 3.2. Alur Pengembangan Produk Baru PT. Zenith Pharmaceuticals. ... 31 Gambar 3.3 Struktur Organisasi Departemen Produksi PT. Zenith
Pharmaceuticals. ... 33 Gambar 3.4. Alur Perencanaan Produksi PT. Zenith Pharmaceuticals.. ... 35
Lampiran 1. Alur produksi sediaan kapsul. ... 67
Lampiran 2. Alur produksi sediaan kaplet/ tablet... 68
Lampiran 3. Alur produksi sediaan sirup . ... 69
Lampiran 4. Alur produksi sediaan suspensi... 70
Lampiran 5. Alur produksi sediaan tablet/kaplet β-laktam.. ... 71
Lampiran 6. Alur produksi sediaan kapsul β-laktam ... 72
1.1 Latar Belakang
Obat adalah bahan atau paduan bahan, termasuk produk biologi yang digunakan untuk mempengaruhi atau meyelidiki sistem fisiologi atau keadaan patologi dalam rangka penetapan diagnosis, pencegahan, penyembuhan, pemulihan, peningkatan kesehatan dan kontrasepsi, untuk manusia (Menteri Kesehatan RI, 2010). Tingkat kesadaran masyarakat dalam menggunakan obat yang meningkat dan didukung dengan menguatnya daya beli masyarakat menyebabkan dampak positif pada pertumbuhan industri farmasi di Indonesia. Industri farmasi adalah badan usaha yang memiliki izin dari Menteri Kesehatan RI untuk melakukan kegiatan pembuatan obat atau bahan obat (Menteri Kesehatan RI, 2010). Oleh karena itu, industri farmasi harus dapat memastikan bahwa obat yang dihasilkan memenuhi standar mutu yang ditetapkan.
Industri Farmasi dalam seluruh aspek dan rangkaian kegiatan pembuatan obat dan/atau bahan obat harus menerapkan Pedoman Cara Pembuatan Obat yang Baik (CPOB). CPOB adalah cara pembuatan obat yang bertujuan untuk memastikan agar mutu obat yang dihasilkan sesuai dengan persyaratan dan tujuan penggunaan (Menteri Kesehatan RI, 2010). Penerapan CPOB pada setiap industri farmasi didasarkan pada peraturan Kepala Badan Pengawas Obat dan Makanan No. HK.03.1.33.12.12.8195 tahun 2012.
Dalam CPOB, salah satu aspek yang penting adalah personalia. Sumber daya manusia sangat penting dalam pembentukan dan penerapan sistem pemastian mutu yang memuaskan dan pembuatan obat yang benar. Kedudukan apoteker dalam industri farmasi adalah personil kunci dalam penerapan aspek–aspek yang tercantum dalam CPOB tersebut agar dihasilkan obat yang berkhasiat, aman dan bermutu.
Untuk mencapai peran dan tanggung jawab tersebut, apoteker dituntut memiliki pengetahuan dan keterampilan yang memadai. Pengetahuan industri farmasi yang diperoleh secara teoritis bagi apoteker dirasakan masih kurang mencukupi sehingga diperlukan keterlibatan secara langsung di lingkungan industri farmasi.
Untuk mewujudkan hal tersebut, Program Profesi Apoteker Universitas Indonesia dan PT. Zenith Pharmaceuthical menjalin kerja sama dalam menyelenggarakan PKPA yang dilaksanakan mulai tanggal 4 Februari 2013 sampai dengan 28 Maret 2013. Dengan demikian, diharapkan calon apoteker memiliki bekal pengetahuan praktis dan pengalaman lapangan, serta pengenalan situasi dan kondisi industri dengan segala permasalahan yang kompleks melalui suatu kegiatan praktek kerja profesi apoteker (PKPA).
1.2Tujuan
Praktek Kerja Profesi Apoteker yang dilakukan di PT. Zenith Pharmaceuthical bertujuan untuk:
a. Mengetahui dan memahami penerapan aspek-aspek cara pembuatan obat yang baik (CPOB) di industri farmasi.
b. Memahami tugas dan peran profesi apoteker di industri farmasi serta mendapatkan pengalaman praktis di lapangan.
BAB 2 TI JAUA UMUM
2.1 Gambaran Umum Industri Farmasi
Industri farmasi adalah badan usaha yang memiliki izin dari Menteri Kesehatan untuk melakukan kegiatan pembuatan obat atau bahan obat (Menteri Kesehatan RI, 2010). Industri farmasi dapat melakukan kegiatan proses pembuatan obat dan atau bahan obat untuk semua tahapan dan atau sebagian tahapan yang harus berdasarkan penelitian dan pengembangan yang menyangkut produk sebagai hasil kemjuan ilmu pengetahuan dan teknologi. Industri farmasi merupakan industri yang diatur secara ketat (seperti registrasi, Cara Pembuatan Obat yang Baik, distribusi dan perdagangan produk yang dihasilkan, dan lain-lain) karena menyangkut jiwa (nyawa) manusia. Disamping menghasilkan obat untuk penderita, juga merupakan suatu industri yang berorientasi untuk memperoleh keuntungan. Jadi tidak hanya aspek sosial namun juga ada aspek ekonomi.
2.2Cara Pembuatan Obat Yang Baik (BPOM RI, 2012)
2.2.1 Manajemen Mutu
Cara Pembuatan Obat yang Baik (CPOB) menyangkut seluruh aspek produksi dan pengendalian mutu, bertujuan agar obat yang dihasilkan sesuai dengan tujuan penggunaannya, memenuhi persyaratan yang tercantum dalam dokumen izin edar (regristrasi) dan tidak menimbulkan resiko yang membahayakan penggunaannya karena tidak aman, mutu rendah, atau tidak efektif. Manajemen mutu bertanggung jawab untuk pencapaian tujuan tersebut melalui suatu kebijakan mutu, yang memerlukan partisipasi dan komitmen dari semua jajaran di semua departemen di dalam perusahaan. Untuk mencapai tujuan mutu secara konsisten dan dapat diandalkan, diperlukan manajemen mutu yang didesain secara menyeluruh dan diterapkan secara benar serta menginkorporasi Cara Pembuatan Obat yang Baik termasuk Pengawasan Mutu dan Manajemen Risiko Mutu. Oleh karena itu, unsur dasar manajemen mutu yaitu:
a. Infrastruktur atau sistem mutu yang mencakup struktur organisasi, prosedur, proses, dan semua sumber daya.
b. Tindakan sistematis untuk melaksanakan sistem mutu, yang disebut pemastian mutu (quality assurance). Tindakan sistematis diperlukan untuk mendapatkan kepastian dengan tingkat kepercayaan yang tinggi, sehingga produk (atau jasa pelayanan) yang dihasilkan akan selalu memenuhi persyaratan yang telah ditetapkan.
Semua bagian sistem pemastian mutu didukung dengan tersedianya personil yang kompeten, bangunan dan sarana serta peralatan yang cukup memadai. Dari unsur dasar tersebut, maka sistem manajemen mutu di industri farmasi mencakup antara lain:
a. Struktur organisasi mutu, termasuk di dalamnnya kewenangan QA/QC b. Prosedur ataupun proses pengolahan produk
c. Pengendalian perubahan
d. Sistem pelulusan bahan baku dan produk jadi e. Penanganan penyimpangan
f. Pengolahan ulang
g. Inspeksi diri atau audit internal
h. Pelaksanaan program kualifikasi dan validasi i. Personalia
j. Sistem dokumentasi
k. Penanganan terhadap perubahan, penyimpangan dan prosedur pengolahan ulang.
2.2.2 Personalia
Sumber daya manusia sangat penting dalam pembentukan dan penerapan sistem pemastian mutu yang memuaskan dan pembuatan obat yang benar. Oleh sebab itu, industri farmasi bertanggung jawab untuk menyediakan personil yang terkualifikasi dalam jumlah yang memadai untuk melaksanakan semua tugas. Tiap personil hendaklah memahami tanggung jawab masing-masing dan dicatat. Seluruh personil hendaklah memahami prinsip CPOB dan memperoleh pelatihan awal dan berkesinambungan, termasuk instruksi mengenai higiene yang berkaitan dengan pekerjaan.
Industri farmasi hendaklah memiliki personil yang terkualifikasi dan berpengalaman praktis dalam jumlah yang memadai. Tiap personil tidak dibebani tanggung jawab yang berlebihan untuk menghindari resiko terhadap mutu obat. Jumlah personil yang memadai sangat mempengaruhi proses produksi. Kekurangan jumlah personil cenderung mempengaruhi kualitas obat, karena dengan jumlah personil yang terbatas tugas cenderung dilakukan secara tergesa-gesa. Disamping itu, kekurangan jumlah personil biasanya mengakibatkan kerja lembur sering dilakukan yang dapat menimbulkan kelelahan fisik dan mental baik bagi operator maupun supervisor atau bagi personil pada tingkat lebih atas yang melakukan evaluasi dan/atau mengambil keputusan.
Industri farmasi harus memiliki struktur organisasi. Tugas spesifik dan kewenangan dari personil pada posisi penanggungjawab hendaklah dicantumkan dalam uraian tugas tertulis. Personil kunci mencakup kepala bagian Produksi, kepala bagian Pengawasan Mutu (Quality Control/ QC) dan kepala bagian Manajemen Mutu (Pemastian Mutu/Quality Assurance/ QA). Posisi utama tersebut hendaklah dijabat oleh personil purnawaktu, harus independen satu terhadap yang lain, dipimpin oleh orang yang berbeda serta tidak saling bertanggung jawab satu terhadap yang lain. Masing-masing personil hendaklah diberi wewenang penuh dan sarana yang memadai yang diperlukan untuk dapat melaksanakan tugasnya secara efektif. Personil tersebut hendaklah tidak memiliki kepentingan lain di luar organisasi yang dapat menghambat atau membatasi kewajibannya dalam melaksanakan tanggung jawab atau yang dapat menimbulkan konflik kepentingan pribadi atau finansial.
Berdasarkan CPOB 2012, masing-masing kepala bagian Produksi, Pengawasan Mutu, Dan Manajemen Mutu (Pemastian Mutu) memiliki tanggung jawab bersama dalam menerapkan semua aspek yang berkaitan dengan mutu, yang berdasarkan peraturan Badan POM mencakup:
a. Otorisasi prosedur tertulis dan dokumen lain, termasuk amandemen, b. Pemantauan dan pengendalian lingkungan pembuatan obat,
c. Higiene pabrik, d. Validasi proses, e. Pelatihan,
f. Persetujuan dan pemantauan terhadap pemasok bahan,
g. Persetujuan dan pemantauan terhadap pembuat obat berdasarkan kontrak, h. Penetapan dan pemantauan kondisi penyimpanan bahan dan produk, i. Penyimpanan catatan,
j. Pemantauan pemenuhan terhadap persyaratan CPOB, k. Inspeksi, penyelidikan dan pengambilan sampel, untuk
l. Pemantauan faktor yang mungkin berdampak terhadap mutu produk.
2.2.3 Bangunan dan Fasilitas
Bangunan dan fasilitas untuk pembuatan obat hendaklah memiliki desain, konstruksi dan letak yang memadai, serta disesuaikan kondisinya dan dirawat dengan baik untuk memudahkan pelaksanaan operasi yang benar. Tata letak dan desain ruangan harus dibuat sedemikian rupa untuk memperkecil risiko terjadinya kekeliruan, pencemaran-silang dan kesalahan lain, dan memudahkan pembersihan, sanitasi dan perawatan yang efektif untuk menghindari pencemaran silang, penumpukan debu atau kotoran, dan dampak lain yang dapat menurunkan mutu obat.
Letak bangunan hendaklah sedemikian rupa untuk menghindari pencemaran dari lingkungan sekelilingnya, seperti pencemaran dari udara, tanah, air, serta dari kegiatan industri lain yang berdekatan. Apabila letak bangunan tidak sesuai, hendaklah diambil tindakan pencegahan yang efektif terhadap pencemaran tersebut. Bangunan dan fasilitas hendaklah dikonstruksi, dilengkapi dan dirawat dengan cermat agar memperoleh perlindungan maksimal dari pengaruh cuaca, banjir, rembesan dari tanah serta masuk dan bersarangnya serangga, burung, dan binatang pengerat. Bangunan serta fasilitas hendaklah dibersihkan dan perlu didesinfeksi sesuai prosedur tertulis yang rinci. Catatan pembersihan dan desinfeksi hendaklah disimpan.
Seluruh bangunan dan fasilitas termasuk area produksi, laboratorium, area penyimpanan, koridor dan lingkungan sekeliling bangunan hendaklah dirawat dalam kondisi bersih dan rapi. Kondisi bangunan hendaklah ditinjau secara teratur dan diperbaiki bila perlu. Perbaikan dan perawatan bangunan dan fasilitas
hendaklah dilakukan hati-hati agar kegiatan tersebut tidak mempengaruhi mutu obat pasokan.
2.2.4 Peralatan
Peralatan untuk pembuatan obat hendaklah memiliki desain dan konstruksi yang tepat, ukuran yang memadai serta ditempatkan dan dikualifikasi dengan tepat, agar mutu obat terjamin sesuai desain serta seragam dari bets-ke-bets dan untuk memudahkan pembersihan serta perawatan agar dapat mencegah kontaminasi silang, penumpukan debu atau kotoran dan, hal-hal yang umumnya berdampak buruk pada mutu produk. Peralatan hendaklah didesain sedemikian rupa agar mudah dibersihkan. Peralatan tersebut hendaklah dibersihkan sesuai dengan prosedur tertulis yang rinci dengan menggunakan desinfektan yang tepat. Peralatan hendaklah dirawat sesuai jadwal untuk mencegah malfungsi atau pencemaran yang dapat mempengaruhi identitas, mutu atau kemurnian produk. Pelaksanaan perawatan dan pemakaian suatu peralatan hendaklah dicatat dalam buku log alat yang menunjukkan tanggal, waktu, produk, kekuatan, dan nomor bets atau lot yang diolah dengan alat tersebut.
2.2.5 Sanitasi dan Higiene
Tingkat sanitasi dan higiene yang tinggi hendaklah diterapkan pada setiap aspek pembuatan obat. Ruang lingkup meliputi personil, bangunan, peralatan, dan perlengkapan, bahan produksi serta wadahnya, dan segala sesuatu yang dapat menjadi sumber pencemaran produk. Sanitasi dan higiene yang diatur dalam pedoman CPOB 2012 adalah higiene perorangan, sanitasi bangunan dan fasilitas, pembersihan dan sanitasi peralatan, serta validasi prosedur pembersihan dan sanitasi.
Higiene perorangan mencakup ketentuan bahwa semua personil yang masuk ke area produksi mengenakan pakaian pelindung yang bersih sesuai dengan kegiatannya. Untuk menjamin perlindungan produk dari pencemaran dan untuk keselamatan personil, hendaklah personil mengenakan pakaian pelindung yang bersih dan sesuai dengan tugasnya termasuk penutup rambut. Program higiene yang rinci, termasuk prosedur yang berkaitan dengan kesehatan, praktek
higiene dan pakaian pelindung personil, hendaklah dibuat secara rinci dan diadaptasikan terhadap berbagai kebutuhan di dalam area pembuatan.
Program higiene tersebut diantaranya meliputi tidak merokok, makan, minum, memelihara tanaman dalam area produksi; tidak bersentuhan langsung dengan bahan awal, produk antara dan produk ruahan yang terbuka, bahan pengemas primer dan juga dengan bagian peralatan yang bersentuhan dengan produk; dan bagi personil yang mengidap penyakit atau menderita luka terbuka yang dapat merugikan mutu produk hendaklah dilarang menangani bahan awal, bahan pengemas, bahan yang sedang diproses dan obat jadi sampai kondisi personil tersebut dipertimbangkan tidak lagi menimbulkan resiko.
Untuk sanitasi bangunan dan fasilitas, desain dan konstruksi memudahkan sanitasi yang baik, Toilet, ventilasi, dan tempat cuci mudah tercukupi dan mudah diakses dari tempat pembuatan. Penyimpanan pakaian dan barang pribadi personil memadai. Penyiapan, penyimpanan, dan konsumsi makanan dan minuman dibatasi di daerah khusus serta sampah dikelola dengan teratur.
Pembersihan dan sanitasi peralatan dilakukan dengan cara setelah digunakan, alat dibersihkan luar maupun dalam sesuai prosedur. Sebelum pakai, dilakukan pemeriksaan untuk memastikan bahwa produk atau bahan dari bets sebelumnya telah hilang. Setelah digunakan, peralatan hendaklah dibersihkan baik bagian luar maupun bagian dalam sesuai dengan prosedur yang telah ditetapkan, serta dijaga dan disimpan dalam kondisi yang bersih. Tiap kali sebelum dipakai, kebersihannya diperiksa untuk memastikan bahwa semua produk atau bahan dari bets sebelumnya telah dihilangkan.
Prosedur tertulis untuk pembersihan dan sanitasi peralatan serta wadah yang digunakan dalam pembuatan obat hendaklah dibuat, divalidasi dan ditaati. Prosedur ini setidaknya meliputi penanggung jawab pembersihan, jadwal, metode, peralatan dan bahan yang dipakai dalam pembersihan serta metode pembongkaran dan perakitan kembali peralatan yang mungkin diperlukan untuk memastikan pembersihan yang benar terlaksana. Jika perlu, prosedur juga meliputi sterilisasi peralatan dan penghilangan identitas bets sebelumnya serta perlindungan peralatan yang telah bersih terhadap pencemaran sebelum digunakan.
Produksi dilaksanakan dengan mengikuti prosedur yang telah ditetapkan dan memenuhi ketentuan CPOB yang menjamin senantiasa menghasilkan produk yang memenuhi persyaratan mutu serta memenuhi ketentuan izin pembuatan dan izin edar. Penanganan bahan dan produk jadi, seperti penerimaan dan karantina, pengambilan sampel, penyimpanan, penandaan, penimbangan, pengolahan, pengemasan, dan distribusi dilakukan sesuai dengan prosedur atau instruksi tertulis dan bila perlu dicatat. Seluruh bahan yang diterima diperiksa untuk memastikan kesesuaiannya dengan pesanan.
Selama pengolahan, semua bahan, wadah produk ruahan, peralatan atau mesin produksi dan bila perlu ruang kerja yang dipakai hendaklah diberi label atau penandaan dari produk atau bahan yang sedang diolah, kekuatan (bila ada) dan nomor bets. Bila perlu, penandaan ini juga menyebutkan tahapan proses produksi. Label pada wadah, alat atau ruangan hendaklah jelas, tidak berarti ganda dan dengan format yang telah ditetapkan.
2.2.7 Pengawasan Mutu
Pengawasan mutu merupakan bagian yang esensial dari CPOB untuk memberikan kepastian bahwa produk secara konsisten mempunyai mutu yang sesuai dengan tujuan pemakaiannya. Keterlibatan dan komitmen semua pihak yang berkepentingan pada semua tahap merupakan keharusan untuk mencapai sasaran mutu mulai dari awal pembuatan sampai kepada distribusi produk jadi. Pengawasan mutu tidak terbatas pada kegiatan laboratorium, tapi juga harus terlibat dalam semua keputusan yang terkait dengan mutu produk. Ketidaktergantungan pengawasan mutu dari produksi dianggap hal yang fundamental agar pengawasan mutu dapat melakukan kegiatan dengan memuaskan. Bagian pengawasan mutu bertanggung jawab untuk memastikan bahwa :
a. Bahan awal untuk produksi obat memenuhi spesifikasi yang ditetapkan untuk identitas, kekuatan, kemurnian, kualitas, dan keamanannya.
b. Semua pengawasan selama proses dan pemeriksaan laboratorium terhadap suatu bets obat telah dilaksanakan dan bets tersebut memenuhi spesifikasi yang ditetapkan sebelum didistribusikan.
c. Suatu bets obat memenuhi persyaratan mutu selama waktu peredaran yang ditetapkan.
Bagian pengawasan mutu ini memiliki wewenang khusus untuk memberikan keputusan meluluskan atau menolak atas mutu bahan baku atau produk obat ataupun hal lain yang mempengaruhi mutu obat. Pengawasan mutu hendaklah mencakup semua kegiatan analitis di laboratorium, antara lain:
a. Pengambilan sampel.
b. Pemeriksaan dan pengujian, yaitu meliputi bahan awal, bahan pengemas, produk jadi, pengujian atau pemantauan lingungan, pengujian ulang bahan yang diluluskan, dan pengolahan ulang.
c. Pengujian yang dilakukan dalam rangka validasi. d. Program stabilitas on-going
e. Penanganan sampel pertinggal.
f. Menyusun dan memperbaharui spesifikasi bahan dan produk serta metode pengujiannya.
2.2.8 Inspeksi Diri dan Audit Mutu
Inspeksi diri bertujuan untuk mengevaluasi apakah semua aspek produksi dan pengawasan mutu industri farmasi memenuhi ketentuan CPOB. Program inspeksi diri dirancang untuk mendeteksi kelemahan dalam pelaksanaan CPOB dan untuk menetapkan tindakan perbaikan yang diperlukan. Inspeksi diri hendaklah dilakukan secara independen dan rinci oleh petugas yang kompeten dari perusahaan yang dapat mengevaluasi penerapan CPOB secara obyektif. Inspeksi diri hendaklah dilakukan secara rutin dan, di samping itu, pada situasi khusus, misalnya dalam hal terjadi penarikan kembali obat jadi atau terjadi penolakan yang berulang. Prosedur dan catatan inspeksi diri didokumentasikan dan dibuat program tindak lanjut yang efektif. Instruksi tertulis untuk inspeksi diri dibuat dengan menyajikan standar persyaratan minimal dan seragam. Inspeksi diri dapat dilaksanakan per bagian sesuai dengan kebutuhan perusahaan, namun inspeksi diri yang menyeluruh hendaklah dilaksanakan minimal 1 (satu) kali dalam setahun.
Penyelenggaraan audit mutu berguna sebagai pelengkap inspeksi diri. Audit mutu meliputi pemeriksaan dan penilaian semua atau sebagian dari sistem manajemen mutu dengan tujuan spesifik untuk meningkatkannya. Audit mutu umumnya dilaksanakan oleh spesialis dari luar atau independen atau suatu tim yang dibentuk khusus untuk hal ini oleh manajemen perusahaan. Audit mutu juga dapat diperluas terhadap pemasok dan penerima kontrak.
2.2.9 Penanganan keluhan terhadap Obat, Penarikan kembalian obat, Obat kembalian
Semua keluhan dan informasi lain yang berkaitan dengan kemungkinan terjadi kerusakan obat harus dikaji dengan teliti sesuai dengan prosedur tertulis. Untuk menangani semua kasus yang mendesak, hendaklah disusun suatu sistem, bila perlu mencakup penarikan kembali produk yang diketahui atau diduga cacat dari peredaran secara cepat dan efektif. Penunjukkan personil yang bertanggung jawab diperlukan untuk menangani keluhan dan memutuskan tindakan yang hendak dilakukan bersama staf yang memadai untuk membantunya. Apabila personil tersebut bukan kepala bagian Manajemen Mutu (Pemastian Mutu), personil tersebut hendaklah memahami cara penanganan seluruh keluhan, penyelidikan atau penarikan kembali produk.
Apabila produk pada suatu bets ditemukan atau diduga cacat, maka hendaklah dipertimbangkan untuk memeriksa bets lain untuk memastikan apakah bets lain juga terpengaruh. Dalam penanganan keluhan terhadap obat yang diduga cacat, perlu adanya suatu prosedur tertulis yang merinci penyelidikan, evaluasi, tindak lanjut yang sesuai, termasuk pertimbangan untuk penarikan kembali produk. Pencatatan dan pelaporan mengenai kerusakan produk, hendaknya memuat secara rinci mengenai asal-usul keluhan dan diselidiki secara menyeluruh dan mendalam serta dilaporkan kepada manajemen atau bagian yang terkait. Setelah melakukan penyelidikan dan evaluasi terhadap laporan dan keluhan mengenai suatu produk hendaklah dilakukan tindak lanjut yang mencakup:
a. Tindakan perbaikan bila diperlukan
b. Penarikan kembali satu bets atau seluruh produk akhir yang bersangkutan c. Tindakan lain yang tepat
Catatan keluhan hendaklah dikaji secara berkala untuk mengidentifikasi hal yang spesifik atau masalah yang berulang terjadi, yang memerlukan perhatian dan kemungkinan penarikan kembali produk dari peredaran.
Penarikan kembali produk adalah suatu proses penarikan kembali dari satu atau beberapa bets atau seluruh bets produk tertentu dari peredaran karena keputusan bahwa produk tidak layak lagi untuk diedarkan. Penarikan kembali produk dilakukan apabila ditemukan produk yang cacat mutu atau bila ada laporan mengenai reaksi yang merugikan yang serius serta berisiko terhadap kesehatan. Penarikan kembali produk dari peredaran dapat mengakibatkan penundaan atau penghentian pembuatan obat tersebut.
Tindakan penarikan kembali produk dilakukan, setelah diketahui ada produk yang cacat mutu atau diterima laporan mengenai reaksi yang merugikan, dengan segera, dan agar pesan tiba dengan cepat, menggunakan system komunikasi yang efektif seperti telepon, surat elektronik (e-mail), fax, radio dan TV. Setelah diketahui ada cacat mutu atau diterima laporan mengenai reaksi yang merugikan yang berisiko tinggi, pendistribusian produk hendaklah diembargo dan dilanjutkan dengan tindakan penarikan kembali sampai tingkat konsumen.
Hendaklah ditunjuk personil yang bertanggung jawab untuk melaksanakan dan mengoordinasikan penarikan kembali produk dan hendaklah ditunjang oleh staf yang memadai untuk menangani semua aspek penarikan kembali sesuai dengan tingkat ugensinya. Untuk mengatur segala tindakan penarikan kembali, perlu tersedia prosedur tertulis yang diperiksa secara berkala dan dimutakhirkan jika perlu.
Produk yang dikembalikan dari peredaran dan telah lepas dari pengawasan industri pembuat hendaklah dimusnahkan. Produk tersebut dapat dijual lagi, diberi label kembali atau dipulihkan ke bets berikut hanya bila tanpa keraguan mutunya masih memuaskan setelah dilakukan evaluasi secara kritis oleh kepala bagian Manajemen Mutu (Pemastian Mutu) sesuai prosedur tertulis. Evaluasi tersebut meliputi pertimbangan sifat produk, kondisi penyimpanan khusus yang diperlukan, kondisi dan riwayat produk serta lama produk dalam peredaran.
Industri menyiapkan prosedur untuk penahanan, penyelidikan dan pengujian produk kembalian serta pengambilan keputusan apakah produk
kembalian dapat diproses ulang atau harus dimusnahkan setelah dilakukan evaluasi secara kritis. Berdasarkan hasil evaluasi, produk kembalian dapat dikategorikan sebagai berikut:
a. produk kembalian yang masih memenuhi spesifikasi dan karena itu dapat dikembalikan ke dalam persediaan;
b. produk kembalian yang dapat diproses ulang; dan
c. produk kembalian yang tidak memenuhi spesifikasi dan tidak dapat diproses ulang.
2.2.10 Dokumentasi
Dokumentasi adalah esensial dalam mengoperasikan suatu industri farmasi agar dapat memenuhi persyaratan CPOB. Dokumentasi tersebut merupakan bagian dari sistem informasi manajemen dan dokumentasi yang baik merupakan bagian yang esensial dari pemastian mutu. Sistem dokumentasi yang dirancang atau digunakan hendaklah mengutamakan tujuannya, yaitu menentukan, memantau dan mencatat seluruh aspek produksi serta pengendalian dan pengawasan mutu. Untuk memenuhi kebutuhan ini ada berbagai jenis dokumen yang diperlukan, antara lain spesifikasi, dokumen produksi induk atau formula pembuatan, prosedur, metode dan instruksi, laporan dan catatan, yang semuanya harus tersedia secara tertulis, bebas dari kekeliruan, dapat dibaca dan dipahami dengan mudah. Dokumentasi yang jelas adalah fundamental untuk memastikan bahwa tiap personil menerima uraian tugas yang relevan secara jelas dan rinci sehingga memperkecil risiko terjadi salah tafsir dan kekeliruan yang biasanya timbul karena hanya mengandalkan komunikasi lisan. Catatan yang direkomendasikan untuk disimpan selama paling sedikit satu tahun setelah tanggal daluwarsa produk jadi adalah semua catatan yang berkaitan dengan proses produksi dan pemeriksaan bahan awal yaitu catatan pengolahan bets, catatan pengemasan bets produk, catatan pengambilan sampel, pemeriksaan serta pelulusan bahan awal dan bahan pengemasnya.
2.2.11 Pembuatan dan Analisis Berdasarkan Kontrak
Pembuatan dan analisis berdasarkan kontrak harus dibuat secara benar, disetujui dan dikendalikan untuk menghindari kesalahpahaman yang dapat menyebabkan produk atau pekerjaan dengan mutu yang tidak memuaskan. Kontrak tertulis antara pemberi kontrak dan penerima kontrak harus dibuat secara jelas menentukan tanggung jawab dan kewajiban masing-masing pihak. Kontrak harus menyatakan secara jelas prosedur pelulusan tiap bets produk untuk diedarkan yang menjadi tanggung jawab penuh kepala bagian Manajemen Mutu (Pemastian Mutu).
Tiap bahan atau produk yang diserahkan oleh pemberi kontrak kepada penerima kontrak hendaklah yang sudah diluluskan oleh kepala bagian Manajemen Mutu (Pemastian Mutu) pemberi kontrak. Pemberi kontrak bertanggung jawab untuk menilai kompetensi penerima kontrak dalam melaksanakan pekerjaan atau pengujian yang diperlukan dan memastikan bahwa prinsip dan pedoman CPOB diikuti. Sebelum surat perjanjian kontrak ditandatangani hendaklah pemberi kontrak menginspeksi calon penerima kontrak dengan menggunakan daftar periksa yang dapat menyimpulkan bahwa calon penerima kontrak dapat melakukan pekerjaan pembuatan produk yang akan dikontrakkan dengan memuaskan.
2.2.12 Kualifikasi dan Validasi
CPOB mensyaratkan industri farmasi untuk mengidentifikasi validasi yang perlu dilakukan sebagai bukti pengendalian terhadap aspek kritis dari kegiatan yang dilakukan. Perubahan signifikan terhadap fasilitas, peralatan dan proses yang dapat mempengaruhi mutu produk hendaklah divalidasi. Pendekatan dengan kajian resiko hendaklah digunakan untuk menentukan ruang lingkup dan cakupan validasi.
Kegiatan validasi meliputi kualifikasi (personil, peralatan dan sistem), kalibrasi (instrumen dan alat ukur) dan validasi (prosedur dan proses). Seluruh kegiatan validasi hendaklah direncanakan. Unsur utama program validasi hendaklah dirinci dengan jelas dan didokumentasikan di dalam Rencana Induk Validasi (RIV) atau dokumen setara. Hendaklah dibuat dokumen RIV yang
menyajikan informasi mengenai program kerja validasi perusahaan. Dokumen ini hendaklah juga memberi rincian jadwal kerja validasi yang harus dilaksanakan.
3.1Gambaran Umum PT. Zenith Pharmaceuticals
3.1.1 Sejarah dan Perkembangan PT. Zenith Pharmaceuticals
PT. Zenith Pharmaceuticals didirikan pada tahun 1952 oleh Prof. Drs. Liem Hook Ie (Alm), seorang guru besar Fakultas Farmasi UGM Yogyakarta, berlokasi di Jl. Wotgandul Barat No. 14-16, Semarang. Pengembangan PT. Zenith Pharmaceuticals tahap kedua dimulai pada tahun 1977, tepatnya pada tanggal 2 Mei 1977 dengan hadirnya tenaga-tenaga profesional muda dan manajemen yang lebih baik. Pada tanggal 23 Juli 1994, secara resmi PT. Zenith Pharmaceuticals memulai pengembangan tahap ketiga dengan memindahkan kegiatan produksinya ke lokasi pabrik baru di Jl. Tambak Aji I No. 1, Semarang yang telah dirancang dan dibangun sesuai persyaratan CPOB.
Hal ini sesuai dengan tujuan pemerintah agar obat-obatan produksi Indonesia dapat memasuki pasaran internasional dengan penerapan CPOB yang memenuhi persyaratan Good Manufacturing Practice (GMP) secara internasional. Sedangkan lokasi PT. Zenith Pharmaceuticals di Jl. Wotgandul Barat No. 14-16, Semarang digunakan sebagai kantor dan gudang pemasaran dengan pertimbangan untuk kemudahan pendistribusian dan pemasaran produk obat. Tahun 1994 PT. Zenith Pharmaceuticals semakin berkembang dengan bergabungnya PT. Bufa Aneka yang berlokasi di Jl. Tambak Aji V Semarang. Sampai saat ini PT. Zenith Pharmaceuticals melakukan kerjasama toll manufacturing dengan PT. Bufa Aneka, sebagian dari produk PT. Bufa Aneka diproduksi oleh PT. Zenith Pharmaceuticals.
3.1.2 Visi dan Misi PT. Zenith Pharmaceuticals
PT. Zenith Pharmaceuticals memiliki motto yaitu “Better Health Through Better Medicines” sehingga berupaya menghasilkan obat yang baik agar pasien memperoleh kesehatan yang baik. Visi dari PT. Zenith Pharmaceuticals adalah “We serve world quality health care” yang berarti “Kami melayani produk kesehatan kelas dunia”. Sedangkan Misi PT. Zenith Pharmaceuticals adalah :
a. Product Quality (Kualitas Produk) b. HR Quality (Kualitas SDM) c. Affordable (Terjangkau)
d. Comply to Regulation (Sesuai dengan Regulasi) e. Good Governance (Pengelolaan yang Baik)
f. Research Based Company (Perusahaan berbasis Penelitian) g. Customer satisfaction (Kepuasan Pelanggan)
h. Continous improvement (Perbaikan yang terus-menerus)
Kebijakan mutu PT. Zenith Pharmaceuticals adalah TEAM (Together Everyone Achieves More) PT. Zenith Pharmaceuticals berkomitmen untuk memproduksi obat yang berkualitas sesuai dengan cGMP dan memberikan kontribusi bagi kesehatan seluruh masyarakat Indonesia dan dunia melalui pelaksanaan tugas dan tanggung jawab tiap personil secara benar dan terus mencari perbaikan yang berkesinambungan demi terciptanya : Zero recall menjadi kewajiban pada setiap hasil produksi
Efektif kualitasnya dan aman
iat konsisten untuk menjaga kualitas Improvement berkelanjutan
Tanggung jawab kualitas oleh semua partisipan Harapan pelanggan tercapai melebihi tuntutannya
3.1.3 Lokasi dan Sarana Penunjang PT. Zenith Pharmaceuticals
Lokasi dan konstruksi bangunan untuk produksi obat-obatan harus memiliki ketentuan untuk mencegah bahaya yang dapat merugikan kualitas obat dan diharapkan dapat memberikan kenyamanan kerja dan kelancaran pelaksanaan operasional perusahaan sehingga dapat berjalan lancar, efektif, dan efisien sesuai dengan perencanaan yang ditetapkan. PT. Zenith Pharmaceuticals terletak di Jl. Tambak Aji No. 1 Semarang, memiliki luas area ± 8000 m2, sebagian dari tanah tersebut (± 6500m2) digunakan untuk bangunan. Lokasi ini berada di kawasan industry yang sesuai dengan CPOB, sehingga dapat meminimalkan terjadinya pencemaran lingkungan, baik pencemaran udara, tanah dan air.
Pemilihan lokasi tersebut berdasarkan pada :
a. Tersedianya sumber air bawah tanah sebagai bahan baku pembuatan aqua demineralisata, dan untuk kebutuhan rumah tangga industri.
b. Tersedianya sumber aliran listrik dari PLN dan Jenset sebagai cadangan. c. Letaknya yang strategis, yaitu di kawasan industri yang dekat dengan jalan
raya sehingga memudahkan untuk distribusi produk dan kebutuhan transportasi perusahaan.
d. Lingkungan pabrik merupakan daerah perindustrian yang jauh dari pemukiman penduduk.
PT. Zenith Pharmaceuticals mempunyai dua gedung utama yaitu gedung non β-laktam dan gedung β-laktam. Gedung non β-laktam terdiri dari dua lantai meliputi lantai 1 yang terdiri dari ruang produksi golongan non β-laktam, gudang bahan baku, gudang bahan kemas, gudang obat jadi, ruang Manajer produksi, ruang Plant Manager, ruang Manajer PPIC, ruang kantor administrasi, ruang komputer, ruang ganti pakaian, resepsionis, ruang tunggu, kantin, mushola, koperasi, dan toilet; sedangkan lantai 2 terdiri dari laboratorium R&D, laboratorium pengawasan mutu (QC), ruang contoh pertinggal, ruang Manajer R&D, ruang Manajer QC, ruang Manajer QA, perpustakaan, ruang ganti pakaian, ruang eksekutif, aula, ruang komputer, dan toilet.
Gedung β-laktam didirikan terpisah dari gedung non β-laktam dengan tujuan untuk menghindari terjadinya kontaminasi silang. Konstruksi bangunan dibuat sedemikian rupa sehingga permukaan dinding, lantai, dan langit-langitdalam ruang produksi rata, bebas dari keretakan dan dibuat licin menggunakan cat epoksi. Sudut antara dinding, lantai,dan langit-langit berbentuk lengkungan sehingga memudahkan pembersihan dan mencegah kotoran menempel di sudut-sudut ruangan. Besar ruang produksi dibuat dua kali luas permukaan perlatan untuk memudahkan aktifitas karyawan, serta letak ruangan dan mesin produksi berurutan sesuai dengan proses alur produksi. Penerapan sistem airlock di antara bagian dalam dan luar ruang produksi bertujuan untuk mencegah dan mengurangi pengotoran oleh partikel debu yang dibawa oleh karyawan ke ruang produksi. Ruang antara tersebut dilengkapi dengan dua pintu yang tidak dapat membuka pada saat bersamaan. Digunakan dua pintu
dimaksudkan agar udara dari luar tidak langsung masuk ke dalam ruang produksi karena mempunyai persyaratan jumlah partikel yang berbeda.
3.1.4 Sumber Daya Manusia (Personalia) PT. Zenith Pharmaceuticals
Selain berorientasi pada mutu sediaan obat yang dihasilkan PT. Zenith Pharmaceuticals juga sangat memperhatikan peningkatan sumber daya manusia (SDM) dari kesejahteraan karyawan. Hal ini diwujudkan dengan membentuk suatu wadah bernama Gugus Kendali Karya Kartini ’97 yang dibentuk pada 21 April 1997 dengan kegiatan antara lain :
a. Koperasi simpan pinjam
b. Pendidikan berupa : pelatihan manajemen dan cara pembuatan obat yang baik (CPOB) bagi karyawan yang dilakukan setiap bulan.
c. ZPAS (Zenith Peduli Anak Sekolah), yang menyediakan beasiswa bagi putra-putri karyawan PT. Zenith Pharmaceuticals.
d. Koperasi karyawan yang menjual barang-barang kebutuhan sehari-hari dengan harga yang relatif murah dan terjangkau.
3.1.5 Struktur Organisasi PT. Zenith Pharmaceuticals
Struktur organisasi menggambarkan hubungan antara atasan dan bawahan yang ditunjukkan dengan garis komando. Struktur organisasi yang jelas diperlukan agar pertanggungjawaban dan kerjasama terkoordinasi dengan baik sehingga setiap kegiatan dan proses yang ada dapat berjalan efektif dan efisien serta mencegah terjadinya conflict of interest. Gambaran tentang struktur organisasi PT. Zenith Pharmaceuticals terdapat pada gambar di bawah ini.
Gambar 3.1. Struktur organisasi PT. Zenith Pharmaceuticals
3.1.6 Hasil Produksi PT. Zenith Pharmaceuticals
Sediaan farmasi yang diproduksi oleh PT. Zenith Pharmaceuticals meliputi:
a. Sediaan tablet biasa non antibiotika b. Sediaan tablet salut non antibiotika c. Sediaan tablet biasa antibiotika d. Sediaan tablet salut antibiotika e. Sediaan kapsul keras non antibiotika f. Sediaan kapsul keras antibiotika g. Sediaan cairan oral non antibiotika h. Sediaan cairan oral antibiotika
i. Sediaan tablet biasa antibiotika penisilin dan turunannya j. Sediaan tablet salut antibiotika penisilin dan turunannya k. Sediaan kapsul keras antibiotika penisilin dan turunannya l. Sediaan suspensi kering antibiotika oral penisilin dan turunannya
3.2Departemen PT. Zenith Pharmaceuticals
3.2.1 Departemen PPIC (Production Plan and Inventory Control)
Sesuai dengan namanya, Departemen PPIC (Production Plan and Inventory Control) mempunyai dua tugas utama, yaitu merencanakan produksi dan mengontrol inventaris pabrik. Tugas tersebut meliputi perencanaan produksi, perencanaan pengadaan bahan baku dan bahan kemas dan pengendalian inventaris. Fungsi departemen PPIC adalah :
a. Untuk mensinergikan kepentingan marketing dan manufacturing.
b. Untuk mensinergikan atau memadukan pihak-pihak dalam organisasi (pemasaran, produksi, personalia, dan keuangan) agar dapat bekerja dengan baik.
Tugas Departemen PPIC adalah sebagai berikut :
a. Membuat rencana produksi berdasarkan ramalan penjualan dari departemen pemasaran.
b. Membuat rencana pengadaan bahan berdasarkan rencana dan kondisi stok dengan menghitung kebutuhan material produksi menurut standar stok yang ideal (ada batasan jumlah minimal dan maksimal bahan).
c. Memantau semua inventory baik untuk proses produksi, stok yang ada di gudang, maupun barang yang didatangkan, sehingga pelaksanaan proses dan pemasukan tetap berjalan lancar dan seimbang.
d. Membuat evaluasi hasil produksi, hasil penjualan, maupun kondisi inventory. e. Mengolah data dan menganalisa mengenai rencana dan realisasi produksi dan
penjualan serta data inventory.
f. Menghitung standar kerja karyawan tiap tahun berdasarkan masukan dari bagian produksi atas pengamatan langsung.
g. Menghitung standar yield berdasarkan realisasi produksi tiap tahun.
h. Aktif berkomunikasi dengan semua pihak yang terkait sehingga diperoleh data yang akurat dan up to date.
i. Sebagai juru bicara perusahaan dalam bekerja sama dengan perusahaan lain, seperti toll manufacturing.
Sasaran pokok perencanaan produksi :
a. Ketepatan waktu dalam memenuhi janji (permintaan) pelanggan. b. Kecepatan waktu penyelesaian pesanan (permintaan) pelanggan. c. Berkurangnya biaya produksi.
d. Peluncuran produk baru dan divestment (write off) produk-produk lama berjalan lancar (teratur).
Tujuan kontrol inventory:
a. Untuk memberikan layanan terbaik pada pelanggan. b. Untuk memperlancar proses produksi.
c. Untuk mengantisipasi kemungkinan terjadinya kekurangan persediaan (stok out).
d. Untuk menghadapi fluktuasi harga.
Sasaran pokok kontrol inventory adalah menghasilkan keputusan tingkat persediaan, yang menyeimbangkan tujuan diadakannya persediaan dengan biaya yang dikeluarkan. Jenis barang yang berada dalam kontrol inventory di departemen PPIC meliputi bahan baku, bahan kemas, produk antara dan produk jadi. Dalam menjalankan tugasnya, PPIC merupakan penghubung antar departemen yang ada dalam perusahaan serta mengkoordinasikan fungsi dari masing masing departemen yang terkait. Selain itu, PPIC juga menjadi penghubung dengan industri farmasi lainnya. Hubungan PPIC dengan departemen lain dapat dijelaskan sebagai berikut:
a. Departemen PPIC dengan departemen R&D
Kedua departemen ini bekerjasama dalam pelaksanaan launching produk baru. Departemen R&D akan mengajukan ide tentang pembuatan obat baru, kemudian melakukan trial formulasi untuk memperoleh formula produk yang dianggap paling baik. Jika formula dan cara produksi telah ditentukan, PPIC akan mengatur jadwal produksi sediaan tersebut, baik penyediaan bahan baku maupun bahan kemas.
b. Departemen PPIC dengan bagian marketing
Kedua departemen ini melakukan koordinasi terhadap forecast produk jadi. PPIC akan melihat kebutuhan pasar melalui angka penjualan bulan sebelumnya
dan PPIC bertugas mengatur stok produk jadi yang ada di gudang dan menyesuaikannya dengan rencana penjualan marketing. Bagian marketing juga bertugas mengatur dan mempersiapkan strategi penjualan produk baru. Bagian marketing juga memberi persetujuan atau penolakan terhadap usulan tersebut dengan mempertimbangkan kebutuhan pasar akan produk baru tersebut.
c. Departemen PPIC dengan bagian purchasing
Kedua departemen ini bekerjasama dalam pengaturan stok bahan baku dan bahan kemas yang dibutuhkan oleh pabrik. PPIC mengajukan kebutuhan bahan baku dan bahan kemas kepada bagian purchasing. Selanjunya bagian purchasing bertanggungjawab terhadap pembelian dan ketepatan kedatangan bahan baku dan kemas tersebut sesuai dengan jadwal produksi yang dirancang PPIC.
d. Departemen PPIC dengan departemen produksi
Kedua departemen ini bekerjasama dalam koordinasi untuk kelancaran proses produksi. PPIC dan produksi bertugas merancang weekly plan. Departemen produksi akan melakukan produksi mingguannya berdasarkan rolling production plan yang telah disusun oleh departemen PPIC.
e. Departemen PPIC dengan departemen pengawasan mutu (QC)
Departemen pengawasan mutu bertanggungjawab dalam pengawasan mutu produk yang dihasilkan. Departemen pengawasan mutu akan memanfaatkan rolling production plan yang telah disusun oleh departemen PPIC dalam memperkirakan kebutuhan reagen untuk pelaksanaan analisis terhadap produk.
f. Departemen PPIC dengan departemen HRD
Berdasarkan rolling production plan yang telah disusun oleh departemen PPIC, departemen HRD dapat memperkirakan kemungkinan kebutuhan peningkatan personil demi mendukung pelaksanaan produksi yang telah direncanakan.
g. Departemen PPIC dengan bagian teknik
Bagian teknik dapat menentukan waktu perawatan mesin berdasarkan rolling production plan yang telah disusun PPIC.
h. Departemen PPIC dengan distributor
Distributor bertugas mendistribusikan barang jadi yang akan dipasarkan oleh bagian marketing. Untuk itu diperlukan koordinasi antara PPIC dan distributor terhadap penyediaan produk jadi.
i. Departemen PPIC dengan industri lainnya
Untuk melaksanakan kerjasama dalam bentuk toll in/toll out, PPIC akan menjadi penghubung antara PT. Zenith Pharmaceuticals dengan industri lainnya.
Kegiatan yang dilakukan oleh departemen PPIC di PT. Zenith Pharmaceuticals antara lain :
a. Penerimaan barang
Penerimaan barang dilakukan oleh bagian umum atau bagian penerimaan, baik bahan baku maupun bahan kemas. Secara garis besar, alur penerimaan barang di PT. Zenith Pharmaceuticals adalah sebagai berikut :
1) Bagian penerimaan melakukan pemeriksaan barang yang datang, antara lain keadaan fisik, penandaan pada barang seperti label dari pabrik pembuat dan waktu kadaluwarsa, kelengkapan, kesesuaian dengan surat jalan, dan Certificate of Analysis (CoA). Bila telah sesuai, maka surat jalan ditanda tangani dan aslinya kembali ke pemasok dengan tembusan disimpan bagian penerimaan. Bila tidak sesuai, barang di-reject dan dikembalikan ke pemasok. 2) Barang-barang yang telah dicek dan sesuai dibuatkan Memo Penerimaan
Barang yang terdiri dari 5 lembar (2 lembar berwarna putih, 1 lembar berwarna merah, 1 lembar berwarna kuning dan 1 lembar berwarna hijau) sebagai bukti penerimaan barang dan didistribusikan ke bagian QC, logistik dan keuangan. Barang-barang tersebut ditempatkan di daerah karantina dan diberi label karantina sambil menunggu pemeriksaan oleh bagian QC.
3) Barang-barang tersebut dicatat dalam Buku Ekspedisi Bahan Baku atau Bahan Kemas.
4) Bagian QC melakukan sampling bahan baku dan bahan kemas, kemudian diberi label “Contoh Diambil” pada barang yg disampling. Petugas QC akan mengisi Log Book yang berisi nama bahan baku, no batch dan jumlah yang disampling pada hari itu. Jika barang release, maka diberi label hijau “Diluluskan”. Manajer QC menandatangani Memo Penerimaan Barang dan mengambil lembar kuning. Empat Memo Penerimaan Barang lainnya diteruskan ke bagian logistik. Jika QC me-reject barang tersebut, maka diberi label merah ”Ditolak” dan barang disimpan di gudang reject untuk dikembalikan ke pemasok. Bagian QC juga harus membuat Memo Penolakan Barang (beserta alasan penolakan) yang kemudian diserahkan ke bagian pembelian, logistik, dan penerimaan.
5) Barang yang dinyatakan release oleh bagian QC dimasukkan ke gudang penyimpanan bahan baku atau bahan kemas. Kepala bagian Logistik akan menandatangani Memo Penerimaan Barang dan mengambil lembar merah. 6) Memo Penerimaan Barang yang lain kembali lagi ke bagian penerimaan untuk
keperluan stok barang. Bagian penerimaan menandatangani Memo Penerimaan Barang tersebut dan kemudian mengambil lembar hijau. Selanjutnya, Memo Penerimaan Barang dibawa ke bagian pembelian untuk dilakukan pemastian bahwa barang telah diperiksa oleh bagian QC untuk kemudian diserahkan ke bagian keuangan atau administrasi. Dua lembar putih Memo Penerimaan Barang dan Surat Jalan diserahkan ke bagian keuangan atau administrasi, kemudian ditandatangani dan dijadikan arsip.
b. Penyimpanan barang
Gudang merupakan salah satu sarana pendukung kegiatan produksi dan operasi industri farmasi yang berfungsi untuk menyimpan bahan baku, bahan kemas dan obat jadi yang belum didistribusikan. Gudang juga berfungsi melindungi bahan dan produk dari pengaruh lingkungan luar dan serangga. Agar dapat menjalankan fungsi tersebut maka harus dilakukan pengelolaan pergudangan secara benar atau biasa disebut manajemen pergudangan. Manajemen pergudangan memiliki cakupan antara lain, mengatur orang atau
petugas (SDM), mengatur penerimaan barang, mengatur penataan/penyimpanan barang, dan mengatur pelayanan akan permintan barang.
Agar dapat menjalankan fungsinya dengan benar, maka gudang harus memenuhi persyaratan-persyaratan yang telah ditentukan dalam CPOB, yaitu : 1) Harus ada prosedur tetap (protap) yang mengatur/tata cara kerja bagian
gudang, termasuk didalamnya mencakup tentang cara penerimaan bahan, penyimpanan dan distribusi bahan/produk.
2) Gudang harus cukup luas, terang dan dapat menyimpan bahan dala keadaan kering, bersuhu sesuai dengan persyaratan, bersih dan teratur.
3) Harus ada tempat khusus untuk menyimpan bahan yang mudah terbakar atau mudah meledak (misal, alkohol atau pelarut organik lain).
4) Tersedia tempat khusus untuk produk atau bahan dalam status “karantina” dan “ditolak”.
5) Tersedia tempat khusus untuk melakukan sampling dengan kualitas ruangan seperti ruang produksi.
6) Pengeluaran bahan harus menggunakan prinsip FIFO (First In First Out) atau FEFO (First Expired First Out).
Gudang memerlukan sistem pengendalian yang tepat dan dirancang sedemikian rupa sehingga memungkinkan penempatan bahan-bahan secara teratur serta memperkecil resiko kontaminasi silang. Lingkungan penyimpanan disesuaikan dengan sifat dan kondisi yang dipersyaratkan dari bahan yang akan disimpan. Gudang di PT. Zenith Pharmaceuticals terdiri dari gudang bahan baku, gudang bahan kemas dan gudang obat jadi. Masing-masing dikepalai oleh seorang kepala bagian.
Gudang bahan baku memiliki dua area yang berfungsi sebagai area sampling dan area penyimpanan. Berikut uraian mengenai kedua area tersebut:
1) Area sampling
Area sampling merupakan tempat/ ruang khusus dilakukannya sampling atau pengambilan contoh bahan baku dan bahan kemas primer oleh bagian QC. Kelas ruang area sampling ini dipersyaratkan sama dengan kelas ruang produksi atau grey area (dikondisikan sama dengan ruang dimana bahan tersebut digunakan). 2) Area Penyimpanan
Area penyimpanan adalah tempat untuk menyimpan bahan baku yang sudah dinyatakan lolos uji oleh QC. Penataan bahan baku disusun berdasarkan prioritas, artinya bahan baku yang sering digunakan bagian produksi disimpan di depan supaya lebih mudah dalam pengambilan. Bahan aktif dan bahan tambahan disimpan terpisah serta disesuaikan dengan kondisi penyimpanan bahan, misalnya cangkang kapsul disimpan di ruang bersuhu sejuk. Bahan cair dan mudah terbakar disimpan terpisah di ruang khusus. Penataan bahan disesuaikan dengan jenis dan kemasan bahan, sedangkan pengeluarannya menggunakan sistem FIFO dan FEFO. Untuk memudahkan pencarian atau pengeluaran digunakan kartu stelling yang terpasang pada setiap rak.
Gudang bahan baku PT. Zenith Pharmaceuticals terdiri dari tiga tingkatan rak. Bahan baku yang dikemas dalam sak-sak atau yang agak ringan ditempatkan di rak bagian atas, sedangkan untuk bahan baku dalam drum-drum berat di rak bawah. Untuk bahan baku β-laktam disimpan di gudang bahan baku β-laktam yang terpisah yaitu di bangunan β-laktam. Tujuannya untuk menghindari terjadinya kontaminasi silang bahan baku non laktam dengan bahan baku β-laktam.
Gudang bahan kemas terdiri dari tiga ruang gudang, yaitu gudang bahan kemas primer; ruang brosur, etiket dan hologram; dan gudang bahan kemas sekunder. Berikut uraian mengenai ketiga ruangan gudang bahan kemas tersebut : 1) Gudang bahan Kemas Primer
Digunakan untuk menyimpan pollycelonium dan botol sirup. Penyimpanan bahan pollycelonium dan cangkang kapsul di ruangan khusus disesuaikan dengan syarat penyimpanannya yaitu pada ruang dengan suhu 20o-28oC dan RH 45-75 %.
2) Ruang Brosur, Etiket dan Hologram (Label Obat)
Brosur, etiket dan hologram disimpan dalam ruang khusus yang terkunci untuk menjamin keamanannya.
3) Gudang Bahan Kemas Sekunder
Digunakan untuk menyimpan folding box, dus dan kaleng (botol plastik). Penataan gudang bahan kemas sekunder menggunakan metode seperti halnya pada gudang bahan baku ada pembagian area khusus untuk setiap jenis bahan
kemas. Untuk memudahkan pengambilan, terdapat kartu stelling pada setiap rak serta kartu stok yang terdapat nomor rak dimana bahan kemas tersebut berada.
Gudang obat jadi merupakan tempat untuk menyimpan obat jadi hasil produksi siap untuk didistribusikan ke bagian pemasaran. Gudang obat jadi PT. Zenith Pharmaceuticals ada dua tempat yaitu gudang utama di pabrik (Jalan Tambak Aji) dan gudang tambahan di kantor pemasaran (Jalan Wotgandul Barat). Gudang obat jadi terdiri dari dua area, yaitu area penyimpanan obat jadi dan area pengeluaran barang. Berikut uraian mengenai ketiga ruangan gudang bahan kemas tersebut :
1) Area Penyimpanan Obat Jadi. Area ini digunakan untuk menyimpan obat yang telah di release oleh departemen QA.
2) Area Pengeluaran Barang. Barang utama untuk dikirim hari itu ditata di dekat pintu luar gedung untuk memudahkan pengiriman. Pengeluaran barang juga menggunakan sistem FIFO dan FEFO. Dari gudang obat jadi, barang kemudian diserahkan ke Bagian Pengiriman Barang dengan disertai Bukti Tanda Terima.
Pengontrolan keluar masuknya barang baik dari gudang bahan baku, gudang bahan kemas, maupun gudang obat jadi dilakukan dengan kartu stok dan kartu stelling. Jumlah barang yang masuk dan keluar akan tercatat dalam kartu stok dan kartu stelling ini. Selain itu, juga dilakukan sistem stock opname setiap 3 bulan untuk mengecek kesesuaian antara kartu stok dengan jumlah sebenarnya di gudang. Apabila ditemukan adanya penyimpangan atau perbedaan, maka dibuat laporan penyimpangan dan dilaporkan pada Manajer Produksi untuk ditelusuri lebih lanjut.
c. Pengiriman obat jadi
Pengiriman barang atau obat jadi dilakukan berdasarkan rencana harian pengiriman obat jadi.
Pengiriman obat jadi dapat dijelaskan berikut ini :
1) Bagian gudang obat jadi membuat rencana harian pengiriman obat jadi berdasarkan permintaan pesanan dan kondisi stok, yang tercatat di Buku
Rencana Pengiriman Obat Jadi dan dibuatkan Bukti Tanda Terima (BTT) sebanyak tiga lembar (1 lembar warna merah, 1 lembar warna putih dan 1 lembar warna kuning).
2) Bagian gudang obat jadi menyerahkan barang atau obat jadi yang akan dikirim ke Bagian Pengiriman disertai BTT.
3) Bagian pengiriman mencocokkan barang yang akan dikirim dengan BTT seperti nama dan jumlah barang, apabila sesuai maka BTT diparaf. Bila tidak sesuai, dilakukan konfirmasi ke bagian gudang obat jadi.
4) Barang yang telah sesuai dimasukkan ke box dan dicatat dalam Buku Pengiriman (tanggal, nomor polisi mobil, tujuan, sopir, jam berangkat dan jam kembali).
5) Barang beserta BTT dikirim ke wotgandul barat, PT. Walet atau PT Amapharm. Pihak penerima menandatangani BTT dan mengambil lembar BTT merah. Lembar BTT warna kuning dan putih dikirim kembali ke bagian pengiriman dan bagian gudang obat jadi di Jalan Tambak Aji.
6) Setiap sopir yang mengirimkan barang harus membawa Surat Jalan dan Bukti Tanda Terima. Surat Jalan diperiksa oleh satpam ketika akan keluar atau masuk pabrik.
3.2.2 Departemen Research and Development (R&D)
Departemen R&Duntuk PT. Zenith Pharmaceuticals dan PT. Bufa Aneka masih tergabung dalam satu struktur manajemen, dimana Manajer R&D membawahi Manajer Pengembangan Formulasi dan Manajer Pengembangan Metode Analisa. Manajer Pengembangan Formulasi yang berkantor di PT. Zenith Pharmaceuticals membawahi bagian pengembangan formula (formula untuk produk baru dan pengembangan formula lama) dan bagian pengembangan kemasan. Manajer Pengembangan Metode Analisa membawahi bagian pengembangan metode analisa dan registrasi yang berkantor di PT. Bufa Aneka. Tugas departemen R&D secara umum adalah :
a. Meneliti dan mengembangkan produk baru.
b. Mengembangkan produk yang sudah ada (existing product). c. Meneliti dan mengembangkan metode analisa baru.
d. Mengembangkan metode analisa produk yang sudah ada. e. Standarisasi kemasan.
f. Membuat desain kemasan primer dan sekunder. g. Melakukan pendaftaran atau registrasi produk baru. h. Melakukan uji stabilitas produk obat.
i. Melakukan trial production.
Departemen Research and Development (R&D) di PT. Zenith Pharmacuticals memiliki 4 bagian, yaitu :
a. Pengembangan Formulasi
Pengembangan produk baru diawali dari usulan pengembangan produk baru. Usulan produk baru dapat diajukan oleh pihak marketing, departemen R&D maupun dari departemen lain, kemudian pihak yang mengajukan usulan mengisi Form Usulan Pengembangan Produk serta disampaikan pada rapat marketing. Usulan pengembangan produk baru yang telah disetujui kemudian dimasukkan ke dalam Rencana Kerja Tahunan untuk dibuat jadwal pelaksanaan pengembangan produk baru yang meliputi formulasi, trial produksi, uji stabilitas produk, analisa dan registrasi produk.
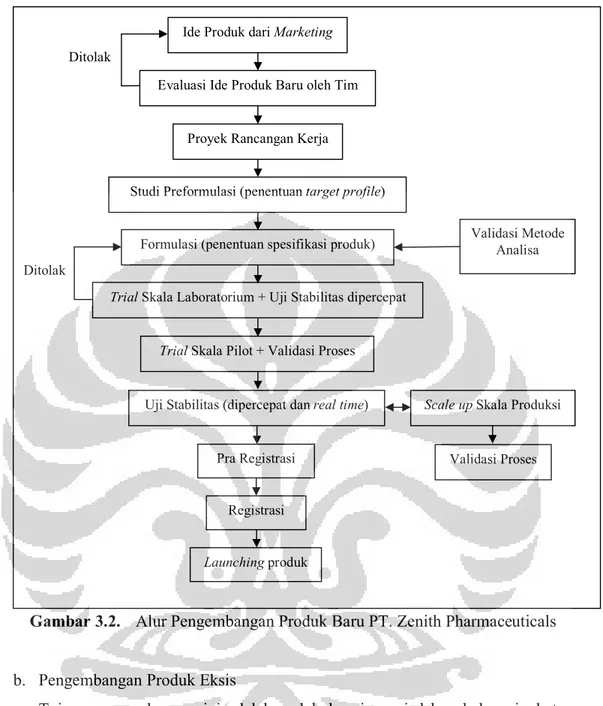
Tahap formulasi diawali dengan studi preformulasi, pengujian produk komparator, menetapkan target profile, dan membuat desain formula. Departemen R&D kemudian mempersiapkan bahan-bahan untuk pelaksanaan percobaan. Percobaan dimulai dari skala laboratorium (besar bets minimal 1/10 dari skala pilot) yang diiukuti uji stabilitas dipercepat untuk formula terpilih. Jika hasil baik, dilanjutkan dengan trial skala pilot (besar bets minimal 1/10 dari skala produksi), diikuti validasi proses dan uji stabilitas dipercepat serta long term.
Data dua bets skala pilot sudah boleh digunakan untuk proses registrasi ke Badan POM. Setelah nomor ijin keluar, segera dilakukan pembuatan skala produksi yang diikuti dengan uji stabilitas dipercepat dan long term. Selanjutnya, dilakukan launching produk. Alur pengembangan produk baru terdapat pada gambar di bawah ini.
Gambar 3.2. Alur Pengembangan Produk Baru PT. Zenith Pharmaceuticals
b. Pengembangan Produk Eksis
Tujuan pengembangan ini adalah melakukan inovasi dalam hal peningkatan mutu produk agar produk yang telah ada tetap eksis dan bersaing di pasaran dengan melakukan improving process dan reformulasi produk serta mencari alternatif bahan baku. Pengembangannya dapat berupa perbaikan bentuk sediaan, perbaikan formula maupun perbaikan kemasan.
c. Pengembangan Kemasan
Pengembang kemasan bertugas mendesain kemasan untuk produk baru maupun perubahan kemasan untuk produk lama. Dalam proses pembuatan
Ide Produk dari Marketing
Evaluasi Ide Produk Baru oleh Tim
Proyek Rancangan Kerja
Studi Preformulasi (penentuan target profile)
Formulasi (penentuan spesifikasi produk)
Trial Skala Laboratorium + Uji Stabilitas dipercepat
Validasi Metode Analisa
Uji Stabilitas (dipercepat dan real time) Trial Skala Pilot + Validasi Proses
Scale up Skala Produksi
Pra Registrasi Registrasi Validasi Proses Ditolak Ditolak Launching produk
kemasan produk, bagian pengembangan kemasan membuat beberapa desain kemasan yang kemudian akan dipilih salah satu kemasan yang sesuai dengan spesifikasi. Kemasan berisi nama obat, kandungan zat aktif, kekuatan sediaan, indikasi, aturan pakai, kontraindikasi, peringatan (untuk obat bebas terbatas), mekanisme farmakologi, logo obat (bebas/bebas terbatas/keras), nomor registrasi obat, nomor bets, tanggal pembuatan, tanggal kadaluwarsa, nama dan lambang PT. Zenith Pharmaceuticals, dan harga eceran tertinggi (HET) obat.
d. Registrasi
Produk-produk obat sebelum beredar di pasaran harus mendapatkan ijin edar dengan melakukan pendaftaran produk atau registrasi pada BPOM. Obat-obat yang akan dipasarkan di masyarakat secara legal mempunyai nomor registrasi produk yang dikeluarkan bila telah memmenuhi evaluasi oleh BPOM.
e. Pengujian Stabilitas Produk Obat
Pada saat melakukan registrasi produk obat baru maupun produk obat copy perlu melampirkan data-data tentang uji stabilitas produk untu mengetahui masa kadaluwarsanya. Stabilitas didefenisikan sebagai kemampuan suatu produk untuk mempertahankan sifat kimia, fisika, mikrobiologi dan biofarmasi sebelum batas kadaluwarsanya. Stabilitas yang dinyatakan sebagai batas waktu atau periode, dimana obat itu masih memenuhi persyaratan, juga disebut selflife.
Pada prinsipnya,ada dua macam uji stabilitas, yaitu uji stabilitas jangka panjang (long term testing) yang berguna untuk menentukan kadaluwarsa riil dan uji stabilitas dipercepat(accelerated testing) yang berguna untuk memprediksi waktu kadaluwarsa. Uji stabilitas jangka panjang dilakukan dengan menyimpan sampel produk pada suhu kamar selama 3 tahun atau lebih, sedangkan uji stabilitas dipercepat dilakukan dengan menyimpan sampel produk dalam climatic chamber yang suhunya dapat diatur sesuai yang ditentukan selama periode 6 bulan. Kriteria sampel yang diguanakan dalam pelaksanaan uji stabilitas :
1) Berasal dari formula dan bentuk sediaan, kemasan yang sama dengan yang akan dipasarkan.
2) Dapat mewakili proses pembuatan baik produksi skala kecil maupun skala besar.
3) Minimal 3 bets dengan mencantumkan jumlah produk tiap bets, kondisi penyimpanan dan frekuensi pengujian.
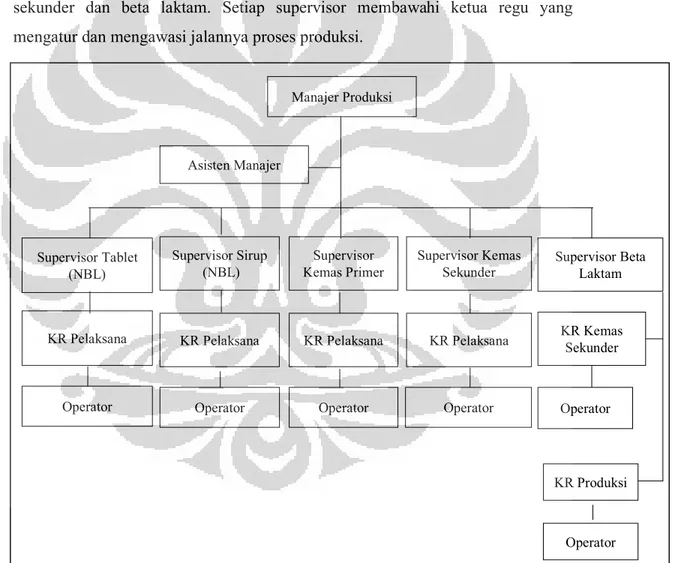
3.2.3 Departemen Produksi
Departemen produksi di PT. Zenith Pharmaceutical dipimpin oleh satu orang manajer produksi dengan dua asisten manajer. Manajer produksi membawahi lima supervisor yaitu bagian tablet, sirup, kemas primer, kemas sekunder dan beta laktam. Setiap supervisor membawahi ketua regu yang mengatur dan mengawasi jalannya proses produksi.
Gambar 3.3. Struktur organisasi departemen produksi PT. Zenith Pharmaceuticals
KR Produksi
Operator
Operator Operator Operator Operator
Supervisor Kemas Primer Supervisor Sirup (NBL) Supervisor Tablet (NBL) Supervisor Kemas Sekunder Supervisor Beta Laktam KR Pelaksana KR Pelaksana
KR Pelaksana KR Pelaksana KR Kemas Sekunder
Operator Manajer Produksi
Departemen produksi mempunyai tugas dan tanggung jawab sebagai berikut:
a. Mencapai target produksi (kuantitas, kualitas, dan waktu yang tepat) yang ditetapkan berdasarkan kapasitas mesin dan ketersediaan tenaga kerja, serta memonitor aktivitas harian dan mingguan berdasar rencana produksi mingguan.
b. Mengoptimalkan dan mengontrol biaya bulanan dan tahunan yang dipakai untuk mencapai target produksi.
c. Memastikan ketersediaan utilitas kerja, misalnya AHU, pengendali tekanan udara, suhu, penerangan, kompresor, dan RH.
d. Memantau produktivitas kerja, output personil dan mesin prouksi.
e. Mengefisienkan pemakaian kapasitas mesin dengan cara melakukan penjadwalan yang efisien, penempatan operator yang tepat, dan perawatan mesin.
f. Memeriksa, mengevaluasi, dan memberi approval dokumen-dokumen yang dipakai dan dikirim ke pengawas mutu.
g. Membimbing supervisor dan ketua regu pelaksana. h. Memberi training.
i. Memastikan dipenuhinya standar-standar atau peraturan-peraturan yang berlaku misal CPOB.
Kegiatan produksi dapat diartikan sebagai semua kegiatan pembuatan mulai dari perencanaan produksi, penerimaan awal, penimbangan, pengolahan sampai dengan pengemasan hingga menghasilkan produk jadi. Proses produksi di PT. Zenith Pharmaceutical dilakukan dengan mengikuti catatan produksi bets, sebagai dasar dalam pembuatan obat, sehingga dapat menjamin mutu obat sesuai spesifikasi yang ditetapkan. Departemen produksi di PT. Zenith Pharmaceuticals dibagi menjadi beberapa bagian yaitu: produksi tablet atau kaplet, produksi sirup dan kapsul, produksi β-laktam, kemas primer dan kemas sekunder.
Lingkup kerja departemen produksi, antara lain : a. Perencanaan produksi
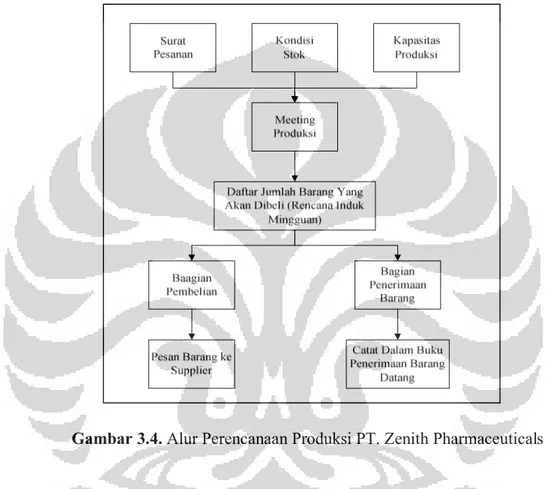
Perencanaan produksi di PT. Zenith Pharmaceuticals dilakukan seminggu sekali pada saat rapat mingguan yaitu setiap hari Jumat, dipimpin oleh manajer