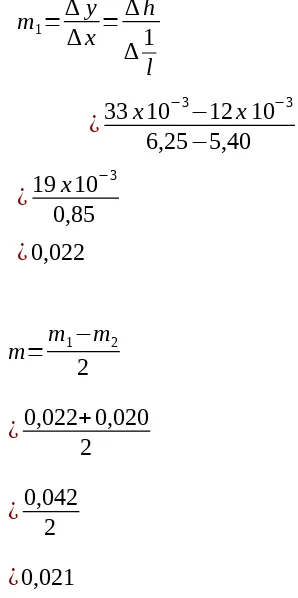LAPORAN PRAKTIKUM FISIKA DASAR
HUKUM BOYLE
NAMA : NENENG ALIF KARLINA
NIM : 14/362703/PA/15781
NO. GOLONGAN : 44A
PRODI : GEOFISIKA
LABORATORIUM FISIKA DASAR
JURUSAN FISIKA FMIPA
UNIVERSITAS GADJAH MADA
2014
LAPORAN PRAKTIKUM HUKUM BOYLE
I. PENDAHULUAN A. Latar Belakang
Dalam Kehidupan sehari-hari, setiap makhluk hidup pasti membutuhkan udara baik untuk bernafas maupun kegiatan lainnya. Udara adalah zat berbentuk gas. Gas merupakan fase dimana jarak antarmolekul sangat jarang, selalu memenuhi ruang berdasarkan bentuk dan volume tempatnya, serta dapat ditekan dan mengembang. Gas mempunyai tekanan, volume, dan temperatur/suhu.
Gas terdiri atas molekul-molekul yang bergerak menurut jalan-jalan lurus ke segala arah dengan kecepatan yang sangat tinggi. Molekul-molekul gas ini selalu bertumbukan dengan molekul yang lain dengan dinding bejana. Tumbukan terhadap dinding bejana ini menyebabkan adanya tekanan. Volume dari molekul-molekul sangatlah kecil bila dibandingkan dengan volume yang teramati oleh gas tersebut sehingga sebenarnya banyak ruangan kosong antara molekul yang menyebabkan gas mempunyai rapat yang kecil daripada zat cair maupun zat padat. Hal ini menyebabkan gas bersifat kompresibel.
Hukum Boyle menyatakan bahwa pada suhu konstan untuk massa tetap, tekanan absolut dan volume suatu gas berbanding terbalik. Robert Boyle (penemu hukum Boyle) melakukan eksperimen berdasarkan asumsi tentang gerakan dan elastis sempurna. Boyle juga mempertimbangkan adanya partikel fluida di tengah air yang tidak terlihat. Saat itu, masih ada anggapan bahwa udara merupakan salah satu dalam empat elemen.
Dengan hukum Boyle, dapat diketahui sifat-sifat suatu gas, yaitu : Gas terdistribusi merata dalam ruang
Bersifat transparan
Dalam ruang, gas memberikan tekanan ke dinding Terdifusi ke segala arah
Dari uraian di atas, dapat diasumsikan bahwa tekanan sangat bergantung pada volume benda atau dengan kata lain, kerapatan zat/udara (gas) juga turut berperan dalam menetapkan tekanan. Dengan tekanan berbanding terbalik dengan volume.
Pada praktikum kali ini, praktikan akan mencari besar tekanan (atmosfer) dengan menggunakan alat manometer. Serta menginterpretasikan dan menerapkannya ke dalam grafik dengan metode ralat bendera dan regresi. Dengan ini, diharapkan praktikan dapat mengerti dan memahami tentang hukum Boyle serta pengartiannya dalam grafik.
B. Tujuan
Belajar menerapkan dan mengartikan (meng-interpretasi-kan) grafik Menentukan tekanan atmosfer
II. DASAR TEORI
Hukum Boyle dirumuskan oleh seorang kimiawan dan fisikawan asal Inggris yaitu Robert Boyle. Hukum Boyle ini berhubungan dengan besaran-besaran seperti volume, suhu dan tekanan. Robert Boyle menyatakan tentang sifat gas bahwa apabila massa gas (jumlah mol) dan temperatur suatu gas dijaga konstan, sementara volume gas diubah ternyata tekanan yang dikeluarkan gas juga berubah sedemikian sehingga perkalian antara tekanan (P) dan volume (V) selalu mendekati konstan. Dengan demikian adalah suatu kondisi bahwa gas tersebut gas sempurna (ideal). Hukum ini dikenal dengan hukum Boyle dengan persamaan :
Atau
Keterangan :
P1 = Tekanan pada keadaan awal V1 = Volume pada kedaan awal P2 = Tekanan pada keadaan akhir V2 = Volume pada keadaan akhir
Syarat berlakunya hukum Boyle adalah gas harus dalam keadaan ideal (gas sempurna), yaitu gas yang terdiri dari satu atom atau lebih dan dianggap identik satu sama lain. Setiap molekul tersebut bergerak secara acak, bebas dan merata serta memenuhi persamaan gerak Newton. Yang dimaksud gas ideal dapat didefinisikan bahwa gas yang perbandingannya PV/nT nya dapat didefinisikan sama dengan R pada setiap besar tekanan. Dengan kata lain, gas sempurna pada tiap besar tekanan bertabiat sama seperti gas sejati pada tekanan rendah. Dengan persamaan sebagai berikut :
3 P1 . V1 = Konstan
………. (2.1)
P1 . V1 = P2 . V2 = Konstan……….
(2.2)
P .V=n . R . T ……….
Kekuatan volume dari kuantitas tetap udara naik, menetapkan udara dari suhu yang telah diukur tekanan (P) harus turun secara proposional. Jika dikonversikan, menurukan volume udara sama dengan meninggikan tekanan. Untuk menunjukkan hukum Boyle, digunakan manometer yang berfungsi mengukur tekanan tolak (dengan catatan tabung dikondisikan dalam keadaan rapat, tidak terjadi celah/kebocoran udara). Persamaannya sebagai berikut :
Keterangan :
P = Tekanan Tolak g = Gravitasi
Po = Tekanan atmosfer h = Perbedaan tinggi pada tabung
ρ = Massa jenis larutan
III.METODE EKSPERIMEN A. Alat dan Bahan
1. Air raksa 2. Kran
3. Tabung karet/Tabung ‘U’ elastis 4. Statis
5. Penggaris 6. Corong
B. Skema Percobaan
4 ……….
(2.4)
P−Po =
Gambar 3.1 Skema persiapan alat dan bahan (kran dibuka sehingga air raksa sejajar)
Gambar 3.2 Skema perubahan ketinggian air ketika kran ditutup
C. Tata Laksana Percobaan
1. Alat dan bahan disiapkan dan disusun sesuai skema (Gambar 2.1) dengan kran terbuka sehingga tinggi air sejajar.
2. Jarak antara kran dan air raksa diukur dan dicatat sebagai l o sepanjang 20 cm
3. Tabung kolom kiri (tertutup dengan kran) diubah posisinya sebesar 0.5 cm sebanyak 10 data
4. Penurunan air raksa pada kolom kanan pada setiap kenaikan 0,5 cm diamati, dan selisih tinggi raksa kolom kiri dengan kanan diukur dan dicatat sebagai h 5. Jarak kran dan kedudukan air raksa di kolom kiri di ukur dan dicatat sebagai L 6. Langkah 1-5 diulangi dengan posisi l o sepanjang 25 cm
D. Analisa Data
P .V=K
5 ……….
(3.1) P .V=n . R . T
………. (3.2)
}
………. (3.3)
P=Po+¿
ρ . g . h ………. Subtitusi ke persamaan (3.2) (3.4)
V=π r2 l
Po+¿
¿ ρ . g . h¿π r
2 l=K
Po π r2 l+ρ . g . h π r2 l=K
ρ . g . h π r2 ¿K
y m x c
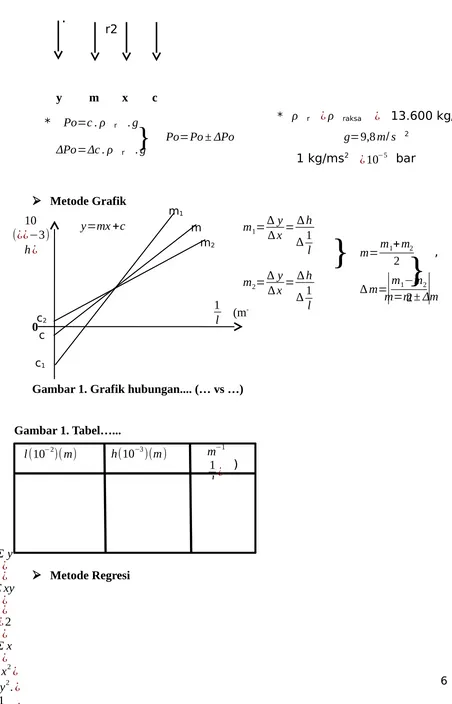
Metode Grafik
0
Gambar 1. Grafik hubungan.... (… vs …)
,
IV. HASIL EKSPERIMEN A. Data
Percobaan 1 ( l o =0,20 m variasi pengurangan panjang 0,005 m) Gambar 4.1 Tabel percobaan 1 dengan l o =0,20 m
19,5 4 5,13
Percobaan 2 ( l o =0,25 m variasi pengurangan panjang 0,005 m) Gambar 4.2 Tabel percobaan 2 dengan l o =0,25 m
24,5 5 4,08
2¿Grafik metode regresi dengan l o=0,20m
8 Gambar 4.3 Grafik metode grafik hubungan antara jarak dan
selisih tinggi kolom raksa ( 1
b) Percobaan 2 ( l o=0,25m variasi pengurangan ketinggian0,005m ) 1) Grafik metode grafik dengan l o=0,25m
9 Gambar 4.4 Grafik metode regresi linier hubungan antara jarak
dan selisih tinggi kolom raksa ( 1
2¿Grafik metode regresi dengan l o=0,25m
10 Gambar 4.5 Grafik metode grafik hubungan antara jarak dan
selisih tinggi kolom raksa ( 1
C. Perhitungan
a) Percobaan 1 ( l o=0,20m variasi pengurangan ketinggian0,005m ) Metode Grafik
11 Gambar 4.6 Grafik metode regresi linier hubungan antara jarak
dan selisih tinggi kolom raksa ( 1
l vs h ) pada l o=¿ 0,25 m m2=∆ y
∆ x= ∆ h ∆1 l
¿39x10
−3
−20x10−3 6,67−5,71
¿19x10
m1=∆ y
Metode Regresi Linier
l o=0,20m (dari grafik hanya didapat 7 data yang dilalui dan dekat dengan garis. Jadi, N=7)
Gambar 4.7 Tabel metode regresi linier percobaan 1
No. x (m) y (10-3) (m) x2 (m2) y2 (10-6) (m2) xy (10-3) (m)
1. 5,40 12 29,16 144 64,80
2. 5,56 16 30,91 256 88,96
3. 5,71 20 32,60 400 114,20
4. 6,06 27 36,72 729 163,62
5. 6,25 31 39,06 961 193,75
6. 6,45 35 41,60 1225 225,75
7. 6,67 39 44,49 1521 260,13
Σ 42,10 180 254,54 5236 1111,21
¿37x10
Metode Regresi Linier
l o=0,25m (dari grafik hanya didapat 7 data yang dilalui dan dekat dengan garis. Jadi, N=7)
Gambar 4.8 Tabel metode regresi linier percobaan 2
No. x (m) y (10-3) (m) x2 (m2) y2 (10-6) (m2) xy (10-3) (m)
1. 4,35 16 18,92 256 69,60
2. 4,44 20 19,71 400 88,80
3. 4,54 23 20,61 529 104,42
4. 4,65 27 21,62 729 125,55
5. 4,76 30 22,66 900 142,80
6. 4,88 33 23,81 1089 161,04
7. 5,00 37 25,00 1369 285,00
Σ 32,62 186 152,33 5272 877,21
14 1066,31−1064,06
]
¿
√
15
[
5272x10−6
.5,27−10,64+5,39
V. PEMBAHASAN
Hukum Boyle menyatakan bahwa volume suatu gas berbanding terbalik dengan tekanan yang diberikan pada saat suhu konstan. Pada praktikum kali ini, praktikan akan mencari tekanan atmosfer dan berusaha membuktikan hukum Boyle tersebut. Alat yang digunakan adalah manometer berbentuk “U”. Pada praktikum, praktikan melakukan dua kali percobaan dengan l o=0,20m dan l o=0,25m . Setiap percobaan, dilakukan variasi l dengan penurunan air raksa sebesar 0,005m sampai 10 data. Setelah itu
data diolah dan di artikan ke dalam 2 bentuk grafik. Yaitu, metode grafik dan metode regresi linier.
Dari metode grafik, dapat diamati bahwa pada percobaan 1 dn 2 c berbanding lurus
dengan 1l . Berdasarkan metode grafik didapatkan:
a) Percobaan 1, l o=0,20m
b) Percobaan 2, l o=0,25m
Kelebihan penggunaan metode grafik adalah perhitungan yang sederhana. Namun, metode grafik ini memiliki tingkat ketelitian yang rendah.
Metode kedua yang digunakan adalah metode regresi linier. Dengan metode ini didapatkan nilai c , Δc , Po , dan ΔPo sebagai berikut :
a) Percobaan 1, l o=0,20m
b) Percobaan 2, l o=0,25m
Namun, terdapat ketidakcocokan antara nilai c hasil perhitungan metode regresi linier dengan metode grafik. Pada metode grafik percobaan 1, didapat nilai c sebesar 1, sedangkan dalam perhitungan dihasilkan c=−0,102 . Dalam percobaan 2 pun juga terjadi perbedaan dimana nila c pada metode grafik adalah -2 dan pada perhitungan adalah c=−0,120 . Hal ini bisa saja terjadi dikarenakan ketidaktelitian praktikan dalam menghitung ataupun dalam melaksanakan praktikum. Misalnya, ketidaktelitian dalam membaca nila l dan h .
Untuk nilai Po , dari hasil perhitungan dapat disimpulkan bahwa nilai Po
berbanding terbalik dengan 1l karena c=Po
ρg
.
16
m± Δm=(0,021±0,001)
m± Δm=(0,031±0,001)
c ± Δc=(−0,102±0,005)
Po± ΔPo=(−0,136±0,006) ¯¿
c ± Δc=(−0,120±0,012)
Sedangkan pada grafik yang telah digambar, dihasilkan grafik dengan kemiringan garis yang linier. Grafik menunjukkan perbedaan ketinggian air raksa ( h )
berbanding lurus dengan 1l
.
Sehingga, dapat disimpulkan bahwa teori P=1V
adalah benar. Berkaitan dengan rumus PV=nRT dimana P berbanding lurus dengan nilai h(Po+ρgh) sedangkan V berbanding lurus dengan l(V=π r2l
) . Jika tekanan (P) dikombinasikan dengan volume (V), maka akan didapat rumus :
Po+cgh= c
π r2l
Dari rumus tersebut terlihat bahwa h berbanding lurus dengan 1l yang menandakan bahwa kemiringan grafik linier adalah benar.
Akan tetapi, jika c pada perhitungan dan grafik berbeda nilai, maka dapat disimpulkan bahwa nilai P pada perhitungan dan grafik juga berbeda. Hal ini sudah dijelaskan, terdapat banyak faktor yang menyebabkan perbedaan nilai c, sehingga menyebabkan perbedaan nilai tekanan atmosfernya.
VI. KESIMPULAN
1. Selisih ketinggian kolom raksa (h) berbanding lurus dengan 1l
2. Tekanan atmosfer berbanding lurus dengan 1l
3. Perbedaan nilai c pada perhitungan dan grafik menyebabkan nilai P atau tekanan atmosfernya berbeda pula
4. Hukum boyle terbukti karena P berbanding terbalik dengan V
5. Apabila volume diperbesar, maka l juga semakin besar. Sehingga, V
berbanding terbalik dengan 1l
6. Hasil percobaan hukum Boyle : a) Percobaan 1, l o=0,20m
17
m± Δm=(0,021±0,001)
Tekanan atmosfernya :
b) Percobaan 2, l o=0,25m
Tekanan atmosfernya :
VII. DAFTAR PUSTAKA
Halliday, Resnick.1985. Fisika. Jakarta : Erlangga.
Staf Laboratorium Fisika Dasar. 2014. Panduan Praktikum Fisika Dasar I. Yogyakarta : Laboratorium Fisika Dasar UGM.
Bueche, Fredenck J. 1998. Seri Buku Schaum Teori dan Soal Fisika Edisi Kedelapan. Bandung : Erlangga
Yogyakarta, 1 Desember 2014
Asisten, Praktikan,
(Limaran K) (Neneng Alif Karlina)
Lampiran
18
Po± ΔPo=(−0,136±0,006) ¯¿
m± Δm=(0,031±0,001)
c ± Δc=(−0,120±0,012)