VIRTUAL SCREENING PEPTIDA BIOAKTIF
ANTIHIPERTENSI DARI HIDROLISAT KASEIN SUSU
KAMBING
SKRIPSI
REZA FEBRIAN
PROGRAM STUDI KIMIA
FAKULTAS SAINS DAN TEKNOLOGI
UNIVERSITAS ISLAM NEGERI SYARIF HIDAYATULLAH
JAKARTA
VIRTUAL SCREENING PEPTIDA BIOAKTIF ANTIHIPERTENSI DARI HIDROLISAT KASEIN SUSU KAMBING
SKRIPSI
Sebagai Salah Satu Syarat untuk Memperoleh Gelar Sarjana Sains Program Studi Kimia
Fakultas Sains dan Teknologi
Universitas Islam Negeri Syarif Hidayatullah Jakarta
Oleh:
REZA FEBRIAN
1111096000040
PROGRAM STUDI KIMIA
FAKULTAS SAINS DAN TEKNOLOGI
UNIVERSITAS ISLAM NEGERI SYARIF HIDAYATULLAH
JAKARTA
PERNYATAAN
DENGAN INI SAYA MENYATAKAN BAHWA SKRIPSI INI ADALAH HASIL KARYA SENDIRI YANG BELUM PERNAH DIAJUKAN SEBAGAI SKRIPSI ATAU KARYA ILMIAH PADA PERGURUAN TINGGI ATAU LEMBAGA MANAPUN. Jakarta, Juli 2018 Reza Febrian NIM: 1111096000040
ABSTRAK
REZA FEBRIAN, Virtual Screening Peptida Bioaktif Antihipertensi Dari Hidrolisat Kasein Susu Kambing di bawah bimbingan SANDRA HERMANTO dan HILYATUZ ZAHROH.
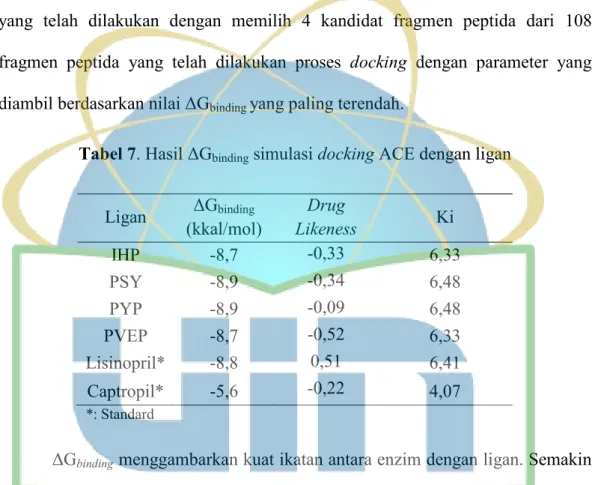
Penelitian mengenai skrining virtual senyawa bioaktif antihipertensi dari sekuen susu kambing telah dilakukan. Enzim Angiotensine Converting Enzyme (ACE) merupakan enzim yang berperan dalam mengatur tekanan darah dalam tubuh. Penghambatan enzim ACE oleh suatu inhibitor dapat menjadi solusi dalam menurunkan tekanan darah. Penelitian ini dilakukan untuk mengetahui aktifitas antihipertensi hidrolisat kasein susu kambing yang dapat menghambat enzim ACE melalui pendekatan in silico. Fragmen peptida bioaktif dihasilkan melalui hidrolisis insilico menggunakan 3 enzim proteolitik (pepsin, tripsin, kimotripsin). Fragmen peptida yang dihasilkan dilakukan skrining melalui studi penambatan molekul ligan terhadap enzim ACE dengan kontrol positif lisinopril (antihipertensi komersial). Penambatan molekul dengan energi bebas (ΔG) terendah diperoleh 4 kandidat ligan yaitu IHP, PYP, PSY dan PVEP dari 108 ligan yang diskrining. Melalui hasil pengujian drug score dan drug likeness diperoleh kandidat ligan dengan nilai terbaik yakni PSY dan PYP. Peptida tersebut mempunyai potensi sebagai kandidat alternatif antihipertensi.
Kata kunci : antihipertensi, Angiotensine Converting Enzyme (ACE), in silico, kasein, molecular docking
ABSTRACT
REZA FEBRIAN, Virtual Screening of Bioactive Peptide from hydrolysates of Goat Milk Casein under the guidance of SANDRA HERMANTO and HILYATUZ ZAHROH.
The research of antihypertensive bioactive compounds from goat milk casein sequences has been done. Angiotensine Converting Enzyme (ACE) was an enzyme played a role in regulating blood pressure in the body. Inhibition of ACE by an inhibitor could be a solution in lowering blood pressure. This study was conducted to determine the antihypertensive activity of goat milk hydrolyzate which was able to inhibit ACE enzyme by in silico approach. Peptide fragments were produced from in silico hydrolysis using 3 proteolytic enzymes (pepsin, trypsin, kimotrypsin). The peptide fragment was screened directly by ACE molecular docking with lisinopril and captropil as positive control (commercial antihypertensive). The virtual screening with the lowest free energy (ΔG) was obtained 4 ligand candidates were IHP, PYP, PSY and PVEP from 108 ligan candidates screened. PSY and PYP were the best scores from the drug score and drug likeness test. Those peptides had great potential as an antihypertensive alternative candidates.
Keywords : Antihypertensive, Angiotensin Converting Enzyme (ACE), casein, in silico, molecular docking
v KATA PENGANTAR
Puji syukur penulis ucapkan kepada Allah SWT atas rahmat dan karunia-Nya. Shalawat serta salam tak lupa penulis sampaikan kepada Nabi Muhammad SAW karena berkat jasa Beliaulah manusia di bawa dari zaman jahiliyah ke zaman yang terang benderang oleh cahaya islam. Alhamdulillah penulis dapat menyelesaikan skripsi penelitian yang berjudul “Virtual Screening Peptida Bioaktif Antihipertensi dari Hidrolisat Kasein Susu Kambing”.
. Skripsi ini tidak mungkin selesai tanpa pihak-pihak yang terus memberikan bimbingan serta dukungannya. Oleh karena itu, penulis menyampaikan banyak terima kasih kepada:
1. Dr. Sandra Hermanto, M.Si., selaku pembimbing I yang telah memberikan bimbingan dan saran kepada penulis selama proses skripsi ini.
2. Hilyatuz Zahroh, M.Si., selaku pembimbing II yang telah memberikan bimbingan dan saran kepada penulis selama proses skripsi ini.
3. Adi Riyadhi, M.Si dan Anna Muawanah, M.Si selaku dosen penguji yang telah banyak memberikan masukan dalam penelitian ini.
4. Drs. Dede Sukandar, M.Si., selaku Ketua Program Studi Kimia Fakultas Sains dan Teknologi UIN Syarif Hidayatullah Jakarta.
5. Dr. Agus Salim, M.Si., selaku Dekan Fakultas Sains dan Teknologi Universitas Islam Negeri Syarif Hidayatullah Jakarta
6. Isalmi Aziz, M.T., selaku Sekretaris Program Studi Kimia Fakultas Sains dan Teknologi UIN Syarif Hidayatullah Jakarta
vi 7. Papa dan Mama yang selalu medo’akan dan tidak mengenal lelah dalam
memberikan dorongan motivasi kepada penulis.
8. Haslinda yang tidak pernah bosan memberikan do’a dan dorongan motivasi kepada penulis.
9. Sahabat-sahabatku Mirna, Alfindah, Irsyad, Syahrullah, Susfa, Asep, Deni dan teman-teman angkatan 2011 kimia yang yang sudah banyak partisipasinya dalam membantu penulis baik secara langsung maupun tidak langsung dan semua pihak yang tidak dapat penulis sebutkan satu per satu.
Skripsi ini tentunya tidak terlepas dari berbagai kekurangan, baik dalam penulisan maupun penyusunannya. Hal ini dikarenakan kurangnya informasi dan keterbatasan ilmu yang dimiliki penulis. Oleh karena itu, saran dan kritik yang membangun sangat diperlukan demi perbaikan penulisan dimasa yang akan datang.
Akhirnya, hanya kepada Allah SWT penulis berserah diri, mudah- mudahan semua bentuk perhatian, bantuan dan partisipasi yang sudah diberikan mendapatkan pahala yang setimpal dari-Nya. Penulis berharap semoga skripsi yang sederhana ini bermanfaat bagi pengembangan ilmu pengetahuan, khususnya dalam bidang Kimia.
Jakarta, Juli 2018
ix DAFTAR ISI
KATA PENGANTAR ………. v
DAFTAR ISI ………. ix
DAFTAR GAMBAR ……… xii
DAFTAR TABEL ………. xiii
DAFTAR LAMPIRAN ……… xiv
BAB I PENDAHULUAN ……… 1 1.1 Latar Belakang ……….. 1 1.2 Rumusan Masalah ………... 5 1.3 Hipotesis Penelitian ………... 5 1.4 Tujuan Penelitian ………... 6 1.5 Manfaat Penelitian ………. 6
BAB II TINJAUAN PUSTAKA ………. 7
2.1 Hipertensi dan Antihipertensi ... 7
2.2 Peptida Bioaktif …... 10 2.3 ACE Inhibitors …... 12 2.4 Susu Kambing ……….……….. 18 2.5 Enzim Proteolitik ……….. 19 2.5.1 Pepsin ……….………... 20 2.5.2 Kimotripsin ……….………..……… 21 2.5.3 Tripsin ……….………..…….. 22
2.6 Peran dan Perkembangan Bioinformatika ……….….. 23
x
2.6.2 Protein Data Bank (PDB) ……….. 25
2.6.3 Molecular Modeling ………... 26
2.6.4 Molecular Docking ………. 27
2.6.5 Autodock Vina ………. 28
2.7 Software PyRx …………...………. 29
2.8 Computer-Aided Drug Discovery and Development (CADDD) ……… 30
2.8.1 In Silico Drug Design ……….. 30
2.8.2 Lipinski’s Rule of Five ………. 32
BAB III METODE PENELITIAN ………. 34
3.1 Waktu dan Tempat Penelitian ... 34
3.2 Alat dan Bahan ... 34
3.2.1 Alat ………... 34
3.2.2 Bahan ……… 35
3.3 Prosedur Kerja Penelitian ... 35
3.3.1 Penyiapan Sekuen Protein Kasein (α S1, α S2, β dan kappa-kasein). 35
3.3.2 Penyiapan Struktur 3D Enzim ACE (Angiotensine Enzyme) ……….. 36
3.3.3 Preparasi File Enzim ACE pra docking ………... 36
3.3.4 Hidrolisis in silico Fragmen Peptide (α S1, α S2, β dan kasein) ...………... 37
3.3.5 Preparasi Ligan (Inhibitor ACE) ………. 38
3.3.6 Simulasi Docking ……… 38
xi
BAB IV HASIL DAN PEMBAHASAN ……… 40
4.1 Penyiapan Sekuen Protein Kasein (α S1, α S2, β dan kappa-kasein) …. 40 4.2 Pencarian Struktur 3D ACE (Angiotensine Converting Enzyme) ……. 41
4.3 Preparasi File Enzim ACE pra docking …….………. 43
4.4 Hasil Hidrolisis in silico Fragmen Peptida (α S1, α S2, β dan kappa- kasein) ………. 44
4.5 Perancangan dan Preparasi File Ligan (Inhibitor ACE) ………. 47
4.6 Simulasi Docking ACE dengan Ligan ……… 49
4.7 Visualisasi Hasil Docking ……… 51
4.8 Drug Screening dan Analisis Drug Scan ………. 57
BAB V PENUTUP……….……….. 59
5.1 Kesimpulan ……….. 59
5.2 Saran ………. 59
DAFTAR PUSTAKA ……….. 60
xii DAFTAR GAMBAR
Gambar 1. Struktur 3D enzim ACE ………... 13
Gambar 2. Sintesis pembuatan kartropil ……… 15
Gambar 3. ACE inhibitor yang digunakan sebagai obat antihipertensi ….… 16 Gambar 4. Mekanisme ACE-inhibitors menghambat angiotensin I menjadi Angiotensin II inaktif yang aktif ……….. 17
Gambar 5. Struktur 3D Enzim Pepsin ……… 21
Gambar 6. Struktur 3D Enzim Kimotripsin ………... 22
Gambar 7. Struktur 3D Tripsin ………... 23
Gambar 8. Struktur 3D enzim ACE dalam keadaan kompleks enzim ACE dengan lisinopril ………... 42
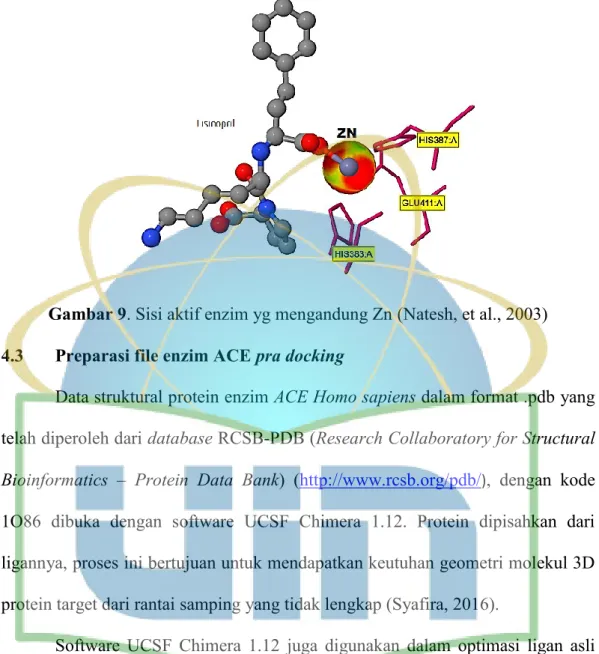
Gambar 9. Sisi aktif yg mengandung Zn ……… 43
Gambar 10. Hasil Preparasi Struktur 3D Enzim ACE ..………. 44
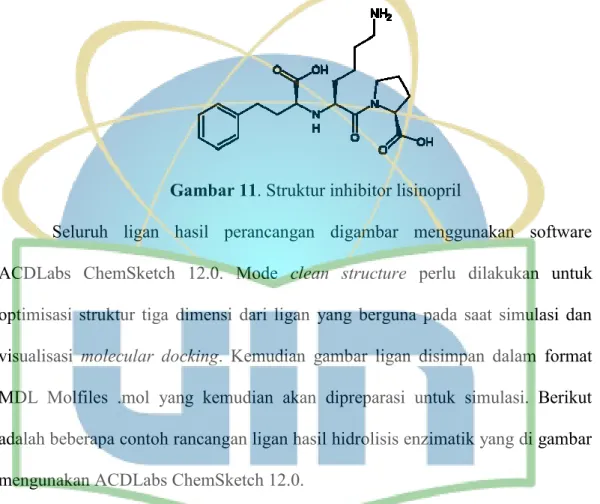
Gambar 11. Struktur inhibitor lisinopril ……….……… 48
Gambar 12. Visualisasi hasil interaksi simulasi docking ACE dengan (a) lisinopril dan (b) captropil ………. 52
Gambar 13. Visualisasi hasil interaksi enzim ACE dengan fragmen peptida (PYP) ……… 54
Gambar 14. Visualisasi hasil interaksi enzim ACE dengan fragmen peptida (PSY) ……….……….. 55
xiii DAFTAR TABEL
Tabel 1. Sofware yang digunakan sebagai simulasi docking …………... 34
Tabel 2. Software yang dapat diakses secara online ………... 35
Tabel 3. Sumber kasein berdasarkan tipe dan nomor ………... 36
Tabel 4. Hasil Hidrolisis Proteolitik Enzim Pepsin ……….. 45
Tabel 5. Hasil Hidrolisis Proteolitik Enzim Kimotripsin ………. 46
Tabel 6. Hasil Hidrolisis Proteolitik Enzim Tripsin ………. 46
Tabel 7. Hasil ΔGbinding simulasi docking ACE dengan ligan ……….. 50
Tabel 8. Hasil Interaksi yang Terjadi antara Ligan dan ACE ……….. 56
Tabel 9. Hasil prediksi ligan kandidat peptida berdasarkan Lipinski's Rule of Five ………. 58
xiv DAFTAR LAMPIRAN
Lampiran 1. Bagan Alir Penelitian ……… 68 Lampiran 2. Kandidat Fragmen Peptida Bioaktif Hasil Hidrolisis ……….... 69 Lampiran 3. Superposisi 4 Residu Terbaik dengan Kontol Positif …..……. 84 Lampiran 4. Hasil simulasi docking menggunakan software PyRx ……….. 86 Lampiran 5. Gambar Interaksi antara Enzim ACE dengan Ligan …………. 88 Lampiran 6. Jenis-jenis ikatan yang terbentuk dan posisi pengikatan pada
interaksi intermolekul ……….. 90 Lampiran 7. Hasil Perhitungan Konstanta Inhibitor (Ki) ..……….. 93 Lampiran 8. Tampilan Perangkat Lunak ………... 97
1 BAB I
PENDAHULUAN
1.1 Latar Belakang
Salah satu penyakit yang banyak diderita oleh masyarakat modern terutama yang tinggal di perkotaan adalah tekanan darah tinggi. Tekanan darah tinggi atau hipertensi menjadi salah satu faktor utama penyebab stroke, serangan jantung, dan gagal ginjal (Zuraidah, et al. 2012). Bahkan akibat terburuk dari penyakit ini adalah kematian. Penyakit darah tinggi dapat disebabkan oleh berbagai faktor misalnya karena konsumsi garam, kolesterol, alkohol, dan kafein yang berlebihan. Faktor lainnya yang menjadi pemicu penyakit hipertensi adalah kurangnya olahraga dan obesitas serta faktor genetik (turunan) dan faktor usia yang tidak bisa dikendalikan (Zuraidah, et al. 2012).
Angiotensine converting enzyme (ACE) adalah enzim kunci yang berperan
dalam mengatur tekanan darah pada manusia. ACE mengkatalis hidrolisis dekapeptida angiotensin inaktif menuju vasokonstriktor angiotensin II, suatu oktapeptida yang berperan dalam mengatur tekanan darah. Selain itu, ACE juga akan memotong bradikinin yang pada suatu vasodilator menjadi fragmen tidak aktif sehingga akan menaikan tekanan darah.Beberapa pengobatan hipertensi dewasa ini sebagian besar memberikan efek protektif terhadap organ (Parmley, 1998). Lebih dari 10 jenis inhibitor ACE sintetik saat ini telah tersedia di berbagai negara sebagai agen monotherapeutic (Brown dan Vaughan, 1998).
2 Penggunaan obat-obat sintetik antihipertensi sebagian besar ternyata mengandung risiko dan dapat menyebabkan beberapa efek samping antara lain seperti hipotensi, penurunan fungsi ginjal, batuk kering dan kelainan janin. Hal ini telah mendorong para peneliti untuk mencari alternatif inhibitor ACE alami yang dampaknya relatif kecil dan tidak beresiko serta tidak menimbulkan ketergantungan. Beberapa agen inhibitor ACE alami yang telah banyak diteliti antara lain bersumber dari protein hewani dan protein nabati (Ariyoshi, 1993). Protein susu merupakan salah satu sumber peptida bioaktif yang dapat berfungsi sebagai antihipertensi. Peptida ini dapat dipisahkan melalui hidrolisis enzimatik dengan enzim proteolitik dan atau melalui fermentasi dengan bakteri asam laktat (FitzGerald et al., 2004).
Beberapa peptida bioaktif susu mampu menghambat aktifitas ACE secara
in vitro dan in vivo (Nakamura et al., 1995; Maeno et al., 1998; Abubakar et al.,
1998; Pihlanto-Leppala et al., 2000). Fragmen peptida seperti Val-Pro-Pro dan Ile-Pro-Pro memiliki sifat antihipertensi pada hewan dan manusia (Nakamura et
al., 1995).
Penelitian yang telah dilakukan oleh Lee, et al. (2005) menyebutkan bahwa hidrolisat kasein susu kambing yang dihidrolisis menggunakan enzim proteolitik pepsin selama 48 jam menunjukkan aktifitas penghambatan ACE sebesar 87.8% sedangkan dengan enzim papain menghasilkan aktifitas penghambatan sebesar 80.3% setelah dihidrolisis selama 60 jam. Penelitian lainnya yang dilakukan Geerlings, et al. (2006) menghasilkan tiga peptida inhibitor ACE yang potensial, dengan sekuen asam amino TGPIPN, SLPQ dan
3 SQPK dengan nilai IC50 masing-masing 316, 330 dan 354 µmol/L. Berdasarkan
hasil pengujian secara in vivo terbukti ketiganya memiliki kemampuan dalam mengendalikan aktifitas ACE dalam menurunkan tekanan darah pada jaringan hati, ginjal dan pembuluh aorta pada hewan percobaan.
Al-Qur’an surat Al-Mu’minun ayat 21
Artinya: “Dan sesungguhnya pada binatang-binatang ternak, benar-benar terdapat pelajaran yang penting bagi kamu, Kami memberi minum kamu dari air susu yang ada dalam perutnya, dan (juga) pada binatang-binatang ternak itu terdapat faedah yang banyak untuk kamu, dan sebagian darinya kamu makan”.
Berdasarkan ayat Al-Quran di atas, susu kambing merupakan produk hasil ternak yang mempunyai potensi cukup baik untuk dimanfaatkan sebagai sumber makanan yang kaya nutrisi dan mempunyai berbagai komponen senyawa aktif yang potensial sebagai peptida fungsional.
Pengujian secara in silico dilakukan dengan mengeksplorasi protein utama susu kambing yaitu kasein α, β, κ dan mengidentifikasi fragmen-fragmen peptida hasil hidrolisis enzimatik yang dilakukan melalui simulasi hidrolisis secara in
4 yang merupakan tahap awal skrining untuk mengindentifikasi fragmen peptida yang potensial sebagai antihipertensi. Lisinopril digunakan sebagai kontrol positif. Penelitian yang dilakukan oleh Priyanto, et al. (2015) menyebutkan bahwa aktifitas inhibitor ACE yang dilakukan secara in silico menggunakan peptida dari biji melon menghasilkan dua senyawa terbaik yaitu VY-7 dan VG-8 dengan masing-masing menghasilkan nilai IC50 terbaik 8,64 ± 0,60 μM dan 13.30 ± 0.62
μM.
Penelitian ini menggunakan tiga jenis enzim proteolitik yaitu pepsin, tripsin dan kimotripsin. Dasar pemilihan ketiga jenis enzim tersebut adalah karena pepsin, tripsin dan kimotripsin merupakan komponen enzim proteolitik yang terdapat dalam sistem pencernaan manusia, sehingga diharapkan hasil hidrolisis enzimatik tersebut akan menghasilkan peptida bioaktif yang tetap memiliki aktifitas fisiologis khususnya ketika diaplikasikan secara in vivo dan mampu diserap dalam usus halus untuk selanjutnya didistribusikan melalui sistem pembuluh darah sebagai agen antihipertensi. Identifikasi peptida bioaktif yang dapat dijadikan kandidat obat antihipertensi (drug lead) dilakukan melalui pengujian drug scan dan drug screening dengan menggunakan druglikeness dan
drugscore berdasarkan Lipinski’s Rule of Five dari senyawa tersebut.
1.2 Rumusan Masalah
Rumusan masalah dari penelitian ini adalah:
1. Bagaimanakah potensi hidrolisat protein kasein susu kambing hasil hidrolisis in silico sebagai sumber peptida bioaktif melalui pendekatan
5 2. Apakah enzim proteolitik (pepsin, tripsin, kimotripsin) mampu menghasilkan hidrolisat dengan daya inhibisi yang lebih baik terhadap enzim ACE dibandingkan dengan lisinopril dan captopril?
3. Bagaimana karakteristik peptida bioaktif terbaik sebagai kandidat obat antihipertensi berdasarkan nilai druglikeness dan drug score?
1.3 Hipotesis Penelitian Hipotesis dari penelitian ini adalah:
1. Hidrolisis protein kasein dari susu kambing secara in silico dengan menggunakan enzim proteolitik (pepsin, tripsin dan kimotripsin) akan menghasilkan fragmen-fragmen peptida dengan sekuen asam amino yang berbeda-beda. Fragmen dengan sekuen asam amino spesifik ini mampu menjadi inhibitor potensial bagi aktifitas enzim ACE sebagai agen antihipertansi.
2. Enzim proteolitik (pepsin, tripsin, kimotripsin) yang digunakan dalam penelitian ini mampu menghasilkan peptida bioaktif dengan daya inhibisi yang lebih baik terhadap enzim ACE dibandingkan dengan obat lisinopril berdasarkan kajian molecular docking.
3. Karakteristik peptida bioaktif yang dihasilkan dari hidrolisis secara in
silico memenuhi standar uji druglikeness dan uji drugscore.
1.4 Tujuan Penelitian Tujuan dari penelitian ini adalah:
1. Mengeksplorasi potensi hidrolisat kasein susu kambing sebagai sumber peptida antihipertensi melalui pendekatan in silico.
6 2. Menguji aktifitas penghambatan enzim ACE oleh peptida bioaktif yang diperoleh dari hidrolisis proteolitik kasein susu kambing dengan menggunakan pepsin, tripsin dan kimotripsin melalui pendekatan
molecular docking.
3. Mengidentifikasi karakteristik fragmen peptida bioaktif yang potensial sebagai agen antihipertensi berdasarkan nilai druglikeness dan drug
score.
1.5 Manfaat Penelitian
Penelitian yang dilakukan ini diharapkan memberikan gambaran tentang potensi hidrolisat kasein dari susu kambing yang nantinya dapat dikembangkan sebagai produk pangan fungsional yang aman, murah dan mampu mengurangi ketergantungan terhadap obat-obat komersial sintetik pada penderita tekanan darah tinggi (hipertensi).
7 BAB II
TINJAUAN PUSTAKA
2.1 Hipertensi dan Antihipertensi
Hipertensi adalah keadaan peningkatan tekanan darah yang memberi gejala yang akan berlanjut untuk suatu target organ seperti stroke (untuk otak), penyakit jantung koroner (untuk pembuluh darah jantung) dan left ventricle
hypertrophy (untuk otot jantung). Dengan target organ di otak yang berupa stroke,
hipertensi adalah penyebab utama stroke yang membawa kematian tinggi (Bustan, 2000).
Menurut Hull (1996), Hipertensi adalah desakan darah yang berlebihan dan hampir konstan pada pembuluh arteri. Tekanan dihasilkan oleh kekuatan jantung ketika memompa darah. Hipertensi berkaitan dengan kenaikan tekanan diastolik, tekanan sistolik, atau kedua-duanya secara terus-menerus. Tekanan sistolik berkaitan dengan tingginya tekanan pada arteri bila jantung berkontraksi (denyut jantung). Ini adalah tekanan maksimum dalam arteri pada suatu saat dan tercermin pada hasil pembacaan tekanan darah sebagai tekanan atas yang nilainya lebih besar (misalnya 120/80 mmHg, angka 120 menunjukkan nilai tekanan darah sistolik). Tekanan diastolik berkaitan dengan tekanan dalam arteri bila jantung berada dalam keadaan relaksasi di antara dua denyutan. Ini adalah tekanan minimum dalam arteri pada suatu saat dan tercermin dari hasil pemeriksaan
8 tekanan darah sebagai tekanan bawah yang nilainya lebih kecil (misalnya 120/80 mmHg, angka 80 menunjukkan nilai tekanan darah diastolik).
Tekanan sistolik dan diastolik dapat bervariasi pada berbagai individu. Tetapi umumnya disepakati bahwa hasil pengukuran tekanan darah yang sama atau lebih besar dari 140/90 mmHg adalah khas untuk hipertensi (WHO, 1999). Berdasarkan penyebabnya hipertensi dibagi menjadi dua, yaitu:
1. Hipertensi essensial atau primer. Jenis hipertensi yang penyebabnya masih belum dapat diketahui. Sekitar 90% penderita hipertensi menderita jenis hipertensi ini. Oleh karena itu, penelitian dan pengobatan lebih banyak ditujukan bagi penderita hipertensi essensial ini.
2. Hipertensi sekunder. Jenis hipertensi yang penyebabnya dapat diketahui, antara lain kelainan pada pembuluh darah ginjal, gangguan kelenjar tiroid, atau penyakit kelenjar adrenal (Arief, 2008).
Hampir seluruh penderita hipertensi tergolong hipertensi esensial (96-99%) dan hanya sebagian kecil saja penderita hipertensi sekunder (1-4%), dari hipertensi sekunder ini hanya 50% secara klinis dapat dibuktikan penyebabnya (Darmojo, 2001).
Antihipertensi adalah obat-obatan yang digunakan untuk mengobati hipertensi. Antihipertensi juga diberikan pada individu yang memiliki resiko tinggi untuk terjadinya penyakit kardiovaskular dan mereka yang beresiko terkena stroke maupun serangan jantung. Pemberian obat bukan berarti menjauhkan individu dari modifikasi gaya hidup yang sehat seperti mengurangi berat badan,
9 mengurangi konsumsi garam dan alkohol, berhenti merokok, mengurangi stress dan berolahraga (Nelson, 2010).
Pemberian obat perlu dilakukan segera pada pasien dengan tekanan darah sistolik ≥ 140/90 mmHg. Pasien dengan kondisi stroke atau miokard infark ataupun ditemukan bukti adanya kerusakan organ tubuh yang parah (seperti mikro albuminuria, hipertrofi ventrikel kiri) juga membutuhkan penanganan segera dengan antihipertensi (Nelson, 2010).
Pada dasarnya pengobatan dengan antihipertensi itu penting agar pasien dapat mencapai tekanan darah yang dianjurkan. Level tekanan darah yang diharapkan pada pasien hipertensi yang tidak disertai komplikasi adalah 140/90 mmHg atau lebih rendah bila memungkinkan, sedangkan pada pasien mengalami insiden kerusakan organ akhir atau kondisi seperti diabetes, level tekanan darah yang diharapkan adalah 130/90 mmHg, dan pada pasien proteinuria (>1 g / hari) diharapkan tekanan darah di bawah 150/75 mmHg (Nelson, 2010). Adapun tujuan pemberian antihipertensi yakni: (Ferder et al., 1987 and Shetty, 2003)
1. Mengurangi insiden gagal jantung dan mencegah manifestasi yang muncul akibat gagal jantung.
2. Mencegah hipertensi yang akan tumbuh menjadi komplikasi yang lebih parah dan mencegah komplikasi yang lebih parah lagi bila sudah ada.
3. Mengurangi insiden serangan serebrovaskular dan akutnya pada pasien yang sudah terkena serangan serebrovaskular.
10 4. Mengurangi mortalitas fetal dan perinatal yang diasosiasikan dengan
hipertensi maternal. 2.2 Peptida Bioaktif
Peptida bioaktif didefinisikan sebagai komponen zat makanan yang berasal dari atau dihasilkan melalui proses hidrolisis protein dan mampu memberikan efek fisiologis dalam tubuh (Korhonen and Pihlanto, 2006). Peptida bioaktif umumnya merupakan fragmen protein yang dihasilkan melalui sistem pencernaan dengan menggunakan enzim proteolitik spesifik dan atau melalui fermentasi. Beberapa peptida biasanya tetap dalam keadaan dormant sampai akhirnya diproses oleh protease spesifik. Enzim proteolitik pencernaan melepaskan peptida yang telah dihidrolisis menjadi fragmen yang lebih sederhana yang memberikan efek biologis yang spesifik (Hettiarachchy, et al, 2012). Beberapa jenis peptida bioaktif umumnya terdiri dari 2-20 residu asam amino walaupun ada beberapa yang memiliki panjang lebih dari 20 residu. Peptida bioaktif ini diserap dalam usus halus dan disebarkan melalui sistem pembuluh darah sehingga mereka memiliki efek fisiologis tertentu dalam sistem metabolisme atau memiliki efek khusus dalam membantu sistem pencernaan yang ada di usus halus (Vermeirssen, et al. 2007).
Penelitian awal tentang peptida bioaktif dimulai pada 1950-an, dimana awalnya para peneliti dan ahli teknologi pangan memusatkan perhatian mereka pada peptida yang mampu mengaktifkan reseptor rasa. Kemudian pada tahun 1978, Yamasaki dan Maekawa (1978), mengisolasi “peptida lezat” dari hasil
11 hidrolisis daging sapi menggunakan papain yang memberikan rasa kaldu yang khas. Isolasi peptida bioaktif dilakukan dengan teknik gel filtrasi, kromatografi pertukaran ion, elektroforesis dan degradasi Edman untuk menentukan urutan peptida tersebut. Penelitian peptida bioaktif lebih lanjut diarahkan pada korelasi antara aspek kesehatan dan diet. Protein zat gizi memainkan peran penting dalam pencegah berbagai penyakit, dan mengoptimalkan fungsi kesehatan manusia (Mils
et al. 2011).
Peptida yang bersifat antihipertensi telah ditemukan dalam produk olahan susu (keju, susu, dll). Laktotripeptida isoleusin-prolin-prolin (Ile-Pro-Pro) dan valin-prolin-prolin (Val-Pro-Pro) diperoleh dari susu asam. Juga dari beberapa keju yang berasal dari Swiss mengandung tripeptida yang sama. Konsentrasi Ile-Pro-Pro dan Val-Ile-Pro-Pro meningkatkan dalam proses pematangan, mencapai 100 mg/kg setelah 4-7 bulan. Fraksi whey (dadih) seperti produk yoghurt ditemukan mengandung dipeptida Tyr-Pro, yang menunjukkan efek antihipertensi yang signifikan pada tikus hipertensi (spontaneously hypertensive rats -SHR) (Sharma
et al, 2011).
Hidrolisis kasein dengan pepsin menghasilkan peptida yang memberikan efek antihipertensi. Peptida ini bersifat sebagai ACE-inhibitor. Kontrol tekanan darah sebagian berhubungan dengan sistem rennin-angiotensin. Angiotensine
converting enzyme (ACE) adalah ectoenzyme multifungsi yang terletak di jaringan
yang berbeda dan memainkan peranan penting dalam pengaturan tekanan darah. Renin bekerja pada angiotensinogen, prekursor inaktifasi, yang melepaskan dekapeptida angiotensin I. ACE selanjutnya akan menghilangkan dipeptida HL
12 pada C-terminal dari Angiotensin I mengakibatkan pembentukan Angiotensin II, suatu vasokonstriktor kuat. ACE juga menghilangkan dipeptida C-terminal dari bradikinin (vasodilator kuat) mengakibatkan pembentukan fragmen peptida inaktif. ACE inhibitor yang berasal dari protein susu merupakan fragmen casokinins (kasein) atau lactokinins (dadih). Dua peptida ACE-inhibitor yang ampuh dari β-kasein, F84-F86, yang sesuai dengan Val-Pro-Pro, dan F74-F76, yang sesuai dengan Ile-Pro-Pro dan satu peptida dari k-kasein, F108-F110, yang sesuai dengan Ile-Pro-Pro yang dimurnikan dari minuman ringan Jepang "Calpis" yang terbuat dari susu skim sapi yang difermentasi dengan Lactobacillus
helveticus dan Saccharomyces cerevisiae (Sharma et al, 2011).
2.3. Struktur 3D Enzim ACE dan ACE Inhibitors
Struktur enzim ACE pertama kali ditentukan dari struktur kompleks inhibitor dengan enzim ACE yakni kompleks ACE dengan Lisinopril yang telah dilaporkan oleh Natest et al., (2003) yang ditentukan dari struktur kristal enzim tersebut. Telah diketahui bahwa struktur enzim terdiri dari 27 heliks (96% dari total residu asam amino) dan 6 struktur β-strands. Bentuk struktur enzim secara 3D membentuk struktur ellipsoid (dengan dimensi rata-rata 72 × 52 × 48 Å) dengan jarak residu kontak ke pusat aktif sebesar 30 Å dan dibagi menjadi dua sub-domain (Gambar 1).
13 Gambar 1. Struktur 3D enzim ACE (Natesh, 2003)
Bagian rongga diisi oleh empat heliks dan satu β-strand. Tiga dari struktur heliks berisi residu asam amino yang bermuatan dan membatasi akses polipeptida yang lebih besar ke arah sisi aktif enzim. Dua ion klorida terikat untuk bagian dalam enzim yang berdekatan dengan sisi aktif enzim yang mengandung ion Zn (II). Sisi aktif yang mengandung Zn(II) terikat pada HEXXH + E motif (His 383, His 387 and Glu 411) dan satu molekul air yang berikatan koordinasi pada posisi keempat.
Penghambat ACE merupakan senyawa yang membantu mengontrol tekanan darah. Penghambat ACE mencegah enzim untuk memproduksi angiotensin II yang dapat menyebabkan penyempitan pembuluh darah sehingga meningkatkan tekanan darah. Hal ini dapat menyebabkan tekanan darah tinggi dan membuat jantung bekerja lebih keras. Penghambat ACE sendiri dapat membantu merelaksasikan pembuluh darah. Oleh karena itu penghambatan ACE menjadi target utama dalam antihipertensi (Padmawinata, 1996).
ACE juga memiliki peranan dalam mengatur tekanan darah serta aliran dan keseimbangan garam pada mamalia. ACE akan mengubah dekapeptida pada
14 angiotensin I yang tidak aktif, menjadi vasokonstriktor (senyawa yang menyebabkan penyempitan pembuluh darah) yang kuat, yaitu oktapeptida pada angiotensin II. ACE nantinya akan menginaktivasi bradikinin, suatu peptida vasodilatory (senyawa yang memperlambat aliran darah sehingga mengakibatkan tekanan darah menjadi turun) (Vercruysse, et al., 2005). Penghambat ACE harus tetap digunakan walaupun tekanan darah sudah mencapai normal karena hipertensi tidak memiliki gejala yang spesifik. Penghambat ACE tidak dapat menyembuhkan hipertensi, akan tetapi hanya dapat mengontrol hipertensi dengan terapi jangka panjang (Warfield, 1996).
Perubahan angiotensin I menjadi angiotensin II tidak saja terjadi di paru-paru, namun ACE ditemukan pula di sepanjang jaringan epitel pembuluh darah (Oates, 2001). Mekanisme aksi ACE-inhibitor (enalapril, lisinopril, captopril dan sebagainya) yaitu dengan menghambat konversi angiotensin I inaktif menjadi angiotensin II yang aktif (vasokonstriktor poten). Selanjutnya mengubah aktivitas RAAS dan menghambat efek biologis angiotensin II (seperti meningkatkan tekanan darah dan sekresi aldosteron, menurunkan sekresi renin dan natriuresis, meningkatkan aktivitas saraf simpatetis, proliferasi sel-sel dan hypertrophi (Kostova, et al. 2005).
Pada tahun 1960, para ilmuwan mempelajari the renin-angiotensin system (RAS) dan kallikrein-kinin system (KKS) menyadari bahwa penghambatan ACE penting untuk pengobatan. Sebuah terobosan dicapai pada tahun 1965 ketika Ferreira untuk pertama kalinya menjelaskan bahwa racun ular Bothrops jararaca menunjukkan beberapa aktivitas potensial bradikinin. Pada tahun 1968, Bakhle
15 menemukan bahwa ekstrak yang sama menghambat pembentukan Ang II dari Ang I in vitro. Dua tahun kemudian, Ng dan Vane melakukan pengujian secara in
vivo efek ACE inhibitor dari racun ular. Ekstrak racun pertama kali dimurnikan di
Lembaga Penelitian Medis Squibb dan ACE inhibitor yang paling ampuh diidentifikasi sebagai nonapeptida (teprotide) (Ferreira, et al. 1970, Ondetti, et al., 1971). Nonapeptida ini diberikan secara intravena sebagai antihipertensi. Namun, pemberian secara oral peptida ini tidak mungkin. Hal ini menyebabkan pencarian untuk antihipertensi lisan berkorelasi dengan struktur dan aktivitas bisa ular.
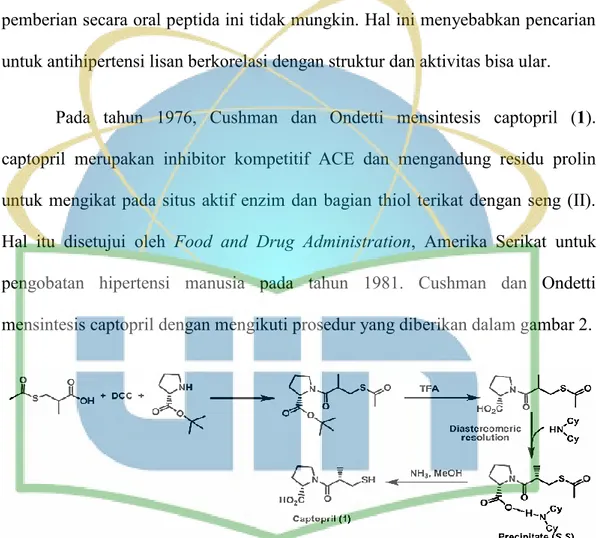
Pada tahun 1976, Cushman dan Ondetti mensintesis captopril (1). captopril merupakan inhibitor kompetitif ACE dan mengandung residu prolin untuk mengikat pada situs aktif enzim dan bagian thiol terikat dengan seng (II). Hal itu disetujui oleh Food and Drug Administration, Amerika Serikat untuk pengobatan hipertensi manusia pada tahun 1981. Cushman dan Ondetti mensintesis captopril dengan mengikuti prosedur yang diberikan dalam gambar 2.
Gambar 2. Sintesis pembuatan captopril (Cushman, et al., 1977)
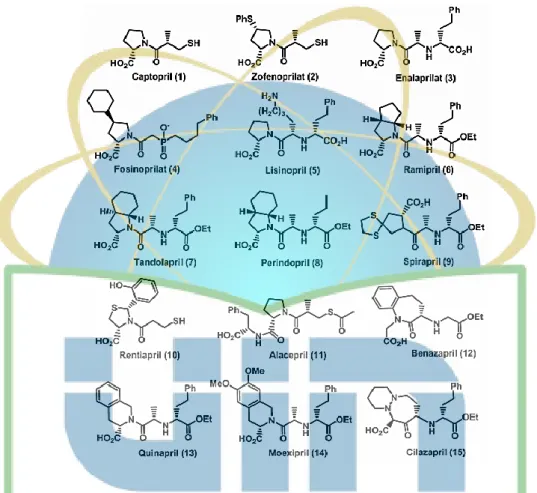
Sejak penemuan captopril, beberapa senyawa yang terkait seperti zofenopril (2), enalapril (3), fosinopril (4), lisinopril (5), ramipril (6), tandolapril
16 (7), perindopril (8), spirapril (9), rentiapril (10), alacepril (11), benzapril (12), quinapril (13), moexipril (14), cilazapril (15) dikembangkan sebagai inhibitor ACE atas dasar-struktur berbasis desain obat dan berhasil digunakan sebagai obat antihipertensi. Sebagian besar inhibitor ini mengandung prolin atau turunan residu seperti yang ditunjukkan pada Gambar 3.
Gambar 3. ACE inhibitor yang digunakan sebagai obat antihipertensi (Cushman,
et al., 1977).
ACE-inhibitor merupakan obat unggulan untuk penyakit kardiovaskular, terutama dalam memperbaiki fungsi dan anatomi pembuluh darah arteri, memperbaiki fungsi endotel, meregresi tunika media, meregresi dan menstabilkan plak aterosklerosis (Sargowo, 1999). Obat-obatan yang termasuk dalam ACE
17 inhibitor tersebut bekerja dengan penghambat efek angiotensin II yang bersifat sebagai vasokonstriktor. Selanjutnya ACE menyebabkan degradasi bradikinin menjadi peptida inaktif atau dalam pengertian bradikinin tidak diubah. Dengan demikian peranan ACE pada hipertensi yaitu meningkatkan kadar bradikinin yang memberikan kontribusi sebagai vasodilatator untuk ACE-inhibitor. Akibat vasodilatasi maka menurunkan tahanan pembuluh peripheral, preload dan
afterload pada jantung sehingga tekanan darah dapat diturunkan (Taddei, et al.
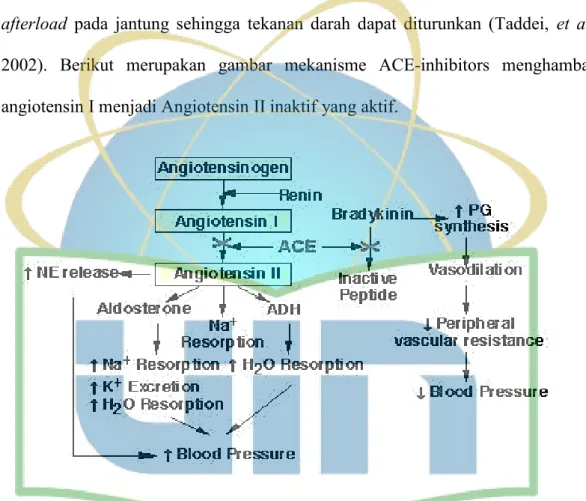
2002). Berikut merupakan gambar mekanisme ACE-inhibitors menghambat angiotensin I menjadi Angiotensin II inaktif yang aktif.
Gambar 4. Mekanisme ACE-inhibitors menghambat angiotensin I menjadi Angiotensin II inaktif yang aktif
(Sumber :www.ovc.uoguelph.ca/BioMed/Courses/Public/Pharmacology/pharmsit e/98-309/Cardio/Hypertension/hypertension_note.html)
18 2.4 Susu kambing
Susu adalah cairan berwarna putih yang disekresikan oleh kambing pada binatang mamalia betina, untuk bahan makanan dan sumber gizi bagi anaknya (Winarno, 1993). Susu adalah cairan yang bernilai gizi tinggi, baik untuk manusia maupun hewan muda dan cocok untuk media tumbuh mikroorganisme karena menyediakan berbagai nutrisi (Susilorini dan Sawitri, 2006). Susu segar yang berkualitas baik mempunyai ciri-ciri tidak memiliki aroma yang kuat,ada sedikit rasa manis dari laktosa (gula susu), warnanya putih sampai sedikit kekuningan (akibat larutan zat karoten dalam lemak susu), belum terpisahnya lemak dengan bagian susu yang lain,tidak terdapat lendir, serta tidak ada penggumpalan protein susu yang sering terjadi jika susu mulai mengalami proses pengasaman (Gaman dan Sherrington, 1992). Susu kambing tidak mengandung kuman TBC (tuberkulosis) dan bahan allergen sehingga lebih aman penggunaannya sebagai bahan makanan, pengganti ASI (air susu ibu). Produksi susu kambing lebih cepat diperoleh dimana kambing telah dapat berproduksi pada usia 1.5 tahun,sedangkan sapi baru dapat berproduksi pada usia 3 - 4 tahun (Susilorini dan Sawitri, 2006).
Kasein dan protein whey merupakan komponen untuk protein yang terdapat di dalam susu. Protein whey memiliki struktur globular dengan komposisi utama didominasi oleh struktur heliks dengan karakteristik residu asam amino (asam, basa, hidrofobik dan hidrofilik) yang hampir sama. Sedangkan kasein memiliki karakteristik yang lebih unik dimana sebagian besar struktur
19 monomer sub-unitnya didominasi oleh residu hidrofilik dan hidrofobik (Swaisgood, 1992).
Kasein dalam susu merupakan partikel yang besar. Di dalamnya tidak saja terdiri dari zat-zat organik melainkan mengandung juga zat-zat anorganik seperti kalsium dan fosfor, di samping itu juga magnesium dan sitrat di dalam jumlah lebih kecil. Kasein dapat diendapkan pada pH 4,6 karena pH tersebut merupakan titik isoelektrisnya. Tetapi protein lain, pada pH tersebut tidak mengendap. Stabilitas kasein mulai terganggu pada pH 5,3. Kasein juga merupakan senyawa amfoter yang dapat bereaksi dengan asam maupun basa karena molekulnya mempunyai muatan baik positif maupun negatif. Pada titik isoelektris muatan positif dan negatif sama. Pada pH di atas titik isoelektriknya, protein tersebut bermuatan negatif. Oleh karena itu pada elektroforesis molekulnya akan bergerak ke elektroda yang bermuatan positif. Begitu sebaliknya pada pH di bawah titik isoelektris, protein mempunyai muatan positif, dan akan bergerak ke elektroda yang bermuatan negatif. Kasein tidak mengalami hidrasi, oleh karena itu pada titik isoelektriknya mudah sekali di endapkan. Pengendapan kasein dapat juga dijalankan dengan enzim proteolitik semacam enzim pepsin dan ficin (Belitz, et
al., 2009).
2.5 Enzim Proteolitik
Enzim proteolitik (proteolytic enzymes) atau disebut juga Proteinase atau Protease, merupakan kelompok enzim yang mampu memecah rantai panjang molekul protein menjadi molekul-molekul yang lebih kecil disebut peptida dan
20 bahkan sampai menjadi komponen-komponen terkecil penyusun protein yang disebut asam amino. Di dalam tubuh manusia enzim proteolitik diproduksi oleh pankreas. Tripsin (trypsin) adalah salah satu enzim yang diproduksi oleh pankreas dan disekresikan dalam keadaan inaktif (inactive). Mekanisme sekresi enzim seperti ini berfungsi untuk mencegah terjadinya autodigestion pancreas atau untuk melindungi pankreas dari aktivitas proteolitik enzim tersebut (Rao, et al, 1998).
2.5.1 Pepsin
Pepsin adalah enzim yang memecah protein menjadi peptida yang lebih kecil (yaitu protease). Pepsin diproduksi di perut dan merupakan salah satu enzim pencernaan utama dalam sistem pencernaan manusia dan banyak hewan lainnya, yang membantu mencerna protein dalam makanan. Pepsin memiliki struktur tiga dimensi (gambar 4), yang satu atau lebih rantai polipeptida berputar dan lipat, menyatukan sejumlah kecil asam amino untuk membentuk situs aktif, atau lokasi pada enzim dimana substrat berikatan dan reaksinya terjadi. Selama proses pencernaan, enzim pepsin memiliki spesialisasi dalam memutuskan hubungan antara jenis asam amino tertentu untuk memecah protein makanan menjadi peptida-peptida agar dapat diserap oleh usus kecil. Pepsin paling efisien dalam membelah ikatan peptida antara asam amino hidrofobik dan lebih disukai gugus aromatik seperti fenilalanin, triptofan, dan tirosin (Dunn, 2001).
21 Pepsin menunjukkan aktivitas maksimal pada pH 2.0 dan tidak aktif pada pH 6.5 dan yang lebih tinggi, namun pepsin tidak sepenuhnya didenaturasi atau dimatikan secara ireversibel sampai pH 8,0 (Johnston, et al, 2006).
Gambar 5. Struktur 3D Enzim Pepsin (Fujinaga, 1995) 2.5.2 Kimotripsin
Kimotripsin adalah enzim proteolitik (Serine protease) yang bekerja dalam sistem pencernaan. Kimotripsin memfasilitasi pembelahan ikatan peptida dengan reaksi hidrolisis, walaupun secara termodinamika terjadi sangat lambat tanpa katalis. Substrat utama dari kimotripsin meliputi triptofan, tirosin, fenilalanin, dan leusin, yang dibelah pada terminal karboksil. Seperti banyak protease, kimotripsin juga akan menghidrolisis ikatan amida secara in vitro. Kimotripsin memotong ikatan peptida dengan menyerang kelompok karbonil yang tidak reaktif dengan nukleofil kuat (Petsko, et al, 2009).
22 Gambar 6. Struktur 3D Enzim Kimotripsin (Freer, et al, 1970)
2.5.3 Tripsin
Tripsin adalah suatu protease yang dapat menghidrolisis protein menjadi peptida yang lebih kecil. Tripsin adalah bagian dari sistem pencernaan yang mendegradasi protein atau bisa dikenal sebagai protease. Tripsin yang awalnya disintesis di pankreas dalam bentuk yang dikenal sebagai tripsinogen, sebuah zymogen. Tripsin memotong rantai peptida terutama di sisi karboksil asam amino lisin atau arginin, kecuali jika diikuti oleh prolin (Rawlings, et al, 1994). Tripsin (trypsin) adalah salah satu enzim yang diproduksi oleh pankreas dan disekresikan dalam keadaan inaktif (inactive). Mekanisme sekresi enzim seperti ini berfungsi untuk mencegah terjadinya autodigestion pancreas atau untuk melindungi pankreas dari aktivitas proteolitik enzim tersebut (Voet, et al, 1995).
23 Gambar 7. Struktur 3D Tripsin (Leiros, 2004)
2.6 Peran dan Perkembangan Bioinformatika
Bioinformatika adalah organisasi dan analisis komplek data yang dihasilkan dari analisa molekuler dan teknik biokimia. Di samping itu bioinformatika merupakan teknologi untuk koleksi, peyimpanan analisis, interprestasi, pelepasan dan aplikasi untuk informasi biologi. Analisis dilakukan dengan cara membandingkan data yang masuk dengan ribuan data lain yang tersedia di dalam pangkalan data (Nuswantara, 2000). Bioinformatika merupakan bidang ilmu interdisipliner yang berperan besar dalam berbagai analisis karakter dan dinamika molekuler pada sistem biologis melalui simulasi komputer (M. Cannataro et al, 2010).
Meskipun merupakan suatu bidang ilmu yang relatif baru, terobosan yang dihasilkan riset bioinformatika ternyata sangat luas dan berdampak besar terhadap berbagai riset bidang ilmu lainnya serta aplikasinya di kehidupan nyata. Salah satu terobosan terbesar bioinformatika adalah kesuksesan penentuan keseluruhan genom manusia melalui Human Genome Project (HUGO). Keberhasilan proyek
24 ini menghasilkan suatu peristiwa yang disebut sebagai “revolusi genomik” (P.J. Kennelly & V.W. Rodwell, 2006).
Revolusi genomik membawa perubahan besar bagi dunia biokimia dan kedokteran. Informasi genetik manusia yang diperoleh dari HUGO sangat berperan dalam identifikasi gen yang bertanggungjawab terhadap berbagai penyakit, baik genetik maupun non-genetik dan juga dapat digunakan untuk mencari solusi pengobatannya (P.J. Kennelly & V.W. Rodwell, 2006).
Bioinformatika modern berhubungan erat dengan metode pengumpulan, penyimpanan, dan analisis data biologis dan medis termasuk landasan komputasional dan pemodelan data untuk simulasi perilaku sistem hidup. Meskipun bioinformatika terlahir sebagai suatu bidang interdisipliner, dewasa ini bioinformatika lebih banyak digunakan di bidang kedokteran dan informasi medis yang melibatkan analisis genomik dan proteomik, serta data klinis yang komparatif (M. Cannataro et al, 2010). Salah satu kontribusi bioinformatika yang paling erat dengan bidang medis adalah penemuan dan pengembangan obat yang dibantu oleh komputer (computer-aided drug discovery and development) (I.M. Kapetanovic, 2008).
2.6.1 Database
Database adalah kumpulan data yang diatur sedemikian rupa untuk
memudahkan penggunanya. Pada database bioinformatika, data yang diatur merupakan data sekuen DNA atau protein yang didapat melalui percobaan laboratorium yang biasanya disimpan dalam file komputer. Setiap file dari suatu
25 sekuen berisi informasi mengenai asal organisme, nama sekuen, dan juga nomor akses yang digunakan untuk mengidentifikasi sekuen tersebut (Mount, 2004).
Dalam analisis bioinformatika, keberadaaan database merupakan syarat utama. Database DNA yang utama adalah GenBank di Amerika Serikat, sedangkan database untuk protein dapat ditemukan di SWISS-PROT, Protein
Information Resource (PIR) dan Protein Data Bank (PDB) (Baxevanis dan
Ouellette, 2005).
2.6.2 Protein Data Bank (PDB)
Database struktural menyimpan data mengenai struktur protein. Sumber
primer untuk data struktur protein adalah Protein Data Bank (PDB) yang tersedia pada URL http://www.pdb.org/ . ini adalah arsip data struktural tunggal tingkat dunia yang dibuat oleh Research Collaboratory for Struktural Bioinformatics (RSCB), di Universitas New Jersey di Rutgers (Westhead, et al., 2001).
Mesin pencarian yang terspesialisasi disediakan oleh grup database struktur makromolekul pada institut bioinformatika eropa (EBI) dengan alamat http://msd.ebi.ac.uk dan juga oleh kolaborasi riset untuk bioinformatika struktural (RCSB) dengan alamat http://www.rcsb.org/pdb. Kedua alat ini dapat digunakan untuk mengambil data struktur pada format PDB (Westhead, et al., 2001).
PDB merupakan data yang berisi koleksi struktur tiga dimensi protein, DNA dan molekul kompleks lainnya yang telah dipublikasikan dan ditentukan secara ekperimen dengan menggunakan X-ray Crystallography atau NMR
26 yang mengandung jutaan salinan suatu molekul. Sinar-X kemudian akan didifraksikan oleh kristal dan membentuk suatu pola yang bila dianalisis secara matematis akan menunjukkan posisi tiap atom dalam molekul. NMR spectroscopy menggunakan molekul dalam larutan dan akan memperlihatkan orientasi atom dalam medan magnetik (Baxevanis dan Ouellette, 2005).
Format PDB merupakan format yang dapat dimengerti baik oleh komputer maupun manusia (machine-human-readable), dimana di dalam format ini ditampilkan informasi tentang sumber, sekuens, struktur sekunder dan juga koordinat tiga dimensi protein (Baxevanis dan Ouellette, 2005).
2.6.3 Molecular Modeling
Molecular modeling merupakan suatu metode untuk merancang dan
menganalisis struktur dan sifat-sifat molekul dengan menggunakan teknik kimia komputasional dan teknik visualisasi grafis yang bertujuan untuk menyediakan struktur geometri tiga dimensi yang sesuai dengan parameter kondisi yang telah ditentukan. Molecular modeling merupakan gabungan dari data empiris dan teknik komputasional untuk menirukan dan memodelkan perilaku molekul sehingga dapat digunakan untuk mempelajarti sistem molekular tertentu (Leach, 2001).
Salah satu aspek penting dalam molecular modeling adalah mekanika molekular yang menggunakan prinsip mekanika Newtonian untuk menjelaskan karakter fisika dari suatu model. Mekanika molekular mengabaikan gerak elektron sehingga sistem yang sebelumnya merupakan sistem kuantum menjadi sistem
27 klasik sehingga sistem menjadi lebih sederhana. Sistem ini memodelkan atom-atom sebagai bola yang terhubung satu sama lain oleh pegas. Dengan demikian energi total (disebut force field) molekul dapat ditentukan oleh hukum Hooke yang secara umum dinyatakan sebagai (Pranowo, 2001).
ET = Estr + Ebend + Etor + Eoop + Evdw + Eelec
Dimana ET adalah energi total molekul, Estr adalah energi bond streching, Ebend
energi angle bending, Etor energi torsial, Eoop energi out-of-plane, Evdw energi Van
Der Waals dan Eelec adalah energi elektrostatik. Parameter-parameter yang
berhubungan dengan energi total molekul disebut juga sebagai force field. Terhadap beberapa macam force field yang penggunaannya disesuaikan dengan molekulnya, seperti MM+ untuk molekul organik dan AMBER untuk peptida, protein dan DNA (Sutarto, 2008).
2.6.4 Molecular Docking
Molecular docking merupakan suatu teknik yang digunakan untuk
mempelajari interaksi yang terjadi dari suatu kompleks molekul. Molecular
docking dapat memprediksikan orientasi dari suatu molekul ke molekul yang lain
ketika berikatan membentuk kompleks yang stabil. Terdapat dua aspek penting dalam molecular docking, yaitu fungsi scoring dan penggunaan algoritma (Funkhouser, 2007).
Fungsi scoring dapat memperkirakan afinitas ikatan antara makromolekul dengan ligan (molekul kecil yang memiliki afinitas terhadap makromolekul). Identifikasi ini didasarkan pada beberapa teori seperti teori energi bebas Gibbs.
28 Nilai energi bebas Gibbs yang kecil menunjukkan bahwa konformasi yang terbentuk adalah stabil, sedangkan nilai energi bebas Gibbs yang besar menunjukkan tidak stabilnya kompleks yang terbentuk, sedangkan penggunaan algoritma berperan dalam penentuan konformasi (docking pose) yang paling stabil (favourable) dari pembentukan kompleks (Funkhouser, 2007).
2.6.5 Software AutoDock Vina
AutoDock Vina (Vina) adalah piranti lunak yang dikembangkan untuk penambatan serta penapisan virtual. Vina dikembangkan oleh Molecular Graphics
Lab. Menggunakan AutoDock Vina, kecepatan proses penambatan dapat
mencapai dua kali lipat dibandingkan AutoDock. Berbeda dengan AutoDock, Vina secara otomatis mengkalkulasi pemetaan grid. Bentuk fungsi penilaian Vina adalah sebagai berikut (Trott & Olson, 2010).
Penjumlahan seluruh pasangan atom yang dapat berpindah relatif satu dengan yang lain, umumnya mengabaikan interaksi elektrostatik 1-4 (atom-atom yang dipisahkan oleh 3 ikatan kovalen). Setiap atom i diberikan tipe ti, dengan set
simetris fungsi interaksi ƒtitj untuk jarak interatomik rij (Trott & Olson, 2010).
Nilai c terdiri atas penjumlahan kontribusi intermolekular dan intramolekular. Algoritma optimisasi akan mencari global minimal dari c kemudian memperingkatkannya. Langkah algoritma yang dimasukkan terdiri atas mutasi dan optimisasi lokal menggunakan metode
Broyden-Fletcher-Goldfarb-29 Shanno (BFGS). BFGS adalah metode optimisasi kuasi-Newton yang menggunakan derivat fungsi penilaian berdasarkan argumen posisi dan orientasi ligan, nilai torsi ikatan yang dapat diputar (rotatable bonds). (Trott & Olson, 2010).
Kalkulasi oleh Vina dilakukan secara multi threading yang memungkinkan paralelisme piranti keras dengan pembagian memori bersama (shared memory) seperti CPU multi-core. Algoritma optimisasi akan mempertahankan set minimal dari berbagai penjalanan kalkulasi (run), kemudian mengkombinasinya dan mengklusternya (Trott & Olson, 2010).
2.7 Software PyRx
PyRx adalah piranti lunak tertambah (add ons) penapisan virtual yang dapat digunakan untuk penapisan pustaka senyawa. PyRx memungkinkan pengguna untuk menjalankan penapisan virtual dalam berbagai platform dan membantu penggunanya dalam setiap tahap proses. Proses yang dapat dilakukan menggunakan piranti lunak ini mencakup preparasi data ligan dan makromolekul, melakukan kalkulasi serta analisis hasil. PyRx dikembangkan oleh Molecular
Graphics Laboratory, The Scripps Research Institute (Dallakyan, 2009).
PyRx menyediakan cekatan yang memudahkan penggunanya melakukan pekerjaan penapisan virtual. Penapisan dapat dilakukan secara lokal (menggunakan GPU ataupun kluster) atau secara remote menggunakan servis web
Opal toolkit. PyRx terdiri atas piranti lunak AutoDock4 dan AutoDock Vina
30 membuat berkas masukan, Python sebagai bahasa pemrograman / scripting, wxPython sebagai antarmuka pengguna grafis (GUI / graphical user interface) lintas platform, alat visualisasi, serta Open Babel untuk pengubah format berkas sdf dan mol (Wolf, 2009).
2.8 Computer-Aided Drug Discovery and Development (CADDD) 2.8.1 In Silico Drug Design
Saat ini diperkirakan biaya penemuan dan pengembangan obat (drug
discovery and development/DDD) membutuhkan dana sekitar 1,3 miliar USD
(dollar Amerika Serikat) dengan waktu keseluruhan riset mencapai 12–15 tahun hingga dapat dijual di pasaran (D. Hecht & G.B. Fogel, 2009). Salah satu kendala yang menyebabkan biaya DDD yang sangat besar ialah penggunaan tipe eksperimen basah (wet experiments) secara keseluruhan dari pencarian senyawa kandidat obat yang potensial hingga uji klinis. Hal ini mengakibatkan pemborosan bahan, energi, dan biaya apabila senyawa yang dihasilkan ternyata tidak cukup potensial untuk dijadikan obat. Untuk itu pendekatan lainnya dilakukan untuk menekan biaya penemuan kandidat obat yang potensial, yaitu melalui pendekatan secara in silico. Pendekatan yang dilakukan secara komputasional atau secara populer juga disebut “eksperimen kering” (dry experiments) ini telah terbukti meningkatkan efektivitas dan efisiensi penemuan dan pengembangan obat (DDD). Salah satu kelebihan teknik dan perangkat bioinformatika di bidang medis adalah penemuan dan pengembangan obat terbaru yang saat ini implementasinya semakin populer dan diapresiasi. Penemuan dan pengembangan obat dibantu
31 komputer (computer-aided drug discovery and development/CADDD) merupakan suatu ranah bioinformatika yang berperan penting pada penemuan dan pengembangan obat terbaru. Ranah riset komputasional ini juga harus didukung oleh teknik eksperimental untuk menemukan dan mengembangkan kandidat obat (drug lead) hingga menjadi obat yang efektif untuk melawan penyakit. Ranah riset CADDD meliputi:
1. Penggunaan teknik komputerisasi untuk mengembangkan proses penemuan dan pengembangan obat.
2. Penggunaan informasi kimia dan biologi mengenai ligan kandidat obat (drug lead) dan juga target obat (drug target) untuk mengidentifikasi dan mengoptimasi obat terbaru.
3. Desain in silico untuk mengeliminasi senyawa dengan sifat yang tidak diinginkan, misalnya memiliki aktivitas yang buruk, atau sifat ADMET (absorption, distribution, metabolism, excretion, and toxicity) yang buruk, kemudian memilih kandidat obat terbaik dan potensial untuk dikembangkan sebagai obat (I.M. Kapetanovic, 2008).
CADDD dan pemodelan secara in silico lainnya dapat meminimalisir waktu dan material yang digunakan untuk sintesis kimia dan pengujian biologis secara signifikan sehingga menjadi suatu strategi yang wajib dilakukan dalam penemuan dan pengembangan obat terbaru.
32 2.8.2 Lipinski’s Rule of Five
Lipinski’s rule of five merupakan suatu aturan kemiripan dengan senyawa
obat (drug likeness) untuk mengevaluasi aktivitas biologis dan farmakologis suatu senyawa kimia (biasanya merupakan kandidat obat) sehingga menjadikannya aktif sebagai obat, terutama obat oral bagi manusia. Aturan ini diformulasikan oleh Christopher A. Lipinski pada tahun 1997 yang didasari atas observasi bahwa kebanyakan senyawa obat memiliki ukuran yang relatif kecil dan lipofilik. Aturan Lipinski menyatakan, bahwa secara umum suatu obat yang aktif secara oral memiliki kriteria sebagai berikut:
1. Memiliki tidak lebih dari 5 donor ikatan hidrogen (atom nitrogen atau oksigen yang mengikat satu atau lebih ikatan dengan hidrogen).
2. Memiliki tidak lebih dari 10 akseptor ikatan hidrogen (atom nitrogen atau oksigen).
3. Massa molekuler kurang dari 500 dalton.
4. Memiliki koefisien partisi oktanol-air (logP) tidak lebih dari 5 (C.A. Lipinski & A. Hopkins, 2004; S. Sakkiah et al, 2011).
Aturan ini dapat menjelaskan bahwa karakter molekuler penting untuk menentukan farmakokinetika suatu obat pada tubuh manusia, termasuk sifat ADMET senyawa tersebut. Tetapi pada perkembangannya, aturan Lipinski ini dimodifikasi agar dapat mengevaluasi drug likeness dari suatu kandidat obat secara lebih tepat. Modifikasi aturan Lipinski dilakukan oleh Ghose et al pada tahun 1999 dengan aturan sebagai berikut:
33 1. Koefisien partisi (logP) di antara -0,4 sampai +5,6.
2. Refraktivitas molar dari 40 sampai 130. 3. Massa molekul dari 160 sampai 500.
4. Jumlah atom dari 20 sampai 70, termasuk donor ikatan hidrogen (O-H dan N-H) dan akseptor ikatan hidrogen (N dan O)
5. Luas permukaan polar tidak lebih dari 140 Å2 (V.K. Monya et al, 2012).
Aturan ini penting sebagai langkah awal untuk mengevaluasi dan mengoptimasi aktivitas farmakologis dan selektivitas senyawa kandidat obat dan secara keseluruhan penting pada pengembangan senyawa obat (V.K. Monya et al, 2012).
34 BAB III
METODE PENELITIAN
3.1 Waktu dan Tempat Penelitian
Penelitian ini dilakukan di Gedung Pusat Laboratorium Terpadu (PLT) UIN Syarif Hidayatullah Jakarta, yang dimulai pada bulan Januari 2017 hingga Juli 2017.
3.2 Alat dan Bahan 3.2.1 Alat
Alat yang digunakan pada penelitian ini meliputi seperangkat personal
computer dengan processor AMD Dual-Core dengan operasi sistem windows 7
dan RAM 2 Gb. Perangkat browser yang digunakan adalah Mozilla Firefox dan Google Chrome. Software yang digunakan untuk simulasi docking yang dapat diunduh secara online tersaji pada Tabel 1.
Tabel 1. Sofware yang digunakan sebagai simulasi docking
Softwares Situs
PyRx (http:// sourceforge.net/projects/pyrx/)
UCSF Chimera 1.12 (http://www.cgl.ucsf.edu/chimera/download.html) Biovia Discovery Studio 2016
(
http://accelrys.com/products/collaborative-
science/biovia-discovery-studio/visualization-download.php)
ACDLabs ChemSketch 12.0 (http://www.acdlabs.com/resources/freeware/chem
35 Sementara yang lainnya dapat langsung digunakan pada web server tersebut (online software). Software yang digunakan pada penelitian ini dapat diakses secara online tersaji pada Tabel 2.
Tabel 2. Software yang dapat diakses secara online.
Softwares Situs
Lipinski Filters (http://www.scfbio-iitd.res.in/software/drugdesign/lipinski.js) Molsoft (http://molsoft.com/mprop/)
Peptide Cutter (http://web.expacy.org/cgi-bin/peptide_cutter/peptidecutter.pl) 3.2.2 Bahan
Bahan untuk studi hidrolisis in silico diperoleh melalui studi pustaka dari pustaka data : National Center for Biotechnology Information (NCBI)
http://www.ncbi.nlm.nih.gov/ dimana pencarian sekuen protein dibatasi pada α
S1, α S2, β dan kappa-kasein susu kambing. Sedangkan penyiapan struktur 3D
enzim ACE (1O86) diperoleh dari RCSB (PDB)
(http://www.rcsb.org/pdb/home/home.do).
3.3 Prosedur Kerja Penelitian
3.3.1 Penyiapan sekuen protein kasein (α S1, α S2, β dan kappa-kasein) Proses yang pertama dilakukan adalah pencarian data sekuen protein kasein susu kambing yang diperoleh dari situs NCBI (http://www.ncbi.nih.gov), kemudian sekuen-sekuen tersebut disimpan dalam format fasta. Berikut adalah tipe dan nomor katalog dari setiap kasein yang tersaji pada tabel 3:
36 Tabel 3. Sumber kasein berdasarkan tipe dan nomor katalog
Tipe Nomor Katalog Sumber Peneliti
α-S1 kasein NP_001272624.1 https://www.ncbi.nlm.nih.gov/protein/NP_001272624.1?report=fasta
(Ramunno, et al. 2004) α-S2 kasein NP_001272514.1 https://www.ncbi.nlm.nih.gov/prot ein/NP_001272514.1?report=fasta (Lagonigro, et al. 2001)
β kasein AAK97639.1 https://www.ncbi.nlm.nih.gov/protein/AAK97639.1?report=fasta
(Wang, et
al. 2001)
κ kasein NP_001272516.1 https://www.ncbi.nlm.nih.gov/protein/NP_001272516.1?report=fasta
(Tokarska,
et al. 2009)
3.3.2 Penyiapan struktur 3D enzim ACE (Angiotensine Converting Enzyme) Struktur 3D enzim ACE sebagai model diperoleh dari RCSB (PDB)
(http://www.rcsb.org/pdb/home/home.do) diunduh dan disimpan dalam format
(.pdb), Selanjutnya struktur 3D enzim ACE diminimisasi dengan software UCSF Chimera 1.12. Struktur inilah yang akan kemudian akan digunakan pada
molecular docking.
3.3.3 Preparasi file enzim ACE pra docking
Data struktural protein enzim ACE Homo sapiens dengan kode DOI:
10.2210/pdb1o86/pdb disiapkan dalam format pdb. Kemudian seluruh data
strukturalnya dibuka dengan software UCSF Chimera 1.12. Langkah selanjutnya ialah enzim ACE yang masih berikatan dengan lisinopril diminimisasi dengan dipilih menu “Select” selanjutnya “Residu” dipilih ligan/inhibitor (lisinopril) dan pelarut (biasanya berupa molekul air / H2O) yang tidak diinginkan untuk
37 “delete”. Setelah itu penambahan hidrogen polar dilakukan menggunakan pada
menu “Tools” lalu dipilih “Structure Editing” dan dipilih “Dock Prep”. Setelah
muncul jendela “Dock Prep” dipilih “OK”. Kemudian muncul jendela “Assign
Charges for Dock Prep”, pada pilihan “other residue” tandai Gasteiger dan dipilih
“OK”. Hasil preparasi enzim ACE di save dalam format .pdb dan siap untuk proses docking (Pettersen, et al, 2004).
3.3.4 Hidrolisis in silico fragmen peptide (α S1, α S2, β dan kappa-kasein) Fragmen peptide (α S1, α S2, β dan kappa-kasein) yang diperoleh dari hasil hidrolisis secara enzimatik menggunakan 3 jenis enzim yaitu (pepsin, tripsin dan kimotripsin), dapat dilakukan secara in silico dengan menggunakan
proteolitic site enzymatic prediction software, yaitu Expasy Peptide Cutter open source software (http://web.expacy.org/cgi-bin/peptide_cutter/peptidecutter.pl) (Artimo, et al, 2012).
Sekuen asam amino hasil hidrolisis enzimatik dipetakan dalam bentuk tabel untuk selanjutnya diolah lebih lanjut dengan menggunakan software ACDLabs ChemSketch 12.0. dengan menggunakan software yang sama, struktur inhibitor atau disebut juga ligan-ligan ini kemudian struktur distabilkan menggunakan fitur clean structure dan dilakukan optimisasi dalam bentuk tiga dimensi (3D) optimization. Ligan disimpan delam format MDL (Molecular
Design Limited) Molfiles (Ogawa, 1984). Ligan dalam format MDL Molfiles ini
kemudian dikonversi ke dalam format .pdb menggunakan software biovia discovery studio 2016 selanjutnya dapat digunakan pada proses docking sebagai kandidat ligan spesifik inhibitor ACE.
38 3.3.5 Preparasi Ligan (Inhibitor ACE)
Kandidat inhibitor ACE atau ligan spesifik dalam format .pdb dibuka dengan software software PyRx. Ligan tersebut dibuka pada menu open babel yang berada pada jendela bawah yang bertuliskan Controls. Struktur ligan dibuka dengan icon insert new item pada jendela open babel kemudian open. Ligan kemudian siap menjalani proses simulasi molecular docking setelah memilih
Convert All to AutoDock Ligan dan berhasil di ubah bentuknya menjadi
format .pdbqt sehingga persiapan ligan selesai (Trott, et al, 2010). 3.3.6 Simulasi Docking
Simulasi docking dilakukan dengan penambatan molekuler ligan terhadap terget model ACE dilakukan dengan program AutoDock dengan menggunakan
software PyRx. Sebelum dilakukan (moleculer docking), terlebih dahulu
dilakukan validasi moleculer docking dengan menggunakan lisinopril sebagai kontrol positif ligan. Ligan dan makromolekul yang digunakan dalam bentuk file .pdbqt di copy dan paste pada folder ligan dan makromolekul yang sudah tersedia di dalam user yang sudah terinstal pada perangkat lunak PyRx. Ligan dan makromolekul yang sudah terdapat pada PyRx diblok dan forward. Grid box pada jendela “Vina Search Space” diubah menjadi 7,474 x 11,976 x 12,626 Å, dengan pusat koordinat X= 40,892 ; Y= 32,798; dan Z= 47,286, selanjutnya diatur parameter exhautiveness pada 30 yang kemudian dilakukan Run Vina. Hasil autodock di simpan dalam format comma-separated values (CSV) dan structure
data format (SDF). Metode yang sama dilakukan terhadap ke 108 ligan kandidat.
39 dilakukan visualisasi menggunakan program biovia discovery studio 2016 (Trott,
et al, 2010).
3.3.7 Drug Screening dan Analisis Drug Scan
Drug scan dilakukan untuk melihat apakah inhibitor yang diusulkan telah
memenuhi syarat sebagai kandidat obat berdasarkan Lipinski’s Rule of Five. Drug
scan dilakukan dengan menggunakan software online Lipinski Filters dan
Molsoft. Drug screening kemudian dilakukan untuk melihat senyawa kandidat obat dengan nilai binding affinity (ΔG) dan druglikeness yang terbaik di antara yang lainnya. Software Molsoft dan Lipinski Filters digunakan untuk menganalisis karakter molekuler seperti logP, jumlah donor ikatan hidrogen, jumlah akseptor ikatan hidrogen, dan massa molekul suatu obat. Menggunakan Lipinski Filters yang diakses memalui website, ligan dalam format (.pdb) diunggah ke situs tersebut. Menggunakan Molsoft yang diakses memalui website, ligan dalam format smiles diunggah ke situs-situs tersebut. Berikut adalah rumus perhitungan untuk menenukan nilai konstanta inhibitor (Ki) yang ditulis oleh
Kitchen et al, 2004:
[ ] [ ][ ]
Dengan:
ΔG = energi bebas pengikatan (kal/mol) R= tetapan gas konstan (kal/mol K), T = temperatur absolut (K), KA = konstanta aktivasi enzim, dan
40 BAB IV
HASIL DAN PEMBAHASAN
4.1 Penyiapan sekuen protein kasein (α S1, α S2, β dan kappa-kasein) Pencarian sekuen protein kasein dilakukan pada database NCBI (National Center for Biotechnology Information) yang dapat diakses dari internet dengan alamat http://www.ncbi.nlm.nih.gov/ dimana parameter yang digunakan adalah jenis protein dan sumber organisme yang menghasilkan sekuen tersebut. Protein sekuen kasein yang digunakan dalam penelitian ini berasal dari susu kambing (Capra hircus) yang terdiri dari alpha S1, alpha S2, beta dan kappa kasein. Hasil pencarian sekuen menunjukkan urutan sekuen dari masing-masing protein tersebut. Berikut adalah urutan sekuen kasein dari susu kambing (Capra hircus) :
a. Alpha-S1 kasein
>gi|550821823|ref|NP_001272624.1|alpha S1 casein [Capra hircus]
MKLLILTCLVAVALARPKHPINHQGLSPEVPNENLLRFVVAPFPEVFRKENINELSKDIG SESTEDQAMEDAKQMKAGSSSSSEEIVPNSAEKYIQKEDVPSERYLGYLEQLLRLKKYNV PQLETVPNSAEEQLHSMKEGNPAHQKQPMIAVNQELAYFYPQLFRQFYQLDAYPSGAWYY LPLGTQYTDAPSFSDIPNPIGSENSGKTTMPLW (Ramunno et al, 2004).
b. Alpha-S2 kasein
>gi|550822248|ref|NP_001272514.1|alpha S2 casein[Capra hircus]
MKFFIFTCLLAVALAKHKMEHVSSSEEPINIFQEIYKQEKNMAIHPRKEKLCTTSCEEVV RNANEEEYSIRSSSEESAEVAPEEIKITVDDKHYQKALNEINQFYQKFPQYLQYPYQGPI VLNPWDQVKRNAGPFTPTVNREQLSTSEENSKKTIDMESTEVFTKKTKLTEEEKNRLNFL KKISQYYQKFAWPQYLKTVDQHQKAMKPWTQPKTNAIPYVRYL (Lagonigro et al, 2001).