(Stelecho
DEPAR
ocarpus bu
RTEMEN
FAKU
INS
urahol) SE
1
GITA
KLINIK
ULTAS KE
STITUT P
ECARA IN
14 HARI
ALVERN
REPROD
EDOKTE
ERTANIA
BOGOR
2011
NTRAGAS
NITA
DUKSI DA
RAN HEW
AN BOGO
STRIK SE
AN PATO
WAN
OR
ELAMA
LOGI
INFORMASI
Dengan ini saya menyatakan bahwa skripsi Gambaran Histopatologi Hati Mencit Setelah Pemberian Suspensi Daging Buah Kepel (Stelechocarpus burahol) Secara Intragastrik Selama 14 Hari adalah karya saya dengan arahan dosen pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, November 2011
Gita Alvernita
© Hak Cipta milik IPB, tahun 2011
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya illmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
Dilarang mengumumkan dan memperbanyak sebagian atau seluruh karya tulis dalam bentuk apa pun tanpa izin IPB.
GITA ALVERNITA. The Histopathology of MiceLiver Treated by Kepel (Stelechocarpus burahol) Suspension Intragastrically for 14 Days. Under direction of EVA HARLINA and SITI SA’DIAH.
The aim of this study was to examine the effect of kepel (Stelechocarpus
burahol) to the mice hepatocytes. Thirty male mice of 4 week aged were divided
into three groups; control group was treated by aquadest, dose 1x group was treated by 2.6 mg/g BW/day kepel powder (0,5 ml kepel suspension/day) and dose 5x group was treated by 13 mg/g BW/day kepel powder (1.0 ml kepel suspension/day). The treatment was intragastrically for 14 days. The mice were euthanized and then followed by the liver collection for histopathology processed. The histopathlogical examination of liver showed hydropic degeneration, apoptosis and extramedullary hematopoietic observed on mice hepatocytes.The ANOVA analysis showed that kepel caused increase significantly (p<0,05) of hydropic degeneration and decrease significantly (p<0,05) of apoptosis of mice hepatocytes.
Keywords: Kepel, hydropic degeneration, apoptosis, extramedullary hematopoiesis.
(Stelechocarpus burahol) SECARA INTRAGASTRIK SELAMA
14 HARI
GITA ALVERNITA
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan pada
Fakultas Kedokteran Hewan Institut Pertanian Bogor
DEPARTEMEN KLINIK REPRODUKSI DAN PATOLOGI
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
BOGOR
Suspensi Daging Buah Kepel (Stelechocarpus burahol) Secara Intragastrik Selama 14 Hari
Nama : Gita Alvernita
NIM : B04070175
Disetujui,
Dr. drh. Eva Harlina, M.Si, APVet. Siti Sa’diah, S.Si,Apt,M.Si
Pembimbing I Pembimbing II
Diketahui,
Dr. Nastiti Kusumorini
Wakil Dekan Fakultas Kedokteran Hewan Institut Pertanian Bogor
melimpahakan rahmat dan karunianya sehingga penulis dapat menyelesaikan skripsi yang berjudul Gambaran Histopatologi Mencit Setelah Pemberian Suspensi Daging Buah Kepel (Stelechocarpus burahol) Secara Intragastrik Selama 14 Hari. Skripsi ini disusun sebagai salah satu syarat untuk memperoleh gelar sarjana pada Fakultas Kedokteran Hewan, Institut Pertanian Bogor.
Terima kasih penulis sampaikan kepada Dr. drh. Eva Harlina, M.Si, APVet. dan Siti Sa’diah, S.Si, Apt, M.Si selaku pembimbing skripsi yang begitu sabar memberikan pengarahan dan bimbingan bagi penulis. Ucapan terimakasih juga penulis sampaikan kepada drh. Huda Darusman, M.Si atas saran dan masukannya selama penelitian, drh. Isdoni, M.Biomed selaku dosen pembimbing akademik, seluruh staf dan pegawai Bagian Toksikologi dan Farmakologi (Pak Edi dan Mbak Anti), seluruh staf dan pegawai Bagian Patologi (Pak Kasnadi, Pak Endang dan Pak Sholeh) serta staf dari Pusat Studi Biofarmaka LPPM IPB (Mbak Dina dan Pak Taufik) atas bantuannya selama penelitian.
Ucapan terima kasih dan penghargaan yang tak terhingga penulis tujukan untuk Ayah dan Ibu tercinta, Andre R. Rustam dan Farida Daulay, Reynaldo Belmundo Andre (Kakak), Dian Ayu Wardhani (Kakak ipar), serta segenap keluarga yang telah berdoa dengan tulus dan memberikan dukungan selama ini. Ucapan terima kasih dan penghargaan yang sangat dalam penulis tujukan kepada Arie Mardjan Tampubolon, Adilla Adha dan Andrini Aditya Wardhani atas kebersamaan dan kesabarannya dalam berjuang sebagai rekan penelitian (Thank you Bang!). Terima kasih penulis ucapkan kepada orang terdekat (Mbung, Astri Priyanti Parameswari, Puti Lenggogeni, Meta Levi, Patricia Noreva, Trismawati Wahid, Azrul Zulmy, dan Dardjat Darul Falah) atas dukungan, saran dan kritikannya, serta rekan-rekan Gianuzzi 44 dan Himpro SATLI. Semoga karya ini bermanfaat bagi pengembangan ilmu pengetahuan.
Bogor, November 2011
Penulis dilahirkan di Jakarta pada tanggal 15 Agustus 1989 dari pasangan Andre R. Rustam dan Farida Daulay. Penulis merupakan anak kedua dari dua bersaudara.
Penulis memulai pendidikan formal pada tahun 1995 di SD Islam Al-Azhar 6 Jakapermai, Bekasi dan lulus pada tahun 2001. Pada tahun yang sama penulis melanjutkan pendidikan ke SMP Islam Al-Azhar 8 Kemang Pratama, Bekasi dan lulus pada tahun 2004. Penulis kemudian masuk ke SMA Islam Al-Azhar 4 Kemang Pratama, Bekasi dan lulus pada tahun 2007. Tahun 2007 penulis diterima di Institut Pertanian Bogor melalui jalur Seleksi Penerimaan Mahasiswa Baru (SPMB) di Fakultas Kedokteran Hewan.
Selama menjalani pendidikan penulis aktif di Himpunan Minat Profesi Satwa Liar (SATLI) sebagai anggota divisi infokom dan anggota cluster Primate.
DAFTAR TABEL ... xii
DAFTAR GAMBAR ... xiii
DAFTAR LAMPIRAN ... xiv
PENDAHULUAN Latar Belakang ... 1 Tujuan... ... 2 Manfaat... ... 2 Hipotesis. ... 3 TINJAUAN PUSTAKA Tanaman Herbal... ... 4
Kepel (Stelechocarpus burahol) ... 6
Hati... ... 9
Mencit.... ... 11
METODE PENELITIAN Waktu dan Tempat ... 12
Bahan dan Alat ... 12
Hewan Coba ... 12
Pembuatan Sediaan Kepel ... 13
Desain Penelitian ... 13
Pembuatan Preparat Histopatologi Hati ... 13
Pengamatan Sediaan Histopatologi Mencit ... 14
Analisis Statistik ... 14
Diagram Alir Penelitian ... 14
HASIL DAN PEMBAHASAN Pengaruh Pemberian Suspensi Daging Buah Kepel (Stelechocarpus burahol) Terhadap Gambaran Histopatologi Hati ... 16
SIMPULAN DAN SARAN Simpulan ... 24
Saran ... 24
DAFTAR PUSTAKA ... 25
Halaman 1. Fitokimia tanaman kepel ... 9 2. Persentase perubahan hepatosit mencit pada pemberian suspensi
DAFTAR GAMBAR
Halaman 1. Bentuk pohon, daun dan buah kepel ... 8 2. Diagram alir penelitian ... 14 3. Grafik persentase perubahan hepatosit mencit pada pemberian
suspensi daging buah Kepel (Stelechocarpus burahol) selama 14 hari . 16 4. Hepatosit yang mengalami degenerasi hidropis pada kelompok dosis 5x 17 5. Hepatosit yang mengalami apoptosis pada kelompok kontrol ... 20 6. Extramedullary hematopoiesis (EMH) pada hati kelompok dosis 5x .... 23
DAFTAR LAMPIRAN
Halaman
1. Penghitungan dosis pemberian kepel ... 31
2. Penghitungan volume pemberian kepel ... 32
3. Pembuatan sediaan histopatologi dan pewarnaan HE ... 33
4. Analisis perubahan degenerasi hidropis pada sel hati ... 35
5. Analisis perubahan apoptosis pada sel hati ... 36
PENDAHULUAN
Latar Belakang
Penggunaan obat-obatan herbal menjadi sebuah alternatif yang saat ini digandrungi oleh masyarakat. Mayoritas masyarakat lebih memilih pengobatan herbal karena bahan alami dianggap bersifat lebih aman, selain itu juga relatif lebih murah dibandingkan obat modern. Faktor pendorong berpindahnya masyarakat memakai obat herbal adalah usia harapan hidup yang lebih panjang setelah mengonsumsi obat herbal saat prevalensi penyakit kronik meningkat dan adanya kegagalan penggunaan obat modern untuk penyakit tertentu seperti kanker. Herbal kembali dilirik kajian ilmiahnya oleh peneliti setelah melihat kemampuan alami hewan di alam liar mengonsumsi tanaman untuk self-treatment dalam mengurangi rasa sakit pada saat-saat tertentu.
Indonesia memiliki lebih dari 30.000 jenis spesies tumbuhan yang 960 spesies diantaranya telah tercatat sebagai tumbuhan berkhasiat, dan 283 jenis diantaranya merupakan tumbuhan yang penting bagi industri obat tradisional (Kusuma dan Zaky 2005). Diantara tanaman berkhasiat tersebut adalah daun jambu biji (Psidium guava) yang mengandung psiditanin yang berguna sebagai obat diare, atau Echinacea purpurea yang mengandung echinasida yang berfungsi sebagai immunomodulator. Beberapa tanaman yang telah menjadi obat herbal terstandar diantaranya Kiranti®, yang mengandung kunyit (Curcuma domestic) berguna untuk meredakan nyeri pada saat haid, dan Stimuno®, contoh immunomodulator dari herbal alami yang membantu meningkatkan daya tahan
tubuh. Stimuno® terdaftar sebagai sediaan fitofarmaka yang berasal dari ekstrak tanaman meniran (Phyllantus niruri) yang terstandarisasi, karena telah melalui berbagai uji preklinik dan klinik (Anonim 1 2009). Berdasarkan temuan-temuan di atas memicu para peneliti untuk menelaah lebih jauh potensi tumbuhan khas Indonesia dalam mewujudkan kesehatan masyarakat, hewan dan lingkungan. Salah satu tanaman asli Indonesia yang biasa digunakan sebagai jamu adalah tanaman khas asal Yogyakarta yang sering disebut dengan kepel.
Kepel (Stelechocarpus burahol) dikategorikan sebagai tanaman asli Indonesia yang dilindungi dan digunakan secara tradisional sebagai deodoran oral
bagi masyarakat Keraton, Yogyakarta. Putri keraton dahulu menggemari buah ini sebagai penghilang bau badan, memberi efek wangi pada produk ekskresi manusia seperti keringat, urin dan feses. Selain itu daun kepel mengandung banyak zat sitotoksik bagi sel kanker (Wiart 2007), dan mengandung banyak senyawa flavonoid yang bersifat sebagai antioksidan (Sunarni et al. 2007). Bunga dari tumbuhan kepel diketahui memiliki efek antiimplantasi sehingga dapat digunakan sebagai kontrasepsi (Warningsih 1995). Bagian kulit batangnya juga diketahui sebagai antiagregasi platelet (Sunardi et al. 2007). Banyaknya potensi obat yang dimiliki tanaman kepel berbanding terbalik dengan langkanya tanaman ini. Kelangkaan disebabkan oleh kurangnya nilai ekonomis dari tanaman ini, dan kepel termasuk tanaman yang berbuah setahun sekali. Karena faktor inilah mengapa masyarakat urung membudidayakan dan memanfaatkan kepel. Adanya publikasi ilmiah mengenai potensinya diharapkan menjadi ujung tombak memasyarakatkan kepel sebagai tanaman yang memiliki nilai ekonomi tinggi.
Penelitian ini bertujuan untuk mempelajari gambaran histopatologi organ hati terhadap pemberian suspensi daging kepel, karena hati merupakan organ interna pertama yang terkena efek toksik dari suatu substansi yang masuk ke dalam tubuh. Hati juga memiliki peranan yang sangat penting karena merupakan pusat metabolisme zat makanan sebelum diedarkan ke seluruh tubuh (Banks 1986). Berdasarkan data empiris dari masyarakat Keraton, kepel dikonsumsi sebanyak 2 buah dalam 1 hari. Bersumber dari data empiris tersebut maka dilakukan penelitian untuk mempelajari adakah perubahan pada gambaran histopatologi hati mencit setelah pemberian kepel selama 14 hari. Dari hasil penelitian ini diharapkan semakin banyak masyarakat yang mengetahui potensi kepel sehingga tertarik membudidayakan dan memanfaatkannya.
Tujuan
Penelitian ini bertujuan untuk mempelajari pengaruh pemberian suspensi daging buah kepel terhadap gambaran histopatologi organ hati mencit.
Manfaat
Manfaat penelitian adalah untuk mengetahui potensi kepel sehingga masyarakat tertarik untuk membudidayakan dan memanfaatkannya, dan juga meningkatkan pamor dan nilai ekonomis kepel sehingga dapat merubah gaya hidup untuk semakin mencintai buah nasional.
Hipothesis
Hipotesis penelitian ini adalah sebagai berikut:
H0: Suspensi daging buah kepel tidak berpengaruh terhadap gambaran histopatologi organ hati mencit.
H1: Suspensi daging buah kepel berpengaruh terhadap gambaran histopatologi organ hati mencit.
TINJAUAN PUSTAKA
Tanaman Herbal
Tanaman herbal memiliki keistimewaan yang tidak dimiliki oleh farmakologi konvensional. Farmakologi konvensional saat ini bersifat single
compound yang spesifik khasiatnya terhadap suatu penyakit. Hal ini berbeda
dengan tanaman herbal yang memiliki multi compound yang mengandung berbagai macam substansi dengan khasiat yang berbeda sehingga dapat menyeimbangkan efek samping. Farmakologi konvensional umumnya tetap dianggap sebagai pilihan pengobatan karena khasiatnya bersifat spesifik sehingga respon penyembuhannya lebih cepat. Tanaman herbal dianggap sebagai pilihan yang tepat dalam pengobatan penyakit kronis karena memiliki bahan alami yang dapat memperbaiki metabolisme sehingga dianggap lebih aman dalam penggunaan jangka panjang.
Pengobatan herbal mewakili berbagai macam disiplin ilmu seperti botani, sejarah, etnomedisinal dan farmakologi (Wynn dan Fougere 2007). Pengobatan herbal pada hewan diawali dengan adanya perilaku hewan yang mampu melakukan self-treatment saat terserang penyakit. Perilaku alami hewan ini menjadikan salah satu alasan para ahli herbal meneliti tanaman obat dan interaksinya dalam tubuh. Sebagai contoh, kera besar di Tanzania memakan daun-daun berambut yang berasal dari 34 spesies tanaman obat berbeda, tanpa mengunyah namun langsung menelannya. Beberapa daun yang dipilih diketahui mengandung fitokimia aktif dan sebagian tidak, namun semua daun yang dipilih memiliki tekstur permukaan kasar dengan mikrostruktur mirip dengan kait yang biasa disebut dengan trichomes. Dedaunan tersebut biasanya dikonsumsi hewan pada saat musim hujan dimana infestasi cacing meningkat sehingga menyebabkan diare, malaise dan sakit perut (Huffman et al. 1997). Hasil penelitian menunjukkan bahwa tekstur kasar pada permukaan daun berperan sebagai pembersih mekanis cacing yang menginfestasi saluran pencernaan. Dedaunan kasar juga meningkatkan motilitas usus dan merangsang diare, sehingga membantu mempermudah pengeluaran cacing dan toksin yang dihasilkan cacing.
Interaksi dedaunan di dalam tubuh menghasilkan efek yang cepat dalam menanggulangi gejala penyakit yang diderita kera tersebut seperti malaise pada saluran pencernaan (Huffman et al. 1997). Perilaku alami mengonsumsi dedaunan berambut juga telah membantu simpanse di Taman Nasional Kibale, Uganda untuk menyingkirkan infestasi cacing pita (Bertiella studeri) dalam saluran pencernaan (Wrangham 1994).
Perilaku alami juga ditemukan pada simpanse dengan gejala diare, malaise dan infeksi nematode dengan mengonsumsi daun pahit Vernonia amygdalina. Dalam waktu 24 jam, simpanse yang mengonsumsi daun ini sembuh. Waktu persembuhannya serupa dengan masyarakat lokal yang mengonsumsi daun ini untuk mengatasi gejala penyakit saluran pencernaan. Vernonia amygdalina berasal dari Gunung Mahale, Tanzania, yang mengandung tujuh glukosida steroid serta empat sesquiterpene lakton yang mampu membunuh parasit yang menyebabkan schistosomiasis, malaria dan leishmaniasis. Sesquiterpene lakton bukanlah antihelmintik namun antiamoeba, antitumor dan antimikroba. Lapis luar dari daun yang dikunyah oleh simpanse merupakan lapisan yang mengandung vernoniosida B1 yang tinggi dan dapat bersifat sangat toksik terhadap simpanse. Simpanse tidak hanya dapat mencari pakan yang dapat menangani gejala penyakit yang menyerangnya, namun juga mampu menemukan bagian tumbuhan yang memiliki khasiat tanpa bersifat merugikan dirinya (Ohigashi et al. 1994).
Tanaman herbal membutuhkan waktu tertentu untuk pembentukan senyawa aktif yang terkandung di dalamnya. Oleh karena itu, usia kematangan dari bagian tanaman herbal sangat mempengaruhi jumlah dan jenis senyawa yang dikandungnya. Selain itu faktor ekstrinsik seperti suhu, kelembaban udara, iklim dan demografi tanah juga memiliki peranan vital dalam pembentukan senyawa aktif dalam tanaman herbal. Senyawa aktif ini bekerja sama dalam menghasilkan khasiat sehingga apabila salah satu senyawa aktif berhasil diisolasi belum tentu dapat menghasilkan khasiat yang sama.
Badan POM mengelompokkan obat tradisional menjadi tiga, yaitu sediaan jamu, sediaan herbal terstandar dan sediaan fitofarmaka. Sediaan jamu merupakan sediaan obat tradisional yang pemakaiannya secara empiris (berdasarkan pengalaman) (BPOM 2004). Sediaan herbal terstandar merupakan
sediaan obat tradisional yang bahan bakunya harus distandarisasi dan sudah diuji farmakologi secara eksperimental yaitu uji pra klinik, efikasi dan toksisitas. Sediaan fitofarmaka adalah sediaan obat tradisional yang bahan bakunya harus distandarisasi dan harus melalui uji klinik. Pengembangan obat tradisional seperti halnya pengembangan obat modern yaitu melalui uji praklinik dan uji klinik. Uji praklinik meliputi uji farmakodinamik, uji toksikologi dan uji farmasetik, sedangkan uji klinik meliputi uji klinik fase I (dilakukan terhadap 50-150 sukarelawan sehat), uji klinik fase II (dilakukan terhadap 100-200 pasien), uji klinik fase III (dilakukan terhadap 50-5000 pasien) dan post marketing
surveillance sebagai uji klinik fase IV. Dalam melakukan pengembangan obat
tersebut, bagian tanaman obat yang digunakan dapat berasal dari batang, akar, daun, buah, kulit, biji atau bahkan semua bagiannya. Tanaman obat yang diuji dapat berupa simplisia (bahan alami yang dikeringkan), ekstrak kental, ekstrak kering dan ekstrak cair.
Kepel (Stelechocarpus burahol)
Stelechocarpus burahol merupakan tanaman yang termasuk ke dalam
Kingdom: Plantae, Subkingdom: Tracheobinta, Divisio: Magnoliophyta, Klas: Magnoliopsida, Ordo: Magnoliales, Famili: Annonaceae, Genus: Stelechocarpus, Spesies: Stelechocarpus burahol.
Di Indonesia terdapat tiga spesies dari tanaman ini yaitu Stelechocarpus
burahol, Stelechocarpus cauliflorus dan Stelechocarpus schefferii. Ketiga spesies
ini dapat ditemukan di lembaga observasi herbarium seperti di taman nasional sebagai tanaman koleksi dan tanaman untuk diuji kembangkan propagasinya. Propagasi kepel dilakukan dengan menggunakan biji yang diambil dari buah yang matang. Telah dicoba propagasi dengan cara lain namun gagal (Sunarto 1987, Sunarto1992). Hal inilah yang menyebabkan dilakukannya program penanaman kembali kepel sebagai tanaman langka.
Kepel menjadi salah satu tanaman langka yang masuk ke dalam Daftar Tanaman yang Terancam Punah (Sastrapradja dalam Mogea 2001). Namun kepel dapat ditemukan di berbagai taman nasional seperti Kebun Raya Bogor, Taman Sringanis Bogor (masih dalam bentuk spesimen biji), Taman Nasional Meru Betiri
Jember, Taman Buah Mekarsari dan hutan lindung Leuweng Sancang, Cikalong (Anonim 2 2003). Spesies Stelechocarpus burahol ditanam sebagai pohon ornamen di perkebunan masyarakat Yogyakarta, namun terbatas di daerah selain Yogyakarta. Kepel dapat ditemui di daerah Jawa Barat, Jawa Tengah dan Jawa Timur. Masyarakat di daerah Garut Selatan, Tasikmalaya selatan dan Banyumas memanfaatkan kepel sebagai buah segar. Selebihnya kepel dapat ditemukan di perkebunan masyarakat seperti di daerah Karang Anyar, Kebumen dan Solo.
Kepel merupakan tanaman berkayu dengan batang berbentuk silinder. Daunnya tipis, berwarna hijau kehitaman, mengkilat dan berbentuk lonjong. Buahnya berbentuk bulat, berwarna kecokelatan dengan diameter 5-6.3 cm (Umiyah 2005). Daging buahnya memiliki kandungan air yang tinggi sebesar 87-90% sehingga kadar rendemen atau bahan kering yang dimiliki hanya sekitar 10-13% (Darusman 2010). Kepel memiliki biji yang cukup besar dibandingkan ukuran buah keseluruhannya yaitu 27%, sehingga daging buah yang dapat dikonsumsi sangat sedikit, hanya 49% (Verhejj dan Coronell 1997). Pohon kepel mencapai masa berbuah pada usia 6-8 tahun dan hidup di daerah kaki pegunungan dengan ketinggian 150-300 m diatas permukaan laut. Tanaman ini memiliki tajuk berbentuk kubah meruncing dan buah yang menyerupai buah buni (berrylike ripe
carpels) yang bertangkai pada batang utama pohon. Kepel berbunga pada bulan
September hingga Oktober (Sunarto 1992), Maret hingga Oktober (Backer & Bakhuizen dalam Umiyah 2005) bahkan dapat berbunga pada bulan Juni di Taman Nasional Meru Betiri, Jember (Umiyah 2005). Gambar pohon, buah dan daun kepel disajikan pada Gambar 1.
Masyarakat keraton percaya dengan mengonsumsi buah kepel, bau keringat, bau nafas dan bau air seni menjadi wangi (Fachrurozi 1980; Heyne 1987; Sunarto 1987; Verheij dan Coronell 1997). Zaman dahulu, para Sultan dari Yogyakarta dan Solo menggunakan buah kepel sebagai deodoran tradisional. Hal ini dilakukan sebagai bentuk pengabdian terhadap pasangan. Oleh karena itu, dahulu buah kepel hanya diperbolehkan dikonsumsi oleh putri dan bangsawan Keraton dan dilarang untuk dikonsumsi oleh masyarakat biasa, sehingga kepel hanya dapat ditemukan di dalam wilayah istana (Heyne 1987). Pemanfaatan
tanaman kepel dalam aspek hortikultura, seleksi dan analisis sifat aromatiknya masih belum banyak dilakukan.
Ekstrak daun kepel memiliki sifat sitotoksik yang tinggi terhadap zat kanker carcinoma colorectal (Shiddiqi et al. 2008). Daun kepel juga dapat menurunkan asam urat (Purwatiningsih et al. 2009). Daging buah kepel memiliki kandungan bahan aktif antioksidan yang tinggi (Tisnadjaja et al. 2006). Kajian khasiat kepel yang ditarik secara filogenis dari tanaman famili Annonaceae lainnya seperti sirsak (Annona muricata), tanaman asli Trinidad yang mirip dengan apel yaitu cashima (Rollinia exsucca) dan Rollinia pittieri menunjukkan potensi kandungan zat sitotoksik (Osorio et al. 2007).
Gambar 1 Bentuk pohon, daun dan buah kepel. Sumber: Wong (2010).
Studi lain yang menunjukkan khasiat dari tanaman ini adalah kemampuannya menghasilkan senyawa acetogennin dan stiryllactone yang bersifat sitotoksik pada sel kanker (Wiart 2007). Famili Annonaceae juga merupakan tanaman phytoestrogen yang memiliki kemampuan mempengaruhi reseptor estrogen dengan kandungan isoflavon, yang secara teori dapat
menghambat enzim DNA isomerase dan tyrosine kinase (Piersen 2003). Kandungan fitokimia kepel menurut Darusman (2010) disajikan pada Tabel 1. Tabel 1 Kandungan Fitokimia Tanaman Kepel (Darusman 2010).
No Sampel Flavo noid Ta nin Steroid Triterp enoid Sap onin Alkaloid Drage ndorf Me yer Wagner 1. Daun + + + - - - - - 2. Daging buah + + - - - - 3. Kulit Buah + - - - + - - - 4. Biji + + - + - - - - Hati
Hati merupakan organ terbesar dalam tubuh dengan unit histologi dasar yaitu lobulus. Lobulus hati dikelilingi oleh ruang portal yang berisi cabang-cabang dari buluh empedu, arteri hepatika dan vena porta, yang disebut juga sebagai segitiga Kiernan. Hepatosit merupakan sel parenkim hati yang mengisi lobulus hati dan dipisahkan oleh sinusoid. Di dalam lumen sinusoid terdapat sel-sel Kupffer yang berperan sebagai makrofag residen yang melapisi sinusoid dan memfagositosis bakteri dan benda asing dalam darah sinus hepatikus (Guyton dan Hall 2007). Sel-sel Kupffer mengandung sitokines seperti faktor tumor nekrosis, interleukin dan interferon. Lapisan endotel sinusoid mempunyai pori-pori yang sangat besar. Di bawah lapisan ini terdapat ruang yang sangat sempit yang terletak di antara sel endotel dan hepatosit yaitu ruang Disse atau ruang perisinusoidal.
Hepatosit memiliki retikulum endoplasma yang kasar dan halus, kompleks Golgi, mitokondria, lisosom, peroksisom, glikogen dan lemak. Sel sinusoid memiliki tiga tipe yaitu sel endothelial yang membatasi sinusoid secara tidak teratur, sel-sel Kupffer yang berada di antara sel endotel atau pada lapisan sinusoid dan yang terakhir adalah sel-sel Stellate yang sering disebut dengan sel Ito yang berfungsi menyimpan vitamin A dan kolagen ekstraseluler (Kmiec 2001).
Hati merupakan organ interna yang memiliki banyak fungsi dalam sistem pencernaan diantaranya sekresi empedu, metabolisme lemak, protein dan karbohidrat, gudang penyimpanan makanan dan mineral, fungsi detoksifikasi,
fungsi metabolisme hormon, obat dan racun. Oleh karena itu hati memiliki peranan yang signifikan dalam melepaskan hasil metabolisme zat makanan sebelum diedarkan ke seluruh tubuh. Hati juga berfungsi dalam mengubah produk metabolisme protein menjadi urea untuk diekskresikan oleh ginjal. Selain itu hati memiliki peran dalam mekanisme penggumpalan darah sebagai pertahanan diri. Semua fungsi hati ini didukung dengan kemampuan hati dalam beregenerasi sehingga hati dapat melakukan banyak fungsinya (Maher 1997).
Distribusi peredaran darah dalam organ hati dimulai dari cabang-cabang portal arteri hepatika dan vena porta menuju vena sentralis. Melalui vena sentralis darah dialirkan ke vena hepatika. Unit fungsional hati adalah asinar dengan pusatnya pada saluran portal yang berbeda dengan unit histologinya. Hepatosit berdasarkan sistem asinar dibagi menjadi tiga zona. Zona satu di sekitar saluran portal yang merupakan zona paling teroksigenasi, mengandung konsentrasi nutrisi dan hormon tertinggi. Zona tiga berada di tepi area asinar mengandung sedikit oksigen, dan zona dua sebagai zona intermediet.
Tiap sel hati memiliki dua lapisan sinusoid yang dibatasi oleh mikrovili. Kanalikuli empedu yang dibentuk oleh sel-sel hati juga dibatasi oleh mikrovili. Segitiga Kiernan atau area porta berada di antara tiga atau lebih lobulus dan masing-masing berisi satu atau lebih cabang arteri hepatika, vena porta hepatika dan pembuluh darah limfatik beserta buluh empedu (Aughey dan Frey 2001). Aliran empedu bertolak belakang dengan arah aliran darah.
Sel-sel hati merupakan sel-sel yang mudah melakukan regenerasi sehingga hati masih dapat berfungsi walaupun sel-sel hatinya telah mengalami kerusakan hingga 70% (Guyton dan Hall 2007). Regenerasi sel hati berlangsung sangat cepat dan membutuhkan waktu hanya 5 sampai 7 hari pada tikus. Selama regenerasi, hepatosit diperkirakan mengalami replikasi sebanyak satu atau dua kali, dan setelah mencapai ukuran dan volume hati sebelumnya, hepatosit kembali kepada keadaan semula. Regenerasi hati dipengaruhi oleh Hepatocyte Growth
Factor (HGF) yang diproduksi oleh sel mesenkimal di dalam hati dan jaringan
lain, namun bukan hepatosit. Selain itu regenerasi hati dapat terjadi karena adanya epidermal growth factor dan sitokin seperti tumor necrosis factor dan interleukin 6 yang terdapat pada sel-sel Kupffer (Guyton dan Hall 2007).
Mencit
Hewan percobaan adalah hewan yang sengaja dipelihara dan diternakkan untuk dipakai sebagai hewan model guna mempelajari dan mengembangkan berbagai macam ilmu dalam skala penelitian atau pengamatan laboratorik (Malole dan Pramono 1989). Mencit termasuk kedalam salah satu jenis hewan percobaan yang sering digunakan karena cepat berkembang biak, mudah dipelihara dalam jumlah banyak, variasi genetiknya cukup besar serta sifat anatomis dan fisiologisnya tercirikan dengan baik. Mencit jantan dewasa memiliki berat badan berkisar antara 20-40 g, sedangkan mencit betina dewasa memiliki berat badan berkisar antara 25-40 g. Berdasarkan Spiridonova et al. (2003), mencit termasuk kedalam Kingdom: Animalia, Filum: Chordata, Sub Filum: Vertebrata, Kelas: Mamalia, Ordo: Rodentia, Sub Ordo: Myomorpha, Familia: Muridae, Genus: Mus dan Spesies: Mus musculus albinus.
BAHAN DAN METODE
Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan April 2010 hingga Juli 2011, yang bertempat di Pusat Studi Biofarmaka LPPM IPB, Bagian Farmakologi dan Toksikologi, Departemen Anatomi, Fisiologi, dan Farmakologi dan Bagian Patologi, Departemen Klinik, Reproduksi, dan Patologi FKH IPB.
Bahan dan Alat
Bahan yang digunakan dalam penelitian ini adalah buah kepel (Stelechocarpus burahol), pelet pakan mencit, air minum, dan bahan-bahan pembuat preparat histopatologi hati yaitu larutan buffer neutral formalin 10%, alkohol 70%, 80%, 90% dan 95%, alkohol absolut, xylol, parafin cair, pewarna
Mayer’s Hematoxylin, lithium karbonat, akuades, dan pewarna Eosin.
Alat-alat yang digunakan dalam penelitian ini adalah labu ukur, blender, sonde lambung, spoit, tissue cassette, blok parafin, kaca objek, kaca penutup, dan alat-alat nekropsi yaitu gunting, scalpel, pinset, kapas, timbangan, mikrotom,
refrigerator serta inkubator.
Hewan Coba
Hewan coba yang digunakan dalam penelitian ini adalah mencit jantan
(Mus musculus) berumur 4 minggu dengan berat 20 g. Hewan coba ditempatkan
di dalam boks plastik yang dimodifikasi sebagai kandang. Pakan yang diberikan berupa pelet ikan sebanyak 0.6 g/ekor/hari, dan air minum diberikan secara
ad-libitum. Sekam digunakan sebagai alas kandang yang diganti setiap dua hari
sekali. Sebelum perlakuan dimulai, hewan diadaptasikan dan dilakukan
pretreatment selama 5 hari. Pretreatment berupa pemberian antibiotik
Clavamox® (asam klavulanat dan amoksisilin) dengan dosis 0.001 mg/g BB (Hrapkiewicz dan Medina 2007) selama 3 hari, dan anti cacing Pyrantel Pamoat dengan dosis 0.015 mg/g BB. Perlakuan mulai dilaksanakan pada hari keenam selama 14 hari.
Metode
Penelitian ini dilaksanakan dalam tiga tahap yaitu tahap pembuatan serbuk buah kepel, tahap pencekokan mencit dan tahap pembuatan dan pengamatan preparat histopatologi organ hati.
Pembuatan Sediaan Kepel
Buah kepel dicuci, kemudian dipisahkan daging buah dari kulit dan bijinya. Daging buah dipotong kecil-kecil, kemudian dikeringkan di dalam oven selama 3-4 hari dengan suhu 40oC. Setelah kering, potongan buah kepel digrinding agar menjadi serbuk dengan ukuran 100 mesh. Selanjutnya serbuk halus dilarutkan dalam akuades sehingga terbentuk suspensi dan siap digunakan.
Desain Penelitian
Sebanyak 30 ekor mencit dibagi menjadi tiga kelompok, yaitu kelompok kontrol, kelompok dosis 1x dan kelompok dosis 5x. Kelompok kontrol hanya dicekok akuades, kelompok dosis 1x dan kelompok dosis 5x masing-masing dicekok sediaan kepel dengan dosis 2.6 mg/g BB dan 13 mg/g BB. Penentuan dosis pada mencit berdasarkan hasil konversi dosis empiris pada manusia, dengan faktor konversi sebesar 0.0026 (Laurence dan Bacharach 1964). Perhitungan dosis dan volume cekok suspensi daging buah kepel disajikan pada Lampiran 1. Volume pencekokan pada kelompok kontrol sebesar 0.5 ml/hari, dosis 1x sebesar 0.5 ml/hari, dan dosis 5x sebesar 1 ml/ hari. Pada kelompok dosis 5x pencekokan dibagi dua, yang dilakukan pada siang dan malam hari. Untuk kelompok lainnya pencekokan dilakukan pada siang hari selama 14 hari. Pada akhir penelitian, mencit dieuthanasi dan diambil hatinya untuk dibuat sediaan histopatologi.
Pembuatan Preparat Histopatologi Hati
Hati difiksasi dalam larutan buffer neutral formalin 10% selama 3 hari. Hati yang sudah difiksasi kemudian dipotong-potong atau ditrimming dan dimasukkan ke dalam tissue cassette. Selanjutnya jaringan mengalami proses dehidrasi, clearing, embedding, cutting, mounting dan staining dengan pewarnaan
HE. Metode pembuatan dan pewarnaan sediaan histopatologi hati selengkapnya disajikan pada Lampiran 2.
Pengamatan Sediaan Histopatologi Hati Mencit
Pengamatan dilakukan dengan menggunakan mikroskop cahaya dengan perbesaran 10x, 20x dan 40x. Pada setiap preparat hati dilakukan pemotretan pada 20 lapang pandang menggunakan lensa okuler Webcam® dan lensa objektif 40x. Evaluasi organ hati dilakukan pada hasil foto dengan menghitung jumlah hepatosit yang mengalami degenerasi hidropis dan apoptosis dengan menggunakan software ImageJ (Ferreira dan Rasband 2011).
Analisis Statistik
Persentase hasil penghitungan degenerasi hidropis dan apoptosis hepatosit dari tiap 20 lapang pandang dianalisis menggunakan analisis sidik ragam (ANOVA). Jika perlakuan berbeda nyata maka dilakukan uji lanjutan Post-Hoc yaitu uji Duncan (α = 0.05).
HASIL DAN PEMBAHASAN
Pengaruh Pemberian Suspensi Daging Buah Kepel (Stelechocarpus burahol) terhadap Gambaran Histopatologi Hati
Pengamatan histopatologi hati dilakukan hanya pada tiga ekor mencit pada setiap kelompok perlakuan. Hal ini disebabkan tujuh ekor mencit dari kelompok dosis 5x mati dalam perjalanan penelitian. Tujuan penelitian ini ingin mengetahui pengaruh pemberian suspensi daging buah kepel pada dosis normal (dosis 1x) dalam jangka panjang terhadap fungsi hati, sedangkan pemberian dosis 5x bertujuan untuk mengetahui adakah pengaruh peningkatan dosis terhadap perubahan hepatosit.
Hasil pengamatan seluruh sediaan histopatologi hati mencit pada umumnya ditemukan perubahan pada hepatosit berupa degenerasi hidropis dan apoptosis. Selain itu ditemukan pula fokus-fokus sel radang yang terdiri atas sel-sel myeloblast dan eritroblast di sinusoid, di daerah segitiga Kiernan maupun ditepi-tepi vena sentralis. Kumpulan sel-sel radang tersebut merupakan
extramedullary hematopoiesis (Marchiori et al. 2007). Hasil analisis statistik
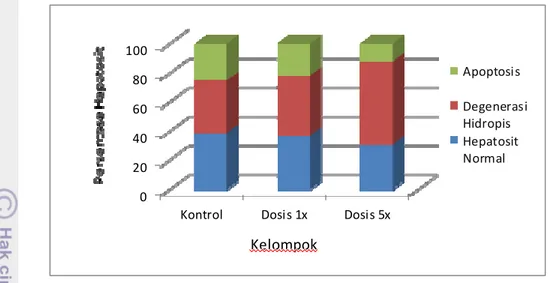
persentase hepatosit mencit yang mengalami degenerasi hidropis dan apoptosis disajikan pada Tabel 2 dan Gambar 3.
Tabel 2 Persentase perubahan hepatosit mencit pada pemberian suspensi daging buah kepel (Stelechocarpus burahol) selama 14 hari.
Persentase (%) Hepatosit
Kelompok Hepatosit Normal Degenerasi Hidropis Apoptosis Kontrol 38.79 ± 15.00a 36.05 ± 12.50a 25.16 ± 13.57a
Dosis 1x 36.89 ± 12.67a 41.45 ± 13.07b 21.66 ± 7.757b
Dosis 5x 30.17 ± 11.73b 57.70 ± 12.57c 12.13 ± 6.47c Keterangan: Huruf berbeda pada kolom yang sama berbeda nyata pada α 0.05
0 20 40 60 80 100
Kontrol Dosis 1x Dosis 5x
Apoptosis Degenerasi Hidropis Hepatosit Normal Kelompok
Gambar 3 Persentase perubahan hepatosit mencit pada pemberian suspensi daging buah kepel (Stelechocarpus burahol) selama 14 hari.
Hasil analisis statistik persentase hepatosit yang mengalami degenerasi hidropis pada kelompok dosis 1x lebih tinggi dan berbeda nyata (p<0,05) dibandingkan dengan kelompok kontrol. Namun jika ditelaah, kenaikannya tidak terlalu besar dibandingkan tingginya kejadian degenerasi hidropis pada kelompok dosis 5x. Persentase degenerasi hidropis pada kelompok dosis 5x lebih tinggi dan berbeda nyata (p<0,05) dibandingkan kelompok dosis 1x dan kelompok kontrol. Peningkatan persentase degenerasi hidropis sejalan dengan meningkatnya dosis pemberian kepel. Dengan demikian degenerasi hidropis pada hepatosit disebabkan oleh pemberian suspensi daging buah kepel.
Degenerasi hidropis merupakan kerusakan sel yang dimulai dengan terjadinya hipoksia yang akan menyebabkan kerusakan membran sel dan penurunan fosforilasi oksidatif, sehingga mengakibatkan terjadinya penurunan ATP. Turunnya ATP menyebabkan penurunan kerja pompa Na. Adanya kerusakan membran sel, ion K+ keluar dari sel sedangkan air, ion Na+ dan ion Ca2+ masuk ke dalam sel secara berlebihan sehingga terjadi pembengkakan sel. Penurunan ATP juga mengakibatkan peningkatan glikolisis sehingga pH sel akan mengalami penurunan. Penurunan pH mengakibatkan benang khromatin pada inti sel menjadi menebal dan pada akhirnya menjadi rusak. Hal ini dapat
menyebabkan hilangnya benang khromatin dan protein yang terkandung sehingga apabila berlanjut akan berujung pada nekrosis sel (Hanna 2011).
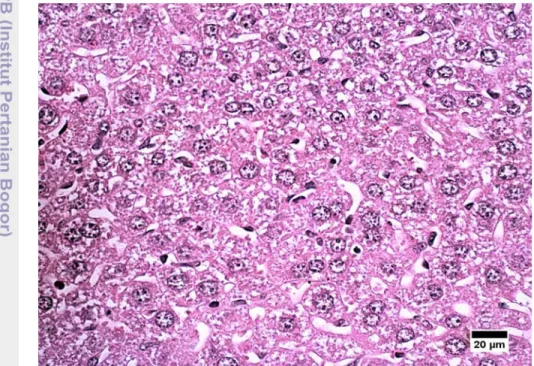
Degenerasi hidropis merupakan repson awal hepatosit terhadap bahan-bahan yang bersifat toksik yang masuk ke hati melalui aliran darah. Dengan demikian degenerasi hidropis biasanya dimulai pada hepatosit-hepatosit yang berada pada tepi lobuler yang kemudian akan menyebar ke sentra lobuler (Talukder 2001). Selain itu, degenerasi hidropis juga dapat terjadi pada hewan yang mengalami hipoksia. Pemberian oksigen yang cukup serta penghentian paparan bahan toksik dapat memulihkan sel yang mengalami degenerasi hidropis. Hepatosit yang mengalami degenerasi hidropis ditandai dengan membengkaknya sitoplasma dan adanya akumulasi cairan interstisium di sitoplasma menyebabkan terbentuk ruang-ruang kosong di sitoplasma hepatosit. Gambaran degenerasi hidropis pada hati mencit yang diberi suspensi daging buah kepel kelompok dosis 5x disajikan pada Gambar 4.
Gambar 4 Hepatosit yang mengalami degenerasi hidropis pada kelompok dosis 5x. Pewarnaan HE, bar:20µ.
Buah kepel memiliki banyak kandungan senyawa aktif, diantaranya adalah tanin. Senyawa tersebut masuk mengikuti aliran darah dari usus menuju ke hati dan mengalami proses metabolisme lebih lanjut. Belum diketahui jenis tanin yang
dikandung kepel, namun tanin merupakan senyawa yang bersifat toksik sehingga hati merespon bahan tersebut dengan terbentuknya lesio degenerasi hidropis.
Jika ditarik secara filogenis buah kepel memiliki kesamaan famili dengan sirsak (Annona muricata) yaitu Annonaceae. Tanaman dengan famili ini memiliki senyawa aktif yang khas yaitu acetogennin atau Annonaceous acetogennin (ACGs). ACGs memiliki bioaktivitas yang luas, diantaranya adalah antimalaria, insektisida, antibakteria dan fungisida (Gonzalez-Coloma et al. 2002). ACGs bekerja dengan cara menghambat pembentukan ATP pada kompleks I mitokondria (Wiart 2007). Oleh sebab itu, ACGs diduga memiliki peranan dalam menyebabkan terjadinya degenerasi hidropis hepatosit. Penurunan produksi ATP mengakibatkan sel hipoksia sehingga terjadi kerusakan membran sel. Hal ini yang menyebabkan cairan interstisium masuk dan mengisi ruang-ruang sitoplasma. Namun perlu dilakukan uji lebih lanjut untuk mengetahui kadar kandungan ACGs di dalam buah kepel.
Hasil analisis statistik persentase hepatosit yang mengalami apoptosis berbanding terbalik dengan yang mengalami degenerasi hidropis. Persentase apoptosis pada kelompok dosis 1x lebih rendah dan berbeda nyata (p<0,05) dibandingkan kelompok kontrol. Demikian pula persentase apoptosis kelompok dosis 5x lebih rendah dan berbeda nyata (p<0,05) dibandingkan kelompok dosis 1x dan kelompok kontrol.
Apoptosis merupakan suatu bentuk kematian sel terprogram yang bersifat aktif yang ditandai dengan adanya kondensasi kromatin dan fragmentasi kromosom (D’Amico dan McKenna 1994). Apoptosis berbeda dengan nekrosis dimana sel berperan aktif dalam proses terminasi diri, sedangkan pada nekrosis sel berperan pasif. Menurut Underwood (1996), proses nekrosa melibatkan banyak sel yang diiringi oleh terjadinya peradangan dan fagositasi oleh makrofag. Sel-sel yang mengalami apoptosis akan menyerap lebih banyak pewarna eosin, sehingga sitoplasma sel hati yang mengalami apoptosis berwarna lebih merah dengan inti yang berwarna lebih ungu.
Apoptosis biasanya dicirikan oleh sel yang mengalami terminasi diri yang tidak diikuti oleh peradangan. Menurut Dash (2011), apoptosis dapat terjadi akibat berbagai macam stimuli seperti ionisasi radiasi benang kromatin, infeksi
virus, ekspresi gen proapoptosis melalui aktivasi enzim caspase, tekanan pada sel seperti deplesi faktor pertumbuhan, tekanan pada sitoplasma, dan radikal bebas.
Apoptosis secara normal muncul selama proses perkembangan dan penuaan sebagai mekanisme homeostasis untuk menjaga populasi sel dalam jaringan (Kresno 2001). Sekitar 10 miliar sel hati dibuat setiap harinya untuk menyeimbangkan sel-sel hati yang mengalami apoptosis (Renehan et al. 2001). Kejadian ini disebut juga dengan istilah regenerasi sel. Menurut Kuntz dan Kuntz (2008), regenerasi fisiologis hati mengikuti fisiologi penuaan sel sehingga sel apoptosis merupakan kematian sel yang terprogram. Regenerasi hepatosit akan mengisi ruang jaringan hati yang hilang. Regenerasi sempurna menghasilkan bentuk sel dan perbaikan fungsi spesifik sel, sedangkan regenerasi tidak sempurna akan menyebabkan area nekrosis diisi oleh jaringan pengganti. Apoptosis juga muncul sebagai respon terhadap keadaan stres oksidatif akibat adanya radikal bebas (Norbury dan Hickson 2001).
Daging buah kepel mengandung flavonoid tertinggi dibandingkan bagian buah lainnya yaitu sebesar 29,12 ppm sedangkan standar flavonoid pada vitamin C hanya sebesar 5.35 ppm. Flavonoid diproduksi oleh tanaman sebagai respon alami saat tanaman mengalami luka (Tisnadjaja et al. 2006). Flavonoid merupakan senyawa pigmen paling umum di dunia tanaman, kadang bersifat fluorescent setelah dilakukan radiasi UV dan merupakan derivat dari asam shikimik melalui jalur propanoid. Komponen terkait yang dihasilkan melalui reaksi kompleks jaringan adalah isoflavon, auron, flavananon dan flavononol yang dihasilkan dari kalkon. Leukoantosianidin, flavanon dan flavanol dihasilkan dari flavanonol, sedangkan antosianidin dihasilkan dari leukoantosianidin (Kintzios dan Barberaki 2004).
Flavonoid merupakan senyawa antioksidan yang berfungsi sebagai penangkap radikal bebas hasil metabolisme aerob. Proses metabolisme aerob menghasilkan oksigen reaktif atau Reactive Oxygen Species (ROS) (Fleury et al. 2002). Oksigen reaktif ini disebut dengan istilah radikal bebas yang dihasilkan di mitokondria. ROS atau sering juga disebut dengan pro-oxidant bersifat tidak stabil dan reaktif terhadap jaringan. Stres oksidatif terbentuk apabila terjadi ketidakseimbangan jumlah pro-oxidant yang berpotensi sebagai radikal bebas
dengan anti-oxidant dalam jaringan. Stres oksidatif juga dianggap berperan dalam proses penuaan (Yan et al. 1997).
ROS berbahaya apabila mengoksidasi senyawa tertentu seperti asam lemak tak jenuh, yang prosesnya disebut dengan lipid peroxidation (Kuntz dan Kuntz 2008). Peroksidasi lipid dapat menyebabkan kerusakan membran sel yang memicu terjadinya apoptosis. Selama apoptosis, permeabilitas mitokondria mengalami peningkatan, terjadi pengaktivan enzim-enzim proapoptosis seperti caspase activator dan procaspase. Enzim-enzim ini dapat memicu kerusakan membran mitokondria sehingga merangsang sel melakukan apoptosis (Fleury et
al. 2002).
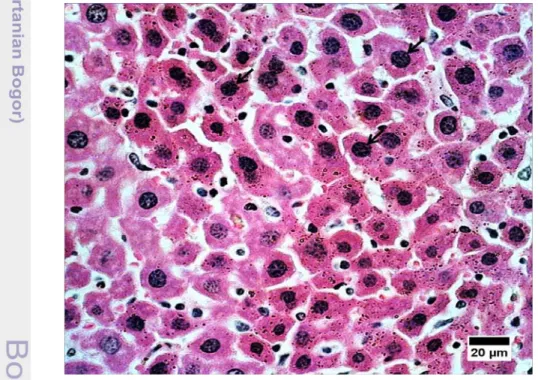
Adanya apoptosis pada kelompok kontrol diduga merupakan respon fisiologis sel hati menanggapi stres oksidatif. Persentase apoptosis yang lebih rendah pada kelompok perlakuan dosis 5x dan 1x dibandingkan kontrol kemungkinan disebabkan oleh senyawa flavonoid yang dikandung buah kepel. Senyawa flavonoid berfungsi sebagai antioksidan yang memperpanjang masa hidup sel-sel hati, sehingga semakin besar dosis pemberian kepel maka jumlah sel hati yang mengalami apoptosis semakin rendah. Hepatosit yang mengalami apoptosis pada kelompok kontrol disajikan pada Gambar 5.
Gambar 5 Hepatosit yang mengalami apoptosis pada kelompok kontrol. Pewarnaan HE, bar : 20µ.
Di tepi-tepi vena sentralis, vena porta dan sinusoid ditemukan kumpulan atau fokus-fokus sel-sel myeloblast dan eritroblast. Kumpulan sel ini merupakan
extramedullary hematopoiesis (EMH), yang terbentuk terutama bila hewan
mengalami anemia dan myelofibrosis. Selain itu EMH juga ditemukan pada kasus tumor jinak kelenjar mammae pada anjing (Grandi et al. 2010). EMH biasanya ditemukan di organ hati, limpa dan limfonodus yang terdiri atas sel-sel mieloblast dan eritroblast (NIEHS 2010).
Anemia didefinisikan sebagai suatu keadaaan yang ditandai dengan rendahnya konsentrasi hemoglobin dalam darah yang dapat disebabkan oleh beberapa faktor. Salah satu faktor tersebut adalah nutrisi, yang memiliki peranan penting pada kejadian anemia. Beberapa vitamin seperti vitamin B12, asam folat
dan riboflavin mempengaruhi pembentukan hemoglobin, akan tetapi faktor nutrisi yang paling berperan dalam kejadian anemia adalah defisiensi zat besi.
Defisiensi zat besi awalnya ditandai dengan deplesi penyimpanan zat besi, eritropoiesis akibat kurangnya zat besi dan anemia defisiensi zat besi. Salah satu indikator terpenting dalam menentukan status zat besi dalam darah adalah pengukuran feritin. Pada awal terjadinya defisiensi zat besi, konsentrasi feritin sudah mulai menurun sehingga membuat feritin sebagai parameter yang sangat sensitif dalam menentukan terjadinya anemia. Feritin yang rendah selalu mengindikasikan terjadinya deplesi penyimpanan zat besi (Biesalski dan Erhardt 2007). Feritin merupakan protein penyimpan zat besi dalam darah. Zat besi dalam darah yang dapat disimpan tiap molekul feritin dapat mencapai 4500 atom (Lynch 2007). Feritin berada di sekitar sel makrofag pada organ hati, limpa, dan otot rangka. Zat besi di dalam darah memiliki peranan vital dalam transpor dan penyimpanan oksigen, metabolisme oksidatif dan proses fisiologis lainnya.
Selain flavonoid, menurut Darusman (2010) daging buah kepel juga mengandung senyawa tanin. Tanin merupakan senyawa kelas fenol yang dibentuk melalui jalur fenilpropanoid. Terdapat dua jenis tanin yang mempengaruhi nutrisi hewan yaitu tanin yang dapat dihidrolisis (hydrolyzable
tannins/Hts) dan tanin padat yang disebut dengan proantosianidin. Proantosinidin
merupakan polimer dari flavonoid yang dihubungkan oleh ikatan karbon, dan ikatan ini tidak dapat dipisahkan oleh hidrolisis. Jumlah proantosianidin di dalam
tumbuhan jauh lebih banyak dibandingkan jumlah tanin terhidrolisis. Tanin memiliki aktivitas mengendapkan protein dan bentuk senyawa kompleks seperti alkaloid dan glikosida.
Kapasitas tanin dalam mengikat protein bersifat spesifik dan bergantung pada struktur dari tanin, protein maupun kondisi reaksinya. Protein yang diikat tanin merupakan protein dengan ukuran molekul yang besar, memiliki struktur yang fleksibel dan terbuka serta kaya akan prolin, sedangkan tanin yang mengikat protein memiliki berat molekul yang tinggi dan mobilitas konformasi yang tinggi. Faktor yang mendukung terjadinya interaksi protein dengan tanin adalah pH, suhu, komposisi protein terlarut dan waktu (Hagerman 1992). Tanin memiliki sifat astringensia yang bekerja dengan cara melapisi mukosa usus sehingga menurunkan daya serap nutrisi oleh usus.
Tanin dapat menginduksi terjadinya anemia karena dapat mengikat protein darah yaitu feritin sehingga tubuh mengalami defisiensi zat besi. Walaupun kadar tanin dalam daging buah kepel belum diketahui hingga saat ini, namun adanya senyawa tanin cukup memberikan landasan dugaan pengaruhnya terhadap hati mencit. Protein yang diikat oleh tanin dapat mengakibatkan mencit mengalami hipoproteinemia, yang pada akhirnya akan berujung pada anemia. Anemia yang terjadi pada mencit dapat dilihat dari terbentuknya fokus-fokus extramedullary
hematopoiesis (EMH) pada jaringan hati. Agregat sel-sel EMH ini ditemukan
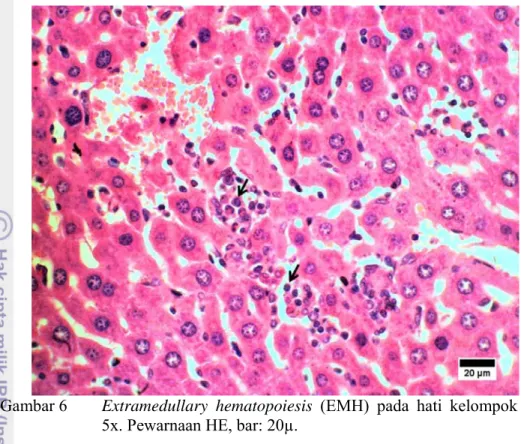
pada seluruh kelompok mencit, dan fokus EMH jauh lebih banyak ditemukan pada kelompok kepel dengan dosis 5x. Hal ini disebabkan lebih banyak suspensi daging buah kepel yang dikonsumsi sehingga lebih banyak pula senyawa tanin yang dicerna. Akibatnya, semakin sedikit nutrisi pakan yang dapat diserap oleh mencit kelompok dosis 5x dibandingkan kelompok dosis 1x dan kontrol. Fokus-fokus EMH disajikan pada Gambar 6.
Gambar 6 Extramedullary hematopoiesis (EMH) pada hati kelompok dosis
SIMPULAN DAN SARAN
Simpulan
Pemberian suspensi daging buah kepel (Stelechocarpus burahol) pada dosis 2.6 mg/g BB dan dosis 13 mg/g BB selama 14 hari menginduksi terjadinya degenerasi hidropis dan extramedullary hematopoiesis (EMH), serta menurunkan terjadinya apoptosis pada hepatosit mencit. Dengan demikian konsumsi buah kepel harus dengan dosis rendah dan jangan terlalu lama.
Saran
1. Perlu dilakukan uji toksisitas subkronis untuk mengetahui pengaruh pemberian buah kepel dengan dosis 2.6 mg/g BB dan dalam jangka waktu yang lebih panjang terhadap sel hati mencit.
2. Perlu dilakukan uji toksisitas LD50 terhadap daging buah kepel
(Stelechocarpus burahol).untuk mengetahui dosis aman hingga dosis lethal. 3. Perlu dilakukan pretreatment pada hewan coba sebelum perlakuan dimulai,
seperti pemberian antibiotik, obat cacing dan obat antiprotozoa agar hewan coba yang digunakan bersih dari agen patogen.
DAFTAR PUSTAKA
[[Anonim 1]. 2009. Stimuno. http://www.dexa-medica.com/ourproducts/otc/detail.php?id=35. [7 Juli 2011].
[Anonim 2]. 7 Agustus 2003. Memanfaatkan potensi buah burahol. Pikiran Rakyat. www.pikiran-rakyat.com. [16 Agustus 2011].
Aughey E, Frey FL. 2001. Comparative Veterinary Histology with Clinical
Correlates. London: Manson Publishing. 124-127p.
[BPOM]. Badan Pengawas Obat dan Makanan. 2004. Ketentuan Pengawasan Obat dan Makanan. Jakarta.
Banks WJ. 1986. Applied Veterinary Histology. Baton Rouge, Louisiana: Williams & Wilkins.
Biesalski HK, Erhardt JG. 2007. Diagnosis of nutritional anemia-laboratory assessment of iron status. Didalam: Kraemer K dan Zimmermann MB, editor. Nutritional Anemia.Germany: Sight and Life. hlm 37-44.
D’amico AV, McKenna WG. 1994. Apoptosis and re-investigation of the biologic basis of cancer therapy, radiotherapy and oncology. Radiother Oncol 33:3-10.
Dash P. 2011. Apoptosis. Basic Medical Sciences, St. George’s University of
London. [terhubung berkala]. www.sgul.ac.uk/dept/immunology/~dash. [2
Oktober 2011].
Darusman HS. 2010. Aktivitas Farmakologis Tanaman Kepel (Stelechocarpus
burahol (Blume) Hook & Thompson) Sebagai Deodoran Topikal dan Oral.
[Thesis]. Bogor: Fakultas Kedokteran Hewan Institut Pertanian Bogor. Elmore S. 2007. Apoptosis: a review of programmed cell death. Toxicol Pathol.
35 (4): 495-516.
Fachrurozi Z. 1980. Burahol (Stelechocarpus burahol (Blume) Hook & Thomson) deodoran tempo dulu dan masalah pelestariannya. Buletin Kebun Raya 4 (4): 127-130.
Ferreira T, Rasband W. 2011. ImageJ User Guide: IJ 1.45m. [terhubung berkala]. http://rsb.info.nih.gov/ij/docs/index.html. [6 November 2011].
Fleury C, Mignotte B, Vayssiere JL. 2002. Mitochondrial reactive oxygen species in signaling cell death. Biochim 84: 2-3. [abstrak].
http://www.sciencedirect.com/science/article/pii/S030090840201369X . [2 Oktober 2011].
Gonzalez-Coloma A, Guadano A, De Ines C, Martinez-Diaz R, Cortes D. 2002. Selective actions of acetogennin mitochondrial complex I inhibitors. Z.
Naturforsch 57:1028-1034.
Grandi F, Colodel MM, Monteiro LN, Leao JR, Rocha NS. 2010. Extramedullary hematopoiesis in a case of benign mixed mammary tumor in a female dog: cytological and histopathological assessment. BMC Vet Res (6) 45.
Guyton AC, Hall JE. 2007. Buku Ajar Fisiologi Kedokteran Edisi 11. Jakarta: EGC. 902-908p.
Hagerman AE. 1992. Tannin-Protein Interaction. Phenolics Compounds in Food
and How They Affect on Health I 506: 236-247 [terhubung berkala].
http://pubs.acs.org/doi/abs/10.1021/bk-1992-0506.ch019 [10 Oktober 2011].
Hanna P. 2011. Cellular pathology. [terhubung berkala]. http://people.upei.ca/hanna/. [2 Oktober 2011]
Heyne K. 1987. Tumbuhan Berguna di Indonesia Jilid II. Jakarta: Badan Litbang Kehutanan.
Huffman MA, Gotoh S, Turner LA, Hamai M, Yoshida K.1997. Seasonal trends in intestinal nematode infection and medicinal plant use among chimpanzees in the Mahale Mountains, Tanzania. Primates 38:111-125. Kintzios SE, Barberaki MG. 2004. Plants That Fight Cancer. Boca Raton: CRC
Press. 22-23p.
Kmiec Z. 2001. Cooperation of liver cells in health and diseases. Adv Anat
Embriol Cell Biol. 161 (III-XIII): 1-151.
Kresno SB. 2001. Ilmu Onkologi Dasar. Bagian Patologi Klinik FK UI: Indonesia. hlm 13-15.
Kuntz E, Kuntz HD. 2008. Hepatology: Textbook and Atlas. Germany: Springer. hlm 407.
Kusuma FR, Zaky MB. 2005. Tumbuhan Liar Berkhasiat Obat. Jakarta : Agromedia Pustaka.
Laurence J, Bacharach M. 1964. Analytical Toxicology. Philadelphia: CRC Press. Lynch S. 2007. Iron metabolism. Di dalam: Kraemer K dan Zimmermann MB,
Maher JJ. 1997. Exploring alcohol’s effects on liver function. Alchl Health and
Res Wor. 21:5-12.
Malole MBM, Pramono CSU. 1989. Bahan Pengajaran Penggunaan
Hewan-hewan Percobaan di Laboratorium. Bogor: Departemen Pendidikan dan
Kebudayaan, Direktorat Jenderal Pusat Antar Universitas Bioteknologi, Institut Pertanian Bogor. 94-103p.
Marcheix JJ, Fleuriel A, Billiot J. 1990. Fruit Phenolics. Boca Raton: CRC Press.\ Marchiori E, Escuisato DL, Irion KL, Zanetti G, Rodrigues RS, Meirelles GS,
Hochhegger B. 2007. Extramedullary hematopoiesis: findings on computed tomography scans of the chest in 6 patients. Jor. Bras. Pneum.
[terhubung berkala].
http://www.scielo.br/scielo.php?script=sci_arttext&pid=S1806-37132008001000009&lng=en&nrm=iso&tlng=en . [12 Oktober 2011] [NIEHS]. National Institute of Environmental Health Sciences. 2011. The
Digitized Atlas of Mouse Liver Lesions: Extramedullary Hematopoiesis.
[terhubung berkala].
http://www.niehs.nih.gov/research/atniehs/labs/lep/path-support/core-support/lverpath/miscellaneous.cfm [6 Oktober 2011].
Norbury CJ, Hickson ID. 2001. Cellular responses to DNA damage. Annu Rev
Pharmacol Toxicol 41:367–401.
Ohigashi H, Huffman MA, Izutsu D, et al. 1994. Toward the chemical ecology of medicinal plant use in chimpanzee: the case of Vernonia amygdalina Del. A plant used by will chimpanzees possible for parasite-related diseases. J
Chem Ecol 20:246-252.
Osorio E, Arango GJ, Jimenez N, Alzate F, Ruiz G, Guiterrez D, Paco MA, Gimenez A, Robledo S. 2007. Antiprotozoal and Cytotoxic Activities In Vitro of Colombian Annonaceae. J Ethnopharmacol.111(3):630-5.
Spiridonova LN, Chelomina GN, Moriwaki K, Yonekawa H, Bognado AH. 2003. Genetic and taxonomic diversity of the house mouse Mus musculus from the Asian part of the former Soviet Union. Russ J of Gen 40 (10): 1134-1143.
Piersen CE. 2003. Phytoestrogen in Botanical Dietary Supplements: Implication for Cancer. Integr Cancer Ther Jun 2 (2): 120-138.
Purwatinigsih, Hakim AR, Purwantini. 2010. Antihyperuricemic activity of the Kepel [Stelechocarpus burahol (Bl.) Hook. F. & Th.] leaves extract and xanthine oxidase inhibitory study. International J of Pharmacy and Pharm
Renehan AG, Booth C, Potten CS. 2001. What is apoptosis, and why is it important?. BMJ 322:1536–8.
Shiddiqi T, Rindiastuti Y, Sri NA. 2008. Potensi In Vitro Zat Sitotoksik
AntiKkanker Daun Tanaman Kepel (Stelechocarpus burahol) terhadap carcinoma colorectal. Surakarta: Fakultas Kedokteran, Universitas
Sebelas Maret.
Sinclair J. 1955. A Revised of the Malayan Annonaceae. The Gardens' Bulletin
Singapore. 14 (15): 149-515
Sunardi CSA, Padmawinata K, Kardono LBS, Gana A. 2007. Isolasi dan
Identifikasi Kulit Batang Burahol (Stelechocarpus burahol) Terhadap sel Leukimia [disertasi]. Bandung : Institut Teknologi Bandung, Sekolah
Farmasi.
Sunarni T, Pramono S, Asmah R. 2007. Flavonoid antioksidan penangkap radikal
dari daun kepel (Stelechocarpus burahol). Majalah Farmasi Indonesia ;
18(3).
Sunarto AT. 1992. Burahol kosmetika alam bagi kerabat keraton. Trubus 18 (207): 103-104.
Talukder SI. 2001. Lecture notes on pathology of hepatobiliary system.
[terhubung berkala]. http://www.talukderbd.com/lectures/hepatobiliary_system_note.pdf [6
September 2011].
Tisnadjaja D, Saliman E, Silvia, Simanjuntak P. 2006. Pengkajian Burahol (Stelechocarpus burahol (Blume) Hook & Thompson) sebagai buah yang memiliki kandungan senyawa antioksidan. Biodiv 7 (2): 199-202.
Umiyah. 2005. Existence of Stelechocarpus burahol (Blume) Hook & Thompson. in wilderness zone, Bande Alit Resort, Meru Betiri National Park. Berk.
Penel.Hayati: 10 (85-88).
Underwood JCE. 1996. General and Systematic Pathology: 2nd
Ed. Churchill
Livingstone: NewYork-London-Madrid. hlm 117-119.
Verhejj EWM, Coronell RE. 1997. Sumber Daya Nabati Asia Tenggara 2.
Buah-buahan yang Dapat Dimakan. Bogor: Prosea.
Warningsih. 1995. Uji fitokimia dan efek antiimplantasi ekstrak etanol bunga
hibiscus rosa-sinensis, buah Piper nigrum, dan buah Stelechocarpus burahol [abstrak]
Wiart C. 2007. Goniothalamus species: A source of drugs for the treatment of cancers and bacterial infections?. eCAM 4 (23) 299-311.
Wong KF. 2010. Kepel dan Matoa. http://wongkamfung.boogoor.com/kepel-dan-matoa112.html. [15 Agustus 2011]
Wrangham RW. 1994. Feeding behavior of chimpanzee in Gombe National Park, Tanzania, In: Clutton-Brock TH, ed. Primate Ecology. New York: Academic Press : 504-538.
Wynn SG, Fougere BJ. 2007. Veterinary Herbal Medicine. Missouri: Mosby, Inc. hlm 12-20.
Yan LJ et al. 1997. Oxidative damage during aging targets mitochondrial aconitase. Proc. Natl. Acad. Sci. USA. 94: 11168-11172.
Lampiran 1. Penghitungan Dosis Pemberian Kepel.
• Berat keseluruhan daging buah kepel yang masih basah:440 g, dan setelah dikeringkan diperoleh 60 g serbuk simplisia kering. Jadi rendemen kepel:60 g/440 g x 100% = 13.63%
• Dosis empiris konsumsi kepel pada manusia adalah 2 buah kepel dalam 2 hari. Jika diasumsikan berat kepel adalah 70 g/buah dan BB manusia 70 kg, maka konsumsi kepel pada manusia dalam dua hari adalah 140 g/70 kg. Konsumsi buah kepel dalam bentuk serbuk kering pada manusia adalah: 13.63/100 x 140 g= 19.08 g atau rata-rata 20 g serbuk kering.
• Faktor konversi dosis manusia ke mencit: 0.0026 (Laurence & Bacharach 1964), sehingga dosis konsumsi kepel normal (sama dengan dosis pada manusia) adalah: = 20 g x 0.0026 = 0.052 g/20g mencit = 52 mg/20 g mencit = 2.6 mg/g BB mencit (Dosis 1x) • Dosis 5x= 2.6 mg/g BB x 5 = 13 mg/g BB.
Lampiran 2. Penghitungan Volume Pemberian Kepel. • Dosis 1x = 2.6 mg/g BB
Volume pemberian = (Dosis x BB)/Konsentrasi = (2.6 mg/g BB x 20 g)/10% = (2.6 mg/g x 20 g)/(10 g/100 ml)
= (52 mg)/100 mg/ml
= 0.5 ml
• Dosis 5x = 13 mg/g BB
Volume pemberian = (Dosis x BB)/konsentrasi 0.5 ml= (13 mg/g x 20 g BB)/konsentrasi Konsentrasi = 260 mg/0.5 ml
= 520 mg/ml
Konsentrasi = 5.2 g/10mlÆ5.2 g serbuk buah dilarutkan ke dalam 10 ml akuades.
• Kepel tidak dapat tersuspensi dengan baik dalam akuades karena terlalu pekat sehingga untuk dosis 5x, konsentrasi yang digunakan sebesar 2.6 gr/10 ml, dan didapat volume pemberian sebesar 1 ml.
Lampiran 3. Pembuatan Sediaan Histopatologi dan Pewarnaan HE.
Hati difiksasi dalam larutan Buffer Neutral Formalin 10% selama 3 hari. Hati yang sudah difiksasi dipotong-potong atau ditrimming dan dimasukkan kedalam tissue cassette.
Selanjutnya jaringan didehidrasi dengan cara dimasukkan secara berturut-turut ke dalam larutan alkohol 70%, 80%, 90% dan alkohol 95% selama 2 jam. Kemudian dehidrasi dilanjutkan ke dalam alkohol absolut I selama 2 jam, alkohol absolut II selama 2 jam, xylol I, xylol II dan xylol III masing-masing selama 40 menit, parafin I, parafin II, parafin III dan parafin IV masing-masing selama 30 menit dalam suhu 60o C.
Proses selanjutnya adalah embedding dimana jaringan dimasukkan ke
dalam blok pencetak berisi parafin cair kemudian parafin cair ditambahkan lagi ke dalam blok pencetak hingga penuh dan ditunggu sampai seluruh parafin mengeras. Setelah paraffin mengeras blok paraffin dimasukkan ke dalam
refrigerator dengan suhu sekitar 4-6°C.
Proses pembuatan sediaan histopatologi dilanjutkan dengan pengirisan blok parafin menggunakan mikrotom dengan ketebalan 3-5 mµ. Kemudian potongan jaringan tersebut diletakkan di atas permukaan air hangat dengan suhu 45°C untuk menghilangkan lipatan-lipatan. Setelah itu potongan jaringan diangkat (mounting) dengan kaca objek yang sudah diulas dengan larutan albumin.
Sediaan dikeringkan selama minimal 2 jam dalam inkubator bersuhu 58°C. Selanjutnya dilakukan pewarnaan HE, dengan mencelupkan sediaan ke dalam larutan-larutan dengan urutan sebagai berikut: larutan xylol I dan xylol II masing-masing selama dua menit, alkohol absolut selama 2 menit, alkohol 95% dan 80% masing-masing selama 1 menit, kemudian dicuci dalam air keran atau akuades selama 1 menit, dilanjutkan dengan memasukkan sediaan ke dalam larutan pewarna Mayer’s Hematoksilin selama 8 menit, kemudian dicuci kembali dengan air keran selama 30 detik. Setelah itu sediaan dimasukkan ke dalam larutan lithium karbonat selama 15-30 detik dan kembali dicuci dengan air keran atau akuades selama 2-3 menit. Selanjutnya sediaan diwarnai dengan pewarna eosin selama dua menit dan dicuci dalam air keran selama 30-60 detik.
Langkah selanjutnya adalah mencelup sediaan ke dalam larutan alkohol 95% sebanyak sepuluh kali, alkohol absolut I sebanyak sepuluh kali, alkohol absolut II selama dua menit, xylol I selama satu menit, dan xylol II selama dua menit. Setelah itu sediaan dikeringkan dan diberi perekat permount, lalu ditutup dengan kaca penutup dan disimpan selama beberapa menit sampai zat perekat mengering dan sediaan siap untuk diamati.
Lampiran 4 Analisis Perubahan Degenerasi Hidropis Pada Sel Hati.
dh * perlakuan Dh
perlakuan Mean N Std. Deviation
kontrol 36.0500 60 12.49736 dosis 1x 41.4500 60 13.07012 dosis 5x 57.7000 60 12.57291 Total 45.0667 180 15.65323 Dh Duncan perlakuan N Subset 1 2 3 kontrol 60 36.0500 dosis 1x 60 41.4500 dosis 5x 60 57.7000 Sig. 1.000 1.000 1.000
Means for groups in homogeneous subsets are displayed. Based on observed means.
Lampiran 5 Analisis Perubahan Apoptosis Pada Sel Hati.
apoptosis * perlakuan apoptosis
perlakuan Mean N Std. Deviation
kontrol 25.1667 60 13.56862 dosis 1x 21.6667 60 7.74743 dosis 5x 12.1333 60 6.46887 Total 19.6556 180 11.16975 apoptosis Duncan perlakuan N Subset 1 2 3 dosis 5x 60 12.1333 dosis 1x 60 21.6667 kontrol 60 25.1667 Sig. 1.000 1.000 1.000
Means for groups in homogeneous subsets are displayed. Based on observed means.
Lampiran 6 Analisis Sel Hati Normal.
normal * perlakuan normal
perlakuan Mean N Std. Deviation
kontrol 38.7833 60 15.00406 dosis 1x 36.8833 60 12.67467 dosis 5x 30.1667 60 11.71724 Total 35.2778 180 13.64353 normal Duncan perlakuan N Subset 1 2 dosis 5x 60 30.1667 dosis 1x 60 36.8833 kontrol 60 38.7833 Sig. 1.000 .443
Means for groups in homogeneous subsets are displayed.
Based on observed means.
The error term is Mean Square(Error) = 183.017.