Absorpsi
Dalam absorbansi, satu substansi diambil ke dalam struktur fisik dari bahan lainnya. Zat, yang menyerap ke dalam zat lain, dikenal sebagai “absorbat.” Zat yang menyerap absorbat yang dikenal sebagai “absorben.” Sebagai contoh, jika suatu molekul organik masuk ke dalam partikel padat (partikel tanah), maka molekul organik absorbat, dan partikel tanah adalah absorben. Absorben bisa menjadi gas, cair atau padat, sedangkan absorbat dapat menjadi atom, ion atau molekul. Biasanya, absorbat dan absorben yang berada dalam dua fase yang berbeda. Sifat Penyerapan bahan kimia yang digunakan dalam berbagai kesempatan. Sebagai contoh, ini adalah prinsip di belakang ekstraksi cair-cair. Di sini, zat terlarut dapat diekstraksi dari satu cairan ke cairan lainnya, karena zat terlarut lebih diserap ke salah satu cairan dari yang lain ketika mereka berada dalam wadah yang sama. Dalam rangka untuk menyerap, absorben harus memiliki struktur berpori atau cukup ruang di mana absorbat dapat ditampung. Molekul absorbat juga harus memiliki ukuran yang cocok, untuk masuk ke dalam struktur penyerap. Selanjutnya, harus ada gaya tarik menarik antara dua untuk memudahkan proses penyerapan. Sama seperti massa yang diserap; energi juga dapat diserap ke dalam zat. Ini adalah dasar spektrofotometri. Di sana, cahaya diserap oleh atom, molekul atau yang lainnya.
Adsorpsi
Dalam adsorpsi, suatu zat atau energi yang tertarik pada permukaan adalah masalah lainnya. Zat yang menarik disebut “adsorbat”, dan permukaan disebut “adsorben.” Benda antara bahan organik dan karbon aktif adalah contoh adsorpsi. Bahan organik adalah adsorbat dalam
kesempatan ini, dan adsorben adalah karbon aktif. Contoh lain dari adsorpsi menarik protein ke biomaterial. Adsorpsi dapat dari tiga jenis, adsorpsi fisik, kemisorpsi, dan adsorpsi elektrostatik. Dalam adsorpsi fisik, gaya lemah van der Waals adalah kekuatan menarik. Dalam kemisorpsi, daya tarik berlangsung melalui reaksi kimia antara adsorben dan adsorbat. Seperti namanya, dalam adsorpsi elektrostatik, interaksi elektrostatik terbentuk antara ion dan permukaan. Apa perbedaan antara Absorpsi dan Adsorpsi?
1. Dalam absorpsi, suatu zat (materi atau energi) dibawa ke zat lain. Namun dalam adsorpsi interaksi terjadi hanya pada tingkat permukaan yang sedang berlangsung.
titrasi Asam Basa
Titrasi asam-basa sering disebut juga dengan titrasi netralisasi. Dalam titrasi ini, kita dapat menggunakan larutan standar asam dan larutan standar basa. Pada prinsipnya, reaksi yang terjadi adalah reaksi netralisasi yaitu :
Reaksi netralisasi terjadi antara ion hidrogen sebagai asam dengan ion hidroksida sebagai basa dan membentuk air yang bersifat netral. Berdasarkan konsep lain reaksi netralisasi dapat juga dikatakan sebagai reaksi antara donor proton (asam) dengan penerima proton (basa).
Dalam menganalisis sampel yang bersiaft basa, maka kita dapat menggunakan larutan standar asam, metode ini dikenal dengan istilah asidimetri. Sebaliknya jika kita
Gambar 15.16. Titrasi alkalimetri dengan larutan standar basa NaOH
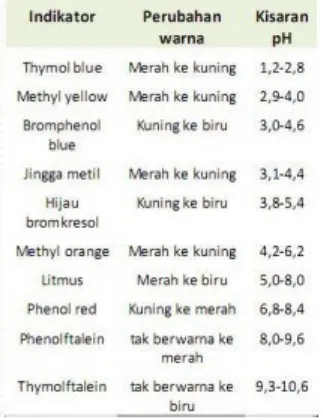
Analit bersifat asam pH mula-mula rendah, penambahan basa menyebabkan pH naik secara perlahan dan bertambah cepat ketika akan mencapai titik ekuivalen (pH=7). Penambahan selanjutnya menyebakan larutan kelebihan basa sehingga pH terus meningkat. Dari Gambar 15.16, juga diperoleh informasi indikator yang tepat untuk digunakan dalam titrasi ini dengan kisaran pH pH 7 – 10 (Tabel 15.2).
Tabel 15.2. Indikator dan perubahan warnanya pada pH tertentu
Pamanfaatan teknik ini cukup luas, untuk alkalimetri telah dipergunakan untuk
menentukan kadar asam sitrat. Titrasi dilakukan dengan melarutkan sampel sekitar 300 mg kedalam 100 ml air. Titrasi dengan menggunakan larutan NaOH 0.1 N dengan menggunakan indikator phenolftalein. Titik akhir titrasi diketahui dari larutan tidak berwarna berubah menjadi merah muda. Selain itu alkalimetri juga dipergunakan untuk menganalisis asam salisilat, proses titrasi dilakukan dengan cara melarutkan 250 mg sampel kedalam 15 ml etanol 95% dan tambahkan 20 ml air. Titrasi dengan NaOH 0.1 N menggunakan indikator phenolftalein, hingga larutan berubah menjadi merah muda. Teknik asidimetri juga telah dimanfaatkan secara meluas misalnya dalam pengujian boraks yang seringa dipergunakan oleh para penjual bakso. Proses analisis dilakukan dengan melaruitkan sampel seberat 500 mg kedalam 50 mL air dan ditambahkan beberapa tetes indikator metal orange, selanjutnya dititrasi dengan HCl 0.1 N.
Prinsip Titrasi Asam basa
Titrasi asam basa melibatkan asam maupun basa sebagai titer ataupun titrant. Titrasi asam basa berdasarkan reaksi penetralan. Kadar larutan asam ditentukan dengan menggunakan larutan basa dan sebaliknya.
Titrant ditambahkan titer sedikit demi sedikit sampai mencapai keadaan ekuivalen ( artinya secara stoikiometri titrant dan titer tepat habis bereaksi). Keadaan ini disebut sebagai “titik ekuivalen”.
Pada saat titik ekuivalent ini maka proses titrasi dihentikan, kemudian kita mencatat volume titer yang diperlukan untuk mencapai keadaan tersebut. Dengan menggunakan data volume titrant, volume dan konsentrasi titer maka kita bisa menghitung kadar titrant. Cara Mengetahui Titik Ekuivalen
Ada dua cara umum untuk menentukan titik ekuivalen pada titrasi asam basa. a. Memakai pH meter untuk memonitor perubahan pH selama titrasi dilakukan,
kemudian membuat plot antara pH dengan volume titrant untuk memperoleh kurva titrasi. Titik tengah dari kurva titrasi tersebut adalah “titik ekuivalent”.
b. Memakai indicator asam basa. Indikator ditambahkan pada titrant sebelum proses titrasi dilakukan. Indikator ini akan berubah warna ketika titik ekuivalen terjadi, pada saat inilah titrasi kita hentikan.
c. Pada umumnya cara kedua dipilih disebabkan kemudahan pengamatan, tidak diperlukan alat tambahan, dan sangat praktis.
Indikator yang dipakai dalam titrasi asam basa adalah indicator yang perbahan warnanya dipengaruhi oleh pH. Penambahan indicator diusahakan sesedikit mungkin dan umumnya adalah dua hingga tiga tetes.
Untuk memperoleh ketepatan hasil titrasi maka titik akhir titrasi dipilih sedekat mungkin dengan titik equivalent, hal ini dapat dilakukan dengan memilih indicator yang tepat dan sesuai dengan titrasi yang akan dilakukan.
Keadaan dimana titrasi dihentikan dengan cara melihat perubahan warna indicator disebut sebagai “titik akhir titrasi”.
Rumus Umum Titrasi
Pada saat titik ekuivalen maka mol-ekuivalent asam akan sama dengan mol-ekuivalent basa, maka hal ini dapat kita tulis sebagai berikut:
mol-ekuivalen asam = mol-ekuivalen basa
Mol-ekuivalen diperoleh dari hasil perkalian antara Normalitas dengan volume maka rumus diatas dapat kita tulis sebagai:
NxV asam = NxV basa
Normalitas diperoleh dari hasil perkalian antara molaritas (M) dengan jumlah ion H+ pada asam atau jumlah ion OH pada basa, sehingga rumus diatas menjadi:
nxMxV asam = nxVxM basa
Titrasi basa lemah dan asam kuat adalah analog dengan titrasi asam lemah dengan basa kuat, akan tetapi kurva yang terbentuk adalah cerminan dari kurva titrasi asam lemah vs basa kuat. Sebagai contoh disini adalah titrasi 0,1 M NH4OH 25 mL dengan 0,1 HCl 25 mL dimana reaksinya dapat ditulis sebagai:
NH4OH + HCl -> NH4Cl + H2O
Kurva titrasinya dapat ditulis sebagai berikut:
3. Kurva titrasi 0,1 M
NH4OH dengan 0,1 M HCl
4. Pada awal titrasi dalam Erlenmeyer hanya terdapat NH4OH, karena NH4OH adalah basa lemah maka tidak semua akan terionisasi untuk mencari pH nya maka kita gunakan rumus:
5.
6. [OH-] = (10exp-5 x 0,1 )exp1/2 7. [OH-] = 10-3 M
8. pH = 11
9. Setelah titrasi berlangsung maka akan terbentuk sistem buffer disebabkan dalam larutan sekarang terdapat NH4OH dan NH4Cl. Pada saat ini kurva titrasi berada pada daerah yang landai dan pH larutan ditentukan oleh pebandingan [NH4Cl]/[NH4OH].
10. Pada titik tengah titrasi yaitu setengah jumlah mol baik HCl dan NH4OH bereaksi maka [NH4Cl] akan sama dengan [NH4OH] akibatnya pH akan sama dengan pKb (ingat persamaan Henderson-Hasselbalch. Kb NH4OH adalah 10-5.
11.
12. pH = pKb = 5
13. Pada saat titik ekuivalen dicapai maka dalam larutan sekarang hanya terdapat NH4Cl adalah garam dari asam kuat dan basa lemah sehingga dalam larutan akan terhidrolisis parsial dengan reaksi sebagai berikut:
14.NH4Cl -> NH4+ +
16. Dalam larutan sekarang akan bersifat asam disebabkan terdapat H+ dari hidrolisis parsial NH4Cl. pH larutan dapat dihitung dengan persamaan:
17.
18. [H+] = { (10exp-14/10exp-5) }exp1/2 . 0,05 19. [H+] = 7.07.10-6 M
20. pH = 5,15
21.karena pH pada titik ekuivalen titrasi NH4OH dengan HCl jatuh pada kisaran pH 5,15 maka indicator yang memenuhi trayek pH ini adalah metil merah yang memiliki trayek pH 4,4 sampai dengan 6,2 atau juga bisa digunakan metil orange (MO) yang trayek pHnya 3,1 – 4,4.
22. Titrasi Asam Basa: Asam Lemah VS Basa Kuat
23. Asam lemah yang dicontohkan disini adalah asam asetat CH3COOH (biasanya kita singkat menjadi HOAc) dan dititrasi dengan basa kuat NaOH. Reaksi yang terjadi dapat ditulis sebagai berikut:
24.HOAc + NaOH -> NaOAC + H2O
25.Dan kurva titrasi antara 0,1 M HOAc 50 mL dengan 0,1 M NaOH 50 mL dapat digambarkan sebagai berikut:
26. Kurva titrasi 0,1 M CH3COOH dengan 0,1 M
NaOH
27.Pada saat sebelum titrasi dalam Erlenmeyer hanya terdapat asam asetat. HOAc adalah asam lemah sehingga dalam laruta tidak terdisosiasi sempurna, dan untuk mencari konsentrasi H+ nya kita menggunaka rumus pH asam lemah. 0,1 M HOAc dengan volume 50 mL memiliki pH sekitar 3.
28. pH dihitung dengan rumus:
29.
sistem buffer. pH larutan pun sedikit demi sedikit beranjak naik sebagai fungsi perubahan perbandingan [OAc-]/[HOAc].
31. Penambahan 10 mL NaOH 0,1 M pada analit HOAc akan merubah pH larutan menjadi 4,3 (hitung pH dengan persamaan Henderson-Hasselbalch).
32.
33. pH = 5 + log 0,0167/0,067 34. pH = 4,3
35. Pada titik tengah titrasi dimana setengah dari jumlah total mol baik NaOH dan HOAc telah bereaksi maka konsentrasi OAc- akan sama dengan konsentrasi HOAc ( [OAC-] = [HOAc] ) sehingga pH nya akan sama dengan pKa yaitu 5.
36.
37. pH = 5 + log 0,033/0,33 38. pH = 5
39. Pada titik ekuivalen, HOAc habis bereaksi dan sekarang kita mempunyai larutan NaOAc. NaOAc adalah garam yang dibangun dari basa kuat dan asam lemah, sehingga dalam air akan terhidrolisis sebagian dengan reaksi sebagai berikut:
40.NaOAc -> Na+ + OAc-41.OAc- + H2O -> HOAc +
OH-42. Adanya OH- sebagai akibat hidrolisis parsial NaOAc akan menyebabkan pH larutan menjadi bersifat basa, sehingga pH pada titik ekuivalen titrasi asam lemah dan basa kuat adalah basa, dan pHnya ditentukan oleh konsentrasi NaOAc.
43.
44. [OH-] = { (10exp-14/10exp-50 }exp1/2 . 0,05 45. [OH-] = 7.07.10-6 M
46. pOH = -log 7.07.10-6 M = 5,15 47. pH = 14 – 5,15 = 8,85
48.Jadi pH larutan pada saat titik ekuivalen adalah 8,85. pH ini adalah berada pada trayek pH indicator pp oleh sebab itu titrasi asam asetat dengan NaOH dipakai indicator pp. Jika indicator MO dipakai maka warnanya akan berubah begitu titrasi dimulai dan secara gradual berubah menjadi warna pada kondisi basa pada sekitar pH diatas 6 sebelum titik akhir titrasi di capai. Oleh sebab itulah maka indicator titrasi asam lemah yang diapaki adalah indicator yang memiliki transisi perubahan warna pada kisaran pH 7 sampai 10 dan indicator pp memenuhi kriteria ini.
49. Dengan penambahan NaOH maka OH- dari hasil hidrolisis NaOAc dapat diabaikan sebab OH- dari NaOH yang akan mendominasi. Oleh sebab itu adanya penambahan NaOH maka pHnya ditentukan oleh konsentrasi OH- dari NaOH dengan demikian pHnya semakin naik ke pH basa.
Titrasi Asam Basa: Asam Kuat VS Basa Kuat
kuat atau basa kuat. Titik akhir titrasi mudah diketahui dengan membuat kurva titrasi yaitu plot antara pH larutan sebagai fungsi dari volume titran yang ditambahkan.
51. Sebagai contoh titrasi asam kuat dan basa kuat adalah titrasi HCl dengan NaOH. Reaksi yang terjadi adalah sebagai berikut:
52.HCl + NaOH -> NaCl + H2O 53.H+ + OH- -> H2O
54. Reaksi umum yang terjadi pada titrasi asam basa dapat ditulis sesuai dengan reaksi kedua diatas. Ion H+ bereaksi dengan OH- membentuk H2O sehingga hasil akhir titrasi pada titik ekuivalen pH larutan adalah netral. Kurva titrasi antara 50 mL HCl 0,1 M dengan 50 mL NaOH 0,1 M dapat ditunjukkan dengan gambar berikut ini:
55. Kurva Titrasi 0,1 M HCl dengan 0,1 M NaOH
56. Pada awal sebelum titrasi berlangsung maka dalam Erlenmeyer hanya terdapat 0,1 M HCl shingga pH larutan adalah 1. Selanjutnya setelah proses titrasi berlangsung maka pH meningkat sedikit demi sedikit dikarenakan jumlah H+ yang semakin berkurang. Sebagai perbandingan saja jika 90% HCl telah bereaksi dengan NaOH maka konsentrasi H+ dalam larutan berkisar 5,3.10-3 M dan pHnya adalah 2,3, dan secara gradual pHnya akan
meningkat sampai pada saat titik ekuivalen diperoleh. Pada titik ekuivalen maka pH larutan adalah sama dengan 7, dalam larutan hanya terdapat NaCl dan H2O.
57. Penambahan NaOH selanjutnya akan membuat pH semakin meningkat dari konsentrasi 10-7 M untuk OH- hingga bisa mencapai 10-3 M hanya dengan penambahan 5 mL NaOH saja.
58.Pada kurva titrasi diatas ditunjukkan 2 penggunaan indicator yaitu metil orange (MO) dan fenolthalein (PP). Untuk titrasi HCl dan NaOH diatas maka digunakan indicator pp disebabkan trayek pH indicator pp adalah 8,3 – 10 dimana trayek pH ini adalah dekat dengan pH titik ekuivalen titrasi HCl-NaOH yaitu pada pH 7. Pemilihan indicator yang baik adalah setidak-tidaknya antara -1 pH titik ekuivalen sampai dengan +1 pH titik ekuivalen. Indikator lain yang bisa dipakai adalah Bromothymol blue.