PENGARUH MACAM DAN WAKTU APLIKASI AGENSIA HAYATI TERHADAP PENYAKIT KAPANG KELABU PADA STROBERI LEPAS PANEN
(THE EFFECT OF KINDS AND APPLICATION TIME OF BIOLOGICAL AGENTS
ON GREY MOLD OF POSTHATVEST STRAWBERRY)
Oleh:
Ika Permatasari, Loekas Soesanto, dan Mulyo Wachjadi Fakultas Pertanian Universitas Jenderal Soedirman, Purwokerto
Kontak: [email protected]
(Diterima:……….., disetujui: ………)
ABSTRACT
This research aimed at knowing kinds of biological agents and its application time on grey mold of postgharvest strawberry. The laboratory research was carried out with prepared strawberry from strawberry plantation at Serang, Purbalingga. Completely Randomized Design was used in in vitro test repeated five times and Randomized Block Design arranged by factorial was used in vivo one repeated twice. In in vitro test, kinds of biological agents were used, i.e., aquadest as a control, Pseudomonas fluorescens P32 or P60, Bacillus subtillis, and local isolate B. subtilis. In in vivo test, the first factor tested was kinds of the agent and the second one was application time, i.e., wounded and dipped for 1, 3, or 5 min then stored in either cold or room temperatures, dipped for 1, 3, or 5 min and then wounded and stored in either cold or room temperatures. Variables observed were inhibition zone, inhibition level, mycelial dry weight, incubation period, attact area, disease intensity, waste index, soften level, sugar content, and organoleptic test. Result of the research showed that the best biological agent to control Botrytis cinerea eiter in vitro or in vivo tests was B. subtilis local isolate with inhibition zone, inhibition level, incubation period, and attact area of 0.74 cm, 68.67%, 1.5 days, and 1.68 cm2, respectively. The best application time was all times stored in cold temperature compared to room temperature with decreasing incubation period, attact area, disease intensity, and waste index each of 100%. The treatments did not affect strawberry aroma, taste, or color.
Key words: Grey mold, Posyharvest strawberry, Biological agents, Application time.
ABSTRAK
Peubah yang diamati adalah zona hambatan, aras penghambatan, berat kering miselium, masa inkubasi, daerah terserang, intensitas penyakit, indeks sampah, aras kelunakan, kandungan gula, dan uji organoleptis. Hasil penelitian menunjukkan bahwa agensia hayati terbaik untuk mengendalikan Botrytis cinerea baik pada uji in vitro atau in vivo adalah B. subtilis isolat lokal dengan zona hambatan, aras penghambatan, masa inkubasi, dan daerah terserang masing-masing adalah 0,74 cm, 86,87%, 1,5 hari, dan 1,68 cm2. Waktu aplikasi terbaik adalah semua waktu yang disimpan pada suhu dingin bila dibandingkan dengan suhu kamar, dengan penurunan masa inkubasi, daerah terserang, intensitas penyakit, dan indeks sampah masing-masing 100%. Semua perlakuan tidak memengaruhi aroma, rasa, dan warna stroberi.
Kata kunci: Kapang abu-abu, Stroberi lepas panen, Agensia hayati, Waktu aplikasi. PENDAHULUAN
Stroberi (Fragaria vesca L.) merupakan buah memiliki warna, bentuk, dan rasa yang menjadi daya tarik tersendiri serta disukai oleh banyak kalangan umur dan masyarakat. Buah ini mulai dikenal masyarakat Indonesia seiring dengan berkembangnya sentra produksi sayuran dan hortikultura di beberapa daerah yang sudah mengubah usahanya ke budidaya stroberi (Syarifah, 2006).
Faktor pembatas dalam budidaya dan peningkatan produksi stroberi di antaranya penyakit kapang kelabu, yang disebabkan oleh Botrytis cinerea Pers.:Fr. (Maas, 1998). Penyakit kapang kelabu merupakan penyakit penting pada stroberi lepas panen sejak dipetik, selama pengangkutan hingga disimpan di ruang penyimpanan sebelum dijual ke pasar, karena dapat menurunkan kuantitas dan kualitas buah (Blacharski et al., 2000). Pada tahun 1994, penyakit ini menyebabkan kerugian hingga mencapai 7 juta dolar di Selandia Baru (Pyke et al., 1994).
Penggunaan gabungan agensia hayati dan waktu aplikasi, untuk mengendalikan penyakit kapang kelabu belum pernah dilaksanakan. Oleh karena itu, perlu dilakukan penelitian tentang pengaruh macam dan waktu aplikasi agensia hayati terhadap penyakit kapang kelabu pada stroberi lepas panen. Tujuan penelitian ini adalah untuk mengetahui (1) pengaruh macam, (2) waktu aplikasi, dan (3) pengaruh penggabungannya pada suhu dingin yang terbaik untuk menekan penyakit kapang kelabu pada stroberi lepas panen.
METODE PENELITIAN Tempat dan Waktu
Penelitian dilakukan di Laboratorium Penyakit Tumbuhan, Fakultas Pertanian, Universitas Jenderal Soedirman, Purwokerto selama tiga bulan, mulai bulan Mei 2007 sampai dengan Juli 2007.
Penyiapan bahan penelitian
Buah stroberi varietas Oso Grande diperoleh dari pertanaman stroberi di Desa Serang, Kecamatan Karangreja, Kabupaten Purbalingga. Buah dipetik sehomogen mungkin dengan keseragaman umur, warna, ukuran, dan letak buah pada tanaman. Buah kemudian dipilah dan dipilih, dan diletakkan dalam keranjang plastik di suhu dingin untuk keperluan lebih lanjut.
Penyiapan agensia hayati
Isolat P. fluorescens P60 (Soesanto dan Termorshuizen, 2001) dan P. fluorescens P32 (koleksi Loekas Soesanto) disiapkan pada medium King’s B (Schaad, 1980). Biakan diinkubasi pada suhu kamar selama 2-3 hari, kemudian dipanen dengan menambahkan 10 ml akuades dan kepadatannya dihitung dengan metode pengenceran hingga delapan kali. Pada pengenceran terakhir, bakteri ditumbuhkan pada medium yang sama dan diinkubasi selama 18 jam. Jumlah bakteri yang tumbuh dihitung dan dikalikan dengan faktor pengenceran. Sementara itu, suspensi bakteri disentrifus dengan kecepatan 2.000 rpm selama 10 menit, disaring, dan supernatan yang dihasilkan yang akan digunakan.
2-3 hari pada suhu kamar. Perlakuan berikutnya seperti yang dilakukan pada isolat P. fluorescens di atas.
Penyiapan isolat patogen
Isolat patogen kapang abu-abu, B. cinerea, diisolasi dari buah stroberi bergejala penyakit kapang abu-abu dari lapang, ditumbuhkan pada medium PDA yang ditambah streptomosin 0,125 g/L medium, dan diinkubasi pada suhu kamar selama 7 hari. Biakan yang tumbuh memenuhi cawan Petri yang kemudian digunakan dalam penelitian ini. Uji penghambatan in vitro
Pengujian dilakukan dengan memasangkan jamur patogen B. cinerea di satu sisi berjarak 3 cm dari tepi cawan Petri pada medium PDA dengan agensia hayati di sisi lain pada jarak yang sama. Rancangan yang digunakan adalah Rancangan Acak Lengkap (RAL) diulang 5 kali. Faktor yang dicoba adalah A0 = B. cinerea >< Kontrol (akuades), A = B. cinerea >< P. fluorescens P32, B = B. cinerea >< P. fluorescens P60, C = B. cinerea >< B. subtilis, dan D = B. cinerea >< Bacillus sp. isolat lokal.
Uji penghambatan in vivo
Pengujian dilakukan dengan menginokulasi permukaan buah stroberi yang disterilkan dengan alkohol 70%. Rancangan yang digunakan adalah Rancangan Acak Kelompok faktorial dengan dua faktor. Faktor pertama bakteri antagonis, yaitu PO = Kontrol (akuades), A= Ekstrak P. fluorescens P32 (kepadatan 1,15 x 1012 upk ml-1), B = Ekstrak P. fluorescens P60 (kepadatan 1,30 x 1012 upk ml-1), C = Ekstrak B. subtilis (kepadatan 1,69 x 1012 upk ml-1), dan D = Ekstrak Bacillus sp. isolat lokal (kepadatan 1,74 x 1012 upk ml-1). Faktor kedua adalah gabungan waktu aplikasi dan suhu, yaitu W1 = dilukai, dicelup 1 menit, suhu dingin; W2 = dilukai, dicelup 3 menit, suhu dingin; W3 = dilukai, dicelup 5 menit, suhu dingin; W4 = dilukai, dicelup 1 menit, suhu kamar; W5 = dilukai, dicelup 3 menit, suhu kamar; W6 = dilukai, dicelup 5 menit, suhu kamar; W7 = dicelup 1 menit, dilukai, suhu dingin; W8 = dicelup 3 menit, dilukai, suhu dingin; W9 = dicelup 5 menit, dilukai, suhu dingin; W10 = dicelup 1 menit, dilukai, suhu kamar; W11 = dicelup 3 menit, dilukai, suhu kamar; dan W12 = dicelup 5 menit, dilukai, suhu kamar. Jumlah unit gabungan 49 perlakuan dengan ulangan 2 kali, sehingga diperoleh 98 unit percobaan.
Uji inderawi dilakukan terhadap stroberi yang diperlakukan dengan gabungan macam dan waktu aplikasi agensia hayati, yang meliputi aroma, rasa, dan warna, yang dilakukan di akhir penelitian.
Peubah dan Pengukuran
Peubah yang di pada uji in vitro adalah tingkat penghambatan, zona hambatan, dan berat kering miselium jamur. Pengamatan tingkat penghambatan dilakukan dengan cara mengukur jejari koloni yang berlawanan dengan pusat koloni antagonis (r1) dan yang menuju pusat koloni antagonis (r2) setiap hari, kemudian dihitung tingkat penghambatannya dengan rumus (Martoredjo et al., 2001): I = {(r1-r2)/r1} x 100, dengan I = tingkat penghambatan antagonis (%), r1 = jejari koloni yang berlawanan dengan pusat koloni antagonis, dan r2 = jejari koloni yang menuju pusat koloni antagonis. Berat kering miselium dihitung apabila salah satu koloni sudah memenuhi cawan Petri, dengan meneteskan 20 mL HCl 1%, dipanaskan pada penangas air, disaring menggunakan kertas saring, dicuci dengan air steril, dikeringkan dalam inkubator pada suhu 300C selama 24 jam, dan ditimbang sebanyak 2 kali dengan timbangan analisis, dalam satuan mg.
Peubah yang diamati pada uji in vivo adalah masa inkubasi, luas serangan, intensitas serangan, indeks sampah, tingkat kelunakan, dan kadar gula. Luas serangan diukur dalam satuan mm2, menggunakan kertas milimeter pada akhir pengamatan (hari ke-3). Intensitas serangan diukur dengan satuan persen (%) menggunakan rumus menurut Sukardi dan Permadi (1990) dan dihitung di akhir pengamatan. Indeks sampah diukur dengan satuan gram, menggunakan rumus perbandingan berat terserang dengan berat total (Soesanto, 1989) dan dihitung di akhir pengamatan. Tingkat kelunakan dihitung dengan satuan mm/g/10s menggunakan penetrometer di akhir pengamatan. Kadar gula diukur dengan satuan 0Brix menggunakan refraktometer di akhir pengamatan. Pengukuran peubah pada uji inderawi pada hari ke-3, oleh 15 panelis, meliputi aroma, warna, dan rasa.
Analisis Data
HASIL DAN PEMBAHASAN Uji penghambatan in vitro
Berdasarkan Tabel 1. dapat dilihat bahwa rerata tingkat penghambatan antagonis terkecil nampak pada kontrol, sedangkan rerata terbesar pada perlakuan dengan Bacillus sp. isolat stroberi lokal. Perlakuan dengan B. subtilis dan Bacillus sp. isolat stroberi lokal tidak menunjukkan perbedaan, artinya bahwa B. subtilis dan Bacillus sp. isolat stroberi lokal memiliki kemampuan sama dalam menekan pertumbuhan kapang B. cinerea in vitro.
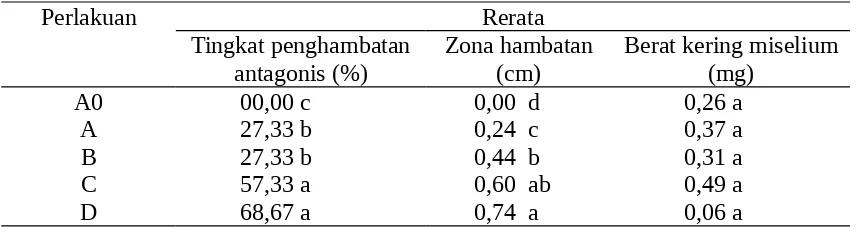
Tabel 1. Rerata tingkat penghambatan antagonis, zona hambatan, dan berat kering miselium B. cinerea in vitro pada hari ke-3 pengamatan
Perlakuan Rerata
Tingkat penghambatan antagonis (%)
Zona hambatan (cm)
Berat kering miselium (mg)
A0 00,00 c 0,00 d 0,26 a
A 27,33 b 0,24 c 0,37 a
B 27,33 b 0,44 b 0,31 a
C 57,33 a 0,60 ab 0,49 a
D 68,67 a 0,74 a 0,06 a
Keterangan: Angka diikuti huruf sama pada kolom sama tidak berbeda nyata menurut DMRT pada taraf kesalahan 5%. Data tingkat penghambatan antagonis, zona hambatan, dan berat kering miselium yang dianalisis merupakan data hasil transformasi arc sin (x + 0,5)1/2. A0 = B. cinerea >< Kontrol (akuades), A = B. cinerea >< P. fluorescens P32, B = B. cinerea >< P. fluorescens P60, C = B. cinerea >< B. subtilis, dan D = B. cinerea >< Bacillus sp. isolat lokal.
Rerata tingkat penghambatan antagonis tertinggi pada uji in vitro nampak pada Bacillus sp. isolat stroberi lokal sebesar 68,67%. Diduga antagonis tersebut telah beradaptasi dengan patogen pada habitat yang sama, sehingga memiliki kemampuan tertinggi dibanding dengan antagonis lainnya. Hal ini sejalan dengan pendapat Paul et al. (1996) dan Gould et al. (2007), yang menyatakan bahwa bakteri yang diisolasi dari tanah maupun permukaan bunga dan daun, efektif dalam mengendalikan B. cinerea.
beradaptasi dengan medium tumbuh, sehingga pertumbuhannya optimum. Pertumbuhan yang optimum akan mendukung produksi antibiotika, sehingga makin banyak jumlah antibiotika yang dihasilkan, makin besar pula kemampuan bakteri tersebut menghambat pertumbuhan kapang B. cinerea in vitro. Hal ini sesuai pendapat Vidaver et al. (1972 dalam Fravel, 1988), bahwa produksi antibiotika oleh bakteri in vitro dipengaruhi oleh beberapa faktor, antara lain kandungan nutrisi, kedalaman, dan umur medium tumbuh pada cawan Petri, jumlah inokulum bakteri, dan suhu lingkungan.
Pada Tabel 1, rerata berat kering miselium pada kontrol maupun perlakuan tidak menunjukkan perbedaan. Hal ini diduga pertumbuhan kapang secara aerial yang tidak seragam dipengaruhi oleh keefektifan agensia hayati, sesuai dengan pendapat Angkat (2005). Meskipun demikian, rerata berat kering miselium terkecil terdapat pada perlakuan dengan Bacillus sp. isolat stroberi lokal, yang memiliki rerata tingkat penghambatan antagonis dan zona hambatan terbesar dibandingkan perlakuan yang lain. Semakin kecil nilai berat kering miselium, maka nilai tingkat penghambatan antagonis dan zona hambatan semakin besar. Hal ini sejalan dengan pendapat Leisinger dan Margraff (1979 dalam Rokhlani, 2005), bahwa bakteri antagonis akan menghasilkan komponen antijamur, sehingga pertumbuhan kapang B. cinerea in vitro terhambat, termasuk miselium, yang pertumbuhannya dapat dilihat pada medium buatan.
Uji penghambatan in vivo
Pengaruh perlakuan terhadap komponen penyakit
Berdasarkan Tabel 2, perlakuan agensia hayati memengaruhi masa inkubasi, tingkat kelunakan, dan luas serangan. Hal ini diduga dipengaruhi oleh luka buatan pada saat perlakuan dan faktor ketahanan buah, suhu dan kelembapan, serta perbedaan jumlah bakteri yang digunakan, yang mengakibatkan jumlah metabolit sekunder yang berbeda. Sesuai dengan pendapat Rustam et al. (1993), bahwa semakin banyak jumlah bakteri yang terdapat dalam suspensi, semakin tinggi pula kemampuannya dalam menekan pertumbuhan kapang.
Tabel 2. Pengaruh macam agensia hayati terhadap komponen peubah yang diamati
A 1,2 a 3,795 b 29,868 a 0,3367 a 93,8 a 39,4 a
B 1,4 b 3,991 b 30,521 a 0,3460 a 106,0 b 35,2 a
C 1,4 bc 3,622 b 31,146 a 0,3324 a 100,2 ab 34,4 a
D 1,5 c 1,680 a 25,348 a 0,3398 a 102,9 b 39,8 a
Keterangan: Angka yang diikuti oleh huruf yang sama tidak berbeda nyata menurut DMRT 5%, A = Pf. P32, B = Pf. P60, C = Bs., D = B. sp. isolat stroberi lokal. Data luas serangan dan indeks sampah hasil transformasi √x+0,5 dan intensitas serangan ke arc sin √x+0,5.
Luka buatan pada buah yang diperlakukan juga mendukung infeksi patogen yang juga memengaruhi masa inkubasinya (Soesanto, 2006). Suhu pada saat perlakuan berkisar antara 23-280C sangat mendukung pertumbuhan patogen pascapanen, sehingga laju pertumbuhannya juga semakin cepat. Hal ini sesuai dengan pendapat Sommer (1992), bahwa patogen pascapanen tumbuh optimum pada kisaran suhu 20-250C.
Perlakuan agensia hayati tidak memengaruhi intensitas serangan dan indeks sampah. Hal ini diduga karena metabolit sekunder yang dihasilkan agensia hayati makin berkurang meskipun melekat, tetapi tidak bekerja sepenuhnya yang dipengaruhi oleh faktor lingkungan maupun ketahanan buah itu sendiri. Buah masih tetap melangsungkan respirasi hingga terjadi penuaan karena adanya pematangan, pelunakan, perubahan warna dan tekstur, dan akhirnya mati (Muchtadi, 1992). Selain itu, nilai indeks sampah juga dipengaruhi oleh adanya periode laten. Seiring dengan pematangan buah, patogen akan berkecambah dan melakukan penetrasi ke jaringan buah, yang didukung ketersediaan nutrisi serta kandungan etilen yang dihasilkan akibat pelukaan buah (Soesanto, 2006)
produk lebih rentan terhadap serangan patogen lepas panen, karena etilen akan memengaruhi perkembangan patogen tersebut (Soesanto, 2006).
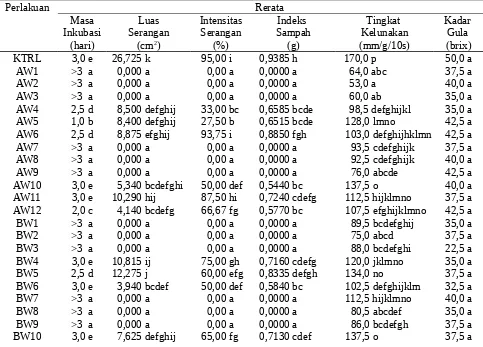
Berdasarkan Tabel 4., gabungan agensia hayati dan waktu aplikasi memengaruhi masa inkubasi, luas serangan, intensitas serangan, tingkat kelunakan, dan indeks sampah. Perlakuan gabungan agensia hayati dan waktu aplikasi pada suhu dingin dapat memperlambat masa inkubasi, menurunkan luas dan intensitas serangan, serta indeks sampah sebesar 100%. Hal ini menunjukkan bahwa suhu berperan penting terhadap proses infeksi patogen.
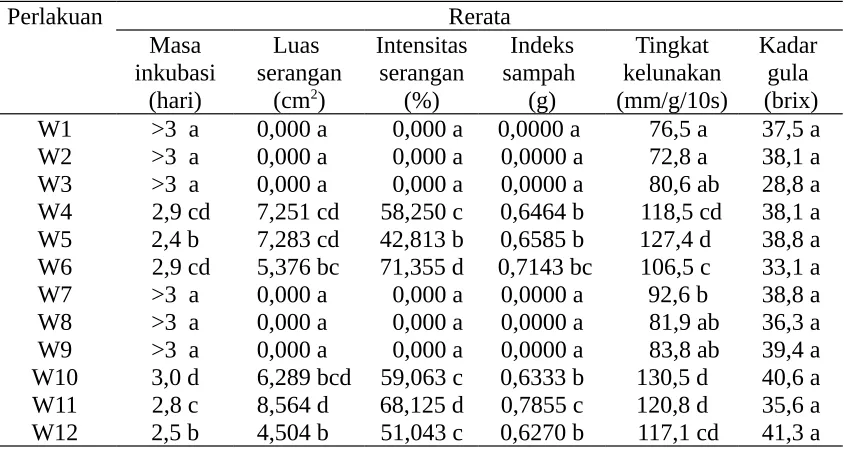
Tabel 3. Pengaruh waktu aplikasi agensia hayati terhadap komponen peubah yang diamati
Perlakuan Rerata Keterangan: Angka yang diikuti oleh huruf sama tidak berbeda nyata menurut DMRT
5%, W1 = dilukai, dicelup 1 menit, suhu dingin; W2 = dilukai, dicelup 3 menit, suhu dingin; W3 = dilukai, dicelup 5 menit, suhu dingin; W4 = dilukai, dicelup 1 menit, suhu kamar; W5 = dilukai, dicelup 3 menit, suhu kamar; W6 = dilukai, dicelup 5 menit, suhu kamar; W7 = dicelup 1 menit, dilukai, suhu dingin; W8 = dicelup 3 menit, dilukai, suhu dingin; W9 = dicelup 5 menit, dilukai, suhu dingin; W10 = dicelup 1 menit, dilukai, suhu kamar; W11 = dicelup 3 menit, dilukai, suhu kamar; dan W12 = dicelup 5 menit, dilukai, suhu kamar. Data luas serangan dan indeks sampah ditransformasi √x+0,5 dan intensitas serangan ke arc sin √x+0,5.
Selain itu, agensia hayati diduga masih tetap beraktivitas dalam mengendalikan patogen pada suhu rendah meskipun dalam batas minimum untuk pertumbuhannya. Suhu minimum untuk pertumbuhan Bacillus spp. berkisar 5-200C (Goto, 1992) dan Pseudomonas spp. 4-250C (Domsch et al., 1993), sedangkan suhu rendah yang digunakan pada uji in vivo sebesar 14 0C.
Teknik aplikasi antara dilukai dahulu baru dicelup ke dalam ekstrak agensia hayati atau dicelup ke dalam ekstrak agensia hayati kemudian dilukai dan disimpan pada suhu kamar tidak memberikan pengaruh pada nilai intensitas serangan. Hal ini diduga adanya infeksi patogen yang terjadi sebelum buah diperlakukan. Pengendalian hayati sukar diterapkan terhadap infeksi laten pada bebuahan lepas panen karena patogen jauh sudah berada di dalam buah, dan akan berkembang seiring dengan pematangan buah dan apabila kondisi lingkungan mendukung patogen untuk mengadakan pertumbuhan selanjutnya (Eckert, 1975).
BW11 3,0 e 8,740 fghij 60,00 efg 0,6670 bcde 129,0 lmno 35,0 a
Keterangan: Angka yang diikuti oleh huruf sama tidak berbeda nyata menurut DMRT 5%. KTRL = kontrol, suhu kamar; A = Pf P32; B = Pf P60; C = Bs; D = B. sp. isolat lokal. W1 = dilukai, dicelup 1 menit, suhu dingin; W2 = dilukai, dicelup 3 menit, suhu dingin; W3 = dilukai, dicelup 5 menit, suhu dingin; W4 = dilukai, dicelup 1 menit, suhu kamar; W5 = dilukai, dicelup 3 menit, suhu kamar; W6 = dilukai, dicelup 5 menit, suhu kamar; W7 = dicelup 1 menit, dilukai, suhu dingin; W8 = dicelup 3 menit, dilukai, suhu dingin; W9 = dicelup 5 menit, dilukai, suhu dingin; W10 = dicelup 1 menit, dilukai, suhu kamar; W11 = dicelup 3 menit, dilukai, suhu kamar; dan W12 = dicelup 5 menit, dilukai, suhu kamar. Data luas serangan dan indeks sampah ditransformasi √x+0,5 dan intensitas serangan ke arc sin √x+0,5.
2. Pengaruh perlakuan terhadap komponen pematangan buah
dikeluarkan. Lebih lanjut, Soesanto (2006) menjelasakan bahwa panas tersebut akan memacu pematangan buah lebih awal.
Berdasarkan Tabel 3. dan 4., perlakuan waktu aplikasi serta gabungannya dengan agensia hayati memengaruhi tingkat kelunakan. Peranan suhu dingin diduga dapat mengurangi tingkat kelunakan buah dibanding pada suhu kamar. Suhu rendah mampu menghambat laju transpirasi buah dan metabolisme secara umum, di samping menghambat pertumbuhan patogen yang dapat memacu produksi etilen, sehingga dapat mencegah kehilangan kualitas dalam hal penampilan dan tekstur, seperti pelunakan buah, hilangnya kerenyahan, dan kandungan jus (Kader, 1992).
Berdasarkan hasil penelitian, perlakuan agensia hayati, waktu aplikasi, maupun gabungannya tidak memengaruhi kadar gula buah stroberi (Tabel 2, 3, dan 4). Hal ini diduga tidak terjadi peningkatan kandungan gula pada buah tak-klimak. Saat buah stroberi dipanen sebelum masak seluruhnya, buah tersebut akan berubah warna dan menjadi lunak selama pematangan. Kandungan asam akan menurun, tetapi peningkatan gula dalam jumlah besar tidak terjadi karena tidak tersedianya cadangan pati saat panen (Sommer, 1992). Menurut pendapat Hastuti dan Ari (1998), penurunan kadar asam total disebabkan adanya pemakaian asam pada respirasi, sedangkan pada buah tak-klimak, respirasi berjalan lambat, sehingga penurunan kadar asam total kemungkinan berjalan lambat pula.
Uji inderawi
Perlakuan agensia hayati, waktu aplikasi, maupun gabungan keduanya pada umumnya tidak memengaruhi warna, aroma, dan rasa buah stroberi.
SIMPULAN DAN SARAN Simpulan
2. Waktu aplikasi agensia hayati serta gabungannya pada suhu dingin mampu memperlambat masa inkubasi serta menurunkan intensitas serangan, indeks sampah, dan luas serangan masing-masing sebesar 100% dibanding pada suhu kamar.
3. Penginokulasian B. cinerea tidak berpengaruh terhadap nilai kadar gula buah pada perlakuan macam dan waktu aplikasi agensia hayati, maupun gabungannya.
4. Gabungan perlakuan macam dan waktu aplikasi agensia hayati tidak memengaruhi aroma, rasa, dan warna buah stroberi.
Saran
1. Perlu penelitian lebih lanjut mengenai macam agensia hayati, waktu, dan teknik aplikasi lain yang berpengaruh terhadap penyakit kapang kelabu pada pada stroberi lepas panen.
2. Perlu penelitian lebih lanjut mengenai aplikasi penggunaan agensia hayati secara in planta.
DAFTAR PUSTAKA
Angkat, S.E. 2005. Pengaruh Macam dan Waktu Aplikasi Fungisida Nabati terhadap Perkembangan Penyakit Antraknosa pada Pisang (Musa paradisiaca) Kultivar Susu Lepas Panen. Skripsi. Fakultas Pertanian, Universitas Jenderal Soedirman, Purwokerto. 60 hal. (Tidak dipublikasikan).
Blacharski, R.W, J.A. Bartz, C.L Xiao and D.E Legard. 2000. Control of Postharvest Botrytis Fruit Rot With Preharvest Fungicide Applications in Annual Strawberry. (On-line). http://strawberry.ifas.ufl.edu/publications/ control of postharvest. botrytis.htm diakses 13 November 2006.
Baker, K.F. and R.J. Cook. 1983. The Nature and Practice of Biological Control of Plant Pathogens. American Phytopathological Society, St. Paul, Minnessota. 538 pp. Domsch, K.H., W. Gams, and T.H Anderson. 1993. Compendium of Soil Fungi. Volume I.
IHW-Verlag. Eching. 859 pp.
Eckert, J.W. 1975. Patologi Pasca Panen. Pp. 627-663. Dalam: Er.B. Pantastico (Ed.). Fisiologi Pascapanen: Penanganan dan Pemanfaatan Buah-buahan dan Sayur-sayuran Tropika dan Subtropika. Terjemahan oleh Kamariyani. 1989. Gajah Mada University Press, Yogyakarta. 906 hal.
Fravel, 1988
Goto, M. 1992. Fundamentals of Bacterial Plant Pathology. Academic Press Inc., San Diego, California. 342 pp.
Hastuti, P. dan Ari M. 1998. Perubahan Sifat Kimia dan Kesenangan Konsumen terhadap Salak Pondoh Selama Penyimpanan pada Suhu Dingin. Prosiding Seminar Penelitian Pasca Panen Pertanian. Bogor, 1-2 Februari 1998.
Kader, A.A. 1992. Postharvest Biology and Technology: An Overview. Pp. 15-20. In: A.A. Kader (Ed.). Postharvest Technology of Horticultural Crops. University of California, California.
Maas. 1998. Compendium of Strawberry Disease. Second Edition. The American Phytopathological Society, St. Paul, Minessota. 98 pp.
Martoredjo, T., C. Sumardiyono, dan E.H. Astuti. 2001. Kajian Pengendalian Hayati Penyakit Kapang Hijau pada Buah Jeruk dengan Trichoderma sp. Prosiding Kongres XIV dan Seminar Nasional PFI. Bogor. Hal. 354-356.
Mitchell, F.G. 1992. Cooling Horticultural Commodities: Need for Coolng. Pp. 53- 56. In: A.A. Kader (Ed.). Postharvest Technology of Horticultural Crops. University of California, California.
Muchtadi, D. 1992. Fisiologi Pasca Panen Sayuran dan Buah-buahan. Institut Pertanian Bogor, Bogor. 189 hal.
Paul, B., A. Benoît, L. Chapuis, A. Chereyathmanjiyil, and I. Masih. 2007. Biological Control of Botrytis cinerea Causing Grey Mould Disease of Grapevine and Elicitation of Stilbene Phytoalexin (Resveratrol) by a Soil Bacterium. (On-line). http://www.u-bourgogne.fr/IUVV/paul98.html diakses 30 Agustus 2007.
Pyke, N.B., P.A.G Elmer, K.G. Tate, P.N. Wood, L.H. Cheah, I.C Harvey, K.S.H. Boyd-Wilson, and R. Balasubrahmanian. 1994. Biological Control of Botrytis cinerea in kiwifruit: problems and progress. (On-line). http://www. hornet.co.nz/publication/proceeding/ifoam/ifoam45.htm diakses tanggal 14 November 2006.
Rokhlani. 2005. Potensi Pseudomonas fluorescens P60, Trichoderma harzianum, dan Gliocladium sp. dalam menekan Fusarium oxysporum f. sp. gladioli In Vitro dan In Planta. Skripsi. Fakultas Pertanian, Universitas Jenderal Soedirman, Purwokerto. 58 hal. (Tidak dipublikasikan).
Rustam, A. Hanafiah, Darnetti, dan Nasrun. 1993. Pengaruh Konsentrasi Bakteri Antagonis Pseudomonas fluorescens Untuk Menekan Pertumbuhan Jamur Patogen Rhozoctonia Solani Penyebab Penyakit Rebah Kecambah Bibit Tomat. Risalah Kongres Nasional XII dan Seminar Ilmiah PFI. Yogyakarta, 6-8 September 1993.
Shcaad, N.W. 1980. Laboratory Guide for Identification of Plant Pathogenic Bacteria. Bacterialogical Committe of the American Phytophatological Society, St.Paul, Minnesota. 67 pp.
Soekarto, S.I. 1985. Penilaian Organoleptis untuk Industri Pangan dan Hasil Pertanian. Bharata Karya Aksara, Jakarta. 87 hal.
Soesanto, L. 1989. Pengaruh Umur Petik Buah Apel terhadap Perkembangan Penyakit Antraknosa. Tesis. Fakultas Pertanian, Universitas Gadjah Mada, Yogyakarta. (Tidak dipublikasikan).
Soesanto, L. dan A.J. Termorshuizen. 2001. Potensi Pseudomonas fluorescens P60 sebagai agensia hayati jamur-jamur patogen tular-tanah. Prosiding Kongres XIV dan Seminar Nasional PFI, Bogor. Hal. 183-186.
Sommer, N.F. 1992. Principles of Disease Suppression by Handling Practise. Pp. 109-116. In: A.A. Kader (Ed.). Postharvest Technology of Horticultural Crops. University of California, California.
Sukardi A. dan Permadi. 1990. Evaluasi kultivar cabai (Capsicum sp.) terhadap antraknosa dan bercak daun Cercospora (Cercospora capsici). Bulletin Penelitian Hortikultur 18:94-101.
Sutedjo, M.M., A.G. Kartasapoetra, dan RD.S. Sastroatmojo. 1996. Mikrobiologi Tanah. Rineka Cipta, Jakarta. 446 hal.
Syarifah. 2006. Israel Sukses Kembangkan Stroberi. (On-line). Pikiran Rakyat. http://www.pikiran-rakyat.com/cetak/2006/062006/08/cakrawala/profil 01 .htm di-akses 30 Agustus 2007.