Pokok Bahasan IV : TEKNIK ASEPTIS
Pendahuluan
Teknik kultur jaringan mensyaratkan kondisi aseptik, bebas dari bakteri, jamur, yeast dan jasad renik lain pada setiap tahapan kegiatannya. Hambatan utama keberhasilan pelaksanaan kultur jaringan adalah adanya kontaminasi yang dapat timbul baik selama prosedur tersebut dikerjakan maupun selama kultur dipelihara didalam ruang inkubator. Kontaminasi oleh mikroorganisme menjadi problem yang sangat serius, karena mikrobia kontaminan akan segera mengkonsumsi zat hara yang ada pada medium kultur. Mikroorganisme ini meskipun berukuran sangat kecil, tetapi jumlahnya sangat banyak dan aktivitas metabolismenya sangat tinggi, jika pertumbuhannya tidak dapat dicegah maka dalam waktu yang relatip singkat segera mendominasi kultur. Sel dan jaringan tanaman yang dikulturkan akan mati, matinya eksplan dapat disebabkan karena dibebaskanya senyawa-senyawa toksik sebagai hasil metabolisme dari mikrobia kontaminan, dapat juga karena eksplannya "dimakan" oleh mikrobia kontaminan tsb.
Kontaminasi dapat timbul pada setiap tahapan dari pelaksanaan kultur jaringan, prosedur kerja aseptis yang harus dikerjakan untuk menanggulangi kontaminasi adalah:
1. Sterilisasi ruang kerja
2. Sterilisasi medium dan alat-alat 3. Sterilisasi eksplan.
Tujuan Instruksional Khusus:
Setelah mengikuti kuliah ini diharapkan mahasiswa dapat menjelaskan prinsip kerja aseptik yang meliputi: teknik Sterilisasi ruang kerja, medium, alat-alat dan eksplan.
Subpokok Bahasan 1 : STERILISASI RUANG KERJA, MEDIUM, ALAT-ALAT DAN EKSPLAN
Pendahuluan
Sebagaimana telah diuraikan pada Pokok Bahasan Laboratorium Kultur Jaringan, kegiatan aseptis dimulai didalam Ruang Steril dan Ruang Inkubasi / Kultur, kegiatan utama yang dilakukan meliputi sterilisasi dan penanaman eksplan diatas atau didalam medium kultur. Laboratorium sederhana setidaknya mempunyai dua ruangan tersebut, yang kebersihannya senantiasa harus diperhatikan. Ruang kerja yang kotor, akibat terlalu banyak orang yang lalu lalang didalamnya, dapat mengundang timbulnya kontaminasi. Ruang kultur yang tidak terpelihara dapat mengundang serangga-serangga kecil untuk masuk kedalam botol-botol yang berisi medium kultur. Serangga-serangga kecil ini menimbulkan permasalahan tersendiri karena spora-spora jamur dan bakteri biasanya ikut lerbawa masuk kedalam botol kultur. Ruang kerja harus mudah dibersihkan dan dilengkapi dengan AC sehingga senantiasa kering dan sejuk. Kegiatan sterilisasi medium dan alat-alat dikerjakan diruang persiapan. Kebersihan dan organisasi laboratorium yang efisien, ditunjang dengan peralatan yang memadai, dapat menciptakan kondisi aseptis yang terkendali.
Materi Subpokok Bahasan 1 Sterilisasi ruang kerja
menit setelah UV dimatikan, maksudnya supaya ozon tidak terhirup.
Peneliti yang akan bekerja didalam ruangan ini haras memakai jas lab. masker dan tutup kepala, juga harus mencuci tangan dengan sabun antiseptik, kalau perlu menggunakan sarung tangan dari karet. Didalam ruangan ini terdapat alat-alat yang dapat menciptakan kondisi aseptis yang terkendali, antara lain Laminar Air Flow dan stenl box (entkas).
a. Laminar air flow (laf).
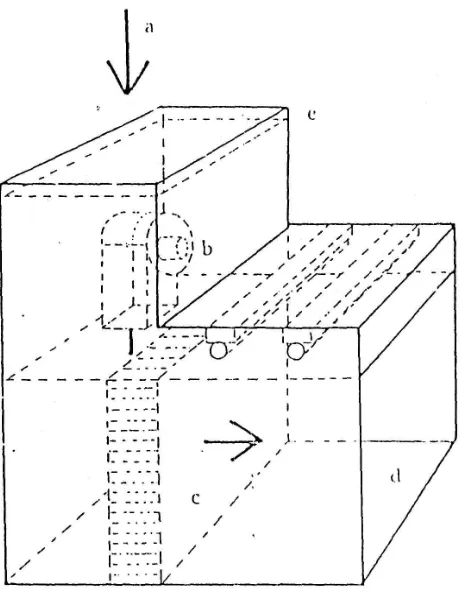
Alat ini sangat baik dan efisien, namun harganya relatip mahal untuk menciptakan atmosfer yang steril dimana pekerjaan-pekerjaan aseptis haras dilakukan. Prinsip kerja alat ini yaitu dengan hembusan udara yang sudah disaring (lihat gambar 1).
Udara yang dihisap oleh blower dihembuskan melalui HEPA (high efficiency particulate air) filter dengan porositas 0,22 μm, spora-spora jamur dan bakteri akan tertahan, sehingga udara yang berhembus keluar sudah suci hama, laf kadang-kadang dilengkapi dengan UV. Sebelum mulai bekerja, permukaan meja kerja laf disemprot dan dilap dengan kain yang telah dibasahi alkohol 70% atau spiritus, semua alat-alat dimasukkan ruang kerja (lihat gambar 2. detail ruang kerja). Alat-alat dan medium harus sudah steril baik permukaan maupun bagian dalamnya, untuk botol kultur yang berisi media, permukaannya disemprot atau dilap dengan alkohol 70%. Untuk laf yang dilengkapi dengan UV, sebelum bekerja lampu UV dinyalakan selama 30-60 menit untuk mematikan kontaminan pada permukaan ruang kerja.
Didalam laf juga sering dilengkapi dengan instalasi gas yang diperlukan untuk sterilisasi alat-alat dengan pembakaran, tetapi ini dapat diganti dengan lampu spiritus atau baktisinerator.
b. Steril box (entkas)
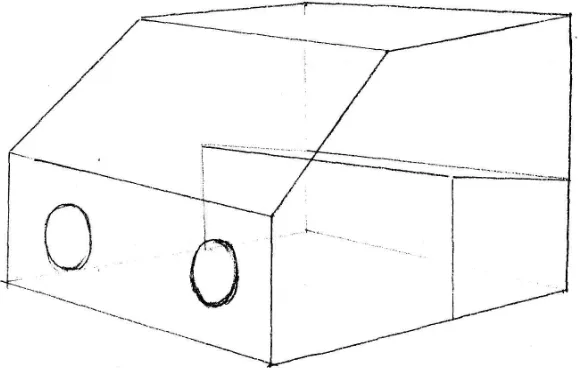
Alat lain untuk dapat menciptakan ruang kerja yang steril dengan harga yang relatip murah adalah steril box (entkas). Alat ini berujud seperti kotak yang terbuat dari bahan kaca (lihat gambar 4.3 ), plywood, papan kayu atau yang lebih sederhana misalnya dari kardus yang didalamnya dilapisi aluminum foil. Steril box atau entkas dapat dibuat dengan ukuran sesuai dengan yang dikehendaki, yang penting untuk diperhatikan adalah tangan kita dapat menjangkau setiap dinding entkas karena akan memudahkan untuk membersihkannya.
Gambar 4.3 Steril box (entkas) yang terbuat dari bahan kaca
permukaannya satu persatu dengan alkohol 70% kemudian dimasukan kedalam entkas, dibiarkan 30 menit baru mulai bekerja. Pada entkas juga dapat ditambahkan lampu UV, entkas ini seluruh dinding luarnya harus ditutup dengan aluminum foil, hal ini diperlukan untuk menghindari mata dan kulit dari bahaya radiasi UV.
Sterilisasi media dan alat-alat
Media yang mengandung bahan-bahan yang tahan panas sterilisasinya dilakukan dengan pemanasan basah, menggunakan alat yang namanya autoclave, bekerjanya dengan tekanan uap. Standar teknis untuk Sterilisasi ini adalah pada temperatur 121°C, tekanan antara 15 - 17 psi dengan waktu antara 15-40 menit tergantung dari banyaknya media yang disterilisasi. Untuk 15 ml media dalam tabung reaksi atau botol kecil berukuran 75 ml, Sterilisasi dilakukan dengan tekanan 15 psi selama 20 menit. Volume yang lebih besar membutuhkan tekanan yang lebih tinggi dengan waktu yang lebih lama.
Autoclave yang digunakan ada bermacam-macam, mulai dari yang paling sederhana sampai yang dapat diprogram (programmable). Autoclave sederhana pemanasan airnya menggunakan kompor gas, sedangkan pengaturan suhu tekanan dan waktunya dilakukan secara manual. Pada waktu mengoperasikan autoclave ini, jangan tergesa-gesa menutup klep pembuang sebelum udara yang ada didalam autoclave diganti seluruhnya oleh uap air yang mendidih sehingga akan tercapai temperature 121°C ( langkah ini tidak dikerjakan untuk autoclave yang programmable). Setelah waktu Sterilisasi selesai (15-20 menit) klep-klep pembuang dibuka pelan-pelan, tekanan uap didalam autoclave pelan-pelan akan sama dengan tekanan atmosfer, pembukaan klep pembuang yang tergesa-gesa akan mengakibatkan medium yang ada didalam botol kultur mendidih dan meluap. Alat lain yang mempunyai prinsip kerja mirip dengan autoclave adalah
Tabel 4. 1. Lama waktu minimal untuk sterilisasi media
Volume per wadah (ml) Waktu minimal sterilisasi pada 121°C (menit)
(Biondi dan Thorpe, 1978)
Sterilisasi medium kultur dengan menggunakan autoclave mempunyai banyak kelemahan, antara lain:
1. Sukrosa akan terurai menjadi fruktosa dan glukosa
2. Penggunaan temperatur yang tinggi pada autoclave dapat mengakibatkan terbentuknya caramel gula yang berwarna coklat, merupakan racun didalam medium kultur
3. Sejalan dengan lamanya waktu sterilisasi, pH medium dapat mengalami perubahan, terjadi pengendapan garam-garam dan depolimerisasi agar.
Alat-alat yang digunakan didalam ruang steril antara lain : scalpel, pinset bermacam-macam ukuran, petridish, cork borrer, pipet, alat-alat gelas (botol kultur dsb), gunting, kertas saring dsb. Alat-alat tersebut, sebelum disterilisasi, dibersihkan terlebih dahulu kemudian dibungkus rapi dengan kertas coklat. Alat-alat yang akan disterilisasi dengan autoclave tidak boleh dibungkus dengan aluminum foil sebab uap air tidak dapat masuk kedalam bungkusan. Untuk botol kultur, sebelumnya harus dicuci kemudian ditutup dengan aluminum foil atau bahan lain yang terbuat dari karet, kain atau plastik yang tahan panas. Botol kultur dengan penutup yang berulir, tidak boleh ditutup terlalu rapat ketika disterilisasi, ini diperlukan agar tidak terjadi perbedaan tekanan dengan ruangan didalam autoclave, perbedaan tekanan akan mengakibatkan pecahnya botol kultur.
Sterilisasi eksplan
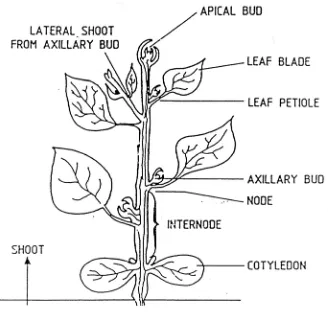
Gambar 4. 4. Tanam dikotil dengan kuncup apikal dan aksiler dimana didalamnya terdapat sel-sel yang meristematik.
didalam jaringan tanaman. Kontaminan internal ini sangat sulit untuk diatasi, karena sterilisasi permukaan tidak akan efektip.
Eksplan yang digunakan ukurannya sangat bervariasi dari yang hanya dapat dilihat dengan mikroskop (mikroskopis) misalnya mikrospora, shoot apical meristem, embrio dsb sampai yang berukuran 1 cm atau lebih misalnya ruas batang, daun, hipokotil, biji, rhizom dsb. Bagian-bagian tanaman tersebut seringkali masih tertutup oleh jaringan / sarung-sarung daun misalnya pada daun tebu, hal ini akan memudahkan prosedur sterilisasi karena secara alamiah bagian daun yang ada didalamnya masih suci hama. Eksplan yang berukuran terlalu besar akan membawa resiko kontaminasi yang lebih besar, namun jika digunakan eksplan yang terlalu kecil pertumbuhan dan respon yang diharapkan juga tidak sebaik jika menggunakan eksplan yang berukuran besar. Dilemma ini menyebabkan tidak adanya metoda sterilisasi eksplan yang baku untuk semua tanaman. Hal penting yang harus diperhatikan pada sterilisasi eksplan adalah bahwa eksplan dan mikrobia kontaminan keduanya adalah jasad hidup, kontaminasi harus dihilangkan tanpa mematikan eksplan.
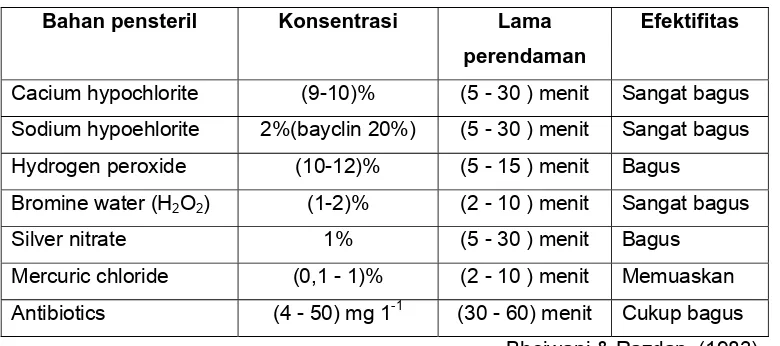
Bahan pensteril yang umum digunakan untuk sterilisasi eksplan adalah calcium hypochlorite , sodium hypochlorite, sublimat/mercuric chloride (HgCl2), alkohol dsb. Konsentrasi dan lama waktu sterilisasi sangat bervariasi tergantung dari jenis eksplan dan tempat tumbuhnya. Eksplan yang ditumbuhkan dalam rumah kaca relatip lebih bersih, sedangkan yang berasal dari lapangan pada umumnya lebih kotor, lebih terkontaminasi sejak dari awalnya sehingga prosedur sterilisasi harus dibuat lebih keras dengan meningkatkan konsentrasi bahan pensteril atau dengan memperpanjang waktu sterilisasi.
Tabel 4. 2. Efektifitas beberapa bahan pensteril
Bahan pensteril Konsentrasi Lama perendaman
Efektifitas
Cacium hypochlorite (9-10)% (5 - 30 ) menit Sangat bagus
Sodium hypoehlorite 2%(bayclin 20%) (5 - 30 ) menit Sangat bagus Hydrogen peroxide (10-12)% (5 - 15 ) menit Bagus Bromine water (H2O2) (1-2)% (2 - 10 ) menit Sangat bagus
Silver nitrate 1% (5 - 30 ) menit Bagus Mercuric chloride (0,1 - 1)% (2 - 10 ) menit Memuaskan
Antibiotics (4 - 50) mg 1-1 (30 - 60) menit Cukup bagus Bhojwani & Razdan, (1983)
Pra-sterilisasi dengan mencuci eksplan menggunakan sabun/detergent dan dibiarkan beberapa saat dibawah pancuran air yang mengalir selama 15-30 menit juga diperlukan untuk memecah koloni kontaminan agar lebih peka terhadap bahan pensteril. Bahan yang sudah bersih dikecilkan ukurannya kemudian dibawa kedalam ruang steril untuk disterilisasi lebih lanjut. Untuk sterilisasi eksplan kadang-kadang digunakan dua atau lebih bahan pensteril, misalnya direndam didalam larutan sodium hypochlorite kemudian dicuci dengan air steril dilanjutkan dengan perendaman didalam larutan sublimate dan pembilasan dengan air steril.
Latihan soal-soal
1. Jelaskan bagaimana prinsip kerja autoclave, apa kelemahan sterilisasi medium dengan autoclave!
2. Jelaskan apa bahayanya sinar UV yang digunakan untuk sterilisasi ruang kerja!
3. Jelaskan bagaimana prinsip kerja Laminar Air Flow!
4. Jelaskan cara sterilisasi medium dalam jumlah banyak yang ditambahkan asam-asam amino dan Gibberellin!
5. Jelaskan tahapan-tahapan yang harus dijalankan untuk sterilisasi eksplan yang berasal dari lapangan!
Petunjuk jawaban latihan soal-soal
1. Ingat cara kerja autoclave dan akibat yang ditimbulkan oleh pemanasan yang bertekanan terhadap komponen medium!
2. Ingat sifat-sifat sinar UV! 3. Ingat arti Laminar Air Flow! 4. Ingat cara sterilisasi medium!