BAB II
TINJAUAN PUSTAKA
2.1 Definisi Cedera Otak
Cedera kepala dapat didefinisikan secara luas yang meliputi setiap hal berikut ini: 1. Bukti riwayat pukulan terhadap kepala
2. Bukti trauma terhadap kulit kepala dalam bentuk bengkak, lecet ataupun memar 3. Bukti patah pada tulang kepala dengan foto schedel atau CT Scan kepala atau
bukti cedera otak dengan CT Scan yang dibuat segera setelah trauma. 4. Bukti klinis patah tulang dasar tengkorak
5. Bukti klinis cedera otak (hilang atau terganggunya kesadaran, lupa ingatan, defisit neurologis, kejang) (Selladurai et al, 2007).
Definisi cedera otak adalahproses patologis pada jaringan otak yang bukan bersifat degeneratif ataupun kongenital, melainkan akibat kekuatan mekanis dari luar yang menyebabkan gangguan fisik, fungsi kognitif dan psikososial yang sifatnya menetap atau sementara dan disertai dengan hilangnya atau berubahnya tingkat kesadaran (Narayan et al, 1996)
2.2 Klasifikasi cedera otak
Berat tidaknya cedera otak paling umum digunakan modalitas dari GCS (Glasgow Coma Scale) post resusitasi, yaitu ringan (GCS 13-15), Sedang (GCS 9-12) dan Berat (GCS ≤8). Bila berdasarkan mekanismenya cedera otak dibagi atas tumpul dan tembus/tajam ( penetrating head injury) (Narayan et al, 1996).
2.3 Patofisiologi cedera otak
Perubahan-perubahan setelah trauma adalah terjadi pada tingkat molekuler, biokimia, seluler, dan pada tingkat makroskopis (Selladurai et al, 2007).
2.3.1 Cedera Otak Primer dan Kontusio Serebri
Cedera otak primer disebabkan oleh kerusakan mekanik pada jaringan otak dan pembuluh darah pada saat terjadinya trauma. Pada tingkat makroskopis bisa terlihat terputusnya jaringan otak; pada tingkat mikroskopik bisa terlihat kerusakan parenkhim sel (sel neuron, axon, dan glia) dan mikrosirkulasi (arteriol, capiler, dan venula) (Selladurai,et al,2007).
Kontusio serebri adalah tipe kerusakan otak fokal terutama disebabkan oleh kontak antara permukaan otak dan tonjolan permukaan tulang dasar tengkorak, menuerut ICD-9 kontusio cerebri adalah luka memar pada otak akibat tubrukan / impact terhadap kepala atau suatu trauma acceleration/deceleration (Narayan et al,1996).
Diantara banyak peristiwa molekouler paskacedera otak hal yang paling penting adalah Sur-1 yang memberi kontribusi berkembangnya kontusio serebri. Secara umum area kontusio serebri dibagi tiga yaitu; Epicenter, Pericotusional penumbra, dan Parapenumbra area. Pada epicenter terputusnya pembuluh darah terjadi segera.Pada penumbra dan parapenumbra area pukulan energi tidak merobek jaringan, tetapi mengawali peristiwa molekuler sensitif-mekanik yang mengiduksi overexpresi dari Sur-1. Sur-1 adalah regulator subunit dari non-selektif kation channel (NCCa-ATP) yang ditemukan oleh Simard group dan berimplikasi pada patophisiologi edema serebri dan bertransformasi dari kontusio menjadi hemoragic. Induksi overekspresi Sur-1 meningkatkan pembengkakan sel dan kematian onkotik sel astrocyte, neuron, dan sel endothelial. Pecahnya endotelial sel mengakibatkan microhemoragic yang berakibat terbentuknya perdarahan baru dan konsekuensi perdarahan menjadi progresif pada traumatik kontusio serebri ( Kurland.D., 2012).
Tidak ada aliran darah pada area sentral kontusio serebri dan pengurangan aliran darah pada daerah perikontusional edema, dimana autoregulasi terganggu (vasoparalysis). Oleh karena itu pada daerah perilesional ada kerusakan parsial sel yang rentan terhadap setiap pengurangan perfusi oleh pengurangan MAP (mean arterial pressure), peningkatan tekanan intrakranial atau vasokonstriksi setelah hipocapnia akibat dari hiperventilasi ( Selladurai.B., 2007).
Perkembangan dari lesi kontusio serebri adalah (1) Komponen perdarahan berkembang; penyatuan fokus –fokus perdarahan kecil dapat terjadi; komponen perdarahan dari kontusio serebri dapat mencapai maximal dalam waktu 12 jam pascatrauma pada 84% pasien; koangolopati dan alkoholik dapat memperbesar risiko bertambahnya komponen perdarahan pada kontusio serebri, (2) Meningkatnya pembengkakan zona sentral kontusio dan zona perikontusional; kerusakan parsial sel parenkim pada sentral kontusio juga pada zona perikontusional bisa menyebabkan bengkak (cytotoxic edema). Pada area nekrotik dari kontusio makromolekuler yang didegradasi menjadi molekul yang lebih kecil dapat meningkatkan osmolaritas jaringan dan bisa menyebabkan perpindahan cairan dari intravasculer ke area necrosis kontusio (osmolar edema).Pembengkakan area sentral kontusio menyebabkan penekanan zona perikontusional dan menyebabkan iskhemik lebih lanjut dan edema. Perikontusional edema dapat mencapai maximal 48-72 jam setelah cedera ( Selladurai.B., 2007).
2.3.2 Cedera Otak Sekunder
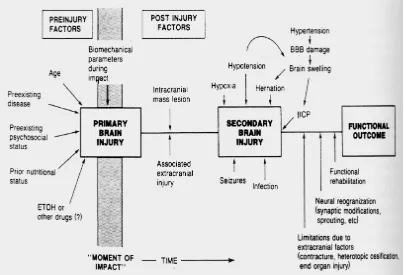
Gambar 1 : Faktor-Faktor yang memengaruhi Prognosis Setelah Cedera Otak (Vollmer.D.G., 1993).
2.4 Penilaian Tingkat Kesadaran pada Cedera Otak
a. Respon buka mata Nilai
Spontan 4
Atas perintah / suara 3
Rangsangan nyeri 2
Tidak ada 1
b.Respon Motorik Nilai
Menurut perintah 6
Melokalisir nyeri 5
Fleksi normal (menarik anggota yang dirangsang) 4
Fleksi abnormal (dekortikasi) 3
Ekstensi abnormal (deserebrasi) 2
Tidak ada (flasid) 1
c. Respon bicara Nilai
Berorientasi baik 5
Berbicara mengacau / bingung 4
Kata-kata tidak teratur 3
Suara tidak jelas 2
Tidak ada 1
Tabel.1. Diambil dari: American College of Surgeons 1997, Advance Trauma Life Support Program Student Manual, Komisi Trauma ”IKABI” (Ikatan Ahli Bedah Indonesia), 6th ed, Komisi Trauma ”IKABI”, Jakarta.
2.5 Terapi Standar pada Cedera Kepala Sedang 1. Pemberian antibiotika bila ada luka,
2. Pemberian analgetik NSAID,
3. Pemberian sedatif/transquilizer bila diperlukan untuk memperbaiki kenaikan TIK dan penenang,
4. Pemberian manitol untuk menurunkan TIK secara bolus 0,25-1 gram/kgBB, serum osmolaritas harus diperiksa bawah 320 mmol/l untuk mencegah gagal ginjal,
5. Pemberian nutrisi dini secara bertahap yang harus tercapai untuk kebutuhan total dalam waktu 7 hari setelah trauma, adalah 140% dari kebutuhan basal pada pasien yang tidak dilumpuhkan dan yang diberikan secara parenteral dan enteral, sedikitnya 15% dari asupan energi harus mengandung protein,
Bagan.1. Penatalaksanaan Cedera Kepala Sedang Nonoperatif
2.6 Skala Prognosis Glasgow(Glasgow Outcome Scale=GOS)
pasien yang membaik secara signifikan dan secara klinis terutama 6 bulan setelah cedera otak (Narayan et al, 1995).
Skala pengukuran GOS ini pertama kali ditemukan oleh Jennet dan Bond pada tahun 1975. Prognosis pascacedera otak yang didasarkan kapabilitas sosial pasien pascacedera otak dikombinasikan dengan efek mental spesifik dan defisit neurologis. Derajat skala ini mencerminkan suatu kerusakan otak secara umum, dimana juga mampu menilai prognosis pascakoma traumatik ataupun nontraumatik (Bullock, 2004; Narayan, Michel,2002; Jennet, 2005).
Telaah pada penderita adalah sebanyak 150 orang yang bertahan hidup setelah cedera otak di Glasgow oleh spesialis saraf dan bedah saraf . Keduanya memutuskan bahwa penilaian ini sangat tepat pada 3 bulan, 6 bulan, dan 12 bulan pascatrauma (Jennet, 2005).
Skala penilaian prognosis Glasglow terdiri atas lima kategori (Jennet ,2005)
(1) Pemulihan baik (good recovery= GR) diberi nilai 5.Pasien dapat berpartisipasi pada kehidupan sosial, kembali bekerja seperti biasa. Pemeriksaa ini dapat disertai komplikasi neurologis ringan, seperti defisit minor saraf kranial dan kelemahan ekstremitas atau sedikit gangguan pada uji kognitif atau perubahan personal. (2) Ketidakmampuan sedang (Moderate disability=MD, independent but disabled)
diberi nilai 4.Kondisi pasien jelas berbeda sebelum cedera dan mampu menggunakan transportasi umum, tetapi tidak dapat bekerja seperti biasa. Pasien defisit memori/perubahan personal, hemiparesis, disfasia, ataksia, epilepsi paska traumatika, atau defisit mayor saraf kranial. Derajat ketergantungan pasien pada orang lain lebih baik dibandingkan dengan lansia dan kemampuan kebutuhan personal sehari-hari dapat dikerjakan tetapi, mobilitas dan kapasitas berinteraksi tidak dapat dilakukan tanpa asisten.
(3) Ketidakmampuan berat (Severe disability=SD, conscious but dependent) diberi nilai 3.Pasien mutlak bergantung pada orang lain setiap saat (memakai baju, makan, dll), paralisis spastik, disfasia, disatria, defisit fisik dan mental yang mutlak memerlukan supervisi perawat/keluarga.
withdrawal sebagai pencerminan menuruti perintah, mengerang, menangis, kadang mampu mengatakan tidak sebagai bukti proses kembali berbicara.
(5) Meninggal dunia (dead) diberi nilai 1. Pada tahun 1981 Jennet menelaah dan memodifikasi ulang skala GOS karena masalah sensitivitas statistik dan penggunaan yang lebih praktis pada uji klinis obat neuroproteksi, yaitu distribusi bimodal (dikotomisasi) antara hidup (GR, MD, SD) dan mati (PVS, Dead) dan penilaian ekstensi (GOS Extended), yaitu
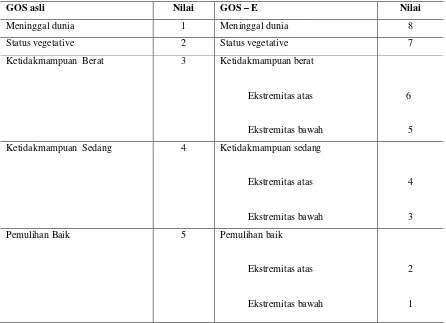
GOS asli Nilai GOS – E Nilai
Meninggal dunia 1 Meninggal dunia 8
Status vegetative 2 Status vegetative 7
Ketidakmampuan Berat 3 Ketidakmampuan berat
Ekstremitas atas
Ekstremitas bawah
6
5 Ketidakmampuan Sedang 4 Ketidakmampuan sedang
Ekstremitas atas
Ekstremitas bawah
4
3
Pemulihan Baik 5 Pemulihan baik
Ekstremitas atas
Ekstremitas bawah
2
1
Tabel. 2. Nilai GOS Asli dan Extended 2.7Skala Fungsional Barthel’s Index
olehMahoney dan Barthel dengan manampilkan rentang penilaian dari 0-20. Meskipun versiaslinya telah dipergunakan secara luas, skala ini telah mengalami modifikasi olehGranger dkk pada tahun 1979 menjadi 0-10 point untuk tiap variabelnya dan perbaikanselanjutnya diperkenalkan pada tahun 1989. Skala ini dikenal cukup reliable (Mahoney, Barthel ,1965). Barthel index diukur pada saat awal terapi dan secara berkala selama terapi sampai diperoleh keuntungan yang maksimum (Mahoney and Barthel, 1965).
2.7.1 Penilaian Kondisi Mental Sederhana
The mini mental state examination(MMSE), digunakan untuk screening gangguan cognitive. Setiap nilai lebih atau sama dengan 25 adalah efektif normal, gangguan cognitive berat (≤ 9),sedang (10-20) dan ringan (21-24). MMSE merupakan suatu skala terstruktur yang terdiri atas tiga puluh poin yang dikelompokan menjadi tujuh kategori: orientasi terhadap tempat (negara, provinsi, kota, gedung dan lantai), orientasi terhadap waktu (tahun, musim, bulan, hari, dan tanggal), registrasi (mengulang dengan cepat tiga kata), perhatian dan konsentrasi (secara berurutan mengurangi tujuh, dimulai dari angka seratus, atau mengeja kata WAHYU secara terbalik), mengingat kembali (mengingat kembali tiga kata yang telah diulang sebelumnya), bahasa (memberi nama dua benda, mengulang kalimat, membaca dengan keras dan memahami suatu kalimat, menulis kalimat dan mengikuti perintah tiga langkah), dan kontruksi visual (menyalin gambar) (Lezak, 2004; Tombaugh, 1992).
2.8 Mediator-Mediator dan Mekanismenya pada Cedera Otak Sekunder 2.8.1 Nekrosis/Apoptosis
Nekrosis sel terjadi sebagai respon terhadap toxic atau cedera fisik dan iskemik. Nekrosis dikarakteristikkan dengan pembengkakan sel dan kerusakan membran yang berkaitan dengan lisis nuclear kromatin. Ketika kelompok-kelompok sel terlibat secara simultan, isi sel yang banyak tumpah dalam jaringan yang cedera dapat membangkitkan respon inflamasi dalam area lokal. Apoptosis adalah kematian sel yang terprogram yang terjadi dengan respon terhadap aktifasi dari sinyal sel dan juga terlihat memberi konstribusi terhadap kematian sel SSP setelah cedera otak. Kematian dengan mekanisme apoptosis secara normal digunakan dalam perkembangan dan mempertahankan populasi sel. Berbeda dengan kematian karena nekrosis sel membengkak dan pecah. Ketika sel mengalami apoptosis, sel menjadi menciut dan integritas membran dipertahankan sampai akhir setelah kematian sel. Bangkai sel apoptosis mengandung sisa sitoplasma, organella, dan nucleus cromatin dihilangkan dan difagosit. Kematian sel dengan proses
apoptosis yang memerlukan energi, sedangkan kematian sel karena nekrosis karena tidak adekuatnya persediaan energi (Hatton J, 2001).
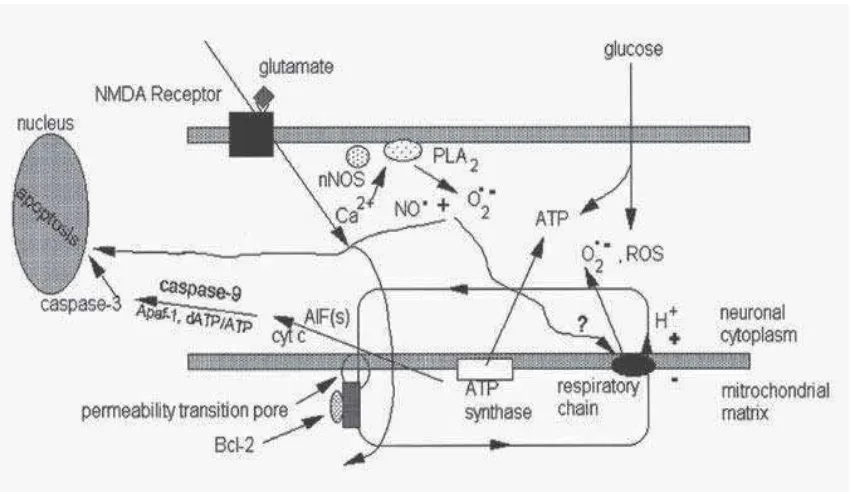
Gambar. 2. Beberapa Gambaran Cedera Apoptosis pada Neuron(Alzheimer, 2002: 23)
2.8.2 Reperfusi Injuri/Cytokines
Sintesis proinflamasi cytokines, aktivasi leukosit, vasogenik edema, dan kerusakan sawar darah otak adalah salah satu yang bisa memberi konstribusi edema paskacedera otak. Perubahan sinyal untuk repair, regenerasi dan proteksi telah dilaporkan dengan reperfusi yang berkaitan dengan respon inflamsi. Proinflamasi cytokine bisa memperberat iskemik pada cedera CNS melalui efek lansung pada neuron, astrosit dan sel mikroglial, atau melalui induksi molekul proinflamsi lain seperti TNFα dan interleukin-1β. Mereka terlihat langsung memodulasi apoptosis sel CNS, dan differensiasi dan, proliferasi dan memengaruhi infiltrasi leukosit. Cytokine juga terlibat dalam produksi protein untuk apoptosis. Aktivasi NFκB menyebabkan up-regulasi cyclo-oxygenase-2(COX-2), intercellular adhesion molecule 1 (ICAM-1)dan, IL-1 β, IL-6, dan juga dapat menginduksi sintesa Nitric Oxide (NOS), TNFα dan Fas Ligand (Hatton.J., 2001).
puncak dalam 6-12 jam pascaiskemik dan menurun kembali dalam 1-2 hari. Bukti yang dihasilkan sejauh ini mengesankan bahwa obat yang menekan produksi TNFα akan mengurangi infiltrasi leukosit dalam area iskemik otak dan mengurangi kehilangan jaringan. Pada hewan percobaan cedera otak tertutup, inhibisi TNFα memberikan suatu neuroproteksi. Pentoxifilline telah digunakan untuk mengurangi produksi TNFα dan berhasil menurunkan TNFα otak 80%. Setelah iskemik CNS peningkatan produksi IL-6 terlihat menonjol pada daerah yang kehilangan sel-sel neuron (Hatton J, 2001).
Kerja IL-6 telah dilaporkan sebagai neuroprotektif dan juga sebagai neurotoxic. IL-6 mempromosikan ketahan hidup sel neuron dan menghambat NMDA yang terinduksi toxin in vitro. Konsentrasi yang tinggi dari IL-6 bisa berperan sebagai prediktor pemulihan fungsional pasien dan berkorelasi dengan ukuran infark. Pada reperfusi IL-6 memberi konstribusi terhadap produksi ICAM-1.IL-1 β , IL-6, dan TNFα dapat meningkatkan ekspresi ICAM-1 pada sel endotelial dan astrocyte, memfasilitasi infiltrasi leukosit, dan meningkatkan aktivasi leukosit. Eselectine dan ICAM-1 ter up-regulasi pada endotelial cerebrovascular pasca kontusio fokal otak pada tikus. ICAM-1 antagonis telah
memberi keuntungan melawan apoptosis neuron pada fokal iskemik otak (Hatton J,2001).
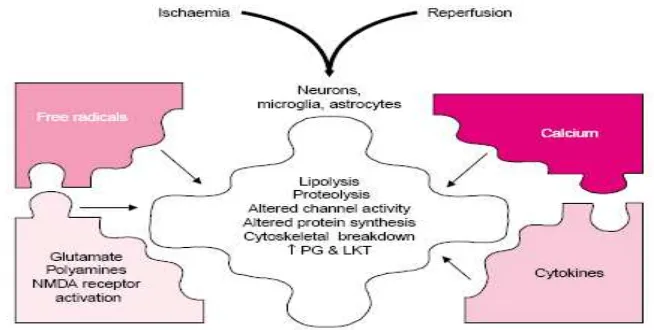
Gambar. 3. Mekanisme dan Mediator-Mediator Sekunder pada Cedera Saraf LKT = leukotrienes;NMDA= N-methyl-D-aspartate; PG = prostaglandins(Hatton ,2001).
2.8.3 Excitotoxicity/Glutamate
sel neuron dipapar sementara dengan glutamte, aktifasi NFκB terjadi dan ekspresi gen proapoptosis yang ter-upregulasi menyebakan kematian sel. Glutamat yang berlebihan dengan cepat merusak neuron postsynaptik karena influx kalsium berlebihan. Glutamat dapat mengaktifkan NMDA ,α- amino-3-hydroxy-5-methyl-4-isoxazolepropionate (AMPA), dan reseptor kainate. Pada aktivasi AMPA atau reseptor kainate, ion channels terbuka dan memungkinkan sodium, potassium, dan hidrogen masuk kedalam sel. Pembengkakan sel terjadi karena pergeseran osmotik cairan dan masuknya sodium dengan cepat dapat mendepolarisasi membran sel. Blok pada tipe reseptor AMPA dan kainate telah memperlihatkan keuntungan pada iskemik fokal dan global hewan percobaan. Aktivasi glutamat pada NMDA reseptor yang membuka kunci ion channel dapat menyebabkan peningkatan kalsium dan sodium (Hatton J, 2001).
toleransi yang baik dibandingakan dengan glutamat antagonis. Glutamat terus menerus menjadi target strategi terapi yang diteliti dan sering digunakan sebagai marker rujukan respon obat (Hatton.J., 2001).
Bagan. 2. Induksi Glutamate pada Cedera Saraf Akut (Alzheimer, 2002).
2.8.4 Kalsium
anorganik, dan asam amino merupakan petanda sudah terjadi pelepasan. Hal ini kemudian memicu mekanisme internal selular untuk siklus kematian sel (Hatton.J., 2001).
Sinyal dari kerusakan axon secara lambat dapat terlihat dalam 2-3 jam setelah cedera otak dan menetap selama 24 jam atau lebih.Peningkatan kalsium intraseluler dan bisa mengaktifkan protease netral spesifik kalsium. Kerja protease dapat menyebabkan peningkatan jangka lama pada calpain-induced spectrin degradation breakdown products, kerusakan sel dan perubahan tingkah laku. Degradasi yang termediasi kalsium dari cytoskleton dianggap menjadi penting pada cedera axonal secara lambat yang mana kerusakan menjadi lebih buruk pada 24 jam pertama pascacedera otak. Actine adalah suatu protein struktur besar polymerase dari bentuk microfilamen yang dapat membatasi masuknya kalsium dari voltage-gated channel atau NMDA. Gelsoline suatu enzyme intraseluler yang menghambat masuknya kalsium lebih banyak lagi. Gelsoline memotong microfilamen dan menggangu fungsi sel normal. Gelsoline juga bisa menjadi mediator apoptosis karena dia secara spesifik diaktifkan oleh caspase-3 sebagai enzyme kunci pada cascade apoptosis (Hatton.J., 2001).
Fungsi mitokhondria adalah untuk mempertahankan kalsium intraseluler dan perlindungan sel. Kalsium masuk ke dalam sel dengan low capasitor antiporter atau electronic uniporter. Pompa mitokhondria mengeluarkan kalsium ketika kadar kalsium dalam sitosol tinggi. Masuknya kalsium yang berlebihan setelah aktivasi glutamat pada NMDA reseptor menyebabkan cedera sekunder pada neuron. Pada kondisi normal mitokhondria terlindungi dari cedera cytotoxic oleh akumulasi kalsium ketika terpapar oleh glutamate. Cyclosporin telah diteliti potensialnya terhadap neuroproteksi karena efeknya pada mekanisme pengangkutan kalsium di mitochondria (Hatton.J., 2001).
2.8.5 Radikal Bebas
banyak menghasilkan hidrogen peroksida dalam otak. Pengubahan hidrogen peroksida ke hydroxiyl radikal dikatalisa oleh metal transisi (contoh: besi dan tembaga). Radikal reaktif OH, Lipid peroxyl radikal, thio atau thio-ferro radikal yang merusak sel dengan menyebakan:
1. Peroksidasi lemak
2. Oksidasi protein atau proteolysis 3. Mengurangi adenosine triphosphate 4. Memecahkan DNA
Enzyme antioxidant endogen meliputi superoxida dismustase(SOD), Catalase, gluthation peroxidase dan reduktase, thiol-spesifik antioxidan enzyme, thioredoxin dan protease inhibitor. Antioxidatif seluler ini adalah sistem perlindungan yang secara aktif melindungi sel otak dan neuron dari cedera oxidant.Otak mengandung sejumlah besar asam lemak polyunsaturasi, target untuk peroxidase, dan pembentukan species radikal bebas reaktif.Selama iskemik, katekolamin oksidasi, extravasasi oksidasi haemoglobin, neutrophil infiltrasi, dan nitric oxide memberi konstribusi dalam mempercepat produksi radikal bebas.Ketersediaan nitric oxide selama iskemik juga meningkatkan potensial toxisitas dari superoxida radikal. Antioxidan endogen normal, superoxida dismustase, catalase dan gluthathion peroxidase tidak dapat sepenuhnya menetralisasi reaksi ini dalam keadaan iskemik. Seluruh produksi radikal ini, peroxidasi lemak secara lansung merusak membrane sel dan juga mengubah kontraktilitas vaskuler dan mengurangi aliran darah. Setiap radikal cascade diakhiri, anyaman menyilang di dalam membrane atau dengan komponen sel lain dapat terjadi. Hal ini bisa menyebabkan inflamasi sel, edema, dan merubah sistem enzyme. Perubahan ini memengaruhi permiabelitas seluler dan merubah kemotaxis sehingga menyebabkan kerusakan tidak langsung. Radikal bebas mengawali peroxidasi membrane sel, melibatkan myelin, dikatalisa oleh ion besi bebas yang dilepas oleh hemoglobin, transferin, dan ferritin oleh setiap penurunan PH atau oksigen jaringan (Chieueh.C., 1999).
produksi thromboxan A2, Prostaglandin, dan leukotrine. Hal ini tidak begitu jelas apakah peristiwa ini menyebabkan kerusakan yang sama pada pembuluh darah dan neuron. Nitic oxide dihasilkan in vivo pada sel endotelial, astroglia dan sedikit pada neuron dengan tiga bentuk berbeda dari NOS. Nitric oxide bisa berkerja melalui second messengers, contohnya, cyclic guadinosine monophosphate (GMP), yang menyebabkan sinyal neurogenik vasodilatasi. NFκB dan IL-1 dapat mengiduksi sinyal NOS (iNOS) dapat menghasilkan Nitric Oxide. Ada bukti menunjukkan bahwa aktivasi reseptor NMDA bisa meransang pembentukan Nitric Oxide. Nitric oxide telah berakibat pada pelepasan ikatan phosphorilasi oxidatif pada mitokhondria, memicu apoptosis, dan pengurangan produksi energi melalui aktivasi polyadenosin diphosphate (ADP)-ribosesintetase (PARS). Kadar nitrit dan nitrat (produk stabil nitric oxide) dalam CSF meningkat antara 30 dan 42 jam setelah cedera otak manusia. Lubeluzol, yaitu suatu obat yang diteliti dapat menghambat induksi glutamat pada cedera otak dan diusulkan sebagai mekanisme yang terlibat dalam patway nitric oxide intraseluler. Nitric oxide adalah sumber untuk produksi radikal bebas dan NO. Radikal ini dihasilkan selama iskemik dan secara umum telah dikenal sebagai neurotoxic (Chieueh.C., 1999).
2.8.6 Ekspresi Gen, Sintesa Protein dan Growth Factors
Factor(GDNF), dan Neurotrophic Factor-3), neurotrophic factror bisa meng up-regulasi sintesis protein baru untuk berkerja menguragi efek kerusakan akibat masuknya ion kalsium dalam jumlah banyak yang menyebabkan sekunder injury. Ada bukti dari percobaan in vitro bahwa growth factor dapat memproteksi neuron untuk melawan cedera dari energi yang hilang atau kalsium yang berlebihan. Transmisi growth factor bisa dipengaruhi oleh kerusakan axon setelah cedera otak. Pada manusia dengan cedera otak, kadar sistemik IGF-1 endogen menurun setelah cedera otak dan tetap rendah sampai 14 hari. IGF-1 yang ada sekarang hanya growth factor yang diperiksa secara klinis untuk potensial neuroprotektif nya pada pasien dengan cedera otak (Hatton.J., 2001).
2.9 Strategi Farmakologi Pemilihan Neuroproteksi
2.9.1 Apoptosis Inhibibisi
Target obat pada program sel bunuh diri dalam kondisi iskemik meliputi inhibisi caspase, inhibisi protein modulator neuronal apoptosis(NAIP, dan inhibisi poly (ADP-ribose) polymerase (PARP) .Aktifasi Caspase-3 telah diobservasi pada penderita stroke, trauma medula spinalis dan cedera otak. NAIP diekspresikan hampir secara khusus dalam sel saraf dan menghambat aktifitas enzyme caspase-3. Pada stroke hewan percobaan , modulasi NAIP expresi dapat mencegah kematian sel saraf (Hatton.J., 2001).
.
2.9.2 Agonis α-Adrenoceptor
Agonis α2-Adrenoceptor menginduksi vasokonstriksi pembuluh darah otak dan mengurangi ICP pada cedera kepala hewan percobaan. Dexmedotomidine pada tikus percobaan menurunkan volume iskemik 40% walaupun hipotensi dan hiperglikemia telah diobservasi pada beberapa hewan percobaan. Arginin juga telah diberikan pada hewan percobaan ini dan efektivitasnya mengurangi volume kontusio tanpa mengubah ICP. Penelitian ini mengesankan bahwa ada terapi alternatif yang bisa diharapkan mengurangi aliran darah otak tanpa memengaruhi hipotensi sistemik untuk mempertahankan tekan perfusi otak (Hatton.J., 2001).
2.9.3 Agonis cholinergic
menunjukkan pengurangan aktivitas kholinergik yang berperan terhadap sequele nerologis setelah cedera otak (Hatton.J., 2001).
2.9.4 Antagonis kinin
Bradikinin menyebabkan dilatasi vaskuler otak dan dengan nyata meningkatkan permiabelitas vaskuler otak. Efek dimediasi oleh reseptor bradikinin yang terletak pada endotelium vasculer. Aktivasi reseptor bradikinin-2 memediasi edema otak. LF 160687 adalah reseptor antagonis bradikinin-2 yang jelas mengurangi edema otak pada tempat cedera. Satu penelitian yang menggunakan LF 160687 pada dosis 100μ gr/kg/mnt pada tikus dengan edema otak fokal memperlihatkan penyembuhan fungsional yang secara signifikan membaik dalam 6-7 hari. Percobaan klinis dari antagonis kinin Deltibant(CP 0127) telah sempurna. Dua puluh pasien dengan cedera otak ringan sampai sedang (GCS 9-14) diterapi selama 7 hari dengan Deltibant 3 μgr/kg/mnt dalam 24-96 jam cedera otak. Kontrol ICP lebih baik dan sedikit menurun pada score GCS dapat terlihat pada kelompok yang menerima dengan plasebo (Pruneau.D., 1999).
2.9.5 Inhibisi Cyclo-Oxygenase-2(COX-2)
2.9.6 Antagonis Adhesion Molekul Intraseluler
Pada Citicoline secara alamiah ditemukan senyawa endogen yang dilaporkan dapat memberi efek neuroprotektif setelah iskemik otak. Obat ini terlihat tergantung dosis pada hewan percobaan. Pada dosis lebih tinggi citicoline dapat mengurangi edema dan kerusakan sawar darah otak. Efek ini diobservasi pada kasus cedera dan noncedera. Walaupun citicoline tidak memperlihatkan efek yang signifikan pada percobaan klinis stroke (phase II/III) harapan ke depan pada cedera otak akibat trauma masih ada (Hatton.J., 2001).
2.9.7 Antagonis reseptor NMDA (N-Methyl –D-Aspartate)
Fokus besar penelitian neuroprotektif ditargetkan pada reseptor NMDA. Pada keadaan normal kompleks reseptor NMDA terlibat dalam proses belajar dan memori. Dengan menghambat proses transduksi sinyal dalam neuron, antagonis NMDA bisa menginduksi halusinasi, phisikosis, dan efek samping CNS lainya pada pasien sadar. Kompetitif antagonis NMDA memunyai affinitas yang tinggi terhadap reseptor glutamate. Secara teoritis obat ini jika diberikan dalam konsentrasi yang cukup, akan menghambat glutamat dari ikatan pada reseptornya dan mencegah pembukaan NMDA channel. Saat ini target baru bentuk modulasi efek glutamat pada reseptor NMDA telah diidentifikasi. Penelitian sekarang menghubungkan usaha untuk mengurangi akumulasi glutamat selama iskemik dengan menghambat kunci enzyme intraseluler, N-acetylated alpha-linked acidic dipeptidase (NAALADase). Pendekatan ini potensial menguntungkan secara selektif pada tempat di mana glutamat diproduksi berlebihan dari pada keseluruhan otak. Ini bisa diusulkan perbaikan yang substansial dalam profile yang aman modulator glutamat dan tergantung pada bukti lanjut keefektifan setiap penelitian kedepan yang sempurna (Hatton.J., 2001).
2.9.8 Antagonis Receptor α-Amino-3-Hydroxy-5-Methyl-4- Isoxazolepropionate (AMPA)
sangat baik pada hewan percobaan dan berpotensial sebagi neuroprotektif setelah cedera otak. Obat ini diabsorbsi dengan pemberian oral dan berinteraksi dengan beberapa obat lain yang dimetabolisme oleh Cytocrome P450 (CYP) 3 A isoenzyme. Percobaan klinis obat ini pada cedera otak belum dimulai (Hatton.J., 2001).
2.9.9 Magnesium Sulfate
Magnesium mengatur masuknya kalsium ke dalam sel melalui reseptor NMDA. Kadar magnesium intraseluler baik yang bebas maupun total lebih rendah pasca cedera otak dan berkorelasi dengan beratnya cedera axon diffuse. Penurunan magnesium bebas dalam sel menetap sampai 4 hari dan akhirnya menurun ke nilai dasar hari ke 6. Pemberian magnesium chlorida 125 μ mol pada tikus dalam 60 menit dari cedera otak, mampu memperbaiki kadar magnesium terionisasi darah sampai ke nilai dasar dalam waktu 24 jam pasca cedera otak , berkorelasi pada 1-2 minggu dengan perbaikan motorik tetapi tidak mempengaruhi hal yang berkaitan dengan belajar. Waktu pemberian setelah cedera otak penting, ketika magnesium diberikan antara 8-12 jam setelah cedera otak tikus terus memperlihatkan perbaikan motorik. Konsentrasi magnesium terionisasi dalam darah bisa menjadi indikator prognostik motorik outcome. Konsentrasi serum 1,49 mmol/L dan telah memperlihatkan efek neuroprotektif pada penelitian preklinis. Skema dosis pemberian magnesium chlorida 0,5 mmol/kg intravena sebagai loading dose diikuti dengan 0,12 mmol/kg/jam untuk mempertahankan konsentrasi magnesium serum 2 mmol/l (Hatton.J., 2001).
2.9.10 Dexanabinol
Dexanabinol (HU 211) adalah nonpsychotropic sintetis cannabinol dengan sifat farmakologi yang sama dengan non kompetitif antagonis reseptor NMDA; walaupun ia stereoselective inhibisi reseptor. Mekanisme lain dari neuroprotektif telah ditemukan dengan obat ini yang meliputi scavenging dari peroxide, hydroxi radikal dan dapat
sempurna.Dexanabinol pada psienmemperlihatkan efektif yang terbatas pada hipertensi intrakranial dalam episode 4 jam pascacedera otak. Obat diberikan dalam 6 jam cedera otak dengan dosis 48 mg, 150 mg dan 200 mg (Hatton.J., 2001).
2.9.11 Stratrienes
Estradiol secara lokal dibentuk di jaringan saraf dan ekspresi dipengaruhi dalam astrocyte setelah cedera otak.Estrogen telah dilaporkan memberikan beberapa tingkat neuroprotektif melawan induksi toxisitas glutamat dan juga melawan neurotoxisitas akibat induksi amyloid peptida. Walaupun mekanisme pasti tidak diketahui, downn-regulasi pembentukan jaringan gliosis telah diobservasi.Efek ini menyebabkan akumulasi astrocyte pada daerah cedera otak lebih rendah.Estratrienes adalahsalah satu kelas baru neurosteroid yang telah dikembangkan untuk dimanfaatkan sebagai neuroprotektif potensial (Hatton J, 2001).
2.9.12.Antagonis Kalsium
Peran terpadu kalsium dalam memicu sejumlah besar urutan yang berperan utama terhadap cedera otak sekunder secara alamiah menyebabkan penelitian berbagai target terapi mediator ini. Penelitain awal diperiksa antagonis spesifik channel-kalsium, yaitu Nimodipine suatu antagonis kalsium channel type-L.Obat ini dijumpai lebih berproteksi pada pasien dengan perdarahan subarachnoid berkaitan dengan cedera otak, walaupun hasilnya masih diperdebatkan. Fase I penelitain aman telah lengkap dengan DP b 99, prodrug kalsium chelator BEPTA. Ziconotide (SNX 111/CI 1009) bekerja pada presinaptik kalsium channel type –N untuk menghambat ransangan pelepasan neurotransmitter pasca cederaotak, pada tikus percobaan obat ini efektif menurunkan akumulasi kalsium (Hatton.J., 2001).
2.9.13 LOE 908
2.9.14 MS 153
MS 153 yaitu suatu obat yang diteliti baru-baru ini dijelaskan memungkinkan target pada sodium voltage-gated atau channel kalsium teraktifasi setelah iskemik otak. Mekanisme kerjanya kurang dapat dipahami, mekanisme kerja obat ini juga menurunkan kadar glutamate ekstraseluler. Kerjanya pada protein kinase-C menunjukkan sebagai hal yang memberikan kontribusi pada kerja dari MS 153 (Hatton.J., 2001).
2.9.15 Cyclosporine
Cyclosporindapat mencegah kematian sekunder sel saraf dengan menghambat pembukaan pori dan pencegahan keluarnya kalsium. Cyclosporin secara luas digunakan sebagai obat immunosupressi yang menghambat aktivasi lymphosit-T dan memunyai peran multiple penting dalam regulasi sel saraf.Bukti penelitian pada hewan percobaan menunjukkan efek protektif pada cedera saraf.Cyclosporin diberikan pada kelinci dan tikus setelah kontussio kortek berat, yaitu penurunan cedera saraf sampai 50%. Sifat psychochemical cyclosporin penetrasi ke CNS yang terbatas adalah dalam keadaan psychological normal. Meskipun demikian, sawar darah otak terganggu setelah cedera otak. Hasil dari penelitian telah terindikasi bahwa rentang waktu intervensi terapi adalah paling cepat dan bahkan selambat-lambatnya 24 jam. Pemberian pascacedera otak cyclosporin menghasilkan pengurangan signifikan(40%) volume lesi (Hatton.J., 2001).
2.9.16 Antioxidants
asam nukleat sel yang cedera. Obat yang melindungi mikrovaskuler bentuk ini dari spesies oksigen reaktif pasca cederaotak dapat memberikan keuntungan ( Chieueh.C., 1999).
2.9.17 Inhibisi Nitric Oxide
Derivat Nitric oxide dan modulatornya dianggap sebagai calon neuroprotektif setelah cedera otak. Antiosidan dan anti radikal bebas dianggap sebagai potensial menguntungkan.Radikal nitroxide stabil yang dievaluasi pada tikus memperlihatkan beberapa efek perbaikan klinis, termasuk pengurangan edema dan kerusakan sawar darah otak.Mekanisme neuroprotektif dapat melibatka nitroxide dalam transisi logam, radikal bebas, atau oksigen.NXY 059 adalah nitrone yang bisa menembus sawar darah otak dan memperlihatkan pengurangan volume infark dan nekrosis ketika diberikan setelah atau sebelum cedera otak pada tikus percobaan.Lubeluzole adalah modulator dari sirkuit sintesis nitric oxide.Volume kontusio, bengkak hemispher dan kandungan air tidak berubah dengan dosis pascacedera kontusio kortek pada tikus.Corticotropin-releasing factor adalah neuroprotektif peptida endogen, yaitu bukti baru yang menunjukkan bahwa ia bisa melawan kematian sel akibat oxidatif di samping fungsi fisiologis normalnya. Pada tingkat molekuler, kortikotropin menurunkan aktivitas ikatan DNA dan aktivitas transkripsi dari NFκB. Mekanisme ini dapat bertanggungjawab untuk efek protektif corticotrophine melawan stress oksidatif yang diinduksi oleh NFκB. Corticotrophine realising factor(CRF) dapat merangsang pelepasan kortikotropin. CRP adalah neuropeptida hipotalamus yang dikenal untuk menghambat kebocoran cairan dari plasma yang melewati membrane.Hal ini mengurangi edema pada jaringan cedera.Corticorelin yang berfungsi sebagai releasing factor dapat meningkatkan kortikotropin, termasuk penelitian fase II pada pasien dengan edema otak peritumoral. Untuk yang akan datang dalam pengobatan edema otak sampai saat ini masih diteliti (Kroppenstedt.S.N.,1999).
2.9.18 Growth Factors
GDNF. Mengirimkan konsentrasi adekuat ke CNS telah menjadikan tabir dari obat ini untuk dibuat penelitain yang lebih besar. Keterbatasan yang lain adalah kurangnya dokumentasi yang spesifik dari defisiensi growth factor pasca cederaotak dan juga apakah suplemen eksogen growth factorakan memberikan keuntungan. Dosis, waktu pemberian awal, dan lamanya terapi masih dalam penelitian pada banyak hewan percobaan untuk berbagai endogen dihasilkan growth factor. Basic fibroblast growth factor (BFGF) diberikan setelah fluid percussion injury pada tikus, secara signifikan mengurangi jumlah kerusakan neuron kortikal dan ukuran kontusio dengan hanya diinfus 3 jam. IGF-1 diberikan dalam 2 minggu dengan menggunakan pompa subcutan untuk memperbaiki fungsi motorik, kemampuan belajar dan retensi memori pada tikus dengan cedera otak.Penelitian yang terakhir menunjukkan pengobatan jangka panjang setelah cedera otak mungkin manjur.Manusia dengan cedera otak secara signifikan menurunkan IGF-1 serum (Hatton et al, 2001). Penelitian randomise terhadap 33 pasien dengan cederera otak sedang sampai berat (GCS 4-10) tidak diterapi dengan kortikosteroid terhadap dukungan nutrisi saja atau kombinasi dengan kontinyu infus IGF-1(0,01 mg/kg/jam). Terapi dimulai 72 jam pasca cedera otak dan terus sampai 14 hari. Obat yang diberikan mendapat toleransi baik pada semua pasien dan perbaikan metabolik dilaporkan dalam 3 hari cedera otak pada pasien yang menerima obat ini.Ini laporan pertama dari efektifitas anabolik dengan dukungan nutrisi pada populasi ini (Alzheimer, 2002).
Bagan. 3. Ringkasan Jalur Sinyal Neuroprotektif yang Dipengaruhi olehFibrine Growth
Ditemukan bahwa walaupun IGF-1 yang diberikan kontinyu secara sistematis, konsentrasi serum cepat menurun. Growth hormon meningkat dan konsentrasi ikatan protein utama diperifer (IGFBP3) turun. IGF-1 eksogen yang terlihat mulai negatif biofeedback pada fungsi pituitary dapat menyebabkan perubahan pada pembersihan.
Strategi dosis ini disetujui karena konsentrasi farmakologi (>450 μg/L) tidak dapat
dipertahankan. Keseimbangan negatif nitrogen dan perbaikan hasil akhir neurologis pada 6 bulan terlihat berhubungan dengan pencapaian konsentrasi serum lebih tinggi daripada nilai normal endogen (150-450 μg/L). Tes lebih lanjut dengan potensial IGF-1 untuk perbaikan parameter metabolik dan neurologis pada cedera otak berat, secara prospektif, randomisasi dan, double blind dukungan nutrisi saja atau kombinasi IGF-1 dengan terapi growth hormon dan nutrisi telah dimulai. 98 pasien telah dirandomise ke dalam penelitian ini dengan metodelogi identik terhadap penelitian IGF-1 sebelumnya (Alzheimer, 2002).
Kombinasi IGF-1 dan growth hormon cepat mencapai serum farmakologis dan parameter metabolik yang secara signifikan lebih baik pada kelompok terapi.Sistemik IGF-1 /growth hormonterapi terlihat dapat meningkatkan konsentrasi IGF-1 dalam CNS. Hasil akhir klinis neurologis, tidak ada perbedaan signifikan dari yang dicapai dengan dukungan nutrisi saja.Penambahan growth hormon pada regimen dalam usaha mengoptimalkan konsentrasi sistemik telah dapat memengaruhi hasil akhir.Penelitian telah ditempatkan pada penanganan klinis karena laporan growth hormon dapat meningkatkan kematian pasien pada penyakit kritis. Potensial penuh dari terapi IGF-1 dalam hal neuroprotektif masih memerlukan penelitian lebih lanjut (Hatton.J.,2001).
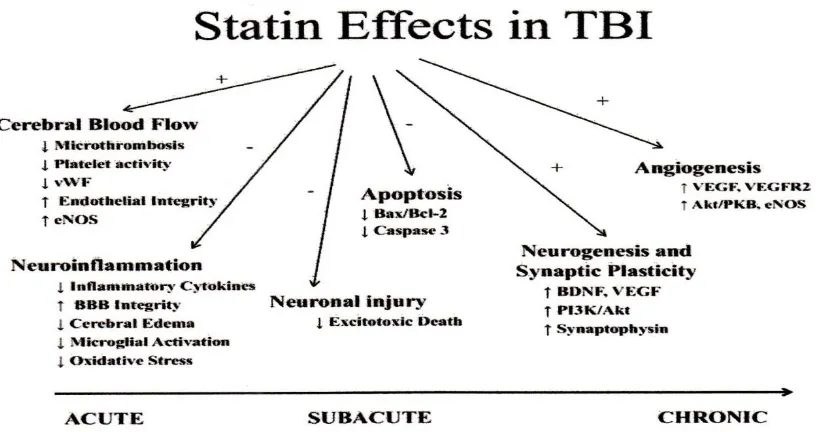
2.10 Statin sebagai Neuroprotektor
statin memunyai mekanisme kerja lain yang mungkin melalui jalur produksi mevalonat yang berperan dalam pemberi isyarat seluler (cellular signalling).Selama beberapa dekade yang lalu memunyai bukti yang jelas bahwa statin juga memunyai efek neuroprotektif.Telah dilaporkan bahwa pemberian statin berhubungan dengan insiden penyakit Alzaimer.Hal ini tidak dipersoalkan lagi, tetapi beberapa penelitian memperlihatkan bukti bahwa statin mengurangi produksi Amyloid-β peptida in vitro. Penelitian terbaru juga memunyai harapan efek statin pada penyakit parkinson. Lebih lanjut pada hewan percobaan tampak bahwa statin mungkin menguntungkan pada terapi multiple sclerosis dan stroke akut.Statin dikenal efektif dan mempunyai sedikit efek samping. Efek samping adalah yang paling sering adalah gejala gatrointestinal dan merasa mules, Hepatotoxic bisa ditandai dengan peningkatan serum SGOT, terjadi kurang 1% pasien dengan pemberian dosis tinggi (Most et al, 2009).
Jenis-jenis statin adalah lovastatin, pravastatin dan simvastatin yang berasal dari jamur; atorvastatin, rosuvastatin, fluvastatin, pravastatin adalah sintetis (Schachter, 2005).Atorvastatin dan simvastatin meskipun farmakokinetiknya berbeda, tidak banyak menunjukkan perbedaan dalam penanganan cedera otak. Simvastatin yang diberikan secara oral akan diserap oleh usus antara 30% hingga 85%. Simvastatin diserap dalam bentuk laktone inaktif sehingga perlu ditransformasi di hati menjadi bentuk aktif, yaitu ß-hydroxy acid dan asam simvastatin. Hampir seluruh Simvastatin yang diserap akan mengalami first pass metabolism di hati. Mekanisme simvastatin masuk ke dalam hati melalui difusi sederhana karena sifat simvastatin yang lipofilik, Akibat first pass metabolism, bioavabilitas sistemik simvastatin dan metabolitnya bervariasi antara 5% hingga 30% dari dosis yang diberikan. Farmakokinetik statin di dalam plasma, lebih dari 95% simvastatin dan metabolitnya akan berikatan dengan protein. Setelah pemberian oral, konsentrasi simvastatin dalam plasma akan mencapai puncak dalam waktu 1 hingga 4 jam. Begitu juga dengan waktu paruh dari simvastatin, yaitu 1 hingga 4 jam. Simvastatin dan metabolitnya diekskresikan melalui feses sebanyak 70% dan sisanya melaui urin (Suzy. Rr, 2012; Brunton, 2006).
sawar darah otak (bood brain barrier). (Suzy. Rr, 2012; Wible.E.F., et al, 2010). Walaupun simvastatin dan atorvastatin memiliki keunggulan yang sama sebagai neuroprotektor, pada penelitian ini digunakan simvastatin karena harga murah dan sudah tersedia dalam bentuk generik di indonesia.
Bagan 4.Jalur metabolisme mevalonat (Most et al, 2009).
2.10.1 Neuroprotective Signalling Pathways yang Diaktifkan oleh Statin
menunjukkan terapi statin setelah cedera otak meningkatkan neurogenesis dan synaptogenesis tanpa perubahan serum kolesterol.Penemuan mereka juga menunjukkan induksi neuroproteksi oleh statin dengan mempromosikan pelepasan neurotrophic factor.Sesungguhnya Simvastatin telah memperlihatkan induksi ekspresi dari BDNF (Brain Derived Neurotrophic Factor) setelah cedera otak dan injeksi LPS ke dalam substansia nigra.Beberapa penelitian in vitro dan in vivo memberikan bukti bahwa statin mengaktifkan neuroprotektif protein kinase-B(PKB/Akt).Aktifasi dariPKB/Akt oleh statin terbukti pada saat sekarang dan lampau pada sel endotel dan prognitor dan sekarang telah dilakukan pada kultur neuron dan pada CNS binatang yang diterapi dengan statin (Most et al , 2009).
Bagan 5. Mekanisme Statin pada Metabolisme Lemak dan Selular Signalling Neuroprotektif
2.10.2.Efek Neuroinflamasi Inhibitor HMG CoA Reduktase (Statin)
2.10.2.1.Menurunkan Inflamasi Sitokin
Statin mengurangi ekspresi induksi-sitokain dari ko-stimulasi molekul pada sel imun (termasuk mikroglia) dan endotelium. Statin juga mengurangi induksi molekul ekspresi dari MHC kelas II.Efek yang terakhir bergantung pada GGPP, tetapi beberapa penelitian mengindikasikan lemak bisa terlibat dan bisa juga tidak. Statin bisa juga efek menghambat ekspresi MHC kelas-I, tetapi buktinya terbatas untuk asumsi ini dan masih kontroversi (Most et al, 2009).
Tidak mengherankan, inhibisi presentasi antigen berakibat pada pengurangan proliferasi sel-T, tetapi statin juga bisa memengaruhi sel-T phenotype, walaupun ini kontroversi.Statin mempromosikan differensiasi sel-T menjadi Th2 phenotype. Statin mengurangi sekresi pro-inflamasi cytokine Th1 dan meningkatkan sekresi anti inflamsi cytokine Th2. Ini juga paling mungkin akibat kekurangan isoprenoid, walaupun tidak semua bukti setuju. Penelitian tunggal pada binatang dilaporkan bahwa statin pelindung melawan multiple sclerosis dan proteksi dapat ditransfer ke binatang lainnya dengan mentransfer Th2 defferensiasi sel. Pada hewan percobaan multiple sclerosis juga memperlihatkan bahwa statin mengurangi migrasi leukosit dan infiltrasi pada jaringan inflamasi.LFA-1 memainkan peran penting pada infiltrasi jaringan, jadi ini mungkin disebabkan oleh ikatan LFA-1 dan mencegah interaksi nya dengan ICAM-1 (Most et al, 2009).
2.10.2.2 Meningkatkan Integritas Sawar Darah Otak
2.10.2.3 Mengurangi Edema Serebri
Respon neuroinflamasi setelah cedera otak menyebabkan kematian sel sekunder subakut melalui proses eksitotoksik, peroksidasi lemak, kerusakan sawar darah otak, dan akhirnya menyebabkan edema serebri. Pada percobaan preklinis inhibitor HMG CoA reduktase (simvastatin dan atorvastatin) memperlihatkan penurunan translokasi sukrosa dan albumin.Dengan demikian, mengurangi edema serebri pascacedera otak (Wible, E.F., et al, 2010).
2.10.2.3 Mengurangi Oksidatif Stres
Statin dapat melindungi sel dari kerusakan akibat osidatif. Statin telah meperlihatkan mempunyai efek antiokidatif pada jaringan dan in vivo binatang percobaan juga pada percobaan kinis. Pada neuron statin dilaporkan mengurangi peroksidasi lemak setelah kehilagan oksigen, gula, dan reperfusi. Statin dapat mengurangi produksi species oksigen reaktif dengan menghambat pembentukan dan aktivasi NADPH commplex. Selain itu statin dapat mengurangi kerusakan akibat oksidasi dengan mengontrol produksi nitric oxide dan memungkinkan pengurangan respon inflamasi (Most et al, 2009).
2.10.3 Respon Neuroinflamasi pada Kontusio Serebri
Ringkasan efek neuroprotektif statin Aktifitas tombosist
↓Agregasi trombosit
↓Deposit trombosit pada dinding pembuluh darah yang rusak
Pembentukan trombin
↓Penumpukan peptida dari pemecahan trombin
↓Penumpukan trombus (menekan penumpukan abnormal tromboxan A2)
Pembentukan nitric oxide(NO)
↑Upregulasi sintesa endotelial NO dengan ↑ bioavailabilitas NO (Peran fisiologis protektif) ↑Aliran darah otak(CBF)
↓Produksi toxic dari NO melalui iNOS
Efek anti inflamsi
↓Menurunkan potensial kerusakan cytokine dari macrophage selama iskemik otak ↓Pembentukan pro-inflamsi isoprenoid
↓Ekspresi adhesion molekul ↓Interaksi endotelial leukosit
Efek anti oksidan ↓Oksidasi lipoprotein
↓Kerusakan akibat radikal bebas
Tabel 5. Efek Neuroprotektive Statin (Cucchiara et al , 2001; Indharty.S, 2012)
Bagan-6; Efek statin pada cedera otak (Wible et al, 2010; Indharty.S, 2012 ), Bax/Bcl-2= Bcl-2
associated X protein; BBB= blood brain barrier; BDNF= brain-derived neurotrophic factor;
eNOS= endothelial isoform of nitric oxide synthase; PKB= protein kinase B; PI3K
=phosphoinositide-3-kinase; VEGF= vascular endothelial growth factor; VEGFR2 vascular
2.11 Interleukin
Interleukin adalah suatu kelompok cytokine yang pertama sekali diekspresikan oleh leukosit, istilah interleukin berasal dari inter- yang artinya komunikasi dan –leukin yang artinya turunan protein yang dihasilkan oleh leukosit. Fungsi sistem imun sebagian tergantung pada interleukin. Mayoritas interleukin disintesis oleh helper CD4 T limphosit juga oleh monosit, makrophag, dan sel endotelial.Interleukin reseptor pada astrosit dihipocampus juga diketahui terlibat dalam perkembangan memori pengenalan ruang / lingkungan pada tikus (Wikipedia, 2013).
2.11.1 Gambaran Umum Interleukin-6
Interleukin-6 (IL-6) adalah glikoprotein dengan berat molekul 20-30 kDa, dan tergantung pada sumber sel. Interleukin-6 juga adalah suatu cytokine dengan daya pleiotropic dan memainkan peran utama dalam mempertahankan host. Tergantung pada target sel, Interleukin-6 (IL-6) dapat menginduksi pertumbuhan dapat menghambat pertumbuhan, dan juga efek menginduksi differensiasi. Interleukin-6 (IL-6) dihasilkan oleh banyak tipe sel meliputi monosit, makrophage, fibroblas, keratinosit, sel endotelial, sel mesangial, khondrosit, osteoblas, sel otot polos, T sel, B sel, granulosit, mast sel,dan sel tumor tertentu. Sejumlah sel kultur telah dijumpai melepaskan interleukin-6 (IL-6) dalam jumlah kecil, dan menjadi sangat tinggi setelah stimulasi (Suzuki, 2009).
Sitokin dihasilkan juga oleh susunan saraf pusat (SSP) dan terlibat dalam patogenesis banyak penyakit SSP, seperti peradangan, autoimun dan penyakit degeneratif, infeksi, neoplasma, dan stroke.Pada hewan percobaan dijumpai peningkatan akibat iskemik stroke.Walaupun Suzuki dkk; menjumpai peningkatan tidak hanya oleh inflamasi tetapi juga efek neutrophil pada iskemik otak, peran sebenarnya dari Interleukin-6 (IL-6) pada patofisiologi iskemik otak belum sepenuhnya dapat dijelaskan. Dengan kata lain apakah Interleukin-6 (IL-6) berkerja sebagai mediator peradangan cedera atau zat neuroprotektif pada iskemik otak belum dapat ditentukan. Interleukin-6 (IL-6) adalah satu dari cytokine inflamsi SSP dan telah berakibat pada respon seluler. Sitokin ini atau chestrate adalah suatu respon inflamsi antara sel darah, endotelium vaskuler, dan sel penghuni parenkhim otak dan dapat menginduksi beberapa chemokine dan sel adhesion molekul, bersama dengan kebocoran sawar darah otak dapat menyebabkan infiltrasi leukosit (Suzuki, 2009).
perbaikan dan regenerasi hanya berhasil sangat kecil jika peran sel inflamsi mengambil porsi yang lebih besar. Selanjutnya, selama fase subakut Interleukin-6 (IL-6) bekerja sebagai mediator neuroprotektif bersama dengan leukemia inhibitory factor (LIF) dan ciliaryneurotrophic factor (CNTF) (Suzuki, 2009).
Peningkatan serum interleukin-6(IL-6) dimulai dalam 24 jam dan mencapai puncak 2-4 hari setelah serangan stroke. Kadar tinggi menetap sampai 90 hari stroke. Biomarker inflamasi meningkat paralel dengan C-reaktif protein, fibrinogen, reseptor antagonis IL-1 dan tumor nekrosis faktor(TNF-α). Beberapa percobaan independent dilaporkan bahwa tingginya serum interleukin-6(IL-6) berhubungan dengan volume infark, perburukan neurologis dini, suhu tubuh dan hasil akhir yang buruk dalam jangka lama.Interleukin-6(IL-6) meningkat dalam CSF pada pasien stroke akut.Secara sistemik produksi interleukin-6(IL-6) dapat potensial secara pasif masuk ke CSF melalui sawar darah otak yang rusak. Akan tetapi penelitian lain melaporkan interleukin-6(IL-6) dalam serum secara signifikan lebih rendah dari pada CSF selama minggu pertama setelah serangan stroke. Penemuan ini sangat kuat sebagai bukti bahwa bukan produksi primer IL-6 disistemik yang masuk ke CSF setelah iskemik otak (Suzuki, 2009).
2.11.2 Interleukin-6(IL-6) pada Cedera Otak Akibat Trauma
2.11.3.Kondisi Lain yang Dapat Meningkatkan Kadar Interleukin-6
Selama latihan fisik IL-6 disintesis dan dilepaskan oleh otot, kontraksi otot memproduksi IL-6 dan dilepaskan ke dalam aliran darah dan efeknya sampai ke organ lain. Nilai normal dibuktikan 1 pg/ml, juga meningkat pada orang gemuk, aktivitas fisik, wanita menstruasi, hiperglikemia akut, selama dan sesudah pembedahan dan, juga pada pasien arteriosklerosis (Fisman, 2010).
2.11.4.Peran Inhibitor HMG CoA Reduktase Dalam Menurunkan Kadar IL-6
Respon neuroinflamsi setelah cedera kepala menyebabkan kematian sel neuron sekunder subakut melalui excitotoxic injury, lipid perosidasi, kerusakan sawar darah otak dan edema cerebri.Pada percobaan preklinis cedera kepala menunjukkan upregulasi dari mediator inflamasi.Terutama tumor necrosis faktor (TNF-α), interleukinn-6 (IL-6) dan IL-1 β meningkat dan berhubungan dengan hilangnya integritas sawar darah otak yang memberi kontribusi terhadap edema otak. Baik terapi preinjury dan postinjury pada hewan percobaan bahwa statin menurunkan kadar IL-1 β, TNF α , IL- 6 and ICAM-1 pada akut dan subakut setelah cedera otak traumatik. Mikroglia marker (mediator inflamasi) meningkat setelah percobaan trauma otak, puncak pada 24 jam pasca trauma dan menetap untuk 7 hari (Wible, 2010).
2.12 Kerangka teori
Berdasarkan teori-teori pendukung yang telah dikemukakan sebelumnya, maka dapatlah disusun suatu kerangka teori yang akan mendasari dilakukan penelitian ini.