PRAKTIKUM POTENSIOMETRI DAN PH METRI
Laporan
disusun untuk memenuhi salah satu tugas mata kuliah Instrumentasi Analitik
Oleh Kelompok 1 Abdul Kholik (141411001) Aldi Muhamad R. (141411002)
Arif Imanuddin (141411003)
Dosen Pembimbing : Mentik Hulupi Tanggal Praktikum : 19 Maret 2015 Tanggal Penyerahan Laporan : 26 Maret 2015
PROGRAM STUDI D3-TEKNIK KIMIA DEPARTEMEN TEKNIK KIMIA POLITEKNIK NEGERI BANDUNG
A. TUJUAN PRAKTIKUM 1. Mengukur pH larutan
2. Mengukur tegangan (beda potensial) larutan
3. Menentukan konsentrasi sebenarnya dari HCl dan CH3COOH
4. Menentukan konsentrasi FeSO4
5. Dapat menentukan titik ekuivalen dengan tepat dan benar
6. Dapat mengkondisikan alat (mengatur posisi tombol) dengan tepat dan benar hingga diperoleh kurva yang simetris
B. DASAR TEORI
Potensiometer dan pH meter merupakan suatu metode analisis kimia yang didasarkan pada pengukuran beda potensial. Namun, output dari kedua alat ini berbeda, pH meter menunjukan pH (tingkat keasaman) suatu larutan, sedangkan potensiometer menunjukkan tegangan (beda potensial) suatu larutan. Kedua instrumen atau alat ini dapat menggantikan peran indikator pada metode volumetrik (titrasi). Karena dengan kedua alat ini kita dapat mengetahui titik ekuivalen antara analit dan titran. Sehingga tujuan dari metode volumetrik, yaitu menentukan kadar analit dapat dicapai dengan memasukkan data titik ekuivalen ke dalam persamaan. Titik ekuivalen dapat diperoleh dengan beberapa metode (Zahidah, t.t.), diantaranya:
1. Metode Bisection
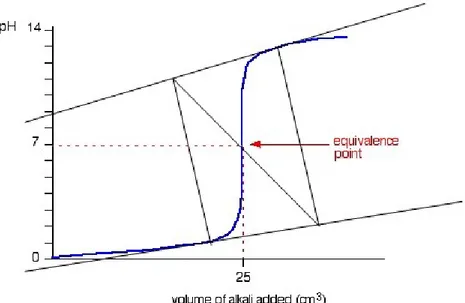
Pada kurva volume titran terhadap pH, bila ditarik garis, akan diperoleh titik ekuivalen. Titik ekuivalen adalah titik dimana jumlah mol titran sama dengan jumlah mol analit. Titik ekuivalen berbeda dengan titik akhir titrasi. Titik akhir titrasi merupakan titik dimana titran yang ditambahkan telah berlebih, sehingga akan ditandai dengan adanya perubahan warna.
2. Metode Tangensial
Titik ekuivalen didapat dari kurva dengan menggunakan alat khusus 3. Metode Circlefit
Titik ekuivalen didapat dengan menggunakan penggaris berbentuk lingkaran yang dicocokan dengan kurva, kemudian ditarik garis dari setiap pusat lingkaran untuk mendapatkan perpotongan garis yang menunjukan titik ekuivalennya.
4. Metode Tubulasi
Menentukan titik ekuivalen dengan menggunakan kurva turunan pertama (ΔpH/ΔV atau ΔE/ΔV) dan kurva turunan kedua (Δ2pH/Δ2V atau Δ2E/Δ2V).
Gambar 1. Penentuan titik ekuivalen dengan metode
Sumber: (Zahidah, t.t.)
C. ALAT DAN BAHAN Alat Bahan 1. pH meter 2. Potensiometer 3. Buret 50 ml 4. Corong gelas 5. Magnetic stirrer 6. Pipet tetes 7. Gelas ukur 10 ml 8. Dongkrak 9. Botol semprot 1. 40 ml NaOH 0,1 N 2. 10 ml HCl 0,1 N 3. 10 ml CH3COOH 0,1 M 4. 50 ml H2SO4 2,5% 5. 30 ml K2CrO4 0,1 N 6. 10 ml FeSO4 0,1 N 7. Air suling D. FLOW SHEET 1. pH meter
c. Penentan pH air keran
E. DATA PENGAMATAN 1. Penentuan Kosentrasi HCl
Data praktikum untuk penentuan konsentrasi HCl didapat dari kelompok 2, Kelas 1A-D3 Teknik Kimia.
Titran: NaOH 0,1 N Analit: 5ml HCl
No NaOH (mL) pHPercobaan 1dpH/dV pHPercobaan 2dpH/dV
1 0 2.07 0.14 2.01 0.02 2 0,5 2.14 0.18 2.02 0.06 3 1 2.23 0.14 2.05 0.12 4 1,5 2.3 0.22 2.11 0.14 5 2 2.41 0.24 2.18 0.16 6 2,5 2.53 0.42 2.26 0.26 7 3 2.74 1.08 2.39 0.38 8 3,5 3.28 6.04 2.58 0.64 9 4 6.3 7.7 2.9 6.54 10 4,5 10.15 1.5 6.17 7.66 11 5 10.9 0.44 10 1.4 12 5,5 11.12 0.58 10.7 0.6 13 6 11.41 0.16 11 0.34 14 6,5 11.49 11.17
2. Penentuan Konsentrasi CH3COOH
Titran: NaOH 0,1N Analit: 5ml CH3COOH
No NaOH (mL) Percobaan 1 Percobaan 2
pH dpH/dV pH dpH/dV
1 0 3.53 0.5 3.4 0.76
2 0.5 3.78 0.58 3.78 0.34
3 1 4.07 0.42 3.95 0.48
5 2 4.47 0.4 4.38 0.36 6 2.5 4.67 0.42 4.56 0.42 7 3 4.88 0.46 4.77 0.38 8 3.5 5.11 0.66 4.96 0.74 9 4 5.44 1.48 5.33 1.82 10 4.5 6.18 2.76 6.24 4.96 11 5 7.56 5.18 8.72 2.92 12 5.5 10.15 1.2 10.18 1.1 13 6 10.75 0.48 10.73 0.42 14 6.5 10.99 0.34 10.94 15 7 11.16 0.26 16 7.5 11.29
3. Penentuan Konsentrasi FeSO4
Titran: K2CrO4 0,1N
Analit: 5ml FeSO4 (dalam suasana asam jadi ditambah 25 ml H2SO4)
No K2CrO4 (mL) Percobaan 1 Percobaan 2
E dpE/dV E dpE/dV 1 0 603 30 571 24 2 0.5 618 42 583 24 3 1 639 44 595 48 4 1.5 661 14 619 34 5 2 668 18 636 48 6 2.5 677 292 660 70 7 3 823 40 695 78 8 3.5 843 34 734 38 9 4 860 28 753 36 10 4.5 874 24 771 36 11 5 886 12 789 40 12 5.5 892 12 809 24 13 6 898 10 821 20 14 6.5 903 8 831 22 15 7 907 4 842 22
16 7.5 909 853
F. PERHITUNGAN
1. Penentuan Konsentrasi HCl
Kurva dibawah merupakan Kurva dari data percobaan 2. Hanya dibuat satu Kurva dari data yang paling baik.
0 1 2 3 4 5 6 7 0 2 4 6 8 10 12 0 1 2 3 4 5 6 7 0 2 4 6 8 10 12 ml
Kurva 1. Kurva sigmoid, volume NaOH (x) vs pH larutan (y) 4.6 ;
ml
Kurva 2. Kurva turunan pertama, volume NaOH (x) dpH/dV (y) 4.6 ;
Berdasarkan Kurva 1 Berdasarkan Kurva 2 Volume ekuivalen = 4,6 ml Volume ekuivalen = 4,6 ml V1 . N1 = V2 . N2 V1 . N1 = V2 . N2
5 . 0,1 = 4,6 N2 5 . 0,1 = 4,6 N2
N2 = 0,109 N N2 = 0,109 N
2. Penentuan Konsentrasi CH3COOH
Kurva dibawah merupakan Kurva dari data percobaan 2. Hanya dibuat satu Kurva dari data yang paling baik.
0 1 2 3 4 5 6 7 8 0 2 4 6 8 10 12 0 1 2 3 4 5 6 7 8 0 2 4 6 8 10 12 ml 5.2 ;
Kurva 3. Kurva sigmoid, volume NaOH (x) vs pH larutan (y)
ml 5 ;
Berdasarkan Kurva 3 Berdasarkan Kurva 4 Volume ekuivalen = 5,2 ml Volume ekuivalen = 5 ml V1 . N1 = V2 . N2 V1 . N1 = V2 . N2
5 . 0,1 = 5,2 N2 5 . 0,1 = 5 N2
N2 = 0,096 N N2 = 0,1 N
3. Penentuan Konsentrasi K2CrO4
Kurva dibawah merupakan kurva dari data percobaan 1. Hanya dibuat satu Kurva dari data yang paling baik.
0 1 2 3 4 5 6 7 8 0 100 200 300 400 500 600 700 800 900 1000 ml 2.78 ; 757
0 1 2 3 4 5 6 7 8 0 2 4 6 8 10 12
Reaksi yang terjadi :
Oksidasi : Fe2+ Fe3+ + e } x 6 Eo
sel = -0,771 v
Reduksi : Cr2O72- + 14 H+ + 6 e 2 Cr3+ + 7 H2O Eosel = +1,33 v
Cr2O72- + 14 H+ + 6 Fe2+ 2 Cr3+ + 6 Fe3+ + 7H2O Esel = +0,559 v
Berdasarkan Kurva 5 Berdasarkan Kurva 4
Volume ekuivalen = 2,78 ml Volume ekuivalen = 2,5 ml V1 . N1 = V2 . N2 V1 . N1 = V2 . N2
5 . 0,1 = 2,78 N2 5 . 0,1 = 2,5 N2
N2 = 0,18 N N2 = 0,2 N
G. PEMBAHASAN
1. Oleh Abdul Kholik (141411001) a. Potensiometri
Titrasi potensiometri merupakan analisis volumetri. Analisis volumetri biasanyadiperlukan larutan standar. Proses penentuan konsentrasi larutan satandar dengan larutan lain yang telah diketahui pasti konsentrasinya disebut standarisasi atau membakukan. Larutan standar adalah larutan yang diketahui konsentrasinya yang akan digunakan pada analisis volumetri.
Dalam praktikum kali ini, yang pertama dilakukan adalah mencampurkan FeSO4 0,1 N sebanyak 5 mL dengan H2SO4 2,5% sebanyak 25 mL, kemudian larutan
ml
Kurva 6. Kurva turunan pertama, volume K2CrO4 (x) dE/dV (y)
tersebut di titrasi menggunakan K2CrO4 0,1 N, kemudian catat hasil titrasi setiap
penambahan 0,5 mL K2CrO4 0,1 N dengan melihat di layar potensiometer. Lakukan
percobaan ini minimal sebanyak 2 kali.Setelah itu membuat kurva dari hasil titrasi tersebut. Konsentrasi FeSO4 yang didapat setelah menganalisis kurva, yaitu 1,9 N,
dengan tegangan atau beda potensial pada titik ekivalen adalah 757 mV.
b. pH meter
Penentuan kadar asam asetat dan asam klorida dalam sampel pada praktikum ini menggunakan metode titrasi asam basa, dimana dalam titrasi ini menggunakan pH-Meter untuk menentukan titik akhir dari titrasi ini.
Sebelum memulai pengukuran, Kalibrasi pH meter yang dilakukan terhadap larutan standar yang sudah diketahui dengan pasti derajat keasamannya (pH),larutan buffer yang digunakan pada kalibrasi kali ini adalah larutan buffer dengan buffer pH 4 dan 7 karena ditujukan mengukur dan menentukan kadar dari asam sitrat. setelah di kalibrasi alat siap digunakan.
Yang selanjutnya yaitu mengisi buret dengan NaOH 0,1 N, kemudian menyiapkan larutan HCl dan CH3COOH dalam gelas kimia, yang pertama adalah
mentitrasi larutan HCl menggunakan NaOH yang ada dalam buret, dan catat hasil titrasi tersebut setiap 0,5 mL NaOH dengan melihat ke layar pH-meter. Selanjutnya adalah mentitrasi larutan CH3COOH menggunakan larutan NaOH yang ada dalam
buret, dan catat hasilnya setiap penambahan 0,5 mL NaOH dengan melihat pada layar pH-meter. Setelah itu membuat kurva dari hasil titrasi tersebut. Setelah menganalisi 2 kurva yang terbentuk diketahui bahwa konsentrasi HCl yang sebenarnya adalah 0,109
N dengan pH pada titik ekuivalen adalah 6,9. Untuk konsentrasi CH3COOH sendiri
adalah 0,098 dengan pH pada titik ekuivalen adalah 8,6.
2. Oleh Arif Imanuddin (141411003) a. Potensiometer
Potensiometri adalah salah satu metode penentuan konsentrasi zat melalui pengukuran nilai potensial. Nilai potensial yang diukur setiap penambahan volume titran tertentu akan diplotkan menjadi kurva titrasi dan akan didapatkan titik ekuivalen titrasinya (Abriyanti, t.t.), yang mana dalam praktikum kali ini menggunakan metode circlefit dan metode tubulasi. Volume pada titik ekuivalen titrasi tersebut adalah volume titran yang akan digunakan dalam perhitungan selanjutnya.
Cara potensiometri ini bermanfaat bila tidak ada indikator yang cocok untuk menentukan titik akhir titrasi, misalnya dalam hal larutan keruh atau bila daerah kesetaran sangat pendek (Rivai, 1995 dalam sebuah artikel yang berjudul “Potensiometer”).
Potensiometri pada praktikum ini dilakukan pada reaksi redoks, yaitu reaksi anatara FeSO4 dan K2CrO4 dalam keadaan asam, untuk menentukan konsentrasi
sebernarnya dari FeSO4. Setelah menganalisis 2 kurva yang terbentuk didapatkan
konsentrasi sebenarnya dari FeSO4 adalah 0,19 N (dari 2 data yang diketahui, yaitu
1,8 N dan 0,2 N). Dan tegangan atau beda potensial pada titik ekivalen adalah 757 mV.
b. pH meter
pH metri adalah salah satu metode penentuan konsentrasi zat melalui pengukuran tingkat keasaman atau pH suatu larutan. Prinsip kerja dari pH meter hampir
sama dengan potensiometer, yaitu pengukuran didasarkan pada perbedaan potensial elektroda. Namun, pada pH meter output nya berupa pembacaan pH sedangkan potensiometer pembacaan nya berupa beda potensial.
Di dalam pH meter terdapat elektrode gelas yang berfungsi sebagai elektroda indikator. Elektroda indikator adalah elektroda yang potensialnya bergantung pada konsentrasi ion yang akan ditetapkan atau bisa disebut merupakan fungsi dari konsentrasi analit. Karena pada percobaan ini yang ditetapkan adalah pH yang memiliki hubungan dengan konsentrasi ion H+ maka digunakan elektroda indikator yang
potensialnya bergantung pada konsentrasi ion H+ yaitu elektrode glass.
Pada praktikum ini, pH metri dilakukan pada reaksi asam-basa, yaitu reaksi antara NaOH-HCl dan NaOH-CH3COOH. Yang bertindak sebagai titran adalah NaOH
dan yang menjadi analit adalah HCl dan CH3COOH. Setelah menganalisi 2 kurva yang
terbentuk diketahui bahwa konsentrasi HCl yang sebenarnya adalah 0,109 N dengan pH pada titik ekuivalen adalah 6,9. Untuk konsentrasi CH3COOH sendiri adalah 0,098 N
(dari 2 data yang diketahui, yaitu 0,096 N dan 0,1N) dengan pH pada titik ekuivalen adalah 8,6.
pH pada titik ekuivalen NaOH-HCl cenderung netral karena kedua senyawa tersebut merupakan basa kuat dan asam kuat atau bisa disebut reaksi netralisasi. Sedangkan pada NaOH-CH3COOH pH pada titik ekuivalennya cenderung lebih basa
karena NaOH adalah basa kuat sednagkan CH3COOH asam lemah. Perbedaan yang
signifikan juga terlihat pada kurva sigmoid yang terbentuk, untuk NaOH-HCl lonjakannya lebih tajam dibandingkan dengan NaOH-CH3COOH.
H. KESIMPULAN
1. Potensiometri dan pH metri merupakan metode yang dapat menggantikan peran indikator pada titrasi
2. Konsentrasi HCl yang sebenarnya adalah 0,109 N dengan pH pada titik ekuivalen adalah 6,9
3. Konsentrasi CH3COOH yang sebenarnya adalah 0,098 N dengan pH pada titik
ekuivalen adalah 8,6 4. Konsentrasi FeSO4
5. yang sebenarnya adalah 1,9 N dengan tegangan atau beda potensial pada titik ekivalen adalah 757 mV
I. DAFTAR PUSATAKA
Abriyanti. T.t.. “Penetapan Kadar Asam Salsilat Secara Potensiometri”
https://www.academia.edu/8749063/PENETAPAN_KADAR_ASAM_SALISILA
T_SECARA_POTENSIOMETRI [25 Maret 2015].
Zahidah, Nur Atiqah. T.t.. “Dasar Potensiometri” https://www.academia.edu/8993135/ Dasar_Potensiometri [25 Maret 2015].
2012. “Potensiometri”. https://gembelcungkring.wordpress.com/tag/titrasi-potensiometri/ [25 Maret 2015].