ISOLASI DAN ELEKTROFORESIS DNA TOTAL DARI UBI KAYU (Manihot esculenta Crantz.) GENOTIPE VARIEGATA
DAN KERITING ASAL PROVINSI RIAU Suci Islami Sanjaya1, Dewi Indriyani Roslim2, Herman2
1
Mahasiswa Program S1 Biologi
2
Dosen Bidang Genetika Jurusan Biologi
Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Riau Kampus Bina Widya Pekanbaru, 28293, Indonesia
ucimaniz98@yahoo.co.id
ABSTRACT
Cassava (Manihot esculenta Cranzt.) is a species that has high adaptability to acidic and poor nutrient soil in Riau Province. This province has high cassava genotypes that distributed in several districts, including Rokan Hilir. The variegata and keriting cassava are cassava genotypes from Rokan Hilir, but the genetic studies to isolation DNA have never been conducted. This study was aimed to isolate and electrophoresis the total DNA of variegata dan keriting cassava. The research methods included the isolation of DNA from fresh leaves of the variegata dan keriting cassava using CTAB (Cetyl Trimethyl Ammonium Bromide) method and the electrophoresis was conducted ina 1,2% agarose gel to know the quantity and quality of total DNA obtained. The results showed that the quality of the total DNA of variegata dan keriting cassava with thick band and intact. The concentration of total DNA obtained approximately 700-1000 ng/ µl.
Keywords: DNA isolation, electrophoresis, Manihot esculenta, Riau, total DNA
ABSTRAK
Ubi kayu (Manihot esculenta Cranzt.) merupakan tanaman yang memiliki daya adaptasi yang tinggi terhadap kondisi tanah yang asam dan miskin hara di Provinsi Riau. Provinsi ini memiliki banyak genotipe ubi kayu yang tersebar di beberapa Kabupaten, diantaranya Rokan Hilir. Ubi kayu variegata dan keriting merupakan salah satu genotipe ubi kayu yang berasal dari Kabupaten Rokan Hilir, akan tetapi belum pernah dilakukan penelitian secara genetik dengan mengisolasi DNAnya. Penelitian ini bertujuan mengisolasi dan mengelektroforesis DNA total dari ubi kayu genotipe variegata dan keriting. Metode penelitian meliputi isolasi DNA dari daun segar tanaman ubi kayu variegata dan keriting menggunakan metode CTAB (Cetyl Trimethyl
Ammonium Bromide) dan elektroforesis pada 1,2% gel agarose untuk mengetahui
kualitas dan kuantitas DNA total yang diperoleh. Hasil penelitian menunjukkan bahwa kualitas DNA total dari ubi kayu variegata dan keriting yang diperoleh memiliki pita tebal dan utuh. Kosentrasi DNA total yang diperoleh sekitar 700-1000 ng/µl.
PENDAHULUAN
Ubi kayu (Manihot esculenta Crantz.) atau singkong merupakan salah satu makanan pokok di Indonesia setelah padi dan jagung. Indonesia memiliki beberapa wilayah penghasil ubi kayu, diantaranya Provinsi Riau. Ubi kayu mampu beradaptasi dengan baik pada kondisi tanah yang asam serta miskin unsur hara di Provinsi Riau. Pada tahun 2014 Provinsi Riau tercatat telah memproduksi ubi kayu sebanyak 103.070 ton pada 2.863 ha lahan (Dinas Pertanian Tanaman Pangan dan Hortikultura Provinsi Riau 2014).
Ubi kayu merupakan tanaman yang mengandung kardohidrat tinggi dengan kadar amilosa 15-30% dan amilopektin 70-85%. Karbohidrat yang tinggi pada ubi kayu merupakan sifat yang tidak dimiliki oleh umbian-umbian lainnya sehingga ubi kayu dapat dimanfaatkan sebagai bahan pangan, industri, dan pakan ternak (Rismayani 2007). Pati merupakan kabohidrat kompleks yang tersusun oleh monomer -D-glukosa yang saling terikat satu sama lain dengan ikatan (1,4) dan -(1,6) glikosidik (Suprapti 2005).
Ubi kayu memiliki kadar pati yang berbeda tergantung genotipenya sehingga ada beberapa genotipe yang memiliki rasa umbi pahit dan tidak pahit. Secara umum, ubi kayu memiliki kandungan pati sebesar 34,7% dalam 100 gram umbi segar (Suprapti 2005). Ubi kayu variegata merupakan salah satu genotipe ubi kayu yang ada di Provinsi Riau yang berasal dari Kabupaten Rokan Hilir, memiliki corak daun variegata hijau-kuning dan rasa umbi tidak pahit. Contoh ubi kayu dengan rasa umbi tidak pahit lainnya adalah ubi kayu roti,
medan, cita, tangkai putih, tangkai merah, emas, lambau, pucuk hitam, bangka, dan hijau. Ubi kayu dengan kadar pati yang tinggi banyak dimanfaatkan sebagai bahan baku industri penghasil tepung tapioka.
Ubi kayu pahit dan tidak pahit juga mengandung senyawa racun, yaitu sianida. Ubi kayu tidak pahit mengandung sianida <40 ppm sehingga aman untuk dikonsumsi, sedangkan ubi kayu pahit mengandung sianida >100 ppm dan tidak aman untuk dikonsumsi dan biasanya dimanfaatkan sebagai gaplek. Untuk menghindari keracunan akibat sianidanya, ubi kayu pahit harus diolah terlebih dahulu sebelum dikonsumsi (Priyadarshani et al. 2004; Mburu et al. 2012). Umbi ubi kayu keriting memiliki rasa yang sangat pahit karena kadar sianidanya sangat tinggi, yaitu 400,638 ppm dan memiliki kadar pati yang rendah. Namun daun ubi kayu keriting tidak pahit dan sangat enak dibuat sayuran. Contoh ubi kayu dengan rasa umbi pahit lainnya, yaitu ubi kayu lurus, okulasi, pulut kuansing, dan menggalo (Roslim & Herman 2014).
Analisis mendalam dari ubi kayu variegata dan keriting sangat perlu dilakukan untuk melihat perbedaan antara kedua ubi kayu tersebut secara genetik. Langkah awalnya ialah dengan mengisolasi DNA dari ubi kayu variegata dan keriting. Isolasi DNA merupakan suatu metode untuk mengeluarkan DNA utas ganda dari sel tanaman sehingga didapatkan DNA murni yang dapat dianalisis lebih lanjut (Corkill & Rapley 2008). Untuk mengetahui kualitas dan kuantitas DNA yang berhasil diosolasi dilakukan dengan metode elektroforesis. Elektroforesis adalah proses memigrasikan DNA pada
matriks berpori dibawah pengaruh medan listrik. DNA dimigrasikan dari kutub negatif menuju kutub positif (Magdeldin 2012). Penelitian ini bertujuan untuk mengisolasi dan mengelektroforesis DNA total dari ubi kayu variegata dan keriting. Hasil penelitian ini diharapkan dapat digunakan sebagai bahan untuk penelitian lanjutan tentang analisis genetik lainnya.
METODE PENELITIAN
Penelitian ini dilakukan di Kebun Biologi dan Laboratorium Genetika, Jurusan Biologi, FMIPA Universitas Riau Pekanbaru dari bulan Maret 2014 sampai Januari 2015.
Alat yang digunakan dalam penelitian ini adalah sarung tangan, masker, gunting, timbangan, mortar dan pestel, spatula, tisu, waterbath, pipet mikro berukuran 20, 200, 1000 µl, tip mikro berukuran 20, 200, 1000 µl, tabung mikro berukuran 0,2, 1,5, dan 50 ml, sentrifus, hot plate, perangkat elektroforesis, lampu UV, dan camera.
Bahan yang digunakan di dalam penelitian ini adalah sampel daun ubi kayu variegata dan keriting koleksi Laboratorium Genetika yang ditanam di Kebun Jurusan Biologi, FMIPA, Universitas Riau yang berasal dari Rokan Hilir, nitrogen cair, buffer CTAB (Cetyl Trimethyl Ammonium Bromide) [komposisi: 1 M Tris HCl pH 8; 0,5 M EDTA pH 8; 5 M NaCl; dH2O; 0,2% 4 M BME (β-mercaptoethanol); dan 2% CTAB], kloroform, fenol, etidium bromida, isopropanol, etanol 70%, TE (0,5 M EDTA pH 8 dan 1 M Tris HCl pH 8), loading dye, 1 kb DNA ladder (Thermo Scientific), akuabidestilata
(dH2O) steril, agarose, dan 10x TBE (Tris-Borate; EDTA).
Prosedur penelitian meliputi isolasi dan elektroforesis DNA total. Isolasi DNA total dilakukan dari daun tanaman ubi kayu variegata dan keriting yang berumur dua bulan menggunakan metode CTAB (Saghai-Maroof el al. 1984) dengan sedikit modifikasi. Daun ubi kayu yang segar dengan berat ±200 mg dipotong-potong menggunakan gunting yang bersih, lalu dimasukkan ke dalam mortar, lalu digerus di dalam nitrogen cair. Setelah halus dimasukkan ke dalam tabung steril berukuran 50 ml, lalu tambahkan buffer CTAB. Campuran tersebut kemudian diinkubasi di dalam waterbath pada suhu 65oC, selama 1 jam, lalu didinginkan pada suhu ruang. Setelah itu tambahkan 1 volume kloroform, lalu dibolak-balik sampai homogen dan disentrifus dengan kecepatan 4000 rpm selama 10 menit. Fase cair bagian atas atau supernatan dipindahkan ke tabung 1,5 ml yang steril dengan menggunakan pipet mikro 1000 µl.
Setelah itu ditambahkan 1 volume isopropanol lalu dibolak-balik sampai terbentuk benang-benang DNA yang berwarna putih, kemudian disentrifus dengan kecepatan 4000 rpm selama 10 menit. Fase atas atau bagian cair dibuang, endapan DNA yang terbentuk kemudian dikeringkan pada suhu 37oC. Setelah kering ditambahkan 500 µl buffer TE. Lalu diinkubasi pada suhu 37oC selama semalam. Setelah itu, ditambahkan 200 µl TE untuk memperbesar volume DNA, lalu ditambahkan 700 µl fenol. Campuran tersebut dibolak-balik secara pelan-pelan selama 10 menit, kemudian disentrifus
pada kecepatan 4000 rpm selama 10 menit.
Larutan DNA fase cair bagian atas dipindahkan ke dalam tabung 1,5 ml yang steril. Kemudian ditambahkan 1 volume isopropanol. Tabung dibolak-balik hingga terbentuk benang-benang yang berwarna putih. Tabung disentrifus kembali dengan kecepatan 4000 rpm selama 10 menit. Pelet dikeringkan pada suhu 37oC, kemudian endapan DNA dibilas dengan etanol 70% dan dilarutkan kembali dengan 100 µl larutan TE. Larutan DNA stok disimpan pada suhu -20oC sedangkan larutan DNA kerja disimpan di suhu 4oC di dalam kulkas.
Setelah DNA total berhasil diisolasi, untuk mengetahui kualitas dan kuantitasnya ditentukan dengan metode elektroforesis menggunakan 1,2% gel agarose. Sebelum mencetak gel agarose, terlebih dahulu dirakit tempat cetakan gel dan jangan lupa untuk meletakan sisir sebagai alat untuk pembentuk sumur. 1,2% gel agarose dibuat dengan cara menambahkan 1,2 g bubuk agarose ke dalam 100 ml 1x buffer TBE. Kemudian dipanaskan di atas hot plate sampai larutan mendidih dan menjadi bening. Setelah bening, ditambahkan 4 µl etidium bromida menggunakan pipet mikro. Diamkan beberapa menit, kemudian larutan gel agarose dituangkan ke dalam cetakan. Saat gel sudah padat, sisir diangkat dan cetakan dimasukkan ke dalam alat elektroforesis (Fisons
Model FEC 360, Large Horizontal Gel System), lalu ditambahkan larutan 1x
buffer TBE ke dalam alat elektroforesis hingga semua permukaan gel terendam. Campur 3 µl DNA dengan 1 µl loading
dye, kemudian dimasukkan ke dalam
sumur. Sebanyak 3 µl 1 kb DNA ladder
juga dimasukkan ke dalam salah satu sumur sebagai standar ukuran DNA. Elektroforesis dilakukan pada tegangan 75 volt selama 30 menit. Gel hasil elektroforesis direndam dalam larutan etidium bromida, lalu divisualisasi di atas lampu UV (WiseUv WUV-M20,
Daihan Scientific) dan difoto dengan
kamera digital (Olympus SP-500 UZ).
HASIL DAN PEMBAHASAN
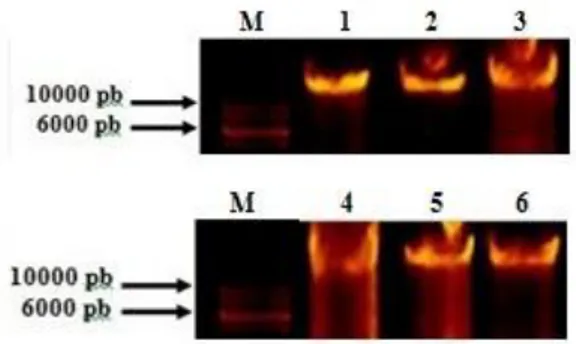
DNA total dari ubi kayu variegata dan keriting yang telah didapatkan dari hasil isolasi dan purifikasi DNA ditentukan kualitas dan kuantitasnya dengan metode elektroforesis. Elektroforesis adalah teknik pemisahan molekul bermuatan pada matriks berpori berdasarkan perbedaan tingkat migrasinya dalam sebuah medan listrik. Ada dua jenis gel yang sering digunakan dalam elektroforesis, yaitu agarose dan poliakrilamid. Gel poliakrilamid digunakan untuk memisahkan oligonukleotida, sedangkan gel agarose untuk memisahkan fragmen DNA (Magdeldin 2012). Gel agarose dapat memisahkan fragmen DNA dengan ukuran dari beberapa ratus hingga 20.000 pasang basa (pb). Hasil elektroforesis DNA total dari ubi kayu variegata dan keriting menunjukkan bahwa pita yang dihasilkan tebal dan utuh (Gambar 1). Kosentrasi DNA total yang diperoleh sekitar 700-1000 ng/µl dengan panjang fragmen >10000 pb.
Gambar 1 Pita DNA total dari ubi kayu keriting. Keterangan: (M) 1 kb DNA ladder (Thermo
Scientific), (1) variegata-1,
(2) 2, (3) variegata-3, (4) 1, (5) keriting-2, (6) keriting-3
Prinsip dasar dari elektroforesis yaitu molekul DNA (Deoxyribo Nucleid
Acid) yang bermuatan negatif
dimigrasikan melalui matriks gel agarose dari kutub negatif (anion) menuju kutub positif (kation) (Lee & Bahaman 2010). Kecepatan molekul yang bermigrasi tergantung pada bentuk dan ukuran DNA. Elektroforesis dapat memisahkan fragmen DNA menjadi pita-pita yang masing-masing memiliki ukuran yang sama (Campbell et al. 2002). Perangkat elektroforesis terdiri atas comb (sisir) yang akan membentuk well (sumur) pada gel agarose, tray merupakan wadah cetakan gel, dan chamber yang merupakan tempat berlangsungnya proses elektroforesis.
Ada beberapa bahan-bahan yang digunakan dalam elektroforesis seperti loading dye, 1 kb DNA ladder, dan etidium bromida. Loading dye atau blue
juice berfungsi sebagai pewarna untuk
memantau migrasi molekul DNA pada gel dan sebagai pemberat agar molekul DNA tidak keluar dari sumur. 1 kb DNA ladder atau marker merupakan
kumpulan fragmen yang spesifik dan telah diketahui ukurannya yang berfungsi sebagai penanda untuk memperkirakan ukuran DNA hasil amplifikasi. Setelah elektroforesis, DNA divisualisasi di atas lampu UV untuk melihat pita-pita DNA. Etidium bromida yang ditambahkan saat pembuatan gel agarose berperan sebagai pewarna yang dapat menyisip di antara basa-basa pada molekul DNA yang akan meningkatkan daya fluoresensi dari DNA sehingga dapat terlihat jelas. Kualitas DNA yang baik dan utuh tampak sebagai pita yang terang dan tidak smear (Martin 1996).
Menurut Wolfe (1993) dan Bowen (2000), ada beberapa faktor yang mempengaruhi laju migrasi molekul DNA pada saat elektroforesis, yaitu (1) ukuran molekul DNA. Molekul DNA bermigrasi melalui pori-pori kecil pada padatan gel agarose. Semakin kecil ukuran molekul DNA, maka semakin cepat migrasi molekul DNA melewati gel karena hanya terjadi sedikit gesekan antara molekul DNA dengan gel saat bergerak menuju kutub positif; (2) konsentrasi gel, semakin tinggi konsentrasi gel agarose, maka semakin kaku gel yang dibuat sehingga sulit untuk dilewati oleh molekul DNA. Konsentrasi gel agarose yang lebih tinggi akan memudahkan pemisahan DNA yang berukuran kecil, konsentasi agarose yang lebih rendah memudahkan pemisahan DNA dengan ukuran yang lebih besar; (3) densitas muatan yaitu muatan per unit volume molekul. Semakin tinggi densitas molekul, maka semakin cepat migrasi molekul DNA; (4) ukuran pori-pori gel, jika semakin kecil ukuran pori-pori gel, maka semakin lambat migrasi molekul DNA; (5)
voltase atau tegangan listrik yang tinggi dapat mempercepat migrasi molekul DNA; (6) komposisi buffer elektroforesis.
KESIMPULAN
Penelitian ini memperoleh DNA total dari ubi kayu variegata dan keriting dengan kualitas pita yang tebal dan utuh. Kosentrasi DNA total yang diperoleh sekitar 700-1000 ng/µl dan panjang fragmen >10000 pb. Molekul DNA total ubi kayu yang berhasil diisolasi dapat digunakan sebagai bahan untuk penelitian lanjutan tentang analisis keanekaragaman genetik.
UCAPAN TERIMA KASIH
Penulis mengucapkan terima kasih kepada SIMLITABMAS DIKTI yang telah mendanai peneliian ini melalui hibah penelitian fundamental tahun kedua 2015 atas nama Dr. Dewi Indriyani Roslim, M.Si. Terima kasih juga penulis ucapkan kepada semua pihak terkait yang telah mendukung dan membantu baik secara moril maupun materil sehingga penelitian ini dapat terlaksana.
DAFTAR PUSTAKA
Bowen R. 2000. Principles of gel electrophoresis.
http://www.vivo.colostate.edu. [20 Februari 2015].
Campbell NA, Reece JB, Mitchell LG. 2002. Biologi Edisi 5 Terjemahan. Jakarta: Erlangga.
Corkill G, Rapley R. 2008. The
Manipulation of Nucleic Acids:
Basic Tools and Techniques. In: Molecular Biomethods Handbook Second Edition. USA: Humana
Press.
Dinas Pertanian Tanaman Pangan dan Hortikultura Pekanbaru. 2014.
Laporan Angka Sementara
(ASEM) Sayur-Sayuran 2013 Tahun 2014 Provinsi Riau.
Pekanbaru: Dinas Tanaman Pangan dan Hortikultura.
Lee SV, Bahaman AR. 2010. Modified gel preparation for distinct DNA fragment analysis in agarose gel electrophoresis. Tropical
Biomedicine 27(2):351-354.
Magdeldin, Sameh. 2012. Gel Electrophoresis-Principles and Basics. Croatia: InTech Publisher.
Martin, R. 1996. Gel Electrophoresis:
Nucleid Acids. Oxford: Bios scientific Publisher.
Mburu FW, Swaleh A, and Njue W. 2012. Potential toxic levels of cyanide in cassava (Manihot
esculenta Crantz) grown in Kenya. African J of Food Science
6(16):416-420.
Priyadarshani AMB, Jansz ER, Peiris H, Jayasinghe S. 2004. Detoxification of cassava leaves. J Natn Sci
Foundation Sri Lanka
32(1&2):61-68.
Rismayani. 2007. Analisis Usaha Tani
dan Pemasaran Hasil. Medan:
USU Press.
Roslim DI, Herman. 2014. Laporan Tahunan Penelitian Fundamental: Karakter morfologi, biokimia, serta urutan nukleotida gen Meisa1 dan Lin pada ubi kayu (Manihot
esculenta Crantz) asal Riau. Pekanbaru: Universitas Riau.
Saghai-Maroof, MA, Solimah KM, Jorgensen RA, Allard RW. 1984. Ribosomal DNA spacer length polymorphisme in barley: mendelian inheritance, chromosomal location and population dynamics. Proc Natl
Acad Sci 81:8014-8018.
Suprapti LM. 2005. Tepung Tapioka,
Pembuatan dan Pemanfaatannya.
Yogyakarta: Kanisius.
Wolfe SL. 1993. Introduction to Cell
and Molecular Biology. Belmont:
Wardworth Publishing Company. xvii+820 hlm.