Halaman: 38-42
© 2003 Jurusan Biologi FMIPA UNS Surakarta
Pengaruh Ekstrak Temu Putih (Curcuma zedoaria Rosc.) terhadap
Spermatogenesis dan Kualitas Spermatozoa Mencit (Mus musculus L.)
The effect of zedoary extract (Curcuma zedoaria Rosc.) on spermatogenesis and quality of sperms
of Mus musculus L.
TUTIK SISWANTI, OKID PARAMA ASTIRIN, TETRI WIDIYANI
Jurusan Biologi Fakultas MIPA Universitas Sebelas Maret Surakarta 57126 Diterima: 6 Agustus 2002. Disetujui: 15 Januari 2003
ABSTRACT
The aims of the study were to know the effect of zedoary or temu putih extract (Curcuma zedoaria Rosc.) on mice spermatogenesis (Mus musculus L.) and the quality of sperms. Male mice were treated with zedoary extract orally for 34 days, then testis sperms were collected, and the histological section was made using paraffin and Hematoxyllin-Eosin (HE) method. The results indicated that the extract affect spermatogenesis by decreasing spermatogonia cells, spermatocyte and spermatid, as well as decreasing spermatogenic cell layer of mice (Mus musculus L.), sperm viability, and tend to decrease sperm motility.
Key words: zedoary extract (Curcuma zedoaria Rocs.), spermatogenesis, sperm quality.
PENDAHULUAN
Indonesia adalah negara tropis yang kaya akan tumbuh-an obat. Obat tradisional merupaktumbuh-an salah satu alternatif dalam pengobatan karena efek sampingnya dianggap lebih kecil dan harganya lebih murah dibandingkan obat modern. Salah satu rempah yang banyak tumbuh di Indonesia dan dimanfaatkan untuk obat tradisional adalah temu putih (Curcuma zedoaria Rosc.).
Temu putih termasuk dalam familia Zingiberaceae, memiliki kandungan kimia berupa minyak atsiri 1-1,5%, kurkumin, gum, resin, amilum, dan tanin. Temu putih dapat digunakan sebagai antikanker, antibakteri, antitrombik, antifungal, antioksidan, dan hepatoprotektif (Nurrochmad dan Murwanti, 2000). Adapun wujud efek toksik kurkumin in-vivo adalah antifertilitas (Garg dalam Listyaningsih dkk., 2000). Agar dapat dimanfaatkan secara luas dan bertang-gungjawab, perlu dilakukan penelitian obat tradisional yang mencakup pengujian, pengembangan khasiat, dan keamanannya (Sumarjan, 1992).
Tujuan penelitian ini adalah untuk mengetahui (i) pengaruh pemberian ekstrak temu putih terhadap sperma-togenesis dan kualitas spermatozoa mencit (Mus musculus L.) yang meliputi kecepatan gerak, motilitas, morfologi, dan viabilitas, serta (ii) pengaruh variasi dosis ekstrak temu putih yang diberikan pada mencit terhadap spermatogenesis dan kualitas spermatozoa. Manfaat yang diharapkan dari penelitian ini adalah diketahui tingkat keamanan ekstrak temu putih sebagai salah satu obat tradisional terutama terhadap proses reproduksi jantan, serta memberikan informasi kepada masyarakat tentang kemungkinan adanya efek samping penggunaan obat tradisional temu putih.
BAHAN DAN METODE
Penelitian dilakukan mulai bulan Juli s.d Oktober 2001 di BPTO Tawangmangu, PPOT UGM Yogyakarta, UPHP UGM Yogyakarta, dan sub Lab. Biologi Laboratorium Pusat MIPA UNS Surakarta.
Cara kerja dalam penelitian ini meliputi persiapan, preparasi temu putih dengan metode soxletasi, serta perlakuan pemberian ekstrak temu putih dengan menggunakan disposable syringe 2,5 ml yang ujungnya diganti dengan kanul dan dimasukkan secara per oral selama 34 hari. Penelitian dibagi dalam 4 kelompok, yaitu: (i) dosis 0 mg/kg BB/hari (diberi akuades), (ii) dosis 100 mg/kg BB/hari, (iii) dosis 200 mg/kg BB/hari, dan (iv) dosis 300 mg/kg BB/hari.
Setelah diberi ekstrak temu putih selama 34 hari, mencit dibedah dan diambil testisnya untuk dibuat preparat histologis dengan metode parafin dan pewarnaan HE, sedangkan spermatozoa diambil dari sel epididimis. Pemeriksaan kualitas spermatozoa meliputi pengamatan motilitas, morfologi, viabilitas dan pemeriksaan kecepatan gerak. Data yang diperoleh dianalisis dengan menggunakan ANOVA dan dilanjutkan dengan DMRT.
HASIL DAN PEMBAHASAN
Spermatogenesis
Spermatogenesis merupakan proses pembentukan spermatozoa yang terjadi dalam tubulus seminiferus. Pada proses ini terjadi serangkaian tahapan pembentukan sel-sel yang terdiri dari sel spermatogonia, spermatosit dan
spematid (Frandson, 1993). Penghitungan jumlah sel-sel ini dilakukan dengan cara menghitung sel-sel spermatogenik pada tubulus seminiferus testis dengan menggunakan mikroskop cahaya perbesaran 200 kali (Tabel 1).
Tabel 1. Jumlah rata-rata sel spermatogenik mencit per tubulus seminiferus setelah perlakuan dengan ekstrak temu putih.
Perlakuan (mg/kg BB/hari) Spermatogonia M ± SD Spermatosit M ± SD Spermatid M ± SD Lapisan sel spermatogenik M ± SD 0 45,2 ± 1,72a 39,8 ± 2,14a 49,6 ± 3,0 a 6,6 ± 0,8 a 100 39,8 ± 2,56 a 35,0 ± 3,40a 41,2 ± 4,26a 4,2 ± 0,4 b 200 33,6 ± 2,87b 29,4 ± 2,58b 35,8 ± 3,25b 4,2 ± 0,4 b 300 31,6 ± 2,15 b 27,6 ± 2,50b 34,0 ± 1,90b 3,4 ± 0,49 b
Keterangan: Angka yang diikuti huruf yang sama menunjukkan tidak beda nyata.
Dari Tabel 1 diketahui adanya penurunan jumlah sel spermatogenik pada tubulus seminiferus mencit setelah diberi ekstrak temu putih, baik spermatogonia, spermatosit mau-pun spermatid dibandingkan kontrol. Semakin tinggi dosis temu putih yang diberikan, maka jumlah sel-sel sperma-togen semakin menurun. Berdasarkan uji statistik terhadap sel spermatogonia, spermatosid, spermatid, dan lapisan sel spermatogenik terdapat beda nyata antara ke-lompok kontrol dan keke-lompok perlakuan. Dengan demikian dapat dikatakan bahwa ekstrak temu putih mempengaruhi spermatogenesis dan lapisan sel spermatogenik mencit.
Penurunan jumlah sel spermatogenik ini, menurut Winarni (1996), kemungkinan dikarenakan terganggunya sintesis testosteron pada sel Leydig (Gambar 3B.), sehingga mengakibatkan terganggunya fungsi sel Sertoli. Lebih lanjut oleh Sudomo dan Tamtomo (1979), dikatakan bahwa dengan terganggunya sel Sertoli dapat mengakibat-kan terjadinya degenerasi sel-sel spermatogenik. Hal ini terjadi karena salah satu fungsi sel Sertoli adalah memberi nutrisi sel-sel spermatogenik. Akibat kekurangan nutrisi, sel-sel spermatogenik tidak dapat berkembang secara optimal. Semakin tinggi dosis temu putih yang diberikan, akan mengakibatkan semakin banyak sel Sertoli yang rusak dan sel spermatogenik yang terbentuk juga semakin sedikit. Selain itu, penurunan sel spermatogenik dapat pula di-sebabkan adanya zat sitotoksik dalam temu putih, sehingga mengganggu pertumbuhan dan perkembangan jaringan sel (Purwaningsih dan Susmiarsih, 1998). Akibat terganggu-nya pertumbuhan dan perkembangan jaringan ini, maka jumlah sel spermatogenik menurun karena sel-sel sper-matogen merupakan sel yang aktif melakukan pembelahan.
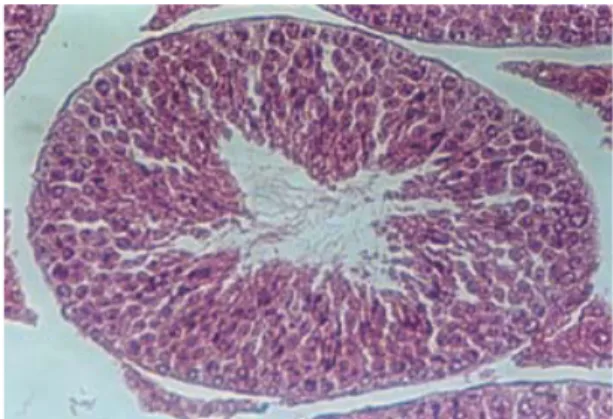
Hasil pengamatan terhadap tubulus seminiferus menunjukkan terjadinya perbedaan struktur tubulus seminiferus antara kelompok kontrol dan kelompok perlakuan. Tubulus seminiferus kelompok kontrol tersusun atas sel-sel spermatogenik yang tersusun kompak dan padat. Lapisan sel pada kelompok ini rata-rata terdiri dari 6 lapis sel. Lumen tubulus seminiferus kelompok kontrol terlihat lebih sempit karena jumlah lapisan sel pada kelompok ini lebih banyak dan penuh berisi spermatozoa daripada kelompok perlakuan (Gambar 1).
Struktur histologis tubulus seminiferus mencit kelompok perlakuan I (dosis 100 mg/kg BB/hari) sudah mulai menunjukkan terjadinya kerusakan. Pada kelompok
ini sel-sel spermatogenik mulai tersusun tidak teratur dan susunan sel mulai tidak rapat. Selain itu membrana basalis antara tubulus seminiferus sudah saling merapat satu dengan yang lain dan lapisan sel sudah mulai berkurang, sehingga lumen tubulus terlihat lebih lebar dibandingkan kelompok kontrol dan tampak kososng, tidak berisi spermatozoa (Gambar 2).
Gambar 1. Struktur tubulus seminiferus mencit kelompok kontrol. Pewarnaan HE. Perbesaran 200 kali. Keterangan: a. membranan basalis, b. sel interstiil, c. spermatogonia, d. spermatosit, e. spermatid, dan f. sel sertoli.
Gambar 2. Struktur tubulus seminiferus mencit kelompok I (dosis 100 mg/kg BB/hari). Pewarnaan HE. Perbesaran 200 kali. Keterangan: a. membranan basalis, b. sel interstiil, c. spermatogonia, d. spermatosit, e. spermatid, dan f. sel sertoli.
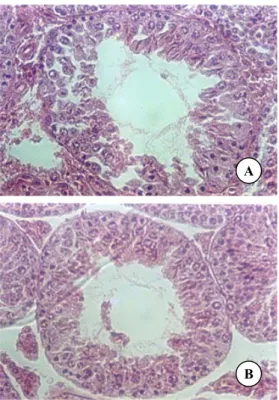
Struktur tubulus seminiferus mencit pada kelompok perlakuan II (dosis 200 mg/kg BB/hari) (Gambar 3A) dan III (dosis 300 mg/kg BB/hari) (Gambar 3B) menunjukkan kerusakan yang semakin terlihat nyata. Sel-sel spermatoge-nik pada kelompok perlakuan II tersusun agak jarang dan pada kelompok perlakuan III struktur tubulus seminiferus mencit sudah mengalami kerusakan yang semakin komplek. Selain jumlah sel-sel spermatogenik mengalami penurunan, sel Leydig pada kelompok perlakuan III ini juga mengalami degradasi dan jarak antara tubulus seminiferus makin rapat sehingga sukar untuk dibedakan jarak antar tubulus. Lapisan sel spermatogenik pada kelompok ini juga semakin menurun dan sel-sel tersusun lebih jarang, sehingga lumen juga terlihat semakin lebar.
Gambar 3. A. Struktur tubulus seminiferus mencit kelompok perlakuan II (dosis 200 mg/kg BB/hari). B. Struktur tubulus seminiferus mencit kelompok perlakuan III (dosis 300 mg/kg BB/hari). Pewarnaan HE. Perbesaran 200 kali. Keterangan: a. membranan basalis, b. sel interstiil, c. spermatogonia, d. spermatosit, e. spermatid, dan f. sel sertoli.
Pengamatan terhadap tubulus seminiferus menunjukkan terjadi perubahan struktur tubulus seminiferus antara kelompok kontrol dengan kelompok perlakuan. Penurunan jumlah sel spermatogenik yang terjadi dapat dilihat pada lapisan sel spermatogenik dalam tubulus seminiferus yang berkurang akibat terganggunya spermatogenesis.
Menurut Gufron dan Herwiyanti (1995), hambatan atau gangguan spermatogenesis dapat dilihat dari letak sel spermatogenik yang tidak teratur sehingga lumen tidak mempunyai batas yang tegas. Menurut Yen dan Jaffe (dalam Gufron dan Herwiyanti, 1995), terganggunya spermatogenesis ini kemungkinan karena adanya zat dalam temu putih yang bersifat kompetitif terhadap reseptor FSH (Follicle Stimulating Hormone), sehingga mengganggu keseimbangan FSH pada aksis hipotalamus-hipofisis dan selanjutnya menghambat spermatogenesis.
Lebih lanjut oleh Junqueira, dkk. (1995), dijelaskan bahwa spermatogenesis dipengaruhi oleh kerja FSH dan hormon lutein (LH) dari hipofisis pada sel-sel testis. LH mempengaruhi sel interstitiil merangsang produksi testosteron yang diperlukan untuk perkembangan normal sel spermatogenik. Jika sel ini mengalami degenerasi, maka sintesis testosteron akan terganggu, sehingga pemasakan sel saat spermatogenesis menjadi terganggu juga, karena hormon ini merupakan hormon yang mutlak diperlukan untuk spermatogenesis selain FSH. FSH juga meningkatkan sintesis dan sekresi ABP (Androgen Binding Protein). ABP berikatan dengan testosteron dan mengangkutnya ke dalam lumen tubulus seminiferus.
Dengan terganggunya keseimbangan hipotalamus-hipofisis, maka kerja FSH menjadi tidak optimal dan mempengaruhi sel Sertoli sebagai pemberi nutrisi sel spermatogenik, akibatnya spermatogenesis terhambat dan sel-selnya mengalami degenerasi. Semakin tinggi dosis ekstrak temu putih yang diberikan, maka degenerasi sel semakin banyak.
Menurut Lu (1995), terganggunya spermatogenesis ini dapat menyebabkan atrofi testis. Untuk mengetahui apakah terganggunya spermatogenesis yang terjadi menyebabkan atrofi testis, maka setelah diberi perlakuan testisnya ditimbang terlebih dahulu. Berdasarkan uji ANOVA terdapat beda nyata pada berat testis. Menurut Turner dan Bagnara (1988), hipofungsi sel Leydig ditunjukkan dengan adanya atrofi organ-organ seks, yang diikuti disorganisasi epitel tubulus seminiferus dan dapat berakibat berhentinya spermatogenesis.
Ekstrak temu putih dapat mengakibatkan hipofungsi dari sel Leydig yang ditunjukkan dengan berkurangnya jumlah sel ini. Selain penurunan jumlah sel, hipofungsi sel Leydig juga ditunjukkan dengan penurunan berat testis (atrofi). Gambar 1-4 menunjukkan bahwa semakin tinggi dosis ekstrak temu putih yang diberikan, semakin tinggi disorganisasi epitel tubulus seminiferus. Penurunan rata-rata berat testis mencit antara kelompok kontrol dan perlakuan ditunjukkan Tabel 2.
Tabel 2. Berat rata-rata testis kanan mencit setelah perlakuan dengan ekstrak temu putih.
Dosis Perlakuan Berat rata-rata testis (gram) M ± SD
0 mg/kg BB/hari 0,2072 ± 0,020a
100 mg/kg BB/hari 0,1766 ± 0,019 a
200 mg/kg BB/hari 0,1722 ± 0,034ab
300 mg/kg BB/hari 0,1546 ± 0,013c
Keterangan: angka yang diikuti huruf yang sama menunjukkan tidak beda nyata.
Kualitas spermatozoa
Spermatozoa yang diamati diambil dari bagian epi-didimis yang dipotong dan dibuat suspensi dengan larutan garam fisiologis (NaCl 0,9%) bersuhu 40oC. Pemeriksaan
kualitas spermatozoa dilakukan secara mikroskopis meliputi motilitas, kecepatan gerak dan viabilitas (Tabel 3, 4 dan 5.). Pemeriksaan kualitas spermatozoa yang pertama adalah kecepatan gerak. Menurut Soekarno dan Pietersono (dalam Fitria, 2000), kecepatan gerak spermatozoa merupakan variabel penting untuk menguji kemampuan motilitas spermatozoa.
Kecepatan gerak spermatozoa tergantung kecepatan pukulan dan gerakan ekor spermatozoa. Spermatozoa yang kekurangan energi bergerak lambat, meskipun arahnya tetap ke depan dan ekor bergerak teratur (Hafez dalam Panghiyangani, 1994). Pemeriksaan kecepatan gerak spermatozoa dilakukan dengan menggunakan bilik hitung hemositometer Neubeuer dengan cara mengambil spermatozoa yang telah diencerkan dengan NaCl 0,9% dan diperiksa di bawah mikroskop perbesaran 400 kali. Kecepatan gerak spermatozoa dinyatakan dalam satuan µm/detik (Tabel 3.).
A
Tabel 3. Rata-rata kecepatan gerak spermatozoa mencit setelah perlakuan dengan ekstrak temu putih.
Dosis Perlakuan Kecepatan gerak (µm/dt) M ± SD
0 mg/kg BB/hari 175,2 ± 40,78a
100 mg/kg BB/hari 156,6 ± 16,80 a
200 mg/kg BB/hari 128,4 ± 21,59ab
300 mg/kg BB/hari 120,8 ± 42,83c
Keterangan: Angka yang diikuti huruf yang sama menunjukkan tidak beda nyata.
Tabel 3 menunjukkan adanya penurunan kecepatan gerak spermatozoa setelah pemberian ekstrak temu putih. Semakin besar dosis ekstrak temu putih yang diberikan, maka kecepatan gerak spermatozoa semakin menurun. Berdasarkan analisis statistik, secara umum tidak terdapat beda nyata kecepatan gerak spermatozoa antara kelompok kontrol dan perlakuan, meskipun antara kontrol dan perlakuan III (dosis 300 mg/kg BB/hari) terdapat beda nyata. Dengan demikian dapat dikatakan bahwa ekstrak temu putih baru mempengaruhi kecepatan gerak spermatozoa secara nyata pada dosis 300 mg/kg BB/hari.
Untuk mengetahui gerakan spermatozoa baik atau buruk, maka dilakukan pemeriksaan motilitas spermatozoa dengan cara melihat gerakan spermatozoa di bawah mikroskop perbesaran 200 kali. Adapun yang dimaksud spermatozoa dengan motilitas baik adalah spermatozoa yang bergerak lincah lurus ke depan (progesif), sedangkan spermatozoa dengan motilitas buruk adalah spermatozoa dengan gerakan apapun selain gerak tersebut.
Tabel 4. Motilitas spermatozoa mencit setelah perlakuan dengan ekstrak temu putih.
Dosis Perlakuan Baik (%) Buruk (%) Immotil (%) 0 mg/kg BB/hari 38,0 ± 5,18a 28,8 ± 5,78 a 34,4 ± 7,12 a
100 mg/kg BB/hari 30,0 ± 14,14 a 36,0 ± 8,0 a 34,0 ± 8,0 a
200 mg/kg BB/hari 29,8 ± 11,79 a 22,2 ± 6,64ab 48,0 ± 9,27 a
300 mg/kg BB/hari 28,8 ± 6,76 a 30,0 ± 6,32b 42,0 ± 11,66 a
Keterangan: Angka yang diikuti huruf yang sama menunjukkan tidak beda nyata.
Tabel 4 menunjukkan persentase spermatozoa yang motilitasnya baik cenderung mengalami penurunan dengan meningkatnya dosis temu putih yang diberikan, artinya ekstrak temu putih dapat menyebabkan spermatozoa menjadi immotil atau bergerak tak teratur. Rata-rata spermatozoa immotil paling banyak ditemukan pada kelompok dosis 200 mg/kg BB/hari. Spermatozoa yang tidak bergerak ini belum tentu mati. Immotilitas spermatozoa ini dapat saja terjadi karena spermatozoa tidak memiliki energi yang cukup. Keterbatasan energi ini mungkin disebabkan kondisi spermatozoa itu sendiri sejak sebelum dilakukan pemeriksaan. Untuk mengetahui spermatozoa yang tidak bergerak ini masih hidup atau sudah mati, dilakukan pengecatan supravital. Penurunan motilitas spermatozoa ini kemungkinan disebabkan adanya zat toksik dalam temu putih yang dapat menurunkan motilitas spermatozoa.
Menurut Soeharso (1985), perangkat motilitas sperma-tozoa atau aksonem disusun oleh mikrotubulus dan
protein-protein kontraktil lain. Susunan tersebut diatur sedemikian rupa sehingga dapat mengorganisasi gerakan-gerakan yang pada akhirnya tampak sebagai simpangan ke kanan dan ke kiri ekor spermatozoa. Tenaga yang diperlukan untuk menggerakkan aksonem itu diperoleh dari pemecahan ATP oleh enzim ATP-ase melalui proses respirasi atau glikolisis. Selain itu, motilitas spermatozoa juga dipengaruhi oleh fisiologi spermatozoa itu sendiri, yang antara lain distribusi ion dalam sel. Zat toksik dalam temu putih mungkin dapat mengganggu respirasi atau glikolisis dalam aksonem sehingga mengganggu aktivitas enzim ATP-ase pada mem-bran spermatozoa. Kemungkinan lain dapat juga disebab-kan terganggunya aktivitas protein dinein, salah satu protein pada ekor spermatozoa, yang mempunyai aktivitas ATP-ase (Grady dan Nelson, 1972), sehingga energi yang dihasilkan tidak maksimal dan motilitas spermatozoa terganggu. Kecenderungan penurunan motilitas spermato-zoa ini setelah dianalisis statistik tidak menunjukkan ada-nya beda ada-nyata. Sehingga dapat dikatakan bahwa ekstrak temu putih sampai dosis 300 mg/kg BB/hari tidak menye-babkan penurunan motilitas spermatozoa secara nyata.
Untuk mengetahui apakah spermatozoa immotil pada kelompok perlakuan hidup atau mati dilakukan pewarnaan diferensial dengan menggunakan zat warna neutral red. Setelah diwarnai, selanjutnya diamati di bawah mikroskop perbesaran 200 kali dan dihitung spermatozoa yang berwarna dan tidak berwarna sampai berjumlah 100. Menurut Nalbandov (1990), terdapat perbedaan afinitas menghisap zat warna antara sel spermatozoa hidup dan mati, sehingga memberi kemungkinan untuk menaksirkan jumlah spermatozoa hidup atau mati.
Perbedaan afinitas menghisap zat warna ini karena sel-sel yang mati akan menyerap warna. Hal ini disebabkan karena permeabilitas membran sel spermatozoa mati meningkat terutama di daerah kepala yang tidak tertutup akrosom, sedangkan pada spermatozoa hidup membran sel utuh dan sukar ditembus zat warna (Nalbandov, 1990).
Tabel 5. Viabilitas spermatozoa setelah perlakuan temu putih. Dosis Perlakuan Spermatozoa hidup
(%) M ± SD Spermatozoa mati (%) M ±SD 0 mg/kg BB/hari 73,6 ± 1,62a 26,4 ± 1,62 a
100 mg/kg BB/hari 68,2 ± 2,71 b 31,8 ± 2,12 b
200 mg/kg BB/hari 59,0 ± 3,49 c 41,0 ± 3,52 c
300 mg/kg BB/hari 50,8 ± 3,25 d 49,2 ± 3,25 d
Keterangan: Angka yang diikuti oleh huruf yang sama menunjukkan tidak beda nyata
Tabel 5 menunjukkan adanya penurunan viabilitas (kemampuan hidup) spermatozoa sejalan dengan penambahan dosis ekstrak temu putih. Penurunan motilitas dan viabilitas spermatozoa akibat pemberian ekstrak temu putih, kemungkinan disebabkan adanya zat toksik dalam temu putih khususnya yang bersifat antifertilitas, sehingga menurunkan motilitas atau bahkan mematikan spermatozoa dan menurunkan viabilitasnya (Purwaningsih dan Susmiarsih, 1998). Zat toksik ini kemungkinan berupa kurkumin (Listaningsih, 2000). Kemungkinan lain adalah terganggunya fungsi sel Sertoli sebagai penunjang, pelindung dan pengatur nutrisi bagi spermatozoa yang
berkembang (Junqueira, dkk., 1995). Terganggunya fungsi sel Sertoli menyebabkan terganggunya pertukaran dan metabolisme sel sehingga dapat mematikan spermatozoa.
Dari uji ANOVA untuk viabilitas spermatozoa, secara umum dapat diketahui bahwa terdapat perbedaan yang sangat nyata antara kelompok kontrol dengan kelompok perlakuan. Dengan demikian dapat dikatakan bahwa ekstrak temu putih bersifat toksik sehingga dapat mematikan spermatozoa. Jadi, meskipun ekstrak temu putih tidak mempengaruhi motilitas atau kecepatan gerak, tapi justru dapat mematikan spermatozoa mencit.
Untuk mengetahui abnormalitas spermatozoa setelah perlakuan ekstrak temu putih, maka dibuat preparat apus yang diwarnai dengan neutral red dan dilihat dibawah mikroskop dengan perbesaran 400 kali. Morfologi spermatozoa mencit normal terdiri dari kepala, badan dan ekor. Kepala spermatozoa mencit berbentuk kait dan mempunyai panjang ± 0,008 mm. Panjang keseluruhan spermatozoa mencit ± 0,1226 mm (Rugh, 1968). Bentuk abnormalitas yang muncul setelah perlakuan ekstrak temu putih dapat dibedakan menjadi abnormalitas primer dan sekunder. Abnormalitas primer merupakan abnormalitas yang berasal dari gangguan testis dan biasanya terjadi pada daerah kepala (Partodihardjo, 1980). Kelainan pada kepala umumnya berupa kelainan tudung akrosom (Purwaningsih, 1996). Kelainan ini dapat terjadi pada fase spermio-genesis, dimana terjadi pembelahan sel secara meiosis yang salah satu tahapannya adalah pembentukan tudung akrosom. Tudung akrosom berperan menembus sel telur pada saat pembuahan. Selain pada kepala, bentuk abnormalitas primer dapat pula terjadi pada daerah leher. Kelainan ini akan menyebabkan penurunan motilitas spermatozoa, karena selain di bagian ekor pada bagian leher spermatozoa juga terdapat berkas fibril yang penting untuk pergerakan spermatozoa.
Abnormalitas sekunder menurut Toelihere (1985), dapat terjadi setelah spermatozoa meninggalkan tubulus seminiferus, selama perjalanan melalui saluran epididimis dan vas deferens, selama ejakulasi atau dalam perjalanan melalui saluran urethra. Tetapi abnormalitas sekunder dapat juga disebabkan perlakuan yang terlalu keras pada saat pembuatan preparat.Bentuk abnormalitas sekunder pada penelitian ini antara lain spermatozoa tanpa kepala atau tanpa ekor, dan ekor melingkar atau pertautan pada kepala. Spermatozoa tanpa kepala atau tanpa ekor ini mungkin disebabkan kesalahan pembuatan preparat.
Menurut Lu (1995), suatu toksikan dapat menurunkan jumlah sel-sel spermatogenik dan menyebabkan abnormal-itas spermatozoa. Hal ini dapat dimengerti karena sperma-tozoa merupakan hasil akhir dari spermatogenesis, se-hingga apabila proses ini dihambat atau dipengaruhi oleh suatu zat, maka spermatozoa yang dihasilkan juga mega-lami gangguan yang dapat dilihat sebagai abnormalitas. Dengan demikian selain mempengaruhi spermatogenesis dan menurunkan kualitas spermatozoa, ekstrak temu putih juga mengakibatkan abnormalitas spermatozoa mencit.
KESIMPULAN
Ekstrak temu putih (C. zedoaria Rosc.) dapat mempe-ngaruhi spermatogenesis mencit dengan menurunkan jum-lah sel spermatogonia, spermatosit, spermatid, dan lapisan sel spermatogenik, serta menurunkan kualitas spermatozoa mencit dengan menurunkan kecepatan gerak, motilitas dan viabilitasnya. Pemberian dosis temu putih sebanyak 300 mg/kg BB/hari secara nyata mempengaruhi spermato-genesis dan kualitas spermatozoa.
DAFTAR PUSTAKA
Fitria, L. 2000. Pengaruh Ekstrak Kuda Laut (Hippocampus kuda
Blecker) terhadap Spermatogenesis dan Kualitas Spermatozoa Mencit Jantan (Mus musculus). [Skripsi]. Yogyakarta: Fakultas Biologi
UGM
Frandson, A. 1993. Anatomi dan Fisiologi Ternak. Edisi 4. Yogyakarta: UGM Press
Grady, A.V. dan L. Nelson, 1972. Cationic influences on sperm biopotential. Experimental Cell Research 73: 192-195.
Gufron, M, dan S. Herwiyanti. 1995. Gambaran Histologik Spermatogenesis Tikus Putih (Rattus norvegicus) setelah Diberi Makan Terong Tukak (Solanum torvum). Jurnal Kedokteran Yarsi 2 (3): 28-35.
Junqueira, L.C., J Carneiro dan R.O Kelley. 1995. Histologi Dasar. Edisi 8. Penerjemah: Tambayong, J. Jakarta: Penerbit Buku Kedokteran EGC. Listyaningsih, S., B. Widjokongko dan O.P Astirin. 2000. Pengaruh
Pemberian Ekstrak Kunyit Putih terhadap Perkembangan Folikel Ovarium Mencit. Surakarta: Fakultas Kedokteran UNS.
Lu, F.C. 1995. Toksikologi Dasar Azas, Organ Sasaran dan Penilaian
Resiko. Edisi Kedua. Penerjemah: Nugroho, E. Jakarta: UI
Nalbandov, A.V. 1990. Fisiologi Reproduksi Pada Mamalia dan Unggas Penerjemah: Keman, S. Jakarta: UI Press.
Nurrochmad, A dan R. Murwanti. 2000. Efek hepatoprotektif ekstrak alkohol rimpang temu putih (Curcuma zedoaria Rosc.) pada tikus putih jantan. Pharmacon 1 (1): 31-36.
Panghiyangani, R. 1994. Struktur Histologis Tubulus Seminiferus Testis
dan Kualitas Spermatozoa Mencit (Mus musculus L.) setelah Perlakuan Kafein. Yogyakarta: Fakultas Biologi UGM.
Partodihardjo, S. 1980. Ilmu Reproduksi Hewan. Jakarta: Penerbit Mutiara Purwaningsih, E dan T. Susmiarsih. 1998. Efek spermatisida ekstrak biji
oyong (Luffa acutangula Roxb.) terhadap motilitas dan viabilitas spermatozoa in-vitro. Jurnal Kedokteran Yarsi 6 (3): 54-65.
Purwaningsih, E. 1996. Morfologi Spermatozoa : Adakah Kaitannya dengan Keberhasilan Kehamilan?. Jurnal Kedokteran Yarsi 4 (1): 17-27.
Soeharso, P. 1985. Beberapa aspek biokimia plasma semen dan sperma-tozoa. Dalam Nukman, M. dan T. Arjatmo (ed). Proses Reproduksi,
Kesuburan dan Seks Pria dalam Perkawinan. Jakarta: FKUI.
Sudomo, A dan D.G. Tamtomo. 1979. Perubahan Struktur Histologis Testis sesudah Vasektomi. Dalam Hadi, K. (ed): Spermatologi. Surabaya: Perkumpulan Andrologi Indonesia.
Sumarjan, S. 1992. Jamu suatu tinjauan dari sudut sosiologi. Dalam Agoes, A. dan Jacob (ed): Antropologi Kesehatan Indonesia. Jilid I. Jakarta: Penerbit Buku Kedokteran EGC.
Toelihere, M.R. 2985. Fisiologi Reproduksi pada Ternak. Bandung: Penerbit Angkasa.
Turner, C.D. dan Bagnara. 1988. Endokrinologi Umum. Surabaya: Universitas Airlangga.
Winarni, D. 1996. Kadar lutenaizing hormon serum dan spermatogenesis tikus putih (Rattus norvegicus L.) dewasa setelah pemberian estrogen dengan lama waktu berbeda. Berkala Penelitian Hayati,