Sumatera Utara, dan Sumatera Barat dengan areal berkisar antara 6.600−7.900 ha/tahun. Umumnya, usaha tani nilam masih dilakukan secara tradisional berupa perladangan berpindah. Sistem usaha tani demikian dalam jangka panjang dapat mengganggu kelestarian hutan karena
PEMANFAATAN KULTUR
IN VITRO
UNTUK
MENINGKATKAN KERAGAMAN
GENETIK TANAMAN NILAM
Ika Mariska dan Endang G. Lestari
Balai Penelitian Bioteknologi dan Sumberdaya Genetik Pertanian, Jalan Tentara Pelajar No. 3A, Bogor 16111
ABSTRAK
Nilam (Pogostemon cablin) merupakan tanaman yang potensial untuk dikembangkan. Namun, keragaman genetik tanaman nilam cukup rendah karena tanaman nilam budi daya tidak berbunga. Untuk meningkatkan keragaman genetik tanaman maka dilakukan kultur in vitro antara lain melalui keragaman somaklonal yang dikombinasikan dengan pemberian mutagen baik fisik maupun kimiawi, serta fusi protoplas antara nilam Jawa yang tahan nematoda dan nilam budi daya yang kadar minyaknya tinggi. Penggunaan asam humat (AH) 200 mg/l tanpa zat pengatur tumbuh dapat meningkatkan pembentukan tunas lima kali lebih banyak daripada kontrol. Untuk regenerasi nilam khimera hasil radiasi sinar gamma 1 krad pada massa sel, pemberian ancimidol 2−6 mg/l sangat efektif memacu pembentukan akar. Perbaikan tanaman melalui metode keragaman somaklonal dikombinasikan dengan radiasi juga telah menghasilkan nomor-nomor baru yang kadar minyaknya lebih tinggi daripada tanaman induknya. Pengujian nomor-nomor tersebut telah dilakukan pada dua lokasi dan musim yang berbeda. Pemberian mutagen colchisin
menghasilkan tanaman dengan warna daun yang lebih hijau, batang dan daun yang lebih besar, kaku dan lebih tegar dibandingkan tanaman kontrol. Dari hasil fusi protoplas telah diperoleh pula genotipe baru yang mempunyai kadar lignin dan fenol yang lebih tinggi dari nilam Jawa. Berbagai hasil penelitian tersebut menunjukkan bahwa keragaman genetik tanaman nilam dapat ditingkatkan melalui kultur in vitro. Adanya keragaman yang ditimbulkan tersebut membuka peluang mendapatkan genotipe nilam baru yang mempunyai sifat seperti yang diharapkan.
Kata kunci: Nilam, Pogostemon cablin, kultur in vitro, keragaman genetik, variasi somaklonal, mutagen, fusi protoplas, regenerasi
ABSTRACT
The application of in vitro culture in improving genetic variability of patchouli
Patchouli (Pogostemon cablin) is an important crop to be developed in Indonesia. However, patchouli has never flowered in Indonesia, so that its genetic variability is naturally low. To improve genetic variability of patchouli, some in vitro methods are developed, including somaclonal variation combined with the application of physical and chemical mutagens, and protoplast fusion of P. heyneanus (Javanese patchouli), which is resistant to nematodes and P. cablin which contains high content of oil. For regeneration, the application of humic acid at a concentration of 200 mg/l increased chimeras resulted from 1 krad gamma irradiation, the application of 2−6 mg/l a cell mass was very effective for root formation. From genetic improvement through somaclonal variation combined with gamma irradiation, two clones of pathcouli have been identified which have higher oil content. The two clones have been tested in two locations at different planting season. Colchicine application produced plants with larger and darker green of leaves, bigger, and more vigorous of stem composed with control. From protoplast culture, some new genotypes are produced. The genotypes contained higher lignin and fenols than Javanese patchouli. From the above studies it was shown that the genetic variability of patchouli, new genotypes with a desired characters may be produced.
Keywords: Patchouli, Pogostemon cablin, in vitro culture, genetic variation, somaclonal variation, mutagen, protoplast fusion, regeneration
N
ilam (Pogostemon cablin) merupakan tanaman penghasil minyak atsiri yang cukup penting. Ekspor minyak nilam Indonesia mencapai 500−800 t/tahun dengan nilai devisa US $ 9−14 juta. Pada tahun 1997, ekspor meningkat menjadi sekitar 765 ton dengan nilai US $ 33juta (Biro Pusat Statistik 1997). Dengan volume ekspor tersebut, Indonesia me-rupakan pemasok minyak nilam terbesar di pasaran dunia dengan kontribusi sekitar 80%.
Di Indonesia, tanaman nilam banyak diusahakan di Sumatera terutama Aceh,
untuk setiap penanaman baru (1−2 tahun), petani akan membuka hutan baru.
Untuk melestarikan lingkungan hutan serta mempertahankan posisi Indonesia sebagai pemasok minyak nilam terbesar di pasaran dunia, maka usaha tani nilam perlu dilakukan secara menetap. Untuk mendukung usaha tersebut diperlukan paket teknologi, antara lain varietas unggul yang disertai dengan teknik budi daya dan pengolahan hasil yang efisien. Upaya tersebut diharapkan dapat pula meningkatkan pendapatan petani nilam.
Masalah yang dihadapi dalam perbaikan varietas atau populasi nilam adalah variabilitas genetik yang di-perkirakan rendah. Di Indonesia terdapat tiga spesies nilam, yaitu Pogostemon cablin Benth, P. hortensis Backer, dan P. heyneanus Benth. Dari ketiga spesies tersebut, yang banyak diusahakan adalah P. cablin yang dikenal dengan nama nilam Aceh. Dua spesies lainnya tidak di-usahakan secara komersial karena rendemen dan mutu minyaknya rendah sehingga tidak memenuhi standar mutu perdagangan.
Di Indonesia, P. cablin tidak dapat berbunga, sehingga bentukan-bentukan genotipe baru hasil persilangan alami tidak dapat terjadi. Akibatnya, keragaman genetiknya relatif sempit, terutama untuk kandungan minyak. Menurut Rusli et al. (l997), kadar minyak berkisar antara 0,30− 0,40% dari terna segar atau 1−2% dari terna kering. Hasil pengujian beberapa nomor nilam Aceh menunjukkan bahwa berdasarkan terna kering suling, kadar minyak mencapai 1,55−2,20% di Bogor, 1,43−1,61% di Citayam (Depok), serta 1,76−1,83% di Manoko, Lembang (Wikardi et al. 1990; Komisi Penelitian Bidang Per-kebunan 1995).
Dengan berkembangnya metode kultur jaringan, variabilitas genetik nilam dapat ditingkatkan melalui keragaman somaklonal, antara lain kultur kalus dan iradiasi. Keragaman somaklonal, di samping dengan kombinasi perlakuan fisik, juga dapat dilakukan dengan perlakuan kimiawi antara lain dengan colchicin. Melalui cara ini, keragaman dapat diperluas karena variasi genotipe dapat terjadi pada tingkat sel, walaupun sifat yang timbul dari variasi-variasi tersebut tidak dapat diperhitungkan secara tepat. Beberapa tanaman hasil seleksi somaklonal yang telah dilepas adalah tebu tahan penyakit dengan kadar
sukrosa yang lebih tinggi serta jagung, tembakau, anggrek, bawang, nenas, dan kentang dengan kualitas dan kuantitas hasil yang lebih baik.
Perbaikan tanaman melalui kultur in vitro dapat pula dilakukan melalui fusi protoplas. Teknologi tersebut sangat potensial diterapkan pada tanaman nilam Aceh yang produktivitasnya tinggi tetapi tidak berbunga. Untuk meningkat-kan ketahanan terhadap nematoda Meloidogyne spp. dan Pratylenchus brachyurus yang sering menjadi masalah pada tanaman nilam (Mustika et al. l991; Mustika dan Nuryani l993), dapat dilakukan fusi protoplas antara nilam Jawa (P. heyneanus) yang tahan nema-toda dan nilam Aceh. Melalui fusi protoplas diharapkan sifat ketahanan nilam Jawa dapat dipindahkan ke nilam Aceh yang kadar minyaknya tinggi.
Berbagai metode perbaikan tanam-an ytanam-ang dilakuktanam-an aktanam-an berhasil bila sistem regenerasi kalus dapat dikuasai. Untuk itu, sebagai langkah awal, peneliti-an optimasi sistem regenerasi perlu dilakukan.
REGENERASI TANAMAN
Perbanyakan vegetatif nilam secara in vitro telah dicoba dengan menggunakan asam humat (AH). Menurut Chen dan Aviad (l990), AH dapat berpengaruh seperti zat pengatur tumbuh tanaman. Bahan ini mengandung sumber N organik dari berbagai kelompok asam amino, antara lain asam aspartat, asam glutamat, alanin, arginin, dan histidin (Orlov l985). Seperti halnya sitokinin maka AH dapat pula meningkatkan sintesis mRNA (Vaughan dan Malcolb l978) serta menghambat oksidasi IAA.
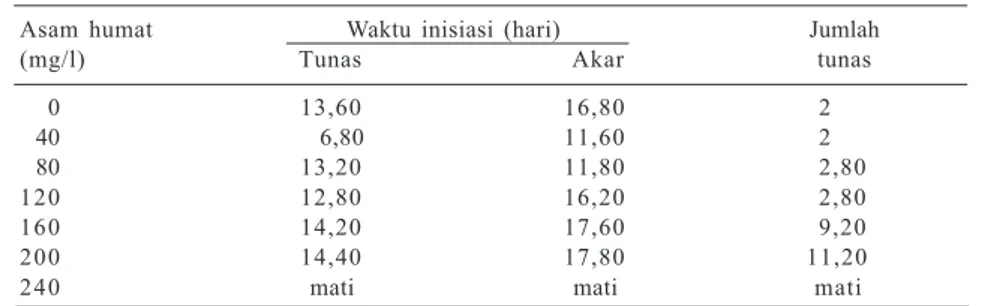
Sebagai eksplan dapat digunakan batang dengan nodus tunggal yang mempunyai dua daun dan berasal dari biakan in vitro. Tanpa adanya zat pe-ngatur tumbuh dalam media, penggunaan AH 40 mg/l dapat mempercepat waktu inisiasi tunas sekitar 7 hari dibandingkan kontrol (Tabel 1). Demikian pula dengan waktu inisiasi akar. Kondisi ini me-nunjukkan bahwa asam amino dalam AH antara lain dapat berperan dalam pembentukan triptofan yang merupakan prasat dari IAA. Dengan tersedianya N dan IAA maka proses diferensiasi ke arah pembentukan tunas dan akar dapat dipercepat.
Dari hasil perlakuan keragaman somaklonal dikombinasikan dengan radiasi pada nilam telah diperoleh ta-naman khimera, yaitu tata-naman yang daunnya mempunyai bercak-bercak putih. Tanaman ini perlu diteliti karena di samping penampakannya menarik, kadar minyaknya juga lebih tinggi dari tanaman induknya. Tanaman tersebut berasal dari radiasi sinar gamma 1 krad pada kalus yang telah mengalami periode kultur in vitro yang lama. Variasi pada daun dan warna petal bunga disebabkan adanya perbedaan pigmen yang diproduksi oleh sel epidermis (George dan Sherington 1984).
Dari penelitian awal diketahui bahwa dengan menggunakan beberapa jenis auksin, perakaran tunas khimera sangat sulit berkembang sehingga dicoba menggunakan media dasar MS dan MS yang garam makronya dicairkan sampai setengah dari formulasi dasar. Selanjut-nya, ke dalam media tersebut diberikan zat penghambat ancimidol. Hasil peneliti-an menunjukkpeneliti-an adpeneliti-anya pembentukpeneliti-an akar dengan penambahan ancimidol ke dalam media MS ½, baik jumlah akar
Tabel 1. Pengaruh asam humat terhadap pertumbuhan biakan pada nilam.
Asam humat Waktu inisiasi (hari) Jumlah (mg/l) Tunas Akar tunas 0 13,60 16,80 2 40 6,80 11,60 2 80 13,20 11,80 2,80 120 12,80 16,20 2,80 160 14,20 17,60 9,20 200 14,40 17,80 11,20 240 mati mati mati Sumber: Mariska dan Husni (1994).
maupun panjang akarnya lebih rendah dibandingkan media MS. Pemberian ancimidol 2−6 mg/l meningkatkan jumlah akar 2−3 kali lebih banyak daripada tanpa ancimidol. Jumlah akar paling banyak diperoleh dengan pemberian ancimidol 4,88 mg/l dan akar paling panjang didapat dengan ancimidol 7,51 mg/l. Ancimidol merupakan retardan yang menghambat sintesis giberelin sehingga meningkatkan pembentukan akar (Hutami et al. l998).
PENINGKATAN
KERAGAMAN GENETIK
Beberapa metode in vitro telah di-manfaatkan untuk meningkatkan ke-ragaman genetik tanaman nilam, antara lain melalui 1) keragaman somaklonal kombinasi dengan radiasi; 2) keragaman somaklonal dengan perlakuan colchicin; dan 3) fusi protoplas.
Keragaman Somaklonal dan
Radiasi
Massa sel yang berasal dari suspensi sel yang telah mengalami periode kultur in vitro 1, 6, 17, 18, dan 24 bulan diradiasi masing-masing dengan dosis 0, 1, 2, dan 3 krad. Selanjutnya, tanaman hasil kultur in vitro yang telah diberi dua faktor perlakuan tersebut ditanam dalam dua tahap yang berbeda. Hasil pengamatan secara visual menunjukkan bahwa keragaman telah mulai muncul sejak tahap in vitro, yang dicirikan oleh penampakan yang berbeda-beda antarnomor maupun dengan kontrol. Keragaman dicirikan oleh morfologi daun, mulai dari warna, bentuk, dan ukuran. Setelah ditanam di lapang, variasi morfologi tetap terlihat dan secara kuantitatif, komponen pertumbuhan juga menunjukkan adanya keragaman (Tabel 2). Pengujian hasil panen dari kedua tahap penanaman menunjukkan bahwa keragaman pada kelompok yang tidak diradiasi hanya dijumpai pada panen kedua untuk sifat panjang daun, lebar daun, dan panjang tunas. Keragaman yang muncul dari perlakuan radiasi hanya dijumpai pada sifat kadar minyak pada panen pertama. Untuk sifat panjang dan lebar daun, kedua panenan menunjukkan pula adanya keragaman pada perlakuan radiasi. Untuk diameter batang dan patchouli alkohol, perlakuan radiasi tidak menimbulkan keragaman. Analisis
ga-bungan bagi nomor-nomor tertentu untuk kedua panenan menunjukkan bahwa pengaruh interaksi hanya dijumpai pada sifat kadar minyak. Ini berarti bahwa kadar minyak untuk nomor-nomor tertentu ditentukan oleh cuaca saat panen. Pada perlakuan yang tidak diradiasi tidak dijumpai adanya keragaman sesuai yang diharapkan (Tabel 3 ).
Berdasarkan Tabel 3, perlakuan radiasi mengakibatkan nilai rataan
men-jadi lebih kecil atau bahkan tidak berpengaruh. Namun, adanya keragaman di antara nomor-nomor hasil radiasi menunjukkan potensi adanya nomor-nomor yang diharapkan memiliki sifat-sifat yang lebih baik (Syamsudin et al. 1997).
Dari sekitar 411 somaklon yang berhasil ditanam di lapang, setelah dianalisis kadar minyaknya, diperoleh 5 somaklon baru yang kadar minyaknya
Tabel 2. Keragaman sifat tanaman nilam pada kelompok yang diradiasi dan tidak diradiasi.
Percobaan Sifat Tidak diradiasi Diradiasi Lingkungan Panen I Kadar minyak (%) 0 0,36 0,10
Patchouli alkohol (%) 0 0 71,28 Panjang daun (cm) 0 1,42 0,29 Lebar daun (cm) 0 1,48 0,32 Tebal daun (cm) 0 0 0,003 Panjang tunas (cm) − − −
Bobot basah terna (g/pohon) 0 273,17 7,25 Diameter batang (cm) − − −
Panen II Kadar minyak (%) 0 0 0,56 Patchouli alkohol (%) 0 0 13,20 Panjang daun (cm) 0,38 1,04 0,41 Lebar daun (cm) 0,49 1,35 1,76 Tebal daun (cm) 0 0,03 0,01 Panjang tunas (cm) 108,79 120,11 52,49 Bobot basah terna (g/pohon) 0 0 49,35 Diameter batang (cm) 0 0 0
−−−−−= tidak diamati.
Sumber: Mariska et al. (1996).
Tabel 3. Nilai tengah kelompok tanaman nilam asal kalus yang tidak diradiasi dan diradiasi.
Peubah Panen Tidak Diradiasi Pengujian diradiasi
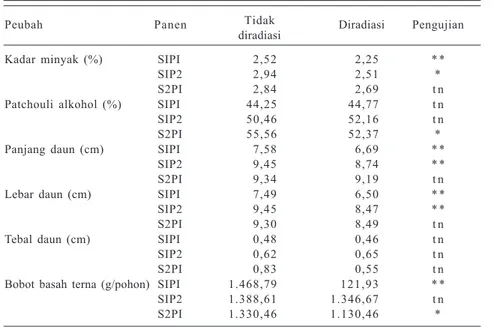
Kadar minyak (%) SIPI 2,52 2,25 * * SIP2 2,94 2,51 * S2PI 2,84 2,69 t n Patchouli alkohol (%) SIPI 44,25 44,77 t n SIP2 50,46 52,16 t n S2PI 55,56 52,37 * Panjang daun (cm) SIPI 7,58 6,69 * *
SIP2 9,45 8,74 * * S2PI 9,34 9,19 t n Lebar daun (cm) SIPI 7,49 6,50 * * SIP2 9,45 8,47 * * S2PI 9,30 8,49 t n Tebal daun (cm) SIPI 0,48 0,46 t n SIP2 0,62 0,65 t n S2PI 0,83 0,55 t n Bobot basah terna (g/pohon) SIPI 1.468,79 121,93 * * SIP2 1.388,61 1.346,67 t n S2PI 1.330,46 1.130,46 * * = berbeda nyata pada taraf 5%; ** = berbeda nyata pada taraf 1%; tn = tidak berbeda nyata. Sumber: Syamsudin et al. (l997).
lebih tinggi dibandingkan tanaman induknya yaitu nilam Aceh (Mariska et al. 1997) (Gambar 1).
Keragaman Somaklonal dengan
Pemberian
Colchisin
Massa sel yang berasal dari potongan jaringan daun digandakan kromosomnya dengan pemberian colchisin (0,50 dan 1%) dengan waktu yang berbeda, yaitu
Tabel 4. Persentase regenerasi kalus nilam membentuk tunas adventif pada umur 7 minggu.
Perlakuan Persentase regenerasi
Kontrol Kinetin 2 mg/l BA 0,10 mg/l Colchisin 0,50% 1 hari 6 0 8 0 100 3 hari 6 0 8 0 100 5 hari 2 0 4 0 6 0 7 hari 0 0 2 0 Colchisin 1% 1 hari 8 0 100 100 3 hari 2 0 6 0 100 5 hari 2 0 2 0 8 0 7 hari 2 0 2 0 4 0 Sumber: Mariska et al. (1995).
1, 3, 5, dan 7 hari. Hasil penelitian menunjukkan bahwa persentase re-generasi paling tinggi diperoleh dengan BA 0,10 mg/1 (Tabel 4). Semakin lama pemberian colchicin, semakin rendah massa sel yang dapat beregenerasi. Kondisi ini menunjukkan bahwa col-chisin merupakan senyawa yang bersifat karsiogenik yang dapat menghambat proses sitokinesis.
Terdapat pengaruh interaksi antara perlakuan colchisin dan zat pengatur
tumbuh terhadap jumlah tunas (Tabel 5). Perlakuan colchisin dengan kontrol memberikan jumlah tunas yang paling banyak. Tunas paling sedikit berasal dari colchisin 0,50% dan BA 0,10 mg/l. Respons yang berbeda tersebut dapat disebabkan adanya gangguan dari perimbangan zat pengatur tumbuh dalam jaringan tanaman atau dapat pula karena perbedaan tingkat ploidi yang dicobakan karena colchicin. Dari penampakan visual setelah tanaman ditumbuhkan di rumah kaca, terlihat bahwa tanaman yang berasal dari perlakuan colchisin mem-punyai warna daun yang lebih hijau, batang dan daun yang lebih lebar, lebih kaku dan lebih tegar dibanding tanaman yang tidak diberi colchisin (kontrol).
Tabel 5. Pengaruh interaksi
col-chisin dan zat pengatur
tumbuh terhadap pertum-buhan tunas nilam pada minggu ke-8. Perlakuan Jumlah (mg/l) tunas Colchisin 0,50 Kontrol 3,77 Kinetin 2 3,27 BA 0,10 0,89 Colchisin 1 Kontrol 1,89 Kinetin 2 2,30 BA 0,10 1,32 Sumber: Mariska et al. (1995).
Fusi Protoplas
Untuk memindahkan sifat ketahanan terhadap nematoda maka dilakukan fusi protoplas antara nilam Jawa (Girilaya) dan nilam Aceh yang kadar minyaknya tinggi. Isolasi protoplas dilakukan dengan enzim selulosa dan macerozim 0,50% selama 16 jam. Penggunaan selulosa 0,50% dan kombinasi macerozim 0,50% menghasilkan densitas protoplas yang tinggi. Pe-ningkatan konsentrasi selulosa umum-nya menurunkan densitas protoplas. Densitas protoplas paling tinggi terdapat pada Girilaya dengan selulosa 2% (Tabel 6).
Fusi protoplas antara dua tetua nilam dengan menggunakan PEG 30% memberikan keberhasilan 5,60% untuk binner fusi/bidang pandang dan 10% untuk multifusi. Untuk PEG 50%,
ke-berhasilan pada binner fusi lebih tinggi yaitu 16,70% dan 17,60% untuk multifusi (Nuryani et al. 1999). Protoplas hasil fusi kemudian dicuci 2−3 kali dan selanjutnya dikulturkan dalam media KM8P dan VKM yang diberi 2,4-D sebanyak 0,30 mg/l + NAA 1 mg/l.
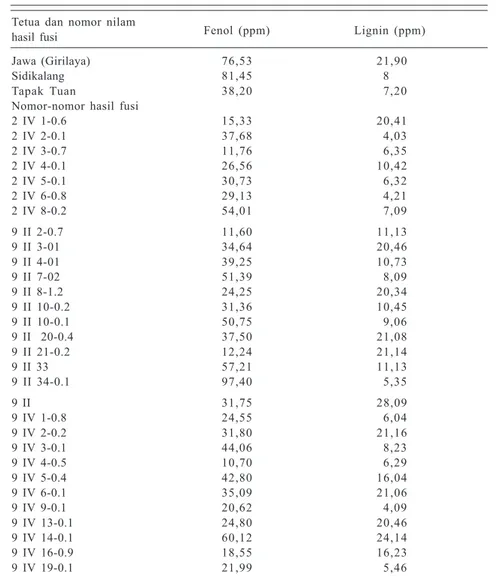
Menurut Dalmaso et al. (l992), mekanisme ketahanan terhadap nematoda dapat terjadi secara fisik dan kimiawi. Berbagai hasil penelitian menunjukkan bahwa tanaman yang tahan nematoda mempunyai kandungan fenol yang lebih tinggi dibandingkan tanaman rentan. Untuk itu, pada nomor-nomor baru hasil fusi perlu dilakukan analisis kandungan fenol dan lignin kemudian dibandingkan dengan nilam Jawa yang tahan dan nilam Aceh yang rentan. Kandungan fenol yang tinggi diperoleh dari nomor 9 II 34-0.1 sebesar 97,40 ppm, lebih besar dari tetuanya nilam Jawa. Untuk lignin, terdapat 10 nomor hasil fusi yang kandungannya hampir sama dengan nilam Jawa yaitu 20,06−24,11 ppm (Tabel 7). Hasil tersebut menunjukkan bahwa fusi protoplas dapat digunakan untuk me-ningkatkan keragaman genetik pada tanaman nilam. Berdasarkan keragaman yang ditimbulkan tersebut kemudian dapat diuji ketahanannya terhadap nematoda.
KESIMPULAN
Kultur in vitro merupakan teknologi potensial untuk meningkatkan keragaman genetik tanaman nilam. Dengan adanya keragaman tersebut maka peluang untuk mendapatkan genotipe baru yang ung-gul menjadi terbuka.
Pemberian asam humat tanpa zat pengatur tumbuh dapat memacu daya regenerasi tunas. Dari penelitian
ke-Tabel 6. Pengaruh jenis dan konsentrasi radiasi enzim pektinase 0,50% serta konsentrasi sukrosa terhadap densitas protoplas pada nilam.
Jenis nilam Densitas protoplas
Sukrosa 0,50% Sukrosa 1% Sukrosa 2% Girilaya 3 x 106 1,20 x 106 2,10 x 105
TT 75 4,40 x 105 1,90 x 105 1,40 x 105
Sumber: Nuryani et al. (1999).
ragaman somaklonal dikombinasikan dengan perlakuan fisik (radiasi) dan kimiawi (colchisin) telah diperoleh lima nomor harapan nilam dengan kadar minyak lebih tinggi dari tanaman induk-nya. Nomor-nomor tersebut telah diuji pada dua lokasi dan dua musim tanam yang berbeda.
Fusi protoplas dapat digunakan untuk mengatasi hambatan perbaikan tanaman secara konvensional, mengingat tanaman nilam Aceh tidak berbunga. Melalui teknologi tersebut telah diperoleh 11 nomor baru nilam dengan kandungan fenol atau lignin yang lebih tinggi daripada nilam Jawa.
Tabel 7. Kandungan fenol dan lignin pada akar dari tiga tetua dan 30 nomor nilam hasil fusi protoplas.
Tetua dan nomor nilam
Fenol (ppm) Lignin (ppm) hasil fusi
Jawa (Girilaya) 76,53 21,90 Sidikalang 81,45 8 Tapak Tuan 38,20 7,20 Nomor-nomor hasil fusi
2 IV 1-0.6 15,33 20,41 2 IV 2-0.1 37,68 4,03 2 IV 3-0.7 11,76 6,35 2 IV 4-0.1 26,56 10,42 2 IV 5-0.1 30,73 6,32 2 IV 6-0.8 29,13 4,21 2 IV 8-0.2 54,01 7,09 9 II 2-0.7 11,60 11,13 9 II 3-01 34,64 20,46 9 II 4-01 39,25 10,73 9 II 7-02 51,39 8,09 9 II 8-1.2 24,25 20,34 9 II 10-0.2 31,36 10,45 9 II 10-0.1 50,75 9,06 9 II 20-0.4 37,50 21,08 9 II 21-0.2 12,24 21,14 9 II 33 57,21 11,13 9 II 34-0.1 97,40 5,35 9 II 31,75 28,09 9 IV 1-0.8 24,55 6,04 9 IV 2-0.2 31,80 21,16 9 IV 3-0.1 44,06 8,23 9 IV 4-0.5 10,70 6,29 9 IV 5-0.4 42,80 16,04 9 IV 6-0.1 35,09 21,06 9 IV 9-0.1 20,62 4,09 9 IV 13-0.1 24,80 20,46 9 IV 14-0.1 60,12 24,14 9 IV 16-0.9 18,55 16,23 9 IV 19-0.1 21,99 5,46 Sumber: Nuryani et al. (1999).
DAFTAR PUSTAKA
Biro Pusat Statistik. 1997. Statistik Perdagangan Luar Negeri Indonesia. Jilid III Ekspor. Biro Pusat Statistik, Jakarta. hlm. 978. Chen, Y. and T. Aviad. 1990. Effects of humic
substances on plant growth. In P. Mac Corthy (Ed.). Humic Substances in Soil. Crop Sci. p. 161−166.
Dalmaso, A., P. Castaganom–Sereno, and P. Abad. 1992. Tolerance and resistance of plants to nematodes, knowledge needs and prospects. Seminar Nematologica 38: 466−
472.
George, E.F. and P.D. Sherington. 1984. Plant Propagation by Tissue Culture. Handbook and Directory of Commercial Laboratories. Eastern Press, Reading, England. 709 p. Hutami, S., N. Sunarlim, Y. Supriyati, dan I.
Mariska. l998. Perbanyakan in vitro
tanaman nilam khimera melalui proliferasi tunas aksilar. Jurnal Bioteknologi Pertanian 3(2): 47−52.
Komisi Penelitian Bidang Perkebunan. l995. Evaluasi Hasil dan Pemantapan Program Penelitian Tanaman Rempah dan Obat. Ko-misi Penelitian Bidang Perkebunan, Pusat Penelitian Tanaman Industri, Bogor. 37 hlm.
Mariska, I. dan A. Husni. 1994. Peranan humic acids pada pertumbuhan nilam secara in vitro.
Media Komunikasi Penelitian dan Pe-ngembangan Tanaman Industri 14: 67−71. Mariska, I., D. Seswita, dan R. Purnamaningsih.
1995. Peningkatan keragaman genetik tanaman nilam dengan colchicin. Prosiding Simposium Nasional I Tumbuhan Obat dan Aromatik. LIPI, Bogor, 10−12 Oktober 1995.
Mariska, I., Hobir, E. Gati, dan D. Seswita. 1996. Peningkatan keragaman genetik melalui radiasi pada kalus in vitro. Risalah Pertemuan Ilmiah Aplikasi Isotop dan Radiasi. BATAN, PAIR, Jakarta, 9−10 Januari 1996. Mariska, I., Hobir, Mugiono, D. Seswita, and E.
Gati. 1997. Increasing of patchouli ( Pogos-temon cablin) oil content through in vitro
culture and introduction in Indonesia. Proceeding of Seminar on Mutation Breeding in Oil and Industrial Crops for Regional Nuclear Cooperation in Asia RDA and Japan Atomic Industrial Forum, Suwon, Korea, 12−18 October 1997.
Mustika, I., Y. Nuryani, dan O. Rostiana. 1991. Nematoda parasit pada beberapa kultivar nilam di Jawa Barat. Buletin Penelitian Tanaman Rempah dan Obat VI(1): 9−14. Mustika, I. and Y. Nuryani. 1993. Screening for
resistance of four patchouli cultivar to
Radopholus similis. Journal of Spice and Medicinal Crops 1(2): 11−18.
Nuryani, Y., I. Mariska, A. Husni, dan C. Syukur. 1999. Fusi protoplas nilam Jawa dan nilam Aceh. Prosiding Ekspose Hasil Penelitian Bioteknologi Pertanian. Badan Litbang Pertanian Jakarta, 31 Agustus – 1 September 1999.
Orlov, D.S. 1985. Humic Acids of Soils. USDA-NFSA Amerin. Pub. Co., New York-New Delhi.
Rusli, S., Nurdjanah, N. Kemala, S. Hasnam, A. Hamid, A. Asman, A. Sufiani, S. Emyzar, dan Hobir. 1997. Efisiensi usaha tani, tata niaga dan peningkatan mutu minyak atsiri (nilam dan akar wangi). Laporan Hasil Penelitian ARMP 1991/92. Balai Penelitian Tanaman Rempah dan Obat, Bogor. Syamsudin, E., I. Mariska, dan Hobir. 1997.
Keragaman somaklonal dan heritabilitas beberapa sifat tanaman nilam. Jurnal Penelitian Tanaman Industri 3(1): 25−30. Vaughan, O. and R.E. Malcolb. 1978. Effect of
soil organic matter on peroxidase activity of wheat roots. Soil Biol. Biochem. 11: 57−
63.
Wikardi, E.A., A. Asman, dan P. Wahid. 1990. Pengembangan penelitian tanaman nilam. Edisi Penelitian Tanaman Rempah dan Obat 6: 1−21.