i
INDUKSI KERAGAMAN GENETIK
DENGAN MUTAGEN SINAR GAMMA PADA NENAS
SECARA
IN VITRO
ERNI SUMINAR
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
ABSTRACT
ERNI SUMINAR. Genetic Variability Induced with Gamma Rays Mutagen on Pineapple In Vitro. Under direction of AGUS PURWITO and SOBIR.
Improvement of the genetic variability of pineapple plant can be done by mutation induction with gamma rays. The aim of the research was to increase
genetic variability on pineapple through gamma irradiation of calli that have been frequently subculture. Medium for calli induction was MS + 1 mg L-1
benzylaminopurine (BAP) + 0.05 mg L-1 2,4-dichlorophenoxyacetic acid (2,4-D),
while the medium for shoot regeneration was MS + 1.5 mg L-1 kinetin + 0.5 mg L-1 NAA. Calli were then irradiated with 0, 15, 25 and 35 Gy gamma
irradiation. Completely randomized design with 40 replication were used in this experiment. The result showed that irradiation gamma rays were affected on growth and regeneration on calli. Generally, the 15 Gy induced variance of shoot growth, phenotypic and genetic variability. Gamma irradiation changed the banding pattern of DNAs as they were amplified with five primers of ISSR molecular marker to analysis genetic variability among regenerant. Serial selection based on erect leaves structures and narrow canopy diameter character resulted to seven regenerants mutant with erect leaves structure and narrow canopy diameter without reducing plant height and leaves number compared to those of control regenerants population.
iii
RINGKASAN
ERNI SUMINAR. Induksi Keragaman Genetik dengan Mutagen Sinar Gamma pada Nenas Secara In Vitro. Dibimbing oleh AGUS PURWITO dan SOBIR.
Nenas (Ananas comosus (L.) Merr) merupakan tanaman buah yang potensial untuk dikembangkan karena telah banyak digunakan baik sebagai makanan segar, bahan industri makanan, kosmetik, obat-obatan dan industri tekstil. Produktivitas nenas di Indonesia masih rendah dan rasio bobot buah dengan tanaman hanya berkisar 0.43-0.46, sedangkan di negara maju telah mencapai rasio 0.6.
Pusat Kajian Buah Tropika IPB telah memiliki klon harapan nenas yang memiliki kualitas buah unggul, namun produktivitasnya masih rendah. Salah satu kendala dalam meningkatkan produktivitas di lapangan secara agronomi adalah diameter tajuk yang lebar mecapai 1 m, daun yang panjang mencapai 1 m atau lebih, serta kedudukan daun terkulai sehingga memerlukan jarak tanam yang lebar.
Upaya untuk mengatasi hal ini salah satunya adalah melalui perakitan varietas nenas unggul yang memiliki kualitas buah baik, struktur tanaman yang tegak, dan diameter tajuk sempit sehingga jarak tanam di lapangan dapat dirapatkan sehingga produktivitas dapat ditingkatkan. Karakter tanaman nenas yang memiliki kedudukan daun tegak dan diameter tajuk sempit belum tersedia di alam dan perlu dilakukan peningkatan keragaman terutama untuk karakter-karakter tersebut, sedangkan sifat lainnya seperti kualitas buah dipertahankan.
Pemuliaan mutasi dengan menggunakan mutagen fisik seperti sinar gamma merupakan salah satu alternatif untuk meningkatkan keragaman yang dapat mengubah satu atau beberapa karakter tanpa mengubah karakteristik asalnya. Tujuan akhir diharapkan akan dihasilkan varietas unggul nenas yang memiliki karakter kedudukan daun tegak dengan kualitas buah yang baik.
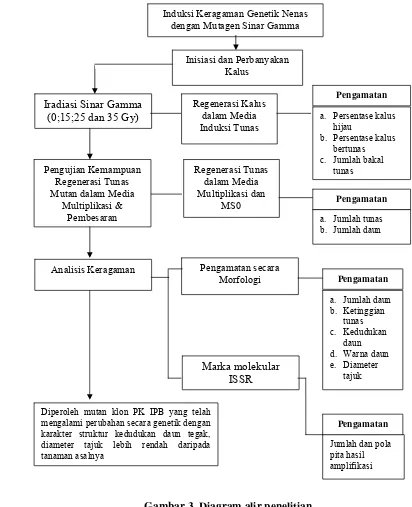
Penelitian ini merupakan bagian dari pemuliaan yang diperlukan dalam perakitan varietas nenas unggul. Percobaan telah dilakukan dengan melalui beberapa tahap, mulai dari pembentukan kalus, iradiasi sinar gamma pada kalus, regenerasi kalus untuk pembentukan tunas, serta analisis keragaman genetik berdasarkan marka morfologi, penanda molekular, dan gabungan antara morfologi dan molekular sehingga diperoleh informasi bahwa pemberian mutagen sinar gamma dapat menyebabkan perubahan baik morfologi maupun pada tingkat DNA.
Kegiatan penelitian terdiri dari empat kegiatan yaitu persiapan dan
perbanyakan bahan tanam dan inisiasi kalus telah dilaksanakan selama 6 bulan di Laboratorium Kultur Jaringan PKBT IPB, selanjutnya dilakukan
induksi mutasi dengan mutagen sinar gamma dengan dosis 0 Gy, 15 Gy, 25 Gy, dan 35 Gy pada kultur kalus in vitro. Kegiatan ini dilakukan di BATAN Jakarta
dengan. Regenerasi kalus dilakukan dalam media induksi tunas (MS + 1.5 mg L-1 kinetin +0.5 mg L-1 NAA dan dilakukan pembesaran tunas dalam MS0.
b) Persentase kalus yang mampu membentuk tunas (%), c). Jumlah bakal tunas (buah), dan d) jumlah daun.
Kegiatan berikutnya adalah pengujian daya regenerasi tunas mutan pada tahap multiplikasi dan pembesaran secara in vitro. Media multiplikasi yang digunakan yaitu media MS dengan penambahan 1 mg L-1 BAP. Parameter yang diamati terdiri dari : a) jumlah tunas dan b) jumlah daun. Tunas-tunas yang mampu bermultiplikasi, selanjutnya dilakukan subkultur ke dalam media MS0
untuk pembesaran. Parameter yang diamati terdiri dari : a) jumlah tunas, b) jumlah daun, dan c) tinggi tunas.
Untuk pengujian keragaman genetik yang terjadi akibat pemberian mutagen sinar gamma, dilakukan dengan menggunakan penanda morfologi yang dapat dilihat dari perubahan bentuk tanaman secara visual, sedangkan pengujian pada tingkat DNA dilakukan dengan menggunakan penanda molekular ISSR dan dilakukan analisis data dengan program NTSYS ver. 2.02.
Berdasarkan analisis ragam pada tahap pertumbuhan kalus setelah diiradiasi menunjukkan bahwa pemberian mutagen sinar gamma dapat mempengaruhi pertumbuhan dan perkembangan kalus dalam pembentukan tunas baik pada media induksi maupun pada media multiplikasi dan pembesaran tunas selanjutnya. Terjadi perubahan morfologi yang dapat dilihat secara visual, yaitu pada karakter jumlah daun, bentuk daun, bentuk tunas, tinggi tunas, warna daun, kedudukan daun tegak, dan diameter tajuk. Perubahan yang terjadi pada tingkat DNA dapat dilihat dari pola pita DNA yang teramplifikasi dengan menggunakan marka molekular ISSR.
Hasil seleksi pertama dilakukan pada satu karakter yaitu kedudukan daun tegak dan diperoleh genotipe mutan sebanyak 24, namun memiliki nilai rata-rata jumlah daun yang lebih rendah daripada tanaman kontrol (normal). Untuk mendapatkan mutan yang memiliki struktur kedudukan daun tegak, diameter tajuk lebih sempit dengan jumlah daun dan tinggi tunas yang tidak berbeda nyata dengan kontrol maka dilakukan seleksi kedua berdasarkan pada dua karakter sekaligus (kedudukan daun tegak dan diameter tajuk < 0.9 cm) maka diperoleh tujuh regeneran mutan yang memiliki struktur kedudukan daun tegak dan diameter tajuk lebih sempit daripada regeneran kontrol tetapi memiliki karakter tinggi tunas dan jumlah daun yang tidak berbeda nyata dengan regeneran kontrol. Mutan-mutan ini berasal dari populasi dengan pemberian mutagen sinar gamma dosis 15 Gy.
v DAFTAR ISI
Halaman
DAFTAR TABEL ……… xiii
DAFTAR GAMBAR ……… xiv
DAFTAR LAMPIRAN ……… xv
PENDAHULUAN Latar Belakang ……… 1
Kerangka Pemikiran ……… 4
Tujuan Penelitian ………. 5
TINJAUAN PUSTAKA Biologi Tanaman Nenas ……… 6
Pemuliaan TanamanNenas ……… 8
Kultur In Vitro pada Nenas ………... 9
Induksi Mutasi pada Kultur In Vitro……….. 11
Mutagen Sinar Gamma ………. 13
Penanda Morfologi ……… 15
Penanda Molekuler ISSR ……….. 15
BAHAN DAN METODE Bahan tanaman ……….. 17
Metode Penelitian ………. 17
Analisis Data ……… 22
HASIL DAN PEMBAHASAN Kondisi Umum Pertumbuhan Kalus ... 25
Pengaruh Pemberian Mutagen Sinar Gamma terhadap Regenerasi Kalus Nenas In Vitro ………... 26
Kemampuan Regenerasi Tunas Mutan pada Tahap Multiplikasi dan Pembesaran secara in vitro ……… 30
Keragaman Mutan Genetik dengan Menggunakan Penanda Morfologi, Molekular ISSR dan Gabungan ... 37
Seleksi, Analisis Perbandingan Nilai Rata-rata dengan Uji-t dan Analisis Perbandingan Nilai Varians Populasi Kontrol dan Mutan dengan Uji F . 44 SIMPULAN DAN SARAN... 47
DAFTAR PUSTAKA ... 48
DAFTAR TABEL
Halaman
1 Susunan nukleotida, kandungan G/C dari 17 primer berulang
ISSR yang Digunakan untuk Seleksi Primer ………. 22 2 Nilai F-hitung karakter fenotipik dalam media regenerasi pada
8 MST...……… 27
3 Nilai F-hitung karakter fenotipik dalam media pembesaran
(MS0) pada 8 MST…………....……… 29
4 Jumlah tunas dan jumlah daun regeneran hasil iradiasi sinar
gamma dalam media multiplikasi pada 8 MST……….. 31 5 Keragaman 16 regeneran contoh pada nenas in vitro hasil
perlakuan radiasi sinar gamma ….………. 35 6 Jumlah pita hasil amplifikasi lima primer pada analisis ISSR …. 39 7 Nilai koefisien keragaman tertinggi dan terendah pada penanda
morfologi, ISSR dan data gabungan ………. 43 8 Pengamatan karakter kuantitatif regeneran mutan hasil iradiasi
sinar gamma dalam media pembesaran (MS0) pada umur 16 MST sebelum dan setelah seleksi S1 (kedudukan daun tegak) dan S2 (kedudukan daun tegak dan diameter tajuk<0.9 cm)
vii DAFTAR GAMBAR
Halaman
1 Skema kerangka pemikiran penelitian induksi mutasi nenas klon PK secara in vitro ...
4
2 [A] Deskripsi tanaman klon PK di lapangan; [B] Karakteristik buah nenas klon PK; [C] Plantlet in vitro nenas klon PK ………
17
3 Diagram alir penelitian.. ………. 18 4 Tahapan perbanyakan bahan tanam dan inisiasi kalus……… 25 5 Morfologi kalus 8 mingggu setelah iradiasi dalam media induksi
tunas ……….. 26
6 Histogram rata-rata persentase kalus hijau, persentase kalus
membentuk tunas, dan jumlah tunas dalam media regenerasi akibat pemberian mutagen sinaar gamma pada 8 MST ……… 28 7 Histogram rata-rata jumlah tunas dan daun regeneran dalam media
MS0 pada 8 MST…………..……….. 30
8 Keragaman karakter morfologi regeneran mutan putatif in vitro
dalam media pembesaran (MS0) pada 8 MST ……...……… 33 9 Keragaman bentuk daun regeneran hasil induksi mutasi dengan
sinar gamma……...……… 36
10 Dendrogram kemiripan morfologi hasil analisis gerombol dengan metode pengelompokan UPGMA berdasarkan karakter morfologi dari 16 regeneran nenas in vitro ………
37
11 Pola pita 16 regeneran kontrol dan mutan………..…….. 40 12 Pola pita 16 regeneran kontrol dan mutan………..…….. 40 13 Dendrogram kemiripan genotipik hasil analisis gerombol dengan
metode pengelompokan UPGMA berdasarkan pola pita ISSR dari 16 regeneran nenas in vitro ……… 42 14 Dendrogram UPGMA dari hasil analisis data gabungan penanda
morfologi dan penanda molekular ISSR pada 16 regeneran nenas
DAFTAR LAMPIRAN
Halaman
1 Komposisi Media MS (Murashige dan Skoog 1962) ……… 57 2 Deskripsi tanaman nenas klon harapan PK IPB ………. 58 3 Deskripsi buah nenas klon harapan PK IPB ……….. 59 4 Komposisi larutan dan bahan-bahan yang digunakan untuk isolasi
DNA, analisis ISSR, dan elektroforesis ………..….. 60
5 Komposisi peraksi dan buffer untuk analisis DNA tanaman nenas . 62 6 Matriks koefisien kemiripan morfologi (KM) antar 16 regeneran
nenas in vitro ……….. 63
7 Matriks koefisien kemiripan genetik (KG) penanda ISSR antar 16
regeneran nenas in vitro ……… 64 8 Matriks koefisien kemiripan data gabungan penanda morfologi dan
penanda ISSR antar 16 regeneran nenas in vitro ……….. 65 9 Data biner gabungan morfologi dan pita DNA dari 5 primer ISSR
PENDAHULUAN
Latar Belakang
Nenas (Ananas comosus (L) Merr) merupakan salah satu komoditas
hortikultura yang mempunyai manfaat ganda, baik sebagai makanan segar, bahan
industri makanan seperti pizza, rempah, pemanis, penyedap, kue, yoghurt,
minuman, es krim (Medina & Garcia 2005), serat daun mahkota untuk bahan pulp
(Van Tran 2006), limbah dari buah untuk pakan ternak, produksi asam organik
(seperti asam sitrat, asam askorbat, asam malat), serat daun untuk bahan tekstil
dan bromelian untuk industri makanan, kosmetik obat-obatan (Nakasone & Paull
1999). Nenas mengandung enzim proteolitik bromelian yang digunakan untuk
melunakkan daging dan digunakan dalam bidang kedokteran (Hale et al 2005). Produksi nenas di Indonesia pada tahun 2007 sebesar 1 427 781 ton (BPS 2008),
sedangkan Thailand dan Philipina masing-masing mencapai 2 705 000 ton dan
1 833 000 ton (FAOSTAT 2007). Rendahnya produksi nenas di Indonesia antara
lain disebabkan tingkat produktivitas di Indonesia masih rendah yaitu hanya
sebesar 11.56 ton per hektar (FAOSTAT 2007) dan rasio bobot buah dengan
tanaman hanya mencapai 0.43-0.46 (43-46%) (Didin 2009).
Pada tanaman nenas, panjang buah, diameter buah, bobot buah, total
padatan terlarut dan kandungan asam merupakan karakter-karakter yang menjadi
standar perdagangan nenas baik untuk konsumsi segar maupun sebagai buah
olahan (Thakur et al. 1980 diacu dalam Soedibyo 1992). Saat ini Pusat Kajian Buah Tropika telah memiliki salah satu klon harapan yaitu klon nenas PK IPB
yang memiliki sifat-sifat unggul seperti kandungan air pada buah rendah, warna
buah kuning merata, warna buah matang merata, ukuran buah besar, dan mata
datar, namun produktivitasnya masih rendah.
Secara agronomis peningkatkan produksi dapat dilakukan dengan
meningkatkan jumlah populasi dari pertanaman nenas per hektarnya, namun
struktur tanaman dewasa yang memiliki ketinggian rata-rata 100 cm – 200 cm
dan diameter tajuk sekitar 100 cm – 200 cm dengan rata-rata panjang daun
mencapai 1 m atau lebih dengan kedudukan daun terkulai sehingga sangat sulit
melakukan pemuliaan tanaman terutama untuk memperbaiki karakter morfologi
agar diperoleh struktur tanaman nenas yang memiliki kedudukan daun tegak dan
diameter tajuk dengan mempertahankan karakter baik yang sudah ada.
Dalam program pemuliaan tanaman salah satu pedoman yang harus
diperhatikan dalam memperoleh kultivar unggul adalah adanya keragaman
genetik yang luas terutama pada karakter yang dikehendaki. Keragaman genetik
yang luas dari suatu karakter akan memberikan peluang yang baik dalam proses
seleksi, karena akan terjadi pada karakter yang mempunyai keragaman genetik
maupun fenotipik yang luas. Apriyani (2005) menyatakan bahwa penampilan
nenas koleksi PKBT dari 22 aksesi, berdasarkan karakter morfologi dan analisis
RAPD yang diamati tidak dapat menunjukkan adanya keragaman. Keragaman
genetik yang rendah pada nenas merupakan salah satu masalah yang dihadapi
dalam perbaikan klon atau populasi dan sangat sulit untuk pembentukan genotipe
baru.
Keragaman genetik secara konvensional dapat terjadi melalui persilangan
(Leal & Coppens 1996), namun permasalahan yang dihadapi dalam meningkatkan
keragaman genetik nenas melalui persilangan adalah tingginya tingkat
heterosigositas sehingga akan banyak karakter yang harus dievaluasi selama
proses seleksi dan pembentukan kultivar baru menjadi tidak efisien (Cabral et al. 2000), sifat self-incompatibilty yang tinggi (Bartholomew et al. 2003), diperoleh keturunan yang mengalami segregasi sehingga memungkinkan terjadinya
kombinasi-kombinasi berbeda yang menyebabkan perbedaan genotipe keturunan
(Poespodarsono 1988).
Pemuliaan mutasi merupakan salah satu cara untuk meningkatkan
keragaman genetik karakter tertentu pada tanaman menyerbuk silang dengan
mempertahankan suatu sifat yang kompleks seperti halnya kualitas good eating dalam varietas itu yang memerlukan perbaikan hanya pada satu karakter saja yang
diturunkan dan untuk mengembangkan suatu metode dalam mendapatkan
tunas-tunas atau tanaman yang dihasilkan dari hanya satu sel. Pemuliaan mutasi secara
nyata dapat meningkatkan keragaman genetik pada tanaman yang diperbanyak
Teknik kultur in vitro seperti kultur kalus yang dikombinasikan dengan teknik induksi mutasi menggunakan mutagen fisik atau kimia merupakan salah
satu alternatif dalam meningkatkan keragaman somaklonal (Lapade et al. 2002).
Teknik induksi mutasi pada tanaman yang diperbanyak secara vegetatif lebih
efektif karena dapat mengubah satu atau beberapa karakter tanpa mengubah
karakteristik kultivar asalnya (Nagatomi 1996). Keragaman somaklon dapat
ditingkatkan melalui iradiasi sinar gamma dengan munculnya berbagai mutan
baru sebagai sumber keragaman, diantaranya untuk mengembangkan tanaman
yang memiliki idiotipe yang diharapkan dari karakter unggul yang sudah ada
seperti sifat yang dimiliki nenas klon PK IPB dengan memperbaiki bentuk
tanamannya yang memiliki struktur kedudukan daun terkulai dan diameter tajuk
lebar.
Predieri et al. (1997) melaporkan bahwa iradiasi sinar gamma dapat
mengubah karakter morfologi dan agronomi tanaman pear seperti mengurangi
ukuran tanaman, mempercepat panen, perubahan warna, dan kulit buah. Iradiasi
sinar gamma juga dapat menyebabkan perubahan morfologi, fisiologi, dan mutasi
pada manggis (Qosim et al. 2007). Perubahan morfologi regeneran mutan dapat diamati dengan adanya perubahan ukuran regeneran dan bentuk daun. Iradiasi
sinar gamma sering digunakan dalam usaha pemuliaan tanaman karena dapat
meningkatkan keragaman, sehingga dapat menghasilkan mutan baru (Wattimena
1992).
Keragaman genetik dapat dianalisis secara morfologi, biokimia maupun
molekuler. Keragaman morfologi dilakukan dengan menggunakan data hasil
pengamatan atau pengukuran karakter morfologi tertentu (Falconer 1970), namun
analisis keragaman genetik dengan menggunakan penanda morfologi sangat
dipengaruhi oleh faktor lingkungan, memperlihatkan penurunan sifat
dominan-resesif, dan memiliki tingkat keragaman atau polimorfisme yang rendah
(Asiedu et al.1989).
Marka molekuler memberikan alternatif terbaik dalam menganalisis
keragaman genetik tanaman karena mampu memberikan polimorfik pita DNA
dalam jumlah banyak, konsisten, tidak dipengaruhi oleh faktor lingkungan dan
berasosiasi dengan genotipe tertentu (Asiedu et al. 1989), memastikan kualitas tanaman hasil kultur jaringan, produksi tanaman transgenik dan mengenal suatu
keragaman (Soniya et al. 2001), keterpautan dengan karakter yang diinginkan
(McCaskill & Giovanni 2002), serta pewarisannya bersifat stabil (Brar 2002).
Beberapa marka molekuler berdasarkan PCR yang telah banyak digunakan
sebagai penciri genotipe tanaman diantaranya adalah RAPD (Williams et al. 1990), ISSR (Zietkiewicz et al. 1994) dan AFLP (Vos et al. 1995)
Kerangka Pemikiran
Untuk melakukan pemuliaan pada tanaman nenas yang memiliki kedudukan
daun tegak dan diameter tajuk yang sempit, maka diperlukan sumber keragaman
genetik terutama untuk karakter-karakter tersebut. Karakter kedudukan daun tegak
dan diameter tanaman sempit pada nenas PK IPB secara genetik belum tersedia,
sehingga perlu dibentuk populasi dasar yang memiliki keragaman pada
karakter-karakter tersebut dengan mempertahankan karakter-karakter baik yang sudah ada.
Salah satu alternatif untuk meningkatkan keragaman genetik adalah melalui
pemuliaan mutasi dengan pemberian mutagen sinar gamma, sehingga dapat
diperoleh mutan baru yang telah mengalami perubahan morfologi dan genetik
dalam waktu yang relatif singkat, selain itu teknik induksi mutasi pada tanaman
yang diperbanyak secara vegetatif lebih efektif karena dapat mengubah satu atau
beberapa karakter tanpa mengubah karakteristik asalnya.
Nenas PK dengan perubahan pada karakter morfologi termasuk bentuk tunas, daun dan kedudukan daun
Mutan solid dapat diperoleh secara langsung jika bagian yang diiradiasi
berupa kalus dan keragaman genetik yang diperoleh dievaluasi pada tingkat
morfologi dan molekuler dengan penanda ISSR (Inter Simple Sequence Repeat).
Mutan-mutan yang dihasilkan selanjutnya diseleksi untuk mendapatkan mutan
unggul yang secara genetik memiliki karakter morfologi struktur kedudukan daun
tegak dan diameter tajuk yang lebih sempit daripada kultivar asalnya. Skema
kerangka pemikiran penelitian tersaji dalam Gambar 1.
Tujuan Penelitian
1. Meningkatkan keragaman genetik tanaman nenas dengan menggunakan
mutagen sinar gamma untuk mendapatkan karakter tanaman dengan
kedudukan daun yang tegak dan diameter tajuk sempit.
2. Mendapatkan informasi mengenai keragaman genetik hasil radiasi melalui
analisis morfologi dan analisis molekular ISSR.
3. Mendapatkan calon mutan nenas klon PK IPB yang memiliki struktur tanaman
TINJAUAN PUSTAKA
Biologi Tanaman Nenas
Nenas termasuk tanaman herbaceous dari klas monokotil yang bersifat
perenial. Kultivar nenas dikelompokkan dalam 5 kelompok yaitu Cayenne,
Queen, Spanish, Pernambuco (Abacaxi) dan Perolera (Maipure) (Petty et al. 2002). Kultivar yang banyak ditanam di Indonesis adalah Cayenne dan Queen.
Tergantung pada varietasnya tanaman nenas dewasa dapat mencapai ketinggian
100-200 cm, dengan diameter tajuk 100 cm – 200 cm. Struktur utama morfologi
dibedakan menjadi batang, daun, tangkai buah, buah majemuk atau sinkarp,
mahkota, tunas, dan akar (Leal & Coppens 1996). Bagian tanaman nenas yang
dapat digunakan untuk perbanyakan yaitu mahkota, shoots, suckers, dan slips (Bartholomew et al. 2003).
Daun nenas berbentuk pedang dengan panjang 1 m atau lebih, lebar 5-8 cm,
pinggiran berduri atau hampir rata, berujung lancip. Daun menempel secara spiral
pada batang dengan jarak yang rapat sehingga membentuk roset. Daun nenas
mengandung serat 2-3% yang dapat digunakan untuk tekstil (Leal & Coppens
1996). Jumlah daun yang terbentuk dapat mencapai 70-80 helai (Collins 1960).
Permukaan atas daun licin seperti lilin, berwarna hijau terang atau coklat
kemerahan, permukaan bawahnya terdapat garis-garis linier berwarna putih
keperakan, mudah lepas dari epidermis yang berwarna hijau terang. Stomata
tersusun dalam garis putus-putus. Stomata berada di bagian sisi dan bawah
permukaan daun diantara garis-garis linier (Collins 1960).
Batang nenas terdiri dari ruas dan buku. Ruasnya pendek berkisar antara
1-10 cm, ruas yang panjang berada pada bagian tengah batang, yaitu batang yang
pertumbuhannya paling cepat. Buku nenas dapat dilihat melalui daun yang dekat
batang. Menghasilkan tunas ketiak setiap buku. Tunas ketiak ini dapat
menghasilkan tunas dasar buah atau tunas anakan (Wee & Thongtham 1997;
Nakasone & Paull 1998). Batang nenas berbentuk ganda dengan panjang
25-50 cm dan lebar 2-5 cm pada bagian dasar dan 5-8 cm pada bagian atas.
Perakaran nenas dikelompokkan menjadi akar primer, sekunder, dan akar
bibit selanjutnya akar ini hilang dan berganti dengan akar adventif. Pada akar
adventif selanjutnya bercabang menjadi akar sekunder yang dapat berupa rambut
akar, epidermis, exodermis, korteks bagian luar dan dalam, endodermis, perisikel,
floem, xylem, dan sel-sel empulur. Tanaman nenas hanya mempunyai sistem
perakaran serabut yang sebarannya ke arah horizontal dan vertikal mencapai
ukuran radius 50 cm (Collins 1960; Nakasone & Paull 1998).
Nenas mempunyai tangkai buah yang berkembang dari perpanjangan
meristem apikal yang kemudian berdifferensiasi dan membentuk buah. Mahkota
merupakan kelanjutan dari sel-sel meristem pada batang. Pertumbuhannya sejalan
dengan perkembangan buah dan ketika buah matang mahkota menjadi dorman.
Rangkaian bunga dan buah tanaman nenas terdapat pada meristem apikal batang.
Bunganya hermaprodit berjumlah 100-200 masing-masing berkedudukan di
ketiak daun dan letak bunga dalam bentuk spiral. Bunga nenas termasuk
bunga sempurna artinya dalam satu bunga terdapat benangsari dan putik.
Penyerbukannya bersifat self incompatible atau cross pollinated (Bartholomew et al. 2003).
Buah nenas merupakan buah multiple partenokarpi atau sinkarp yang terbentuk dari penebalan poros bunga dan peleburan masing-masing bunga (Wee
& Thongtham 1997). Perkembangan fruitlet telah lengkap bersamaan dengan munculnya mahkota buah, selanjutnya buah dan mahkota terus berkembang
sampai buah matang. Buah matang sekitar 4 bulan sejak munculnya mahkota atau
6-7 bulan dari inisiasi bunga (Nakasone & Paull 1999).
Inisiasi inflorescence secara alami dapat lebih cepat dengan adanya suhu
rendah pada malam hari dan pengurangan jam penyinaran, namun inisiasi dapat
diinduksi secara buatan dengan menggunakan etilen atau ethepon (Kuan et al. 2005). Fase generatif terbagi dalam 5 tahap yaitu (1) awal induksi, yaitu
inflorenscence tersembunyi membentuk roset daun, (2) red hearth yaitu tahap
antara munculnya inflorescence, (3) anthesis, (4) tahap pertumbuhan buah, dan
(5) tahap pematangan buah (Coppens d’Eeckenbrugge et al. 2001). Inflorescence kompak mengandung 100-200 bunga hermaprodit. Antesis terjadi 2-4 minggu,
Bakal biji dan serbuk sari berfungsi normal tetapi tidak kompatibel
menyerbuk sendiri (self incompatible) sehingga tidak menghasilkan biji atau biji yang terbentuk tidak normal (Nakasone & Paull 1999). Self incompatible ini
disebabkan oleh terhambatnya pertumbuhan serbuk sari pada 1/3 bagian atas dari
tangkai putik (Brewbaker dan Gorrez 1967 diacu dalam Nakasone & Paull 1999).
Nenas yang ditanam di dataran rendah ukurannya lebih besar, lebih manis
dan lebih berair (Wee &Thongtham 1997). Rasio gula:asam sangat bervariasi
tergnatung pada kultivar, kondisi pertumbuhan tanaman dan umur panen
(Nakasone & Paull, 1999). Wee & Thongtham (1997) menyatakan rasio
gula:asam = 16:1 adalah ideal untuk proses pengalengan.
Pemuliaan Tanaman Nenas
Pemuliaan nenas pada umumnya diarahkan untuk mendapatkan tanaman
nenas yang mempunyai pertumbuhan cepat, daun pendek tidak berduri, tangkai
buah pendek dan kuat, berdaya hasil tinggi, sistem perakaran baik, bentuk buah
silindris, kemasakan seragam, daging buah berwarna lebih kuning, kandungan
asam oksalat dan bromelian buah rendah, memenuhi standar untuk buah segar dan
olahan serta tahan terhadap hama dan penyakit (Collins 1960), dan memiliki
karakter morfologi dengan struktur kedudukan daun yang tegak.
Perbaikan genotipe tanaman pada dasarnya bergantung pada tersedianya
suatu populasi yang individunya memiliki susunan genetis berbeda dan
keefektifan seleksi terhadap populasi tersebut. Keragaman genetik suatu populasi
dapat diketahui dengan mengevaluasi beberapa sifat pertumbuhan dan hasil.
Keragaman genetik yang luas dari suatu karakter yang akan diperbaiki, akan
memberikan peluang yang baik dalam proses seleksi. Apabila suatu sifat
mempunyai keragaman genetik luas, maka seleksi akan dapat dilaksanakan pada
populasi tersebut, dan apabila nilai keragaman genetik sempit, maka kegiatan
seleksi tidak dapat dilaksanakan karena individu dalam populasi relatif seragam
sehingga perlu dilakukan upaya untuk memperbesar keragaman genetik
(Poespodarsono 1988).
Salah satu cara untuk meningkatkan keragaman genetik secara konvensional
diantaranya fertilitas dalam Ananas comosus termasuk rendah ditunjukkan oleh rendahnya persentase ovule yang menghasilkan biji setelah persilangan yaitu
berkisar 5% - 29% (Leal & Coppens 1996), terjadinya segregasi pada F1 dan
biasanya pada tanaman menyerbuk silang hibridisasi dilakukan untuk
menghasilkan tanaman inbreeding atau menguji potensi sesuatu atau beberapa
tetua (Poespodarsono 1988), keragaman genetik di alam untuk karakter tanaman
kedudukan daun tegak ini belum tersedia.
Tujuan pemuliaan nenas adalah untuk mendapatkan varietas tanaman nenas
yang unggul, baik sebagai buah segar maupun nenas olahan juga karakter
morfologi dengan mengubah struktur daunnya. Untuk buah segar diharapkan
mempunyai karakter antara lain: mahkota buah kecil, warna kulit seragam dan
berwarna cerah, ukuran buah kecil sampai sedang, bentuk buah tidak memanjang,
mata buah datar dan warna daging buah kuning sampai kuning emas. Kriteria lain
seperti tekstur, kadar asam dan gula, aroma dan buah tidak berbiji serta
kandungan askorbat juga penting. Sedangkan untuk tujuan nenas olahan selain
berproduksi tinggi, juga harus memenuhi kriteria yaitu tangkai buah kuat, bentuk
buah silindris, mata buah datar dan dangkal, permukaan buah keras, empulur dan
serat kurang kurang serta mempunyai kandungan asam dan gula tertentu serta
aroma menarik dan buah tidak berbiji (Leal & Coppens 1996).
Salah satu cara untuk meningkatkan produktivitas nenas salah satu caranya
adalah dengan meningkatkan populasi tanaman di lapangan, namun tanaman
nenas yang memiliki diameter tajuk sekitar 100 cm dengan daun berukuran
100 cm atau lebih, sehingga perlu dilakukan kegiatan pemuliaan dengan
mengubah karakter morfologi tanaman tersebut agar diperoleh tanaman dengan
struktur tunas yang memiliki kedudukan daun tegak, sehingga jarak tanam dapat
dirapatkan.
Kultur In Vitro pada Nenas
Sistem regenerasi tanaman yang efisien sangat diperlukan untuk menunjang
program pemuliaan tanaman melalui kultur in vitro seperti rekayasa genetik, variasi somaklonal, dan induksi mutasi (Litz & Gray 1992). Teknik
2001; Barboza et al. 2004; Hamad & Taha 2008). Ada beberapa metode regenerasi yaitu organogenesis langsung (direct organogenesis), organogenesis tidak langsung (indirect organogenesis) dan embriogenesis somatik (somatic
embryogenesis). Pada kultur in vitro kesesuaian media dan pemilihan eksplan merupakan hal penting untuk menghasilkan plantlet (Hartmann et al. 1997).
Organogenesis langsung adalah proses pembentukan tunas adventif
langsung dari eksplan. Tunas adventif yang dihasilkan berstruktur unipolar dan
jaringan tersebut masih terkait dengan jaringan asalnya. Organogenesis in vitro
bergantung pada fitohormon eksogen, seperti auksin dan sitokinin dan juga
kemampuan jaringan merespon fitohormon selama kultur (Sugiyama 1999). Pada
beberapa species tanaman, tunas adventif diinduksi dengan konsentrasi sitokinin
yang tinggi dibandingkan auksin (Phillips et al. 1995; Sugiyama 1999).
Organogenesis tidak langsung adalah proses pembentukan tunas adventif
melalui pembentukan kalus terlebih dahulu. Tunas adventif atau embriosomatik
dapat dibentuk dari kalus jika konsentrasi zat pengatur tumbuh khususnya auksin
rendah. Kalus dapat diperoleh dari species tanaman, akan tetapi tidak semua kalus
dari species tanaman dapat diregenerasikan menjadi plantlet bergantung dari sifat
totipotensinya (Yeoman 1986).
Pada eksplan yang ditransfer ke dalam media dengan konsentrasi auksin
yang tinggi seperti 2,4-D akan menjadi friable (remah) dan berproliferasi lebih cepat. Pertumbuhan kalus friable yang ditempatkan pada media cair dan digojok akan membentuk suspensi sel (Yeoman 1986). Kalus embriogenik dapat diinduksi
dengan adanya 2,4-D pada basal medium (Phillips et al. 1995).
Beberapa penulis melaporkan prosedur mikropropagasi nenas dan
menggunakan BAP untuk mendapatkan laju differensiasi yang tinggi. BAP
secara nyata dapat mempengaruhi rata-rata jumlah tunas, panjang dan bobot tunas,
namun tidak berpengaruh terhadap panjang dan bobot per eksplan (Hamad &
Taha 2008).
Pada nenas kultivar Queen, induksi kalus nodular berasal dari eksplan mata
tunas yang diambil dari crown yang ditanam pada medium Murashige & Skoog
(MS) yang dilengkapi dengan 1.5 mg L-1 NAA dan 1.0 mg L-1 kinetin atau hanya
regenerasi tanaman dari nodul kalus dilakukan pada media MS dengan
penambahan 1.5 mg L-1 kinetin dan 0.5 mg L-1 NAA (Akbar et al. 2003).
Hasil penelitian Rosmaina (2007) menunjukkan bahwa penggunaan zat
pengatur tumbuh BA pada eksplan pangkal batang plantlet nenas kultivar Smooth
Cayenne dapat menghasilkan laju multiplikasi, keberhasilan pengakaran dan
persen plantlet hidup pada saat aklimatisasi yang tinggi dibandingkan dengan
perlakuan TDZ. Penggunaan 4.44 µM BAP menghasilkan tanaman regeneran
dengan pertumbuhan vegetatif dan kualitas buah lebih baik dan seragam
dibanding tanaman dari tempat asal (Nursandi 2006).
Induksi Mutasi pada Kultur In Vitro
Mutasi adalah perubahan genetik baik gen tunggal, sejumlah gen ataupun
susunan kromosom (Poespodarsono 1988). Secara luas mutasi menghasilkan
segala macam tipe perubahan genetik yang mengakibatkan perubahan fenotipe
yang diturunkan, termasuk keragaman kromosom maupun mutasi gen (Crowder
1990; Hartana 1992). Teknik kultur in vitro sangat potensial dalam menginduksi mutan, keragaman somaklonal yang terjadi melalui kultur kalus dapat digunakan
untuk program pemuliaan. Penggunaan mutagen dalam kultur in vitro memegang
peranan penting dalam meningkatkan keragaman genetik (Samad et al. 1998). Predieri et al. (1997) melaporkan bahwa iradiasi sinar gamma dapat mengubah karakter morfologi dan agronomi tanaman pear seperti mengurangi
ukuran tanaman, mempercepat panen, perubahan warna, dan kulit buah.
Selanjutnya dikatakan, bahwa iradiasi sinar gamma dapat meningkatkan frekuensi
varian tanaman pear sebesar 2.75%. Iradiasi sinar gamma dapat menyebabkan
perubahan morfologi, fisiologi, dan mutasi pada manggis (Qosim et al. 2007). Perubahan morfologi regeneran mutan dapat diamati dengan adanya perubahan
ukuran regeneran dan bentuk daun (Lee et al. 2002). Iradiasi sinar gamma sering
digunakan dalam usaha pemuliaan tanaman karena dapat meningkatkan
keragaman, sehingga dapat menghasilkan mutan baru (Wattimena et al. 1992). Kultur sel somatik yang berasal dari batang, daun, organ bunga atau jaringan
mersitematik dapat digunakan sebagai sumber keragaman genetik (Sleper &
untuk pemuliaan tanaman dan keragaman genetik yang berasal dari kultur in vitro disebut variasi somaklonal (Jain 2000 diacu dalam Sheidai et al. 2008).
Ada tiga cara untuk mendapatkan variasi somaklonal yaitu regenerasi
langsung maupun tidak langsung, kultur sel dan kultur protoplas. Variasi genetik
dapat ditingkatkan dengan pemberian mutagen pada eksplan baik secara fisik
(radiasi) maupun kimia (Wattimena & Mattjik 1992). Pada dasarnya prinsip
pemberian radiasi pada teknik kultur in vitro adalah memberikan dosis radiasi pada bagian tanaman yang ditempatkan di dalam suatu kondisi yang aseptik dan
dalam keadaan pertumbuhan optimal. Bagian tanaman tersebut ditanam dalam
suatu medium yang dilengkapi dengan unsur-unsur hara mikro dan makro yang
esensial bagi tanaman, gula, vitamin, dan zat pengatur tumbuh dengan kondisi
lingkungan yang terkendali.
Penggunaan induksi mutasi dengan kultur jaringan pada tanaman yang
diperbanyak secara vegetatif sangat efektif dalam mengurangi pembentukan
kimera dan mempercepat seleksi karakter yang diharapkan (Maluszynski et al. 1995), selain itu dapat meningkatkan keragaman suatu tanaman dan mutan baru
akan didapatkan dalam waktu yang relatif singkat dan dapat mengubah satu atau
beberapa karakter tanpa mengubah karakteristik asalnya (Nagatomi 1996).
Bahan yang sering digunakan di dalam teknik radiasi secara in vitro adalah berupa tunas, mata tunas atau pucuk, dan kalus yang merupakan sekelompok sel
yang belum mengalami diferensiasi. Penggunaan kalus di dalam teknik kultur
jaringan pada saat sekarang masih ditemui kesulitan dalam meregenerasikan
menjadi tanaman lengkap. Penggunaan kalus tersebut dapat meningkatkan
keragaman somaklonal (Van Harten 1998) dan tanaman yang berasal dari sel-sel
tunggal secara in vitro ini akan diperoleh mutan solid dan dapat menghindari terjadinya kimera (Zhen 1998).
Induksi mutasi dapat meningkatkan keragaman suatu tanaman dan mutan
baru dapat diperoleh dalam waktu yang relatif singkat serta dapat memperbaiki
karakter agronomi penting tanaman buah-buahan seperti ukuran tanaman, waktu
pemasakan, perubahan warna buah dan self compatibilty (Donini 1982) dan telah dilakukan pada apel, pear, pisang dan anggur (Broertjes & Van Harten 1988),
et al. 2004), Garcinia mangostana (Qosim et al. 2006), Citrus sinensis (Ling et al.
2008), serta tanaman lainnya yang diperbanyak secara vegetatif seperti
Allium sativum (Selvaraj et al. 2001), Rosa sinensis (Nomomura et al. 2001), dan
Saccharum officinarum untuk ketahanan terhadap penyakit red rot (Ali et al. 2007), serta toleran kadar garam tinggi (Gandonou et al. 2005; Patade et al. 2008).
Bila dibandingkan dengan metode pemuliaan mutasi in vivo, metode in vitro, waktu yang diperlukan dari mulai eksplan diberi perlakuan mutagen
sampai pelepasan klon mutan relatif lebih cepat. Pada tahun pertama diperoleh
keragaman genetik diantara tanaman mutan, sedangkan tahun kedua sampai
ketujuh uji kestabilan genetik tanaman termutasi dan tahun kedelapan dapat
melepas klon mutan. Keuntungan metode in vitro, isolasi jaringan termutasi akan lebih mudah dilakukan dengan cara multiplikasi (Donini et al. 1990).
Mutagen Sinar Gamma
Mutagen dapat dikelompokkan menjadi mutagen fisik dan kimia.
Mutagen fisik yang sering digunakan adalah sinar ultraviolet dan beberapa tipe
radiasi pengion, seperti sinar X, sinar gamma, partikel alfa, partikel beta, proton
dan neutron (Sleper & Poehlman 2006). Masing-masing mutagen fisik
mempunyai ionisasi yang berbeda. Mutagen fisik yang sering digunakan adalah
sinar gamma yang mempunyai panjang gelombang pendek (10 – 0.01 nm).
Sumber utama sinar gamma adalah isotop Cobalt-60 (60Co) dan Caesium-137
(137Cs).
Penggunaan mutagen fisik sangat dianjurkan karena mudah diaplikasikan,
penetrasi dan reprodusibilitas dan frekuensinya tinggi (Broertjes & van Harten,
1988), sedangkan mutagen kimia penetrasinya sangat rendah dan bersifat toksik
(Sleper & Poehlman 2006). Penggunaan mutagen radiasi untuk menginduksi
mutan sudah banyak dilakukan oleh para pemulia tanaman di seluruh dunia. Salah
satu aplikasinya pada tanaman buah-buahan dilakukan untuk memperoleh
keragaman bentuk serta mendapatkan tanaman baru yang lebih unggul.
Radiasi merupakan penyinaran dengan sinar radioaktif, yang mempunyai
kemampuan menghasilkan radiasi pengion. Radiasi pengion adalah radiasi dengan
energi tinggi yang dapat mengadakan reaksi dengan objek yang dikenal radiasi
(1998) menyatakan bahwa sinar gamma adalah radiasi elektromagnetik dan
mempunyai energi yang cukup tinggi untuk mengionisasi atom-atom dari molekul
yang disinari tersebut, gelombang elektromagnetik ini mempunyai spektrum
berkelanjutan.
Sinar gamma dapat menghasilkan radiasi pengion yang mampu
mengionisasi materi yang dilewatinya. Jika ionisasi terjadi pada atau di dekat
kromosom dapat menyebabkan terputusnya ikatan kimia, dan dapat menyebabkan
perubahan di dalam inti sel, termasuk perubahan struktur dari gen, delesi gen, atau
sekuen-sekuen DNA, chromosomal rearrangement, peningkatan atau penurunan frekuensi kiasmata, patahnya sentromer, kehilangan atau penambahan kromosom,
kerusakan benang spindel dan sebagainya. Adanya kerusakan pada tingkat
molekuler inilah yag menyebabkan munculnya keragaman pada tanamna yang
diirdaiasi namun pada keadaan tertentu kerusakan dapat diperbaiki selama siklus
hidupnya, hal ini disebut sebagai kerusakan fisisologi (Van Harten 1998).
Sinar gamma ditemukan pada tahun 1990 oleh P. Villard, setelah
penemuan partikel α dan ß. Sinar gamma biasanya diperoleh dari radioisotop 137Cs
dan 60Co. Cobalt 60 mempunyai dua macam energi radiasi yaitu 1.33 dan 1.17
MeV, dengan masa paruh 5.3 tahun sedangkan Cesium 137 dalah jenis mono
energi dengan 0.66 MeV dan waktu paruh 33 tahun (Van Harten 1998). Sinar
gamma merupakan gelombang elektromagnetik yang memiliki tipe energi radiasi
tinggi di atas 10 MeV sehingga mempunyai daya penetrasi yang kuat kedalam
jaringan dan mampu mengionisasi molekul yang dilewatinya, Iradiasi sinar
gamma dapat menyebabkan terjadinya perubahan formasi atau struktur kromosom
dan gen.
Dosis iradiasi yang diberikan untuk mendapatkan mutan tergantung pada
jenis tanaman, fase tumbuh, ukuran, kekerasan, dan bahan yang akan dimutasi
(Soerdjono, 2003). Dosis optimum mutagen sinar gamma untuk induksi mutasi
secara in vitro pada nenas belum banyak diketahui. Keberhasilan program pemuliaan mutasi sangat bergantung pada pemilihan mutagen (fisik atau kimia),
metode aplikasi (akut atau kronik), dosis yang optimum, tahap perkembangan
fisiologi materi tanaman (dorman atau pertumbuhan), bagian tanaman atau
dan teknik penanganan materi yang diradiasi dan seleksi pada generasi
selanjutnya (Donini et al. 1990).
Penanda Morfologi
Keragaman genetik dapat dianalisis secara morfologi, kandungan protein
dalam benih, isozim maupun marka molekular (Dongre et al. 2007). Keragaman morfologi dilakukan dengan menggunakan data hasil pengamatan atau
pengukuran karakter morfologi tertentu (Falconer, 1970). Analisis keragaman
genetik menggunakan penanda morfologi sangat dipengaruhi oleh faktor
lingkungan, memperlihatkan penurunan sifat dominan-resesif, dan memiliki
tingkat keragaman atau polimorfisme yang rendah (Asiedu et al.1989).
Terdapat beberapa karakter vegetatif yang dapat dijadikan kriteria seleksi
tidak langsung berhubungan dengan bobot buah, yaitu tinggi tanaman, diameter
tajuk, jumlah daun, dan panjang daun sedangkan karakter tinggi tanaman, jumlah
daun, dan lebar daun berkorelasi positif terhadap bobot buah serta karakter duduk
daun terbuka dan karakter duri pada daun berhubungan dengan karakter tebal
daging buah (Nasution 2008).
Penanda Molekuler ISSR
Variasi somaklonal dapat dievaluasi sedini mungkin. Evaluasi bisa
dilakukan pada plantlet dalam botol, saat aklimatisasi di rumah kaca atau di
lapangan pada fase vegetatif dan generatif. Identifikasi dengan menggunakan
karakter morfologi mudah dilakukan dan biayanya murah, namun sering
dipengaruhi oleh lingkungan dan tahap perkembangan tanaman. Jika pengaruh
lingkungan sangat besar terhadap induksi keragaman maka penilaian keragaman
berdasarkan data karakter morfologi tidak mencerminkan tingkat keragaman
genetik yang sebenarnya (Yee et al. 1999).
Marka molekular telah digunakan untuk karakterisasi plasma nutfah,
penanda genetik, analisis genetik dan pemuliaan molekular. Marker ini juga
digunakan untuk mengidentifikasi kemungkinan terjadinya variasi somaklonal
pada tahap awal perkembangan yang dianggap sangat berguna untuk memastikan
suatu varian (Soniya et al. 2001) dan lebih efisien karena reliable dan polimorfisme (Wu et al. 1993 diacu dalam Dongre et al. 2007).
ISSR (Inter Simple Sequence Repeat) merupakan markar yang banyak
digunakan dan lebih konsisten untuk menganalisis keragaman genetik serta dapat
menunjukkan keterkaitan antara fragmen polimorfik yang teramplifikasi dengan
karakter morfologi atau karakter agronomi lainya (Dongre et al. 2002). ISSR/SSRs dikenal juga dengan istilah microsatelite yaitu berupa pengulangan mono, di, atau trinucleotida yang biasanya terdiri atas 4 - 10 unit pengulangan,
membentang pada utas DNA. Susunan basa yang demikian merupakan
karakteristik dari nuklear genom dan bervariasi antar spesies atau populasi.
Pada ISSR pendeteksian genetik polymorphisme tanpa perlu lebih dahulu
mengetahui susunan basa (sequence) dari genomik tanaman diantara susunan basa yang berulang, asal susunan basa berulang tersebut mewakili secara luas dan
menyebar di seluruh genom. Pada dasarnya ISSR dapat menginisiasi bagian
tertentu utas DNA pada daerah dekat diantara pengulangan mikrosatelit
menggunakan primer berjangkar pada posisi 5` atau ‘3 di awal/akhir primer
dengan 2 sampai 4 tambahan basa tidak berulang (Zietkiewicz at el. 1994).
Penggunaan marka molekular ISSR telah banyak digunakan untuk
mempelajari keragaman genetik pada Arachis hypogaea (Raina et al. 2001), Gossypium spp. (Dongre et al. 2002), Rhodiola chrysanthemifolia (Crassulaceae)
(Xia et al. 2007), Zinnia elegans (Ye et al. 2008), Pelargonium reniforme (De Wet et al. 2008), Vicia faba L. (Terzopoulos & Bebeli 2008), Dianthus (Fu
et al. 2008), dan Amorphophallus albus (Jianbin et al. 2008).
Marka molekular ISSR dilaporkan dapat mengatasi keterbatasan penanda
molekular yang lain (Reddy et al. 2002 diacu dalam Terzopoulos 2008), dan menguntungkan bila digunakan untuk melihat hubungan kekerabatan antar
kultivar, selain itu ISSR lebih polymorphisme daripada RAPD (Pharmawati et al.
BAHAN DAN METODE
Bahan Tanaman
Bahan tanaman yang digunakan adalah klon nenas harapan PK IPB yang
memiliki karakter kandungan air pada buah rendah, warna buah kuning merata,
warna buah matang merata, ukuran buah besar, dan mata datar (Gambar 2A),
karakter morfologi kedudukan daun terkulai, daun yang panjang (82-102 cm),
serta diameter tajuk yang lebar (85-92 cm) sehingga memerlukan jarak tanam di
lapangan yang luas (Gambar 2B). Dalam penelitian ini digunakan plantlet nenas
in vitro (Gambar 2C) koleksi PKBT IPB dan digunakan sebagai bahan untuk perbanyakan kalus.
[A] [B] [C]
Gambar 2. [A] Deskripsi tanaman klon PK di lapangan; [B] Karakteristik buah nenas klon PK; [C] Plantlet in vitro nenas klon PK
Inisiasi kalus dilakukan dengan menggunakan nodul sebagai bahan
eksplan yang terbentuk pada bagian dasar dari plantlet nenas in vitro setelah tiga kali subkultur, kemudian ditumbuhkan dalam media inisiasi kalus dengan
pemberian 1 mg L-1 BAP + 0.05 mg L-1 2,4-D. Setiap botol diisi sebanyak
4 nodul. Perbanyakan kalus dilakukan selama enam bulan sampai menghasilkan
kalus sebanyak 700 buah kalus.
Metode Penelitian
Penelitian untuk induksi keragaman genetik ini terdiri dari tiga kegiatan
percobaan yaitu : (1) Induksi mutasi dengan mutagen sinar gamma pada kultur
multiplikasi dan pembesaran secara in vitro; (3) Analisis keragaman genetik mutan berdasarkan penanda morfologi dan penanda molekular ISSR. Bagan alir
penelitian dapat dilihat pada Gambar 3.
Analisis Keragaman Pengamatan secara
Morfologi
Diperoleh mutan klon PK IPB yang telah mengalami perubahan secara genetik dengan karakter struktur kedudukan daun tegak, diameter tajuk lebih rendah daripada tanaman asalnya
1. Induksi Mutasi dengan Mutagen Sinar Gamma pada Kultur Kalus Nenas in vitro
Perlakuan iradiasi sinar gamma dilaksanakan di Puslitbang Teknologi Isotop
dan Radiasi, Badan Tenaga Nuklir Nasional Jakarta pada bulan April 2009,
sedangkan percobaan kultur jaringan dilaksanakan di Laboratorium Kultur
Jaringan Pusat Kajian Buah-buahan Tropika (PKBT) IPB.
Kalus embriogenik hasil biakan in vitro berumur 6 minggu dalam media induksi kalus, kemudian diiradiasi dengan sinar gamma pada iradiator Gamma
Chamber 4000 A (sumber 60Co) dengan dosis 0 Gy, 15 Gy, 25 Gy, dan 35 Gy.
Laju dosis 0.96481 kgray/jam (96.481 krad/jam) pada bulan Januari 2009.
Kalus yang sudah diradiasi kemudian diregenerasikan dalam media
induksi tunas yaitu media MS dengan penambahan 1.5 mg L-1 kinetin dan
0.5 mg L-1 NAA (Akbar et al. 2003). Perbedaan dosis iradiasi sinar gamma
dijadikan perlakuan dan diulang sebanyak 40 kali (botol kultur), masing-masing
botol kultur terdiri dari empat buah potongan kalus.
Parameter yang diamati, terdiri dari : a) Persentase kalus berwarna hijau
(%), b) Persentase kalus membentuk tunas (%), c). Jumlah bakal tunas (buah).
Tunas yang terbentuk dalam tahap ini berukuran sangat kecil, sehingga dilakukan
subkultur ke dalam media pembesaran (media MS tanpa pemberian zat pengatur
tumbuh).
Percobaan ditata dalam Rancangan Acak Lengkap (RAL) pada saat kalus
diregenerasikan menjadi tunas. Dosis iradiasi sinar gamma (0; 15; 25 dan 35 Gy)
digunakan sebagai perlakuan. Setiap unit percobaan diulang 40 kali. Model linier
satu faktor dengan Rancangan Acak Lengkap (RAL) menurut Mattjik dan
Sumertajaya (2006) adalah :
Yijk = µ + i + εij
Dimana : Yijk = pengamatan pada perlakuan kultivar ke-i dan ulangan ke-j
µ = Rataan umum
i = Pengaruh perlakuan ke-i
εij = Pengaruh acak pada perlakuan ke-i ulangan ke-j
Perbedaan setiap perlakuan dianalisis dengan menggunakan uji F pada
lanjutan dengan menggunakan Uji Jarak Berganda Duncan (UJGD) pada taraf 5%,
dengan menggunakan program SAS Release 6.12 (SAS Inst. 2002) dan dilakukan
uji keragaman fenotipik dari masing-masing perlakuan dosis iradiasi.
2. Kemampuan Regenerasi Tunas Mutan pada Tahap Multiplikasi dan Pembesaran secara In Vitro
Percobaan ini dilakukan di Laboratorium Kultur Jaringan Pusat Kajian
Buah-buahan Tropika (PKBT) Institut Pertanian Bogor selama 4 bulan.
Tunas-tunas yang telah mengalami pembesaran dalam media MS0 pada
kegiatan sebalumnya, kemudian disubkultur kedalam media MS dengan
penambahan 1 mg L-1 BAP (Nursandi 2006) untuk pengujian kemampuan
multiplikasi dari tunas-tunas mutan selama 8 MST. Tunas-tunas yang terbentuk
dalam media multiplikasi kemudian disubkultur kedalam media MS tanpa
pemberian zat pengatur tumbuh untuk pemanjangan dan pembesaran tunas selama
8 MST. Parameter yang diamati terdiri dari : a) jumlah tunas dan b) jumlah daun.
Rancangan percobaan yang digunakan adalan Rancangan Acak Lengkap.
Dosis iradiasi sinar gamma (0; 15; 25 dan 35 Gy) digunakan sebagai perlakuan.
Setiap unit percobaan diulang 10 kali. Model linier satu faktor dengan Rancangan
Acak Lengkap (RAL) menurut Mattjik dan Sumertajaya (2006).
Perbedaan setiap perlakuan dianalisis dengan menggunakan uji F pada taraf
5%, jika terdapat perbedaan nyata antar perlakuan maka dilakukan uji lanjutan
dengan menggunakan Uji Jarak Dunnet pada taraf 5%, dengan menggunakan
program SAS Release 6.12 (SAS Inst. 2002).
3. Analisis Keragaman Genetik Mutan Berdasarkan Penanda Morfologi dan Penanda Molekular ISSR
Percobaan ini dilakukan di Laboratorium Kultur Jaringan dan Laboratorium
Molekular Pusat Kajian Buah-buahan Tropika (PKBT) Institut Pertanian Bogor
selama 4 bulan.
Tunas-tunas yang telah mengalami pembesaran dalam media MS0 setelah
tahap multiplikasi, selanjutnya dilakukan subkultur setiap 4 minggu sebanyak dua
kali pada MS0. Pengamatan dilakukan terhadap karakter morfologi (jumlah daun,
Analisis keragaman genetik mutan terseleksi dalam MS0 dengan
menggunakan penanda molekuler ISSR, dilakukan dengan menganalisis DNA
dari mutan-mutan terseleksi yang memiliki penampilan karakter tertentu yang
mewakili populasi mutan. Percobaan dilaksanakan di Laboratorium Molekular
Pusat Kajian Buah Tropika IPB selama dua bulan dengan tahapan sebagai berikut:
Pengambilan Sampel Daun. Sampel daun diambil dari setiap botol kultur
yang telah terseleksi unggul (kalus embriogenik yang aktif berkembang dalam
media).
Isolasi DNA Total. Daun sebanyak 200 mg dimasukkan ke dalam mortar
yang berisi 10 ml penyangga lisis ( 100 mM Tris-HCl pH 8.2% (m/v) CTAB,
1.4 M NaCl, 20 mM EDTA, dan 0.2 % ß mercaptoethanol ditambahkan pada saat
akan diisolasi) dan 0.07 g pasir kuarsa, selanjutnya digerus sampai halus.
Cairan/serbuk daun dipindahkan ke dalam tabung 15 ml dan diinkubasi pada suhu
65oC selama 30 menit. Suspensi DNA diambil dengan melakukan sentrifuse pada
11000 rpm selama 10 menit, dilanjutkan dengan ekstraksi 1 volume chloroform :
isoamil alkohol (24:1). DNA di dalam suspensi dipresipitasi dengan
menambahkan 0.1 volume sodium asetat 3M pH 5.2 dan 0.8 volume isopropanol.
Endapan DNA yang dihasilkan melalui sentrifuse 11000 rpm selama
10 menit, dicuci dengan etanol 70%, dikeringkan, dan DNA disuspensi dalam
500 μl larutan TE 1X. Suspensi DNA diektraksi berturut-turut dengan fenol,
kemudian dengan 1 volume kloroform : isoamil alkohol (24:1). Tahapan berikut
adalah presipitasi sampai tahap mensuspensi DNA yang prosedurnya sama dengan
langkah sebelumnya.
Amplifikasi ISSR dengan PCR. Untuk amplifikasi ISSR, total campuran
yang digunakan adalah sebanyak 12.5 μl terdiri dari 30 - 100 ng genomic DNA,
0.5 μl primer, 1x PCR buffer, 0,2 mM dNTPs, 1,5 mM MgCl2, and 0,5 Unit rTaq polymerase. Diusahakan pencampuran larutan homogen dan kegiatan dilakukan
pada kondisi dingin (diatas es). Amplifikasi dilakukan menggunakan thermocycle
dengan tahapan program sebagai berikut: Denaturasi awal pada kondisi 94ºC
selama 2 menit, dilanjutkan dengan 35 putaran yang terdiri dari denaturasi pada
94ºC selama 30 detik, amplifikasi 52ºC selama 45 detik, dan extension pada 72ºC
pada 72ºC selama 7 menit. Hasil dari reaksi kemudian dielektroforesis pada
agarose gel pada konsentrasi 1,5%. Gel kemudian diwarnai dengan Ethidium bromide dan diamati di bawah UV transiluminator untuk melihat pola pita yang
dihasilkan. Primer ISSR yang digunakan sebanyak 19 buah, kemudian diseleksi
dan hanya 5 primer menunjukkan tingkat polimorfisme yang tinggi (Tabel 1).
Tabel 1 Susunan nukleotida, kandungan G/C dari 19 primer berulang ISSR yang digunakan untuk seleksi primer
No. Primer Susunan oligonukleotida 5’ ---3’ TM
(oC)
1 PKBT 1 ACACACACACACACACTG 54
2 PKBT 2 ACACACACACACACACTT 53*
3 PKBT 3 AGAGAGAGAGAGAGAGT 53
4 PKBT 4 AGAGAGAGAGAGAGAGAA 53*
5 PKBT 5 AGAGAGAGAGAGAGAGTA 53
6 PKBT 6 AGAGAGAGAGAGAGAGTT 53*
7 PKBT 7 GAGAGAGAGAGAGAGAGAA 53*
8 PKBT 8 GAGAGAGAGAGAGAGAGAC 54
9 PKBT 9 GAGAGAGAGAGAGAGAGAT 54*
10 PKBT 10 GTGTGTGTGTGTGTGTGTA 54
11 PKBT 11 GTGTGTGTGTGTGTGTGTC 54
12 PKBT 12 GTGTGTGTGTGTGTGTGTT 54
13 ISSRED 12 AGAC AGACAGACAGAC 50
14 ISSRED 14 GACAGACAGACAGACA 50
15 ISSRED 15 GATA GATA GATA GATAG 44
16 ISSRED 17 GACGACGACGACGAC 55
17 ISSRED 18 GGATGGATGGATGGAT 50
18 ISSRED 19 GAA GAA GAA GAA GAA GAA 46
19 ISSRED 26 CACACACACACAAG 46
Keterangan : * primer terseleksi
Analisis Data
1. Analisis Keragaman Genetik Regeneran Mutan Berdasarkan Penanda Morfologi
Hasil pengamatan pada Percobaan II untuk karakter morfologi (jumlah
daun, bentuk daun, tinggi tunas, kedudukan daun, warna daun, dan diameter tajuk)
dalam media pembesaran (MS0), kemudian diubah menjadi data biner dengan
skoring data berdasarkan kriteria-kriteria yang sudah ditetapkan pada setiap
variabel. Bila ada nilai pada kriteria tersebut diskor ”1” atau tidak ada nilai diskor
matrik kesamaan antar galur mutan yang dihitung berdasarkan Dice algoritme yang terdapat dalam paket program NTSYSpc (Numerical Taxonomy and Multivariate Analysis System) versus 2.02 (Rohlf 1998).
2. Analisis Keragaman Genetik Regeneran Mutan Berdasarkan Penanda Molekular ISSR
Produk ISSR hasil pemotretan gel berupa pola pita DNA dengan ukuran
tertentu. Ukuran DNA ditentukan dengan membandingkan marka dengan berat
molekul 1 kb DNA ladder. Perbedaan antar individu tanaman ditunjukkan dengan
adanya jumlah pita dan jarak migrasinya. Pita-pita DNA diubah menjadi data
biner dengan melakukan skoring data. Pita diskor ”1” jika ada pita atau diskor ”0”
jika tidak ada pita. Berdasarkan pada muncul tidaknya pola pita yang diperoleh
pada tahap ini, kemudian dihitung matrik kesamaan antar galur mutan yang
dihitung berdasarkan Dice algoritme yang terdapat dalam paket program NTSYSpc (Numerical Taxonomy and Multivariate Analysis System) versus 2.02 (Rohlf 1998).
3. Analisis Similaritas
Data biner hasil marka ISSR dan data morfologi dilakukan analisis dengan
menggunakan UPGMA (Unweighted pair group method with aritmathic means)
dengan fungsi SIMQUAL menjadi dendrogram NTSYSpc 2.02 for windows
(Rohlf 1998). Hasil analisis tersebut menggambarkan hubungan kekerabatan
antara tanaman yang satu dengan yang lain berdasarkan jarak genetik.
4. Analisis Gerombol
Analisis gerombol (clustering) semua data baik morfologi, data ISSR dan data gabungan masing-masing dianalisis dengan menggunakan Sequential,
Agglomerative, Hierarchical and Nested (SAHN)-UPGMA (Unweighted pair
group method, arithmetic average) pada program NTSYSpc versi 2.02.
5. Analisis Komparasi antara Dua Penanda
Untuk mengetahui tingkat keselarasan koefisien kesamaan antara dua
penanda morfologi dengan profil DNA dari analisis molekular kemudian
MXCOMP NTSYS-pc versi 2.02. Tingkat keselarasan pengelompokan ditentukan
berdasarkan kriteria goodness of fit, yakni tingkat kesamaan nilai matriks similarity coefficient dengan interpretasi kesesuaian matriks korelasi dua data
adalah sangat sesuai (r ≥ 0.9), sesuai (0.8 ≤ r ≤ 0.9), tidak sesuai (0.7 ≤ r ≤ 0.8),
dan sangat tidak sesuai (r < 0.7).
6. Analisis Perbandingan Nilai Rata-rata antara Populasi Mutan (M-15) dengan Populasi Kontrol (M-00) Sebelum dan Sesudah dilakukan Seleksi dengan Uji t
Seleksi pertama dilakukan terhadap tunas yang memiliki karakter
kedudukan daun tegak dan seleksi kedua dilakukan pada dua karakter yaitu
karakter kedudukan daun tegak dan karakter diameter tajuk. Analisis statistik
berdasarkan pada nilai rata-rata, standar deviasi, dan ragam dari masing-masing
populasi pada karakter jumlah daun, tinggi tunas, dan diameter tajuk pada
tanaman in vitro. Data yang diperoleh kemudian dilakukan analisis perbandingan nilai rata-rata antar populasi dengan uji t. Analisis data dilakukan dengan
menggunakan program MINITAB 14 (Iriawan & Septin 2006).
7. Analisis Perbandingan Nilai Varian antar Dua Populasi Mutan (M-15) dengan Populasi Kontrol (M-00) Sebelum dan Sesudah dilakukan Seleksi dengan Uji F
Perhitungan varian dilakukan untuk melihat penyebaran suatu data. Uji
rasio varian antar populasi digunakan untuk menguji kesesuaian varian populasi
M-15 dengan populasi kontrol M-00 sebelum dan sesudah dilakukan seleksi.
Analisis data dilakukan dengan menggunakan program MINITAB 14 (Iriawan &
HASIL DAN PEMBAHASAN
Kondisi Umum Pertumbuhan Kalus
Kalus merupakan sekumpulan sel yang tidak terorganisir, hanya sel-sel
parenkim yang berasal dari eksplan awal (Gunawan 1987). Inisiasi kalus diawali
dengan pengambilan eksplan nodul dari bagian dasar plantlet (Gambar 4A). Kalus
terbentuk akibat adanya pelukaan atau irisan pada permukaan eksplan. Potongan
nodul ditanamn dalam media MS + 0.05 mg L-1 2,4-D + 1 mg L-1 BAP
(Gambar 4B) dan berhasil membentuk kalus berwarna bening kekuning-kuningan
serta memiliki tekstur remah (Gambar 4C).
Gambar 4. Tahapan perbanyakan bahan tanam dan inisiasi kalus. [A] Tanda panah menunjukkan eksplan yang digunakan untuk induksi kalus; [B] Inisiasi kalus dalam media MS + 0.05 mg L-1 2,4-D + 1 mg L-1 BAP; [C] Kalus yang akan diiradiasi sinar γ
Zat pengatur tumbuh 2,4-D dikenal sebagai auksin sintetik yang digunakan
untuk induksi kalus sebab memiliki kemampuan untuk untuk mendorong
pembelahan sel dalam jaringan pada beberapa tanaman (George & Sherrington
1996), namun dalam pembentukan kalus nenas ini diperlukan adanya
auksin (2,4-D) dan sitokinin (BAP). Hal ini sejalan dengan hasil penelitian
Alagumanian et al. (2004) yang menyatakan bahwa penggunaan BAP dapat mendorong pertumbuhan kalus pada eksplan daun dan potongan batang
Solanum trilobatum L. dan kalus yang dihasilkan berwarna hijau serta memiliki tekstur kompak. Auksin dan sitokinin berperan dalam induksi dan proliferasi
kalus (Aftab et al. 2008).
Pengaruh Pemberian Mutagen Sinar Gamma terhadap Regenerasi Kalus Nenas in Vitro
Kalus-kalus berumur 6 MST dalam media induksi kalus, selanjutnya diberi
mutagen sinar gamma pada dosis 0 Gy, 15 Gy, 25 Gy dan 35 Gy, kemudian
diregenerasikan dalam media induksi tunas. Media regenerasi tunas menggunakan
media MS (Lampiran 1) dengan zat pengatur tumbuh 0.5 mg L-1 NAA
(Naphthalene Acetic Acid) dan 1.5 mg L-1 kinetin. Penggunaan kinetin dapat menginduksi tunas pada kalus nenas (Akbar et al. 2003; Khar et al. 2005). Zat pengatur tumbuh memegang peranan dalam kultur in vitro tanaman monokotil dan penambahan sitokinin secara nyata dapat mempengaruhi regenerasi tanaman
(Bhaskaran & Smith 1990).
[A] [B]
[C] [D]
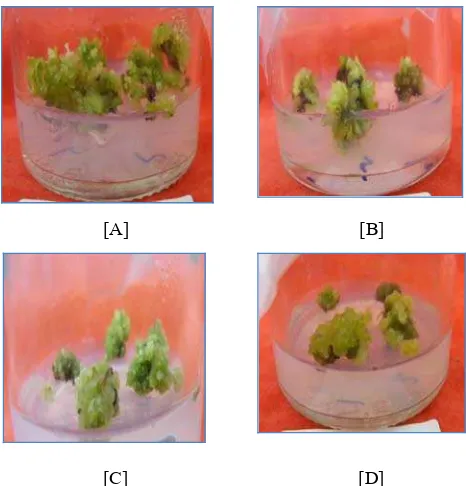
Gambar 5 Morfologi kalus 8 minggu setelah iradiasi sinar gamma (γ) dalam media induksi. [A] Kalus yang diradiasi sinar γ pada dosis 0 Gy ; [B] Kalus yang diradiasi sinar γ pada dosis 15 Gy; [C] Kalus yang diradiasi sinar γ pada dosis 25 Gy ; [D] Kalus yang diradiasi sinar γ pada dosis 35 Gy
Pertumbuhan kalus pada 8 MST dalam media induksi tunas tidak
nodul terlebih dahulu, kemudian membentuk tunas dengan ukuran yang relatif
kecil, kompak, dan padat (Gambar 5).
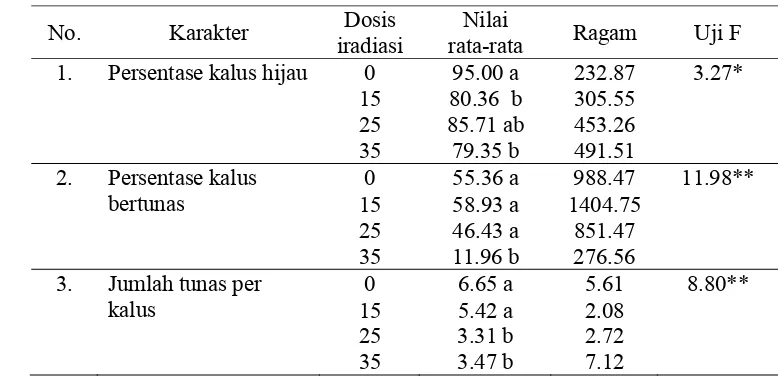
Berdasarkan hasil uji F (Tabel 2) terlihat bahwa perlakuan berbagai dosis
iradiasi sinar gamma menunjukkan pengaruh yang berbeda nyata pada parameter
persentase kalus berwarna hijau, persentase kalus bertunas, dan jumlah tunas per
kalus pada 8 MST. Keragaman yang terjadi pada generasi MV1 akibat iradiasi
sinar gamma dapat disebabkan oleh akumulasi pengaruh kerusakan fisiologis,
mutasi gen, dan mutasi kromosom namun kerusakan fisiologis kontribusinya lebih
besar daripada mutasi gen maupun kromosom pada MV1 (Nwachukwu et al. 2009).
Keterangan : Angka-angka yang diikuti oleh huruf yang berbeda pada kolom yang sama berarti berbeda nyata berdasarkan uji jarak berganda Duncan α = 0.05, (*) berbeda nyata; (**) berbeda sangat nyata
Pemberian mutagen sinar gamma dapat mempengaruhi terbentuknya tunas.
Rata-rata jumlah tunas yang dihasilkan pada perlakuan dosis iradiasi sinar gamma
15 Gy adalah 5.42 tunas yang tidak berbeda nyata dengan kontrol sebanyak
6.65 tunas (Tabel 2). Dosis iradiasi sinar gamma yang lebih besar menyebabkan
jumlah tunas yang terbentuk rendah sebab proses diferensiasi tunas terhambat
akibat perlakuan dosis radiasi dan frekuensi terbentuknya tunas menurun sejalan
dengan peningkatan dosis radiasi (Zhen 1998) yang mengakibatkan terganggunya
akan melibatkan proses fisika dan kimia yang dapat menghasilkan peroksida
(H2O2) dan dapat menyebabkan kerusakan gen (Ismachin 1988).
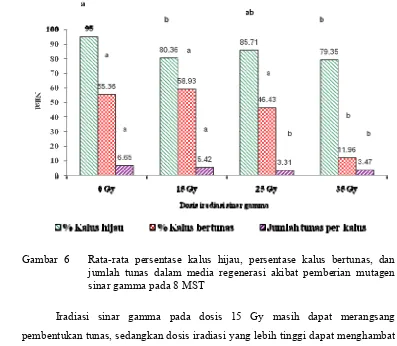
Perlakuan pemberian mutagen sinar gamma berpengaruh nyata terhadap
variabel persentase kalus membentuk tunas (Gambar 6). Peningkatan dosis
iradiasi sinar gamma menyebabkan penurunan persentase daya regenerasi kalus
membentuk tunas. Variabel persentase kalus bertunas yang diamati berbeda nyata
artinya perlakuan dosis iradiasi dapat berpengaruh terhadap regenerasi tunas dari
kalus. Peningkatan perlakuan dosis iradiasi sinar gamma dapat menyebabkan
penurunan persentase daya regenerasi kalus membentuk tunas.
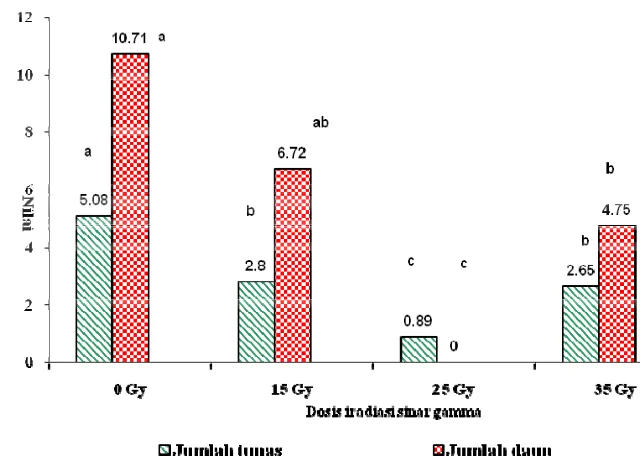
Gambar 6 Rata-rata persentase kalus hijau, persentase kalus bertunas, dan jumlah tunas dalam media regenerasi akibat pemberian mutagen sinar gamma pada 8 MST
Iradiasi sinar gamma pada dosis 15 Gy masih dapat merangsang
pembentukan tunas, sedangkan dosis iradiasi yang lebih tinggi dapat menghambat
munculnya tunas. Pemberian iradiasi pada dosis rendah memberi efek dapat
mendorong pertumbuhan tanaman (IAEA 1985). Tunas-tunas yang terbentuk
dalam media regenerasi tunas selama 8 MST memiliki ukuran yang sangat kecil
sehingga perlu dilakukan subkultur kedalam media MS tanpa pemberian zat
(Gambar 7). Eksplan yang telah beregenerasi dalam media MS yang mengandung
sitokinin dapat dipindah ke media lain tanpa zat pengatur tumbuh (MS0).
Tabel 3 Nilai F- hitung pada karakter fenotipik dalam media pembesaran (MS0) pada 8 MST
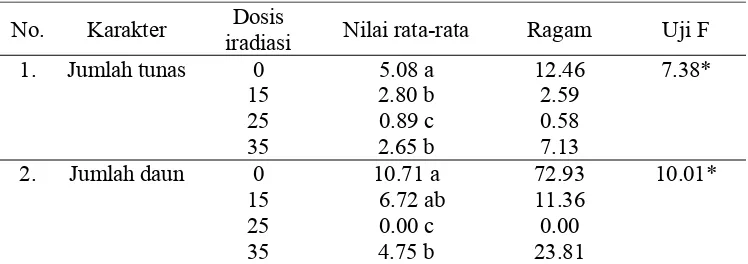
No. Karakter Dosis
iradiasi Nilai rata-rata Ragam Uji F 1. Jumlah tunas 0 5.08 a 12.46 7.38*
15 2.80 b 2.59
25 0.89 c 0.58
35 2.65 b 7.13
2. Jumlah daun 0 10.71 a 72.93 10.01* 15 6.72 ab 11.36
25 0.00 c 0.00
35 4.75 b 23.81
Keterangan : Angka-angka yang diberi huruf yang berbeda pada kolom yang sama berarti berbeda nyata berdasarkan uji jarak berganda Duncan α = 0.05.
Hasil uji F menunjukkan bahwa iradiasi sinar gamma berpengaruh nyata
terhadap jumlah tunas yang tumbuh dalam media MS0. Pemberian dosis iradiasi
35 Gy tidak berbeda nyata dengan dosis 15 Gy terhadap variabel jumlah tunas dan
jumlah daun (Tabel 3), namun tunas yang dihasilkan pada 35 Gy berukuran sangat
kecil, berdaun tipis, dan keriting. Pemberian dosis iradiasi 25 Gy diperoleh nilai
rata-rata dan ragam yang terendah pada karakter jumlah tunas dan jumlah daun.
Hal ini menunjukkan bahwa perlakuan 25 Gy menghambat pertumbuhan tunas
dan daun dan tidak dapat meningkatkan keragaman. Hal ini kemungkinan telah
terjadi kerusakan seluler pada jaringan meristem, sehingga pertumbuhan menjadi
terhambat.
Pemberian mutagen sinar gamma pada dosis 35 Gy, terlihat nilai ragam
yang tinggi yaitu 7.13 pada karakter jumlah daun dan 23.81 pada karakter jumlah
tunas (Tabel 3). Hal ini menunjukkan bahwa dosis 35 Gy dapat meningkatkan
keragaman pada karakter jumlah daun dan jumlah tunas, namun keragaman yang
terjadi tidak dapat digunakan untuk seleksi karena karakter tunas dan daun yang
Gejala abnormalitas yang terjadi akibat pemberian mutagen sinar gamma
kemungkinan disebabkan oleh adanya radikal bebas yang dapat bereaksi dengan
senyawa penting dalam proses metabolisme serta terbentuknya senyawa hidrogen
peroksida yang bersifat toksik. Keadaan ini menyebabkan terjadinya kerusakan
fisiologis dan menyebabkan proses pembelahan dan diferensiasi sel menjadi
terhambat pada akhirnya memacu kerusakan jaringan (Ismachin 1989).
Kemampuan Regenerasi Tunas Mutan pada Tahap Multiplikasi dan Pembesaran secara In Vitro
Regeneran yang tetap hidup pada tahap induksi dan pembesaran,
selanjutnya dilakukan seleksi dan disubkultur kedalam media multiplikasi untuk
melihat kemampuan bermultiplikasi dari masing-masing regeneran. Tahap
multiplikasi merupakan tahap pembentukan tunas adventif dan tunas aksilar yang
Iradiasi sinar gamma dapat menyebabkan terjadinya keragaman
pertumbuhan tunas. Pengaruh yang signifikan berdasarkan analisis statistika
diantara populasi tunas somaklon dalam media in vitro menunjukkan terjadinya
keragaman. Nilai standar deviasi dari masing-masing somaklon menunjukkan
besarnya tingkat keragaman dalam populasi somaklon tersebut. Menurut Miglani
(2006), jika dua atau lebih genotipe ditumbuhkan pada kondisi lingkungan yang
sama (kondisi in vitro) sehingga menghasilkan pertumbuhan yang berbeda, maka kedua individu tersebut mempunyai genotipe yang berbeda. Untuk mengetahui
adanya variasi dari suatu populasi harus dilakukan pengukuran dan analisis
mengikuti kaidah statistika. Populasi yang bervariasi mempunyai ciri-ciri khusus
yang dapat dilihat dari nilai rata-rata, ragam, dan standar deviasi (Baihaki 1999).
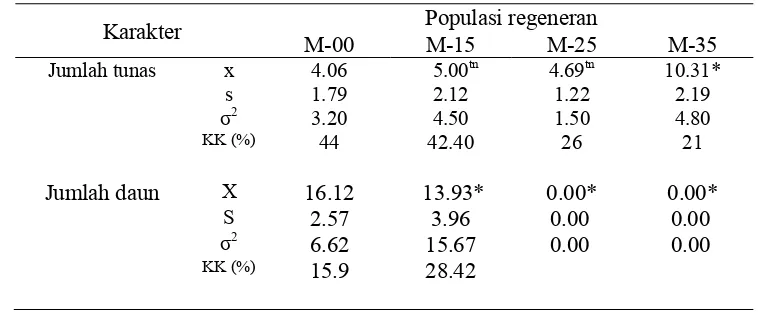
Tabel 4. Jumlah tunas dan jumlah daun regeneran hasil iradiasi sinar gamma pada media multiplikasi pada 8 MST
Karakter Populasi regeneran
M-00 M-15 M-25 M-35
Jumlah tunas x 4.06 5.00tn 4.69tn 10.31*
s 1.79 2.12 1.22 2.19
2
3.20 4.50 1.50 4.80
KK (%) 44 42.40 26 21
Jumlah daun X 16.12 13.93* 0.00* 0.00*
S 2.57 3.96 0.00 0.00
2
6.62 15.67 0.00 0.00
KK (%) 15.9 28.42
Keterangan : Angka-angka nilai tengah (x) yang diberi tanda (*), berbeda nyata menurut uji
Dunnet 5%, s = standar deviasi; 2 = ragam; KK=koefisien keragaman; M-00,
M-15, M-25 dan M-35 merupakan regeneran hasil perlakuan dosis sinar gamma berturut-turut 0, 15, 25 dan 35 Gy.
Berdasarkan hasil uji Dunnett 5% menunjukkan bahwa nilai rata-rata
jumlah tunas pada populasi regeneran kontrol (M-00) menghasilkan rata-rata
jumlah tunas yang tidak berbeda nyata dengan regeneran asal perlakuan radiasi
15 Gy (M-15) dan 25 Gy (M-25), namun berbeda nyata dengan regeneran asal
35 Gy (M-35). Rata-rata jumlah daun yang dihasilkan pada populasi kontrol
(M-00) lebih tinggi dan berbeda nyata dengan perlakuan lainnya (Tabel 4). Hal
![Gambar 2. [A] Deskripsi tanaman klon PK di lapangan; [B] Karakteristik buah nenas klon PK; [C] Plantlet in vitro nenas klon PK](https://thumb-ap.123doks.com/thumbv2/123dok/713885.361938/25.612.128.508.300.457/gambar-deskripsi-tanaman-lapangan-karakteristik-plantlet-vitro-nenas.webp)