DALAM KULTUR
IN VITRO
WACIH TRESNASIH
A34304022
PROGRAM STUDI HORTIKULTURA
FAKULTAS PERTANIAN
RINGKASAN
WACIH TRESNASIH. Pemanfaatan Methylobacterium spp. untuk Meningkatkan Pertumbuhan Bibit Tanaman Nilam (Pogostemon cablin. Benth.) dalam KulturIn Vitro. (Dibimbing oleh AGUS PURWITO dan ENY WIDAJATI).
Penelitian ini bertujuan untuk mengetahui pengaruh isolat Methylobacterium spp. terhadap pertumbuhan bibit tanaman nilam serta untuk mendapatkan strain yang dapat digunakan untuk multiplikasi tunas dan induksi akar tanaman nilam dalam kultur in vitro. Penelitian dilaksanakan mulai bulan Februari sampai November 2008 di Laboratorium Biologi Sel dan Jaringan, dan Laboratorium Mikrobiologi Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumberdaya Genetik Pertanian (BB-Biogen), Cimanggu, Bogor. Penelitian dibagi menjadi 3 percobaan.
Percobaan I bertujuan untuk menentukan teknik sterilisasi yang efektif untuk isolatMethylobacterium spp. sehingga dapat dimanfaatkan dalam kultur in vitro. Isolat yang digunakan adalah strain TD-L2. Isolat ini selanjutnya di
sterilisasi sesuai dengan perlakuan, kemudian diujikan pada bibit tanaman nilam. Percobaan ini menggunakan Rancangan Acak Lengkap (RAL) satu faktor perlakuan berupa teknik sterilisasi yang terdiri dari 3 taraf. Taraf pertama yaitu sterilisasi menggunakan filter. Taraf kedua menggunakan filter kemudian menggunakan otoklaf. Taraf ketiga menggunakan otoklaf. Hasil percobaan I menunjukkan bahwa media yang ditambahkan isolat bakteri yang disterilisasi menggunakan otoklaf menghasilkan media steril tertinggi yaitu 93,75%.
Percobaan II bertujuan untuk melihat pengaruh Methylobacterium spp. penghasil trans-zeatin dalam meningkatkan multiplikasi tunas bibit tanaman nilam dalam kulturin vitro. Isolat yang digunakan adalah strain TD-J2dan TD-J7.
Isolat ini diujikan pada bibit tanaman nilam dalam kultur in vitro secara terpisah. Strain TD-J2 disterilisasi menggunakan otoklaf, sedangkan strain TD-J7
disterilisasi menggunakan filter karena strain TD-J7 ini akan dibandingkan
MS+10% TD-J2, 2) MS+20% TD-J2, 3) MS+30% TD-J2, 4) MS0, 5) MS+0,1 mg/l
BAP, dan 6) AMS. Media AMS adalah mediaAmmonium Mineral Salt. Media ini biasa digunakan untuk perbanyakan Methylobacterium spp. Penambahan strain 20% dan 30% strain TD-J2lebih baik dibandingkan BAP sintetik 0,1 mg/l dalam
memacu multiplikasi tunas tanaman nilam dalam kulturin vitro.
Percobaan IIB menggunakan Rancangan Acak Lengkap satu faktor perlakuan berupa media yang terdiri dari 6 taraf yaitu 1) media MS+10% TD-J7,
2) MS+20% TD-J7, 3) MS+30% TD-J7, 4) MS0, 5) MS+0,1 mg/l Zeatin, dan 6)
AMS. Penambahan 30% strain TD-J7 dapat menginduksi kalus lebih baik
dibandingkan zeatin sintetik 0,1 mg/l. Kualitas kalus yang dihasilkan oleh media dengan penambahan 30% strain TD-J7 lebih friable dibandingkan dengan kalus
yang dihasilkan oleh media dengan penambahan zeatin sintetik 0,1 mg/l.
Percobaan III bertujuan untuk melihat pengaruh Methylobacterium spp. penghasil IAA dalam menginduksi perakaran bibit tanaman nilam dalam kulturin vitro. Isolat yang digunakan adalah strain TD-J10. Percobaan ini menggunakan
Rancangan Acak Lengkap satu faktor perlakuan. Faktor perlakuan berupa media yang terdiri dari 7 taraf yaitu 1) MS+10% TD-J10, 2) MS+20% TD-J10, 3)
MS+30% TD-J10, 4) MS0, 5) MS+0,1 mg/l IAA, 6) MS+0,1 mg/l NAA, dan 7)
AMS. Penambahan 10%, 20%, dan 30% strain TD-J10 tidak lebih baik
PEMANFAATAN
Methylobacterium
spp. UNTUK
MENINGKATKAN PERTUMBUHAN BIBIT TANAMAN
NILAM (
Pogostemon cablin,
Benth.)
DALAM KULTUR
IN VITRO
Skripsi sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian pada Fakultas Pertanian Institut Pertanian Bogor
WACIH TRESNASIH A34304022
PROGRAM STUDI HORTIKULTURA
FAKULTAS PERTANIAN
JUDUL : PEMANFAATAN Methylobacterium spp. UNTUK
MENINGKATKAN PERTUMBUHAN BIBIT
TANAMAN NILAM (Pogostemon cablin, Benth.) DALAM KULTURIN VITRO
NAMA : WACIH TRESNASIH
NRP : A34304022
PROGRAM STUDI : Hortikultura
Menyetujui,
Dosen Pembimbing I Dosen Pembimbing II
Dr. Ir. Agus Purwito, MSc.Agr. Dr. Ir. Eny Widajati, MS. NIP. 19611101 198703 1 003 NIP. 19610106 198503 2 002
Mengetahui, Dekan Fakultas Pertanian
Prof. Dr. Didy Sopandie, M.Agr. NIP. 19571222 198263 1 002
RIWAYAT HIDUP
Penulis dilahirkan di Majalengka pada tanggal 23 Maret 1985. Penulis adalah anak ketiga dari tiga bersaudara keluarga Bapak Warta dan Ibu Sarah dengan kakak pertama bernama Nana Carmana dan kakak kedua bernama Damanah S.P.
Penulis menyelesaikan pendidikan dasar di SD Negeri Waringin IV kabupaten Majalengka pada tahun 1998. Tahun 1998 penulis melanjutkan pendidikan di SLTP Negeri 1 Palasah kabupaten Majalengka dan pada tahun 2001 penulis melanjutkan pendidikan di SMU Negeri 1 Jatiwangi kabupaten Majalengka. Pada tahun 2004 penulis diterima di Institut Pertanian Bogor (IPB) melalui jalur Undangan Seleksi Masuk IPB (USMI) sebagai mahasiswa Program Studi Hortikultura, Departemen Agronomi dan Hortikultura, Fakultas Pertanian.
Selama menjadi mahasiswa, penulis aktif sebagai anggota Garden and Decorations Club (GREDA-C) pada tahun 2004-2005, aktif sebagai pengurus Divisi Syiar Forum Keluarga Rohani Islam Departemen Fakultas Pertanian (FKRD-A) pada tahun 2005-2006, aktif sebagai pengurus Divisi Eksternal (Public Relation) Himpunan Mahasiswa Agronomi dan Hortikultura (HIMAGRON) pada tahun 2005-2007, aktif sebagai Bendahara Rohani Islam Program Studi Hortikultura pada tahun 2005-2008, aktif sebagai Senior Residence (SR) Asrama TPB IPB pada tahun 2006-2009, aktif sebagai pengurus harian di Klub Sepeda Kampus IPB pada tahun 2006-2007, aktif menjadi panitia berbagai kegiatan kampus sejak tahun 2004-2008. Penulis menjadi Ketua Pelaksana Hari Pelepasan Wisudawan yang diselenggarakan oleh Departemen Agronomi dan Hortikultura tiga kali berturut-turut pada tahun 2005 - 2007.
terus berkarya. Proposal PKMK (Program Kreativitas Mahasiswa bidang Kewirausahaan) yang berjudul “Kultur Seni : Flowerbed In D’Bottle” dan proposal PKMP (Program Kreativitas Mahasiswa bidang Penelitian) yang
berjudul “Pengaruh Konsentrasi Paclobutrazol dalam Induksi Pembungaan
(Flowering) Mawar Mini Hibrida Varietas Rosmarun dan Yulikara secara In Vitro” lolos didanai masing-masing sebesar 7 juta dan 6,5 juta. Penulis bersama dengan timnya menjadi finalis dalam Lomba Peningkatan Kreasi Seni dalam Budidaya Pertanian yang diselenggarakan oleh BEM-KM IPB pada tahun 2009.
KATA PENGANTAR
Puji syukur penulis panjatkan kehadirat Allah Swt. yang telah memberikan hidayah-Nya sehingga penulis dapat menyelesaikan penelitian ini dengan baik. Penelitian yang berjudul “Pemanfaatan Methylobacterium spp. untuk meningkatkan pertumbuhan bibit tanaman Nilam (Pogostemon cablin, Benth.) dalam kultur in vitro” dilaksanakan untuk mengeksplorasi potensi yang dimiliki oleh bakteri Methylobacterium spp., serta sebagai salah satu syarat dalam memperoleh gelar Sarjana Pertanian pada Fakultas Pertanian Institut Pertanian Bogor (IPB).
Penulis menyampaikan terima kasih kepada Dr. Ir. Agus Purwito, MSc.Agr. dan Dr. Ir. Eny Widajati, MS. selaku dosen pembimbing skripsi, atas bimbingan, arahan, motivasi, dan doa yang telah diberikan selama proses bimbingan. Ucapan terima kasih juga disampaikan kepada Ir. Diny Dinarti, MS selaku dosen pembimbing akademik, kepada Mia Kosmiatin, S.Si.MSi. dan Dra. Selly Salma, MS. yang telah memberikan bimbingan selama di laboratorium Biologi Sel dan Jaringan dan laboratorium Mikrobiologi BB-Biogen, Cimanggu Bogor. Kepada kedua orang tua dan keluarga atas dukungan moril maupun materiil. Kepada staf dan laboran BB-Biogen. Kepada Dr. Ir. Bonny P.W. Soekarno, MS. dan Dr. Irmansyah, M.Si selaku kepala BPA periode 2003-2010 dan 2010-2015 beserta staff serta rekan Senior Residence Asrama TPB-IPB.
Ucapan terima kasih juga disampaikan kepada tim PKM Florito, Midori, Rosella, Amuraki, dan Cresh. Kepada Ir. Edhi Sandra, MSi (Pemilik Eshaflora). Kepada teman-teman mahasiswa Agronomi dan Hortikultura angkatan 41, mahasiswa penghuni Asrama TPB IPB angkatan 43 sampai angkatan 47, Himpunan Mahasiswa Majalengka, penghuni kost Andaleb 1, kelompok Kuliah Kerja Profesi (KKP) Desa Mulyasari Cianjur, Alumni ESQ Mahasiswa Angkatan 7, Kelompok C Shell live wire, serta semua pihak yang telah membantu. Semoga hasil penelitian ini dapat bermanfaat bagi masyarakat dan civitas akademika.
KATA PENGANTAR ... v
DAFTAR ISI ... vi
DAFTAR TABEL... vii
DAFTAR GAMBAR ... viii
DAFTAR LAMPIRAN... ix
PENDAHULUAN Latar Belakang ... 1
Tujuan ... 3
Hipotesis ... 3
TINJAUAN PUSTAKA Nilam dan Lingkungan Tumbuhnya ... 4
Methylobacteriumspp. ... 9
Perbanyakan Tanaman dengan Kultur Jaringan ... 13
Zat Pengatur Tumbuh ... 15
Auksin ... 15
Sitokinin ... 16
BAHAN DAN METODE Waktu dan Tempat ... 18
Bahan dan Alat ... 18
Metode Percobaan ... 19
Pelaksanaan Penelitian ... 22
HASIL DAN PEMBAHASAN Kondisi Umum ... 36
Percobaan I.Uji Efektivitas Teknik Sterilisasi IsolatMethylobacterium spp. untuk KulturIn VitroTanaman Nilam... 38
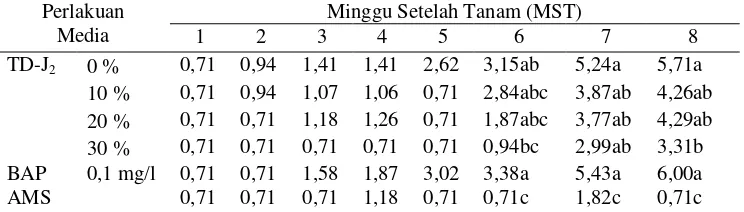
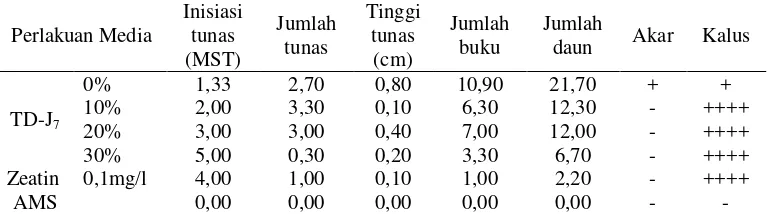
Percobaan II. Pengujian StrainMethylobacteriumspp. Penghasil Sitokinin (TD-J2dan TD-J7) untuk Meningkatkan Multiplikasi Tunas Tanaman Nilam dalam KulturIn Vitro... 41
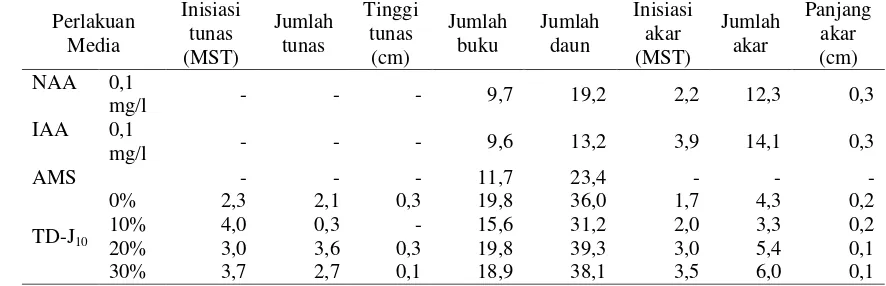
Percobaan III. Pengujian StrainMethylobacteriumspp. Penghasil Auksin (TD-J10) untuk Menginduksi Perakaran Tanaman Nilam dalam KulturIn Vitro... 51
KESIMPULAN DAN SARAN Kesimpulan ... 55
Saran ... 55
DAFTAR PUSTAKA... 56
DAFTAR TABEL
Nomor Halaman
1. Volume ekspor/impor minyak nilam Indonesia tahun 1999-2004 ... 4
2. Rekapitulasi Sidik Ragam Peubah yang Diamati pada Pertumbuhan Bibit Tanaman Nilam dalam KulturIn Vitro... 37
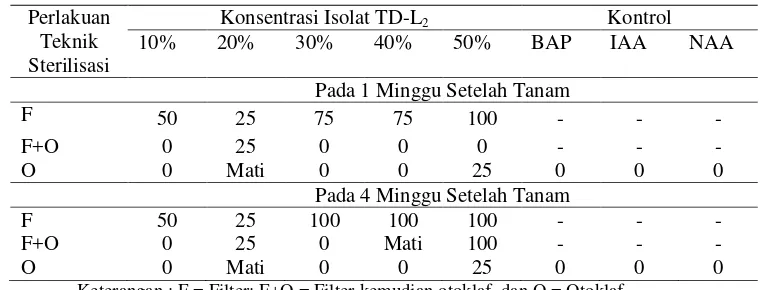
3. Pengaruh Teknik Sterilisasi Isolat TD-L2 terhadap Persentase (%) Kontaminasi Tanaman Nilam dalam KulturIn Vitro... 38
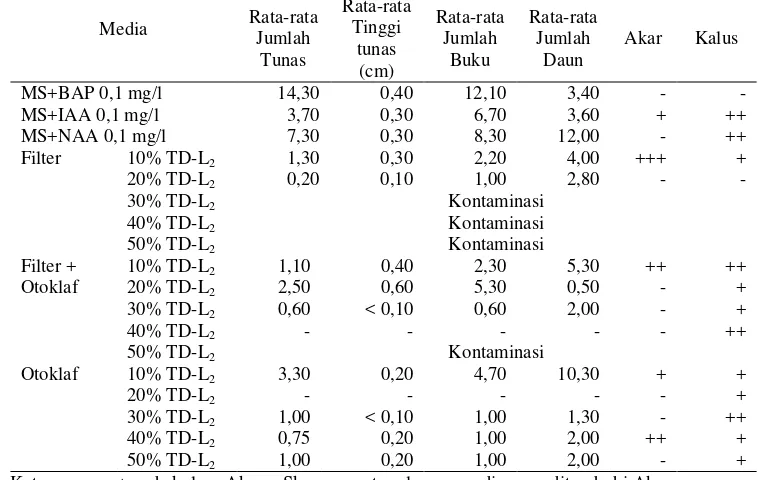
4. Respon Pertumbuhan Tanaman Nilam terhadap Media dengan Penambahan IsolatMethylobacteriumspp. Strain TD-L2pada 4 MST . 40 5. Pengaruh Isolat TD-J2terhadap Jumlah Tunas Tanaman Nilam ... 42
6. Pengaruh Isolat TD-J2terhadap Jumlah Buku Tanaman Nilam ... 42
7. Pengaruh Isolat TD-J2terhadap Jumlah Daun Tanaman Nilam ... 42
8. Pengaruh Isolat TD-J2terhadap Tinggi Tunas Tanaman Nilam... 43
9. Pengaruh TD-J2terhadap Persentase Kultur Berkalus Tanaman Nilam. 45 10. Pengaruh Strain TD-J2 terhadap Jumlah Akar Tanaman Nilam pada 8 MST ... 46
11. Pengaruh Strain TD-J2terhadap Panjang Akar Tanaman Nilam... 46
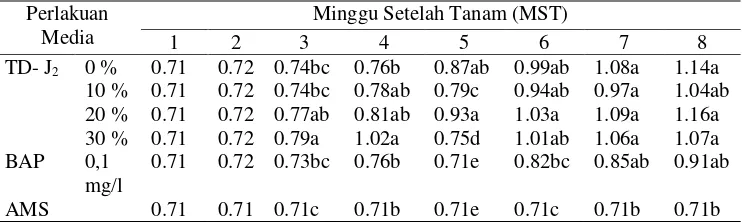
12. Respon Pertumbuhan Tanaman Nilam pada Media dengan Penambahan Isolat TD-J7pada 4 MST... 49
13. Respon Pertumbuhan Tanaman Nilam pada Media dengan Penambahan Isolat TD-J7pada 8 MST... 50
14. Analisis Kadar IAA, GA, dan Trans Zeatin yang Terdapat pada 17 Suspensi KulturMethylobacterium spp. pada Media AMS Modifikasi Selama 7 hari ... 52 15. Respon Pertumbuhan Akar Tanaman Nilam pada Media dengan
Penambahan IsolatMethylobacteriumspp. Strain TD-J10pada 4 MST . 52
Nomor Halaman
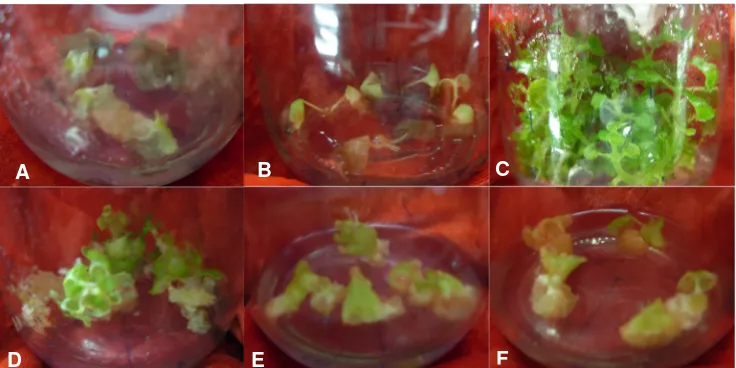
1. Kalus yang Terbentuk pada Media dengan Penambahan Isolat Methylobacteriumspp. Strain TD-J7pada 8 MST... 50
2. Pertumbuhan Akar Tanaman Nilam pada Media dengan Penambahan IsolatMethylobacteriumspp. Strain TD-J10pada 8 MST ... 53
DAFTAR LAMPIRAN
Nomor Halaman
1. Morfologi Bunga, Daun, dan Batang Tanaman Nilam Aceh
(Pogostemon cablinBenth.) ... 64
2. Kriteria Kesesuaian Lahan dan Iklim untuk Lingkungan Tumbuh Tanaman Nilam... 65
3. Komposisi Media Murashige and Skoog (MS) ... 66
4. Komposisi Media Kultur BakteriMethylobacterium(Media AMS)... 66
5. Komposisi Trace Element per 100 ml ... 67
6. Sketsa Gambar Bahan Tanaman Nilam yang Digunakan Sebagai Eksplan... 67
7. Isolat BakteriMethylobacteriumspp. ... 68
8. Sidik Ragam TD-J2terhadap Jumlah Tunas Kultur NilamIn Vitro... 69
9. Sidik Ragam TD-J2terhadap Jumlah Buku Kultur NilamIn Vitro... 70
10. Sidik Ragam TD-J2terhadap Jumlah Daun Kultur NilamIn Vitro... 71
11. Sidik Ragam TD-J2terhadap Tinggi Tunas Kultur NilamIn Vitro... 72
12. Sidik Ragam TD-J2terhadap Jumlah Kalus Kultur NilamIn Vitro... 73
13. Sidik Ragam TD-J2terhadap Jumlah Akar Kultur NilamIn Vitro... 74
14. Sidik Ragam TD-J2terhadap Panjang Akar Kultur NilamIn Vitro... 75
15. Sidik Ragam TD-J7terhadap Jumlah Tunas Kultur NilamIn Vitro... 76
16. Sidik Ragam TD-J7terhadap Jumlah Buku Kultur NilamIn Vitro... 77
17. Sidik Ragam TD-J7terhadap Jumlah Daun Kultur NilamIn Vitro... 78
18. Sidik Ragam TD-J7terhadap Tinggi Tunas Kultur NilamIn Vitro... 79
19. Sidik Ragam TD-J7terhadap Jumlah Kalus Kultur NilamIn Vitro... 80
20. Sidik Ragam TD-J7terhadap Jumlah Akar Kultur NilamIn Vitro... 81
21. Sidik Ragam TD-J7terhadap Panjang Akar Kultur NilamIn Vitro... 82
22. Sidik Ragam TD-J10terhadap Jumlah Tunas Kultur NilamIn Vitro... 83
23. Sidik Ragam TD-J10terhadap Jumlah Buku Kultur NilamIn Vitro... 84
24. Sidik Ragam TD-J10terhadap Jumlah Daun Kultur NilamIn Vitro... 85
25. Sidik Ragam TD-J10terhadap Tinggi Tunas Kultur NilamIn Vitro... 86
26. Sidik Ragam TD-J10terhadap Jumlah Kalus Kultur NilamIn Vitro... 87
27. Sidik Ragam TD-J10terhadap Jumlah Akar Kultur NilamIn Vitro... 88
Latar Belakang
Pasar dunia saat ini membutuhkan rata-rata 1500 ton minyak nilam setiap tahun. Permintaan dunia ini cenderung terus meningkat, sedangkan produksi yang tersedia belum mampu memenuhinya. Secara keseluruhan, Indonesia memasok sekitar 90% kebutuhan minyak nilam dunia (Direktorat Neraca Produksi BPS 2002 dalam Anonim 2010). Rendahnya jumlah pasokan minyak nilam indonesia salah satunya disebabkan oleh keterbatasan pasokan bibit tanaman nilam yang bermutu baik.
Petani di Kabupaten Garut misalnya, mereka tidak bisa mendapatkan bibit tanaman nilam bermutu baik dalam jumlah yang cukup karena suplai dari koperasi yang terbatas. Koperasi Agro Nilam Jawa Barat yang menjalankan pola inti plasma dengan petani nilam di Kabupaten Garut ini hanya mampu menghasilkan 50.000 bibit pada satu musim tanam, sedangkan permintaan petani mencapai 100.000 polibag bibit (Agronilam 2010). Maka dari itu diperlukan teknologi alternatif dalam perbanyakan bibit tanaman nilam ini sehingga dihasilkan bibit dalam jumlah besar dalam waktu yang relatif singkat serta bermutu baik.
Gunawan (1988) mengemukakan bahwa kultur jaringan atau kultur in vitro diakui sebagai metode perbanyakan tanaman yang dapat memproduksi tanaman dalam jumlah besar dalam waktu yang singkat yang menjadikan teknologi ini efisien digunakan dalam mengatasi masalah keterbatasan bibit. Penerapan teknologi kulturin vitrodalam perbanyakan tanaman ini telah berhasil dilakukan oleh negara-negara Amerika, Eropa dan Jepang sejak tahun 1970 (Wattimena 1991).
2
Di Indonesia, teknologi kulturin vitro ini terbukti efektif dalam penyediaan bibit tanaman pisang dan rami (Hutami dan Ragapadmi 2003).
Perbanyakan bibit tanaman nilam dalam kultur in vitro dapat berhasil dengan adanya Zat Pengatur Tumbuh (ZPT) yang digunakan untuk mengarahkan pertumbuhan tanaman sesuai dengan tujuan. Benzyl Amino Purine (BAP) merupakan ZPT yang biasa digunakan untuk tujuan multuplikasi tunas tanaman nilam dalam kulturin vitro. Jenis ZPT lainnya yang biasa digunakan dalam kultur in vitro nilam adalah NAA (Naphtalene Acetic Acid) dan IAA (Indole Acetic Acid) untuk menginduksi perakaran tanaman nilam. Jenis ZPT BAP, NAA, dan IAA ini merupakan senyawa sintetik yang dibuat oleh ahli kimia. Senyawa ini dibuat menyerupai hormon pertumbuhan di alam baik struktur maupun fungsinya pada tanaman.
Senyawa sintetik ini di pasarkan dengan harga yang relatif mahal. Harga lima gram BAP adalah Rp.1.126.000,00., harga lima gram IAA adalah Rp.307.000,00., dan harga 25 gram NAA adalah Rp.307.000,00., (PT. Intralab ekatama 2007). Maka dari itu diperlukan alternatif pengganti ZPT sintetik tersebut yang lebih ekonomis, lebih mudah terurai di alam, serta memiliki manfaat yang minimal sama atau lebih baik dibandingkan ZPT sintetik yang sudah ada.
Penelitian mengenai mikroba telah banyak dilakukan, demikian pula dengan bakteri Methylobacterium spp. telah banyak diteliti. Ivanova, Doronina, dan Trotsenko (2001) mengemukakan bahwa bakteri Methylobacterium spp. menghasilkan hormon pertumbuhan yang diketahui dapat memacu pertumbuhan tanaman. Hormon pertumbuhan yang dihasilkan oleh Methylobacterium spp. adalah sitokinintrans-zeatin, dan auksin Indole Acetic Acid(IAA) (Lidstrom dan Chistoserdova 2002). Koopmann dan Kutschera (2005) melaporkan bahwa Methylobacterium spp. dapat meningkatkan jumlah tunas dan jumlah akar tanaman bunga matahari dalam kulturin vitro.
tinggi terhadap ZPT golongan auksin ataupun sitokinin (Tasma dan Hidayat 1988) sehingga cocok digunakan sebagai objek untuk menguji kemampuan Methylobacterium spp. dalam memacu pertumbuhan tanaman dalam kultur in vitro.
Media kontrol yang digunakan adalah media MS+IAA 0,1 mg/l, MS+NAA 0,1 mg/l, MS+BAP 0,1 mg/l serta media AMS (Ammonium Mineral Salt) yaitu media yang biasa dipakai untuk perbanyakan atau inokulasi Methylobacteriumspp.
Tujuan
Penelitian ini bertujuan untuk mengetahui pengaruh isolat bakteri Methylobacterium spp. strain TD-L2, TD-J2 dan TD-J7, dan TD-J10 terhadap
pertumbuhan bibit tanaman nilam (Pogostemon cablin Benth.) dalam kultur in vitro, serta untuk mendapatkan strain yang dapat digunakan untuk multiplikasi tunas dan induksi akar tanaman nilamin vitro.
Hipotesis
1. Terdapat satu teknik sterilisasi yang tepat untuk pemanfaatan Methylobacteriumspp. dalam kulturin vitro.
TINJAUAN PUSTAKA
Nilam dan Lingkungan Tumbuhnya
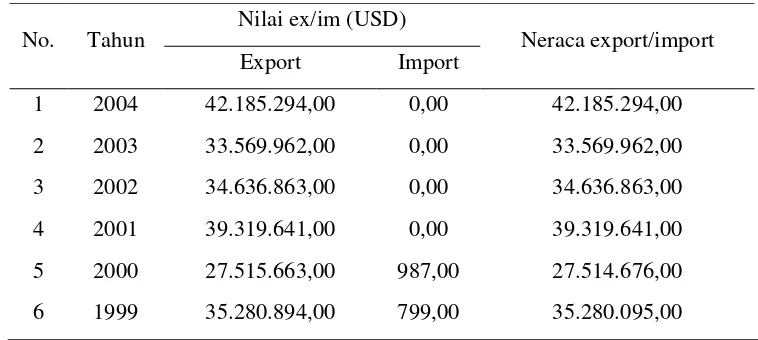
Nilam (Pogostemon cablin Benth.) merupakan penghasil minyak atsiri yang potensial dikembangkan di Indonesia. Indonesia merupakan pemasok utama minyak nilam di pasar dunia. Sitohang (2008) mengatakan bahwa dalam perdagangan minyak atsiri dunia, mutu minyak nilam Indonesia dikenal paling baik. Satriana (2008) mengemukakan bahwa Indonesia memasok 70% – 90% kebutuhan minyak nilam dunia setiap tahunnya. Satriana mengemukakan pula bahwa ekspor minyak nilam Indonesia cenderung terus meningkat, dengan laju peningkatan sebesar 6% per tahun atau sekitar 700 ton sampai 2000 ton minyak nilam per tahun.
Puteh (2004) dan Krismawati (2005) mengatakan bahwa hingga saat ini belum ada produk apapun baik alami maupun sintetik yang dapat menggantikan minyak nilam dalam posisinya sebagai senyawa fixatif (pengikat bau) dalam industri parfum dan kosmetika. Kondisi inilah yang menyebabkan permintaan dunia terhadap minyak nilam terus meningkat. Data peningkatan jumlah ekspor minyak nilam Indonesia pada tahun 1999 sampai 2004 disajikan pada Tabel 1.
Tabel 1. Volume ekspor/impor minyak nilam Indonesia tahun 1999-2004
No. Tahun Nilai ex/im (USD) Neraca export/import Export Import
1 2004 42.185.294,00 0,00 42.185.294,00 2 2003 33.569.962,00 0,00 33.569.962,00 3 2002 34.636.863,00 0,00 34.636.863,00 4 2001 39.319.641,00 0,00 39.319.641,00 5 2000 27.515.663,00 987,00 27.514.676,00 6 1999 35.280.894,00 799,00 35.280.095,00 Sumber : Dewan Atsiri Indonesia (Webmaster 2009) .
dan Nuryani (2006) mengatakan bahwa pada tahun 2006 meningkat menjadi 21,602 ha. Peningkatan luas areal penanaman nilam ini memungkinkan Indonesia untuk semakin meningkatkan jumlah eksport minyak nilam pada tahun-tahun berikutnya.
Faktanya di lapangan, meskipun terjadi peningkatan luas areal penanaman, produktivitas daun kering nilam Indonesia hanya dua sampai tiga ton per hektar per tahun (Satriana 2008). Satriana (2008) juga mengemukakan bahwa banyak faktor yang menyebabkan rendahnya produksi dan mutu minyak nilam Indonesia antara lain masalah teknologi, budidaya yang tidak intensif, bibit yang kurang baik, serta cara penanganan bahan baku dan penyulingan yang kurang baik.
Harga jual minyak nilam dipasar dunia mencapai US $1.000 per kg pada tahun 2008 (Hambociek 2008). Bahkan menurut Zuhri (2010) mengemukakan bahwa harga minyak nilam tertinggi pada tahun 2008 mencapai Rp.1,2 juta per kg. Pada tahun 2010 mengalami penurunan harga sampai Rp.350.000,00. per kg. Hal ini terjadi karena pada tahun 2010 sudah semakin banyak petani yang menanam nilam. Meskipun terjadi penurunan harga, Suwandi, Manajer Pemasaran PT Djasula Wangi dalam Zuhri (2010) menilai bahwa harga minyak atsiri termasuk minyak nilam dan turunannya masih cenderung naik pada 5 tahun terakhir dibandingan tahun-tahun sebelumnya. Penurunan harga minyak nilam ini dapat diminimalisir dengan ditunjang oleh manajemen agribisnis yang baik.
Tanaman nilam merupakan tanaman semak penghasil minyak atsiri. Minyak atsiri yang disuling dari tanaman nilam ini dinamakan minyak nilam. Komponen utama minyak nilam berupa patchoully alcohol (45-50%),patchoully camphor, eugenol, aldehida,dan ester-ester yang memberi bau khas pada minyak nilam (Burkill 1935 dalam Dzalimi, Anggraeni, dan Hobir 1998). Nagasampagi (2001) menambahkan bahwa selain yang disebutkan oleh Burkill, terdapat beberapa komponen lain dalam minyak nilam seperti A-Bulnesene, A-Guaiene, Seychelene, A-Patchoulene, B-Patchoulene, Pogostol, Δ -candinene,
6
Tanaman nilam memiliki banyak manfaat diantaranya di India, daun nilam yang telah dikeringkan digunakan sebagai pewangi selendang, diletakkan diantara pakaian, di dalam bantal, atau kasur agar berbau harum (Soepadio dan Tan 1978). Kalshoven (1981) melaporkan bahwa minyak nilam dapat menghambat aktivitas peneluran Callobrucheus sp. serangga yang menginvestasi tanaman polong di lapangan dan biji kering di tempat penyimpanan. Daun nilam juga biasa digunakan sebagai bahan pewangi karpet, tinta, pakaian dan rambut. Seiring dengan berkembangnya industri parfum, selain digunakan sebagai bahan baku pembuatan parfum (minyak wangi), minyak nilam juga digunakan sebagai bahan pengikat bau (fiksatif) bahan pewangi lain, sehingga bau harum parfum tersebut dapat bertahan lama (Tasma dan Hidayat 1988).
Minyak nilam mampu menekan populasi hama ketumbar Stegobium paniceumsebesar 25% - 42% selama 9 hari penyimpanan. Tepung daun nilam dan campuran minyak nilam, serbuk gergaji, dan dekstrin dalam bentuk pelet dapat mengusir kumbang jagung Sitophilus zeamays (Mardiningsih 1994). Patchoully alcohol, pogostol, dan pogoston menunjukkan aktivitas anti mikroba terhadap bakteri dan fungi periodontopatik (Van 2001).
Minyak nilam dapat digunakan sebagai bahan antiseptik, antijamur, antijerawat, obat eksem dan kulit pecah-pecah serta ketombe, juga dapat mengurangi peradangan. Minyak nilam membantu mengurangi kegelisahan dan depresi, atau membantu penderita insomnia (gangguan susah tidur), sering dipakai untuk bahan aroma terapi, serta bersifat afrodisiak (Alwy 2007), nilam juga digunakan sebagai pengusir lipas, nyamuk, lalat dan tikus (Webmaster 2008a).
Akan tetapi di Indonesia jenis ini tidak pernah berbunga (Dzalimi et al. 1998), sehingga tidak dapat diperoleh varietas baru melalui persilangan (Lestari 2008).
Di Indonesia, terdapat tiga jenis nilam yang dibudidayakan oleh petani, yaitu nilam Aceh (Pogostemon cablin Benth. Syn.P. patchouly Pellet. varsauvis Hook.), nilam Jawa (P. heyneanusBenth.), dan nilam kembang atau nilam sabun (P. hortensis Backer.) (Soepadio dan Tan 1978). Nilam Aceh (P. cablinBenth.) adalah jenis yang paling banyak dibudidayakan dibandingkan dua jenis lainnya karena hasil minyaknya yang tinggi (Hayati 1992) yaitu 2,5% - 5% (Krismawati 2005; Alwy 2007). Nilam Jawa memiliki kadar minyak 0,5% - 1,5% (Alwy 2007) dan berkualitas rendah, namun tetap diusahakan karena jenis nilam ini resisten terhadap nematoda (Santoso 2007).
Tanaman nilam Aceh berasal dari Filipina yang bahasa lokalnya menurut Reglos dalam Kadir (2007) disebut “Kabling”, masuk ke Indonesia melalui Singapura pada tahun 1895 (Burkill 1935 dalam Dzalimi et al. 1998), dan dinamakan Dilem Singapur untuk membedakannya dengan nilam Jawa (P. heyneanusdan P. hortensis) yang telah dikenal lebih dulu. Nilam Aceh ini telah dibudidayakan sejak tahun 1906 di daerah Tapak Tuan dan sejak 1909 telah menyebar ke pantai Timur Sumatera (Heyne 1927 dalam Dzalimi et al. 1998). Sampai sekarang jenis ini merupakan jenis yang paling banyak dibudidayakan dan dikenal dengan nama nilam Aceh.
Tanaman nilam ditemukan tumbuh secara liar di Filipina terutama di daerah dengan ketinggian 1000-2000 meter di atas permukaan laut (mdpl) (Lionnet 1962dalamHayati 1992), sedangkan di Indonesia, terutama di Sumatera Utara nilam dibudidayakan pada dataran rendah hingga pegunungan dengan ketinggian 1500 mdpl. Tanaman nilam dapat tumbuh dengan baik pada ketinggian 600 mdpl meskipun pertumbuhannya agak lambat. Nilam tumbuh dan berproduksi dengan baik pada ketinggian optimum 400 mdpl.
8
Agar dapat tumbuh dengan optimal tanaman nilam membutuhkan curah hujan 3000 mm tiap tahun dengan penyebaran yang merata sepanjang tahun. Bulan kering/curah hujan < 60 meter/bulan tidak lebih dari tiga bulan tiap tahun (Nuryani 2007). Werkhoven (1968) dalam Hayati (1992) mengemukakan bahwa membudidayakan nilam masih mungkin dilakukan pada daerah yang bercurah hujan rendah seperti yang terjadi di Seychelles (1750-2500 mm setiap tahunnya), tetapi pada kondisi ini diperlukan naungan dan mulsa.
Suhu udara antara 24–280C dengan kelembaban relatif yang tinggi (di atas 75%) (Rosman, Emmyzar, dan Pasril 1998). Nilam dapat tumbuh pada berbagai tipe tanah, akan tetapi pertumbuhan optimalnya pada tanah yang kaya humus, subur dan berdrainase baik (Werkhoven 1968 dalam Hayati 1992). Walaupun tanaman ini membutuhkan banyak air, namun tidak tahan genangan air (Hayati 1992), karena pada kondisi ini (permukaan air tanah dangkal dan tergenang) tanaman mudah terserang penyakit busuk akar yang disebabkan oleh cendawan Phytophthora sp. (Mansur dan Tasma 1987). Kriteria kesesuaian lahan dan iklim untuk lingkungan tumbuh tanaman nilam disajikan pada Lampiran 2.
Penyinaran matahari langsung menyebabkan pertumbuhan tanaman nilam kurang subur dengan daun-daun yang lebih sempit dan lebih tebal serta warna daun hijau agak kekuningan dan sedikit merah namun kadar minyaknya lebih tinggi. Apabila tanaman ternaungi maka pertumbuhannya terlihat lebih subur dengan daun-daun yang lebat, lebih tipis dengan warna daun hijau muda. Tanaman ini umumnya menunjukkan kadar minyak yang lebih rendah bila dibandingkan dengan tanaman yang tidak ternaungi. Tanaman nilam akan berproduksi dengan baik pada intensitas radiasi surya 75% – 100% (Rosmanet al. 1998).
Methylobacteriumspp.
Methylobacterium spp. anggota kingdom Bacteria, phylum Proteobacteria, kelas Alpha Proteobacteria, ordo Rhizobiales, family Methylobacteriaceae, genus Methylobacterium ini memiliki sekitar 24 species yang telah diketahui, diantaranya M. Adhaesivum, M. Aminovorans, M. Aquaticum, M. Chloromethanicum, M. Dichloromethanicum, M. Extorquens, M.
Fujisawaense, M. Hispanicum, M. Isbiliense, M. Jeotgali, M. Lusitanum, M.
Mesophilicum, M. Nodulans, M. Organophilum, M. Oryzae, M. Podarium, M.
Populi, M. Radiotolerans, M. Rhodesianum, M. Rhodinum, M. Suomiense, M.
Thiocyanatum, M. Variabile, M. Zatmanii(Webmaster 2008b).
Methylobacterium spp. merupakan bakteri obligat aerobik (Eller dan Frenzel 2001), bersifat non-motil, berbentuk batang (Eller dan Frenzel 2001, Lidstrom dan Chistoserdova 2002), tepi koloni licin, elevasi cembung, dan memiliki konsistensi lengket (Riupassa 2003), yaitu lendir yang diekresikan bakteri kepada lingkungannya yang berperan sebagai matriks dan menyangga lingkungan sekitarnya akibat cekaman kekeringan.
Bakteri yang membentuk agregat seperti ini lebih bertahan hidup pada cekaman kekeringan dibandingkan bakteri yang hidup soliter (Lindow dan Brandl 2003), gram-negatif, bersifat non-sporulating, resistan pada kekeringan,freezing, cholirine, radiasi ion dan ultraviolet (UV), dan suhu ekstrim (Trotsenko 2001 in Aken, Peres, Doty, Yoon, dan Schnoor 2004a). Methylobacterium spp. membentuk lapisan/mat yang menyatu dengan kuat pada permukaan minyak dan atau air (White 2006). Masih menurut White (2006) bahwa lapisan/mat/film ini kaya akan nitrogen.
Methylobacterium spp. hidup baik pada suhu kamar 280C (Holland dan Polacco 1992). Green (1992) in Aken, Yoon, dan Schnoor (2004b) memiliki pendapat sendiri yaitu bahwa bakteri ini biasanya tumbuh baik pada suhu sekitar 300C dalam media kultur cawan di laboratorium. Methylobacterium spp. dapat tumbuh pada suhu 50C - 300C, namun pada umumnya strainMethylobacterium spp. tumbuh baik pada suhu kisaran 300C.
10
dihasilkan stomata tanaman akibat dari adanya aktivitas enzim methanol dehydrogenase (Salma, Suwanto, Tjahjoleksono, dan Meryandini 2005) dan methilamina(CH3NH2) serta senyawa karbon majemuk C2, C3, dan C4(Lidstrom
dan Chistoserdova 2002). Selain itu, bakteri ini dapat tumbuh pada senyawa methanethiol dan dimethylsulphide (Anesti, Vohra, Goonetillaka, McDonald, Straubler, Stackebrandt, Kelly, dan Wood 2004).Methylobacteriumspp. tumbuh lambat, kira-kira 3 hari baru mulai terlihat penggandaannya dan butuh sekitar 7 hari untuk mencapai ukuran maksimumnya 0,8 - 1,0 x 1,0 - 10,0 µm (Anestiet al. 2004).
Lidstrom dan Chistoserdova (2002) mengemukakan bahwa karena Methylobacterium spp. ini memiliki pigmen pink, yaitu karotenoid (Riupassa 2003) maka bakteri ini diberi nama PPFMs (Pink-Pigmented Facultative Methylotrophs). Adanya pigmen merupakan salah satu cara bakteri untuk beradaptasi pada lingkungan yang terpapar sinar UV (Sundin dan Jacobs 1999).
Methylobacterium spp. banyak ditemukan pada tanah, permukaan daun berbagai jenis tanaman, seluruh bagian tanaman (Lidstrom dan Chistoserdova 2002; Salma et al. 2005), lumut dan paku-pakuan (Salma et al. 2005) dan air (Gallego, Teresa, dan Ventosa 2005), serta ditemukan pada debu dan endapan sediman di danau (Sy, Timmers, Knief, dan Vorholt 2005) bahkan White (2006) melaporkan bahwa Methylobacterium khususnya M. thiocyanatum telah berhasil di isolasi dari lidah, gusi dan plak gigi manusia.
Ismail (2002) melaporkan bahwa keberadaanMethylobacterium spp. pada filosfer sejumlah tanaman tropis di Indonesia cukup tinggi yaitu berkisar 105 cfu/gram daun. Riupassa (2003) melaporkan bahwa jumlah bakteri ini pada daun poh-pohan adalah 6,52 x 104cfu/gram daun, 4,44 x 104cfu/gram daun pada daun kemangi, dan 8,75 x 102cfu/gram daun pada kecambah taoge.
memacu perkecambahan benih. Lee, Madhaiyan, Kim, Choi, Chung, dan Sa (2006) melaporkan bahwa Methylobacterium spp. mampu meningkatkan perkecambahan benih, indeks vigor benih, dan meningkatkan biomassa. Benih padi yang diberi perlakuan Methylobacterium spp. menunjukkan kadar hormon tanaman viz trans-zeatin riboside, isopentenyladenosine, dan IAA yang lebih tinggi dibandingkan dengan benih yang tanpa perlakuan bakteri ini (Lee et al. 2006). Hormon tanaman ini diketahui berguna sebagai (immune) bagi tanaman. Dua strain Methylobacterium (Q4 dan Q5) signifikan (P≤0,05) dapat meningkatkan pertumbuhan dan perkembangan dua kultivar padi Japonica cv. CR76 dan Indica cv. A301 yang dikulturkan secarain vitropada media MS tanpa penambahan hormon pertumbuhan (Lee et al. 2006). Hal ini dikarenakan auksin dan sitokinin yang ditambahkan oleh dua strain Methylobacterium Q4 dan Q5. Benih kacang tanah yang diimbibisi dengan Methylobacterium spp. dapat meningkatkan daya berkecambah sampai 19,5% dibandingkan dengan kontrol.
Methylobacterium spp. memproduksi pyrroloquinoline quinon (PQQ) dengan karakteristik sebagai antioksidan (He, Nukada, Urakami, dan Murphy 2003). PQQ adalah suatu gugus prostetik (koenzim) darimethanol dehidrogenase. Pada bakteri methylotroph, perombakan methanol dan methylamina menjadi formaldehida (CH2O) memerlukan enzim methanol dehidrogenase dan
methylamina dehidrogenase(Riupassa 2003). Heet al.(2003) melaporkan bahwa PQQ dapat menurunkan kematian sel karena perannya sebagai antioksidan.
Methylobacteriumspp. juga dapat menghasilkan enzim urease, enzim yang berperan dalam metabolisme nitrogen (Riupassa 2003), memacu pertumbuhan dan morfologi akar, menginduksi tanaman resistan secara sistemik, menggunakan 1-aminoCyclopropane 1-carboxylate (ACC) sebagai sumber nitrogen dan memproduksi ACC deaminase (Munusamy 2007; White 2006). Lemus, Lucas, Girard, dan Mellado (2009) melaporkan bahwa ACC deaminse yang dihasilkan oleh Burkholderia sp. dapat mempengaruhi level etilen serta memiliki peran penting dalam meningkatkan pertumbuhan tanaman tomat.
12
formyltransferase/hydrolase complex (Fhc) (Pomper, Saurel, Milon, dan Vorholt 2002), methanol dehydrogenase (Williams, Coates, Mohammed, Gill, Erskine, Coker, Wood, Anthony, dan Cooper 2004), serta enzim dehalogenase sehingga dapat mendegradasi herbisida Dalapon (2,2-dichloropropionate) dengan cara menghilangkan halogen (Jing, Taha, Pakingking, Wahab, dan Huyop 2008).
Methylobacterium spp. ini juga berperan dalam pembentukkan rasa dan aroma pada buah stroberi yaitu sebagai dampak dari simbiosis antaraphenomenon yang dihasilkan oleh Methylobacterium extorquens dengan sel tanaman stroberi, dan sebagai endosimbion dengan sel-sel tunas pada Pinus-sylvestris (Pirttila, Laukkanen, Pospiech, Myllyla, dan Hohtola 2000). Ia juga bersimbiosis dengan legume dalam memfiksasi nitrogen pada nodul,Methylobacteriumspp. dapat pula berasosiasi dengan Rhizobia dan Agrobacterium (Lidstrom dan Chistoserdova 2002).
Tanaman-tanaman yang dilaporkan dapat berasosiasi dengan Methylobacterium spp. diantaranya Catharanthus roseus (Madagaskar periwinkle) dan Nicotiana clevelandii (Clevelands tobacco), dan para peneliti menggunakan kedua tanaman ini sebagai tanaman model untuk mempelajari interaksi yang terjalin antara Methylobacterium spp. dan Xylella fastidiosa (Andreote, Lacava, Gai, Araujo, Maccheroni, Van Overbeek, van Elsas, dan Azevedo 2006). Xylella fastidiosa menyebabkan penyakitpearce pada strowbery dengan gejala penurunan produksi dan berakhir dengan kematian tanaman. Methylobacterium spp. bersimbiosis dengan tanaman yaitu dengan memproduksi vitamin B12 yang dapat memacu perkembangan tanaman, disamping dengan
memproduksi hormon tanaman sitokinin dan IAA, sebagaimana banyak dilaporkan sebelumnya (Syet al.2005).
Methylobacterium spp. dapat mendegradasi zat-zat racun seperti TNT (2,4,6-trinitrotoluene), RDX (hexahydro-1,3,5-trinitro-1,3,5-triazene), dan 0Ctahydro-1,3,5,7-tetranitro-1,3,5, HMX (tetraz0Cine) (Aken et al. 2004b). Methylobacterium spp. merupakan mikroba CH4-oksida yang dapat mengurangi
emisi CH4 global (White 2006). Vannelli, Studer, Kertesz, dan Leisinger (1998)
(CH2Cl2) merupakan limbah industri yang dibuang ke lingkungan dan bersifat
toksik terhadap mamalia (Riupassa 2003).
Proses degradasi ini, DCM terlebih dulu diubah menjadi asam diklorik dan formaldehida, yaitu produk intermediet methylotroph (Kayser, Curum dan Vuilleumier 2002). Salma et al. (2005) menjelaskan bahwa Methylobacterium spp. melakukan fiksasi CO2yang memiliki peranan penting bagi siklus karbon di
alam, menambat N2tanpa bersimbiosis atau berasosiasi dengan tanaman tertentu
serta pelaku biodegradasi senyawa aromatik.
PenggunaanMethylobacteriumspp. dikombinasikan denganRhizobiumsp. akan lebih signifikan dapat meningkatkan pertumbuhan tanaman, nodulasi, dan meningkatkan persentase hasil panen jika dibandingkan dengan penggunaan Methylobacteriumspp. danRhizobium secara terpisah. ApabilaMethylobacterium spp. di inokulasikan pada kacang tanah, kemudian kacang tanah tersebut di infeksikan Aspergillus niger atau Sclerotium rolfsii, maka 24 sampai 72 jam kemudian terjadi peningkatan aktivitas enzim peroksidase (PO), phenylalanine ammonia lyase (PAL), dan β-1-3-glucanase secara konstan. Madhaiyan, Suresh, Anandham, Senthilkumar, Poonguzhali, dan Sundaram (2006a) melaporkan hasil penelitiannya bahwa benih kacang tanah yang di imbibisi dengan Methylobacterium spp. dapat meningkatkan perkecambahan sebesar 19,5% dibanding kontrol.
Perbanyakan Tanaman dengan Kultur Jaringan
14
Kultur jaringan pada tanaman nilam sudah banyak dilakukan. Mapriti (1997) melakukan penelitian untuk mempelajari pertumbuhan terbaik stek mikro nilam pada media yang diperkaya dengan triptofan dan GA3. Hasil penelitian
tersebut menyatakan bahwa pertumbuhan terbaik dicapai pada pemberian 1-2 mg/l GA3 dengan 20-30 mg/l triptofan. Hayati (1992) menyatakan hasil penelitiannya
pada kultur meristem nilam bahwa media MS yang diberi BA 0,5-1 mg/l menghasilkan faktor multiplikasi yang tinggi, sedangkan pada eksplan yang berbeda yaitu batang satu buku, Mapriti (1997) mendapatkan hasil terbaik dari media yang ditambah BA 0,1 mg/l dan asam fulvat 200 mg/l. Beliau juga mengemukakan bahwa untuk mempercepat waktu inisiasi tunas dan akar dapat dilakukan dengan menambahkan humic acid 40 mg/l ke dalam media pertumbuhan.
Penelitian untuk tujuan memperluas keragaman genetik tanaman nilam juga telah dilakukan. Mariska, Suwarno, dan Damardjati (1996) menggunakan colchicin untuk meningkatkan keragaman genetik nilam. Hasil penelitian menunjukkan adanya variasi pada penampakan kultur pada tiap perlakuan. Keragaman yang sangat menonjol berasal dari perlakuan perendaman dalam colchicin0,5% dan 1% selama 1 hari, kultur tampak lebih tegar, daun lebih hijau, agak menggulung, dan tulang daun menonjol. Penelitian lain yang dilakukan Seswita, Mariska, dan Gati (1996) dengan meradiasi kalus nilam pada berbagai tingkatan umur dengan sinar gamma 0, 10, 20, 30 Gy. Dari perlakuan radiasi sinar gamma 10 Gy terhadap kalus berumur 6 bulan dihasilkan tunas chimera yang multiplikasinya paling baik pada media MS tanpa ZPT dan kinetin 0,1 mg/l.
Zat Pengatur Tumbuh
Zat pengatur tumbuh (ZPT) adalah senyawa organik yang berfungsi merangsang pertumbuhan tanaman. ZPT digunakan untuk mengarahkan pertumbuhan eksplan dalam kultur in vitro. George dan Sherington (1984) membedakan istilah zat pengatur tumbuh tanaman (plant growth regulator) dari hormon pertumbuhan (plant growth substanceatauplant hormones).
Hormon pertumbuhan merupakan senyawa-senyawa aktif dalam konsentrasi rendah yang muncul secara alami dalam jaringan tanaman dan berfungsi sebagai pengatur tumbuh, sedangkan ZPT merupakan bahan kimia sintetik yang memiliki pengaruh yang sama dengan hormon pertumbuhan yang ditambahkan untuk mengubah dan atau mengatur level hormon pertumbuhan dalam tanaman sehingga dapat memanipulasi pertumbuhan dan perkembangan tanaman.
Dua golongan ZPT yang sangat penting yang dikenal dalam kultur jaringan yaitu sitokinin dan auksin. Zat pengatur tumbuh ini mempengaruhi pertumbuhan dan morfogenesis dalam kultur sel, jaringan, dan organ. Interaksi dan perimbangan antara zat pengatur tumbuh yang diberikan dalam media dan yang diproduksi oleh sel secara endogen, menentukan arah pertumbuhan dan perkembangan suatu kultur. Penambahan auksin dan sitokinin eksogen, mengubah level zat pengatur tumbuh endogen sel. Level zat pengatur tumbuh endogen ini kemudian menjadi trigerring factor untuk proses-proses pertumbuhan dan morfogenesis.
Auksin
16
berperan dalam pembuatan komponen sel. Prosesnya yaitu setelah terjadi pembesaran sel, keutuhan dinding sel terganggu (retak). Auksin mengaktifkan pembuatan komponen-komponen dinding sel dan menyusun kembali ke dalam suatu matriks dinding sel yang utuh.
Beberapa jenis auksin yang biasa digunakan dalam kultur jaringan adalah IAA (Indole Acetic Acid), NAA (Naphtalene Acetic Acid), 2,4-D (2,4,-Dichlorophenoxy Acetic Acid), IBA (Indole Butyric Acid), NOA (Naphtoxy Acetic Acid), 4-CPA (4-Chlorophenoxy Acetic Acid), 2,4-5,T (2,4-5-Trichloro Acetic Acid), Dicamba (3,6-Dichloro Anisic Acid), Picloram (4-Amino-3,5,6 Trichloro Picolonic Acid), dan IAA konjugat (IAA-L-alanin, IAA-Glycine).
Tasma dan Hidayat (1988) melaporkan bahwa pemberian 0,25% auksin dan sitokinin terhadap tanaman nilam dapat memberikan hasil yang lebih baik terhadap seluruh komponen pertumbuhan tanaman, yang meliputi tinggi, jumlah daun, berat basah dan berat kering daun, cabang dan akar dibandingkan dengan perlakuan zat tumbuh lainnya. Lestari, Dwi, dan Eny, (2007) melaporkan bahwa asam indol asetat atauIndol Acetic Acid(IAA) yang diekresikanAzospirillum sp. dan diinokulasikan terhadap padi secara in vitro mampu mempercepat perkembangan akar lateral dan merangsang kerapatan dan panjang rambut akar, yang pada akhirnya menyebabkan peningkatan serapan hara pada tanaman.
Sitokinin
Sitokinin merupakan zat pengatur tumbuh yang berperan dalam semua fase perkembangan tanaman, dari mulai pembelahan dan pembesaran sel sampai pembentukan bunga dan buah. Lebih jauh lagi George dan Sherington (1984) serta Wattimena (1988) menyebutkan bahwa sitokinin berfungsi dalam menginduksi pembelahan sel, mendorong proliferasi tunas dan diferensiasi tunas vegetatif dari kalus dan organ, serta sintesa protein. Konsentrasi sitokinin yang memungkinkan untuk proliferasi tunas dapat menghambat inisiasi dan pertumbuhan akar.
kecepatan pembuatan RNA (tRNA, rRNA, dan mRNA), kemungkinan dengan meningkatkan enzimchromatin boundRNApolymerase. Kedua, sitokinin bekerja pasca transkripsi dengan mendorong pembentukanpolisomdan atau mengaktifkan polisom sedemikian rupa sehingga mengaktifkan mRNA yang tidak ditranslasi (Wattimena 1991).
Sitokinin merupakan turunan dari adenin (Moore 1979). Jenis sitokinin yang biasa digunakan dalam kultur jaringan adalah Kinetin (6-furfuryl amino purine), Zeatin (4-hydroxyl-3-methyl-trans-2-butenyl amino purine), 2iP, BAP ( 6-Benzyl Amino Purine), Thidiazuron, dan lain-lain. Zeatin adalah sitokinin endogen yang juga dapat dibuat secara sintetik. BAP merupakan sitokinin yang paling banyak digunakan dalam kultur jaringan (Zaerr dan Mapes 1982; Hu dan Wang 1983). Hal ini disebabkan BAP lebih stabil, lebih murah, segera tersedia dan paling efektif digunakan dibandingkan jenis sitokinin lainnya.
BAHAN DAN METODE
Waktu dan Tempat
Penelitian dilakukan di Laboratorium Biologi Sel dan Jaringan (BSJ) dan Laboratorium Mikrobiologi Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumberdaya Genetik Pertanian (BB-Biogen), Cimanggu, Bogor. Penelitian dilaksanakan pada Februari 2008 - November 2008.
Bahan dan Alat
Bahan yang digunakan adalah 1) tanaman nilam Aceh (Pogostemon cablin, Benth.), 2) isolatMethylobacterium spp. strain TD-L2, TD-J2,TD-J7, dan
TD-J10. TD-L2 adalah isolat no 2 yang diisolasi dari filosfer daun tanaman Labu
siam dari Kecamatan Teluk Dalam Kabupaten Tenggarong, Kutai Kertanegara, Kalimantan Timur. TD-J2 adalah isolat no 2 yang diisolasi dari filosfer daun
tanaman Jagung dari Kecamatan Teluk Dalam Kabupaten Tenggarong, Kutai Kertanegara, Kalimantan Timur. TD-J7 adalah isolat no 7 yang diisolasi dari
filosfer daun tanaman Jagung dari Kecamatan Teluk Dalam Kabupaten Tenggarong, Kutai Kertanegara, Kalimantan Timur. TD-J10 adalah isolat no 10
yang diisolasi dari filosfer daun tanaman Jagung dari Kecamatan Teluk Dalam Kabupaten Tenggarong, Kutai Kertanegara, Kalimantan Timur., 3) media
Murrashige & Skoog (MS) yaitu media yang banyak digunakan dalam kultur in vitro. Komposisi media MS disajikan pada Lampiran 3., 4) media Amonium Mineral Salt (AMS) yaitu media yang biasa digunakan untuk perbanyakan Methylobacteriumspp. Komposisi media AMS disajikan pada Lampiran 4.
Metode
Percobaan I. Uji Efektivitas Teknik Sterilisasi Isolat Methylobacterium spp. untuk KulturIn VitroTanaman Nilam
Percobaan I bertujuan untuk menentukan teknik sterilisasi yang efektif digunakan untuk mensterilisasi crude Methylobacterium spp. yang akan dimanfaatkan untuk memacu pertumbuhan bibit tanaman nilam dalam kultur in vitro. Isolat yang digunakan adalah Methylobacterium strain TD-L2 dengan
konsentrasi 0%, 10%, 20%, 30%, 40%, dan 50% (v/v media). Isolat ini selanjutnya di sterilisasi sesuai dengan perlakuan, kemudian diujikan pada bibit tanaman nilam dalam kulturin vitro.
Bibit tanaman nilam yang digunakan pada Percobaan 1 ini adalah eksplan steril koleksi Laboratorium Biologi Sel dan Jaringan (BSJ) BB-Biogen, Cimanggu Bogor. Eksplan ini merupakan hasil mutasi radiasi sinar gamma (γ). Eksplan
mutan ini telah distabilkan dengan cara disubkultur (pindah tanam) secara terus-menerus setiap 3 bulan sekali ke dalam media tanam MS. Eksplan yang digunakan pada percobaan ini berupa batang satu buku sepanjang 2 cm dengan dua daun yang tidak dipotong. Gambar eksplan bibit tanaman nilam yang digunakan pada Percobaan I disajikan pada Lampiran 6.
Percobaan ini menggunakan Rancangan Acak Lengkap (RAL) satu faktor perlakuan. Faktor perlakuan berupa teknik sterilisasi yang terdiri dari 3 taraf. Taraf pertama yaitu sterilisasi menggunakan filter. Taraf ini selanjutnya akan
dinotasikan dengan huruf “F”. Taraf kedua yaitu sterilisasi menggunakan filter kemudian menggunakan otoklaf. Taraf ini selanjutnya akan dinotasikan dengan
huruf “F+O”. Taraf ketiga yaitu sterilisasi hanya menggunakan otoklaf. Taraf ini
selanjutnya akan dinotasikan dengan huruf “O”. Masing-masing perlakuan diulang sebanyak 20 ulangan (20 botol).
20
Model rancangan acak lengkap yang digunakan adalah sebagai berikut: Yij= µ + αi+ εij
Yij = Respon perlakuan faktor media ke-i ulangan ke-j µ = Nilai rataan umum
αi = Pengaruh faktor teknik sterilisasi ke-i (i = 1,2,3,...,6)
εij = Pengaruh galat percobaan oleh faktor perlakuan teknik sterilisasi ke-i ulangan ke-j.
Percobaan II. Pengujian Strain Methylobacterium spp. Penghasil Sitokinin (TD-J2 dan TD-J7) untuk Meningkatkan Multiplikasi Tunas Tanaman Nilam dalam KulturIn Vitro
Percobaan II bertujuan untuk melihat pengaruh Methylobacterium spp. penghasil fitohormon sitokinin trans-zeatin dalam meningkatkan multiplikasi tunas bibit tanaman nilam dalam kultur in vitro. Isolat yang digunakan adalah strain TD-J2dan TD-J7. Isolat ini diujikan pada bibit tanaman nilam dalam kultur
in vitro secara terpisah. Strain TD-J2 disterilisasi menggunakan teknik sterilisasi
menggunakan otoklaf, sedangkan strain TD-J7 disterilisasi menggunakan filter
milipore 0,22 µm karena strain TD-J7 ini akan dibandingkan terhadap media
kontrol zeatin. Zeatin sintetik ini akan mengalami kerusakan jika disterilisasi menggunakan otoklaf, maka dari itu untuk menjaga keseragaman dalam satu set perlakuan, strain TD-J7 disterilisasi menggunakan filter tidak menggunakan
otoklaf.
Bibit tanaman nilam yang digunakan pada percobaan II adalah eksplan steril koleksi Laboratorium Biologi Sel dan Jaringan (BSJ) BB-Biogen, Cimanggu
Bogor. Eksplan ini merupakan hasil mutasi radiasi sinar gamma (γ). Eksplan
mutan ini telah distabilkan dengan cara disubkultur (pindah tanam) secara terus-menerus setiap 3 bulan sekali ke dalam media tanam MS. Eksplan yang digunakan pada percobaan ini berupa batang satu buku sepanjang 2 cm dengan dua daun yang tidak dipotong. Gambar eksplan bibit tanaman nilam yang digunakan pada Percobaan II disajikan pada Lampiran 6. Pengujian strain TD-J2
dinamakan sebagai percobaan IIA, dan pengujian isolat TD-J7dinamakan sebagai
Percobaan IIA menggunakan Rancangan Acak Lengkap (RAL) satu faktor perlakuan. Faktor perlakuan berupa media yang terdiri dari 6 taraf yaitu 1) media MS+0% TD-J2, 2) MS+10% TD-J2, 3) MS+20% TD-J2, 4) MS+30% TD-J2, 5)
MS+0,1 mg/l BAP, dan 6) AMS. Media AMS adalah media Ammonium Mineral Salt, media yang biasa digunakan untuk perbanyakan Methylobacterium spp. Masing-masing perlakuan diulang sebanyak 6 ulangan (6 botol). Masing-masing ulangan terdiri dari 4 eksplan tanaman nilam.
Model rancangan acak lengkap yang digunakan adalah sebagai berikut: Yij= µ + αi+ εij
Yij = Respon perlakuan faktor media ke-i ulangan ke-j µ = Nilai rataan umum
αi = Pengaruh faktor media ke-i (i = 1,2,3,...,6)
εij = Pengaruh galat percobaan oleh faktor perlakuan media ke-i ulangan ke-j Percobaan IIB menggunakan Rancangan Acak Lengkap (RAL) satu faktor perlakuan. Faktor perlakuan berupa media yang terdiri dari 6 taraf yaitu 1) media MS+0% TD-J7,2) MS+10% TD-J7, 3) MS+20% TD-J7, 4) MS+30% TD-J7, 5)
MS+0,1 mg/l Zeatin, dan 6) AMS. Masing-masing perlakuan diulang sebanyak 6 ulangan (6 botol). Masing-masing ulangan terdiri dari 4 eksplan tanaman nilam.
Model rancangan acak lengkap yang digunakan adalah sebagai berikut: Yij= µ + αi+ εij
Yij = Respon perlakuan faktor media ke-i ulangan ke-j µ = Nilai rataan umum
αi = Pengaruh faktor media ke-i (i = 1,2,3,...,6)
εij = Pengaruh galat percobaan oleh faktor perlakuan media ke-i ulangan ke-j
Percobaan III. Pengujian Strain Methylobacterium spp. Penghasil Auksin (TD-J10) untuk Menginduksi Perakaran Tanaman Nilam dalam KulturIn Vitro
Percobaan III bertujuan untuk melihat pengaruh Methylobacterium spp. penghasil auksin IAA dalam menginduksi perakaran bibit tanaman nilam dalam kulturin vitro. Isolat yang digunakan adalah strain TD-J10.Isolat ini diujikan pada
22
pada percobaan II adalah eksplan steril koleksi Laboratorium Biologi Sel dan Jaringan (BSJ) BB-Biogen, Cimanggu Bogor.
Eksplan ini merupakan hasil mutasi radiasi sinar gamma (γ). Eksplan
mutan ini telah distabilkan dengan cara disubkultur (pindah tanam) secara terus-menerus setiap 3 bulan sekali ke dalam media tanam MS. Eksplan yang digunakan pada percobaan ini berupa batang tiga buku sepanjang 4 cm dengan daun yang tidak dipotong. Gambar eksplan yang digunakan pada Percobaan III disajikan pada Lampiran 6.
Percobaan III menggunakan Rancangan Acak Lengkap (RAL) satu faktor perlakuan. Faktor perlakuan berupa media yang terdiri dari 7 taraf yaitu 1) MS+0% TD-J10,2) MS+10% TD-J10, 3) MS+20% TD-J10, 4) MS+30% TD-J10, 5)
MS+0,1 mg/l IAA, 6) MS+0,1 mg/l NAA, dan 7) AMS. Masing-masing perlakuan diulang sebanyak 6 ulangan (6 botol). Masing-masing ulangan terdiri dari 3 eksplan tanaman nilam.
Model rancangan acak lengkap yang digunakan adalah sebagai berikut: Yij= µ +αi+εij
Yij = Respon perlakuan faktor media ke-i, dan ulangan ke-j µ = Nilai rataan umum
αi = Pengaruh faktor media ke-i (i = 1,2,3,...7)
εij = Pengaruh galat percobaan oleh faktor perlakuan media ke-i ulangan ke-j
Pelaksanaan Penelitian
Sterilisasi Alat
Alat-alat yang akan digunakan dicuci bersih dengan menggunakan detergen, kemudian disterilisasi menggunakan oven pada suhu 1500C selama 2-3 jam. Alat-alat yang disterilisasi antara lain botol kultur, alat-alat tanam (pinset, gunting,scalpel), cawan petri, erlenmeyer, dll.
Inokulasi BakteriMethylobacteriumspp.
dengan cara memindahkan 1 ose biakan dari media agar miring (AMS padat) kedalam media AMS cair. Gambar biakan murni Methylobacterium spp. dalam media agar miring disajikan pada Lampiran 7.
Langkah pertama adalah pembuatan media AMS cair. Komposisi serta dosis bahan-bahan media AMS disajikan pada Lampiran 4. Pembuatan media AMS cair dilakukan dengan menimbang bahan I pada Lampiran 3 dan memasukkannya kedalam gelas kimia. Sebanyak 500 ml aqudes steril dituangkan kedalamnya. Media dikocok menggunakan magnetik stirer sampai semua bahan larut. Larutan media AMS dari gelas kimia dituangkan kedalam labu ukur, kemudian ditambahkan aquades steril dan ditera sampai 1 liter.
Langkah kedua adalah mensterilisasi media AMS cair menggunakan otoklaf pada suhu 1210C dan tekanan 17,5 psi selama 40 menit. Larutan media AMS yang telah diencerkan sampai 1 liter tadi kemudian dibagi menjadi 4 bagian kedalam labu erlenmeyer 300 ml masing-masing sebanyak 250 ml. Menutupnya dengan memampatkan gumpalan kapas kedalam mulut labu erlenmeyer, kemudian menutupnya menggunakan aluminium foil dan memasukkannya kedalam otoklaf untuk disterilisasi.
Langkah ketiga adalah inokulasi bakteri secara aseptik didalam laminar air flow cabinet. Inokulasi dilakukan dengan cara menambahkan methanol sebanyak 1% kedalam media AMS cair yang telah disterilisasi pada langkah kedua. Selama penamabahan methanol, sebaiknya tidak menyalakan api bunsen didalam laminar karena methanol mudah terbakar. Api bunsen baru dinyalakan pada saat penambahan tryptofan sebanyak 0,1% sampai akhir kegiatan. Setelah penambahan tryptofan sebanyak 0,1% dilakukan setelah penambahan methanol.
24
Methylobacterium spp. yang dipanen setelah 7 hari masa inkubasi disajikan pada Lampiran 7.
Pembuatan Media Perlakuan
Percobaan I. Uji Efektivitas Teknik Sterilisasi Isolat Methylobacterium spp. untuk KulturIn VitroTanaman Nilam
Perlakuan pada percobaan I yaitu berupa teknik sterilisasi yang terdiri dari 3 taraf. Taraf yang pertama yaitu teknik sterilisasi menggunakan filter. Taraf yang kedua yaitu teknik sterilisasi menggunakan filter kemudian otoklaf. Taraf yang ketiga yaitu teknik sterilisasi menggunakan otoklaf.
1. Teknik sterilisasi dengan filter
Langkah pertama adalah filterisasi (penyaringan) bakteri. Filterisasi ini dilakukan secara aseptik didalam laminar air flow cabinet. Biakan yang telah selesai diinkubasi selama 7 hari kemudian difilter (disaring) menggunakan filter milipore ukuran 0,22 µm. Bakteri Methylobacteriumspp. memiliki ukuran tubuh maksimum 0,8-1,0 x 1,0-10,0 µm (Aken et al. 2004a), maka dari itu digunakan filtermiliporeukuran 0,22 µm untuk menyaringnya.
Biakan bakteri diambil sekitar 2-3 ml menggunakan suntikan steril, kemudian disuntikkan kedalam filter miliporeyang diletakkan tepat dimulut labu erlenmeyer. Hasilnya akan menetes dari dalam filtermiliporemasuk kedalam labu erlenmeyer. Proses ini dilakukan terus berulang-ulang sampai biakan habis. Filter milipore dan suntikan diganti setiap 100 ml biakan demi menjaga sterilitas dan memudahkan peneliti dalam melakukan proses ini.
Hasil dari filterisasi ini berupa larutan bening berwarna kekuningan yang disebut filtrat. Filtrat hasil dari proses filterisasi disajikan pada Lampiran 7. Filtrat ini mengandung auksin, sitokinin, dan bahan lainnya yang disintesis oleh bakteri. Filtrat ini yang ditambahkan kedalam media MS untuk kemudian ditanami eksplan nilam.
sebanyak 50 ml filtrat. Media MS dibuat dengan cara memipet bahan-bahan media MS yang telah dibuat dalam larutan-larutan stok sesuai konsentrasinya dan memasukkannya kedalam gelas kimia volume 1 liter. Sebanyak 15 gram gula pasir dan aquades steril sebanyak 300 ml dituangkan kedalamnya. Larutan dikocok menggunakan magnetik stirer sampai benar-benar larut, kemudian dilakukan pengukuran pH menggunakan digital pH meter. pH media yang sesuai untuk kultur nilam adalah pH netral yaitu 5,8-6.
Jika larutan media terlalu basa (angka pH tinggi, diatas 6), maka dilakukan penurunan pH dengan menambahkan larutan HCl setetes demi setetes menggunakan pipet sampai mencapai pH 5,8-6. Jika larutan terlalu asam (angka pH rendah, dibawah 5,8), maka dilakukan penambahan larutan KOH setetes demi setetes untuk meningkatkan pH sampai 5,8-6. Larutan media MS dituangkan kedalam gelas ukur untuk ditera dengan ditambahkan aquades steril sampai tepat 450 ml. Larutan media dituangkan kedalam labu erlenmeyer. Sebagai bahan pemadat, sebanyak 2,5 gram pytagel ditambahkan kedalam larutan media, kemudian menutupnya dengan aluminium foil. Larutan media disterilisasi mengunakan otoklaf selama 25-30 menit.
Langkah ketiga adalah menambahkan filtrat kedalam media MS steril. Kegiatan ini dilakukan secara aseptik didalam laminar air flow cabinet segera setelah larutan media MS selesai disterilisasi dalam otoklaf. Kegiatan ini harus dilakukan dengan cepat sebelum media MS dingin dan memadat dalam labu erlenmeyer. Sebanyak 50 ml filtrat ditambahkan kedalam labu erlenmeyer yang berisi 450 ml media MS untuk membuat media MS+10% filtrat bakteri. Larutan dikocok sebentar sampai larut, kemudian dituangkan kedalam 20 botol kultur dengan volume yang sama yaitu sekitar 25 ml per botol kultur.
26
2. Teknik sterilisasi dengan filter kemudian otoklaf
Langkah pertama adalah filterisasi (penyaringan) bakteri. Filterisasi ini dilakukan secara aseptik didalam laminar air flow cabinet. Biakan yang telah selesai diinkubasi selama 7 hari kemudian difilter (disaring) menggunakan filter miliporeukuran 0,22 µm.
Biakan bakteri diambil sekitar 2-3 ml menggunakan suntikan steril, kemudian disuntikkan kedalam filter miliporeyang diletakkan tepat dimulut labu erlenmeyer. Filtrat akan menetes dari dalam filter milipore masuk kedalam labu erlenmeyer. Proses ini dilakukan terus berulang-ulang sampai biakan habis. Filter milipore dan suntikan diganti setiap 100 ml biakan demi menjaga sterilitas dan memudahkan peneliti dalam melakukan proses ini.
Langkah kedua adalah pembuatan media MS+10% filtrat yaitu dengan cara menambahkan sebanyak 50 ml filtrat kedalam 450 ml larutan media MS. Bahan-bahan media MS disajikan pada Lampiran 3. Media MS dibuat dengan cara memipet bahan-bahan media MS yang telah dibuat dalam larutan-larutan stok sesuai konsentrasinya dan memasukkannya kedalam gelas kimia volume 1 liter. Sebanyak 15 gram gula pasir dan aquades steril sebanyak 300 ml dituangkan kedalamnya. Sebanyak 50 ml filtrat ditambahkan kedalam larutan media. Larutan dikocok menggunakan magnetik stirer sampai benar-benar larut, kemudian dilakukan pengukuran pH menggunakan digital pH meter sampai 5,8-6.
Larutan media dituangkan kedalam labu ukur untuk ditera dengan ditambahkan aquades steril sampai tepat 500 ml. Sebagai bahan pemadat, sebanyak 2,5 gram pytagel ditambahkan kedalam larutan media. Larutan media dididihkan menggunakan hotplate sampai mendidih, kemudian menuangkannya kedalam 20 botol kultur dengan volume yang sama setiap botolnya yaitu sekitar 25 ml media. Botol kultur yang sudah berisi media kemudian ditutup dengan menggunakan aluminium foil. Media disterilisasi mengunakan otoklaf selama 25-30 menit, kemudian disimpan sampai media memadat.
3. Teknik sterilisasi dengan otoklaf
dengan koloni bakteri dan bahan-bahan lainnya tanpa melalui proses penyaringan (filterisasi) sebagaimana dilakukan pada taraf perlakuan 1 dan 2. Crude ini merupakan hasil pemanenan biakan setelah diinkubasi selama 7 hari. Komposisi media MS disajikan pada Lampiran 3. Media MS dibuat dengan cara memipet bahan-bahan media MS yang telah dibuat dalam larutan-larutan stok sesuai konsentrasinya dan memasukkannya kedalam gelas kimia volume 1 liter. Sebanyak 15 gram gula pasir dan aquades steril sebanyak 300 ml dituangkan kedalamnya. Sebanyak 50 ml crude bakteri ditambahkan kedalam larutan media. Larutan dikocok menggunakan magnetik stirer sampai benar-benar larut, kemudian dilakukan pengukuran pH menggunakan digital pH meter sampai 5,8-6.
Langkah selanjutnya, larutan media dituangkan kedalam labu ukur untuk ditera dengan ditambahkan aquades steril sampai tepat 500 ml. Sebagai bahan pemadat, sebanyak 2,5 gram pytagel ditambahkan kedalam larutan media. Larutan media dididihkan menggunakan hotplate sampai mendidih, kemudian menuangkannya kedalam 20 botol kultur dengan volume yang sama setiap botolnya yaitu sekitar 25 ml media. Botol kultur yang sudah berisi media kemudian ditutup dengan menggunakan aluminium foil. Media disterilisasi mengunakan otoklaf selama 25-30 menit, kemudian disimpan sampai media memadat.
Percobaan II. Pengujian Strain Methylobacterium spp. Penghasil Sitokinin (TD-J2 dan TD-J7) untuk Meningkatkan Multiplikasi Tunas Tanaman Nilam dalam KulturIn Vitro
A. Strain TD-J2
Media perlakuan terdiri dari media MS+10% TD-J2, MS+20% TD-J2,
MS+30% TD-J2. Cara pembuatan media yang akan dijelaskan adalah cara
pembuatan media MS+10% TD-J2. Cara pembuatan MS+20% TD-J2 dan
MS+30% TD-J2dilakukan dengan cara yang sama dengan cara pembuatan media
MS+10% TD-J2. Perbedaannya hanya pada jumlah aquades yang dikurangi dan
28
dengan cara memipet bahan-bahan media MS yang telah dibuat dalam larutan-larutan stok sesuai konsentrasinya dan memasukkannya kedalam gelas kimia volume 1 liter. Sebanyak 15 gram gula pasir dan aquades steril sebanyak 300 ml dituangkan kedalamnya. Sebanyak 50 ml crude bakteri ditambahkan kedalam larutan media. Larutan dikocok menggunakan magnetik stirer sampai benar-benar larut, kemudian dilakukan pengukuran pH menggunakan digital pH meter sampai 5,8-6.
Langkah selanjutnya, larutan media dituangkan kedalam labu ukur untuk di tera dengan ditambahkan aquades steril sampai tepat 500 ml. Sebagai bahan pemadat, sebanyak 2,5 gram pytagel ditambahkan kedalam larutan media. Larutan media dididihkan menggunakan hotplate sampai mendidih, kemudian menuangkannya kedalam 20 botol kultur dengan volume yang sama setiap botolnya yaitu sekitar 25 ml media. Botol kultur yang sudah berisi media kemudian ditutup dengan menggunakan aluminium foil. Media disterilisasi mengunakan otoklaf selama 25-30 menit, kemudian disimpan sampai media memadat.
B. Strain TD-J7
Media perlakuan terdiri dari media MS+10% TD-J7, MS+20% TD-J7,
MS+30% TD-J7. Cara pembuatan media yang akan dijelaskan adalah cara
pembuatan media MS+10% TD-J7. Cara pembuatan MS+20% TD-J7 dan
MS+30% TD-J7dilakukan dengan cara yang sama dengan cara pembuatan media
MS+10% TD-J7. Perbedaannya hanya pada jumlah aquades yang dikurangi dan
volume filtrat yang dinaikkan sampai mencapai persentase yang diinginkan. Langkah pertama adalah filterisasi (penyaringan) bakteri. Filterisasi ini dilakukan secara aseptik didalam laminar air flow cabinet. Biakan yang telah selesai diinkubasi selama 7 hari kemudian difilter (disaring) menggunakan filter miliporeukuran 0,22 µm.
memudahkan peneliti dalam melakukan proses ini. Hasil dari filterisasi ini berupa filtrat yang selanjutnya ditambahkan kedalam media MS untuk kemudian ditanami eksplan nilam.
Langkah kedua adalah pembuatan media MS+10% TD-J7. Komposisi
media MS disajikan dalam Tabel Lampiran 3. Media MS+10% TD-J7 dibuat
sebanyak 500 ml dengan penambahan filtrat sebanyak 10%. Artinya, pada 450 ml media MS ditambahkan sebanyak 50 ml filtrat. Komposisi media MS disajikan pada Lampiran 3. Media MS dibuat dengan cara memipet bahan-bahan media MS yang telah dibuat dalam larutan-larutan stok sesuai konsentrasinya dan memasukkannya kedalam gelas kimia volume 1 liter. Sebanyak 15 gram gula pasir ditambahkan kedalamnya. Aquades steril sebanyak 300 ml dituangkan kedalamnya.
Larutan dikocok menggunakan magnetik stirer sampai benar-benar larut, kemudian dilakukan pengukuran pH menggunakan digital pH meter sampai mencapai pH 5,8-6. Larutan media dituangkan kedalam gelas ukur untuk ditera dengan ditambahkan aquades steril sampai tepat 450 ml. Larutan media dituangkan kembali kedalam labu erlenmeyer. Sebagai bahan pemadat, sebanyak 2,5 gram pytagel ditambahkan kedalam larutan media, kemudian menutupnya dengan aluminium foil. Larutan media disterilisasi mengunakan otoklaf selama 25-30 menit.
Langkah ketiga adalah menambahkan filtrat kedalam media MS steril. Kegiatan ini dilakukan secara aseptik didalam laminar air flow cabinet segera setelah larutan media MS selesai disterilisasi dalam otoklaf. Kegiatan ini harus dilakukan dengan cepat sebelum media MS dingin dan memadat dalam labu erlenmeyer. Sebanyak 50 ml filtrat ditambahkan kedalam labu erlenmeyer yang berisi 450 ml media MS untuk pembuatan media MS+10% TD-J7. Larutan media
dikocok sebentar sampai larut, kemudian dituangkan kedalam 20 botol kultur dengan volume yang sama yaitu sekitar 25 ml per botol kultur.
Botol kultur yang sudah diisi media MS+10% TD-J7ini kemudian ditutup
30
Percobaan III. Pengujian Strain Methylobacterium spp. Penghasil Auksin (TD-J10) untuk Menginduksi Perakaran Tanaman Nilam dalam KulturIn Vitro
Media perlakuan pada Percobaan III terdiri dari media MS+10% TD-J10,
MS+20% TD-J10, MS+30% TD-J10. Cara pembuatan media yang akan dijelaskan
adalah cara pembuatan media MS+10% TD-J10. Cara pembuatan MS+20% TD-J10
dan MS+30% TD-J10dilakukan dengan cara yang sama dengan cara pembuatan
media MS+10% TD-J10. Perbedaannya hanya pada jumlah aquades yang
dikurangi dan volume crude bakteri yang dinaikkan sampai mencapai persentase yang diinginkan.
Langkah pertama pembuatan media MS+10% TD-J10 adalah dengan cara
menambahkan sebanyak 50 mlcrude TD-J10kedalam 450 ml larutan media MS.
Komposisi media MS disajikan pada Lampiran 3. Media MS dibuat dengan cara memipet bahan-bahan media MS yang telah dibuat dalam larutan-larutan stok sesuai konsentrasinya dan memasukkannya kedalam gelas kimia volume 1 liter. Sebanyak 15 gram gula pasir ditambahkan kedalamnya. Aquades steril sebanyak 300 ml dituangkan kedalamnya. Sebanyak 50 ml crude bakteri ditambahkan kedalam larutan media. Larutan dikocok menggunakan magnetik stirer sampai benar-benar larut, kemudian dilakukan pengukuran pH menggunakan digital pH meter sampai 5,8-6.
Pembuatan Media Kontrol
Percobaan I. Uji Efektivitas Teknik Sterilisasi Isolat Methylobacterium spp. untuk KulturIn VitroTanaman Nilam
Media kontrol pada Percobaan I terdiri dari media MS, MS+BAP 0,1 mg/l, media MS+IAA 0,1 mg/l, dan MS+NAA 0,1 mg/l. Cara pembuatan media yang akan dijelaskan adalah cara pembuatan media MS dan media MS+BAP 0,1 mg/l.
Cara pembuatan media MS+IAA 0,1 mg/l, dan MS+NAA 0,1 mg/l dilakukan dengan cara yang sama dengan cara pembuatan media MS+BAP 0,1 mg/l.
Perbedaannya hanya pada jenis ZPT yang ditambahkan saja yaitu IAA dan NAA. A. Pembuatan media MS
Langkah-langkah pembuatan media MS adalah dengan cara memipet bahan-bahan media MS yang telah dibuat dalam larutan-larutan stok sesuai konsentrasinya dan memasukkannya kedalam gelas kimia volume 1 liter. Komposisi media MS disajikan pada Lampiran 3. Sebanyak 15 gram gula pasir dan aquades steril sebanyak 300 ml ditambahkan kedalamnya. Larutan dikocok menggunakan magnetik stirer sampai benar-benar larut, kemudian dilakukan pengukuran pH menggunakan digital pH meter sampai 5,8-6.
Larutan media dituangkan kedalam labu ukur untuk ditera dengan ditambahkan aquades steril sampai tepat 500 ml. Sebagai bahan pemadat, sebanyak 2,5 gram pytagel ditambahkan kedalam larutan media. Larutan media dididihkan menggunakan hotplate sampai mendidih, kemudian menuangkannya kedalam 20 botol kultur dengan volume yang sama setiap botolnya yaitu sekitar 25 ml media. Botol kultur yang sudah berisi media kemudian ditutup dengan menggunakan aluminium foil. Media disterilisasi mengunakan otoklaf selama 25-30 menit, kemudian disimpan sampai media memadat.
B. Pembuatan media MS+BAP 0,1 mg/l