INDUKSI TUNAS TANAMAN NILAM (Pogostemon cablin Benth.)
DENGAN PEMBERIAN α- BENZIL AMINO PURINA DAN α- ASAM ASETAT NAFTALENA SECARA IN-VITRO
SKRIPSI
OLEH:
ROZALIANA 070307035
BDP-PEMULIAAN TANAMAN
PROGRAM AGROEKOTEKNOLOGI FAKULTAS PERTANIAN UNIVERSITAS SUMATERA UTARA
INDUKSI TUNAS TANAMAN NILAM (Pogostemon cablin Benth.) DENGAN PEMBERIAN α- BENZIL AMINO PURINA DAN α-
ASAM ASETAT NAFTALENA SECARA IN-VITRO
SKRIPSI OLEH: ROZALIANA
070307035
BDP-PEMULIAAN TANAMAN
Skripsisebagai salah satu syarat untuk memperoleh gelar sarjana diFakultas Pertanian
Universitas Sumatera Utara
PROGRAM STUDI AGROEKOTEKNOLOGI FAKULTAS PERTANIAN
UNIVERSITAS SUMATERA UTARA MEDAN
Judul Skripsi : Induksi Tunas Tanaman Nilam (Pogostemon cablin Benth.) Dengan Pemberian α-Benzil Amino Purina dan α-Asam Asetat Naftalena Secara In –vitro
Nama : Rozaliana
NIM : 070307035
Program Studi : Pemuliaan Tanaman
Disetujui oleh, Komisi Pembimbing
Ketua
(Luthfi Aziz Mahmud Srg, SP, MSc, PhD)
Mengetahui,
Ketua Program Studi Agroekoteknologi Ir. T. Sabrina, M. Agr,Sc. Phd
ABSTRAK
ROZALIANA: Induksi Tunas Tanaman Nilam (Pogostemon cablin Benth) Dengan Pemberian α-Benzil Amino Purina dan α-Asam Asetat Naftalena Secara In-Vitro, dibimbing oleh Luthfi A.M. Siregar dan Eva Sartini Bayu.
Penelitian ini bertujuan untuk mengetahui konsentrasi zat pengatur tumbuh BAP dan NAA yang paling efektif untuk induksi tunas tanaman nilam secara in vitro.Penelitian dilakukan di Laboratorium Kultur Jaringan Tanaman, Fakultas Pertanian Universitas Sumatera Utara, Medan, yang dimulai dari Januari 2012 hingga Juni 2012 menggunakan rancangan acak lengkap dengan 2 faktor perlakuan yaitu pemberian BAP (0, 0.5, 1 dan 1.5 mg/l) dan NAA (0, 0.2, 0.4 dan 0.6 mg/l). Parameter yang diamati adalah persentase eksplan yang hidup, persentase kontaminasi, persentase eksplan membentuk tunas, tinggi tunas, jumlah akar, panjang akar, jumlah daun, jumlah buku, waktu inisiasi, kemunculan kalus, warna kalus, dan tekstur kalus.
Hasil penelitian menunjukkan bahwa pemberian BAP dan NAA berpengaruh nyata terhadap parameter waktu inisiasi dengan waktu inisiasi terbaik yaitu 7 hari (0.6 mg/l NAA dan 1.5mg/l BAP) dan jumlah akar dengan jumlah akar terbanyak yaitu 8 buah (0.2 NAA mg/l dan BAP 1.5mg/l) dan tidak berpengaruh nyata pada parameter lainnya. Media yang terbaik untuk induksi tunas belum diperoleh.
ABSTRACT
ROZALIANA: The induction of nilam (Pogostemon cablin Benth) bud with giving α -Benzil Amino Purin and α- Naftalena acetic acid by in-vitro methode, supervised by Luthfi. A. M. Siregar and Eva Sratini Bayu.
This research aims to determinedthe concentation of the most effectivegrowth regulator for bud induction patchouli plant by in-vitro methode. The research was done in the laboratory of plant tissue culture, agriculture faculty university of north sumatra, medan from January 2012 to june 2012 using factorial completely randomized design with 2wo factors that is giving BAP (0, 0.5, 1 dan 1.5 mg/l) and NAA (0, 0.2, 0.4 dan 0.6 mg/l). The measured parameters were percentage of eksplan living, the percentage of contamination, the percentage of eksplan forming buds, bud height, roots number, root length, leaves number, noods number, time of initiation, appearance of callus, colour of callus and texture of callus.
The result showed that giving BAP and NAA significantly affected on the buds initiation time parameters with the best time of initiation is 7 days ((0.6 mg/l NAA and 1.5mg/l BAP and the highest number of root that 8 pieces (0.2 NAA mg/l and BAP 1.5mg/l)and did not significanly on others parameter. The best medium for bud induction was not found yet.
RIWAYAT HIDUP
Penulis dilahirkan di Medan pada tanggal 4 Juli 1988 dari ayahanda
Alm. Chairuddin dan Ibunda Almh. Rosliana. Penulis merupakan putri kesembilan dari sepuluh bersaudara.
Pendidikan formal yang pernah dijalani adalah SD Negri 060814/45 Medan tahun 1995-2001, SMP Negri 3 Medan tahun 2001-2004, SMA Negri 21 Medan tahun 2004-2007 dan masuk ke Fakultas Pertanian dengan program studi Pemuliaan
Tanaman Universitas Sumatera Utara melalui jalur ujian tertulis Seleksi Penerimaan Mahasiswa Baru pada tahun 2007.
Selama mengikuti perkuliahan, penulis aktif sebagai pengurus Badan Kenaziran Mushola (BKM) Al-Mukhlisin FP USU, Himadita Nursery, Kam Rabbani dan Tim Mentoring Agama Islam.
KATA PENGANTAR
Puji dan syukur penulis panjatkan kepada Allah SWT, Tuhan Yang Maha
Kuasa atas segala rahmat dan karunia-Nya sehingga penulis dapat menyelesaikan skripsi saya yang berjudul “Induksi Tunas Tanaman Nilam (Pogostemon cablinBenth.)Dengan Pemberian α- Benzil Amino Purina dan α- Asam Asetat NaftalenaSecara in-vitro”.
Ucapan terima kasih yang tak terhingga saya persembahkan kepada Ayahanda
saya Alm. Chairuddin dan Ibunda Almh. Rosliana. Juga kepada kakak-kakak saya Nina Zahra, Khairunniza, Mira Mailina, Magdalena, Sri Rezeki, Putri Rezekidan abang-abang saya Chairul Bahzar dan Chairil azhar juga kepada adik saya Ahmad
Fadli, selama penulisan ini banyak memberikan dukungan, semangat dan motivasi yang tak terhingga kepada penulis.
Pada kesempatan ini penulis menghaturkan pernyataan terima kasih sebesar-besarnya kepada Luthfi Aziz Mahmud Srg, SP, MSc, PhD dan Ir. Eva Sartini Bayu, MP selaku ketua dan anggota komisi pembimbing yang telah membimbing dan
memberikan berbagai masukan berharga kepada penulis dalam menyelesaikan skripsi ini.
Akhir kata penulis berharap semoga Allah SWT membalas dengan memberikan rahmat Dan hidayah-Nya Dan semoga penelitian ini bermanfaat bagi pengembangan ilmu pertanian terutama dalam bidang kultur jaringan.
DAFTAR ISI
ABSTRAK ... i
ABSTRACT ... ii
DAFTAR RIWAYAT HIDUP ... iii
KATA PENGANTAR ... iv
DAFTAR ISI ... v
DAFTAR TABEL ... vii
DAFTAR GAMBAR ... viii
DAFTAR LAMPIRAN ... ix
PENDAHULUAN Latar Belakang ... 1
Tujuan penelitian ... 3
Hipotesa Penelitian ... 3
Kegunaan Penelitian ... 4
TINJAUAN PUSTAKA Botani Tanaman ... 5
Kultur Jaringan ... 5
Eksplan ... 7
Media Kultur ... 7
Lingkungan in-vitro ... 8
Zat Pengatur tumbuh ... 9
BAHAN DAN METODE Tempat dan Waktu Penelitian ... 13
Bahan dan Alat ... 13
Metode Penelitian ... 13
PELAKSANAAN PENELITIAN Sterilisasi Alat ... 16
Pembuatan Larutan Stok ... 16
Pembuatan Media ... 17
Persiapan Eksplan ... 17
Sterilisasi Eksplan ... 17
Penanaman Eksplan ... 18
Pemeliharaan ... 18
Pengamatan Parameter ... 18
Parameter kualitatif ... 18
Persentase Eksplan Hidup (%) ... 18
Persentase Kontaminasi (%) ... 19
Persentase Eksplan Membentuk Tunas (%) ... 19
Jumlah Tunas (buah) ... 19
Waktu Inisiasi (hari)... 20
Parameter Kuantitatif ... 20
Kemunculan Kalus dan Tunas Adventif ... 20
Warna Kalus ... 20
Tekstur Kalus ... 20
HASIL DAN PEMBAHASAN Hasil ... 21
Parameter kualitatif ... 21
Persentase Eksplan Hidup (%) ... 21
Persentase Kontaminasi (%) ... 22
Persentase Eksplan Membentuk Tunas (%) ... 23
Jumlah Tunas (buah) ... 23
Waktu Inisiasi (hari) ... 28
Parameter Kuantitatif ... 28
Kemunculan Kalus dan Tunas Adventif ... 28
ABSTRAK
ROZALIANA: Induksi Tunas Tanaman Nilam (Pogostemon cablin Benth) Dengan Pemberian α-Benzil Amino Purina dan α-Asam Asetat Naftalena Secara In-Vitro, dibimbing oleh Luthfi A.M. Siregar dan Eva Sartini Bayu.
Penelitian ini bertujuan untuk mengetahui konsentrasi zat pengatur tumbuh BAP dan NAA yang paling efektif untuk induksi tunas tanaman nilam secara in vitro.Penelitian dilakukan di Laboratorium Kultur Jaringan Tanaman, Fakultas Pertanian Universitas Sumatera Utara, Medan, yang dimulai dari Januari 2012 hingga Juni 2012 menggunakan rancangan acak lengkap dengan 2 faktor perlakuan yaitu pemberian BAP (0, 0.5, 1 dan 1.5 mg/l) dan NAA (0, 0.2, 0.4 dan 0.6 mg/l). Parameter yang diamati adalah persentase eksplan yang hidup, persentase kontaminasi, persentase eksplan membentuk tunas, tinggi tunas, jumlah akar, panjang akar, jumlah daun, jumlah buku, waktu inisiasi, kemunculan kalus, warna kalus, dan tekstur kalus.
Hasil penelitian menunjukkan bahwa pemberian BAP dan NAA berpengaruh nyata terhadap parameter waktu inisiasi dengan waktu inisiasi terbaik yaitu 7 hari (0.6 mg/l NAA dan 1.5mg/l BAP) dan jumlah akar dengan jumlah akar terbanyak yaitu 8 buah (0.2 NAA mg/l dan BAP 1.5mg/l) dan tidak berpengaruh nyata pada parameter lainnya. Media yang terbaik untuk induksi tunas belum diperoleh.
ABSTRACT
ROZALIANA: The induction of nilam (Pogostemon cablin Benth) bud with giving α -Benzil Amino Purin and α- Naftalena acetic acid by in-vitro methode, supervised by Luthfi. A. M. Siregar and Eva Sratini Bayu.
This research aims to determinedthe concentation of the most effectivegrowth regulator for bud induction patchouli plant by in-vitro methode. The research was done in the laboratory of plant tissue culture, agriculture faculty university of north sumatra, medan from January 2012 to june 2012 using factorial completely randomized design with 2wo factors that is giving BAP (0, 0.5, 1 dan 1.5 mg/l) and NAA (0, 0.2, 0.4 dan 0.6 mg/l). The measured parameters were percentage of eksplan living, the percentage of contamination, the percentage of eksplan forming buds, bud height, roots number, root length, leaves number, noods number, time of initiation, appearance of callus, colour of callus and texture of callus.
The result showed that giving BAP and NAA significantly affected on the buds initiation time parameters with the best time of initiation is 7 days ((0.6 mg/l NAA and 1.5mg/l BAP and the highest number of root that 8 pieces (0.2 NAA mg/l and BAP 1.5mg/l)and did not significanly on others parameter. The best medium for bud induction was not found yet.
PENDAHULUAN
Indonesia merupakan negara penghasil minyak nilam terbesar di dunia yang
memenuhi kebutuhan minyak nilam dunia dengan pangsa pasar 90%. Pada tahun 2004, ekspor nilam Indonesia mencapai 2074 ton atau senilai US$ 27,137 juta.
Namun, beberapa tahun terakhir posisinya mulai terancam oleh negara Cina, India, dan Vietnam (Ditjenbun, 2006). Minyak nilam Indonesia sangat digemari pasar Amerika dan Eropa terutama digunakan untuk bahan baku industri pembuatan
minyak wangi, kosmetika, farmasi dan industri yang lainnya. Minyak nilam (patchouli oil) diperoleh dari proses penyulingan daun nilam (Pogostemoncablin
Benth). Dalam industri parfum, minyak nilam digunakan sebagai bahan fixative (pengikat wewangian) yang sampai saat ini belum dapat disintesis (Wikardi, dkk, 1990).
Di Indonesia, P. cablin tidak dapat berbunga, sehingga bentukan-bentukan genotip baru hasil persilangan alami tidak dapat terjadi. Akibatnya, keragaman
genetiknya relative sempit, terutama untuk kandungan minyak (Mariska dan Lestari, 2003).
Minyak nilam merupakan salah satu jenis minyak atsiri yang memiliki
permintaan cukup tinggi. Negara pengimpor terbesar minyak nilam adalah Amerika Serikat yakni tidak kurang dari 210 ton minyak nilam dibutuhkan rata-rata per tahun.
pengembangan pemanfaatan tanaman nilam maka usaha penyediaan bibit yang bermutu dan bebas penyakit mutlak diperlukan. Teknik untuk memenuhi permintaan
tersebut yang tepat adalah teknik propagasi secara in vitro (kultur- Jaringan) (Bowo,dkk., 2007).
Patchouli alcohol adalah komponen utama minyak nilam (ada sekitar 40%) yang digunakan sebagai standar mutu minyak nilam. Komponen penting lainnya dalam minyak nilam ialah α,β, γ patchoulen dan α-buinesen. Produksi minyak nilam
melalui kultur jaringan sebagai pilihan lain cara produksi menarik untuk dipelajari. Beberapa laporan menyatakan bahwa kultur sel / kalus tidak memproduksi minyak
atsiri, kalaupun ada biasanya tidak sama dengan komponen-komponen minyak atsiri dari tanaman utuh (Tjondronegoro dkk, 1997).
Tanaman nilam merupakan tanaman perdu wangi berdaun halus dan
berbatang segiempat. Daun kering tanaman ini disuling untuk mendapatkan minyak nilam (Patchouli oil) yang banyak digunakan di berbagai kegiatan industri. Fungsi
utama minyak nilam sebagai bahan baku pengikat (fiksatif) komponen kandungan utamanya, yaitu patchouli alkohol (C15H26) dan sebagai bahan eteris untuk parfum agar aroma keharumannya bertahan lebih lama. Selain itu minyak nilam digunakan
sebagai bahan campuran produk kosmetika (diantaranya untuk pembuatan sabun), pasta gigi, sampo, lotion dan deodorant), kebutuhan industri makanan diantaranya
pembuatan obat anti radang, anti fungi, anti serangga, afrodisiak, anti – inflamasi, anti depresi, anti flogistik serta dekongestan), kebutuhan aromaterapi serta berbagai kebutuhan industri lainnya. Minyak nilam dapat dicampur secara baik dengan minyak
minyak nilam sangat kaya, terkesan rasa manis, hangat dan menyengat. Aroma tetap terasa manis sampai seluruh minyak menguap (Sobardini dkk, 2006).
Salah satu permasalahan pada tanaman nilam adalah menurunnya kadar Patchouli alkohol yang diperoleh setelah beberapa kali dilakukan pemanenan. Hal ini
disebabkan karena tidak tersedianya bibit unggul tanaman nilam yang memiliki kadar minyak terutama patchouli alkohol yang tinggi. Produksi metabolit sekunder melalui teknik kultur jaringan telah terbukti memberikan hasil peningkatan kadar metabolit
sekunder dengan waktu produksi yang relatif singkat dan kondisi yang aseptik (Nurlelasari., dkk, 2007).
Selain dengan mengumpulkan berbagai klon, peningkatan keragaman genetik pada tanaman yang selalu dibiakkan secara vegetatif dapat dilakukan melalui variasi somaklonal. Variasi ini dapat terjadi akibat ketidakstabilan selama pengkulturan.
Ketidakstabilan tersebut dapat disebabkan antara lain oleh perubahan struktur atau jumlah kromosom, penggunaan zat pengatur tumbuh yang aktivitasnya kuat seperti
2,4 D, komposisi media kultur yang tidak serasi, faktor genetik eksplan atau lamanya periode pengkulturan (Hobir dan Seswita, 2002).
Bahan tanaman nilam yang hanya dapat diperbanyak secara vegetatif (stek)
digunakan petani adalah asalan diambil dari kebun tetangga tanpa diketahui dengan pasti mutunya yang antara lain potensi produksi, rendemen minyak, kadar alkohol,
indeks bias, kadar asam, ketahanan terhadap hama dan penyakit, sehingga untuk mengantisipasi efek perdagangan global yang ditandai oleh kompetisi yang semakin ketat, diperlukan usaha yang intensif untuk memacu penemuan varietas unggul
yang besar dalam waktu yang relatif singkat perbanyakan tanaman dapat dilakukan melalui kultur jaringan. Perbanyakan tanaman nilam telah dilakukan secara kultur
jaringan yang meliputi kegiatan laboratorium (inisiasi, multiplikasi tunas dan perakaran) dan kegiatan di rumah kaca (aklimatisasi). Bibit yang dihasilkan melalui
kultur jaringan mempunyai kelebihan diantaranya bebas penyakit dan proses produksi lebih cepat serta faktor multiplikasi cukup tinggi yaitu (1: 50 – 100) per bulan (Sobardini, 1997).
Sumber bahan tanaman diperoleh dari Aceh. Nilam Aceh (Pogostemon cablin Benth atau Pogostemon patchouli) merupakan tanaman standar ekspor yang
direkomendasikan karena memiliki aroma khas dan rendemen minyak daun keringnya tinggi, yaitu 2.5 – 5% dibandingkan dengan jenis lain (Sobardini, 1997).
Tujuan Penelitian
Untuk mengetahui kombinasi konsentrasi zat pengatur tumbuh BAP dan NAA yang paling efektif untuk induksi tunas tanaman nilam secara in-vitro.
Hipotesis Penelitian
Adanya perbedaan dan interaksi pertumbuhan eksplan nilam pada berbagai kombinasi konsentrasi zat pengatur tumbuh BAP dan NAA.
Kegunaan Penelitian
Penelitian ini berguna untuk mendapatkan data penyusunan skripsi yang
TINJAUAN PUSTAKA
Nilam termasuk salah satu warga familia Lamiaceae. Menurut Gembong
(2000) secara lengkap sistematika tumbuhan ini adalah divisio: Spermatophyta, subdivisio: Angiospermae, classis: Dicotyledonae, subclassis: Sympetale, ordo:
Solanales / Tubiflorae / Personatae, familia:Lamiaceae / Labiatae, genus:
Pogostemon; dan species: Pogostemon sp
Di Indonesia terdapat tiga jenis nilam yaitu Pogostemon cablin Benth. (nilam
Aceh), Pogostemon hortensis Backer. (nilam Jawa), dan Pogostemon heyneanus Benth. (nilam hutan). Nilam Aceh diduga berasal dari Philipina, mula-mula ditanam
di Jawa pada tahun 1895 dan mulai ditanam di Aceh pada tahun 1909. Nilam hutan berasal dari India, tumbuh liar di Sumatera dan Jawa. Nilam ini jarang dibudidayakan, disebut ‘dilem kembang’ karena hanya jenis ini yang berbunga
(Kardinan, 2005 ).
Gambar 1. Tanaman nilam
Nilam mempunyai akar serabut dengan bentuk daun bulat dan lonjong. Daun yang masih muda berwarna hijau muda, sedangkan daun yang sudah tua berwarna
berdiameter 10 - 20mm, dan berbentuk persegi. Permukaan batang kasar, berwarna hijau ketika muda, dan hijau kecoklatan ketika sudah tua (Kardinan dan Mauludi,
2004 ).
Kultur jaringan
Kultur jaringan sebagai salah satu teknik yang digunakan untuk memperbanyak tanaman dengan menggunakan potongan kecil jaringan atau organ tanaman yang dipelihara dalam suatu medium dan dikerjakan seluruhnya dalam
keadaan aseptik. Potongan kecil jaringan atau organ itu disebut eksplan. Sebagai respon terhadap hormon, baik endogen maupun eksogen akan muncul kalus. Kalus
dapat juga terbentuk pada bagian yang tidak mengalami luka akibat irisan dan sering muncul dari bagian ibu tulang daun atau tulang daun, bila helaian daun digunakan sebagai eksplan (Bowo,dkk., 2007).
Teknik budidaya in vitro ini bisa mengatasi kendala yang sering dijumpai pada masalah seputar penyediaan bibit, misalnya: bisa menyediakan bibit yang
seragam, dalam waktu yang relatif singkat, tidak tergantung pada musim, serta bebas penyakit. Di samping itu dalam kondisi in vitro produksi metabolit sekunder seperti yang dikandung oleh tanaman nilam akan lebih menguntungkan, karena kondisinya
terkontrol, dapat diperbanyak pembentukannya yaitu dengan memanipulasi medium dan hasilnya relatif konstan. Kultur jaringan sebagai salah satu teknik yang digunakan
untuk memperbanyak tanaman dengan menggunakan potongan kecil jaringan atau organ tanaman yang dipelihara dalam suatu medium dan dikerjakan seluruhnya dalam keadaan aseptik Potongan kecil jaringan atau organ itu disebut eksplan (Bowo,dkk.,
Pada tanaman herba, eksplan diambil baik dari pucuk apikal maupun lateral yang mengambil jaringan meristematik namun sering kali digunakan mata tunas yang
diharapkan akan berkembang membentuk daun dan batang sempurna. Bagian tanaman yang digunakan sebagai eksplan adalah tunas lateral atau terminal yang
panjangnya kurang lebih 20 mm. Pengaruh dominansi apikal dapat dihilangkan dengan menambahkan zat pengatur tumbuh (terutama sitokinin) kedalam medium. Sebagai hasilnya adalah tunas dengan jumlah cabang yang banyak (Wattimena,
1992).
Eksplan
Sebagai respon terhadap hormon, baik endogen maupun eksogen akan muncul kalus. Kalus dapat juga terbentuk pada bagian yang tidak mengalami luka akibat irisan dan sering muncul dari bagian ibu tulang daun atau tulang daun, bila helaian
daun digunakan sebagai eksplan. Faktor-faktor yang mempengaruhi keberhasilan kultur in vitro antara lain: factor eksplan, komponen medium dan lingkungan kultur
(Bowo,dkk., 2007).
Sumber asal eksplan dapat mempengaruhi pertumbuhan dan potensial morfogenetiknya. Eksplan yang berasal dari satu jenis organ misalnya, juga
diketemukannya adanya keragaman dan regenerasinya. Perbedaan regeneratif ini sering terjadi pada jaringan tua. Sel-sel yang berasal dari permukaan daun yang
sulit mendapatkan eksplan yang steril. Setiap jenis tanaman maupun organ memiliki ukuran eksplan yang optimim untuk dikulturkan (Wattimena, 1992).
Media kultur
Keberhasilan dalam teknologi serta metode in-vitro terutama disebabkan oleh
pengetahuan yang lebih baik tentang kebutuhan hara sel dan jaringan yang dikulturkan. Komposisi formulasi dari suatu media secara umum harus mengandung nutrien esensial makro dan mikro serta sumber tenaga dimana zat-zat tersebut bisa
dicampur sendiri dari bahan dasarnya, atau diperoleh sudah dalam bentuk campuran. Biasanya ditambah zat pengatur tumbuh, seperti hormon-hormon dan zat penyangga
misalnya agar. Tiap tanaman membutuhkan 6 elemen makronutrien : nitrogen, kalium, magnesium, kalsium, belerang, dan fosfor serta tujuh elemen mikro nutrien yaitu besi, mangan, seng, tembaga, boron, molibden, dan klor dalam bentuk ikatan
kimia dan perbandingan yang sesuai. Banyak formulasi media yang digunakan, diantaranya yang dikembangkan oleh Murashiege dan Skoog (MS) dan medium B5
yang dikembangkan di Prairie Regional Laboratory. Keistimewaan medium MS ini adalah kandungan nitrat, kalium dan amoniumnya yang tinggi. Baik medium MS maupun medium B5 tampaknya mengandung jumlah hara anorganik yang layak
untuk memenuhi kebutuhan banyak jenis sel tanaman dalam kultur (Nurlelasari.,dkk, 2007).
berhubungan dengan menurunnya senyawa inhibitor dalam medium (Wattimena, 1992).
Medium padat digunakan untuk menghasilkan kalus yang selanjutnya diinduksi membentuk tanaman yang lengkap (planlet), sedangkan medium cair
biasanya digunakan untuk kultur sel. Medium yang digunakan mengandung lima komponen utama yaitu senyawa anorganik, sumber karbon, vitamin, zat pengatur tumbuh dab suplemen organik (Yuwono, 2008).
Lingkungan in-vitro
Eksplan yang dikulturkan menghendaki suhu ruang tumbuh yang optimum
agar tetap segar. Suhu optimum untuk proses morfogenesis juga bervariasi antar spesies. Suhu tinggi diduga dapat menghambat produksi kinetin yang mendorong pertunasan pembentukan akar dari kultur juga dipengaruhi oleh suhu ruang tumbuh.
Kelembaban relatif ruang tumbuh kultur jaringan kurang lebih 70%, didalam botol menghendaki kelembaban yang lebih tinggi. Respon kultur terhadap cahaya
tergantung pada asal eksplan. Sumber cahaya buatan untuk ruang inkubasi dalam kultur in vitro dilaporkan bahwa cahaya fluorescent yang berasal dari lampu TL memnerikan cahaya dengan panjang gelombang yang dibutuhkan untuk
morfogenesis. Multiplikasi tunas dan pembentukan tunas in vitro umumnya menghendaki cahaya dengan intensitas 500-3000 lux (Wattimena, 1992).
Faktor-faktor lingkungan yang berpengaruh dalam kultur in vitro adalah: cahaya, temperatur dan pH medium. Selama dalam kultur in vitro sel tumbuhan tidak melakukan fotosintesis secara efisien dan urnumnya dalam keadaan non autotrof.
dipenuhi dari gula tetapi untuk menghasilkan plantlet hijau dengan daun normal diperlukan cahaya (Bowo,dkk., 2007).
Zat pengatur tumbuh
Zat pengatur tumbuh terdiri dari golongan sitokinin dan auksin. Auksin
mempunyai peran ganda tergantung pada struktur kimia, konsentrasi, dan jaringan tanaman yang diberi perlakuan. Pada umumnya auksin digunakan untuk menginduksi pembentukan kalus, kultur suspensi, dan akar, yaitu dengan memacu pemanjangan
dan pembelahan sel di dalam jaringan kambium. Untuk memacu pembentukan kalus embriogenik dan struktur embrio somatik seringkali auksin diperlukan dalam
konsentrasi yang relatif tinggi (Lestari, 2011).
Zat pengatur tumbuh tanaman berperan penting dalam mengontrol proses biologi dalam jaringan tanaman. Perannya antara lain mengatur kecepatan
pertumbuhan dari masingmasing jaringan dan mengintegrasikan bagian-bagian tersebut guna menghasilkan bentuk yang kita kenal sebagai tanaman. Aktivitas zat
pengatur tumbuh di dalam pertumbuhan tergantung dari jenis, struktur kimia, konsentrasi, genotipe tanaman serta fase fisiologi tanaman. Dalam proses pembentukan organ seperti tunas atau akar ada interaksi antara zat pengatur tumbuh
eksogen yang ditambahkan ke dalam media dengan zat pengatur tumbuh endogen yang diproduksi oleh jaringan tanaman. Penambahan auksin atau sitokinin ke dalam
media kultur dapat meningkatkan konsentrasi zat pengatur tumbuh endogen di dalam sel, sehingga menjadi “faktor pemicu” dalam proses tumbuh dan perkembangan jaringan. Untuk memacu pembentukan tunas dapat dilakukan dengan memanipulasi
Adapun hormon pertumbuhan yang digunakan ada dua jenis yaitu auksin dan sitokinin. Hormon-hormon lain, diantaranya giberelin dan zat pengatur tumbuh
sintetik juga sering digunakan. Auksin, sitokinin, dan giberellin adalah hormon-hormon yang mempunyai peran ganda karena mempunyai kemampuan untuk
merangsang pertumbuhan eksplan dan mempengaruhi pertumbuhan akar. Kemampuan untuk mensintesa atau merombak serta kepekaan terhadap zat-zat tersebut bila berada dalam media, untuk setiap spesies dan masing- masing bagian
tanaman, sangat bervariasi sehingga bagi usaha propagasi invitro dari suatu tanaman yang belum pernah dikerjakan sebelumnya, perlu dilakukan percobaan dengan
berbagai jenis dan kadar dari hormon-hormon tersebut (Nurlelasari, dkk, 2007).
Sitokinin penting dalam pengaturan pembelahan sel, morfogenesis dan banyak berperan dalam mengatur organogenesis, pembentukan tunas, mendorong
proliferasi meristem ujung, menghambat pembentukan akar, mendorong pembentukan klorofil. Jenis sitokinin yang digunakan dalam kultur jaringan, yaitu
kinetin (6-furfuryl amino purine), zeatine (4-hydroxyl-3-metyltrans- 2-butenyl amino
purine), BAP/BA (6-benzyl amino purine/6-benzyl adenine) (Sobardini dkk, 2006).
Selain sitokinin, auksin merupakan zat pengatur tumbuh yang juga sering ditambahkan ke dalam medium kultur jaringan untuk menginduksi
pertumbuhan kalus dan untuk mengatur morfogenesis diantaranya pembentukan akar,
tunas dan embriogenesis. Salah satu auksin sintetis yang sering
digunakan dalam kultur jaringan adalah NAA (Naphthalene Acetic Acid)
Zat pengatur tumbuh sangat diperlukan sebagaikomponen media bagi pertumbuhan dan diferensiasikalus. Tanpa penambahan zat pengatur tumbuhdalam
media, pertumbuhan akan terhambat bahkanmungkin tidak tumbuh sama sekali. Pembentukankalus dan organ-organ ditentukan oleh penggunaanyang tepat dari zat
pengatur tumbuh tersebut. Pengaruh rangsangan auksin terhadap jaringan berbeda-beda. Rangsangan yang paling kuat terutama terhadap sel-sel meristem apikal batang dan koleoptil. Pada kadar yang tinggi, auksin lebih bersifat menghambat daripada
merangsang pertumbuhan (Sriyanti dan Wijayani, 1994).
Menurut Khrisnamoorthy (1981) dan Wattimena (1990), yang dikutip dari
Sobardini, dkk., 2006, pemberian auksin pada konsentrasi yang tinggi akan menghambat pertumbuhan akar dan tunas. Pemberian auksin pada konsentrasi terlalu tinggi dapat memacu produksi hormon etilen yang merupakan hormon penghambat
pertumbuhan akar, daun dan bunga tergantung pada speciesnya. Respon auksin berhubungan dengan konsentrasinya. Konsentrasi yang tinggi bersifat menghambat
pertumbuhan tunas.
Menurut pendapat Evans dkk (1986) yang dikutip oleh Sobardini dkk (2006) menyatakan bahwa tunas yang sedang berkembang dapat memproduksi auksin dalam
jumlah yang cukup untuk perakaran maka penambahan auksin eksogen tidak diperlukan. Jadi tanpa pemberian NAA pun, eksplan dapat menginisiasi pertumbuhan
BAHAN DAN METODE PENELITIAN
Tempat dan Waktu penelitian
Penelitian ini dilaksanakan di Laboratorium Kultur Jaringan Tanaman, Fakultas Pertanian Universitas Sumatera Utara, Medan, yang dimulai dari bulan
Januari 2012 hingga Juni 2012.
Bahan dan Alat
Bahan yang digunakan dalam penelitian ini adalah tunas nilam, larutan stok
media MS, ZPT (BAP dan NAA), iodine 10%, benlathe, tween 20, agar-agar, NaOH 1N, HCl 1N, pH meter/kertas lakmus, aluminium foil dan aquades, alkohol 96%.
Alat-alat yang digunakan adalah autoklaf, laminar Air Flow (LAF), botol kultur, erlenmeyer, pipet skala, gelas ukur, Petridis, scalpel, gunting, bunsen, timbangan analitik, hotplate, batang pengaduk, lemari es, kertas milimeter, pinset,
oven, dan alat-alat lain yang mendukung penelitian ini.
Metode Penelitian
Penelitian ini menggunakan Rancangan Acak Lengkap (RAL) dengan 2 faktor perlakuan yaitu:
Faktor I: Tingkat konsentrasi pemberian NAA yang terdiri dari 4 taraf, yaitu:
A0= 0 mg/l (kontrol) A1= 0,2 mg/l
Faktor II: Tingkat konsentrasipemberian BAP yang terdiri dari 4 taraf, yaitu: B0= 0 mg/l (kontrol)
B1= 0,5 mg/l B2= 1 mg/l
B3= 1,5 mg/l
Sehingga diperoleh 16 kombinasi perlakuan yaitu:
A0B0 A1B0 A2B0 A3B0
A0B1 A1B1 A2B1 A3B1
A0B2 A1B2 A2B2 A3B2
A0B3 A1B3 A2B3 A3B3
Jumlah ulangan : 4 ulangan Jumlah kombinasi : 16 kombinasi
Jumlah plot : 64 plot
Jumlah tanaman/botol : 1 tanaman
Jumlah seluruh tanaman : 64 tanaman
Dari hasil penelitian dianalisis dengan sidik ragam dengan model linier aditif sebagai berikut :
Yij= µ + αi + βj+ (αβ)ij + εijk
i=1,2,3,4, j= 1,2,3,4 k=1,2,3,4
Yij = Hasil pengamatan pada pemberian BAP pada taraf ke-i dan pemberian NAA pada taraf ke-j
µ = Rataan atau nilai tengah
βj = Efek dari konsentrasi NAA pada taraf ke-j
(αβ)ijk =Efek interaksiantara konsentrasi BAP pada taraf ke-i dengan konsentrasi NAA pada taraf ke j pada ulangan ke k.
εij =Pengaruh galat pada blok ke-i karena pemberian konsentrasi BAP pada taraf ke-i dengan konsentrasi NAA pada taraf ke-j dan pada ulanagna ke k.
Uji lanjutan yang digunakan dalam menentukan notasi bagi perlakuan yang berpengaruh nyata terhadap parameter yang diambil adalah uji BNJ pada taraf 5%
PELAKSANAAN PENELITIAN
Sterilisasi Alat
Sterilisasi bermanfaat untuk membersihkan seluruh alat-alat yang digunakan dalam kultur jaringan sehingga terbebas dari hal-hal yang dapat menimbulkan
kontaminasi. Alat-alat tersebut dicuci dengan deterjen, kemudian dibilas dengan air, setelah itu dikeringkan. Kemudian alat seperti scalpel, pipet skala, pinset, dan cawan petri dibungkus dengan kertas coklat, sedang erlenmeyer dan gelas ukur
permukaannya ditutup dengan aluminium foil. Setelah itu, semua botol kultur dan alat-alat dimasukkan kedalam autoklaf pada tekanan 17,5psi dengan suhu 121°C
selama 60 menit. Setelah itu, di-dinginkan lalu di-keluarkan dan dimasukkan kedalam ruang kultur. Alat-alat selain botol kultur dimasukkan kedalam oven.
Pembuatan Larutan Stok
Pembuatan larutan stok bertujuan untuk memudahkan pekerjaan dalam membuat media. Larutan stok yang dibuat adalah larutan stok makro (20x), mikro
(20x), vitamin (10x), iron (10x) dan FeEDTA (20x) sesuai dengan komposisi media MS (Lampiran 3) yang diaduk dalam erlenmeyer dengan konsentrasi yang lebih pekat. Setelah membuat larutan stok garam-garam, perlu dibuat stok zat pengatur
tumbuh biasanya dalam 100 ml. Stok harus disimpan didalam lemari es.
Pembuatan Media
500 ml. Kemudian ditambahkan larutan stok A sebanyak 50 ml/l, B 5 ml/l, C 10 ml/l, D 5 ml/l (Lampiran 3). Kemudian ditambahkan myo-inositol 0,1 gram/l dan sukrosa
30 gram/l. Setelah itu, ditambahkan aquades sampai mendekati 1000 ml. Lalu pH-nya diukur dengan menggunakan pH meter dan dilihat angkanya. Bila pH masih dibawah
5,7 maka perlu ditambah NaOH 1 N, tetapi bila pH sampai mencapai 6,0 (melebihi 5,8) maka ditambah HCl 1 N. Kemudian, ditambahkan aquades hingga volume mencapai 1000 ml. Lalu ditambahkan agar-agar sebanyak 7g/l. Diaduk dengan
menggunakan stirer sampai mendidih dan agar-agarnya larut semua. Larutan dituangkan ke dalam 16 botol, masing-masing botol berisi 100 ml dan sisanya
disimpan dalam lemari pendingin. Setiap botol ditambahkan zat pengatur tumbuh BAP dan NAA sesuai dengan kombinasi perlakuan. Kemudian setiap media perlakuan dituangkan ke dalam botol kultur sesuai dengan kombinasinya sehingga
setiap botol kultur berisi 15 ml yang telah berlabel dan ditutup dengan aluminium foil. Media ini selanjutnya disterilkan dengan autoklaf pada suhu 121°C, tekanan 17,5
psi, selama 30 menit. Setelah itu, media diletakkan kedalam media kultur.
Persiapan Eksplan
Eksplan yang digunakan adalah tunas aksilar tanaman nilam yang muncul dari
bagian nodus dengan panjang ±2 cm yang diambil langsung dari luar. Tunas aksilar dipotong menggunakan pisau tajam.
Sterilisasi Eksplan
Tunas dicuci bersih dengan menggunakan deterjen selama 15 menit lalu dibilas sampai bersih. Lalu tunas dicuci dengan larutan benlate yang ditambahkan
lagidengan larutan HgCl2 selama 15 menit sambil di kocok, setelah itu dibilas dengan
air aquades. Selanjutnya dicuci dengan larutan iodine 10% selama 15 menit lalu bilas
dengan aquades sebanyak 3 kali. Sterilisasi ini dilakukan di LAF.
Pemotongan Eksplan
Eksplan yang digunakan adalah tunas tanaman nilam. Untuk mempermudah sterilisasi eksplan, tunas dipotong dengan menggunakan scalpel. Eksplan yang selesai disterilisasi dipotong-potong di LAF dengan ukuran 0,5 cm.
Penanaman Eksplan
Penanaman eksplan dilakukan di LAF yang telah disterilkan dengan alcohol
96%. Eksplan yang sudah steril diletakkan di petridis. Diambil botol media lalu didekatkan dengan api bunsen kemudian eksplan ditanam kedalam botol media sesuai dengan perlakuan, setiap botol media terdapat 1 eksplan. Setelah itu, botol media
dikembalikan ke dalam ruang kultur.
Pemeliharaan
Botol-botol yang telah ditanami eksplan diletakkan pada rak-rak kultur didalam ruang kultur. Setiap hari disemprot dengan alcohol 96% agar bebas dari organisme yang menyebabkan kontaminasi.
Parameter Pengamatan
Parameter Kuantitatif Persentase eksplan yang hidup (%)
Persentase eksplan yang hidup = jumlah eksplan yang tumbuh x 100% jumlah eksplan yang ditanam
Persentase kontaminasi (%)
Pengamatan dilakukan pada akhir penelitian dengan menghitung jumlah eksplan yang terkontaminasi.
Persentase kontaminasi = jumlah eksplan yang kontaminasi x 100% jumlah eksplan yang ditanam
Persentase eksplan membentuk tunas (%)
Pengamatan dilakukan pada akhir penelitian dengan menghitung jumlah
eksplan yang membentuk tunas.
Persentase eksplan membentuk tunas = jumlah eksplan membentuk tunas x 100% jumlah eksplan yang tumbuh
Jumlah tunas (buah)
Dihitung pada akhir penelitian dengan menghitung jumlah tunas yang muncul.
Tinggi tunas (cm)
Diukur pada akhir penelitian dengan menggunakan kertas milimeter mulai dari tempat munculnya tunas (pangkal) sampai ujung tunas tertinggi.
Jumlah daun
Dihitung pada akhir penelitian dengan menghitung jumlah daun yang muncul.
Jumlah buku
Dihitung pada akhir penelitian dengan menghitung jumlah buku yang muncul.
Jumlah akar (buah)
Panjang akar (cm)
Diukur pada akhir penelitian dengan menggunakan kertas milimeter mulai
dari tempat munculnya tunas (pangkal) sampai ujung tunas tertinggi.
Jumlah daun
Dihitung pada akhir penelitian dengan menghitung jumlah daun yang muncul.
Jumlah buku
Dihitung pada akhir penelitian dengan menghitung jumlah buku yang muncul.
Waktu inisiasi tunas (hari)
Dihitung dari awal penanaman sampai eksplan mengeluarkan tunas.
Parameter Kualitatif Kemunculan kalus (+ / -)
Diamati ada tidaknya kemunculan kalus pada eksplan selama penelitian. Dan
diamati dari awal penanaman sampai akhir penelitian.
Warna kalus
Diamati warna kalus yang terbentuk. Diamati dari awal hingga akhir penelitian.
Tekstur kalus
HASIL DAN PEMBAHASAN
Hasil
Dari analisa data yang dilakukan diperoleh hasil bahwa pemberian NAA dan
BAP berpengaruh nyata terhadap parameter waktu inisiasi. Adapun interaksi antara NAA dan BAP berpengaruh nyata pada parameter jumlah akar dan waktu inisiasi tunas.
Parameter kuantitatif Persentase eksplan yang hidup (%)
Dari data pengamatan persentase eksplan yang hidup dapat dilihat pada Lampiran 4, dapat dilihat bahwa perlakuan konsentrasi NAA, BAP dan interaksi
antara kedua perlakuan tidak berpengaruh nyata pada parameter persentase eksplan yang hidup.
Rataan persentase eksplan yang hidup pada pemberian konsentrasi NAA dan
BAP dapat dilihat pada Tabel 1.
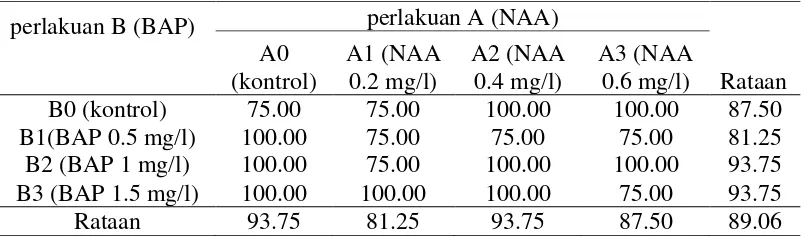
Tabel 1. Rataan persentase eksplan yang hidup (%) pada pemberian konsentrasi NAA dan BAP
pada perlakuan NAA terdapat pada perlakuan A0 dan A2 yaitu sebesar 93.75% dan terendah pada perlakuan A1 yaitu sebesar 81.25%. Pada pemberian konsentrasi BAP,
persentase eksplan yang hidup tertinggi terdapat pada perlakuan B2 dan B3 yaitu sebesar 93.75 dan terendah pada B1 yaitu sebesar 81.25%.
Persentase kontaminasi (%)
Dari data pengamatan persentase kontaminasi dapat dilihat pada Lampiran 5, dapat dilihat bahwa perlakuan konsentrasi NAA, BAP dan interaksi antara kedua
perlakuan tidak berpengaruh nyata pada parameter persentase kontaminasi.
Rataan persentase kontaminasi pada pemberian konsentrasi NAA dan BAP
dapat dilihat pada Tabel 2.
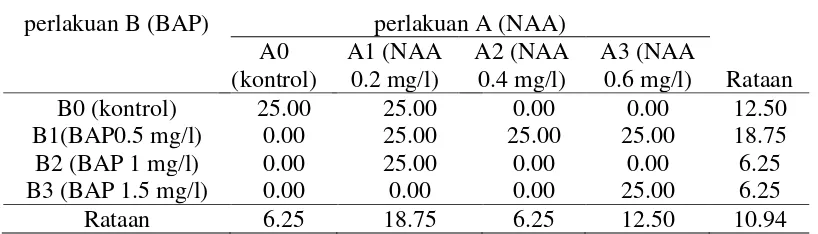
Tabel 2. Rataan persentase kontaminasi (%) pada pemberian konsentrasi NAA dan BAP
Dari Tabel 2 dapat dilihat bahwa pemberian konsentrasi NAA dan BAP yang
tidak berbeda nyata pada semua perlakuan, persentase kontaminasi tertinggi pada perlakuan NAA terdapat pada perlakuan A1 yaitu sebesar 18.75% dan terendah pada perlakuan A0 dan A2 yaitu sebesar 6.25%. Pada pemberian konsentrasi BAP,
Persentase eksplan membentuk tunas
Dari data pengamatan persentase eksplan membentuk tunas dapat dilihat pada Lampiran 6, dapat dilihat bahwa perlakuan konsentrasi NAA, BAP dan interaksi
antara kedua perlakuan tidak berpengaruh nyata pada parameter persentase eksplan membentuk tunas.
Rataan persentase eksplan membentuk tunas pada pemberian konsentrasi NAA dan BAP dapat dilihat pada Tabel 3.
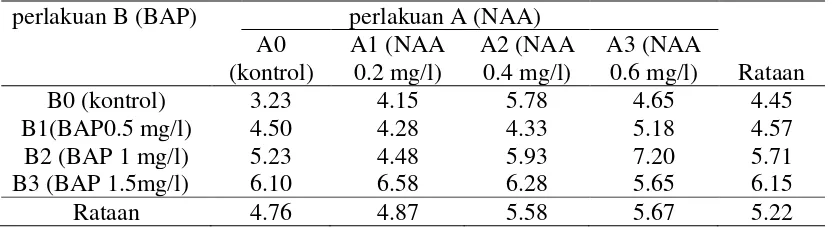
Tabel 3. Rataan persentase eksplan membentuk tunas (%) pada pemberian konsentrasi NAA dan BAP
perlakuan B (BAP)
perlakuan A(NAA) Rataan
A0
Dari Tabel 3 dapat dilihat bahwa pemberian konsentrasi NAA dan BAP yang tidak berbeda nyata pada semua perlakuan, persentase eksplan membentuk tunas tertinggi pada perlakuan NAA terdapat pada perlakuan A0 dan A2 yaitu sebesar 93.75%
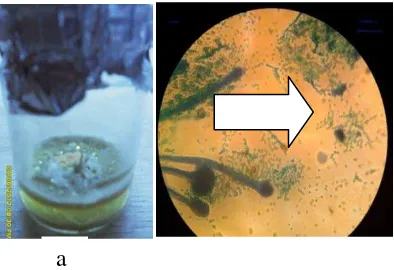
Gambar 2 : a. kontaminasi diamati secara visual b. kontaminasi diamati secara mikroskopik
dan terendah pada perlakuan A1 dan A3 yaitu sebesar 81.25%. Pada pemberian BAP, eksplan membentuk tunas tertinggi pada perlakuan B2 dan B3 yaitu sebesar 93.75%. dan
terendah pada B0 dan B1 yaitu sebesar 81.25%.
Jumlah tunas (buah)
Dari data pengamatan jumlah tunas dapat dilihat pada Lampiran 7, dapat dilihat bahwa perlakuan konsentrasi NAA, BAP dan interaksi antara kedua perlakuan tidak berpengaruh nyata pada parameter jumlah tunas.
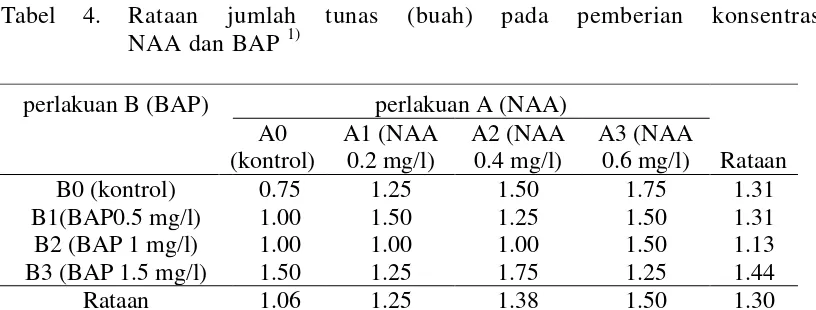
Rataan jumlah tunas pada pemberian konsentrasi NAA dan BAP dapat dilihat pada Tabel 4.
Ket: 1) analisis menggunakan data hasil transformasi (x+0.5)1/2
Dari Tabel 4 dapat dilihat bahwa pemberian konsentrasi NAA dan BAP yang
tidak berbeda nyata pada semua perlakuan, jumlah tunas terbanyak pada perlakuan NAA adalah terdapat pada perlakuan A3 yaitu sebesar 1.50 buah dan terendah pada perlakuan A0 yaitu sebesar 1.06 buah. Pada perlakuan BAP jumlah tunas teringgi
Tinggi tunas (cm)
Dari data pengamatan tinggi tunas (cm) dapat dilihat pada Lampiran 8, dapat
dilihat bahwa perlakuan konsentrasi NAA, BAP dan interaksi antara kedua perlakuan tidak berpengaruh nyata pada parameter tinggi tunas (cm).
Rataan tinggi tunas pada pemberian konsentrasi NAA dan BAP dapat dilihat pada Tabel 5.
Tabel 5. Rataan tinggi tunas (cm) pada pemberian konsentrasi NAA dan BAP 1)
perlakuan B (BAP) perlakuan A (NAA)
Ket: 1) analisis menggunakan data hasil transformasi (x+0.5)1/2
Dari Tabel 5 dapat dilihat bahwa pemberian konsentrasi NAA dan BAP yang
tidak berbeda nyata pada semua perlakuan, tunas tertinggi pada perlakuan NAA adalah terdapat pada perlakuan A3 yaitu sebesar 5.67 cm dan terendah pada
perlakuan A0 yaitu sebesar 4.76 cm. Pada perlakuan BAP tinggi tunas tertinggi terdapat pada B3 yaitu sebesar 6.15 cm dan terendah pada B0 yaitu sebesar 4.45 cm.
Jumlah akar
Dari data pengamatan jumlah akar dapat dilihat pada Lampiran 9, dapat dilihat bahwa perlakuan konsentrasi NAA dan BAP tidak berpengaruh nyata dan
Rataan jumlah akar pada pemberian konsentrasi NAA dan BAP dapat dilihat pada Tabel 6.
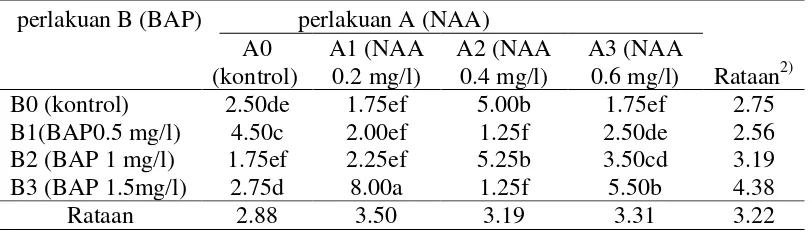
Tabel 6. Rataan jumlah akar (buah) pada pemberian konsentrasi NAA dan BAP1)
perlakuan B (BAP) perlakuan A (NAA) A0
Ket: 1) analisis menggunakan data hasil transformasi (x+0.5)1/2
2)angka-angka yang diikuti huruf yang tidak sama menunjukkan pengaruh nyata pada uji BNJ pada taraf
kepercayaan 5% pada kolom yang sama
Dari Tabel 6 dapat dilihat bahwa pemberian konsentrasi NAA dan BAP yang tidak berbeda nyata pada pada parameter jumlah akar, tetapi interaksi antara NAA
dan BAP berpengaruh nyata pada parameter ini. Jumlah akar terbanyak yaitu terdapat pada kombinasi perlakuan A1B3 yaitu sebesar 8.00 buah dan terendah pada perlakuan A2B3 dan A2B1 yaitu sebesar 1.25 buah.
Panjang akar (cm)
Dari data pengamatan panjang akar dapat dilihat pada Lampiran 10, dapat
dilihat bahwa perlakuan konsentrasi NAA, BAP dan interaksi antara kedua perlakuan tidak berpengaruh nyata pada parameter panjang akar.
Rataan panjang akar pada pemberian konsentrasi NAA dan BAP dapat dilihat
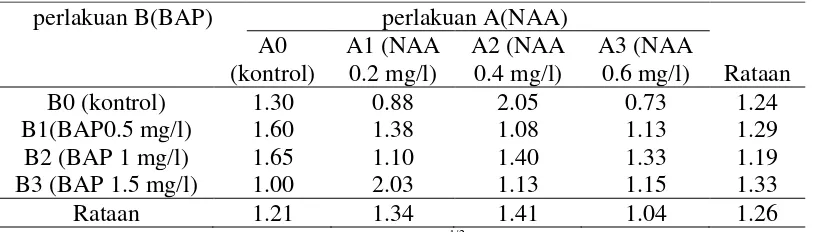
Tabel 7. Rataan panjang akar (cm) pada pemberian konsentrasi NAA dan BAP1)
Ket: 1) analisis menggunakan data hasil transformasi (x+0.5)1/2
Dari Tabel 7 dapat dilihat bahwa pemberian konsentrasi NAA dan BAP yang tidak berbeda nyata pada semua perlakuan, panjang akar tertinggi pada perlakuan
NAA adalah terdapat pada perlakuan A2 yaitu sebesar 1.41 cm dan terendah pada perlakuan A2 yaitu sebesar 1.04 cm. Pada perlakuan BAP panjang akar tertinggi terdapat pada B0 yaitu sebesar 1.41 cm dan terendah pada B2 yaitu sebesar 1.04 cm.
Jumlah daun
Dari data pengamatan jumlah daun dapat dilihat pada Lampiran 11, dapat
dilihat bahwa perlakuan konsentrasi NAA, BAP dan interaksi antara kedua perlakuan tidak berpengaruh nyata terhadap parameter jumlah daun.
Rataan persentase jumlah daun pada pemberian konsentrasi NAA dan BAP
dapat dilihat pada Tabel 8.
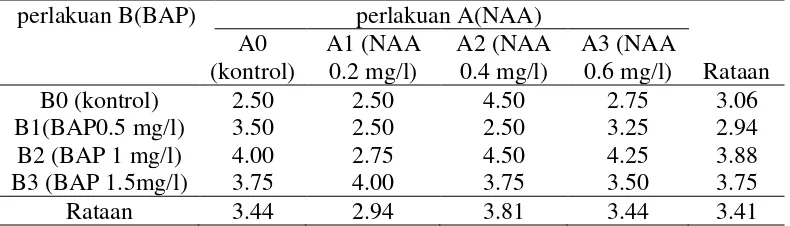
Tabel 8. Rataan jumlah daun (helai) pada pemberian konsentrasi NAA dan BAP 1) perlakuan
B(BAP) perlakuan A(NAA)
A0
Dari Tabel 8 dapat dilihat bahwa pemberian konsentrasi NAA dan BAP yang tidak berbeda nyata pada semua perlakuan, jumlah daun terbanyak pada perlakuan
NAA adalah terdapat pada perlakuan A2 yaitu sebesar 6.75 buah dan terendah pada perlakuan A1 yaitu sebesar 5.56 buah. Pada perlakuan BAP jumlah daun tertinggi
terdapat pada B3 yaitu sebesar 7.13 buah dan terendah pada B1 yaitu sebesar 5.56 buah.
Jumlah buku
Dari data pengamatan jumlah buku dapat dilihat pada Lampiran 12, dapat dilihat bahwa perlakuan konsentrasi NAA, BAP dan interaksi antara kedua perlakuan
tidak berpengaruh nyata pada parameter jumlah buku.
Rataan jumlah buku pada pemberian konsentrasi NAA dan BAP dapat dilihat pada Tabel 9.
Tabel 9. Rataan jumlah buku (buah) pada pemberian konsentrasi NAA dan BAP 1)
perlakuan B(BAP) perlakuan A(NAA)
Ket: 1) analisis menggunakan data hasil transformasi (x+0.5)1/2
Dari Tabel 9 dapat dilihat bahwa pemberian konsentrasi NAA dan BAP yang tidak berbeda nyata pada semua perlakuan, jumlah buku terbanyak pada perlakuan NAA adalah terdapat pada perlakuan A2 yaitu sebesar 3.81 buah dan terendah pada
terdapat pada B2 yaitu sebesar 3.88 buah dan terendah pada B1 yaitu sebesar 2.94 buah.
Waktu inisiasi tunas (hari)
Dari data pengamatan waktu inisiasi tunas dapat dilihat pada Lampiran 13 dan
sidik ragam Lampiran 14, dapat dilihat bahwa perlakuan konsentrasi BAP dan NAA, interaksi antara kedua perlakuan berpengaruh nyata pada parameter waktu inisiasi tunas.
Rataan waktu inisiasi tunas pada pemberian konsentrasi NAA dan BAP dapat dilihat pada Tabel 10.
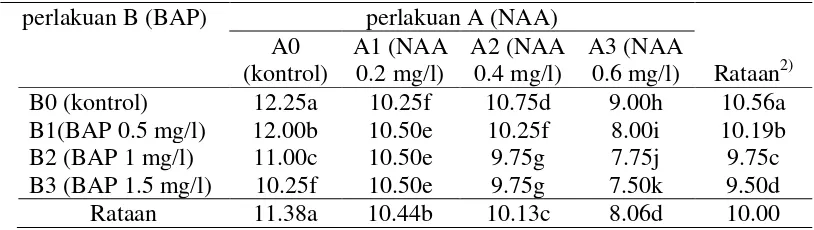
Tabel 10. Rataan waktu inisiasi tunas (hari) pada pemberian konsentrasi NAA dan BAP 1)
perlakuan B (BAP) perlakuan A (NAA) A0
Ket: 1) analisis menggunakan data hasil transformasi (x+0.5)1/2
2)angka-angka yang diikuti huruf yang tidak sama menunjukkan pengaruh nyata pada uji BNJ pada taraf
kepercayaan 5% pada kolom atau baris yang sama
Dari Tabel 10 dapat dilihat bahwa pemberian konsentrasi NAA dan BAP yang berbeda nyata pada semua perlakuan, waktu inisiasi tunas pada perlakuan NAA
adalah terdapat pada perlakuan A3 yaitu sebesar 8.06 hari dan terlama pada perlakuan A0 yaitu sebesar 11.38 hari. Pada perlakuan BAP waktu inisiasi tercepat terdapat pada
B3 yaitu sebesar 9.50 hari dan terlama pada B0 yaitu sebesar 10.56 hari.
Parameter kuantitatif Kemunculan kalus dan tunas adventif
Dari pengamatan yang dilakukan secara visual diperoleh hasil bahwa adanya kemunculan kalus pada penelitian yang dilakukan yaitu hampir di semua kombinasi
perlakuan kecuali pada kombinasi perlakuan A0B0 (kontrol), A0B1(NAA 0 + BAP 0.5mg/l), A0B3 (NAA 0 + BAP 1.5mg/l) dan A1B3 (NAA 0.2 mg/l + BAP 1.5 mg/l). Pengamatan visual kemunculan kalus pada pemberian konsentrasi NAA dan BAP
dapat dilihat pada Gambar 3.
Gambar 3. a. Tanpa kalus, b. Ada kalus
Tabel 11. Kemunculan kalus dan tunas adventif
Ket : - (tidak terbentuk kalus) + (terbentuk kalus)
++ (kalus dan tunas adventif)
Warna kalus
Dari pengamatan visual yang dilakukan diperoleh hasil bahwa warna kalus pada awal proses inisiasi yaitu berwarna putih atau putih kehijauan namun lama
Gambar 4. Kiri: warna tunas yang belum mengalami perubahan warna, kanan: kalus sudah mengalami perubahan warna
Pengamatan visual warna kalus pada pemberian konsentrasi NAA dan BAP
dapat dilihat pada Tabel 12. Tabel 12. Warna kalus
Perlakuan
Ulangan
I II III IV
A0B0 - - - -
A0B1 - - - -
A0B2 Putih Putih Putih Putih
A0B3 putih kehijauan putih kehijauan tidak ada putih kehijauan
A1B0 - - Putih Putih
A1B1 - Putih - -
A1B2 Putih putih kehijauan putih kehijauan -
A1B3 - - - -
A2B0 Putih Putih Putih Putih
A2B1 Putih Putih Putih -
A2B2 Putih Putih Putih Putih
A2B3 putih kehijauan putih kehijauan putih kehijauan putih kehijauan
A3B0 Putih Putih Putih Putih
A3B1 - Putih Putih Putih
Tekstur kalus
Dari pengamatan visual yang dilakukan diperoleh hasil bahwa tekstur kalus
adalah remah pada perlakuan sitokinin yang rendah (B0 dan B1) dan kompak pada perlakuan sitokinin yang tinggi (B2 dan B3) (Gambar 3) .
Gambar 5. Kiri: tekstur padat, kanan: tekstur remah
Pengamatan visual tekstur kalus pada pemberian konsentrasi NAA dan BAP dapat dilihat pada Tabel 12.
Tabel 13. Tekstur kalus
Pembahasan
Dari hasil analisis data yang dilakukan bahwa pemberian BAP dan NAA
berpengaruh nyata pada parameter waktu inisiasi. Dapat dilihat pada Tabel 9 bahwa waktu inisiasi tunas tercepat pada perlakuan NAA adalah terdapat pada perlakuan A3
yaitu sebesar 7.50 hari dan terlama pada perlakuan A0 yaitu sebesar 12.25 hari. Pada perlakuan BAP waktu inisiasi tercepat terdapat pada B3 yaitu sebesar 9.50 hari dan terlama pada B0 yaitu sebesar 10.56 hari. Hal ini menunjukkan bahwa pemberian
NAA dan BAP berpengaruh positif terhadap percepatan munculnya tunas adventif pada eksplan, ini diduga karena penggunaan konsentrasi yang tepat pada NAA dan
BAP sehingga memacu percepatan waktu inisiasi tunas. Hal ini sesuai dengan literatur Lestari (2011) yang menyatakan bahwa dalam proses pembentukanorgan seperti tunas atau akar ada interaksi antarazat pengatur tumbuh eksogen yang
ditambahkan kedalam media dengan zat pengatur tumbuh endogenyang diproduksi oleh jaringan tanaman.Penambahan auksin atau sitokinin ke dalam mediakultur dapat
meningkatkan konsentrasi zat pengaturtumbuh endogen di dalam sel, sehingga menjadi “faktorpemicu” dalam proses tumbuh dan perkembanganjaringan. Untuk memacu pembentukan tunas dapat dilakukan dengan memanipulasi dosisauksin dan
sitokinineksogen.
Dari hasil analisis data yang dilakukan diperoleh hasil adanya interaksi antara
BAP dan NAA yang berpengaruh nyata pada parameter jumlah akar. Dapat dilihat pada Tabel 6 bahwa jumlah akar terbanyak terdapat pada perlakuan A1B3 (0.2 mg/l NAA+1.5 mg/l BAP) yaitu sebanyak 8.00 buah akar. Hal ini menunjukkan bahwa
pembentukkan akar. Wattimena, dkk (1992) menyatakan bahwa di dalam kultur jaringan morfogenesis dari eksplan selalu tergantung dari interaksi antara auksin dan
sitokinin. Dan dilihat dari kombinasi yang ada bahwa kebutuhan terhadap auksin eksogen adalah pada taraf yang rendah, ini diduga karena eksplan yang merupakan
tunas yang sedang berkembang dapat memproduksi auksin yang cukup untuk memacu perakaran. Hal ini sesuai dengan literatur Evans, dkk (1986) yang dikutip oleh Sobardini, dkk (2006) yang menyatakan bahwa tunas yang sedang berkembang
dapat memproduksi auksin dalam jumlah yang cukup untuk perakaran maka penambahan
auksin eksogen tidak diperlukan. Ini dapat dilihat dari kombinasi yang tanpa pemberian
NAA (A0B0) eksplan dapat menginisiasi pertumbuhan akar.
Dari pengamatan yang dilakukan secara visual di peroleh hasil bahwa tidak terlihat adanya kemunculan kalus (Gambar 2) pada kombinasi perlakuan (A0B0) dan
(A0B1). Hal ini diduga karena pada kedua kombinasi perlakuan ini tidak digunakan zat pengatur tumbuh (A0B0) dan kombinasi perlakuan juga sangat rendah (A0B1). Diketahui bahwa kemunculan kalus dipengaruh oleh zat pengatur tumbuh salah
satunya adalah auksin. Hal ini sesuai dengan literatur Pierik (1987) yang menyatakan bahwa pada umumnya auksin digunakan untuk menginduksi pembentukan kalus.
Dari hasil pengamatan yang dilakukan secara visual di peroleh hasil bahwa terjadi perubahan warna kalus dari putih kehijauan menjadi coklat (Gambar 3). Hal ini diduga oleh adanya perubahan yang terjadi pada senyawa fenol dalam jaringan
dan pendewasaan yang terjadi oleh jaringan tersebut. Ini sesuai dengan literatur Trimulyono,dkk (2004) yang menyatakan bahwa kalus setelah berumur 15-17 hari
Kalus menjadi berwarnakuning kecoklatan setelah berumur 28-30 hari, halini karena terbentuknya senyawafenol dari jaringan dan semakin dewasanya umurkalus.
Dari hasil pengamatan yang dilakukan secara visual di peroleh hasil bahwa tekstur kalus remah terdapat pada perlakuan sitokinin yang rendah dan padat pada
perlakuan sitokinin yang tinggi (Gambar 4). Hal ini diduga karena adanya proses morfogenesis dari sel tanaman dan interaksi zat pengatur tumbuh. Hal ini sesuai
dengan literatur Wattimena (1992) yang menyatakan bahwa pada kultur jaringan, morfogenesis darieksplan selalu tergantung dari interaksi dari auksindan sitokinin.
Kadir (2008) menyatakan bahwa kualitas kalus dapat dilihat dari penampakan tekstur kalus dan warna kalus. Pertumbuhan kalus yang baik ditunjukkan oleh struktur kalus
yang remah dan berwarna putih. Hal tersebut mengindikasikan proliferasi kalus menghendaki 2,4D dan BA dalam konsentrasi yang rendah atau tanpa pemberian BA. Penggunaan BA dalam konsentrasi yang tinggi kulitas kalus yang dapat dilihat dari
struktur dan warna kalus yaitu kompak dan berwarna putih kehijauan. Ini menunjukkan adanya diferensiasi dari kalus tersebut. Sriyanti dan Wijayani (1994)
KESIMPULAN
1. Pemberian NAA dan BAP tidak berpengaruh nyata terhadap parameter persentase eksplan yang hidup, persentase kontaminasi, persentase eksplan membentuk tunas, tinggi tunas, panjang akar, jumlah daun, dan jumlah buku
2. Pemberian NAA dan BAP berpengaruh nyata pada parameter waktu inisiasi dan jumlah akar dengan waktu inisiasi tercepat yaitu sebesar 7.50 hari pada
0.6 mg/l NAA dan 1.5mg/l BAP dan jumlah akar terbanyak yaitu 8 buah pada konsentrasi 0.2 mg/l NAA dan 1.5 mg/l BAP.
3. Media yang terbaik untuk perbanyakan akar yaitu pada 0.2 mg/l NAA dan 1.5
mg/l BAP tapi media yang terbaik untuk induksi tunas belum diperoleh.
SARAN
Sebaiknya penelitian lanjutan yang akan dilakukan menggunakan kadar
DAFTAR PUSTAKA
Bowo, S., Triastitu.,R dan Mukhiissul. F., 2007.Propagasi Tanaman Nilam (Pogostemon cablin Benth.) Secara in vitro Dengan Kombinasi Sitokinin dan Auksin 2,4 D. MIPA, Vol. 17, No. 1, Januari 2007: 39 – 47.
Ditjenbun. 2006. Statistik Perkebunan Indonesia. Direktorat Jendral Perkebunan, Departemen Pertanian, Jakarta.
Evans, D.A., W.R. Sharp, P.V. Ammirato.. 1986.. Handbook of plant cell culture: techniques and applications Vol. I. Macmillan Publishing Company. New York.
George, E.F. and P.D. Sherrington., 1984. Plant propagation; by Tissue Culture. Exegetics Ltd. England.
Haryanti, S., Respon Pertumbuhan Jumlah dan Luas Daun Nilam (Pogostemoncablin Benth) pada Tingkat Naungan yang Berbeda. Universitas Dipenogoro. Hal. 20-26.
Hobir dan D, Seswita., 2002. Evaluasi Pertumbuhan dan Daya Hasil Berbagai Klon Nilam Asal Kultur Jaringan. Jurnal LITTRI Vol. 8 No. 4 Desember 2002.
Marizka, I dan E. G. Lestari., 2003. Pemanfaatan Kultur In Vitro Untuk Meningkatkan Keragaman Genetik Tanaman Nilam. Jurnal Litbang Pertanian, 22(2), 2003.
Kadir, A., 2008. Induksi dan Perbanyakan Populasi Kalus,Regenerasi tanaman Serta Uji Respon KalusTerhadap konsentrasi PEG dan Dosis IradiasiSinar Gamma. IPB-Press. Dikutip dari
http://www.damandiri.org.id.abdulkadiripbbab3.pdf
Kardinan, A dan L. Mauludi., 2004. Nilam Tanaman Beraroma wangi untuk industri parfum dan kosmetika. Agromedia Pustaka: Jakarta.
Kardinan, A., 2005. Tanaman Penghasil Minyak Atsiri. Agromedia Pustaka: Jakarta.
Lestari, E. G., 2011. Peranan Zat Pengatur Tumbuh Dalam Perbanyakan Tanaman Melalui Kultur Jaringan. Jurnal AgroBiogen. Vol 7 No 1.
Nurlelasari, 2007.Peningkatan Kadar Patchouli Alkohol Pada Minyak Nilam Melalui Teknik Kultur Jaringan. Laporan Penelitian.
Sobardini, D.,E. Suminar dan Mugayanti., 2006. Perbanyakan Cepat Tanaman Nilam (Pogostemon cablin Benth.) Secara Kultur Jaringan. Universitas Padjadjaran.
Sriyanti, D. P. dan A. Wijayani. 1994. Teknik Kultur Jaringan. Yogyakarta: Kanisius.
Steel, R. G. D dan J. H. Torrie. 1995. Prinsip dan Prosedur statistik. Gramedia, Pustaka Utama, Jakarta.
Tjondronegoro, P.D., Ika, M.S., dan Zamirawati, 1997. Sintesis Minyak Atsiri pada Kultur Jaringan Nilam. Hayati Vol 4, No 2. Hal 35-37.
Trimulyono, G., Solichatun dan S. D. Marliana., 2004. Pertumbuhan Kalus dan Kandungan Minyak Atsiri Nilam (Pogostemon cablin (Benth) Dengan Perlakuan Asan Naftalen Asetat (NAA) dan Kinetin. Biofarmasi Vol.2 No 1. UNS Surakarta.
Wattimena, G.A. 1992. Bioteknologi Tanaman. IPB- Press: Bogor.
Wikardi, EA., dkk. 1990. Perkembangan penelitian tanaman nilam. Edisi khusus Vol. VI, No. 1. Bogor : Littro.